8.1 Ligações Moleculares 8.2 Espectros Moleculares Capítulo 8 Johannes Diderik van der Waals...
Transcript of 8.1 Ligações Moleculares 8.2 Espectros Moleculares Capítulo 8 Johannes Diderik van der Waals...

8.1 Ligações Moleculares8.2 Espectros Moleculares
Capítulo 8
Johannes Diderik van der Waals (1837 – 1923)

8.1 Ligações Moleculares
Os núcleos das moléculas vibram Frequência intermediária: ~1011 - 1013 Hz
Os núcleos das moléculas rodamFrequência baixa: ~109 - 1010 Hz
Movimentos nas Moléculas

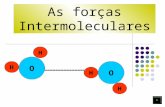
Vibrações da água

Ligações Moleculares
Uma Molécula é uma entidade electricamente neutra que possui mais do que um átomo
Pode ser formada por:
• um único átomo - Hélio (He)
• mais de um átomo do mesmo elemento – Oxigénio (O2)
• átomos de elementos diferentes - Água (H2O) Existem moléculas formadas por centenas ou até mesmo
milhares de átomos, como é o caso das proteínas
A Força Coulombiana (Força eléctrica) é a única que liga os átomos
A combinação de forças atractivas e repulsivas cria uma estrutura molecular estável
Tipos de Ligações Moleculares
IónicasCovalentesde Van der WaalsMetálicasde Hidrogénio
As propriedades químicas de uma substância não são determinadas por uma molécula isolada, mas por um conjunto mínimo destas

Ligações Iónicas
É o mecanismo de ligação mais simples
ExemploO sódio (1s22s22p63s1) cede o seu electrão da camada 3s se tornando o ião Na+ (catião), enquanto o cloro (1s22s22p63s23p5) ganha este electrão se tornando o ião Cl− (anião). Desta forma temos a formação da molécula NaCl (cloreto de sódio)

Ligações Covalentes
ExemplosAs moléculas diatómicas formadas pela combinação de dois átomos idênticos tendem a ser covalentes (H2)
Os átomos não são facilmente ionizáveis
Moléculas grandes são formadas por ligações covalentes
Diamante
Os átomos envolvidos em ligações covalentes compartilham seus electrões de valência

Ligações de Van der Waals
São ligações fracas encontradas em líquidos e sólidos em baixa temperatura
Exemplos: grafiteNo grafite, as ligações de van der Waals mantêm juntas as folhas adjacentes de átomos de carbono
Como consequência, com pouca fricção, uma camada desliza sobre a outra
Gases Nobres

Ligações Metálicas
Os electrões de valência são compartilhados por vários átomos
Exemplos: K, Na, Ag, Cu

Ligações de Hidrogénio
Também chamada de ponte de hidrogénio.Mantém principalmente moléculas orgânicas juntas numa solução

8.2 Espectros Moleculares
Estados Rotacionais
Espectroscopia Molecular
Podemos aprender acerca das moléculas estudando como elas absorvem, emitem e espalham a radiação electromagnética
De acordo com o teorema da equipartição de energia uma molécula pode ser considerada como dois átomos mantidos juntos, ligados por uma haste rígida sem massa e girando em torno do seu centro de massa (cm) (Modelo do rotor rígido)
Num sistema puramente rotacional, a energia cinética é expressa em termos do momento angular L e o momento de inércia I

L é quantizado
Obtemos os níveis de energia
Erot varia somente como função do número quântico
Substituindo em

Estados Vibracionais
Os modos de energia vibracional também podem ser excitados
Podem ocorrer também excitações térmicas
Também é possível estimular a vibração nas moléculas através de radiação electromagnética
Consideramos que os dois átomos são massas pontuais e que estão ligados por uma mola sem massa com movimento harmónico simples (MHS)

Obtemos os níveis de energia resolvendo a equação de Schrödinger para um oscilador harmónico simples, com energia potencial V
2
2
1krV
é a frequência do oscilador de duas partículas,
A energia vibracional do oscilador mecânico quântico é
e
21
21
mm
mm
é a massa reduzida e k a constante da mola
No caso da ligação ser puramente iónica, pode-se calcular k supondo que a força que mantém as massas juntas é puramente Coulombiana
e
krF é a força restauradora, assim:

Combinação de Vibração e Rotação
É possível excitar modos vibracionais e rotacionais simultaneamente
A energia de um sistema simples de vibração-rotação é dada por:
As energias vibracionais são espaçadas em intervalos regulares
Nas transições entre os estados de + 1 e as energias dos fotões serão
As energias dos fotões são espaçadas em intervalos regulares

Normalmente o espectro molecular observado envolve transições electrónicas, vibracionais e rotacionais
Os estados electrónicos para uma molécula diatómica

Os espectros atómicos são espectros de riscas
Parte do espectro de emissão do N2
Os espectros moleculares são espectros de bandas

Espectro de absorção do HCl
Frequência central