9-Compostos Heterocíclicos
-
Upload
api-27441481 -
Category
Documents
-
view
9.881 -
download
3
Transcript of 9-Compostos Heterocíclicos



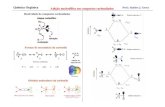
Nos compostos monocíclicos, o heteroátomo do anel recebe o número 1 e os restantes são numerados consecutivamente, de modo a atribuir aos grupos substituintes os números mais pequenos possíveis.
Se se evidenciam dois ou mais heteroátomos, atribui-se a numeração de modo que a estes lhes seja atribuída a numeração mais baixa. Se são diferentes, atribui-se a numeração em primeiro lugar ao oxigénio, seguido do enxofre e, finalmente, o azoto.
É também utilizada a nomenclatura com os prefixos oxa, tia, aza, fosfa e bora, se os grupos CH ou CH2 são substituídos por O, S, N ou NH, P ou PH e B ou BH.
O
CH3
1
2
34
5
N
NCH3
1
2
3
4
5
6
3-Metilfurano 4-Metilpirimidina
H3C NH
O
Oxaazaciclopropano
N
N
N
1,3,8-Triazanaftaleno

Um heterociclo é um composto de cadeia fechada cujo ciclo comporta, na sua cadeia principal, um ou vários átomos diferentes do carbono.
Os heteroátomos mais vulgares são o oxigénio, o azoto e o enxofre; e os anéis mais estáveis são, como no caso dos hidrocarbonetos, os que têm cinco ou mais elos.
Os epóxidos, os ozonídeos, as lactonas, as lactamas, são exemplos de heterociclos, mas não pertencem às séries mais importantes.
Os principais heterociclos com cinco átomos são insaturados e correspondem às seguintes estruturas fundamentais:
Um heteroátomo:
O N
H
SFurano
Pirrol
Tiofeno

O tiofeno ferve a 84ºC e os pontos de ebulição dos seus homólogos e derivados são muito próximos dos análogos benzénicos.
As reacções químicas do tiofeno são também notavelmente semelhantes às do benzeno. A substituição de um anel benzénico por um de tiofeno em compostos fisiologicamente activos tem pouco efeito sobre a sua actividade. Assim, os análogos tiofénicos da cocaína e da atropina têm uma acção anestésica respectivamente semelhantes.
A semelhança do tiofeno ao benzeno pode atribuir-se a pesos moleculares semelhantes, formas semelhantes das moléculas e, antes de mais, a interacções electrónicas semelhantes.
As orbitais p dos átomos de carbono do anel benzénico sobrepõem-se para formar orbitais moleculares , acima e abaixo do plano do anel; analogamente, uma orbital p do átomo de enxofre se sobrepõe com as orbitais p dos átomos de carbono, de modo a formar orbitais moleculares acima e abaixo do plano do anel. Tal como no benzeno, o tiofeno possui 6 electrões que ocupam 3 orbitais , conferindo o já conhecido carácter aromático.

O tiofeno experimenta reacções de substituição electrofílica típicas dos compostos aromáticos. A densidade electrónica dos átomos de carbono é consideravelmente mais elevada que a dos átomos de carbono no benzeno, uma vez que o átomo de enxofre contribui com um par de electrões no sistema e não somente com um electrão. Como resultado deste facto, o tiofeno é consideravelmente mais reactivo (mais facilmente sofre substituição electrofílica) que o benzeno.


Quando possível, a substituição electrofílica no tiofeno ocorre geralmente e quase exclusivamente, nas posições 2 ou 5. Isto porque podem formar-se complexos com mais facilidade na posição 2 que na posição 3, uma vez que a carga positiva pode dispersar-se mais extensamente pelo anel.
A maior reactividade do tiofeno permite efectuar as reacções a condições mais suaves. Um exemplo é a halogenação que não necessita de catalisador.
O pirrol, C4H5N, é o análogo nitrogenado do tiofeno. Está presente no alcatrão da hulha e nos alcatrões obtidos por destilação de restos de animais de matadouro (ossos, cornos). Produz-se com fins comerciais por reacção do furano com amoníaco.
As propriedades físicas e químicas do pirrol diferem significativamente das do tiofeno.
O azoto do pirrol, tais como os átomos de carbono, possui uma hibridação sp2, deixando um par de electrões numa orbital p, que pode formar um sexteto aromático com os quatro electrões das orbitais p dos carbonos.

Como no pirrol é utilizada uma orbital 2p do azoto em vez de uma orbital 3p do enxofre, a sobreposição com as orbitais p do carbono é menor que no tiofeno e os átomos de carbono do anel possuem um excesso de densidade electrónica por parte dos electrões . Estes factores explicam as propriedades físicas e as propriedades químicas do pirrol.
A considerável transferência de carga negativa aos átomos de carbono, confere ao pirrol um elevado momento dipolar, de 1,8 Deby em comparação com 0,5 Deby para o tiofeno. Este elevado momento dipolar é a principal causa do elevado ponto de ebulição, 131ºC, em comparação com 84ºC, para o tiofeno e 55ºC para a dietilamina.
O pirrol é uma base muito mais débil (pKa=0,4), comparativamente ao amoníaco (pKa=9,2) e um ácido muito mais forte (pKa=15, em comparação com 33 para o amoníaco). No entanto, não é um ácido tão forte como o fenol (pKa=9,9).
Dada a elevada densidade de electrões no núcleo, o pirrol oxida-se no ar mais rapidamente que a anilina e que o fenol.
A substituição electrofílica ocorre com extraordinária facilidade. Dada a sua sensibilidade aos ácidos, as reacções como a halogenação, a
nitração, a sulfonação e Friedel-Crafts não ocorrem nas condições usuais. O pirrol é estável, mas em presença de bases fortes e de um ião H+ como
resultado da eliminação do protão pelo N, actua como um agente nucleofílico.

Dois heteroátomos:
N
O N
N
H
N
SOxazol
Pirazol
Tiazol
Vários heteroátomos:
N
N
N
H
NN
N
N
HTriazol-1,2,3 Tetrazol
Existem alguns, no entanto, cujo anel é saturado:
O N
HTetra-hidrofurano
Pirrolidina
Estes últimos assemelham-se muito, pelas suas propriedades, aos compostos análogos alifáticos ou homocíclicos (o tetrafurano aos éteres, a pirrolidina às aminas secundárias).

Os anéis heterocíclicos são importantes, pois aparecem frequentemente em produtos naturais, como açúcares, hemoglobina, clorofila, vitaminas e alcalóides (cafeína, cocaína, estriquinina etc). Anéis heterocíclicos existem também em medicamentos sintéticos, como os antibióticos (penicilina, amicetina, eritromicina etc);
O furano aparece no alcatrão de madeira (pinheiro); o tiofeno e o pirrol existem no alcatrão de hulha;
O anel da pirrolidina aparece na cocaína e na atropina; O anel do indol é o núcleo central do triptofano, um aminoácido essencial e em certas
hormonas; A estrutura da purina aparece na cafeína, no ácido úrico e na adenosina (uma base
nitrogenada existente nos ácidos nucléicos); A piridina aparece no alcatrão de hulha e no fumo de cigarro, em decorrência da
decomposição da nicotina; A piridina, quando reduzida, origina a piperidina, cujo núcleo encontra-se na cocaína e
na piperina (alcalóide da pimenta branca); O núcleo da pirimidina aparece em bases nitrogenadas existentes nos ácidos nucléicos; O núcleo do benzopirano aparece em corantes de folhas, flores e frutos; A quinolina existe no alcatrão de hulha e o seu núcleo aparece também na quinina; A isoquinolina ocorre no alcatrão de hulha e o seu núcleo aparece na morfina e na
papaverina; O núcleo do imidazol aparece na histamina (substância responsável por muitas reações
alérgicas).




Fontes:• Estes três heterociclos podem obter-se a partir de um composto de partida único, o aldeído succínico, em presença de diferentes reagentes:
CHO CH2 CH2 CH O
Aldeído succínico
NH3(-2H2O)
P2S5(-2H2O)
H2SO4(-2H2O)
Furano
Pirrol
Tiofeno

Por outro lado, existem, para cada um deles, preparações específicas: O furano prepara-se em geral a partir do furfural, que primeiramente
sofre uma reacção de Cannizzaro:
O
CH O400ºC
CatalisadorO
O pirrol pode obter-se a partir do 2-butino-1,4-diol:
HOCH2 C C CH2OHNH3, pressão
N
H
O tiofeno pode preparar-se por acção do enxofre sobre o butano, a temperatura elevada:
H3C CH2 CH2 CH3 + 4S550ºC
S
+ 3H2S

Uma grande estabilidade e uma maior aptidão para as reacções de substituição do que para as reacções de adição, conferem a estes três heterociclos certa semelhança química com o benzeno e um verdadeiro “carácter aromático”.
A sua estrutura molecular justifica esta analogia, que resulta do facto de que os electrões não emparelhados presentes no O, S ou N participam, com os electrões p das ligações duplas, de uma estrutura mesómera com um total de seis electrões deslocalizados. Como no caso do benzeno, produz-se uma deslocalização completa destes seis electrões que possuem então orbitais moleculares, as quais englobam todo o anel. Só se pode representar esta estrutura por um conjunto de várias formas limites em ressonância.

N
H
N
H
N
H
N
H
N
H
N
H
-
--
-
''+
ACIDIDADE-BASICIDADE: O pirrol, pelos mesmos motivos que uma amina secundária com a qual se parece pelo seu grupo funcional, é ao mesmo tempo ácida (labilidade do hidrogénio ligado ao azoto) e básico (presença de um par de electrões livre sobre o azoto).

Mas a estrutura especial em que o azoto se encontra aqui envolvido torna o pirrol muito menos básico e muito mais ácido do que uma amina secundária normal, como é, por exemplo, a pirrolidina que tem um esqueleto idêntico, mas saturado.
A basicidade que se manifesta principalmente como a possibilidade de fixar um protão, está reduzida por dois motivos: por um lado, a densidade electrónica sobre o azoto é menor do que para o composto saturado correspondente, como consequência da deslocalização do dubleto livre; por outro lado, a fixação de um protão sobre o azoto transforma o pirrol num catião no qual foi destruída a estrutura aromática e perdeu-se a estabilidade correspondente:
N
H
+ H+
N
H H
+
Este ião comporta simplesmente duas ligações duplas conjugadas e, como dienos conjugados, polimeriza-se facilmente.

A labilidade do hidrogénio manifesta-se pela possibilidade de formar derivados metálicos, mais facilmente do que o faria uma amina secundária (a mesma diferença entre um álcool e um fenol).
N
H
+ NaOH
NNa+
+ H2O
O furano e o tiofeno não podem evidentemente comportar-se como ácidos da mesma forma que o pirrol, por não possuírem hidrogénio sobre o heretoátomo, mas apresentam de modo semelhante certo carácter básico, em especial o furano.

A hidrogenação catalítica destes três heterociclos, difícil para o tiofeno que «envenena» certos catalisadores, conduz ao anel saturado correspondente.
O
+ 2H2
O
Catalisador
Tetrahidrofurano
O tetrahidrofurano ou THF, é utilizado com frequência como solvente em química orgânica; é, além disso, a matéria-prima de um processo de síntese no nylon.
O furano permite, pelo seu sistema de ligações duplas conjugadas, sínteses diénicas.

Como os hidrocarbonetos aromáticos, e mais facilmente do que estes, o furano, o pirrol e o tiofeno prestam-se a diferentes reacções de substituição electrofílica: halogenação, nitração, sulfonação, alquilação, acilação. O mecanismo destas reacções é o mesmo que com o benzeno; a grande reactividade destes compostos é devida ao enriquecimento electrónico do anel em detrimento do heteroátomo, e a orientação da reacção, que se justifica por considerações análogas às desenvolvidas para os compostos aromáticos, é tal que o vértice «2», em do heteroátomo, é o mais reactivo.

BASES PÚRICASBASES PÚRICAS
As purinas são a classe mais importante de compostos que contêm dois anéis heterocíclicos condensados. Contêm um anel de pirimidina e um anel de imidazol.
N
N N
CH
N
H
N
N N
CH
N
H
Os aminoderivados e hidroxiderivados da purina acompanham as pirimidinas nos produtos de hidrólise de ácidos nucleicos. Também ocorrem livres nos líquidos e tecidos de animais e plantas. A Adenina é 6-Aminopurina; a Hipoxantina é 6-Hidroxipurina; a Guanina é 2-Amino-6-hidroxipurina e a Xantina é 2,6-Dihidroxipurina.
A origem destes compostos, dada as condições da sua origem, devem ter aparecido no início em que a atmosfera terrestre era uma mistura de metano, amoníaco, hidrogénio e água.

N
N
C
CC
N
CN N
CO
N
SH
N
NH
N
N
S
N
NH
O2N N
N CH3
O
O
H H
H
H
C
CC
N
CN N
COH
N
OH
HO
H
6-Mercaptopurina Azotriopina
Ácido úrico

A 6-Mercaptopurina corresponde ao análogo tio da hipoxantina e é um antimetabolito, usado no tratamento da leucemia aguda. É aplicada também como supressor de imunidade para evitar a rejeição de órgãos transplantados.
O ácido úrico é 2,6,8-trihidroxipurina; encontra-se no sangue e na urina. Ainda que os animais eliminem ácido úrico em pequenas quantidades, é o principal produto do metabolismo do azoto em aves e répteis.
Os compostos a que se devem a acção estimulante do café, do chá e do cacau são os derivados metílicos da xantina. A Teofilina encontra-se no chá; a Teobromina, no cacau; e a Cafeína, no chá, no café, entre outras plantas.
C
CC
N
CN N
CH
N
O
O
CH3
H
H3C
Teofilina
C
CC
N
CN N
CH
N
O
O
CH3
H
H3C
Teobromina
C
CC
N
CN N
CH
N
O
O
CH3
CH3
H3C
Cafeína

Vários compostos biologicamente importantes possuem o núcleo de pteridina, no qual está fusionado um anel de pirimidina a um anel de piracina. As pterinas são compostos que incolores ou amarelos que se encontram na pele e nos olhos de peixes, anfíbios e répteis e no fígado e na urina dos mamíferos. Caracterizam-se pela emissão de fluorescência em solução neutra.
N
N N
N
Pteridina
N
N N
N
OH
H2N
OH
Xantopterina
N
N N
N
OH
H2N
OH
OH
Leucopterina

Os ácidos fólicos são necessários para o crescimento de certos microrganismos. O ácido pteroilglutâmico sintetiza-se industrialmente para o tratamento de certos tipos de anemias.
N
ON
N
N
H
H2N
CH2NH CO(NHCHCH2CH2CO)nOH
COOH
Ácido Fólico A Riboflavina (vitamina B2) é o grupo prostético de várias flavoproteínas, que
desempenham um papel importante no metabolismo de -aminoácidos e aerobio de carbohidratos. A biotina intervém no metabolismo do ácido pirúvico.
ON
CN N
N
H
O
CH3
CH3
CH2(CHOH)3CH2OH
Riboflavina
SCH2
CH
CH
CH
(CH2)4COOH
N
N
CO
Biotina
H
H

N
NN
N
NH2
O
OHOH
HHHH
OP-O
O-
O
NH
N
N
O
NH2N
O
OH
HHHHOH
OP-O
O
O-
N
NH2
ON
O
OHOH
HHHH
OP-O
O-
O
NH
O
ON
O
OHOH
HHHH
OP-O
O-
O
Adenina
Guanina
Citosina
Uracilo

Adenina
Guanina
Citosina
Timina
N
NN
N
NH2
O
HOH
HHHH
OP-O
O-
O
NH
N
N
O
NH2N
O
H
HHHHOH
OP-O
O
O-
N
NH2
ON
O
HOH
HHHH
OP-O
O-
O
NH
O
ON
O
HOH
HHHH
OP-O
O-
O



Algumas aplicações dos compostos heterocíclicos:Algumas aplicações dos compostos heterocíclicos:
O furano, por hidrogenação, produz o tetrahidrofurano, usado como solvente;
A hidrólise do furano produz o furfural (um aldeído), usado na fabricação de plásticos e
também como solvente para remover impurezas de óleos lubrificantes;
O pirrol é utilizado para fabricação de polímeros de cor vermelha;
O indol tem odor agradável e serve à fabricação de perfumes, mas a sua grande
importância reside no facto de servir como matéria-prima para a fabricação do índigo blue,
um corante azul, utilizado no tingimento de tecidos;
A piridina tem um baixo carácter básico (devido ao efeito de ressonância do anel, que
deslocaliza o par electrónico do azoto), mais fraco que o das aminas terciárias, e é utilizada
como catalisador básico em sínteses orgânicas e para desnaturar o álcool etílico (tornar o
etanol industrial impróprio para a fabricação de bebidas);
A pirimidina é usada na fabricação de certos barbituratos (medicamentos usados em
sedativos e soporíficos).

Os AlcalóidesOs Alcalóides
Alcalóides são compostos nitrogenados, em geral, heterocíclicos, de caráter básico, que são normalmente produzidos por vegetais e têm acção enérgica sobre os animais - em pequenas quantidades podem servir como medicamentos, e em doses maiores são tóxicos. Quase todos os alcalóides são substâncias sólidas, de sabor amargo. A classificação mais aceite para os alcalóides é aquela que os agrupa de acordo com o núcleo da qual derivam. Os principais grupos de alcalóides são:
Alcalóides relacionados com a piridina:Coniina - Encontrada na cicuta, é um dos poucos alcalóides que se apresenta sob a
forma líquida. É um veneno fortíssimo.Piperina - Principal alcalóide da pimenta negra. A toxicidade dessa substância é
relativamente baixa em relação à dos demais alcalóides.Nicotina - Principal alcalóide do tabaco, podendo alcançar 4 a 5% da folha seca. O
produto puro é um líquido incolor. É um veneno muito violento. Por oxidação pelo dicromato de potássio, dá origem ao ácido nicotínico, que é uma das vitaminas do complexo B.

Alcalóides relacionados com a quinolina:Quinina - É um pó branco pouco solúvel em água, mas forma sais solúveis, sendo
utilizada sob esta forma.Cinconina - É muito semelhante à quinina na sua estrutura química. Diferencia-se
daquela por, no lugar de um grupo OCH3, apresentar um átomo de hidrogénio.
Estricnina - Em pequenas doses, a estricnina é utilizada como tónico. Em doses elevadas, porém, pode causar a morte.
Alcalóides relacionados com a isoquinolina:Morfina - É um sedativo de grande potência e largamente empregado como tal.
Por causar dependência, o seu emprego é extremamente controlado.Codeína e Heroína - São também utilizados como narcóticos analgésicos.
Alcalóides do grupo tropânico:Atropina - Este alcalóide foi isolado da raiz da beladona. É um éster do ácido
trópico com o tropanol, com grande aplicação em oftalmologia, devido ao seu poder midriático.
Hiosciamina - É um isómero da atropina e encontra-se em algumas espécies de solanáceas.
Escopolamina - É um epoxi-derivado da atropina.Cocaína - Este alcalóide teve grande importância no início do seu descobrimento,
mas está praticamente abandonada como medicamento, devida à grande tendência que apresenta para causar dependência química. A cocaína é um veneno fortíssimo, encontrado na folha da coca, juntamente com outros alcalóides. É um éster do ácido benzóico com um derivado do tropano.


Nomenclatura oficial IUPAC: Nomenclatura oficial IUPAC: ácidoácido + hidrocarboneto + + hidrocarboneto + sulfónico sulfónico
Nomenclatura usual: Nomenclatura usual: ácidoácido + radical + + radical + sulfónico sulfónico

De entre os ácidos sulfónicos, têm grande importância somente os aromáticos. Convém não confundir os ácidos sulfónicos, nos quais o carbono se liga directamente ao enxofre (Ar-SO3H), com os sulfatos orgânicos (ésteres do ácido sulfónico), nos quais o carbono se
liga ao enxofre através de um oxigénio (Ar-OSO3H).
Os ácidos sulfónicos aromáticos são sólidos cristalinos, insolúveis em substâncias apolares, mas bastante solúveis em água, inclusive os seus sais de cálcio, bário e chumbo são solúveis em água, ao contrário dos sulfatos desses metais. Como seria de esperar da sua estrutura, os ácidos sulfónicos são compostos altamente polares. De maneira geral, verifica-se que são mais solúveis em água do que qualquer outra espécie de composto orgânico. Por isso, é comum inserir-se grupos SO3H em grandes moléculas, para conferir-
lhes solubilidade em água. Os ácidos sulfónicos têm baixa volatilidade e ao serem aquecidos, decompõem-se,
geralmente, antes de atingir o seu ponto de ebulição. São compostos difíceis de se purificar, por serem altamente deliquescentes, e por isso torna-se mais cómodo isolá-los sob a forma de sais. Utilizam-se muitas vezes nessa forma.
Normalmente os ácidos sulfónicos são preparados pela reacção com ácido sulfúrico concentrado. Essa reacção é chamada sulfonação:
Para alifáticos: Sulfonação de alcanos Para aromáticos: Sulfonação do benzeno (ou derivados)

Como ácidos fortes que são, os ácidos sulfónicos encontram-se totalmente ionizados em água. As reacções mais importantes dos ácidos sulfónicos são aquelas em que o grupo SO3H,
sendo orientador meta, orienta as substituições no anel aromático nesta posição.
Os ácidos sulfónicos são o ponto de partida para a produção de inúmeros derivados importantes, tais como:
Detergentes: Geralmente sais de ácido sulfónicos aromáticos com longa cadeia carbónica. Ex: dodecil-benzeno-sulfonato de sódio (para - C12H25 - Ph - SO3Na);
Sulfatos alquil-metálicos com radical alquilo longo: utilizados também como detergentes. Ex: sulfato de dodecil-sódio (C12H25)NaSO4;
Sulfonamidas: São amidas dos ácidos sulfónicos e têm grande importância como medicamentos do grupo das "sulfas". Ex: sulfanilamida (para - NH2 - Ph - SO2NH2);
Sacarina: Uma imida do ácido o-sulfobenzóico, usada como adoçante; Sulfatos de metilo e etilo: Líquidos altamente tóxicos e corrosivos, usados como agentes
alquilantes, por serem tão reactivos quanto os haletos correspondentes, porém, mais baratos do que estes.


Nomenclatura e exemplos:Os tio-compostos são moléculas que apresentam átomos de enxofre na sua estrutura. Em geral, são produzidos pela substituição dos átomos de oxigénio dos álcoois, fenóis, éteres e peróxidos, por átomos de enxofre, originando os tioálcoois (ou tióis), tiofenóis, tioéteres e dissulfetos. Para tio-álcoois e tio-fenóis:
Nomenclatura oficial IUPAC: Nomenclatura oficial IUPAC: nome do hidrocarbonetonome do hidrocarboneto ++ tiol tiol
Nomenclatura usual I: Nomenclatura usual I: radical +radical + mercaptana mercaptana
Nomenclatura usual II: Nomenclatura usual II: radical + radical + hidrogenossulfetohidrogenossulfeto
Para tio-éteres:
Nomenclatura oficial IUPAC: Nomenclatura oficial IUPAC: radical menor + radical menor + tiotio + hidrocarboneto maior + hidrocarboneto maior
Nomenclatura usual: Nomenclatura usual: sulfeto desulfeto de + radical menor + + radical menor + ee + radical maior + radical maior
Para dissulfetos:
Nomenclatura oficial IUPAC:Nomenclatura oficial IUPAC: dissulfeto de dissulfeto de + radial menor + + radial menor + ee + radical maior + radical maior

Os tioálcoois aparecem, em pequenas quantidades, na putrefacção de proteínas sulfuradas, no gás de hulha e no petróleo. Os membros mais simples são líquidos incolores, pouco solúveis em água e bastante voláteis, caracterizados por um odor penetrante e desagradável, que os torna reconhecíveis mesmo em mínimas concentrações. Os tioálcoois são muito solúveis em soluções básicas fortes, pois apresentam um carácter ácido mais forte do que os álcoois. Os pontos de ebulição dos tioálcoois são bem inferiores aos dos álcoois correspondentes, pela baixa tendência do enxofre a formar ligações de hidrogénio, enfraquecendo assim as forças intermoleculares.
Os sulfetos (tioéteres) não ocorrem na natureza e são de pequena importância. A iperita, ou gás mostarda, que é um sulfeto clorado, foi usado durante a Segunda Guerra Mundial, como gás tóxico. Os sulfetos mais simples são líquidos incolores, de cheiro etérico, insolúveis em água e solúveis em álcool, éter etc.
O dissulfeto de alila (H2C=CH-CH2-S-S-CH2-CH=CH2) é um líquido de odor penetrante, que ferve a 139ºC, encontrado há muito tempo no alho. O radical -CH2-CH=CH2 recebeu, por esse motivo, o nome de alila. Os compostos em que este aparece são ditos alílicos.

Os principais métodos de preparação dos tioálcoois são (as duas primeiras dão bons
rendimentos):
• Reacção de sulfato de alquila com KSH (a quente): R-SO4 + 2 KSH 2 R-SH + K2SO4
• Reacção de haletos de alquila com NaSH (a quente): R-X + NaSH R-SH + NaX
• Reacção de álcoois com P2S5: 5 R-OH + P2S5 5 R-SH + P2O5
• Reacção de álcoois com H2S (catalisada por óxido de tório): R-OH + H2S R-SH + H2O
Os sulfetos são preparados, normalmente, pelas reacções:
• 2 R-X + Na2S R-S-R + 2 NaX
• R-X + R-SNa R-S-R + NaX

A facilidade com que os tioálcoois reagem com o óxido de mercúrio, e em geral com os metais de alta massa molecular, formando compostos cristalinos, distingue os tioálcoois dos álcoois. É dessa característica, aliás, que deriva o seu nome usual (mercaptana), formado a partir da expressão "mercurius captans", ou seja, traduzindo literalmente, significa que se “apodera do mercúrio". Os tioalcoolatos, ou mercaptatos, são compostos cristalinos obtidos com metais pesados, e correspondem aos alcoolatos. Entretanto, além de se formarem com mais facilidade, são mais estáveis que os alcoolatos.
A "iperita" sofre uma reacção interessante, chamada Substituição Nucleofílica Interna. Esse tipo de SN ocorre em moléculas que apresentam na sua estrutura um nucleófilo e um bom grupo de saída. No caso da iperita [Di-(2-cloroetiltioetil)-éter], o nucleófilo é o enxofre (que possui pares de electrões livres) e o grupo de saída é o cloro. A substituição do grupo de saída por outro grupo mais estável é facilitada pela acção do nucleófilo. A essa "ajuda“ dada pelo nucleófilo chama-se "ajuda anquimérica".


Dentre as mercaptanas alifáticas (tioálcoois), destaca-se o etanotiol (C2H5SH), que constitui um comnposto intermediário para a produção do sulfonal, que se presta à obtenção de remédios hipnóticos. Das mercaptanas aromáticas, o tiofenol (C6H5SH) é um dos membros mais importantes. A partir das mercaptanas é possível obter, por oxidação, os ácidos sulfínicos (R-SO2H) e os ácidos sulfónicos (R-SO3H). As mercaptanas, pelo seu forte odor penetrante, são utilizados em misturas com gases de reservatórios e tubulações, para detecção de vazamentos.


Existem duas formas principais de manter os níveis de glucose no sangue entre as refeições: a degradação do glicogénio e a gluconeogénese. A Gluconeogénese consiste na síntese de glucose a partir de outros compostos orgânicos (piruvato, succinato, lactato, oxaloacetato, etc.). O processo é bastante semelhante ao inverso da glicólise. De facto, quase todas as reacções da glicólise são reversíveis em situações fisiológicas. As três excepções são as reacções catalizadas por:

Na gluconeogénese, cada um destes passos é substituído por reacções termodinamicamente favoráveis. Desses três passos, a síntese do fosfoenolpiruvato a partir do piruvato é o mais exigente em termos energéticos, por ter um DG bastante positivo. Para ultrapassar esta barreira termodinâmica, esta reacção vais ser acoplada a uma descarboxilação, uma estratégia usada frequentemente pela célula para empurrar um equilíbrio no sentido da formação de produtos, como se verá em várias reacções do ciclo de Krebs. Como quer o piruvato quer o fosfoenolpiruvato (PEP) são compostos com três carbonos, isto implica uma carboxilação prévia, cuja energia provém da hidrólise do ATP. A descarboxilação do oxaloacetato assim formado produz a energia necessária para a fosforilação do carbono 2 pelo GTP, dando origem ao fosfoenolpiruvato (numa reacção catalizada pela fosfoenolpiruvato carboxicinase - PEPCK).
A enzima responsável pela carboxilação do piruvato (a piruvato carboxilase) existe na matriz mitocondrial, e contém biotina. O oxaloacetato (OAA) formado nesta reacção é incapaz de atravessar a membrana da mitocôndria. Pode sair da mitocôndria apenas depois de transformado em malato ou aspartato. A escolha do processo depende da disponibilidade de NADH (necessário para a gluconeogénese) no citoplasma. Se houver NADH suficiente no citoplasma (p.ex. se se estiver a realizar gluconeogénese a partir do lactato), o oxaloacetato é transaminado a aspartato. Caso contrário, o OAA é reduzido a malato, que sai da mitocôndria para o citoplasma, onde é novamente oxidado a OAA com produção simultânea de NADH. O OAA é então descarboxilado a PEP pela PEPCK citoplasmática. Em humanos, existe também uma PEPCK mitocondrial.


As reacções catalizadas pela fosfofrutocinase e pela hexocinase são substituídas na gluconeogénese por reacções hidrolíticas. Neste ponto, em vez de fosforilar ADP a ATP (o inverso da glicólise, mas desfavorecido termodinamicamente em condições fisiológicas), ocorre a libertação do fosfato por hidrólise:
A frutose 1,6-bisfosfatase existe em quase todos os tecidos, mas a glucose-6-fosfatase existe apenas no fígado e no rim, o que lhes permite fornecer glucose ao resto do organismo:

A concentração de glucose na corrente sanguínea é mantida a níveis sensivelmente constantes de cerca de 4-5 mM. A glucose entra nas células por difusão facilitada. Este processo não permite a acumulação na célula de concentrações de glucose superiores às existentes no sangue, pelo que a célula deve ter um processo para acumular glucose no seu interior. Isto é feito por modificação química da glucose pela enzima hexocinase:
A membrana celular é impermeável à glucose-6-fosfato, que pode por isso ser acumulada na célula. A glucose-6-fosfato será utilizada na síntese do glicogénio (uma forma de armazenamento de glucose), para produzir outros compostos de carbono na via das pentoses fosfato, ou degradada para produzir energia - glicólise.

Para poder ser utilizada na produção de energia, a glucose-6-fosfato é primeiro isomerizada a frutose-6-fosfato. A frutose-6-fosfato é depois fosforilada a frutose-1,6-bisfosfato. Este é o ponto de não-retorno desta via metabólica: a partir do momento em que a glucose é transformada em frutose-1,6-bisfosfato já não pode ser usada em nenhuma outra via.

Seguidamente, numa reacção inversa da adição aldólica, a frutose-1,6-bisfosfato é clivada em duas moléculas de três carbonos cada:
Estas duas moléculas (dihidroxiacetona fosfatada e gliceraldeído-3-fosfato) são facilmente interconvertíveis por isomerização. Portanto, basta uma via metabólica para degradar as duas. É por esta razão que a glucose-6-P foi isomerizada a frutose-6-P: a clivagem da glucose pela reacção inversa da condensação aldólica daria origem a duas moléculas bastante diferentes, de dois e quatro átomos de carbono, respectivamente, que exigiriam duas vias metabólicas diferentes para a sua degradação.

Os aldeídos têm potenciais de oxidação redução bastante baixos (cerca de -600 a -500 mV). A reacção de oxidação do gliceraldeído-3-fosfato pelo NAD+ (E0=-320 mV) é portanto bastante espontânea. É uma reacção tão exergónica que pode ser usada para produzir ATP (a produção de ATP a partir de ADP e Pi pode ser realizada se existir uma diferença de potencial de cerca de 180 mV). A produção de ATP é feita em dois passos. No primeiro, dá-se a oxidação do gliceraldeído-3-fosfato e a fosforilação do ácido produzido.
Os ácidos fosforilados (tal como os fosfoenóis e os fosfoguanidinos) têm grupos fosfatos bastante energéticos: a saída do grupo fosfato dá origem a espécies muito mais estabilizadas por ressonância. O grupo fosfato do carbono 1 do 1,3-bisfosfoglicerato pode por isso ser transferido para ADP, produzindo ATP.

O 3-fosfoglicerato é isomerizado a 2-fosfoglicerato, que depois de desidratado (i.e. perder H2O dá origem a um fosfoenol:
Devido ao seu elevado potencial de transferência de fosfato o fosfoenolpiruvato pode transferir um fosfato ao ADP:
Na glicólise gastam-se portanto dois ATP, e produzem-se quatro ATP. O NAD+ tem de ser regenerado, caso contrário a glicólise pára, uma vez que é substrato de uma das reacções. Em condições aeróbicas, o NADH transfere os seus electrões para a cadeia transportadora de electrões. Na ausência de O2 o NADH transfere os seus electrões para o próprio piruvato,
dando origem a lactato. É o que se denomina fermentação : um processo em que o aceitador final dos electrões provenientes da degradação é um produto orgânico da própria degradação.

Para realizar o seu anabolismo, a célula não precisa apenas de energia (ATP): também precisa de poder redutor, sob a forma de NADPH. O NADPH é produzido durante a oxidação da glucose-6-P por uma via distinta da glicólise, a via das pentoses-fosfato. Esta via é muito activa em tecidos envolvidos na biossíntese de colesterol e de ácidos gordos (fígado, tecido adiposo, cortex adrenal, glândulas mamárias). Esta via também produz ribose-5-P, o açúcar constituinte dos ácidos nucleicos.A glucose-6-P é primeiro oxidada no seu carbono 1, dando origem a uma lactona (um ácido carboxílico cíclico). Os electrões libertados são utilizados para reduzir uma molécula de NADP+. O anel é então aberto por reacção com água:

A descarboxilação do gluconato liberta dois electrões, que vão reduzir outra molécula de NADP+. Obtém-se assim um açúcar de 5 carbonos, a ribulose-5-fosfato, que por isomerização é transformado em ribose-5-P. (Na figura assinalam-se a verde as diferenças entre os isómeros).

O que se passa a seguir depende das necessidades da célula: se a célula só precisar de NADPH e não precisar de ribose-5-P esta poderá ser reaproveitada. Isto é feito através de 3 reacções. Na primeira, a ribose-5-P recebe dois carbonos da xilulose-5-P (obtida por epimerização da ribulose-5-P):

Seguidamente, são transferidos três
carbonos da sedoeptulose-7-P
para o gliceraldeído-3-P:
Por transferência de dois carbonos da xilulose-5-P para a eritrose-4-P, forma-se outra molécula de frutose-6-P e
uma molécula de gliceraldeído-3-P:

O balanço destas últimas reacções é:2 xilulose-5-P + ribose-5-P -----> 2 frutose-6-P + gliceraldeído-3-PA frutose-6-P e o gliceraldeído-3-P podem ser utilizados na glicólise para produção de energia, ou reciclados pela gluconeogénese para formar novamente glucose-5-P. Neste último caso, através de seis ciclos da via das pentoses-fosfato e da gluconeogénese uma molécula de glucose-6-P pode ser completamente oxidada a seis moléculas de CO2 com produção simultânea de 12 moléculas de NADPH. Quando as necessidades de ribose-5-P são superiores às de NADPH, esta pode ser produzida por estas reacções a partir de frutose-6-P e gliceraldeído-3-P.

Adenosina Trifosfato O ATP é o nucleotídio trifosfatado mais importante. Ele participa das inúmeras reacções e processos metabólicos relacionados à transferência e conversão de tipos de energia. A hidrólise do radical fosfato terminal do ATP, formando difosfato de adenosina (ADP) e fosfato inorgânico, libera energia livre de 7,3 kcal/mol, quantidade apropriada para as funções celulares. A energia do ATP é disponibilizada para as células pelo acoplamento da hidrólise desta substância a reacções químicas que requeiram energia. No hialoplasma, existe apenas uma pequena reserva de ATP, de tal maneira que, à medida que ele é utilizado, deve ser reposto por meio de reacções que fosforilam o ADP a ATP. Existem dois mecanismos de regeneração do ATP. O primeiro é a fosforilação pelo nível de substrato, em que um radical fosfato é transferido para o ADP por um composto intermediário, a fim de formar o ATP. Este tipo de fosforilação pode ocorrer na ausência de oxigénio, condição denominada de metabolismo anaeróbio. Como exemplo deste tipo de fosforilação, temos: a glicólise (primeira etapa da respiração celular) e a fermentação. O segundo mecanismo de produção de ATP é a fosforilação oxidativa, que ocorre nas membranas internas dos organelos denominadas mitocôndrias, e que exige a presença de oxigénio molecular. A fosforilação oxidativa produz a maior parte do ATP utilizado pelo organismo. O conjunto das reacções que compõem a fosforilação oxidativa é chamado metabolismo aeróbio.


Transportadores de electrões: NAD e FADAs reacções metabólicas que degradam a glicose e obtêm energia para a célula são do tipo oxidação-redução (também denominada oxirredução). Quando um composto químico (molécula, ião) perde electrões ou hidrogénio, diz-se que houve oxidação. Ao contrário, se uma espécie química ganha electrões ou hidrogénio, observa-se uma redução. A maior parte da energia da glicose é retirada por meio de reacções de oxirredução. Nestas reacções participam substâncias conhecidas como coenzimas. As mais importantes coenzimas transportadoras de electrões são o dinucleotídio de nicotinamida-adenina e o dinucleotídio de flavina-adenina. As formas oxidadas dessas coenzimas são abreviadas por NAD+ e FAD+; as formas reduzidas são NADH e FADH2. A coenzima A transfere radicais acetil e será comentada mais adiante. A figura a seguir mostra, em (A), a estrutura do NAD em estado oxidado e estado reduzido; e em (B), a transferência de hidrogénio de uma cadeia carbónica para o NAD oxidado (NAD+).