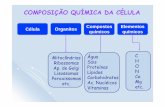
Célula Eucariótica Animal e suas Organelas. Célula Eucariótica Animal.
Aula 16 Potenciais de célula - Tiago Camargo · Aula 16 Potenciais de célula Universidade...
Transcript of Aula 16 Potenciais de célula - Tiago Camargo · Aula 16 Potenciais de célula Universidade...

Aula 16
Potenciais de célula
Universidade Tecnológica Federal do Paraná
Departamento Acadêmico de Química e Biologia
Dr. Tiago P. Camargo

Eletroquímica
Celulas Galvânicas e voltagem
Potencial de célula – o Fluxo de corrente em uma célula eletroquímica é dirigido por uma forçaeletromotriz (emf).
Energia potencial vs. Potencial eletroquímico
Diferença de potencial – ddp entre os dois eletrodos...

Celulas Galvânicas e voltagem
Eletroquímica
A voltagem de uma pilha é medida usando um voltímetro conectada ao circuito.
Condições de comparação – Condições padrão
Reagentes e produtos devem ser sólidos ou líquidos puros,gases a 1,0 bar de pressão ou solutos a 1,0 M de concentração.
Potenciais medidos nestas condições são ditos Potenciaispadrão (Eo). Temperatura comum 25oC (298 K )

Celulas Galvânicas e voltagem
Eletroquímica
A voltagem de uma pilha é medida usando um voltímetro conectada ao circuito.
Por definição : Potenciais de célula em reações eletroquímicasque são favoráveis a produtos são POSITIVOS.
Ex: Na célula { Zn | Cu2+ } - processo espontâneo a 25oC opotencial é de 1,10 Volts.

Celulas Galvânicas e voltagem
Eletroquímica
Sabendo-se que uma reação eletroquímica pode ser entendida através da soma das duas semi-reações é de extrema importância a determinação de cada possível semi reação.
O potencial de célula pode ser obtido usando-se os potenciais das semi-reações:
Eocat e EoAn são os valores de potencial padrão de redução para as duas
semi-reações do cátodo e do ânodo.
Os potenciais e semi-reações por definição sempre são escritos naforma de semi-reação de redução

Celulas Galvânicas e voltagem
Eletroquímica
Fisicamente é impossível determinar separadamente o potencial de uma reação redox.
Apenas diferenças de potencial podem ser determinados
Semi reação de redução de H+ / H2(g) foi adotado como padrão
Por definição a redução de H+ é dada como potencial 0,0 Volts
Todos os outros foram determinados a partir do Eletrodonormal de hidrogênio (ENH).

Celulas Galvânicas e voltagem
Eletroquímica
Quando comparamos o ENH com outros sistemas
Com um sistema que é um melhor redutor
Com um sistema que é um melhor oxidante

Celulas Galvânicas e voltagem
Eletroquímica
Sentido espontâneo...?
Potencial de celula..?

Celulas Galvânicas e voltagem
Eletroquímica
Para a célula { H+ / Cu} :
Neste caso o ENH é o ânodo

Eletroquímica
Potencial de célula

Eletroquímica
Exercício:

Eletroquímica
Exercício:

Eletroquímica
Usando os potenciais padrão:
Como resultado da comparação de vários eletrodos comENH criou-se a tabela de potenciais padrão de redução:
Série eletroquímica
1. Todas as semi-reações são escritas como redução;
2. Cada semi-reações pode ocorrer em ambas asdireções ( H+ / H2 ) ;
3. Quanto mais (+) o potencial (Eored ) mais facilmente ela
será reduzida (ag. Oxidante forte);
4. Quanto mais (-) o potencial (Eored ) mais facilmente ela
será oxidada (reação reversa);

EletroquímicaEletroquímica
Usando os potenciais padrão:
Como resultado da comparação de vários eletrodos comENH criou-se a tabela de potenciais padrão de redução:
Série eletroquímica
5. Nas condições padrão, qualquer espécie a esquerdada semi-reação irá oxidar espécies abaixo e a direita databela;

EletroquímicaEletroquímicaEletroquímica
Usando os potenciais padrão:
6. Os potenciais de redução dependem da concentraçãodos reagentes/produtos mas NÃO dependem daquantidade que cada um reage;
“Considerando o potencial da semi-reação é a energiapor unidade de carga (1 volt= 1 joule / 1 coulomb).Quando a reação é multiplicado por algum número,tanto a energia e número de elétrons são multiplicadospor esse número. Assim, a razão entre a energia para acarga (voltagem) nãomuda”.

Eletroquímica
Potenciais e a energia livre de Gibs
Dessa forma o trabalho é dado pela cte de Faraday vezes o no. De mols de e- e o potencial decélula.
0
elétricow nFE= −
Combinando esta equação com equação termodinâmica que relaciona o ΔG com trabalho denão expansão obtemos :
0G nFE = −
O sinal negativo vem de que para uma reação espontânea o ΔG (-) e o E0 é sempre positivo.Logo eles devem ter sinais opostos.
0 G E −

Eletroquímica
Potenciais e a energia livre de Gibs

Eletroquímica

Eo , ΔGo e K
Eletroquímica
Agora que conhecemos a relação entre ΔGo e Eo nas condições padrão de célula:0G nFE = −
Da termodinâmica, temos que no equíbrio a energia livre de Gibbs é proporcional a ln K
lnG RT K = −
lnonFE RT K− = − lno RTE K
nF=
Juntando estas duas equações, temos:
Estas equações demonstram que ao obtermos Eo, podemoscalcular ΔG e K.

Eletroquímica

Eletroquímica

Eletroquímica
Célula galvânica – reação favorável..
Efeito da Concentração no Potencial
Durante a reação há variação na concentração dos reagentes
Diminuição reagentes→ queda na ddp

Eletroquímica
Resolvendo a equação, temos:
Equação de Nernst:
Simplificando:

Eletroquímica

Eletroquímica

Eletroquímica
Célula eletrolítica – reação não espontânea.
Eletrólise
A reação não espontânea – pode ser induzida com um potencial eletroquímico externo.

Eletroquímica

Eletroquímica
Quais as diferenças?
• Em uma célula voltaica, os elétrons são gerados no ânodo,
então é negativo, e elétrons são consumidos no cátodo, então
é positivo.
• Em uma célula eletrolítica, os elétrons vêm da fonte de
energia externa, que os fornece ao cátodo, por isso é
negativo, e os remove de o ânodo, por isso é positivo.

Eletroquímica
Estequiometria na eletrólise
Lei da eletrólise de Faraday: a quantidade de substância produzida em cada eletrodo é
diretamente proporcional à quantidade de carga que flui através da célula.
Como determinar a quantidade de material depositado nos eletrodos?
1. Equilibre a meia reação para encontrar o número de mols de elétrons necessários por mole
de produto.
2. Use a constante de Faraday (F = 9,65x104 C.mol-1) Para encontrar a carga correspondente.
3. Use a massa molar para encontrar a carga necessária para uma determinada massa de
produto.

Eletroquímica
Exercício - Um técnico está recobrindo uma torneira com 0,86 g de Cr de um banho eletrolítico
contendo Cr2(SO4)3 aquoso. Se 12,5 min são permitidos para o revestimento, qual corrente é
necessária?

Eletroquímica
Exercício - Um técnico está recobrindo uma torneira com 0,86 g de Cr de um banho eletrolítico
contendo Cr2(SO4)3 aquoso. Se 12,5 min são permitidos para o revestimento, qual corrente é
necessária?