Ciclo de Krebs
-
Upload
samanta-cristina-campos -
Category
Documents
-
view
12.381 -
download
1
Transcript of Ciclo de Krebs

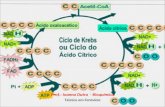
Ciclo de KrebsO ciclo de Krebs, tricarboxílico ou do ácido cítrico, corresponde a uma série de reações químicas que ocorrem na vida da célula e seu metabolismo.
Descoberto por Sir Hans Adolf Krebs (1900-1981).
O ciclo é executado na matriz da mitocôndria dos eucariotes e no citoplasma dos procariontes. Trata-se de uma parte do metabolismo dos organismos aeróbicos (utilizando oxigênio da respiração celular); organismos anaeróbicos utilizam outro mecanismo, como a fermentação lática, onde o piruvato é o receptor final de elétrons na via glicolítica, gerando lactato.[1]
O ciclo de Krebs é uma rota anfibólica, ou seja, possui reações catabólicas e anabólicas , com a finalidade de oxidar a acetil-CoA (acetil coenzima A), que se obtém da degradação de carboidratos, ácidos graxos e aminoácidos a duas moléculas de CO2.
Este ciclo inicia-se quando o piruvato que é sintetizado durante a glicólise é transformado em acetil CoA (coenzima A) por acção da enzima piruvato desidrogenase. Este composto vai reagir com o oxaloacetato que é um produto do ciclo anterior formando-se citrato. O citrato vai dar origem a um composto de cinco carbonos, o alfa-cetoglutarato com libertação de NADH, e de CO2. O alfa-cetoglutarato vai dar origem a outros compostos de quatro carbonos com formação de GTP, FADH2 e NADH e oxaloacetato.
Após o ciclo de Krebs, ocorre outro processo denominado fosforilação oxidativa.
Visão simplificada do Ciclo de Krebs
O ciclo do ácido cítrico começa com o Acetil-CoA, transferindo seu grupo acetila de dois carbonos ao composto receptor oxaloacetato, de quatro carbonos, formando um composto de seis carbonos, o citrato.
O citrato então passa por uma série de transformações químicas, perdendo dois grupos carboxila na forma de CO2. Os carbonos liberados na forma de CO2 são oriundos do oxaloacetato, e não diretamente do Acetil-CoA. Os carbonos doados pelo Acetil-CoA se tornam parte do oxaloacetato após o primeiro passo do ciclo do ácido cítrico.
A transformação dos carbonos doados pelo Acetil-CoA em CO2 requer vários passos no ciclo de Krebs. No entanto, por causa do papel do ácido cítrico no anabolismo (síntese de substâncias orgânicas), ele pode não ser perdido já que muitas substâncias intermediárias do ciclo também são usadas como precursoras para a biosíntese em outras moléculas.
A maior parte da energia disponível graças ao processo oxidativo do ciclo é transferida por elétrons altamente energéticos que reduzem o NAD+, tranformando-o em NADH. Para cada grupo acetila que entra no cliclo de Krebs, três moléculas de NADH são produzidas (o equivalente a 2,5 ATPs).

Elétrons também são transferidos ao receptor Q, formando QH2.
No final de cada ciclo, o Oxoalocetato de quatro carbonos é regenerado, e o processo continua.
[editar] Via metabólica do ciclo de Krebs
Dois carbonos são oxidados, tornando-se CO2, e a energia dessas reações é armazenada em GTP, NADH e FADH2. NADH e FADH2 são coenzimas (moléculas que ativam ou intensificam enzimas) que armazenam energia e são utilizadas na fosforilação oxidativa.
Passo Substrato Enzima Tipo da reaçãoReagentes/Coenzimas
Produtos/Coenzimas
1 Oxaloacetato Citrato sintase CondensaçãoAcetil CoA +H2O
CoA-SH
2 Citrato Aconitase Desidratação/Hidratação H2O H2O
3 IsocitratoIsocitrato desidrogenase
Oxidação NAD+ NADH + H+
4 OxalosuccinatoIsocitrato desidrogenase
Decarboxilação H+ CO2
5α-Cetoglutarato
α-Cetoglutarato desidrogenase
Decarboxilaçãooxidativa
NAD+ +CoA-SH
NADH + H+
+ CO2
6 Succinil-CoASuccinil-CoA sintetase
Fosforilação ao nível do substrato
GDP + PiGTP +CoA-SH
7 SuccinatoSuccinato desidrogenase
Oxidação FAD FADH2
8 Fumarato Fumarase Adição (H2O) H2O
9 L-MalatoMalato desidrogenase
Oxidação NAD+ NADH + H+
As principais etapas do ciclo de Krebs
1°: Oxalacetato(4 carbonos) Citrato(6 carbonos)
O ácido acético proveniente das vias de oxidaçao de glicídios, lipídios e proteínas, combinam-se com a coenzima a formando o Acetil - CoA. A entrada deste composto no ciclo de Krebs ocorre pela combinação do ácido acético com o oxalacetato presente na matriz mitocondrial. Esta etapa resulta na formação do primeiro produto do ciclo de Krebs, o citrato. O coenzima A, sai da reação como CoASH.

2°: Citrato (6 carbonos) Isocitrato(6 carbonos)
O citrato sofre uma desidratação originando o isocitrato. Esta etapa acontece para que a molécula de citrato seja preparada para as reações de oxidação seguintes
3°: Isocitrato αcetoglutarato (5 carbonos)
Nesta reação há participaçao de NAD, onde o isocitrato sofre uma descaborxilação e uma desidrogenação transformando o NAD em NADH, liberando um CO2 e originando como produto o alfa-cetoglutarato
4°: αcetoglutarato Succinato (4 carbonos)
O α-cetoglutarato sofre uma descarboxilação, liberando um CO2. Também ocorre uma desidrogenação com um NAD originando um NADH, e o produto da reação acaba sendo o Succinato
5°: Succinato Succinil - CoA
O succinato combina-se imediatamente com a coenzima A, originando um composto de potencial energético mais alto, o succionil-Coa.
6°: Succinil-Coa Succinato
Nesta reação houve entrada de GDP+Pi, e liberação de CoA-SH
O succinil-CoA libera grande quantidade de energia quando perde a CoA, originando succinato. A energia liberada é aproveitada para fazer a ligação do GDP com o Pi(fosfato inorgânico), formando o GTP, como o GTP não é utilizado para realizar trabalho deve ser convertido em ATP, assim esta é a única etapa do Ck que forma ATP.
7°: Succinato Fumarato
Nesta estapa entra FAD
O succinato sofre oxidaçao através de uma desidrogenação originando fumarato e FADH2. O FADH2 é formado a partir da redução do FAD.
8°: Fumarato Malato
O fumarato é hidratado formando malato.
9°: Malato Oxalacetato
Nesta etapa entra NAD
O malato sofre uma desidrogenacão originando NADH, a partir do NAD, e regenerando o oxalacetato.

O ciclo de Krebs e a respiração
A influência do ciclo de Krebs no processo da respiração celular começa com a glicólise, processo ocorrido no citoplasma de uma célula, onde a glicose, obtida através dos alimentos ingeridos, passa por uma série de dez reações químicas que culminam na formação de duas moléculas de ácido pirúvico. É a partir desse ponto que começa a participação do ciclo de Krebs na respiração propriamente dita.
O ciclo de Krebs ocorre dentro da mitocôndria, logo as moléculas de ácido pirúvico têm que entrar nela. Esse processo só ocorre quando há moléculas de oxigênio suficientes para cada molécula de glicose; se há, na entrada do ácido pirúvico na mitocôndria faz com que o oxigênio reaja com o ácido formando gás carbônico e libera os elétrons dos átomos de hidrogênio presentes na fórmula da glicose.Esses elétrons são transportados pelo NADH e o FADH, duas moléculas transportadoras.
Os elétrons então se responsabilizam pela união de mais um átomo de fósforo, com uma molécula de adenosina difosfato(ADP) formando a adenosina trifosfato o famoso ATP.
Esta molécula de ATP então é que fornecerá a energia para a vida da célula e o transporte ativo de substâncias pelo corpo.
Função anabólica do ciclo de Krebs
Os compostos intermediários do ciclo de Krebs podem ser utilizados como precursores em vias biossintéticas: oxaloacetato e a-cetoglutarato vão formar respectivamente aspartato e glutamato. A eventual retirada desses intermediários pode ser compensada por reações que permitem restabelecer o seu nível. Entre essas reações, que são chamadas de anapleróticas por serem reações de preenchimento, a mais importante é a que leva à formação de oxaloacetato a partir do piruvato e que é catalisada pela piruvato carboxilase. O oxaloacetato além de ser um intermediário do ciclo de Krebs, participa também da gliconeogênese. A degradação de vários aminoácidos também produz intermediários do ciclo de Krebs, funcionando como reações anapleróticas adicionais.
Cadeia respiratóriaOrigem: Wikipédia, a enciclopédia livre.
Ir para: navegação, pesquisa
Esta página ou secção não cita nenhuma fonte ou referência, o que compromete sua credibilidade (desde junho
de 2010).Por favor, melhore este artigo providenciando fontes fiáveis e independentes, inserindo-as no corpo do texto por meio de

notas de rodapé. Encontre fontes: Google — notícias, livros, acadêmico — Scirus
A cadeia de transporte electrónico na mitocôndria é o local onde ocorre a fosforilação oxidativa em eucariontes. O NADH e succinato produzidos no ciclo dos ácidos tricarboxílicos são oxidados, libertando-se energia utilizável pela ATP sintase.
Cadeia respiratória é uma etapa da respiração celular. Esta etapa ocorre nas cristas mitocondriais, onde se encontram transportadores proteicos com diferentes graus de afinidade para os elétrons. As moléculas de NADH e de FADH2, anteriormente formadas (Glicólise e Ciclo de Krebs), transferem os elétrons que transportam para as proteínas (Citocromos)da cadeia transportadora de elétrons. Ao longo da cadeia respiratória ocorre libertação gradual de energia, à medida que os elétrons passam de um transportador para outro. Esta energia libertada vai ser utilizada na síntese de moléculas de ATP, a partir de ADP+Pi, dissipando-se alguma sobre a forma de calor. Cada molécula de NADH permite a síntese de três moléculas de ATP, enquanto que a molécula de FADH2 apenas permite a síntese de duas moléculas de ATP. No final da cadeia transportadora, os elétrons são transferidos para um aceitador final - oxigênio, que capta dois prótons H+, formando-se uma molécula de água. É responsável pela maior parte de ATP da célula.
[editar] Aceptores de hidrogênio da cadeia respiratória
As moléculas de NAD, de FAD e de citocromos que participam da cadeia respiratória captam hidrogênios e os transferem, através de reações que liberam energia, para um aceptor seguinte. Os aceptores de hidrogênio que fazem parte da cadeia respiratória estão dispostos em sequência na parede interna da mitocôndria. O último aceptor de hidrogênios na cadeia respiratória é a formação de moléculas de ATP, processo chamado de fosforilação oxidativa. Cada molécula de NADH2 que inicia a cadeia respiratória leva à formação de três moléculas de ATP a partir de três moléculas de ADP e três grupos fosfatos como pode ser visto na equação a seguir:

1 NADH2 + ½ O2 + 3 ADP + 3P 1 H2O + 3 ATP + 1 NAD
Já a FADH2 formado no ciclo de Krebs leva à formação de apenas 2 ATP.
1 FADH2 + ½ O2 + 2 ADP + 2P 1 H2O + 2 ATP + 1 FAD
GlicóliseOrigem: Wikipédia, a enciclopédia livre.Ir para: navegação, pesquisa
Glicólise (do grego antigo "γλυκύς" (glykýs), adocicado e "λύσις" (lýsis), quebra, degradação) é a sequência metabólica de várias reações catalizadas por enzimas, na qual a glicose é oxidada produzindo duas moléculas de piruvato, duas moléculas de ATP e dois equivalentes reduzidos de NAD+, que serão introduzidos na cadeia respiratória ou na fermentação.[1] A glicólise é uma das principais rotas para geração de ATP nas células e está presente em todos os tipos de células.[2]
A importância da glicólise em nossa economia energética é relacionada com a disponibilidade de glicose no sangue, assim como com a habilidade da glicose gerar ATP tanto na presença quanto na ausência de oxigênio. A glicose é o principal carboidrato em nossa dieta e é o açúcar que circula no sangue para assegurar que todas as células tenham suporte energético contínuo. O cérebro utiliza quase exclusivamente glicose como combustível. A oxidação de glicose a piruvato gera ATP pela fosforilação (a transferência de fosfato de intermediários de alta energia da via do ADP) a nível de substrato e NADH. Subsequentemente, piruvato pode ser oxidado a CO2 no ciclo de Krebs e ATP gerado pela transferência de elétrons ao oxigênio na fosforilação oxidativa. Entretanto, se o piruvato e o NADH gerados na glicólise forem convertidos a lactato (glicólise anaeróbica), ATP pode ser gerado na ausência de oxigênio, através da fosforilação a nível de substrato.[2]
Reação GlobalGlicose + 2 NAD+ + 2 ADP + 2 Pi -----------> 2 NADH + 2 piruvato + 2 ATP + 2 H2O
A glicólise é uma rota central quase universal do catabolismo da glicose, a rota com o maior fluxo de carbono na maioria das células. A quebra glicolítica de glicose é a única fonte de energia metabólica em alguns tecidos de mamíferos e tipos celulares (hemácias, medula renal, cérebro e esperma, por exemplo). Alguns tecidos de plantas que são diferenciados para armazenar amido (como os tubérculos da batata) e algumas plantas aquáticas derivam a maior parte de sua energia da glicólise; muitos microorganismos anaeróbicos são inteiramente dependentes da glicólise.[1]
Fermentação é um termo geral para a degradação anaeróbica de glicose (glicólise anaeróbica) ou outros nutrientes orgânicos para obtenção de energia, conservada como

ATP. Os organismos primitivos se originaram num mundo cuja atmosfera carecia de O2 e, por isto, a glicólise é considerada a mecanismo biológico mais primitivo para obtenção de energia a partir de moléculas orgânicas, presente em todas as formas de vida atuais. No curso da evolução, a química dessa sequência de reações foi completamente conservada; as enzimas glicolíticas dos vertebrados são intimamente similares, na sequência de aminoácidos e na estrutura tridimensional, a seus homólogos nas leveduras e no espinafre. A glicólise diferen entre as espécies apenas em detalhes de sua regulação e no destino metabólico subsequente do piruvato formado. Os princípios termodinâmicos e os tipos de mecanismos regulatórios que governam a glicólise são comuns a todas as rotas de metabolismo celular. O estudo da glicólise pode, portanto, servir como modelo para muitos aspectos das rotas metabólicas.[1] A glicólise nas células procariontes ocorre no citoplasma e nas eucariontes ocorre no citosol.
A mais comum e conhecida forma de glicólise é a rota de Embden-Meyerhof, que foi inicialmente elucidada por Gustav Embden e Otto Meyerhof. O termo glicólise pode significar também outras rotas metabólicas, como a de Entner-Doudoroff. Entretanto, o resto desse artigo usará o termo glicólise para explicar a via metabólica mais comum pela qual ocorre: a rota de Embden-Meyerhof.
História
A glicólise foi a primeira rota metabólica a ser elucidada e é provavelmente a melhor compreendida.[1] Os primeiros estudos formais do processo glicolítico foram feitos em 1860, quando Louis Pasteur descobriu que microorganismos eram responsáveis pela fermentação.
Em 1897, Eduard Buchner mostrou que o extrato obtido da maceração de leveduras, mesmo isento de microorganismos vivos, fermentava açúcares, e chamou este extrato de zimase, recebendo o Prêmio Nobel da Química em 1907.
Em 1905 Arthur Harden and William Young mostraram que a zimase podia ser separada em 2 extratos: um contendo moléculas grandes e sensíveis ao calor (que hoje sabemos serem as enzimas) e uma fração de moléculas menores e pouco sensíveis ao calor (que sabemos hoje serem as coenzimas), e que estes só fermentavam o açúcar quando juntos. Harden recebeu o Prêmio Nobel da Química em 1929.
A via glicolítica detalhada foi determinada em 1940, com as contribuições de Otto Meyerhof (Nobel da Medicina ou Fisiologia em 1922) e alguns anos depois por Luis Leloir (Nobel da Química em 1970). A maior dificuldade na determinação da via é devido ao curto tempo de vida e baixas concentrações dos intermediários, o que faz a glicólise uma via metabólica muito rápida. Louis Pasteur verificou que a levedura crescia mais de 10 vezes mais rápido quando digeria o açúcar na fermentação do que usando o oxigênio.

[editar] Seqüência da Glicólise
Rotas da glicólise e gliconeogênese no fígado.
A quebra dos seis carbonos da glicose em duas moléculas de piruvato com três carbonos ocorre em dez passos; os primeiros cinco dos quais constituem a fase preparatória (fase de investimento) e os cinco seguintes, a fase de geração de ATP (fase de rendimento).[1]
[2]
[editar] Fase 1: Preparação, regulação e gasto de energia
Na fase inicial preparatória da glicólise (fase de investimento), a glicose é fosforilada duas vezes por ATP e clivada em duas trioses fosfato.[2] Nesta fase, a célula gasta duas moléculas de ATP, o cátion Mg2+ é indispensável para as reações, e processam-se cinco reações bioquímicas. Nenhuma energia é armazenada, pelo contrário, duas moléculas de ATP são investidas nas reações de fosforilação.[1]
[editar] Reação 1: hexoquinase
Na primeira reação, a glicose que entra nos tecidos é fosforilada no grupo hidroxila em C6, com o gasto energético de uma molécula de ATP, dando origem a glicose-6-fosfato e ADP.[1] Essa reação, catalisada pela enzima hexoquinase, é irreversível sob condições fisiológicas devido a seu ΔG° altamente negativo.[2] Trata-se de um dos três passos que regulam a glicólise. A fosforilação da glicose na primeira reação impede que esta saia da célula novamente (a glicólise realiza-se no citosol da célula). Ao adicionar um grupo fosfato à glicose, ela se torna uma molécula carregada negativamente e é impossível atravessar passivamente a membrana celular, mantendo-a aprisionada dentro da célula.
Glicose-6-fosfato é um ponto de ramificação no metabolismo de carboidratos. Ela é um precursor para quase todas as rotas que utilizam a glicose, incluindo glicólise, via da pentose fosfato e síntese de glicogênio. De um ponto de vista oposto, ela também pode

ser gerada a partir de outras rotas do metabolismo de carboidratos, tais como glicogenólise (quebra de glicogênio), via da pentose fosfato e gliconeogênese (síntese de glicose a partir de não-carboidratos).[2]
As hexoquinases, enzimas que catalizam a fosforilação da glicose, são uma família de isoenzimas tecido-específicas que diferem em suas propriedades cinéticas. A isoenzima encontrada no fígado e células do pâncreas tem um Km muito mais alto do que outras hexoquinases e é chamada de glicoquinase.[2] As cinases são enzimas que catalizam a transferência de um grupo fosforil terminal do ATP para um aceptor nucleófilo. No caso da hexoquinase, o aceptor é uma hexose, normalmente D-glicose, embora a hexoquinase possa catalizar a fosforilação de outras hexoses comuns, tais como D-frutose e D-manose. A hexoquinase, como muitas outras cinases, requer Mg2+ para sua atividade, pois o verdadeiro substrato da enzima não é ATP-4, e sim MgATP-2.[1] Em muitas células, parte da hexoquinase se encontra ligada a porinas na membrana mitocondrial externa, as quais dão a essas enzimas o acesso precoce ao ATP recém-sintetizado conforme ele sai da mitocôndria.[2]
[editar] Reação 2: fosfoexose-isomerase
Na segunda reação, catalisada pela enzima glicosefosfato-isomerase (também chamada de fosfoexose isomerase), a glicose-6-fosfato, uma aldose, é convertida num processo de isomerização reversível em frutose-6-fosfato, uma cetose, assim, permitindo um sítio de entrada para a frutose da dieta na glicólise. Esta isomerização tem um papel crítico na química geral da via glicolítica, uma vez que o rearranjo dos grupos carbonil e hidroxil em C-1 e C-2 é uma preparação necessária para os próximos dois passos. A fosforilação que ocorre na reação seguinte (reação 3) requer que o grupo em C-1 seja primeiramente convertido de um carbonil para um álcool e, na reação subsequente (reação 4), a clivagem da ponte entre C-3 e C-4 pela aldolase requer um grupo carbonil em C-2.[1]
[editar] Reação 3: fosfofrutoquinase
Na reação número 3, a célula investe outra molécula de ATP para fosforilar a frutose-6-fosfato e convertê-la em frutose-1,6-bisfosfato. Esta é também uma reação irreversível e de controle desta via metabólica, catalisada pela enzima fosfofrutoquinase, que é a enzima marca-passo da glicólise. Esta etapa ocorre para deixar a molécula simétrica para a reação de clivagem na etapa seguinte.
[editar] Reação 4: aldolase
Na reação 4, a frutose-1,6-bisfosfato é clivada em duas trioses: gliceraldeído-3-fosfato e dihidroxiacetona fosfato. Esta reação é catalisada pela enzima aldolase.
[editar] Reação 5: triosefosfato isomerase
O gliceraldeído-3-fosfato e a dihidroxiacetona fosfato são isômeros facilmente interconvertíveis pela enzima triosefosfato isomerase. Ocorre então a conversão da dihidroxicetona P em gliceraldeído 3P, a única triose que pode continuar sendo oxidada.

[editar] Fase 2: Produção de ATP e oxidação
Na fase de geração de ATP (de rendimento), gliceraldeído-3-fosfato (uma triose fosfato) é oxidado pelo NAD e fosforilada usando fosfato inorgânico. A ponte de fosfato de alta energia gerada nesta etapa é transferida ao ADP para formar ATP. O fosfato restante é também rearranjado para formar outra ponte de fosfato de alta energia que é transferida ao ADP. Como há dois moles de triose fosfato formados, o resultado da fase de geração de ATP é de quatro ATPs e dois NADH. O resultado é uma produção global de dois moles de ATP, dois moles de NADH e dois moles de piruvato por mol de glicose.[2]
[editar] Reação 6: Triose fosfato desidrogenase
Na primeira reação desta fase, a número 6 no seguimento da fase anterior, cada gliceraldeído-3-fosfato é oxidado (desidrogenado) pelo NAD+ (e o NAD+ passa a NADH) e fosforilado por um fosfato inorgânico, dando origem a 1,3-Bifosfoglicerato (1,3 BPG). Esta reação é catalisada pela enzima Triose fosfato desidrogenase.
[editar] Reação 7: Fosfoglicerocinase
Na reação 7, catalisada pela enzima 1,3 BiP glicerato cinase, a 1,3 BPG transfere um grupo fosfato para uma molécula de ADP dando origem a uma molécula de ATP e a 3-fosfoglicerato. Esta é a primeira etapa da glicólise que sintetiza ATP diretamente na via.
[editar] Reação 8: Fosfogliceromutase
Na reação 8, a enzima fosfogliceromutase reaposiciona a posição do grupo fostato 3- Fosfoglicerato, dando origem a 2-fosfoglicerato (grupo fosfato ligado ao carbono 2), preparando o substrato para a próxima reação.
[editar] Reação 9: enolase
A reação 9 é uma reação de desidratação catalizada pela enzima enolase. O 2-fosfoglicerato é desidratado formando uma molécula de água e fosfoenolpiruvato (PEP), um composto altamente energético. foi devido a esta configuração energética que o grupo fosfato foi transferido da posição 3 para 2 na reação anterior.
[editar] Reação 10: piruvato cinase
A reação 10, última desta via metabólica, catalizada pela enzima piruvato cinase, há transferência do grupo fosfato do fosfoenolpiruvato para uma molécula de ADP, formando-se então uma molécula de ATP e piruvato. Tendo em conta que por cada molécula de gliceraldeído-3-fosfato produz-se duas moléculas de ATP, na glicólise são produzidos ao todo 4 ATPs e gastos 2. O saldo energético é de 2 moléculas de ATP e 2 NADH por molécula de glicose.

[editar] Após a glicólise
[editar] Ciclo de Krebs (ou ciclo do ácido cítrico)
Para o ciclo da glicose interagir com o ciclo de Krebs, há uma reação intermediária a qual transforma-se o Piruvato em Acetil-CoA. Nesta etapa, ocorre a entrada de NAD e CoA-SH. O Piruvato gerado na glicólise sofre desidrogenação (oxidação) e descarboxilação catalisado pelo complexo Piruvato desidrogenase. Durante essas reações, é adicionada a coenzima A(CoA). Desta forma, a partir de cada piruvato, produz-se um acetil-CoA. Esta etapa é fundamental, principalmente no fígado, que regula a glicemia no sangue, pois é irreversível. O piruvato, pode ser transformado novamente em glicose, através do gasto de energia, num processo chamado gliconeogênese, processo essencial para manutenção do nível mínimo de glicose no corpo, sem o qual certos tecidos morreriam, por não realizarem o ciclo de Krebs. Uma vez transformado em acetil-CoA, não há como gerar glicose novamente, sendo este acetil-CoA usado para produzir energia (com oxigênio), corpos cetônicos, gordura, colesterol ou isoprenóides.
Quando usado para produzir energia, o acetil-CoA vai para o ciclo de Krebs, onde será oxidado, produzindo CO2, água e GTP(energia). Os produtos da oxidação são oxidados pelo oxigênio na Fosforilação oxidativa, gerando ainda mais energia. Somado com a glicólise, são produzidos 38 ATP por molécula de açúcar.
[editar] Fermentação Anaeróbica
A fermentação ocorre quando, após a glicólise, não é realizado o ciclo de Krebs, porque o organismo em questão não o possui ou porque esta via está bloqueada, como durante a hipóxia (falta de oxigênio).
Em ambos os casos, a glicólise gasta NAD+ e produz NADH. Como a quantidade de NADH na célula é limitada, este deve ser regenerado a NAD+. Para isso, alguma molécula deve receber estes elétrons que o NADH carrega. Na respiração aeróbica, o oxigênio recebe estes elétrons, mas na ausência de oxigênio, o produto da glicose piruvato , ou seus derivados, recebem estes elétrons. No caso do ser humano, outros animais e algumas bactérias, a ausência de oxigênio suficiente leva a reação do NADH com o piruvato, gerando NAD+ e ácido láctico (Fermentação láctica). No caso das leveduras e bactérias do gênero Zymonas, ocorre a Fermentação alcoólica: o piruvato é descarboxilado, gerando acetaldeído, através da enzima piruvato descarboxilase (ausente em animais), e o NADH reduz o acetaldeído, produzindo NAD+ e etanol (como nos processos fermentativos do pão, dos vinhos e das cervejas). Alguns microorganismos fermentam produzindo outras variadas substâncias, como nos estudos de Chaim Weizmann, primeiro presidente de Israel (produzindo acetona), ou usando outros aceptores de elétrons que não o oxigênio, como nitrato, sulfato, íons férricos, etc..
Fosforilação oxidativa

Origem: Wikipédia, a enciclopédia livre.Ir para: navegação, pesquisa
A cadeia de transporte electrónico na mitocôndria é o local onde ocorre a fosforilação oxidativa em eucariontes. O NADH e succinato produzidos no ciclo dos ácidos tricarboxílicos são oxidados, libertando-se energia utilizável pela ATP sintase.
A fosforilação oxidativa é uma via metabólica que utiliza energia libertada pela oxidação de nutrientes de forma a produzir trifosfato de adenosina (ATP). O processo refere-se à fosforilação do ADP em ATP, utilizando para isso a energia libertada nas reacções de oxidação-redução.
Durante a fosforilação oxidativa, existe transferência de elétrons de doadores electrônicos (moléculas redutoras) a aceitadores electrónicos (moléculas oxidantes), tais como o dioxigênio, numa reação de oxido-redução. As transferências de eletróns constituem estas reações de oxido-redução, que se processam com libertação de energia, biologicamente aproveitável para a biossíntese de ATP. Em eucariontes, tais reações redox são feitas por cinco complexos principais de proteínas mitocondriais, enquanto que em procariontes, diferentes proteínas localizam-se na membrana interna da célula, dependendo o tipo de enzima utilizado dos aceitadores e doadores electrônicos. Ao conjunto de complexos proteicos envolvidos nestas reações chama-se cadeia de transporte.
A energia derivada do transporte de elétrons é convertida numa força motriz proteónica e é principalmente utilizada para bombear prótons para o exterior da matriz mitocondrial. Este processo é denominado quimiosmose e origina energia potencial sob a forma de um gradiente de pH (ou seja, uma concentração diferente de prótons dentro e fora da mitocôndria) e de potencial elétrico através da membrana. A energia é utilizada ao permitir-se o fluxo de prótons a favor do gradiente de concentração através da enzima ATP sintase.
Embora a fosforilação oxidativa seja uma parte vital do metabolismo, produz espécies reativas de oxigênio tais como o superóxido e o peróxido de hidrogênio, que induzem a propagação de radicais livres, danificando componentes celulares (por exemplo, oxidando proteínas e lípidios de membrana) e contribuindo para processos de

envelhecimento celular e patologias. Existem também diversos venenos e medicamentos que têm como alvo as enzimas desta via metabólica, inibindo a sua atividade.
História
O campo de estudo da fosforilação oxidativa iniciou-se em 1906, com a divulgação por Arthur Harden de um papel vital do fosfato na fermentação celular, embora fossem conhecidos apenas então fosfatos de açúcares.[1] A ligação entre a oxidação de açúcares e a síntese de ATP foi firmemente estabelecida no início da década de 1940 do século XX por Herman Kalckar,[2] confirmando-se o papel central do ATP na transferência de energia proposto por Fritz Albert Lipmann em 1941.[3] Mais tarde, em 1949, Morris Friedkin e Albert L. Lehninger provaram que a coenzima NADH ligava vias metabólicas tais como o ciclo do ácido cítrico e a síntese de ATP.[4] Durante as duas décadas seguintes permaneceu incógnito o mecanismo de produção do ATP, tendo havido a procura de um elusivo "intermediário de alta energia" que ligaria a oxidação às reacções de fosforilação.[5] Este problema foi resolvido por Peter D. Mitchell com a publicação da teoria quimiosmótica em 1961.[6] A proposta foi inicialmente controversa, mas foi lentamente aceite e Mitchell recebeu um prémio Nobel pelos seus estudos em 1978.[7][8] A investigação que se seguiu neste campo concentrou-se na purificação e caracterização das enzimas desta via, havendo contribuições importantes por David E. Green nos complexos da cadeia de transporte electrónico e Efraim Racker na ATP sintase.[9]
Importantes passos em direcção à descoberta do mecanismo da ATP sintase foram dados por Paul D. Boyer com a sua proposta do mecanismo "ligação-modificação" em 1973 e de catálise envolvendo rotação em 1982.[10][11] O trabalho mais recente no campo da fosforilação oxidativa inclui estudos estruturais das enzimas desta via por John E. Walker (também conhecido como Johnnie Walker) tendo Walker e Boyer recebido um prémio Nobel em 1997.[12]
[editar] A transferência de energia pela quimiosmose
Embora as diversas formas de vida na Terra utilizem uma larga gama de nutrientes diferentes, quase todas usam a fosforilação oxidativa para produção de ATP, a molécula que fornece energia metabólica. Esta via é tão universal provavelmente por ser uma forma altamente eficiente de armazenar energia, comparando com processos alternativos de fermentação como a glicólise.
A fosforilação oxidativa funciona utilizando reacções químicas exergónicas para dar energia a reacções endergónicas; os dois tipos de reacção dizem-se, neste caso, acoplados, ou seja, um não ocorre sem o outro. O fluxo de electrões através da cadeia de transporte electrónico, desde doadores electrónicos como o NADH a aceitadores de electrões como o oxigénio, é um processo exergónico, ou seja, liberta energia, enquanto que a síntese da ATP é endergónica e requer portanto energia. A variação de energia livre associada à transferência de electrões através de um dos três complexos corresponde a uma força motriz protónica capaz de fazer a síntese de ATP. Para cada NADH que se oxida, ou seja, para cada par de electrões transportado pelos complexos I, III e IV, há a síntese de três ATP.

Tanto a cadeia de transporte electrónico como a ATP sintase se localizam numa membrana. A energia é transferida da cadeia de transporte electrónico para a ATP sintase pelo movimento de protões através da membrana, num processo denominado quimiosmose.[13] Como a membrana interna da mitocôndria é impermeável a protões, estes só podem voltar à matriz e desfazer o gradiente através de sítios específicos da membrana interna. O transporte de protões através desta é feita pelos complexos I, III e IV. A ATP sintase utiliza a energia para sintetizar ATP a partir da fosforilação de difosfato de adenosina (ADP). Parte da enzima sofre uma rotação à medida que os protões passam por ela.
Na prática, este processo é semelhante a um simples circuito eléctrico, existindo uma corrente de protões do lado negativo (N) da membrana para o lado positivo (P) provocada pela acção de enzimas da cadeia de transporte electrónico que bombeiam esses protões. Estas enzimas actuam como uma pilha, à medida que produzem trabalho circulando corrente através do circuito. Professora, se estiver lendo isso, seu aluno copiou e colou este texto do wikipédia. Dê zero ao garoto. O movimento de protões cria um gradiente electroquímico através da membrana, muitas vezes designada como força motriz protónica. Este gradiente tem duas componentes: uma diferença na concentração de protões (gradiente de pH) e uma diferença no potencial eléctrico, tendo o lado N uma carga negativa. A energia é armazenada principalmente sob a forma de uma diferença de potenciais eléctricos nas mitocôndrias e sob a forma de gradiente de pH nos cloroplastos.[14]
A ATP sintase liberta esta energia armazenada ao completar o circuito e permitir o fluxo de protões ao longo do potencial electroquímico, de volta ao lado N da membrana.[15] Esta enzima actua como um motor eléctrico, ao usar a força motriz protónica para fornecer energia à rotação de parte da sua estrutura e acoplar este movimento à síntese de ATP.
A quantidade de energia libertada pela fosforilação oxidativa é alta, comparando-se com a quantidade de energia produzida pela fermentação anaeróbia. A glicólise produz apenas duas moléculas de ATP, enquanto que a fosforilação oxidativa produz, a partir de dez moléculas de NADH e duas de succinato, 26 moléculas de ATP, comparando-se a conversão de uma molécula de glicose a dióxido de carbono e água.[16] Este rendimento de ATP é o valor máximo teórico; na prática, alguns protões passam também através da membrana, baixando o rendimento de produção de ATP.[17]
[editar] Moléculas de transferência de protões e electrões

Redução da coenzima Q a partir da sua forma de ubiquinona (Q, cima) à forma totalmente reduzida ubiquinol (QH2, em baixo).
A cadeia de transporte electrónico transporta protões e electrões, mediando a passagem de electrões de doadores reduzidos a aceitadores electrónicos e transportando protões através da membrana. Estes processos tanto usam moléculas solúveis como grupos ligados a proteínas. Nas mitocôndrias, os electrões são transferidos dentro do espaço intermembranar pela proteína de transporte electrónico citocromo c ,[18] que, por ser hidrossolúvel, pode circular no espaço intermembranar. O citocromo c transporta apenas electrões, através da oxirredução de um ião de ferro localizado num grupo hemo pertencente à estrutura da proteína. Também se encontra citocromo c nalgumas bactérias, localizando-se no espaço periplasmático.[19]
Na membrana mitocondrial interna, a coenzima Q10 (Q), um transportador electrónico lipossolúvel, transporta não só electrões mas também protões, usando um ciclo redox.[20]
Esta pequena molécula de benzoquinona é muito hidrofóbica, podendo por isso difundir-se facilmente pela membrana. Quando Q aceita dois electrões e dois protões, passa à forma totalmente reduzida ubiquinol (QH2); quando QH2 liberta dois protões e dois elecrões, volta ao estado ubiquinona (Q). Como resultado, se duas enzimas estão dispostas de modo que Q seja reduzido de um lado da membrana e QH2 seja oxidado no outro lado, a ubiquinona acoplará estas reacções e transportará protões através da membrana.[21] Algumas cadeias de transporte electrónico bacterianas usam quinonas diferentes, tais como a menaquinona (ou vitamina K), além da ubiquinona.[22]
Dentro de proteínas, os electrões são transferidos entre cofactores flavínicos,[15][23] centros de ferro-enxofre e citocromos. Existem diversos tipos de centros ferro-enxofre. O tipo mais simples que se encontra na cadeia de transporte electrónico é formado por dois átomos de ferro ligados entre si e por dois átomos de enxofre inorgânico (ou seja, não pertencente a cadeias laterais de aminoácidos), designando-se este tipo de centros [2Fe-2S]. O segundo tipo de centro ferro-enxofre é o [4Fe-4S], sendo similar a um cubo constituído por quatro iões de ferro e quatro de enxofre. Nos centros de ferro-enxofre, cada ião de ferro encontra-se coordenado também a um aminoácido, normalmente através do átomo de enxofre de uma cisteína. Os cofactores contendo metais sofrem reacções redox sem ligar ou libertar protões, pelo que servem apenas para transportar electrões na cadeia de transporte electrónico. Os electrões conseguem viajar distâncias relativamente grandes dentro das proteínas ao efectuar "saltos" entre as cadeias dos cofactores.[24] Tal ocorre devido ao efeito de tunneling quântico, que é rápido através de distâncias inferiores a 14 Å.[25]
[editar] Cadeias de transporte electrónico em eucariontes
Diversos processos bioquímicos catabólicos, tais como a glicólise, o ciclo dos ácidos tricarboxílicos e a beta-oxidação, produzem a coenzima NADH. Esta coenzima contém electrões que possuem um alto potencial de transferência (correspondente a um potencial de eléctrodo muito negativo), ou seja, ao acontecer a oxidação do NADH, é libertada grande quantidade de energia. No entanto, a célula não liberta esta energia de uma só vez, pois tal reacção poderia ser incontrolável. Os electrões são então removidos do NADH e transferidos para o dioxigénio através de uma série de passos catalisados por diferentes enzimas, em que cada passo liberta uma pequena quantidade de energia. Este conjunto de enzimas, designados complexos I, II, III e IV, constitui a cadeia de

transporte electrónico e encontra-se na membrana interna da mitocôndria. O succinato é também oxidado pela cadeia de transporte electrónico, mas entra na via metabólica num ponto diferente.
Em eucariontes, as enzimas neste sistema de transporte electrónico utilizam a energia libertada na oxidação do NADH para bombear protões através da membrana interna da mitocôndria. Esta acção causa a acumulação de protões no espaço intermembranar, originando um gradiente electroquímico através da membrana. A energia armazenada sob este potencial é então utilizada pela ATP sintase para produzir ATP. A fosforilação oxidativa mitocondrial é a mais bem compreendida; existem mitocôndrias em quase todos os eucariontes, exceptuando-se alguns protozoários anaeróbios como Trichomonas vaginalis, que reduzem os protões a hidrogénio molecular num organelo denominado hidrogenossoma, uma mitocôndria residual.[26]
[editar] NADH-coenzima Q oxidoredutase (complexo I)
Complexo I ou NADH-Q oxidorredutase. As abreviaturas utilizadas encontram-se discutidas no texto. Em todos os diagramas de complexos respiratórios, a matriz mitocondrial situa-se em baixo e o espaço intermembranar em cima.
A NADH-coenzima Q oxidorredutase, também conhecida como NADH desidrogenase ou complexo I, é a primeira proteína na cadeia de transporte electrónico.[27] O complexo I é uma enzima de grandes dimensões; o complexo I de mamíferos possui 46 subunidades e uma massa molecular de cerca de mil quilodaltons.[28] É conhecida apenas a estrutura detalhada do complexo de uma bactéria;[29] na maioria dos organismos, o complexo aparenta ter a forma de uma bota com uma esfera projectando-se da membrana em direcção à matriz mitocondrial.[30][31] Os genes que codificam as proteínas que fazem parte deste complexo encontram-se tanto no DNA nuclear como no genoma mitocondrial, tal como acontece com diversas outras enzimas presentes na mitocôndria.

A reacção catalisada por esta enzima é a redução da coenzima Q10 (ou ubiquinona, representado por Q na equação abaixo) por dois electrões provindos do NADH. A coenzima Q10 é uma quinona lipossolúvel da membrana mitocondrial.
O início da reação, e de toda a cadeia electrónica, consiste na ligação de uma molécula de NADH ao complexo I e a doação de dois electrões. Os electrões entram no complexo I através de um grupo prostético ligado ao complexo, o mononucleótido de flavina (FMN). A adição de electrões ao FMN converte este à sua forma reduzida, FMNH2. Os electrões são então transferidos através de diversos centros de ferro-enxofre, o segundo tipo de grupo prostético encontrado no complexo.[29] Existem centros [2Fe-2S] e [4Fe-4S] no complexo I.
À medida que os electrões passam através deste complexo, quatro protões são bombeados da matriz mitocondrial para o espaço intermembranar. Não é bem conhecido o mecanismo exacto de como esta passagem ocorre, mas aparenta haver mudanças conformacionais no complexo I que provocam a ligação de protões ao lado N da membrana e os movimentam para o lado P.[32] Por fim, os electrões são transferidos da cadeia de centros ferro-enxofre para uma molécula de ubiquinona na membrana.[27] A redução da ubiquinona contribi também para a geração de um gradiente de protões, por haver retirada de dois protões da matriz na sua redução a ubiquinol (QH2).Este processo se tornou importante, pois, seres heterotróficos necessitam deste ciclo(terceira fase do processo de transformação quimica da glicose).
Complexo II: Succinato-Q oxidorredutase.
[editar] Succinato-Q oxidorredutase (complexo II)
A succinato-Q oxidorredutase, também conhecida como complexo II, é um segundo ponto de entrada na cadeia de transporte electrónico.[33] Tem a característica de ser a única enzima que participa tanto no ciclo dos ácidos tricarboxílicos como na cadeia de

transporte electrónico. O complexo II consiste de quatro subunidades proteicas e um cofactor dinucleótido de flavina-adenina (FAD), centros de ferro-enxofre e um grupo hemo que não participa na transferência de electrões para a coenzima Q mas aparenta ser necessário para diminuir a produção de espécies reactivas de oxigénio.[34][35] Oxida o succinato a fumarato e reduz a ubiquinona. Como esta reacção liberta menos energia que a oxidação do NADH, o complexo II não transporta protões através da membrana e não contribui para o gradiente de protões.
Nalguns eucariontes, tais como o verme parasita Ascaris suum, existe uma enzima similar ao complexo II, a fumarato redutase (menaquiol:fumarato oxidorredutase, ou QFR) que opera de forma reversa, oxidando ubiquinol e reduzindo fumarato. Este processo permite ao parasita sobreviver no ambiente anaeróbio do intestino grosso, realizando fosforilação oxidativa anaeróbia usando fumarato como aceitador final de electrões.[36] Outra função pouco convencional do complexo II é encontrada no parasita que causa a malária Plasmodium falciparum, em que a acção reversa do complexo II é importante na regeneração de ubiquinol, utilizado pelo parasita num tipo raro de biossíntese de pirimidina.[37]
[editar] Flavoproteína de transporte de electrões-Q oxidorredutase
A flavoproteína de transporte de electrões-ubiquinona oxidorredutase (ETF-Q oxidorredutase), também conhecida como flavoproteína de transporte de electrões desidrogenase, é um terceiro ponto de entrada na cadeia de transporte electrónico. É uma enzima que aceita electrões da flavoproteína transportadora de electrões na matriz mitocondrial e os utiliza para reduzir a ubiquinona.[38] Esta enzima contém uma flavina e um centro [4Fe-4S] mas, ao contrário de outros complexos respiratórios, liga-se à superfície da membrana e não atravessa a bicamada lipídica.[39]
Em mamíferos, esta via metabólica é relevante na beta-oxidação de ácidos gordos e no catabolismo de aminoácidos e colina, ao aceitar electrões de diversas acetil-CoA desidrogenases.[40][41] Em plantas, a ETF-Q oxidorredutase é também importante nas respostas metabólicas que permitem a sobevivência durante longos períodos de escuridão.[42]

Os dois passos de transferência electrónica no complexo III: Q-citocromo c oxidorredutase. Após cada passo, Q (na parte superior da figura) deixa a enzima.
[editar] Q-citocromo c oxidorredutase (complexo III)
A Q-citocromo c oxidorredutase é também conhecida simplesmente como citocromo c redutase, complexo citocromo bc1, ou simplesmente complexo III.[43][44] Em mamíferos, esta enzima é um dímero, em que cada subunidade é ela própria um complexo de 11 proteínas, um centro [2Fe-2S] e três citocromos (um citocromo c1 e dois citocromos b.[45] Um citocromo é um tipo de proteína de transferência electrónica que contém pelo menos um grupo hemo. Os iões de ferro dos grupos hémicos do complexo III alternam entre o estado ferroso (reduzido, Fe2+) e férrico (oxidado, Fe3+), à medida que os electrões são transferidos através da proteína.
O complexo III catalisa a oxidação de uma molécula de ubiquinol e a redução de duas moléculas de citocromo c, que consegue transportar apenas um electrão (ao contrário da coenzima Q, que pode transportar dois)
Como apenas um dos electrões pode ser transferido em cada passo do doador QH2 para um citocromo aceitador, o mecanismo de reacção do complexo III é mais elaborado que aqueles de outros complexos respiratórios e ocorre em dois passos colectivamente designados "ciclo Q".[46] No primeiro passo, a enzima liga três substratos: primeiro o QH2, que sofre oxidação, passando um electrão para o segundo substrato, o citocromo c, e dois protões para o espaço intermembranar. O terceiro substrato é Q, que aceita o segundo electrão de QH2, reduzindo-se ao radical Q.- (ubisemiquinona). Os primeiros dois substratos são libertados, enquanto que o intermediário ubisemiquinona permanece ligado. No segundo passo, liga-se uma segunda molécula de QH2, passando novamente um electrão a outro citocromo c. O segundo electrão é transferido para a ubisemiquinona, reduzindo-a a QH2 ao mesmo tempo que são captados dois protões da matriz mitocondrial. QH2 é então libertado da enzima.[47]
À medida que a coenzima Q é reduzida a ubiquinol no lado interno da membrana e oxidada a ubiquinona no outro lado, existe uma transferência líquida de protões através da membrana, que contribui para o gradiente de protões.[15] Este mecanismo é relativamente complexo mas assegura um aumento da eficiência da transferência de protões: se apenas uma molécula de QH2 fosse utilizada para reduzir directamente dois citocromos, a eficiência seria a metade, havendo apenas a transferência de um protão por citocromo reduzido.[15]

Complexo IV: citocromo c oxidase .
[editar] Citocromo c oxidase (complexo IV)
A citocromo c oxidase , também conhecda como complexo IV, é o último complexo proteico da cadeia de transporte de electrões.[48] Em mamíferos, a enzima tem uma estrutura bastante complexa, contendo 13 subunidades, dois grupos hémicos e diversos outros cofactores metálicos (três iões de cobre, um de magnésio e um de zinco).[49] Esta enzima catalisa a reacção final da cadeia de transporte electrónico, oxidando o citocromo c e transferindo electrões para o oxigénio, ao mesmo tempo que bombeia protões através da membrana.[50] O aceitador final de electrões oxigénio é reduzido a água neste processo. Tanto a passagem de protões através da membrana como o consumo de protões na matriz mitocondrial contribuem para o gradiente protónico.
[editar] Redutases e oxidases alternativas
Muitos organismos eucarióticos possuem cadeias respiratórias diferentes das de mamíferos, que são as mais bem estudadas (e acima descritas). Por exemplo, em plantas, existem NADH oxidases que oxidam o NADH no citoplasma, não na matriz mitocondrial, e passam os electrões para uma reserva de ubiquinona.[51] Estas enzimas não transportam proões, pelo que reduzem a ubiquinona sem alterar o gradiente electroquímico através da membrana interna.[52]
Outro exemplo de um sistema diferente é a "oxidase alternativa", encontrada em plantas, alguns fungos, protistas e possivelmente noutros animais.[53][54] Esta enzima transfere electrões directamente do ubiquinol para o oxigénio.[55]
As vias de transporte electrónico em que participam estas oxidases alternativas rendem menos ATP que a cadeia completa. Não se encontram totalmente esclarecidas as vantagens em possuir cadeias mais curtas; no entanto, estas oxidases alternativas são

produzidas em resposta a situações de stress, como frio, produção de espécies reactivas de oxigénio e infecção, assim como outros factores que inibam a cadeia de transporte completa.[56][57] Vias alternativas podem melhorar a resistência dos organismos a danos causados pelo stress oxidativo.[58]
[editar] Organização de complexos
O modelo original da organização dos complexos da cadeia respiratória descrevia a sua difusão livre e independente na membrana mitocondrial.[28] No entanto, alguns dados mais recentes sugerem que os complexos possam formar estruturas de ordem superior, designadas "supercomplexos" ou "respirassomas".[59] Neste modelo, os diversos complexos existem como conjuntos organizados de enzimas que interactuam.[60] Tais associações poderão permitir a canalização de substratos ("channeling") entre os diferentes complexos da cadeia, optimizando a velocidade e eficiência da transferência de electrões.[61] Em mamíferos, alguns dos componentes poderão existir em maior quantidade que outros, com razões entre complexos I/II/III/IV e ATP sintase de aproximadamente 1:1:3:7:4.[62] No entanto, este modelo não é totalmente aceite, pois existem dados que aparentam não se ajustar ao modelo.[28][63]
[editar] Cadeias de transporte electrónico de procariontes
Em contraste com a similaridade geral que existe na estrutura e função das cadeias respiratórias em eucariontes, as enzimas de transferência electrónica em bactérias e arqueas são muito diversificadas; utilizam também diversos outros compostos químicos como substratos, permitindo a sua adaptação a diferentes condições ambientais.[64][65] Tal como acontece nos eucariontes, a cadeia de transporte electrónico em procariontes utiliza a energia libertada da oxidação de um substrato para bombear iões através de uma membrana e gerar um gradiente electroquímico. Em bactérias, a fosforilação oxidativa em Escherichia coli é a mais bem compreendida; em contraste, os sistemas em arqueas são ainda pouco compreendidos.[66] Em E. coli, a fosforilação oxidativa utiliza uma grande variedade de agentes redutores e oxidantes, listados abaixo. O potencial de meia onda de um composto dá uma medida da quantidade de energia libertada quando esse composto é oxidado ou reduzido, tendo agentes redutores potenciais negativos e agentes oxidantes potenciais positivos.
Enzimas e substratos da respiração em E. coli [67]
Enzima respiratória Par redox Potencial de meia
onda
(Volts) Formato desidrogenase Bicarbonato / Formato −0,43
Hidrogenase Protão / Hidrogénio −0,42
NADH desidrogenase NAD + / NADH −0,32
Glicerol-3-fosfato desidrogenase DHAP / Gly-3-P −0,19
Piruvato oxidase Acetato + Dióxido de carbono / ?

Piruvato
Lactato desidrogenase Piruvato / Lactato −0,19
D -aminoácido desidrogenase 2-oxoácido + amónia / D -aminoácido ?
Glicose oxidase Glicose / Gluconato −0,14
Succinato desidrogenase Succinato / Fumarato +0,03
Ubiquinol oxidase Oxigénio / Água +0,82
Nitrato redutase Nitrato / Nitrito +0,42
Nitrito redutase Nitrito / Amónia +0,36
Dimetilsulfóxido redutase DMSO / DMS +0,16
N -óxido de trimetilamina redutase
TMAO / TMA +0,13
Fumarato redutase Fumarato / Succinato +0,03
Como mostrado acima, a E. coli pode multiplicar-se na presença de agentes redutores como o formato, o hidrogénio ou o lactato como doadores de electrões e o nitrato, DMSO ou oxigénio como aceitadores.[65] Quanto maior é a diferença entre o potencial de um composto oxidante e de um redutor, mais energia é libertada quando eles reagem. Dentro deste conjunto de compostos, o par succinato/fumarato é particular, pois o seu potencial de meia onda é quase zero. Tal significa que o succinato pode ser oxidado a fumarato se houver um oxidante forte presente (como o oxigénio) ou o fumarato pode ser reduzido a succinato na presença de um agente redutor forte (como o formato). Estas reacções alternativas são catalisadas pela succinato desidrogenase e pela fumarato redutase, respectivamente.[68]
Alguns procariontes utilizam pares redox que possuem diferenças muito pequenas no seu potencial de meia onda. Por exemplo, bactérias nitrificantes, como as pertencentes ao género Nitrobacter, oxidam nitrito a nitrato, doando elecrões ao oxigénio. A pequena quantidade de energia libertada nesta reacção é suficiente para bombear protões e produzir ATP, mas insuficiente para produzir NADH ou NADPH directamente em anabolismo.[69] Este problema é contornado usando uma nitrito oxidorredutase que produz força motriz protónica suficiente para fazer funcionar a cadeia de transporte electrónico no sentido inverso, forçando o complexo I a produzir NADH.[70][71]
Os procariontes controlam o uso destes doadores e aceitadores de electrões variando o tipo de enzimas produzido, em resposta a condições ambientais.[72] Esta flexibilidade deve-se à possibilidade de diferentes oxidases e redutases utilizarem a mesma reserva de ubiquinona. Tal permite diversas combinações funcionais de enzimas, enzimas essas ligadas pelo intermediário comum ubiquinol.[67] Estas cadeias respiratórias têm portanto uma natureza modular, com sistemas de enzimas fáceis de permutar.

Além da existência desta diversidade metabólica, os procariontes têm também várias isozimas (diferentes enzimas que catalisam a mesma reacção). Por exemplo, existe em E. coli dois tipos diferentes de ubiquinol oxidase usando oxigénio como aceitador electrónico. Sob condições totalmente aeróbias, a célula utiliza uma oxidase com baixa afinidade para com o oxigénio que consegue transportar dois protões por cada electrão. No entanto, se os níveis de oxigénio decrescem, o metabolismo muda para a utlização de uma oxidase que transfere apenas um protão por electrão, mas que tem alta afinidade para com o oxigénio.[73]
[editar] ATP sintase
ATP sintase. O canal de protões FO e eixo encontra-se a rosa, o domínio sintase F1 a magenta e a membrana a azul translúcido.
A ATP sintase, também designada complexo V, é a enzima final na via da fosforilação oxidativa. Esta enzima encontra-se presente em todas os organismos vivos e funciona de forma idêntica em procariontes e eucariontes. [74] A enzima utiliza a energia armazenada num gradiente de protões existente através da membrana para realizar a síntese de ATP a partir de ADP e fosfato inorgânico (Pi). Existem estimativas de serem necessários entre três e quatro protões para sintetizar um ATP,[75][76] havendo alguns estudos que apontam para uma variação nestes números, dependendo das condições.[77]
Esta reacção de fosforilação é um equilíbrio químico, que pode ser deslocado alterando-se a força motriz protónica. Se não existe uma força motriz, a reacção da ATP sintase prossegue da direita para a esquerda, havendo a hidrólise de ATP e o bombeamento de protões para fora da matriz, através da membrana. No entanto, quando a força motriz é alta, a reacção procede da esquerda para a direita, permitindo o fluxo de protões no sentido do gradiente de concentração (da maior concentração para a menor) e produzindo ATP a partir de ADP.[74]
A ATP sintase é um complexo proteico de grandes dimensões, em forma de cogumelo. A enzima em mamíferos contém 16 subunidades e uma massa de aproximadamente 600 quilodalton.[78] A parte da enzima embebida na membrana é designada FO e contém um

anel de subunidades "c" e o canal de protões. O eixo e a "cabeça" em forma de bola é designada F1, sendo o local onde ocorre a síntese de ATP. O complexo em forma de bola na extremidade de F1 contém seis proteínas de dois tipos distintos (três subunidades α e três subunidades β); o eixo consiste numa proteína (subunidade γ), cuja extremidade penetra na zona das subunidades α e β.[79] Tanto a subunidade α como a β conseguem ligar nucleótidos, mas apenas a subunidade β catalisa a reacção de síntese do ATP. Uma outra subunidade actua como um braço lateral, estendendo-se ao longo de F1, penetrando a membrana e ligando as subunidades α e β à base da enzima.
À medida que os protões atravessam a membrana através do canal na base da ATP sintase, FO entra em movimento de rotação.[80] Esta rotação poderá ser causada por mudanças no estado de ionização de aminoácidos no anel de subunidades "c", o que poderá causar interacções electrostáticas que propulsionam o anel.[81] Este anel em rotação, por sua vez, força a rotação do eixo central (subunidade γ) dentro das subunidades α e β; estas não entram em rotação por se encontrarem fixas pelo braço lateral, que actua como um estator. É o movimento da subunidade γ que providencia a energia necessária para os centros activos das subunidades β sofrerem alterações que permitam a produção e libertação de ATP.[14]
Esta reacção de síntese de ATP é designada em Inglês como binding change mechanism (algo como "mecanismo de ligação-modificação") e consiste na modificação cíclica do centro activo de cada subunidade β em três estados.[11] No estado "aberto", o ADP e o fosfato entram no centro activo. A proteína muda de conformação capturando as moléculas e liga-as de forma fraca (estado de ligação fraca). A enzima muda então novamente de conformação e força o encontro entre estas moléculas (estado "fechado"), em que o centro activo liga a recém-produzida molécula de ATP com alta afinidade. O centro activo volta então ao estado "aberto", permitindo a libertação da molécula de ATP e podendo voltar a ligar ADP e fosfato.
Nalgumas bactérias e arqueas, é o movimento de iões sódio, não de protões, através da membrana que potencia a síntese de ATP.[82][83] Arqueas como as pertencentes ao género Methanococcus contêm também a A1Ao sintase, uma forma da enzima que contém proteínas com muito pouca semelhança a nível da estrutura primária (sequência de aminoácidos) com subunidades de outras ATP sintases bacterianas e eucarióticas. É possível que, nalgumas espécies, esta forma da enzima seja uma ATP sintase especializada no transporte de sódio,[84] embora tal não seja obrigatoriamente verdadeiro em todos os casos.[83]
[editar] Espécies reactivas de oxigénio
O dioxigénio (oxigénio molecular) é um aceitador terminal de electrões ideal, por ser um agente oxidante forte. A redução do dioxigénio pode originar intermediários potencialmente danosos.[85] Embora a transferência de quatro protões e quatro electrões reduza o dioxigénio a água, uma espécie química inócua, a transferência de um ou dois electrões produz o anião radical superóxido e o peróxido de hidrogénio.

Estas espécies reactivas de oxigénio e os seus produtos de reacção, tais como o radical hidroxilo, são muito danosos para as células, pois oxidam proteínas e lípidos membranares e causam mutações no DNA. Estes danos celulares podem contribuir para determinadas patologias e pensa-se que estejam envolvidos no processo de envelhecimento.[86][87]
O complexo da citocromo c oxidase é muito eficiente na redução de dioxigénio a água e produz muito poucos intermediários parcialmente reduzidos. No entanto, são produzidas pequenas quantidades de superóxido e peróxido na cadeia de transporte de electrões.[88] É de particular importância a redução da coenzima Q10 no complexo III, quando existe a formação da ubisemiquinona, um radical livre muito reactivo e instável que pode por vezes "escoar" alguns electrões directamente para o oxigénio, produzindo superóxido.[89]
Para diminuir os efeitos das espécies reactivas de oxigénio, as células possuem diversos sistemas antioxidantes, como a presença das vitaminas C e E e enzimas como a superóxido dismutase, a catalase e peroxidases,[85] que capturam e desintoxicam as espécies reactivas e limitam os danos por elas causados.
[editar] Inibidores
Existem diversos compostos químicos que inibem a fosforilação oxidativa. Embora normalmente qualquer um desses compostos iniba apenas uma enzima da cadeia de transporte electrónico, a inibição de apenas um dos passos é suficiente para parar toda a cadeia. Por exemplo, a presença de oligomicina inibe a ATP sintase, impedindo a passagem de protões para dentro da mitocôndria.[90] Tal resulta na inoperância das bombas de protões, já que o gradiente de concentração protónica se torna demasiado forte para ser superado. O NADH deixa então de ser oxidado, o que pára o funcionamento do ciclo dos ácidos tricarboxílicos, pois a concentração de NAD+ cai para níveis inferiores aos necessários para o funcionamento das enzimas desse ciclo.
Compostos Uso Efeito na fosforilação oxidativa
CianetoMonóxido de carbono
VenenosInibe a cadeia de transporte electrónico ao ligar o oxigénio com maior afinidade que o centro Fe–Cu do citocromo c oxidase, evitando a redução do dioxigénio.[91]
Oligomicina AntibióticoInibe a ATP sintase ao bloquear o fluxo de protões através da subunidade FO.[90]
CCCP2,4-Dinitrofenol
VenenosIonóforos que perturbam o gradiente de protões ao transportar protões através da membrana mitocondrial interna, desacoplando então o bombeamento de protões da síntese de ATP.[92]
Rotenona PesticidaEvita a transferência de electrões do complexo I para a ubiquinona ao bloquear o local de ligação da ubiquinona.[93]
Nem todos os inibidores da fosforilação oxidativa são toxinas. No tecido adiposo castanho existem canais protónicos regulados designados proteínas de desacoplamento

que conseguem fazer o desacoplamento da respiração e síntese de ATP.[94] Este é um tipo de respiração rápida que produz calor e é de particular importância como forma de manter a temperatura corporal em animais em hibernação, embora tais proteínas possam também ter uma função mais geral nas respostas ao stress celular.[95]
GliconeogêneseOrigem: Wikipédia, a enciclopédia livre.Ir para: navegação, pesquisa
Molécula da glicose
Gliconeogênese ("formação de novo açúcar") é a rota pela qual é produzida glicose a partir de compostos aglicanos (não-açúcares ou não-carboidratos), sendo a maior parte deste processo realizado no fígado (principalmente sob condições de jejum) e uma menor parte no córtex dos rins. Em humanos, os principais precursores são: lactato, glicerol e aminoácidos, principalmente alanina. Exceto por três sequências específicas, as reações da gliconeogênese são inversas às da glicólise. [1]
Em mamíferos, a maioria dos tecidos é capaz de suprir suas necessidades energéticas a partir da oxidação de vários compostos, tais como aminoácidos, açúcares e ácidos graxos, porém alguns tecidos dependem quase completamente de glicose como fonte de energia metabólica. Para o cérebro humano e o sistema nervoso, assim como os eritrócitos, testículos, medula renal e tecidos embriônicos, a glicose sanguínea é a única ou principal fonte de energia. Apenas o cérebro requer cerca de 120g de glicose a cada dia - mais do que metade de toda a glicose armazenada como glicogênio em músculos e fígado.[2] A longo prazo, todos os tecidos também requerem glicose para outras funções, tais como a síntese da ribose dos nucleotídeos ou da porção carboidrato de glicoproteínas e glicoproteínas. Portanto, para sobreviver, os organismos precisam ter mecanismos para manutenção dos níveis sanguíneos de glicose.[1] Quando a concentração de glicose circulante vinda da alimentação diminui, o glicogênio hepático

e muscular é degradado (glicogenólise) fazendo com que a glicemia volte a valores normais. Entretanto, o suprimento de glicose desses reservatórios não é sempre suficiente; entre as refeições e durante longos jejuns, ou após exercícios vigorosos, o glicogênio é depletado (consumido), situação que também ocorre quando há deficiência do suprimento de glicose pela dieta ou por dificuldade na absorção pelas células. Nessas situações, os organismos necessitam de um método para sintetizar glicose a partir de precursores não-carboidratos. Isso é realizado pela via chamada gliconeogênese, a qual converte piruvato e compostos relacionados de três e quatro carbonos em glicose.[2]
As modificações que ocorrem no metabolismo da glicose durante a mudança do estado alimentado para o estado de jejum são reguladas pelos hormônios insulina e glucagon. A insulina está elevada no estado alimentado, e o glucagon se eleva durante o jejum. A insulina estimula o transporte de glicose para certas células, tais como as dos músculos e tecido adiposo, e também altera a atividade de enzimas chave que regulam o metabolismo, estimulando o armazenamento de combustível. O glucagon contrarregula os efeitos da insulina, estimulando a liberação dos combustíveis armazenados e a conversão de lactato, aminoácidos e glicerol em glicose.[1]
A gliconeogênese é um processo ubíquo, presente em plantas, animais, fungos e outros microrganismos, sendo que as reações são praticamente as mesmas em todos os tecidos e todas as espécies.[2]
Nas mudas de plantas, gorduras e proteínas armazenadas são convertidas, através de rotas que incluem a gliconeogênese, no dissacarídeo sacarose para transporte através da planta em desenvolvimento. A glicose e seus derivados são precursores da síntese das paredes celulares das plantas, nucleotídeos e coenzimas, e uma variedade de outros metabólitos essenciais. Em muitos microorganismos, a gliconeogênese inicia a partir de compostos orgânicos simples de dois ou três carbonoso, tais como acetato, lactato e propionato no seu meio de crescimento. Embora as reações da gliconeogênese sejam as mesmas em todos os organismos, o contexto metabólico e a regulação da rota diferem de uma espécie para outra e de tecido para tecido.
Precursores
As três maiores fontes de carbono para a gliconeogênese em humanos são lactato, glicerol e aminoácidos, particularmente alanina. O lactato é produzido pela glicólise anaeróbica em tecidos como músculo em exercício ou hemácias, assim como por adipócitos durante o estado alimentado, sendo convertido em piruvato pela enzima lactato desidrogenase. Glicerol é liberado das reservas adiposas de triacilglicerol e entra na rota gliconeogênica como diidroxiacetona fosfato (DHAP). Aminoácidos provém principalmente do tecido muscular, onde podem ser obtidos pela degradação de proteína muscular. Todos os aminoácidos, exceto a leucina e a lisina, podem originar glicose ao serem metabolizados em piruvato ou oxaloacetato, participantes do ciclo de Krebs. A alanina, o principal aminoácido gliconeogênico, é produzida no músculo a partir de outros aminoácidos e de glicose.[1]
Ácidos graxos não podem ser convertidos em glicose em animais, com exceção de ácidos graxos de cadeia ímpar ou ramificada, os quais liberam propionato, um precursor do succinil CoA, sendo fonte mais importante de glicose em ruminantes. Em plantas, especificamente nas mudas, o ciclo do glioxilato pode ser usado para converter ácidos

graxos (acetato) como fonte primária de carbono do organismo. O ciclo do glioxilato produz ácidos dicarboxílicos de quatro carbonos que podem entrar na gliconeogênese.[3]
Rotas da glicólise e gliconeogênese no fígado.
[editar] Ciclo de Cori e ciclo da alanina
Dois ciclos importantes dependem do processo de gliconeogênese: o ciclo de Cori e o ciclo da alanina. O ciclo de Cori ocorre no músculo esquelético e nas hemácias e consiste na oxidação de glicose em lactato, com posterior transporte desse produto para o fígado. Já o ciclo da alanina, que ocorre somente no músculo esquelético, consiste na oxidação da glicose em piruvato, metabolização do piruvato em alanina,(com intuito de retirar NH3 tóxico ao musculo), transporte para o fígado, onde será reconvertida em piruvato e o NH3 excretado como uréia. O lactato e o piruvato oriundos de tais processos são, então, utilizados na gliconeogênese.[1]
[editar] Reações da gliconeogênese
O processo de gliconeogênese superpõe-se ao da glicólise, sendo que, iniciando pelo piruvato, a maioria das reações de síntese de glicose são no sentido inverso aos da glicólise. As enzimas envolvidas na catalização desses passos são reguladas para que, ou glicólise, ou gliconeogênese predomine, dependendo das condições fisiológicas. A maioria das etapas da gliconeogênese usa as mesmas enzimas que catalizam o processo da glicólise, porém, o fluxo de carbonos, é claro, é na direção reversa.[1] Entretanto, em três pontos as reações da glicólise são irreversíveis in vivo (por liberarem energia livre em forma de calor): conversão de glicose em glicose 6-fosfato pela hexoquinase, a fosforilação da frutose 6-fosfato em frutose 1,6-bisfosfato pela fosfofrutoquinase-1 e a conversão de fosfoenolpiruvato em piruvato pela piruvato quinase.[2] Para contornar essas barreiras energéticas, reações e enzimas especiais são necessárias.[1]
Portanto, três etapas diferem da glicólise:

1° etapa: A reação que era catalisada pela piruvato quinase na glicólise passa a ser catalisada pela piruvato carboxilase e pela fosfoenolpiruvato carboxiquinase. O piruvato é transformado em oxaloacetato pela piruvato carboxilase. O oxaloacetato é convertido em fosfoenolpiruvato pela fosfoenolpiruvato carboxiquinase. O fosfoenolpiruvato é transformado em frutose-1,6-bisfosfato por enzimas participantes na glicólise, que catalisam reações reversíveis, podendo operar a via no sentido inverso.
2º etapa: Há a conversão da frutose-1,6-bisfosfato em frutose-6-fosfato. Esta reação é catalisada pela frutose-1,6- bisfosfatase.
3º etapa: Nesta etapa faz-se a conversão de glicose-6-fosfato em glicose. O grupo fosfato ligado ao carbono 6 da glicose-6-fosfato sofre hidrólise catalisada pela glicose-6-fosfatase. O produto dessa reação é a glicose não fosforilada que, assim, pode atravessar a membrana plasmática. A enzima glicose-6-fosfatase só ocorre no fígado e rins.
[editar] Balanço energético da gliconeogênese
A neoglicogênese é uma reação de síntese porque utiliza um precursor de 3 carbonos e tem como produto final a glicose, com seis carbonos. Assim como as demais reações de síntese, a neoglicogênese consome energia na forma de ATP. Para cada molécula de glicose formada a partir de piruvato, seis moles de pontes de fosfato de alta energia são clivadas[1]: quatro ATP, dois GDP, e dois NADH [2] , que são utilizados nas reações catalisadas por piruvato carboxilase, fosfoenolpiruvato carboxiquinase e fosfoglicerato quinase. Dois moles de piruvato são requeridos para a síntese de um mol de glicose.[1]
Regulação
O controle da gliconeogênese é realizado pelo glucagon, que estimula esse processo, e pela insulina, que atua de maneira oposta.[1] Glicólise e gliconeogênese são reguladas reciprocamente. Se glicólise (a conversão de glicose em piruvato) e gliconeogênese (a conversão de piruvato em glicose) fossem permitidas ocorrer simultaneamente em altas taxas, o resultado seria o consumo de ATP e a produção de calor.[2] Embora a gliconeogênese ocorra durante o jejum, é também estimulada durante exercício prolongado, por uma dieta altamente protéica, e sob condições de estresse. Os fatores que promovem o fluxo geral de carbono do piruvato até glicose incluem a disponibilidade de substrato e mudanças da atividade ou quantidade de certas enzimas chave da glicólise e gliconeogênese.[1]
Ácido pirúvicoOrigem: Wikipédia, a enciclopédia livre.Ir para: navegação, pesquisa
Esta página ou secção não cita nenhuma fonte ou referência, o que compromete sua credibilidade (desde janeiro de 2010).

Por favor, melhore este artigo providenciando fontes fiáveis e independentes, inserindo-as no corpo do texto por meio de notas de rodapé. Encontre fontes: Google — notícias, livros, acadêmico — Scirus
A Wikipédia possui o portal:Portal da Bioquímica
Ácido pirúvicoAlerta sobre risco à saúde
Nome IUPAC Ácido oxopropanoico
Outros nomesÁcido alfa-cetopropiônicoÁcido acetilfórmicoÁcido piroracêmico
Identificadores
Número CAS 127-17-3
ChemSpider 1031
SMILES [Expandir]
Propriedades
Fórmula molecular
C3H4O3
Massa molar 88.06 g/mol
Densidade 1.250 g/cm³
Ponto de fusão 11.8 °C, 285 K, 53 °F
Ponto de ebulição
165 °C, 438 K, 329 °F
Acidez (pKa) 2.49 at 25 °C

Compostos relacionados
Outros aniões/ânions
íon piruvato
cetoácidos, ácidos carboxílicos relacionados
ácido acéticoácido glioxílicoácido oxálicoácido propiônicoácido acetoacético
Compostos relacionados
propionaldeídogliceraldeídometilglioxalpiruvato de sódio
Excepto onde denotado, os dados referem-se amateriais sob condições PTN
Referências e avisos gerais sobre esta caixa.Alerta sobre risco à saúde.
O ácido pirúvico
é um composto orgânico contendo três átomos de carbono (C3H4O3), originado ao fim da glicólise. Em meio aquoso dissocia-se formando o ânion piruvato, que é a forma sob a qual participa dos processos metabólicos.
O ácido pirúvico é o composto de menor energia que pode ser obtido da glicose sem a utilização de oxigênio. Durante a glicólise, é transformada uma molécula de NAD+ em NADH. Como a quantidade desta molécula é limitada na célula, esta tem que ser regenerada, o que pode ser feito reduzindo o ácido pirúvico:
1- A álcool etílico (fermentação alcoólica) 2- A ácido lático (fermentação lática) 3- A acetil-CoA e dióxido de carbono (para o Ciclo de Krebs ou Sintetase de
ácidos graxos)
Estas vias de degradação do ácido pirúvico dependem da situação e do organismo no qual se realiza o processo. A fermentação alcoólica só ocorre em certos fungos. A formação de ácido lático e o ciclo de Krebs podem ocorrer em quase todas as células animais.
O ácido pirúvico é um líquido transparente, com odor similar ao do ácido acético, miscivel em água, álcool etílico e éter etílico.

Pode ser produzido em laboratório pela decomposição (perda de CO2) do ácido tartárico catalizada pelo aquecimento deste com hidrogenosulfato de sódio. Também pode ser obtido a partir do cloreto de acetila e cianeto de sódio.
CH3COCl + KCN → CH3COCNCH3COCN + H+ + H2O → CH3COCOOH + NH4
+
Categoria:Ácidos carboxílicosOrigem: Wikipédia, a enciclopédia livre.
Ir para: navegação, pesquisa
O Commons possui uma categoria com multimídias sobre Ácidos carboxílicos
Subcategorias
Esta categoria contém as seguintes 4 subcategorias (de um total de 4).
A
[×] Aminoácidos (60 P)
D
[×] Ácidos dicarboxílicos (27 P)
G
[×] Ácidos graxos (38 P)
H
[×] Hidroxiácidos (26 P)
Páginas na categoria "Ácidos carboxílicos"
Esta categoria contém as seguintes 67 páginas (de um total de 67).
Ácido carboxílico
!
Ácido monocarboxílico
E
EDTA Eritrosina
R
Ranço
S

Ácido tricarboxílico
A
Ácido 1- naftalenoacético
Ácido acetilsalicílico Ácido indolacético Ácido pangâmico Ácido retinoico Aconitato (substrato) Ácido acrílico Amineptina Aminossalicilato Amoxicilina
B
Ácido benzoico Bixina Bumetanida Ácido butanoico
C
Ácido cafeico Calceína Clonixina Ácido crotônico
D
Ácido dicloroacético Ácido
diclorofenoxiacético
Ácido etanoico
F
Ácido fenilacético Fluoresceína Ácido trifluoroacético Ácido metanoico Foscarnet
G
Ácido glioxílico Gluconato
I
Isotiocianato de fluoresceína
Isotretinoína
L
Ácido lisérgico
M
Malonato Ácido 2-metilbenzoico Monensina
N
Natamicina Niacina Ácido nitrilotriacético
O
Ácido orótico Ácido oxalosuccínico
P
Ácido pirúvico Ácido propanoico
Salicilamida Ácido salicílico Ácido sinapínico Ácido sórbico Ácido sulfossalicílico
T
Ácido tricloroacético
V
Ácido valérico Valproato Vermelho de metila
Á
Ácido aldônico Ácido
calconcarboxílico Ácido cloroacético Ácido enântico Ácido isovalérico Ácido perfluoro-
octanoico Ácido
perfluorononanoico Ácido siálico Ácido treonico Ácido urónico Ácidos cloroacéticos

O piruvato representa um ponto de junção importante no catabolismo dos carboidratos . Nos tecidos animais sob condições aeróbicas o piruvato é o produto da glicólise, e o NADH formado pela desidrogenação do gliceraldeído 3-fosfato é reoxidado a NAD+ pelo O2. Entretanto, sob condições anaeróbias, como no músculo esquelético em alta atividade ou nas bactérias do ácido láctico, o NADH gerado pela glicólise não pode ser reoxidado pelo O2 e precisa ser reoxidado pelo piruvato e, assim, este último é convertido em lactato. Nestas condições os elétrons doados originalmente pelo gliceraldeído 3-fosfato ao NAD+ são transportados até o piruvato na forma de NADH. A redução do piruvato é catalisada pela desidrogenase láctica. Ao final da via glicolítica tem-se quatro moléculas de ATP formadas, contudo, o saldo líquido da glicólise são duas de moléculas de ATP, pois foram utilizadas duas moléculas de ATP para fosforilar a glicose e a frutose 6-fosfato nos passos iniciais da glicólise. Deve-se lembrar que são formadas duas moléculas de NADH, as quais participarão da cadeia transportadora de elétrons gerando mais 6 moléculas de ATP (se o mecanismo de transporte do NADH do citossol da célula para o interior da mitocôndria for o sistema especial de transporte do malato-aspartato).11- Redução do piruvato a lactato O piruvato representa um ponto de junção importante no catabolismo dos carboidratos . Nos tecidos animais sob condições aeróbicas o piruvato é o produto da glicólise, e o NADH formado pela desidrogenação do gliceraldeído 3-fosfato é reoxidado a NAD+ pelo O2. Entretanto, sob condições anaeróbias, como no músculo esquelético em alta atividade ou nas bactérias do ácido láctico, o NADH gerado pela glicólise não pode ser reoxidado pelo O2 e precisa ser reoxidado pelo piruvato e, assim, este último é convertido em lactato. Nestas condições os elétrons doados originalmente pelo gliceraldeído 3-fosfato ao NAD+ são transportados até o piruvato na forma de NADH. A redução do piruvato é catalisada pela desidrogenase láctica. Ao final da via glicolítica tem-se quatro moléculas de ATP formadas, contudo, o saldo líquido da glicólise são duas de moléculas de ATP, pois foram utilizadas duas moléculas de ATP para fosforilar a glicose e a frutose 6-fosfato nos passos iniciais da glicólise. Deve-se lembrar que são formadas duas moléculas de NADH, as quais participarão da cadeia transportadora de elétrons gerando mais 6 moléculas de ATP (se o mecanismo de transporte do NADH do citossol da célula para o interior da mitocôndria for o sistema especial de transporte do malato-aspartato).
Cadeia Transportadora de Elétrons

Figura estáticaA cadeia transportadora de elétrons, cadeia respiratória ou fosforilação oxidativa é a
convergência final de todas as vias de degradação oxidativa. A oxidação dos mais variados combustíveis metabólicos libera elétrons que são entregues pelas desidrogenasesa transportadores específicos, reduzindo-os (de NAD+ e FAD a NADH+ e FADH2). Na CTE estes elétrons serão entregues ao oxigênio.
A energia livre disponibolizada pelo fluxo de elétrons criado é acoplada ao transporte contracorrente de protóns através da membrana interna da mitocôndria (impermeável a estes prótons), conservando parte desta energia como potencial eletroquímico transmembrana.
O fluxo transmembrana dos prótons "de volta", a favor de seu gradiente de concentração através de poros protéicos específicos fornece energia livre para a síntese de ATP.
Transportadores de elétrons:A transferência pode se dar de três formas: Direta, como átomo de hidrogênio (H+ +
1elétron), ou como íon hidreto - H- (H+ + 2 elétrons).O NADH+ e o FADH2 transportam os elétrons de diferentes vias até a CTE, onde os
doam. Dentro da cadeia, o fluxo se estabelece entre uma série de transportadores que incluem: carreadores de membrana (como as quinonas), citocromos e proteínas ferro-sulfonadas.
-Ubiquinona- singularmente, sua redução pode se dar em duas etapas diferentes:-Recebe o 1º elétron, sendo reduzida a radical semiquinona - UQH-2º elétron - Ubiquinol - UQH2
Desta forma, a ubiquinona pode fazer a interação entre doadores de 2 elétrons e receptores de um único.
-Citocromos - são proteínas contendo ferro, portanto um grupo heme, responsável pelas diferentes variações: citocromos a, b e c. Enquanto a e b são proteínas de membrana, o c está "preso" à superfície externa da membrana interna por interações eletrostáticas.
-Proteína Fe-S - são boas doadoras de elétrons, e transferem apenas um.
Complexo I: NADH à UbiquinonaEquação geral: NADH + H+ + UQ NAD+ + UQH2
A entrega não é direta, passando por FMN (Flavina MonoNucleotídeo), que entrega os elétrons à Fe-S ao qual está associada, e só então estes são entregues à

UQ.
Complexo II: Succinato à Ubiquinona
A enzima responsável pela oxidação do succinato (a succinato desidrogenase), é a única do Ciclo do Ácido Cítrico ligada à membrana interna da mitocôndria e é através dela que os elétrons são doados ao FAD, para daí serem entregues à UQ via Fe-S. Este complexo não é responsável pelo bombeamento de nenhum próton para o espaço intermembrana. Assim, os elétrons que chegam à CTE via FADH2 só serão responsáveis pelo bombeamento de prótons a partir do complexo III, daí a síntese de 1ATP a menos pelo FADH2 em comparação ao NADH+.
Complexo III: Ubiquinona ao Citocromo c
A Ubiquinona pode movimentar-se ao longo da bicamada lipídica. Assim, após receber elétrons a partir de qualquer um dos complexos anteriores, caminha até o complexo III, responsável por recebê-los e repassá-los ao citocromo c. A UQH2, entretanto, só doará um elétron por vez ao cit c, o outro será doado a um cit b no complexo, que o devolverá à UQ, estabelecendo um ciclo em que se repetem estas etapas: UQH recebe um elétron do complexo I ou II mais 1H+ da matriz. A UQH2 assim formada libera 1H+ para o espaço intermembrana e um elétron para o cit b. A UQH resultante libera outro H+ e doa um elétron ao cit c. A UQ recebe de volta um elétron do cit b e 1H+ da matriz.
Complexo IV - redução do O2
O citocromo c é livre para movimentar-se na superfície externa da membrana, levando assim os elétrons recebidos do complexo III ao IV. Só o fará, entretanto, quando houver acumulado 4 elétrons. Neste complexo, os elétrons após passarem pelos cit a e a3, serão doados a 4H+ e 1O2 da matriz, sintetizando assim duas

moléculas de água.
Síntese de ATP
GlicogénioOrigem: Wikipédia, a enciclopédia livre.
Ir para: navegação, pesquisa
Este artigo ou secção cita fontes fiáveis e independentes, mas elas não cobrem todo o texto.Por favor, melhore este artigo providenciando mais fontes fiáveis e independentes, inserindo-as em notas de rodapé ou no corpo do texto, nos locais indicados.Encontre fontes: Google — notícias, livros, acadêmico — Scirus
A Wikipédia possui o portal:Portal da Bioquímica
GlicogénioAlerta sobre risco à saúde [1]

Identificadores
Número CAS 9005-79-2
Propriedades
Fórmula molecular C6H12O6
Ponto de fusão270-280 °C [1]
Solubilidade em água solúvel [1]
Riscos associados
Frases R -
Frases S -
Excepto onde denotado, os dados referem-se amateriais sob condições PTN
Referências e avisos gerais sobre esta caixa.Alerta sobre risco à saúde.
O glicogénio (português europeu) ou glicogênio (português brasileiro) é um polissacárido e a principal reserva energética nas células animais, encontrado, principalmente, no fígado e nos músculos. Geralmente também é encontrado nos fungos.

Índice[esconder]
1 Descrição 2 Armazenamento 3 Ramificações 4 Hidrólise 5 Síntese 6 Ver também 7 Ligações externas 8 Referências
[editar] Descrição
Ocorre intracelularmente como grandes agregados ou grânulos, que são altamente hidratados por apresentar uma grande quantidade de grupos hidroxila expostos, sendo capazes de formar ligações de hidrogênio com a água. É um polímero constituído por subunidades de glicose unidas por meio de ligações. Apresenta uma ramificação a cada oito a doze unidades.
[editar] Armazenamento
O glicogênio é especialmente abundante no fígado, onde ele constitui até 7% do peso úmido deste órgão. Neste caso é denominado glicogênio hepático, sendo encontrado em grandes grânulos, eles mesmos agregados de grânulos menores compostos por moléculas de glicogênios unitárias altamente ramificadas e com uma massa molecular média de vários milhões. Esses grânulos apresentam em uma forma intimamente unida as enzimas responsáveis pela sua síntese e degradação. A principal função do glicogênio armazenado no fígado serve para alimentar a necessidade energética das células cerebrais.
[editar] Ramificações
Cada ramificação do glicogênio termina com um açúcar não redutor, sendo assim ele tem tantos terminais não redutores quantas ramificações, porém com um único terminal redutor. Quando este é utilizado como fonte de energia, suas unidades de glicose são retiradas uma a uma, a partir dos terminais não redutores. As enzimas podem agir em muitos terminais, fazendo com que este polissacarídeo se reduza a um monossacarídeo.
[editar] Hidrólise
O glicogênio é hidrolisado pelas α- e β-amilases. A α-amilase, presente no suco pancreático e na saliva, quebra o laço glicosídico α(1→4) ao acaso, produzindo tanto maltose quanto glicose. Já a β-amilase (que também quebra o laço glicosídico α(1→4)) cliva sucessivas unidades de maltose, iniciando a partir do terminal não reduzido.

[editar] Síntese
A síntese de glicogênio é o processo pelo qual a glicose é polimerizada a glicogênio, que é acumulado nas células em quantidades variáveis de acordo com o tipo celular, funcionando aí como depósito de energia acessível à célula. Em determinadas células, como nas do fígado e músculo, este processo pode ser intenso e ocorrem extensos depósitos de glicogênio. O glicogênio hepático, que chega a 150 g, é degradado no intervalo das refeições mantendo constante o nível de glicose no sangue ao mesmo tempo em que fornecem este metabólito as outras células do organismo. O glicogênio muscular, ao contrário, só forma glicose para a contração muscular.
[editar] Ver também
CarboidratoOrigem: Wikipédia, a enciclopédia livre.
Ir para: navegação, pesquisa
Este artigo ou secção contém uma lista de fontes ou uma única fonte no fim do texto, mas estas não são citadas no corpo do artigo, o que compromete a verificabilidade. (desde janeiro de 2010)Por favor, melhore este artigo introduzindo notas de rodapé citando as fontes, inserindo-as no corpo do texto quando necessário.
Carboidratos, também conhecidos como glicídios, glícidos, glucídeos, glúcidos, glúcides, sacarídeos , açúcares, ou hidratos de carbono , são as biomoléculas mais abundantes na natureza, constituídas principalmente por carbono, hidrogênio e oxigênio, podendo apresentar nitrogênio, fósforo ou enxofre em sua composição.
Dentre as diversas funções atribuídas aos carboidratos, a principal é a função energética. Também atuam como elementos estruturais e de proteção na parede celular das bactérias, fungos e vegetais, bem como em tecidos conjuntivos e envoltório celular de animais. Agem como lubrificantes das articulações esqueléticas e fornecem coesão entre as células. Podem funcionar como sinalizadores celulares. Alguns carboidratos, como a ribose e a desoxirribose, fazem parte da estrutura de nucleotídeos e dos ácidos nucléicos.
Conforme o tamanho, os carboidratos podem ser classificados em monossacarídeos, oligossacarídeos e polissacarídeos.

Diihidroxi-acetona
Índice[esconder]
1 Estrutura 2 Classificação
o 2.1 Monossacarídeos o 2.2 Oligossacarídeos o 2.3 Polissacarídeos
2.3.1 Holosídeos 2.3.2 Heterosídeos
3 Derivados de carboidratos 4 Função 5 Referencias 6 Ligações externas
[editar] Estrutura
Os carboidratos são compostos orgânicos constituídos por pequenas particulas do acido pertinotido , que atua no pancreas liberando pequenos fungos, no qual alvin yaktori, cientista japonês descobriu que fazem bem para o intestino grosso fazendo com que o cerebro não se junte ao crânio fazendo um diametro dos conjuntos numéricos.[1] hidrogênio e oxigênio, que geralmente seguem a fórmula empírica [C(H2O)]n, sendo n ≥ 3. A relação entre os átomos de carbono, hidrogênio e oxigênio é de 1:2:1. Contudo, alguns carboidratos não se ajustam a esta regra geral, como a ramnose e a fucose, por exemplo, cuja fórmula molecular é C6H12O5. Podem ser poliidroxialdeídos ou poliidroxicetonas, isto é, possuem um grupo que pode ser aldeído ou cetona, respectivamente, e várias hidroxilas, geralmente uma em cada átomo de carbono que não faz parte do aldeído ou grupo funcional cetona. Além de carbono, hidrogênio e oxigênio, alguns carboidratos apresentam nitrogênio, fósforo ou enxofre em sua composição.

[editar] Classificação
[editar] Monossacarídeos
Os monossacarídeos são carboidratos com reduzido número de átomos de carbono em sua molécula. O "n" da fórmula geral pode variar de 3 a 7 (trioses, tetroses, pentoses, hexoses e heptoses), sendo os mais importantes as pentoses (C5H10O5) e as hexoses (C6H12O6). São relativamente pequenos, solúveis em água e não sofrem hidrólise.
Carboidrato Importância biológica
Trioses(C3H6O3)
Gliceraldeído Composto intermediário da glicólise.
Diidroxiacetona
Participa da glicólise e do ciclo de Calvin.
Pentoses
(C5H10O5)
RiboseMatéria-prima para a síntese de
ácido ribonucleico (RNA).
DesoxirriboseMatéria-prima para a síntese de ácido desoxirribonucleico (DNA).
Hexoses(C6H12O6)
GlicoseMolécula mais utilizada pelas células
para a obtenção de energia.
Frutose Função energética.
GalactoseConstitui a lactose do leite. Função
energética.
[editar] Oligossacarídeos
Os oligossacarídeos são carboidratos resultantes da união de duas a nove moléculas de monossacarídeos. A ligação entre os monossacarídeos ocorre por meio de ligação glicosídica, formada pela perda de uma molécula de água. O grupo mais importante dos oligossacarídeos são os dissacarídeos, formados pela união de apenas dois monossacarídeos. Quando são constituídos por três moléculas de monossacarídeos, recebem o nome de trissacarídeos.
Os oligossacarídeos são solúveis em água, mas, como não são carboidratos simples como os monossacarídeos, necessitam ser quebrados na digestão para que sejam aproveitados pelos organismos como fonte de energia.

Carboidrato
Monossacarídeos constituintes
Importância biológica
Dissacarídeos
Sacarose glicose + frutoseAbundante na cana-de-
açucar e beterraba. Função energética.
Lactoseglicose + galactose
Encontrada no leite. Função energética.
Maltose glicose + glicose
Encontrada em alguns vegetais, provém
também da digestão do amido pelos animais. Função energética.
Trissacarídeos
Rafinoseglicose + frutose
+ galactose
Encontrada principalmente nas leguminosas, não é digerida pelos seres humanos. Função
energética.
[editar] Polissacarídeos
Os polissacarídeos são carboidratos grandes, às vezes ramificados, formados pela união de mais de dez monossacarídeos ligados em cadeia, constituindo, assim, um polímero de monossacarídeos, geralmente de hexoses. São insolúveis em água e, portanto, não alteram o equilíbrio osmótico das células. Os polissacarídeos possuem duas funções biológicas principais, como forma armazenadora de combustível e como elementos estruturais.
Carboidrato
Monossacarídeos constituintes
Importância biológica
Polissacarídeos
Amido ≈1.400 glicoses Armazenado no amiloplasto de raízes do
tipo tuberosa (mandioca, batata doce,
cará), caules do tipo tubérculo (batatinha),
frutos e sementes. Principal reserva

energética dos vegetais.
Glicogênio ≈30.000 glicoses
Armazenado no fígado e nos músculos. Principal reserva energética de
animais e fungos.
Celulose ≈1.000 glicoses
Função estrutural na célula vegetal, como um componente da parede
celular.
Quitina
Constitui o exoesqueleto dos artrópodes e está
presente na parede celular dos fungos.
Observação: existem outros tipos de polissacarídeos denominados hetropolissacarídeos que originam, por hidrólise, vários tipos diferentes de monossacarídeos. Como por exemplo o ácido hialurônico, condroitinsulfato e a heparina.
tá tudo erradoo ===
[editar] Holosídeos
São os oligossacarídeos e polissacarídeos que, por hidrólise, produzem somente monossacarídeos. Tipo de açúcar encontrado nas plantas e vegetais. Rafinose + 2 H2O → glicose + frutose + galactose Celulose + n H2O → n glicose
[editar] Heterosídeos
São glicídios que sofrem hidrólise, produzindo oses (hidratos de carbono simples)e outros compostos.
[editar] Derivados de carboidratos
Amidalina - Ácido glicônico - Ácido glicurônico - Ácido sacárico - Sorbitol - Trinitrato de celulose - Piroxilina - Acetato de celulose
[editar] Função
Energética: constituem a primeira e principal substância a ser convertida em energia calorífica nas células, sob a forma de ATP. Nas plantas, o carboidrato é armazenado

como amido nos amiloplastos; nos animais, é armazenado no fígado e nos músculos como glicogênio.
Estrutural: determinados carboidratos proporcionam rigidez, consistência e elasticidade a algumas células. A pectina, a hemicelulose e a celulose compõem a parede celular dos vegetais. A quitina forma o exoesqueleto dos artrópodes. Os ácidos nucléicos apresentam carboidratos, como a ribose e a desoxirribose, em sua estrutura.