Estudo do metano
-
Upload
manuel-vicente -
Category
Science
-
view
53 -
download
3
Transcript of Estudo do metano

Fórmula geral
CH4
*ESTUDO DO METANO

*O metano é o elemento mais simples e o
representante da família dos alcanos.
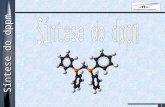
*Esta constituído por um (1) átomo de carbono unido
a quatro (4) átomos de hidrogénio por ligações
covalente.
*A molécula do metano forma um tetraedro
regular, as suas quatro ligações estão dirigidas a
quatro vértices, formando ângulos de 109*28" .

*Embora as quatro ligações (C - H) sejam polares,
a disposição simétrica dos átomos na molécula
implica que a polaridade resultante destas
ligações seja igual a zero e a molécula por tanto
é apolar, quer dizer existe compensação das
ligações.
*O Metano, conhecido também gás dos pântanos,
gás grisú ou como biogás.

*Propriedades físicas do Metano
*O metano é um gás inodoro e incolor,
*Temperatura de ebulição é 162ᵒC
*Sua molécula é tetraédrica e apolar (CH4), de pouca
solubilidade em água,
*Solúvel em álcool
*Está contida em quase todos os gases naturais.

*Propriedades químicas do gás metano
*O metano forma um radical metila (CH3), que reage com o
oxigénio, daí a facilidade de entrar em combustão:
*1. Quando a reacção ocorre numa atmosfera rica em
oxigénio e a temperaturas elevadas, o metano arde com
uma chama incolor, produzindo dióxido de carbono e água
(combustão completa)
equação do processo de combustão completa:
CH4 + 2O2 → CO2 + 2H2O ΔH=-891,40Kj

*2. Quando a reacção ocorre numa atmosfera pobre
em oxigénio (combustão incompleta), o metano
arde com uma chama amarelada e os produtos
resultantes são:
a) Monóxido de carbono (tóxico)
CH4 + 3/2O2 → CO + 2H2O
b) Carbono livre (negro de fumo)
CH4 + O2 → C (s) + 2H2O

*Decomposição térmica do metano,
A 1000ᵒC de temperatura e em ausência de oxigénio do ar, o metano decompõe-se (pirolises):
CH4 + Calor → C (s) + 2H2(g) Metano carbono (livre)

*4. Reacção de substituição: (cloração)*O metano em presença de raios ultravioletas reage vigorosamente com o cloro molecular produzindo o clorometano e o cloreto de hidrogénio:
a) Formação do clorometano
CH4 + Cl2(g) → CH3Cl + HCl(g)
*Este tipo de reacção denomina-se reacção de substituição, porque o átomo de cloro substitui o átomo de hidrogénio na molécula do metano.
A substituição continua até a substituição dos quatro átomos de hidrogénio por átomos de cloro.

b) Formação do diclorometano
CH3Cl + Cl2(g) → CH2Cl2 + HCl(g)
c) Formação do triclorometano
CH2Cl2 + Cl2(g) → CHCl3 + HCl(g)
d) Formação do tetracloreto de carbono
CHCl3 + Cl2(g) → CCl4 + HCl(g)

*MECANISMO DA REACÇÃO DE SUBSTITUIÇÃO
*É uma forma detalhada para explicar o processo químico:
a) Reacção de iniciação (formação dos radicais
livres):
Cl : Cl → Cl . + Cl .
átomos de cloro (ruptura homolítica) Luz U-V radicais livres

*b) Reacção de propagação
Cl. + CH4 → CH3. +
HCl(g) radical metano Luz U-V radical metilo cloreto de hidrogénio
Cl. + CH3. → CH3 -Cl
radical radical metila Luz U-V clorometano

*Fontes de gás metano:• Decomposição de resíduos orgânicos;
• Extracção de combustível mineral;
• Processo de digestão em animais herbívoros;
Os resíduos de animais e plantas que se depositam no fundo de rios e mares se transformam em gás metano, como também os alimentos ingeridos por ruminantes.
No final da digestão, bois e vacas podem exalar um cheiro nada agradável, é o gás metano.
A extracção de metano de depósitos geológicos possibilita o aparecimento de um combustível mineral, este pode ser usado com uma fonte de energia alternativa.

*Obtenção de Metano
*Este composto pode ser extraído de fontes naturais como, por exemplo, dos pântanos, ou por aquecimento ou combustão de biomassa anaeróbica.

*APLICAÇÕES DO METANO
*O metano utiliza-se como matéria-prima na indústria
de álcool, aldeídos, cetonas, ácidos orgânicos e
derivados halogenados.
*O metano utiliza-se como combustível (constitui
quase 80% do gás natural).
*Utiliza-se na obtenção do negro de fumo (recheio para
artigos de caucho e pigmentos de tintas).

*F i m
* Março/2015
*manueldamata.blogs.sapo.pt









![Hidratos de Metano - epe.gov.br · [Digite texto] Hidratos de Metano Aspectos técnicos, econômicos e ambientais Rio de Janeiro 12 de dezembro de 2016](https://static.fdocumentos.com/doc/165x107/5be506ce09d3f2d7048dc5b2/hidratos-de-metano-epegovbr-digite-texto-hidratos-de-metano-aspectos-tecnicos.jpg)