Leonardo Alves e Silva - app.uff.br Alves e Silva... · AFP - analisador da função plaquetária...
Transcript of Leonardo Alves e Silva - app.uff.br Alves e Silva... · AFP - analisador da função plaquetária...

UNIVERSIDADE FEDERAL FLUMINENSE
INSTITUTO BIOMÉDICO
BIOMEDICINA
Leonardo Alves e Silva
USO DE TÉCNICAS LABORATORIAIS PARA AVALIAÇÃO DO
SISTEMA HEMÓSTATICO E DETECÇÃO DE NOVOS
ANTIPLAQUETÁRIOS E ANTICOAGULANTES PARA O
TRATAMENTO DE QUADROS TROMBÓTICOS
NITERÓI
2011

Leonardo Alves e Silva
USO DE TÉCNICAS LABORATORIAIS PARA AVALIAÇÃO DO
SISTEMA HEMÓSTATICO E DETECÇÃO DE NOVOS
ANTIPLAQUETÁRIOS E ANTICOAGULANTES PARA O
TRATAMENTO DE QUADROS TROMBÓTICOS
Orientadora: Profª. Drª. HELENA CARLA CASTRO
Co-orientador: Msc. PLÍNIO CUNHA SATHLER
Niterói
2011
Monografia apresentada ao curso de graduação
em Biomedicina da Universidade Federal
Fluminense como requisito parcial para
obtenção do grau de Bacharelado em
Biomedicina

Leonardo Alves e Silva
USO DE TÉCNICAS LABORATORIAIS PARA AVALIAÇÃO DO
SISTEMA HEMÓSTATICO E DETECÇÃO DE NOVOS
ANTIPLAQUETÁRIOS E ANTICOAGULANTES PARA O
TRATAMENTO DE QUADROS TROMBÓTICOS
BANCA EXAMINADORA
_______________________________________________________
Profª. Drª Helena Carla Castro (Presidente)
Universidade Federal Fluminense (UFF)
__________________________________________________________________
Profª. Drª Evelize Folly das Chagas (Membro 1)
Universidade Federal Fluminense (UFF)
________________________________________________________
Profª. Drª Hye Chung Kang (Membro 2)
Universidade Federal Fluminense (UFF)
___________________________________________________________________
Msc. Plínio Cunha Sathler (Suplente)
Universidade Federal Fluminense (UFF)
Niterói
2011
Monografia apresentada ao curso de graduação
em Biomedicina da Universidade Federal
Fluminense como requisito parcial para
obtenção do grau de Bacharelado em
Biomedicina

“No começo, toda ciência encontra forçosamente fatos que, a princípio, parecem
contraditórios e só um estudo minucioso e completo pode demonstra-lhes a conexão.”
Allan Kardec

Agradecimentos
Inicialmente a Deus, por tudo que fez e tem feito em minha vida.
Aos meus pais, por serem tão importantes em minha vida, meu exemplo de amor, bondade e
respeito. Obrigado por sempre me apoiarem nas minhas decisões, se hoje eu sou vitorioso é por
causa de vocês, então essa vitória é nossa, eu amo vocês! A minha irmãzinha, que desde que chegou
nessa vida me fez entender o amor fraterno, a importância de compartilhar, por fim a amizade.
Amo-te muito minha “pimentinha”. A minha bisavó, e avós que fizeram parte da minha infância e
moram comigo no coração, obrigado por tudo que fizeram por mim. Aos outros familiares que
sempre torcem por mim, o meu muito obrigado.
Aos meus amigos de infância, em especial José Roberto, Evandro, Emanuel e Denison, que
me proporcionaram vários momentos felizes, divertidos e muita, muita história pra contar.
Aos meus amigos, espalhados por todo o Brasil, que compartilhavam do mesmo sonho que o
meu de estar em uma Universidade, pra mim essa etapa acaba agora, portanto muita força a vocês e
obrigado pelo incentivo para nunca desistir.
Aos meus mais novos amigos de Níteroi, que apesar do pouco tempo se tornaram muito
importantes em minha vida, em especial ao Vinícius, meu grande amigo, que já me agüenta há
quatro anos, muito obrigado meu irmão por essa amizade sincera.
Aos meus queridos companheiros da turma de biomedicina Amanda, Angélica, Anna, Ayslan,
Felipe, Gentil, Havana, João Vitor, Jonathas, Juliana, Marcelle, Melise, Raiane, Raquel, Raul e
Thiago, sem todos vocês não teria sido a mesma coisa, guardarei grandes lembranças.
Aos meus amigos do LABIEMOL, cada um de vocês é responsável pela minha vitória
também, portanto meu muito obrigado, em especial ao Mestre “Jedi” Plínio “Skywalker” e seu
discípulo “Padawan” André, se hoje sei alguma coisa de hemostasia e me tornei um exímio
“flebotomista” é por causa de vocês, muito obrigado amigos. A Professora Doutora Helena Carla
Castro por ter aceitado me orientar, muito obrigado.
Aos integrantes da banca examinadora, meus sinceros agradecimentos.
Aos demais que por ventura não foram citados, mas que foram essências em minha
caminhada.

vi
RESUMO
As doenças cardiovasculares representam a causa mais freqüente de morbidade e de
mortalidade em todo o mundo segundo a organização mundial de sáude. Entre as doenças mais
importantes, destacam-se a aterotrombose e o tromboembolismo venoso (TEV), ambos relacionados
ao processo de formação do trombo vascular (trombose). Em geral, a formação do trombo provém
de três fatores principais que caracterizam alterações da hemostasia normal, apontadas em 1856 por
Virchow, que incluem a lesão da parede vascular, a estase venosa e a hipercoagulabilidade
conhecidos como a tríade de Virchow. O tratamento deste distúrbio baseia-se no uso de fármacos
antitrombóticos incluindo antiplaquetários (ex.: ácido acetil salicílico) e anticoagulantes (ex.:
heparinas, dicumarínicos), os quais apresentam efeitos adversos como a trombocitopenia induzida,
neutropenia, hemorragias, osteoporose, resistência, hipersensibilidade e necrose de pele. O objetivo
deste trabalho é estabelecer um protocolo envolvendo técnicas laboratoriais de avaliação do sistema
hemostático empregados na rotina de análises clínicas para monitorar a atividade de fármacos
convencionais e potenciais protótipos antitrombóticos (derivados N-acilhidrazônicos), gerando
assim um perfil comparativo com o padrão observado em pacientes sob terapia antitrombótica
monitorados na rotina hospitalar. Esse estudo demonstra que é possível rastrear os fármacos
convencionais e os novos derivados através das técnicas laboratoriais utilizadas na rotina de
analises clínicas e assim predizer o perfil antitrombótico desses compostos que se encontram em
fase pré-clínica.

vii
ABSTRACT
Cardiovascular diseases are the most frequent cause of morbidity and mortality worldwide.
Among the most important diseases, stand atherothrombosis and venous thromboembolism (VTE),
both related to the process of vascular thrombus formation (thrombosis). Overall, thrombus
formation comes from three main factors that characterize changes in normal haemostasis, pointed
in 1856 by Virchow, which include endothelial injury, venous stasis and hypercoagulability known
as the Virchow's triad. The treatment of these disorders is based on the usage of antithrombotics
including antiplatelet drugs (ie aspirin) and anticoagulants (ie heparin, coumarins), which may
present several adverse effects such as induced thrombocytopenia, neutropenia, bleeding,
osteoporosis, aspirin resistance, hypersensitivity and skin necrosis. The objective of this work is to
establish a protocol involving laboratory techniques toward the evaluation of haemostatic system in
a routine clinical testing to monitor the activity of conventional drugs and potential antithrombotic
prototypes (N-acylhydrazone derived), thus generating a comparative profile with the pattern
observed in antithrombotic therapy in patients monitored into a hospitalar routine. This study
demonstrates that it is possible to detect the interference of conventional drugs and new derivatives
through the laboratory techniques used in routine clinical analysis and also, predict the
antithrombotic profile of these compounds into a preclinical phase.

viii
LISTA DE GRÁFICOS
Gráfico 1: Avaliação da atividade antitrombótica da Heparina 0,25, 0,5, 1 UI/mL utilizando o
ensaio de tempo de tromboplastina parcial ativada. (* p<0,05 ANOVA oneway; Tukey Test). ...... 36
Gráfico 2: Avaliação da atividade antitrombótica da Heparina 0,25, 0,5, 1 UI/mL utilizando o
ensaio de tempo de protrombina. (* p<0,05 ANOVA oneway; Tukey Test). ................................. 36
Gráfico 3: Avaliação da atividade antitrombótica do Argatroban 2, 5 e 10 µg/mL utilizando o ensaio
de tempo de tromboplastina parcial ativada. (* p<0,05 ANOVA oneway; Tukey Test). ................. 37
Gráfico 4: Avaliação da atividade antitrombótica do Argatroban 2, 5 e 10 µg/mL utilizando o ensaio
de tempo de protrombina. (* p<0,05 ANOVA oneway; Tukey Test). ............................................ 37
Gráfico 5: Avaliação da atividade antiplaquetária da aspirina (AAS: Ácido Acetil Salicílico
100µg/mL) através da análise da inibição da amplitude de agregação e da taxa de agregação(%)
frente aos agonistas, Acido araquidônico (AA), Adenosina Difosfato (ADP), Epinefrina (EP) e
Colágeno (COL). (* p<0,05 ANOVA oneway; Tukey Test). ........................................................ 38
Gráfico 6: Avaliação da atividade anticoagulante dos derivados N-acilhidrazônicos (2a, 2c, 2e, 2g e
2h) através dos ensaios de tempo de tromboplastina parcial ativada (TTPA). (* p<0,05 ANOVA
oneway; Tukey Test). .................................................................................................................... 39
Gráfico 7: Avaliação da atividade anticoagulante dos derivados N-acilhidrazônicos (2a, 2c, 2e, 2g e
2h) através dos ensaios de tempo de protrombina (TP). (*p<0,05 ANOVA oneway; Tukey Test). . 40
Gráfico 8: Avaliação da atividade antiplaquetária dos derivados N-acilhidrazônicos (2a, 2c, 2e, 2g e
2h) através da análise da inibição da amplitude de agregação e da taxa de agregação(%) frente aos
agonistas, Acido araquidônico (AA), Adenosina Difosfato (ADP), Epinefrina (EP) e Colageno
(COL). (*p<0,05 ANOVA oneway; Tukey Test). ......................................................................... 41

ix
LISTA DE FIGURAS
Figura 1: O processo de Hemostático. A) Injuria (lesão) com exposição de agonistas plaquetários,
B) Adesão das plaquetas ao subendotélio, C) Mudança de forma da plaqueta com secreção dos
grânulos, D) Ligação plaqueta-plaqueta, E) Depósito da fibrina sobre o tampão plaquetário
(CASTRO et al., 2006). ................................................................................................................ 13
Figura 2: Eventos plaquetários envolvidos na hemostasia (YIP et al., 2005). ................................. 14
Figura 3: A cascata de coagulação sanguínea evidenciando os fatores da via extrínseca (brancos) e
os da via intrínseca (pretos) e seus inibidores (círculos ovais) (CIPRANDI et al., 2003). ............... 16
Figura 4: A aspirina e seu mecanismo. (A) Via metabólica alvo da aspirina – produção do ácido
araquidônico e Tromboxano A2 e (B) Estrutura tridimensional do complexo cicloxigenase com o
substrato, ácido araquidônico (rosa) e com o inibidor, aspirina (cinza) (CASTRO, et al., 2006). ... 22
Figura 5: N-acilhidrazonas e seus substituintes. ............................................................................. 24
Figura 6: Fluxograma dos testes realizados com fármacos de mercado com perfil anticoagulante
(heparina e argatroban), antiplaquetário (Aspirina) e os novos derivados N-acilhidrazônicos (2a, 2c,
2e, 2g e 2h). TTPA: Tempo de tromboplastina parcial ativada; TP: Tempo de protrombina: AA:
Ácido Araquidônico; ADP: Adenosina Difosfato; EPI: Epinefrina; COL: Colágeno. ..................... 31

x
LISTA DE ABREVIATURAS
AA – Ácido Araquidônico
AAS – Ácido acetil salicílico
ADP – Adenosina difosfato
AFP - analisador da função plaquetária
AOAP - avaliação ótica da agregação plaquetária
COL - Colágeno
COX-1 – Cicloxigenase 1
DMSO - Dimetilsulfóxido
EP - Epinefrina
EV - Endovenosa
FA – Fibrilação atrial
FT – Fator Tecidual
GP IIb/IIIa – Glicoproteína IIb/IIIa (Receptor plaquetário)
GP VI – Glicoproteina VI (Receptor plaquetário)
HBPM – Heparina de baixo peso molecular
HNF – Heparina não fracionada
INR - Razão Normatizada Internacional
ISI – Índice de sensibilidade internacional
PAI-1 - Inibidores do ativador do plasminogênio
PAI-2 - Inibidores do ativador do plasminogênio
PPP – Plasma pobre em plaquetas
PRP – Plasma rico em plaquetas
SC – Subcutânea
TEV – Trombo embolismo venoso
TFPI – Inibidor da via do fator tecidual
TP – Tempo de protrombina
t-PA - Ativador do plasminogênio do tipo tecidual
TTPA – Tempo de tromboplastina parcial ativada
TXA2 – Tromboxano A2
TXB2 – Tromboxano B2
u-PA - Ativador do plasminogênio do tipo uroquinase
VRAA - Verificação rápida da ação da aspirina
vWF – Fator de Von Willebrand
α2-AP – α2 antiplasmina

xi
SUMÁRIO
RESUMO ...................................................................................................................................... vi
ABSTRACT ................................................................................................................................. vii LISTA DE GRÁFICOS ............................................................................................................... viii
LISTA DE FIGURAS .................................................................................................................... ix LISTA DE ABREVIATURAS ........................................................................................................ x
1. INTRODUÇÃO ....................................................................................................................... 13 1.1. HEMOSTASIA ................................................................................................................. 13
1.2. DISTÚRBIOS TROMBOEMBÓLICOS E TRATAMENTOS ............................................ 17 1.2.1. TROMBOSE VENOSA ............................................................................................... 17
1.2.2 TROMBOSE ARTERIAL ............................................................................................ 18 1.3. AGENTES ANTITROMBÓTICOS (ANTICOAGULANTES E ANTIPLAQUETÁRIOS) 19
1.3.1. ANTICOAGULANTES .............................................................................................. 19 1.3.2. INIBIDORES PLAQUETÁRIOS ................................................................................ 21
1.3.3. COMPOSTOS E MOLÉCULAS COM POTENCIAL TERAPÊUTICO ...................... 23 1.4. DIAGNÓSTICO E MONITORAMENTO .......................................................................... 24
1.4.1. COAGULOGRAMA ................................................................................................... 25 1.4.1.1. Ensaios de Tempo de Tromboplastina Parcial Ativada e Tempo de Protrombina ....... 25
1.4.2. ENSAIOS DE AGREGAÇÃO PLAQUETÁRIA ......................................................... 27 2. OBJETIVOS ............................................................................................................................. 29
2.1. OBJETIVO GERAL ........................................................................................................... 29 2.2. OBJETIVOS ESPECÍFICOS .............................................................................................. 29
3. MATERIAL E MÉTODOS ....................................................................................................... 30 3.1. CASUÍSTICA .................................................................................................................... 30
3.1.1. PLANEJAMENTO ...................................................................................................... 30 3.1.2. AMOSTRA DO ESTUDO ........................................................................................... 30
3.1.2.1. Critérios de inclusão ................................................................................................. 32 3.1.2.2. Critérios de exclusão ................................................................................................. 32
3.1.3. LOCAL DOS TESTES ................................................................................................ 32 3.1.4. CUIDADOS ÉTICOS .................................................................................................. 32
3.2. METODOLOGIA .............................................................................................................. 33 3.2.1 ENSAIOS DE AGREGAÇÃO PLAQUETÁRIA .......................................................... 33
3.2.2. ENSAIOS ANTICOAGULANTES ............................................................................. 33 3.2.2.1. Tempo de tromboplastina parcial ativada (TTPA) ..................................................... 34
3.2.2.2. Tempo de protrombina (TP) ...................................................................................... 34 3.2.3. ANÁLISE ESTATÍSTICA .......................................................................................... 34
4. RESULTADOS......................................................................................................................... 35 4.1. DETERMINAÇÃO DOS ENSAIOS ANTITROMBÓTICOS IN VITRO UTILIZANDO
FÁRMACOS CONVENCIONAIS (CONTROLES) .................................................................. 35 4.1.1. COAGULAÇÃO ......................................................................................................... 35
4.1.1.1 Heparina – potencializador de antitrombina ............................................................... 35 4.1.1.2. Argatroban – inibidor direto de trombina .................................................................. 35
4.1.2. AGREGAÇÃO PLAQUETÁRIA ................................................................................ 38 4.1.2.1. Aspirina – inibidor de COX ...................................................................................... 38

xii
4.2. ENSAIOS ANTITROMBÓTICOS IN VITRO COM NOVOS DERIVADOS N-
ACILHIDRAZÔNICOS ............................................................................................................ 39 4.2.1 COAGULAÇÃO .......................................................................................................... 39
4.2.2 AGREGAÇÃO PLAQUETÁRIA ................................................................................. 40 5. DISCUSSÃO ............................................................................................................................ 42
6. CONCLUSÃO .......................................................................................................................... 46 7. ANEXOS........................................................................................................................................47
8. REFERÊNCIAS BIBLIOGRÁFICAS ...................................................................................... 49

13
1. INTRODUÇÃO
1.1. HEMOSTASIA
A hemostasia é um processo fisiológico de manutenção do estado líquido e circulante do
sangue, com a indução de um tampão hemostático em caso de lesão vascular (MITCHELL et al.,
2006; BAKER E BRASSARD, 2011). Este processo pode ser dividido em hemostasia primária,
hemostasia secundária e a fibrinólise (Figura 1) (CANOBBIO et al., 2004; TING E
KHASAWNEH, 2010).
Figura 1: O processo de Hemostático. A) Injuria (lesão) com exposição de agonistas plaquetários, B) Adesão das
plaquetas ao subendotélio, C) Mudança de forma da plaqueta com secreção dos grânulos, D) Ligação plaqueta-plaqueta,
E) Depósito da fibrina sobre o tampão plaquetário (CASTRO et al., 2006).

14
Na hemostasia primária, a partir do estabelecimento do quadro lesivo vascular, verifica-se
uma resposta vasoconstritora imediata, mediada por mecanismos neurogênicos reflexos, os quais
geram o aumento da secreção local de substâncias vasoativas como a endotelina. Essa
vasoconstrição local diminui o fluxo sanguíneo, permitindo o maior contato das plaquetas ao
colágeno exposto, proporcionando assim, a sua adesão a esta superfície e em seguida o processo de
ativação.
A adesão plaquetária ocorre na matriz extracelular presente no subendotélio, que contêm ainda
fibronectina, fator de von Willebrand (vWF) e laminina e vitronectina. Com a ativação, as plaquetas
liberam uma série de moléculas pró-agregantes (Adenosina Difosfato, TXA2) promovendo a
agregação plaquetária, amplificando a resposta hemostática e formação do trombo branco (Figura 2)
(CASTRO et al., 2006; CAPLAN E FISHER, 2007; EYRE E GAMLIN, 2010).
Figura 2: Eventos plaquetários envolvidos na hemostasia (YIP et al., 2005).
A hemostasia secundária consiste no processo de coagulação em que se observa a ativação
seqüencial de proteínas plasmáticas inativas, os zimogênios, também chamados de fatores de
coagulação, em enzimas capazes de originar, como produto final, a rede de fibrina a partir do
fibrinogênio. Neste processo uma das enzimas produzidas, a trombina, é também um agonista
plaquetário que aumentará o processo de agregação das plaquetas.
Segundo a literatura tradicional, existem duas vias de coagulação: a via extrínseca e a via
intrínseca. A via extrínseca é ativada após a lesão vascular, promovendo a exposição do fator
tecidual (FT) que em contato com o fator VII, na presença de íons Ca2+
, proporciona a ativação
desse fator em VIIa e formação de um complexo (Complexo FT-FVIIa). Este complexo irá ativar os

15
fatores IX e X, levando a conversão de protrombina em trombina. Na ativação da via intrínseca (via
de contato) verifica-se a participação dos fatores VIII, IX, X, XI e XII da coagulação, além das
proteínas pré-calicreína, cininogênio de alto peso molecular e íons Ca2+
. Quando a pré-calicreína, o
cininogênio, o fator XI e XII são expostos à cargas negativas do vaso lesado, a pré-calicreína é
convertida em calicreína, sendo esta capaz de ativar o fator XII. O fator XIIa acaba convertendo
mais pré-calicreína em calicreína e ativando o fator XI.
Na presença de íons Ca2+
, o fator XIa proporciona a ativação do fator IX. Por sua vez o fator
IXa junto ao fator VIIIa, levam à ativação do fator X. Deste modo, o complexo enzimático
constituído pelo fator Xa, juntamente com o fator Va e íons Ca2+
irão formar o complexo
protrombinase na membrana fosfolipídica das plaquetas, que será responsável pela formação da
trombina (GOODMAN E GILMAN, 2006; FRANCO, 2001). É importante ressaltar que existem
interconexões entre essas duas vias e que para alguns autores, esta ordenação (intrínseca e
extrínseca) é uma visão ainda a ser discutida (HOFFMAN E DOUGALD, 2001; VINE, 2009).
A cascata de coagulação é controlada continuamente por inibidores, evitando assim, a
ativação exacerbada ou inespecífica deste processo (RANG, 2003). Dentre os inibidores mais
importantes estão: a) as antitrombinas (ex. antitrombina III), que agem inibindo a atividade da
trombina e de outras serino-proteases presentes na cascata de coagulação (fatores IXa, Xa, XIa e
XIIa) (MOSESSON, 2007); b) as proteínas C e S, que são dependentes da vitamina K e
caracterizam-se por inativar os fatores Va e VIIIa, e c) o inibidor da via do fator tecidual (TFPI),
uma proteína secretada pelo endotélio subjacente à lesão que inativa os fatores Xa e o complexo
FT-VIIa (Figura 3) (INNERHOFER E KIENAST, 2010).
Em etapa posterior, observa-se desenvolvimento de eventos antitrombóticos os quais ocorrem
a partir da ação de enzimas que dissolvem o coágulo para controle de sua extensão, após a cobertura
da área lesada. Desta forma, o sistema fibrinolítico tem como função, o controle da formação do
coágulo no vaso, garantindo a não-oclusão do mesmo e a restauração adequada da circulação no
local em que ocorreu a lesão vascular (WOHNER, 2008; WOLBERG E CAMPBELL, 2008). Este
sistema controla o tamanho do coágulo de fibrina principalmente pela ação da plasmina, uma
enzima que degrada à fibrina.
A plasmina é uma serino protease ativa após a clivagem da ligação do plasminogênio sendo
dois ativadores fisiológicos do plasminogênio descritos na literatura: o ativador do plasminogênio
do tipo tecidual (t-PA) e o ativador do plasminogênio do tipo uroquinase (u-PA). Os dois ativadores
têm alta especificidade de ligação com seu substrato (plasminogênio) e promovem hidrólise de uma

16
Figura 3: A cascata de coagulação sanguínea evidenciando os fatores da via extrínseca (brancos) e os da
via intrínseca (pretos) e seus inibidores (círculos ovais) (CIPRANDI et al., 2003).
única ligação peptídica (Arg560-Val561) que resulta na formação de uma serino-protease ativa, a
plasmina.
Embora a plasmina degrade não somente a fibrina, mas também o fibrinogênio, fator V e
fator VIII, em condições fisiológicas o processo de fibrinólise se processa de maneira especifica
sobre a fibrina, gerando uma ativação localizada e restrita, não sistêmica, cumprindo desta forma,
sua função de remover o excesso de fibrina intravascular. Esta especificidade é resultado de
interações moleculares específicas entre o plasminogênio e seus ativadores, a fibrina e os inibidores
da fibrinólise. Essas enzimas também são reguladas por inibidores que incluem os inibidores do
ativador do plasminogênio 1 e 2 (PAI-1 e PAI-2) que inativam o t-PA; enquanto a α2 anti-plasmina
(α2-AP) inativa a plasmina (GOODMAN E GILMAN, 2006; THELWELL, 2010).
Embora tais eventos sejam responsáveis pelo controle da hemostasia normal, oclusões ou
mesmo embolias podem ser ocasionadas caso haja uma resposta exacerbada do processo
hemostático que são induzidas por distúrbios fisiológicos. O produto desta indução, com freqüência
resulta no estabelecimento do quadro clínico que recebe o nome de trombose (KUMAR et al.,
2010).

17
1.2. DISTÚRBIOS TROMBOEMBÓLICOS
Diversos fatores, adquiridos ou genéticos, exercem influência contrária ao equilíbrio da
hemostasia o que resulta em estados de hipo ou hipercoagulabilidade. Como define Kummar et al.
(2010) o oposto patológico a hemostasia é a trombose, que pode ser oriunda de uma ativação
inapropriada dos processos hemostáticos normais, tal como a formação de um coágulo sanguíneo
(trombo) na vasculatura não lesionada ou oclusão trombótica de um vaso após uma lesão relativamente
pequena (KUMAR et al., 2010).
Entre as doenças trombóticas mais recorrentes destacam-se a aterotrombose e o
tromboembolismo venoso (TEV) que são doenças causadas por quadros de trombose arterial e
trombose venosa respectivamente. Esses quadros patológicos fazem parte das doenças
cardiovasculares, que segundo a Organização Mundial de Saúde, representam uma das maiores
causas de morbidade e de mortalidade em todo o mundo (WHO, 2009; COTRAN et al., 1996;
MAVRAKANAS E BOUNAMEAUX, 2010)
1.2.1. TROMBOSE VENOSA
O tromboembolismo venoso é uma complicação muito comum que representa um risco de
vida para pacientes hospitalizados ou aqueles que deixam o hospital após um período de
permanência em estado pós-operatório (SANFORD E PLOSKER, 2008). Sua faixa de ocorrência
média, descrita na literatura é superior a 20% em pacientes que passaram por cirurgias gerais e 40%
em pacientes que foram submetidos a cirurgias ortopédicas. As chances de ocorrência de
tromboembolias pulmonares fatais após cirurgias de alto risco têm um valor estimado de 5%.
Segundo Cotran et al., o trombo venoso se forma sob condições de baixa força de
cisalhamento do sangue na parede vascular, apresentando predominantemente fibrina e eritrócitos
(COTRAN et al., 1996). Em sua formação, atuam três fatores principais, apontados desde 1856 por
Virchow, que inclui a lesão da parede vascular, a estase venosa e a hipercoagulabilidade (LENSING
et al., 1999; TURPIE E ESMON, 2011). Estes trombos, uma vez formados, podem se desprender e
migrar para o pulmão, dando origem às embolias pulmonares (BATES E WEITZ, 2003).
Os altos índices de mortalidade provenientes do tromboembolismo venoso após cirurgias de
alto-risco se deve ao fato de tais procedimentos, produzirem distúrbios hemodinâmicos capazes de

18
induzir a ativação da cascata de coagulação além de promover a inibição dos processos
fibrinolíticos. Esses eventos culminam numa formação prolongada do trombo vascular e num
aumento proporcional do risco do paciente desenvolver um quadro clínico de trombose
(ERIKSSON BI et al., 2007; SANFORD E PLOSKER, 2008)
Como visto, os trombos causam obstrução das artérias e veias, podendo ocasionar embolia,
sendo o grau de gravidade determinado pelo local de ocorrência do mesmo. Assim, embora o
trombo venoso possa causar congestão e edema nos leitos vasculares distais, seu desprendimento e
migração podem ser fatais. Inversamente, os trombos arteriais possuem importância direta no local
de ocorrência propriamente dito, podendo causar infarto miocárdico ou cerebral se localizado no
coração ou cérebro (COTRAN et al., 2006).
1.2.2 TROMBOSE ARTERIAL
O trombo arterial se forma sob condições de alta força de cisalhamento, sendo formado
basicamente por plaquetas agregadas, envolvidas em rede de fibrina (COTRAN et al., 1996;
HAGEDORN et al., 2010). Geralmente, os trombos arteriais são formados sobre placas de ateroma
instáveis e rotas (YOSHIDA, 2004). Em situações de hipercoagulabilidade, os trombos podem se
desenvolver até mesmo em superfícies endoteliais aparentemente normais.
Em meio a condições fisiopatológicas, o processo de adesão, ativação e agregação das
plaquetas se mostram como processos-chave para formação do trombo arterial, após o dano
endotelial. Tanto a ruptura das placas ateroscleróticas quanto as intervenções cirúrgicas podem
causar a exposição subendotelial e a subseqüente formação do tampão hemostático, resultando
eventualmente na oclusão de artérias, levando a isquemia, infartos do miocárdio e derrame
(ULRICHTS et al., 2011).
De fato, as respostas normais das plaquetas podem ser alteradas por disfunções
cardiovasculares mediadas pelo estabelecimento de quadros patológicos graves (angina pectoral
estável) e agudos (Infarto do miocárdio). A formação da tromboxano A2 (TXA2), um metabólito da
via do ácido araquidônico e potente ativador plaquetário, foi encontrado em altas concentrações em
pacientes que sofreram infarto agudo do miocárdio, enquanto pacientes com síndromes
coronarianas agudas, apresentaram um aumento significativo da expressão de glicoproteína VI (GP
VI), um dos receptores presentes nas plaquetas que possuem um caráter pró-agregante (XIANG et
al., 2008). Esses trabalhos demonstram que as plaquetas têm um papel importante na formação dos
trombos arteriais.

19
1.3. AGENTES ANTITROMBÓTICOS (ANTICOAGULANTES E
ANTIPLAQUETÁRIOS)
Como alternativa terapêutica para os quadros tromboembólicos é indicada a prescrição de
fármacos antitrombóticos como, os antiplaquetários e anticoagulantes. Estes são administrados de
acordo com o tipo de distúrbio e/ou risco que possam causar ao paciente (FLATO et al., 2010). O
avanço destas terapias tem proporcionado uma nítida melhora na evolução do quadro de pacientes
com síndromes miocárdicas, eventos isquêmicos e no controle do risco de complicações
hemorrágicas (NICOLAU E BARACIOLI, 2010).
1.3.1. ANTICOAGULANTES
Os agentes anticoagulantes são moléculas que alteram direta ou indiretamente a cinética da
coagulação sangüínea (HAMERSCHLAK E ROSENFELD, 1996). De uma maneira geral, os
anticoagulantes são representados pelas heparinas e compostos dicumarínicos.
Em pacientes nos quais anticoagulação imediata é desejada (ex. TEV agudo), recomenda-se
o início da varfarina em ambiente hospitalar concomitantemente com heparina não-fracionada
(HNF) ou heparina de baixo peso molecular (HBPM), em doses terapêuticas, por pelo menos 4-5
dias e até que a Razão Normatizada Internacional (INR) esteja na faixa terapêutica em duas
dosagens separadas por 24 horas, quando então, a heparina pode ser suspensa. Em pacientes com
baixo risco trombótico (ex. fibrilação atrial) a varfarina pode ser iniciada em regime ambulatorial,
sem a necessidade de heparina concomitante (CLÉ et al., 2010).
A heparina tem sido usada na prevenção da trombose venosa profunda, em pós - cirurgias e
pós - partos, em pacientes com estado de hipercoagulopatia, ou sujeitos a trombose causada por
diferentes etiologias (FABRIS et al., 2000). Este anticoagulante é administrado aos pacientes,
geralmente em baixas doses, porém para tratar pacientes com tromboembolismo agudo ou
síndromes coronárias agudas e durante cirurgias cardíacas são usadas doses mais elevadas
(TIMOTEO E PAIS, 1998).
Algumas reações adversas graves, como hemorragias e trombocitopenia, são observadas em
alguns pacientes com o uso de heparina, podendo ainda ocorrer um quadro de hemorragia residual,

20
causados até mesmo por fragmentos de heparina que não possuem atividade anticoagulante
(BARROSO, 2008; WARKENTIN, 2010).
A heparina não é absorvida por via oral e, então, deve ser usada via parenteral: endovenosa
(EV) ou subcutânea (SC). Quando a via endovenosa é a escolhida, a dose preconizada para o uso da
heparina não-fracionada (HNF) no tratamento do TEV é um bolus (administração de um fármaco
para aumentar sua concentração no sangue para um nível eficaz) de 80 U/Kg (máximo 5.000 U)
seguido de infusão contínua de 18 U/Kg/h20.
A dose recomendada pelo Colégio Americano de Cardiologia para o tratamento da Síndrome
Coronariana Aguda (BRAUNWALD et al., 2000) é bolus de 60-70 U/Kg (máximo 5.000 U)
seguido de infusão contínua de 12-15 U/Kg/h (máximo de 1.000 U/h).
Pode-se também, realizar anticoagulação plena para o tratamento do TEV com HNF
utilizando-se a via de administração subcutânea, iniciando com bolus EV de 5.000 U seguido de
250 U/Kg SC de 12 em 12 horas; ou iniciando com uma dose SC de 333 U/Kg seguido de 250
U/Kg SC de 12 em 12 horas (HIRSH et al., 2008).
Utilizando um mecanismo diferente, os anticoagulantes dicumarínicos inibem a conversão da
vitamina K, através da inibição das enzimas 2,3 epoxi-redutase e da quinona redutase de vitamina
K, impedindo a ativação dos fatores de coagulação, que é dependente desta vitamina (KREISNER
et al., 2004; MAZZA E YALE, 2009). Incluem-se nesta categoria de anticoagulantes, os derivados
da cumarina e da indadiona que são comumente utilizados por via oral.
O mecanismo de ação dessas moléculas se deve especificamente a similaridade estrutural com
a vitamina K, com a qual compete na fase final da síntese dos fatores II, VII, IX e X e das proteínas
C e S, impedindo a adequada carboxilação dessas moléculas (BLANCO e MESCHENGIESER,
1990; HAMERSCHLAK E ROSENFELD, 1996). Devido ao seu mecanismo de ação, o efeito
desses anticoagulantes orais não é imediato e depende de vários fatores.
O fármaco mais utilizado pertencente a essa classe é a varfarina. A dose inicial de varfarina
deve ser 5-10mg/dia em adultos e ≤ 5mg/dia em pacientes idosos, desnutridos, com insuficiência
cardíaca, doença hepática, em pós-operatório de cirurgia de grande porte ou que estejam usando
medicação que conhecidamente aumenta a sensibilidade a varfarina (ex. amiodarona) (ANSELL et
al., 2008).
Outra classe que vem sendo muito utilizada na clínica é a dos inibidores diretos de trombina.
Estes fármacos bloqueiam a atividade da trombina impedindo a conversão do fibrinogênio em
fibrina e bloqueando a amplificação da cascata da coagulação via trombina uma enzima da

21
coagulação que participa da última etapa de formação do coágulo de fibrina. Uma vantagem deste
fármaco é que diferentemente da heparina não-fracionada (HNF), que se liga às lipoproteínas de
baixa densidade, globulinas e fibrinogênio, os inibidores de trombina devido a sua estrutura e
especificidade não se ligam às proteínas plasmáticas, permitindo estabilidade plasmática constante.
Esta classe de anticoagulante pode ser dividida em dois grupos, os que se ligam de forma bivalente
à trombina (hirudina e bivalirudina) e os que se ligam de forma univalente à trombina
(ximelagatran, argatroban e dabigatram). A hirudina, bivalirudina e argatroban são fármacos de uso
parenteral e são aprovados para utilização em outras situações que não seja fibrilação atrial (FA),
como por exemplo: trombocitopenia induzida por heparina, síndromes coronarianas agudas,
prevenção e tratamento de trombose venosa profunda entre outras. Ximelagatran e dabigatram são
compostos de uso oral com evidências de sua utilização em pacientes com FA (FLATO, et al.,
2010).
1.3.2. INIBIDORES PLAQUETÁRIOS
A inibição plaquetária se baseia principalmente em dois conceitos incluindo a inibição dos
agentes pró-trombóticos (agonistas, receptores e enzimas) e a modulação dos fatores antiagregantes
endógenos. Essas inibições atuam via mecanismos diferentes seja sobre os fatores e/ou vias de
síntese plaquetária em que essas moléculas estão envolvidas. Dentre os inibidores plaquetários mais
utilizados estão a aspirina, o clopidogrel e os inibidores da glicoproteína IIb/IIIa.
O ácido acetil salicílico, conhecido comercialmente pelo nome de aspirina, vem sendo
utilizado atualmente na prevenção primária e secundária de eventos trombóticos como derrame e
infarto do miocárdio (WEBER et al., 2009). Seu mecanismo de ação antiplaquetária é a acetilação
irreversível da hidroxila da porção de serina-529, no centro ativo da Cicloxigenase 1 (COX-1). Essa
modificação química inibe a ligação do ácido araquidônico no interior do centro ativo
inviabilizando a síntese de Tromboxano A2 (TXA2).
A redução na síntese de 90% do TXA2 é necessária para obter a inibição eficaz da agregação
plaquetária, mas essa inibição pode chegar a 100% em plaquetas expostas à aspirina e inativá-las
permanentemente, para o resto do período de vida dessas células, que normalmente atinge 7-10
dias, uma vez que as plaquetas como células diferenciadas perderam os seus núcleos e são
incapazes de sintetizar novas moléculas da enzima (TSELEPIS et al., 2011).

22
As análises realizadas entre a dosagem de aspirina e seus efeitos na prevenção de derrames
recorrentes tem demonstrado que pequenas doses (30 mg/dia) ou maiores (300–1500 mg/dia) de
aspirina apresentam a mesma eficácia, sendo suas menores doses associadas com baixos efeitos
colaterais (SHULGA E BORNSTEIN, 2011).
Figura 4: A aspirina e seu mecanismo. (A) Via metabólica alvo da aspirina – produção do ácido araquidônico e
Tromboxano A2 e (B) Estrutura tridimensional do complexo cicloxigenase com o substrato, ácido araquidônico (rosa) e
com o inibidor, aspirina (cinza) (CASTRO, et al., 2006).
O Clopidogrel é um antiplaquetário pertencente ao grupo das tienopiridinas. Ele é um pró-
fármaco absorvido pelo intestino e metabolizado no fígado por isoformas da enzima P450. Seu
mecanismo de ação é a inibição irreversível dos receptores P2Y12 de adenosina difosfato (ADP),
presentes nas plaquetas, exercendo sua ação através da formação de ligações disulfícas com dois
resíduos de serina (serina-17, serina-270) da molécula receptora (TSELEPIS et al., 2011).
Em testes ex vivo o clopidogrel apresenta uma eficácia máxima na inibição plaquetária em 3-
7 dias, sendo que após cinco horas da administração de uma dose de 300 mg, na maioria dos
pacientes, 80% da atividade plaquetária é inibida. Na clínica o clopidogrel vem sendo utilizado
juntamente com uma baixa dose de aspirina, principalmente em casos de síndromes coronárias
agudas, e tem demonstrado uma maior eficácia do que apenas a administração de aspirina.
Entretanto essa dupla administração tem levado a relatos de grandes hemorragias em cirurgias
levando os pacientes a necessidade de receberem transfusões de sangue e prolongando sua
recuperação (STEWART E LANGTRY, 2010).

23
Os três principais compostos que representam a classe de inibidores GP IIb/IIIa são o
abciximab, a eptifibatida e o tirofibano. Suas características farmacocinéticas e farmacodinâmicas
foram selecionadas para fornecer em pouco tempo uma alta inibição dos receptores GPIIb/IIIa das
plaquetas para combater a trombose que pode ocorrer em resposta ao rompimento mecânico de
placas de ateroma durante e imediatamente após angioplastia coronária (PATRONO E ROCCA,
2010).
Abciximab, é um fragmento Fab quimérico (humano-murino) de um anticorpo monoclonal
contra o receptor GP IIb/IIIa, sendo o primeiro agente desta classe a demonstrar uma eficácia
clínica. O peso molecular de abciximab é de 4,7 KDa.
Eptifibatida é um heptapéptido cíclico sintético, com um peso molecular de 800 Da, enquanto
tirofibano é um não peptídico com um peso molecular de 495 Da. Após término da infusão de
eptifibatida ou tirofibano são necessárias cerca de 4 horas para a restauração da agregação
plaquetária normal, por outro lado, o abciximab liga-se com mais afinidade ao receptor GP IIb/IIIa
que os outros dois agentes e tem uma atividade antiplaquetária que dura vários dias (72 horas).
Um aumento da incidência de trombocitopenia também foi observada como resultado do
tratamento com abciximab, incluindo um aumento na trombocitopenia grave (em 0,7% dos
pacientes que receberam tratamento primário, e em 2,2% com segundo tratamento), o que sugere
que alguma cautela deve permanecer com qualquer readministração de abciximab. Vários estudos
avaliando o uso de eptifibatide em combinação com uma dose completa ou meia dose de
fibrinolíticos têm mostrado melhora significativa na realização de trombólise no infarto do
miocárdio (SHAH et al., 2009).
1.3.3. COMPOSTOS E MOLÉCULAS COM POTENCIAL TERAPÊUTICO
Embora o tratamento com agentes inibidores de agregação plaquetária, como a aspirina, e
agentes anticoagulantes como a heparina e o varfarin constituam um progresso no tratamento de
doenças tromboembólicas, essas substâncias possuem limitações consideráveis no que se refere a
efeitos colaterais e forma de administração (WEITZ E HIRSH, 2001; GRESELE E AGNELLI,
2002; MACKMAN, 2008). Essas características indicam a necessidade da busca de novas opções
terapêuticas seja de origem natural ou sintética.
Estudos do grupo da Drª. Anna Cláudia Cunha, professora do departamento de Química
Orgânica da UFF, em colaboração com o nosso laboratório descreveram a síntese de compostos

24
acilhidrazônicos com atividade antiplaquetária (CUNHA et al., 2003). Estes compostos
apresentaram um perfil similar à aspirina, porém sem sintomas indesejáveis de ulceração gástrica.
Recentemente este mesmo grupo descreveu a síntese de 10 novos compostos derivados N-
fenilamino-5-metil-1H-1,2,3-triazol-4-carbohidrazida.
Estes foram caracterizados e selecionados por meio de seus perfis antiplaquetários in vitro,
analisados usando ácido araquidônico, adrenalina e ADP como agonistas (JORDÃO et al., 2009).
Baseado nos resultados biológicos e teóricos foi visto que alguns dos derivados N-acilhidrazônicos
sintetizados (2a, 2c, 2e, 2g e 2h), são potencialmente capazes de inibir as vias do ácido
araquidônico, da adrenalina e do ADP (IC50 < 20 μg ml-1), apresentando potencial antiplaquetário
suficiente para serem investigados em sistemas in vivo (JORDÃO et al., 2009). Esses protótipos
estão em fase pré-clínica e apresentam ótimos resultados o que reforça seu potencial como fármaco
antitrombótico no tratamento da trombose arterial, sendo que através do monitoramento por testes
laboratoriais é possível verificar a influência desses derivados na hemostasia. Esse fato nos permite
pressupor como será o perfil de atividade do protótipo, quando for administrado ao paciente com
necessidade de terapia antitrombótica.
Figura 5: N-acilhidrazonas e seus substituintes.
1.4. DIAGNÓSTICO E MONITORAMENTO
Os testes laboratoriais empregados na rotina em análises clínicas desempenham um
importante papel na busca por um diagnóstico correto e fidedigno de diversas doenças
tromboembólicas, assim como o seu uso para o monitoramento de pacientes sobre terapia
antitrombótica. Os métodos laboratoriais para avaliação global, bem como de componentes
específicos do sistema hemostático evoluíram de maneira rápida ao longo das últimas décadas,
permitindo a realização de diagnósticos precisos e caracterização detalhada de distúrbios
hemorrágicos e trombóticos com precisão (RISZATTI E FRANCO, 2003). A comparação de testes

25
de sangramento descritos por Duke em 1912 e Ivy em 1941, comumente utilizados em alguns casos
como uma primeira avaliação dos pacientes, e o teste de tromboelastografia, originalmente descrito
por Hellmut Hartert em 1948, porém automatizado e registrado pela Haemoscope Corporation em
1996, permite a verificação de enorme avanço (RISZATTI E FRANCO, 2003).
É valido salientar que em decorrência do emprego de técnicas moleculares, algumas
mutações em genes de componentes da coagulação, anticoagulação e fibrinólise foram descobertas
e associadas a doenças trombóticas e hemorrágicas. No que tange especificamente à trombose
venosa, uma verdadeira revolução conceitual ocorreu sendo essa doença hoje compreendida como
multigênica, estando envolvidas diferentes alterações genéticas que determinam o risco de sua
ocorrência (FRANCO E REITSMA, 2001).
Mencionar o benefício desses avanços na melhoria do tratamento de pacientes, que passaram
a receber intervenções cada vez mais bem adaptadas às suas reais necessidades, se torna importante,
pois tais avanços terapêuticos ocorreram ainda em virtude do desenvolvimento de novas drogas
anti-hemorrágicas e antitrombóticas, cuja utilização clínica resultou em impacto considerável sobre
a qualidade de vida dos pacientes e diminuição de mortalidade associada a distúrbios hemorrágicos
e trombóticos, hereditários ou adquiridos (FRANCO, 2001).
O impacto da evolução dos conhecimentos na área de hemostasia sobre outras disciplinas e
ramos da medicina foi também surpreendente, criando uma interface que não se limitou ao cenário
clínico, mas que se expandiu para a condução de atividades de investigação com característica
multidisciplinar (RISZATTI E FRANCO, 2003).
Dentre os diversos testes que podem ser empregados no diagnóstico e monitoramento de
pacientes com quadros trombóticos ou sob terapias antitrombóticas os mais comuns na rotina são a
contagem de plaquetas (através do hemograma) e os testes de coagulação Tempo de
Tromboplastina Parcial Ativada (TTPA) e Tempo de Protrombina (TP). Quando se busca uma
análise mais focada para a hemostasia primária, testes complementares como os ensaios de
agregação plaquetária podem ser realizados para uma melhor caracterização do quadro trombótico
(RIZZATTI; FRANCO, 2001).
1.4.1. COAGULOGRAMA
1.4.1.1. Ensaios de Tempo de Tromboplastina Parcial Ativada e Tempo de Protrombina

26
O ensaio mais comumente empregado para verificação do mecanismo intrínseco de
coagulação é o tempo tromboplastina parcial ativada (TTPA) (SWENSON, 1996). Após adição de
cálcio, fosfolipídios de carga negativa e uma substância particulada, como caulim (silicato de
alumínio), observa-se a ativação dos fatores XII e XI por essas substâncias, sendo possível
determinar o TTPA (MAJERUS E TOLLEFSEN, 2003).
Devido a resposta anticoagulante da heparina ser variável entre os pacientes, recomenda-se o
monitoramento freqüente e ajuste das doses com base nos resultados dos testes de coagulação. A
monitorização da HNF é realizada pelo TTPA. Já as heparinas de baixo peso molecular (HBPM)
são monitoradas pelo nível da atividade anti-Xa.
O TTPA, quando se utiliza a HNF EV, deve ser realizado 6 horas após a primeira dose e
repetido de 6 em 6 horas, até que se atinja o nível terapêutico adequado,calculado pela divisão do
TTPA do paciente pelo TTPA de uma amostra controle (razão entre 1,5-2,5) (CLÉ et al., 2010).
Quanto à monitorização da HNF usada para anticoagulação plena por via subcutânea, é
estabelecido, nos trabalhos iniciais que propuseram este esquema, realizar o TTPA 6 horas após a
dose de HNF e ajustar a próxima dose aumentando ou reduzindo 20%, com o objetivo de manter a
razão do TTPA entre 1,5-2,5 (RASCHKE et al., 1996).
No caso do argatroban, a análise do tempo de tromboplastina parcial ativada (TTPA) é
geralmente recomendada. O TTPA deve ser determinado antes do tratamento e pelo menos uma vez
por dia durante o tratamento. O TTPA do paciente em estado de equilíbrio deve ser alcançado após
algumas horas de tratamento e seu valor deve ser de 1,5 a 3,0 vezes o valor do TTPA basal, mas não
deve exceder 100 segundos (IVANDIC; ZORN, 2011)
Outro ensaio de grande importância é o tempo de protrombina (TP), que quantifica o tempo
necessário para que ocorra a coagulação (GUYTON E HALL, 2002). Este teste é usado para
identificar as anormalidades dos fatores envolvidos no sistema extrínseco, a saber, fibrinogênio,
protrombina e fatores V, VII e X. Este mede o tempo necessário para um coágulo de fibrina se
formar em uma amostra de plasma citratado após a adição de íons de cálcio e tromboplastina
tecidual (fator III) (CARLOS E FREITAS, 2007). Dentre esses fatores três são dependentes de
vitamina K (protrombina e fatores VII e X) e se tornam diminuídos com o uso de anticoagulantes
cumarínicos, motivo pelo qual, esse exame é o mais utilizado para o controle e monitoramento de
pacientes sob uso de anticoagulantes orais e/ou procedimentos pré ou pós-operatórios (RIZZATTI E
FRANCO, 2001).

27
O resultado do TP é comumente expresso através da Razão Normatizada Internacional
(INR) que foi instituída pela Organização Mundial de Saúde para padronizar as diferenças de
resultados observadas neste teste entre os vários laboratórios. Essas diferenças ocorrem devido à
diferença de métodos, aparelhos e tromboplastinas.
Todos os fabricantes de tromboplastina devem determinar o Índice de Sensibilidade
Internacional (ISI) mediante a padronização de sua tromboplastina frente a uma tromboplastina de
referência internacional proveniente de cérebro humano, que define a sensibilidade do reagente.
Quanto mais próximo de 1,0 for o ISI, mais sensível é a tromboplastina. Os resultados do TP podem
ser reportados em tempo de protrombina, atividade enzimática (%) e INR (HURSTING et al.,
1999). O cálculo do INR é feito de acordo com a seguinte fórmula: INR = [TP do paciente/TP
normal (média do valor de referência)] ISI
Em pacientes internados, deve-se monitorizar a anticoagulação por meio do TP/INR
diariamente, principalmente em pacientes sob uso de anticoagulantes orais como a varfarina,
iniciando-se após a segunda ou terceira dose, até que o valor terapêutico seja atingido por dois dias
consecutivos. Passa-se, então, a monitorizar o TP/INR 2-3 vezes por semana, durante 1-2 semanas
e, após, menos freqüentemente, não ultrapassando uma vez a cada quatro semanas. O valor do INR
terapêutico, para a maioria das situações, deve ser entre 2,0-3,0. Exceções podem ser feitas nos
seguintes casos, quando se recomenda INR entre 2,5-3,5 (CLÉ et al., 2010).
1.4.2. ENSAIOS DE AGREGAÇÃO PLAQUETÁRIA
A agregação plaquetária ocorre devido à formação de complexos de fibrinogênio e fator de von
Willebrand, liberados pelas plaquetas ativadas, com o receptor GP IIb/IIIa na membrana plaquetária
na presença do Ca2+
que forma um complexo estável na superfície das plaquetas ativadas
(ANDREWS E BERNDT, 2004). Essa também ocorre devido ao metabolismo do ácido
araquidônico, sendo o mesmo liberado a partir da membrana fosfolipídica das plaquetas pela
ativação da enzima fosfolipase A2 e, subseqüentemente, a enzima cicloxigenase (COX-1) converte
o ácido araquidônico em endoperóxidos cíclicos. Esses são então convertidos pela tromboxano
sintetase à tromboxano A2 (TXA2), funcionando como um potente agonista que induz a agregação
(BERNARDI E MOREIRA, 2004)
A agregação plaquetária é um teste que avalia a função das plaquetas pela exploração de
diferentes vias de ativação plaquetária in vitro, quando um plasma citratado rico em plaquetas

28
(PRP) é continuamente agitado, por uma pequena barra de metal (stir) ou imã, em um aparelho
denominado agregômetro. Esse aparelho mede uma combinação de absorção e dispersão de luz,
tendo-se hoje aparelhos que permitem tanto medições nefelométricas, que se baseia na diminuição
da intensidade pela difusão da luz, quanto turbidimétricas, método de medida da redução da
transmissão de luz em um meio causado pela formação de partículas (MATTHEW et al., 2007).
O ensaio de agregação plaquetária medido no agregômetro constitui um processo no qual se
registra alterações na transmissão da luz, pois, ao adicionar agentes agonistas, tem-se um
decréscimo da mesma devido à mudança na forma das plaquetas, que passam de discóides a
esféricas. Isto é seguido de um aumento gradual na transmissão de luz, devido à agregação das
plaquetas, o que torna o meio mais translúcido. Este teste é válido para mostrar problemas na
hemostasia primária, quando se suspeita da história clínica do paciente e na presença de um
prolongamento do tempo de sangramento (ZUCKER, 1989; BITHELL, 1998; BERNARDI E
MOREIRA, 2004).
Não existe um teste laboratorial padrão, que possa ser utilizado como teste ideal para
avaliação da antiagregação plaquetária determinada pela aspirina ou outros agentes antiplaquetários.
Os testes laboratoriais utilizados para avaliação da ação da aspirina nas plaquetas avaliam a função
(in vivo) e a agregação plaquetária (ex vivo). Os principais testes de avaliação da ação da aspirina in
vivo são: nível urinário do TXB2, quantificação da expressão da P selectina e da P selectina solúvel.
Os principais testes que avaliam a ação da aspirina na agregação plaquetária (ex vivo) são: teste de
avaliação ótica da agregação plaquetária (AOAP), analisador da função plaquetária (AFP), teste de
verificação rápida da ação da aspirina (VRAA) e tromboelastograma (OLIVEIRA et al., 2010).
A agregometria por transmissão de luz, empregando o método turbidimétrico, representa o
método mais bem estudado e permite diversas variações no protocolo experimental, tais como o uso
de diferentes agonistas em diferentes concentrações. Contudo, é um método que possui limitações
quanto à rapidez da realização do teste e requer análise adequada dos resultados obtidos na clínica
(SILVA SOARES, DA et al., 2010).

29
2. OBJETIVOS
2.1. OBJETIVO GERAL
O objetivo deste trabalho é determinar um protocolo para monitorar a atividade de fármacos
convencionais e identificar potenciais protótipos antitrombóticos (derivados N-acilhidrazônicos)
através de técnicas laboratoriais de avaliação do sistema hemostático (coagulação e atividade
plaquetária) empregados na rotina de análises clínicas, gerando assim um perfil comparativo com o
padrão observado em pacientes sob terapia antitrombótica monitorados na rotina hospitalar.
2.2. OBJETIVOS ESPECÍFICOS
Determinar a adequabilidade das técnicas laboratoriais de tempo de tromboplastina parcial
ativada (TTPA) e tempo de protrombina (TP) para estabelecer o perfil anticoagulante in
vitro dos controles heparina e argatroban.
Determinar a adequabilidade da técnica laboratorial de agregação plaquetária in vitro para
estabelecer o perfil antiplaquetário do controle aspirina.
Determinar a adequabilidade das técnicas laboratoriais para estabelecer o perfil anticoagulante
e antiplaquetário de novos compostos N-acilhidrazônicos (2a, 2c, 2e, 2g e 2h).
Avaliar a eficiência do protocolo a partir de uma análise comparativa entre os fármacos
convencionais e novos compostos.

30
3. MATERIAL E MÉTODOS
3.1. CASUÍSTICA
3.1.1. PLANEJAMENTO
Para a padronização do monitoramento do perfil antitrombótico de um composto,
inicialmente, determinamos critérios com base nos fármacos de mercado no sentido de traçar um
panorama em relação ao rastreamento destes através dos testes laboratoriais. Desta forma, para o
monitoramento comparativo de um determinado derivado por estas metodologias, o mesmo deve
funcionar como inibidor direto das proteínas envolvidas no mecanismo de agregação plaquetária
(ex.: ácido acetil salicílico) ou como inibidor direto das proteínas e fatores envolvidos na cascata de
coagulação (ex.: argatroban), bem como, potencializador de inibidores naturais da coagulação (ex.:
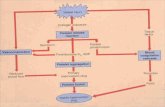
heparina). Os testes ocorreram seguindo o fluxograma representado pela figura 5.
O fator de exclusão para utilização desse protocolo é se os derivados tiverem ação inibitória
sob a síntese de proteínas e/ou componentes ligados a coagulação ou agregação plaquetária que
dependam de uma etapa metabólica (ex.: varfarina), que não poderão ter sua atividade detectada
nessa proposta metodológica.
3.1.2. AMOSTRA DO ESTUDO
Para a realização dos testes de tempo de protrombina e tromboplastina parcial ativada foram
utilizados pools de plasma citratado pobre em plaqueta contendo seis (6) amostras de pacientes do
Hospital Universitário Antônio Pedro e doadores saudáveis que não apresentavam distúrbios no
sistema hemostático e cujo INR expresso no coagulograma, fosse igual ou inferiores a 1,3.

31
Figura 6: Fluxograma dos testes realizados com fármacos de mercado com perfil anticoagulante (heparina e
argatroban), antiplaquetário (Aspirina) e os novos derivados N-acilhidrazônicos (2a, 2c, 2e, 2g e 2h). TTPA: Tempo de tromboplastina parcial ativada; TP: Tempo de protrombina: AA: Ácido Araquidônico; ADP: Adenosina
Difosfato; EPI: Epinefrina; COL: Colágeno.

32
No caso dos experimentos de agregação plaquetária, foram utilizadas amostras de plasma rico
em plaqueta de doadores voluntários da comunidade da Universidade Federal Fluminense após
esclarecimentos acerca do projeto e assinatura do termo livre esclarecido como determinado pelo
projeto submetido ao comitê de ética.
3.1.2.1. Critérios de inclusão de voluntários
Serem maiores de 18 anos;
Apresentarem coagulograma dentro dos valores de referência com INR ≤ 1,3.
3.1.2.2. Critérios de exclusão de voluntários
Pacientes/Doadores em uso de anticoagulantes e antiplaquetários
Pacientes/Doadores com qualquer distúrbio do sistema hemostático;
Apresentarem coagulograma com INR > 1,3.
3.1.3. LOCAL DOS TESTES
A seleção dos pacientes e a realização de alguns testes aconteceram no Laboratório de
Hematologia do Hospital Universitário Antônio Pedro (HUAP) e Laboratório de Antibióticos,
Bioquímica, Ensino e Modelagem Molecular (LABIEMOL) da Universidade Federal Fluminense
localizado no campus do Valonguinho. Os testes definitivos foram realizados no LABIEMOL.
3.1.4. CUIDADOS ÉTICOS
O estudo foi submetido ao Comitê de Ética em Pesquisa da Faculdade de Medicina e do
Hospital Universitário Antônio Pedro/HUAP da Universidade Federal Fluminense, de acordo com a
resolução 196/96 do Ministério da Saúde. Aprovado em dezembro de 2007 sob o número 153/07.
Em 04/07/2008, foi aprovado um adendo para utilização de pool de plasma de descarte do
Laboratório de Hematologia do HUAP, bem como um novo projeto que engloba o atual trabalho e
fornece suporte as atividades desenvolvidas.

33
3.2. METODOLOGIA
3.2.1 ENSAIOS DE AGREGAÇÃO PLAQUETÁRIA
As amostras de sangue humano foram obtidas de voluntários adultos, saudáveis, de ambos os
sexos, na faixa etária de 21 a 35 anos, sem uso de medicamentos ou outras substâncias que possam
interferir no experimento pelo período mínimo de 15 dias.
O sangue foi coletado por punção venosa da veia braquial média, com auxílio de scalp 21 e
seringa de 20 ml, em citrato 3,8%, na proporção de 9 volumes de sangue para 1 volume de citrato.
O plasma rico em plaquetas (PRP) foi preparado por centrifugação do sangue total em 1000 rpm
por 12 minutos enquanto o plasma pobre em plaquetas (PPP) foi obtido por centrifugação do PRP a
4000 rpm por 10 minutos.
A aspirina (100 µg/mL), os derivados N-acilhidrazônicos (100 µg/mL) (JORDÃO, 2009), o
controle negativo (NaCl 0,15 M) e o veículo empregado (DMSO) foram pré-incubados por 2
minutos com o PRP antes da adição do agente agregante (ácido araquidônico 10 µM, ADP 10 µM,
epinefrina 0,3 µM e colágeno 3 µg/mL) . A concentração de DMSO na amostra não ultrapassou o
limite de 1%. Os testes de agregação plaquetária foram realizados pelo menos três vezes em
duplicata e os dados foram analisados estatísticamente.
3.2.2. ENSAIOS ANTICOAGULANTES
Os laboratórios clínicos avaliam a função dos dois componentes da via de coagulação através
de dois ensaios-padrão: tempo de protrombina (TP) e o tempo de tromboplastina parcial ativada
(TTPA).
As amostras de sangue foram coletadas do Hospital Universitário Antônio Pedro utilizando
como anticoagulante o citrato de sódio tamponado 3,8% ou 3,2% na proporção 1:10 (ex: 5mL de
sangue utilizar 500μL de citrato), e centrifugadas a 4000 rpm por 10 minutos.
O plasma foi isolado e transferido para um tubo plástico dentro de no máximo 60 minutos e
direcionado para realização dos experimentos no tempo máximo de 2 horas. Caso fosse impossível
a realização dos testes o plasma era armazenado e congelado em tubos falcon para uso posterior.

34
3.2.2.1. Tempo de tromboplastina parcial ativada (TTPA)
Os ensaios serão realizados no analisador de coagulação Coab Lab IV – Labor Lab®
seguindo o seguinte protocolo (MARTINICHEN-HERRERO et al. 2005).
Inicialmente o reagente aPTT-EA (Cefalina 1,2 mg/mL e Sílica 1mg/mL) foi agitado e
aquecido a 37ºC. Em seguida 97 µL de PPP mais 3 µL de heparina (0,25, 0,5, 1 UI/mL), argatroban
(2 µg/mL, 5 µg/mL e 10 µg/mL), derivados N-acilhidrazônicos (10 µg/mL, 50 µg/mL e 100
µg/mL), NaCL (0,15 M) ou veículo empregado (DMSO 1%) foram incubados e aquecidos a 37ºC
por 2 minutos. Foi então adicionado 100 µL aPTT-EA pré-aquecido e essa amostra tornou a ser
incubada por 2-3 minutos a 37ºC. Após o período de incubação foi adicionado 100 µL de cloreto de
cálcio 0,025M pré-aquecido a 37ºC e iniciou-se a contagem do tempo. Após a formação do coagulo
o tempo foi anotado. Os testes foram realizados em duplicata.
3.2.2.2. Tempo de protrombina (TP)
Os ensaios serão realizados no analisador de coagulação Coab Lab IV – Labor Lab®
seguindo o seguinte protocolo (MARTINICHEN-HERRERO et al. 2005)
Inicialmente o reagente TeClot PT (Tromboplastina 2,5mg/mL e CaCl2 0,025M) foi agitado e
aquecido a 37ºC. Em seguida 97 µL de PPP mais 3 µL de heparina (0,25, 0,5, 1 UI/mL), argatroban
(2 µg/mL, 5 µg/mL e 10 µg/mL), derivados N-acilhidrazônicos (10 µg/mL, 50 µg/mL e 100
µg/mL), NaCL (0,15 M) ou veículo empregado (DMSO 1%) foram incubados e aquecidos a 37ºC
por 2 minutos. Foi então adicionado 100 µL de PBS pré-aquecido e essa amostra tornou a ser
incubada por 2-3 minutos a 37ºC. Após o período de incubação foi adicionado 100 µL TeClot PT
pré-aquecido ao plasma e iniciou-se a contagem do tempo. Após a formação do coagulo o tempo foi
anotado. Os testes foram realizados em duplicata.
3.2.3. ANÁLISE ESTATÍSTICA
Para a análise estatísticas foi realizada utilizando o software SPSS 14.0 para Windows
aplicando-se o teste ANOVA, e na seqüência o teste de Tukey. Sendo um valor de p<0,05
considerado significante. Todos os resultados foram expressos como a média ± desvio padrão.

35
4. RESULTADOS
4.1. DETERMINAÇÃO DOS ENSAIOS ANTITROMBÓTICOS IN VITRO UTILIZANDO
FÁRMACOS CONVENCIONAIS (CONTROLES) – ETAPA 1
4.1.1. COAGULAÇÃO
4.1.1.1 Heparina – potencializador de antitrombina
O teste de tempo de tromboplastina parcial ativada foi capaz de detectar a atividade
anticoagulante da heparina (0,25 UI/mL = 137 segundos; 0,5 UI/mL > 300 segundos; 1 UI/mL >
300 segundos) sendo esses resultados estatisticamente significativos (p<0,05) em relação aos
controles negativos cloreto de sódio 0,15 M (NaCl 0,15 M) e dimetilsulfóxido 1% (DMSO 1%) (24
e 28 segundos respectivamente) (Gráfico 1).
Na avaliação do perfil antitrombótico da heparina, através do teste de tempo de protrombina,
(Gráfico 2) (0,25 UI/mL = 17 segundos; 0,5 UI/mL = 17 segundos; 1 UI/mL = 18 segundos), não
se verificou atividade anticoagulante estatisticamente significativa em nenhuma das concentrações
quando comparado com os controles negativos NaCl 0,15 M e DMSO 1% (16 segundos).
4.1.1.2. Argatroban – inibidor direto de trombina
Em relação ao argatroban pode-se observar que, por meio do teste de tempo de tromboplastina
parcial ativada, é possível detectar a sua atividade anticoagulante (2 µg/mL = 66 segundos; 5 µg/mL
= 98 segundos; 10 µg/mL = 146 segundos) tendo esses resultados significância estatistica (p<0,05)

36
em relação aos controles negativos NaCl 0,15 M e DMSO 1% (24 segundos e 28 segundos
respectivamente) (Gráfico 3).
0
50
100
150
200
250
300
350
NaCl 0,15 M DMSO 1% 0,25 UI/mL 0,5 UI/mL 1 UI/ mL
Tem
po
de
co
agu
laçã
o
(s)
TTPA HEPARINA
Gráfico 1: Avaliação da atividade antitrombótica da Heparina 0,25 UI/mL, 0,5 UI/mL e 1 UI/mL utilizando o ensaio de
tempo de tromboplastina parcial ativada. (*p<0,05 ANOVA oneway; Tukey Test).
0
5
10
15
20
NaCl 0,15 M DMSO 1% 0,25 UI/mL 0,5 UI/mL 1 UI/ mL
Tem
po
de
co
agu
laçã
o
(s)
TP HEPARINA
Gráfico 2: Avaliação da atividade antitrombótica da Heparina 0,25 UI/mL, 0,5 UI/mL e 1 UI/mL utilizando o ensaio de
tempo de protrombina. (*p<0,05 ANOVA oneway; Tukey Test).
*
* *

37
0
20
40
60
80
100
120
140
160
180
NaCl 0,15 M DMSO 1% 2 µg/mL 5 µg/mL 10 µg/mL
Te
mp
o d
e c
oa
gu
laçã
o
(s)
TTPA ARGATROBAN
Gráfico 3: Avaliação da atividade antitrombótica do Argatroban 2 µg/mL, 5 µg/mL e 10 µg/mL utilizando o ensaio de
tempo de tromboplastina parcial ativada. (*p<0,05 ANOVA oneway; Tukey Test).
O teste de tempo de protrombina (Gráfico 4) foi também capaz do detectar a atividade do
argatroban (2 µg/mL = 41 segundos; 5 µg/mL = 72 segundos; 10 µg/mL = 119 segundos). Na
Análise estatística todas as concentrações apresentaram significância quando comparado com os
controles negativos NaCl 0,15 M e DMSO 1% (16 segundos).
0
20
40
60
80
100
120
140
NaCl 0,15 M
DMSO 1% 2 µg/mL 5 µg/mL 10 µg/mL
Tem
po d
e co
agul
ação
(s)
TP ARGATROBAN
Gráfico 4: Avaliação da atividade antitrombótica do Argatroban 2 µg/mL, 5 µg/mL e 10 µg/mL utilizando o ensaio de
tempo de protrombina. (*p<0,05 ANOVA oneway; Tukey Test).
*
*
*
*
*
*

38
4.1.2. AGREGAÇÃO PLAQUETÁRIA
4.1.2.1. Aspirina – inibidor de COX
Em relação aos ensaios de agregação plaquetária, foi possível verificar que essas técnicas
são capazes de detectar a atividade antiplaquetária da aspirina frente aos agonistas ácido
araquidônico 10µM (AA), adenosina difosfato (ADP) 10µM, epinefrina 0,3µM (EP) (inibição da
agregação 93%, 20% e 93% respectivamente) e colágeno 3 µg/mL (COL) (inibição da taxa de
agregação 86%) (Gráfico 5).
Os agonistas ácido araquidônico, ADP e epinefrina foram avaliados determinando-se a
percentagem de inibição da agregação causada pelos antiplaquetários testados enquanto que para o
colágeno foi avaliada a taxa de agregação calculada pelo “slope”, uma função que correlaciona %
de agregação pelo tempo.
0%
20%
40%
60%
80%
100%
120%
AAS 100 µg/mL
% d
e In
ibiç
ão d
a A
greg
ação
a /Ta
xa d
e ag
rega
ção
b
Agregação plaquetária AAS
AA
ADP
EP
COL
Gráfico 5: Avaliação da atividade antiplaquetária da aspirina (AAS: Ácido Acetil Salicílico 100µg/mL) através da
análise da inibição de agregação do Acido araquidônico (AA), ADP, Epinefrina (EP) e da taxa de agregação (%) do
Colageno (COL). (*p<0,05 ANOVA oneway; Tukey Test).
*
*
* *

39
4.2. ENSAIOS ANTITROMBÓTICOS IN VITRO COM NOVOS DERIVADOS N-
ACILHIDRAZÔNICOS – ETAPA II
4.2.1 COAGULAÇÃO
Os ensaios antitrombóticos através do teste de tempo de trombloplastina parcial ativada para
os derivados N-acilhidrazônicos nas concentrações de 10 µg/mL, 50 µg/mL e 100 µg/mL não
apresentaram um perfil de atividade anticoagulante estatisticamente significativo (p<0,05), sendo
seus valores equiparáveis com os controles utilizados negativos (NaCl 0,15 M = 30s e DMSO 1% =
35s respectivamente) (Gráfico 6).
Gráfico 6: Avaliação da atividade anticoagulante dos derivados N-acilhidrazônicos (2a, 2c, 2e, 2g e 2h) através dos
ensaios de tempo de tromboplastina parcial ativada (TTPA). (*p<0,05 ANOVA oneway; Tukey Test).
Os derivados N-acilhidrazônicos não apresentaram perfil anticoagulante estatisticamente
significativo (p<0,05) para os testes de tempo de protrombina, semelhantemente ao TTPA, sendo
seus valores equiparáveis ao dos controles negativos NaCl 0,15 M (15 segundos) e DMSO 1% (15
segundos) (Gráfico 7).

40
0
5
10
15
20
Tem
po
de
co
agu
laçã
o
(s)
TP NAH
10µg/mL
50µg/mL
100µg/mL
Gráfico 7: Avaliação da atividade anticoagulante dos derivados N-acilhidrazônicos (2a, 2c, 2e, 2g e 2h) através dos
ensaios de tempo de protrombina (TP). (* p<0,05 ANOVA oneway; Tukey Test).
4.2.2 AGREGAÇÃO PLAQUETÁRIA
Os ensaios de agregação plaquetária foram capazes de detectar a atividade antiplaquetária dos
derivados N-acilhidrazônicos frente aos agonistas ácido araquidônico, ADP, epinefrina e colágeno.
Cada um dos derivados apresentou um diferente perfil inibitório frente aos agonistas, sendo seu
valores representados no gráfico 8. De acordo com nossos resultados o derivado 2a proporcionou a
maior inibição da agregação plaquetária pelo ADP (94 %), diferente dos derivados 2c, 2e e 2h que
inibiram de maneira mais evidente a agregação induzida pelo acido araquidônico (100%). Os
derivados 2a, 2e, 2g e 2h inibiram a agregação pela epinefrina em 81%, 81%, 82% e 95%
respectivamente, tendo o derivado 2c proporcionado a menor inibição (12%). Para o colágeno
tivemos inibição da taxa de agregação diferente entre os derivados, sendo o 2a de 55%, 2c de 32%,
2e de 68%, 2g de 7% e 2h de 29%.

41
0%
20%
40%
60%
80%
100%
120%
2a 2c 2e 2g 2h
% d
e In
ibiç
ão d
a A
gre
gaçã
o/T
axa
de
agre
gaçã
oAgregação plaquetária NAH
AA
ADP
EP
COL
Gráfico 8: Avaliação da atividade antiplaquetária dos derivados N-acilhidrazônicos (2a, 2c, 2e, 2g e 2h) através da
análise da inibição de agregação do Ácido araquidônico (AA), ADP, Epinefrina (EP) e da taxa de agregação (%) do
Colageno (COL). (*p<0,05 ANOVA oneway; Tukey Test).
*
*
*
*
*
* *
*
*
*
*
*
*
* *
*
*

42
5. DISCUSSÃO
A literatura descreve diversos casos de aumento no risco de sangramento gastrointestinal em
pacientes que fazem uso de aspirina. A utilização da heparina por longos períodos também leva ao
sangramento, seguido de plaquetopenia e outros efeitos adversos como osteoporose, no uso por
longo prazo, hipersensibilidade e necrose de pele (ALMEIDA CHAVES, DE et al., 2010). Assim,
os testes laboratoriais em análises clínicas, utilizados para o monitoramento de pacientes sob terapia
antitrombótica, se fazem necessários, uma vez que, os tratamentos podem necessitar de ajustes na
dosagem para que os pacientes usufruam dos benefícios advindos dessas terapias, sem correr os
riscos causados pelas reações adversas desses fármacos.
Dentre os testes de monitoramento da coagulação, os mais empregados nas rotinas
hospitalares são o tempo de protrombina (TP) e o tempo de tromboplastina parcial ativada (TTPA),
tendo um papel fundamental no rastreamento de fármacos convencionais usados para terapia
antitrombótica como a heparina e o argatroban. Esses testes são capazes não só de detectar as
anormalidades relacionadas aos fatores da coagulação nas vias extrínseca e intrínseca como também
a atividade dos anticoagulantes sob essas vias (RIZZATTI; FRANCO, 2001).
No caso da heparina, um dos anticoagulantes mais utilizados para o tratamento e prevenção de
quadros de trombose venosa, o teste mais indicado para o monitoramento de pacientes é o TTPA
(CLÉ et al., 2010). Segundo o protocolo de heparinização do Hospital Israelita Albert Einstein a
anticoagulação através da heparina é realizada mantendo os níveis plasmáticos deste fármaco dentro
de uma faixa terapêutica de 0,35 UI/mL à 0,75 UI/mL, gerando um aumento nos valores de TTPA
(61 a 85 segundos) (PROTOCOLO HEPARINA, 2011).
Nos testes de TTPA e TP realizados no presente estudo utilizamos heparina em três diferentes
concentrações (0,25 UI/mL, 0,5 UI/mL e 1 UI/mL) a fim de rastrearmos essa faixa terapêutica e
testarmos a sensibilidade desses testes para fins comparativos. O resultado de TTPA da heparina
mostrou que o teste selecionado em nosso protocolo é capaz de rastrear este fármaco nas

43
concentrações propostas. A análise da razão entre o tempo de coagulação da heparina 0,25 UI/mL e
o tempo basal no TTPA, representado pelo controle NaCl 0,15 M, indica uma razão de 5,7
demonstrando uma alta concentração de heparina no plasma, uma vez que a faixa de controle são
razões entre 1,5 e 2,5 (CLÉ et al., 2010; RASCHKE et al., 1996).
De forma importante, os valores de tempo de coagulação observados (heparina 0,25 UI/mL –
137 segundos) no TTPA indicam na clínica altos níveis plasmáticos de heparina, sendo necessária a
suspensão da infusão e a realização de um novo monitoramento, horas depois, para o
acompanhamento e estabilização da faixa terapêutica (PROTOCOLO HEPARINA; VOLSCHAN,
2001).
No teste de TP as concentrações de heparina rastreadas não causaram grandes variações no
tempo de coagulação quando comparadas aos controles, demonstrando que a heparina expressa um
perfil diferente no TP, apresentando uma dose resposta diferente e uma menor atividade
anticoagulante sob o teste que avalia a via extrínseca da coagulação. Isto se deve ao mecanismo
fisiológico da coagulação, onde a antitrombina III, quando potencializada pela heparina, exerce uma
maior ação catalítica sob a trombina e em uma menor escala também sob outras proteases da via
intrínseca da coagulação, os fatores XIIa, XIa, Xa, IXa e calicreína, com esses fatores também
sendo afetados temos o prolongado do tempo no teste de TTPA.
Na via extrínseca, somente na presença de heparina, a antitrombina III expressa uma ação
inibitória sob o fator VIIa, porém a sua taxa de inibição é muito lenta o que torna a antitrombina III
pouco eficaz para o controle fisiológico dessa via, na presença ou ausência da heparina, fazendo
com que o tempo no teste de TP não seja prolongado como foi visto no TTPA (WUN, 1992).
Devido a esse fato o TTPA é um dos testes mais indicados para o monitoramento da terapia com
heparina.
Já o argatroban, um inibidor direto da trombina usado como anticoagulante na profilaxia e
tratamento de complicações tromboembólicas, atinge concentrações plasmáticas de até 2 µg/mL,
com doses de infusão de até 10 µg/kg por minuto. Estudos recentes mostram que o monitoramento
através dos testes de TTPA e TP são usados na clínica, porém não são capazes de detectar
corretamente uma relação dose resposta proporcional quando em baixas doses (0 à 4 µg/mL). Seu
monitoramento na clínica é realizado através do TTPA e seu valor deve ser de 1,5 a 3,0 vezes o
valor do TTPA basal, mas não deve exceder 100 segundos (IVANDIC; ZORN, 2011).
Em nosso estudo, para este fármaco, o resultado de TTPA (Gráfico 3) demonstra que a
concentração de 2 µg/mL está dentro da faixa terapêutica aceitável (razão entre 1,5 a 3,0 ou tempo

44
inferior a 100 segundos), tanto no tempo (66 segundos), quanto na razão (razão = 2,75). A
concentração de 5 µg/mL apesar de não exceder o tempo (98 segundos) apresentou uma razão a
cima da faixa terapêutica (razão = 4,0), assim como a concentração de 10 µg/mL (razão = 6,0). O
TP (Gráfico 4) apresentou razões de 2,6 (2 µg/mL), 4,5 (5 µg/mL) e 7,4 (10 µg/mL) e esses
resultados juntamente com o TTPA comprovam que a dose resposta não segue um padrão de
proporcionalidade, sendo esse fato, como supracitado, condizente com a literatura. Desta forma os
testes propostos utilizando nosso protocolo tem responsividade semelhante ao monitoramento para
anticoagulação visto na clinica.
Os derivados N-acilhidrazônicos não apresentaram um perfil de atividade anticoagulante
detectável através dos testes de TTPA e TP, portanto é possível inferir que estes não interferem de
maneira direta e significativa sob os fatores da coagulação. No entanto, alguns trabalhos
demonstram que novos derivados acilhidrazonicos, planejados por modificação de inibidores
diretos de trombina, são capazes de inibir a trombina nos ensaios de agregação plaquetária, porém
não mostram resultados em relação a coagulação (LIMA, L. M. et al., 2008). Por outro lado,
existem trabalhos que mostram os derivados acilhidrazônicos sendo capazes de prolongar o tempo
nos testes de TP e TTPA, demonstrando portanto ser possível o rastreamento de novos derivados
por esses testes (FRATTANI, F., 2009).
Atualmente não há consenso quanto ao método laboratorial aceito para avaliação ex vivo da
função plaquetária ou para a determinação do grau de ativação plaquetária após o tratamento com
os medicamentos antiplaquetários. Um grande problema é a falta de um método simples, seguro, de
baixo custo e de fácil reprodutibilidade que permita a avaliação da atividade plaquetária e que possa
ser utilizada na prática diária, da mesma forma que testes para controle das doses administradas de
anticoagulantes (SILVA SOARES, DA et al., 2010).
Estudos recentes mostram que existe muita discordância entre autores em relação as análises
realizadas pelo métodos turbidimétricos na clínica, principalmente, devido a falta de padronização
para emprego dessa técnica no monitoramento de pacientes sob uso da terapia antiplaquetária, a
ampla faixa terapêutica empregada em estudos clínicos e os diferentes perfis de inibição quando
comparados com outras técnicas (impedância elétrica) utilizando a mesma concentração do
antiplaquetário, porém uma vez estabelecidos certos padrões os ensaios se tornam muito confiáveis
(SILVA, L. L. DA; D’AMICO, 2010; VICENTE et al., 2009). Porém um estudo realizado com
pacientes que ingeriam 100 mg/dia de aspirina em diversos intervalos de tempo demonstrou que os
testes in vitro de agregação plaquetária, realizados com o agonista ácido araquidônico, tiveram sua

45
agregação máxima reduzida, apresentando uma inibição de 90% da agregação, sendo valor
compatível com o encontrado em nossos testes (PULCINELLI et al., 2004).
Neste estudo, o monitoramento através dos ensaios de agregação plaquetária por turbidimetria
utilizando nosso protocolo foram capazes de detectar a influência inibitória do ácido acetil salicílico
no mecanismo de ativação plaquetária. A aspirina na concentração de 100 µg/mL apresentou um
perfil inibitório significativo nas vias ativadas pelos agonistas AA (93%), EP (91%) e COL (86%)
tendo um menor efeito sob a via do ADP (20%). De acordo com a literatura, essa menor atividade
inibitória na via do ADP ocorre, pois a aspirina inibe a agregação na via do ADP dependendo da
sua concentração em relação ao agonista, ou seja, concentrações altas de ADP (10 µM) impedem a
atividade plena desse fármaco (DOBACZEWSKI et al., 2008).
De acordo com Jordão e colaboradores (2009), as análises realizadas sob os derivados N-
acilhidrazônicos sintetizados (2a, 2c, 2e, 2g e 2h) mostraram que os compostos são potencialmente
capazes de inibir as vias do ácido araquidônico, da adrenalina e do ADP, apresentando então um
perfil antiplaquetário (JORDÃO et al., 2009).
Os testes de agregação plaquetária realizados para os novos derivados N-acilhidrazônicos
utilizando nosso protocolo demonstram que esses compostos são capazes de inibir as vias de
ativação da agregação plaquetária, sendo passíveis de rastreamento por essa técnica. Os derivados
apresentam um perfil inibitório diferente para cada um dos agonistas plaquetários. Alguns
compostos (2c, 2e e 2h) apresentam um perfil inibitório para o ácido araquidônico semelhante ao da
aspirina na mesma concentração (100 µg/mL), permitindo inferir possíveis mecanismos de ação
envolvendo a via do ácido araquidônico.
Outros derivados apresentaram um perfil inibitório diferente do AAS, como o derivado 2g,
que foi capaz de inibir de maneira mais expressiva a via da epinefrina, ou o derivado 2a, que apesar
da não especificidade por uma das vias, inibiu de maneira mais expressiva a via de ativação pelo
ADP.

46
6. CONCLUSÃO
O monitoramento realizado através da metodologia proposta que abrange as técnicas
laboratoriais de tempo de tromboplastina parcial ativada (TTPA) e tempo de protrombina
(TP) são capazes de rastrear a ação anticoagulante de fármacos convencionais como
heparina e argatroban em suas diferentes concentrações, permitindo assim, traçar um perfil
de atividade in vitro dos mesmos, o qual é equivalente ao visto na prática clinica, podendo
ser aplicada para determinar o perfil de outros compostos como os N-acilhidrazônicos (2a,
2c, 2e, 2g e 2h) que aparentemente não interferem na coagulação.
A metodologia empregada para o monitoramento da atividade antiplaquetária realizada pela
técnica laboratorial de agregação plaquetária permitiu rastrear fármacos convencionais como
o ácido acetil salicílico, assim como novos antiplaquetários como os derivados N-
acilhidrazônicos (2a, 2c, 2e, 2g e 2h) que apresentaram um perfil antiplaquetário semelhante
ao da aspirina.
Esse estudo demonstra que é possível determinar o perfil antitrombótico de novos derivados
que se encontram em fase pré-clínica através de técnicas laboratoriais utilizadas na rotina de
analises clínicas, indicando o protocolo utilizado como um guia em potencial para a
descoberta de novos antrombóticos .

47
7. ANEXO
TERMO DE CONSENTIMENTO LIVRE E ESCLARECIDO
Títulos do Projeto: Caracterização do perfil Antitrombótico e Toxicológico In Vitro de Novos Derivados
Sintéticos Pesquisadores Responsáveis: MSc. Plínio Cunha Sathler e Dr. Helena Carla Castro
Instituição a que pertence o pesquisador responsável: Laboratório de Antibióticos, Bioquímica, Ensino e
Modelagem Molecular (LABiEMol-UFF)
Telefone para contato: Nome do Voluntário: Idade: R.G.:
O Sr(ª) está sendo convidado(a) a participar do projeto de pesquisa “Caracterização do perfil
Antitrombótico e Toxicológico In Vitro de Novos Derivados Sintéticos”, conduzida Laboratório de
Antibióticos, Bioquímica, Ensino e Modelagem Molecular (LABiEMol-UFF) Este estudo tem como objetivo testar e entender a atividade de compostos sintéticos no processo
hemostático, afim de analisar o perfil antitrombótico e toxicológico in vitro dos mesmos.
O seu sangue será colhido em tubos de coleta contendo um anticoagulante para armazenamento sem
que haja formação de um coágulo. Este procedimento de coleta de sangue pode causar um ligeiro desconforto. O tubo contendo o seu sangue será destinado exclusivamente para ensaios realizados pelo nosso
laboratório onde testaremos compostos sintéticos para verificar como eles atuam na hemostasia.
O estudo pode gerar informações importantes no futuro quanto a possíveis medicamentos para o tratamento das doenças relacionadas à formação trombos indevidos que podem quadros de aterotrombose
e o tromboembolismo venoso.
Após essas informações o(a) senhor(a) concorda voluntariamente em participar do projeto, ciente que poderá retirar a sua autorização a qualquer momento, sem prejuízo algum para minha, ou sua relação
com o LaBiEMol-UFF ou mesmo para a pesquisa em si. Será mantido caráter confidencial dos seus dados
pessoais e que, se os resultados dos testes gerarem informações importantes para todos que atuem com estes
estudos, estas informações estarão autorizadas a ser apresentadas em congressos nacionais e internacionais e a publicações especializadas.
Eu,____________________________________________, RG nº________________declaro ter sido informado sobre os detalhes desta pesquisa, seus riscos e benefícios e concordo em participar
voluntariamente do projeto de pesquisa acima descrito, doando ao LaBiEoMol, minha amostra de sangue.
Niterói,____de___________de_____

48
____________________________ ____________________________ Nome e assinatura do doador Nome e assinatura do pesquisador responsável
____________________________ ___________________________ Testemunha Testemunha

49
8. REFERÊNCIAS BIBLIOGRÁFICAS
ALMEIDA CHAVES, D. S. DE; COSTA, S. S.; ALMEIDA, A. P. DE; et al. Metabólitos secundários de
origem vegetal: uma fonte potencial de fármacos antitrombóticos. Quim. Nova, v. 33, n. 1, p. 172–180, 2010.
ANDREWS, R. K. E BERNDT, M. C. Platelet physiology and thrombosis. Thrombosis Research, v. 114, n.
5-6, p. 447-453, 2004.
ANSELL, J.; HIRSH, J.; HYLEK, E. Pharmacology and management of the vitamin K antagonists:
American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest, v. 133, n. 6 Suppl, p. 160S-198S, 2008.
BAKER, D. C.; BRASSARD, J. Review of continuing education course on hemostasis. Toxicologic
Pathology, v. 39, n. 1, p. 281-288, 2011.
BARROSO, E.M.A. Efeito antitrombótico de uma fucana não anticoagulante extraída da alga Spatoglossum
Schroederi. Dissertação apresentada a Universidade Federal do Rio Grande do Norte pelo programa de pós-
graduação em ciências da saúde. 2008.
BATES, S.M; WEITZ, J.I. Emerging anticoagulant drugs. Arterioscler. Thromb. Vasc. Biol., 23:1491-1500, 2003.
BERNARDI, P.S.M. E MOREIRA, H. W. Analysis of the waves and aggregation patterns in patients with
cardiovascular diseases in using acetylsalicylic acid compared blood donors. Ver. Brás. Hematol. Hemoter.;26(4):239-244, 2004.
BITHELL T.C. Abordagem diagnóstica das desordens do sangramento. n: Lee GR, Bithell TC, Foerster J et
al. Wintrobe: hematologia clínica. São Paulo: Manole 1998d. v 2, cap. 48, p. 1.427-1.457, 1998.
BLANCO A.N, MESCHENGIESER S - Estandarizacion del control de la terapeutica com anticoagulantes
orales. Calibracion de tromboplastinas. In: Kordich LC, Avalos JCS, Vidal HO, Guerra CCC - Manual de
Hemostasia y Trombosis. 2nd ed. Grupo CLAHT; 155-61, 1990,
BRAUNWALD, E.; ANTMAN, E. M.; BEASLEY, J. W. ACC/AHA guidelines for the management of patients with unstable angina and non-ST-segment elevation myocardial infarction. A report of the American
College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee on the
Management of Patients With Unstable Angina). Journal of the American College of Cardiology, v. 36, n. 3, p. 970-1062, 2000.
CANOBBIO, I.; BALDUINI, C.; TORTI, M. Signalling through the platelet glycoprotein Ib-V-IX complex.
Cell. Signal. 16: 1329-1344, 2004.

50
CAPLAN, L.R.; FISHER, M. The endothelium, platelets, and brain ischemia. Rev. Neurol. Dis. 4(3):113-21,
2007.
CARLOS, M. M. L. E FREITAS, P. D. F. S. Estudo da cascata de coagulação sangüínea e seus valores de referência. Acta Veterinaria Brasílica, v.1, n.2, p.49-55, 2007
CASTRO, H.C.; FERREIRA, B.L.A.; NAGASHIMA T.; SCHUELER, A.; RUEFF, C. Plaquetas: ainda um
alvo terapêutico. J. Bras. Patol. Med. Lab. 42(5):321-332, 2006.
CIPRANDI, A; HORN, F; TERMIGNONI, C. Saliva de animais hematófagos: fonte de novos anticoagulantes. Rev. Bras. Hematol. Hemoter. [online], 25(4): 250-262, 2003
CLÉ, D. V.; GARCIA, A. A.; BRUNETTA, D. M.; SCHWARTZMANN, P. V.; MORIGUTI, J. C.
Anticoagulação em gulação em pacientes hospitalizados. Medicina (Ribeirão Preto), v. 43, n. 2, p. 107–17, 2010.
COTRAN R.S., KUMAR V., ROBBINS S.L., SCHOEN F.J. “Distúrbios hemodinâmicos, trombose e
choque”. In: COTRAN R.S., KUMAR V., ROBBINS S.L., SCHOEN F.J. (eds.). Patologia estrutural e
funcional. Rio de Janeiro: Guanabara Koogan; v. 1, pp. 84-110, 1996
CUNHA, A. C.; FIGUEIREDO, J. M.; TRIBUTINO, J. L. M.; MIRANDA, A. L. P.; CASTRO, H. C.;
ZINGALI, R. B.; FRAGA, C. A. M.; SOUZA, M. C. B. V.; FERREIRA, V. F.; BARREIRO, E. J.
Antiplatelet properties of novel N-substituted-phenyl-1,2,3-triazole-4-acylhydrazone derivatives. Bioorg. Med. Chem., 11, 2051, 2003.
DOBACZEWSKI, M.; GOLAŃSKI, J.; KOWALSKI, T. et al. Can we use adenosine diphosphate (ADP) to
study “aspirin resistance”? The Janus faces of ADP-triggered platelet aggregation. Pharmacological Reports: PR, v. 60, n. 3, p. 361-368, 2008.
ERIKSSON, B.I; DAHL, O.E; ROSENCHER, N; KURTH, A.A; VAN DIJK, C.N; FROSTICK, S.P;
PRINS, M.H; HETTIARACHCHI, R; HANTEL, S; SCHNEE, J; BÜLLER, H.R; RE-NOVATE STUDY
GROUP. Dabigatran etexilate versus enoxaparin for prevention of venous thromboembolism after total hip replacement: a randomised, double-blind, non-inferiority trial. Lancet, 370(9591):949-56, 2007.
EYRE L, GAMLIN F. Haemostasis, blood platelets and coagulation Anaesthesia & Intensive Care
Medicine, 11(6): 244-246, 2010.
FABRIS F, LUZZATTO G, STEFANI PM, GIROLAMI B, CELLA G, GIROLAMI A. Heparin-induced
thrombocytopenia. Haematologica ;85(1):72-81, 2000.
FLATO, U. A. P.; D’EVA, F. C.; FLATO, E. M. S. et al. Novas evidências em antitrombóticos na fibrilação atrial 2010New evidences in antithrombotics for atrial fibrillation 2010. Rev. Soc. Bras. Clín. Méd, v. 8, n. 2,
2010.
FRANCO, R. F. Fisiologia da coagulação, anticoagulação e fibrinólise. Medicina, Ribeirão Preto, v. 34, p.
229–237, 2001.
FRANCO, R. F.; REITSMA, P. H. Genetic risk factors of venous thrombosis. Human genetics, v. 109, n. 4,
p. 369–384, 2001.
FRATTANI, F. Caracterização Farmacológica e estudo do mecanismo de ação antihemostático de derivados acilhidrazônicos. Rio de janeiro: UFRJ, 2009.

51
GOODMAN E GILMAN. Coagulação sangüínea e anticoagulantes, trombolíticos e fármacos
antiplaquetários. As bases farmacológicas da terapêutica. 11ª ed., Rio de Janeiro: Editora Americana, 1321-
1341, 2006.
GRESELE, P. AND AGNELLI, G. Novel approaches to the treatment of thrombosis TRENDS in
Pharmacological Sciences 23 (1): 25-32, 2002.
GUYTON A.C. & HALL J.E.Tratado de Fisiologia Médica, 10 ed. Guanabara Koogan, Rio de Janeiro,
2002.
HAGEDORN I, VÖGTLE T, NIESWANDT B. Arterial thrombus formation. Novel mechanisms and targets
Novel mechanisms and targets. Hamostaseologie; 30(3):127-35, 2010.
HAMERSCHLAK N., ROSENFELD, L. G. M. H Utilização da Heparina e dos Anticoagulantes Orais na Prevenção e Tratamento da Trombose Venosa Profunda e da Embolia Pulmonar. Arq Bras Cardiol. volume
67, (nº 3), 1996.
HIRSH, J.; BAUER, K. A.; DONATI, M. B. et al. Parenteral anticoagulants: American College of Chest
Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest, v. 133, n. 6 Suppl, p. 141S-159S, 2008.
HOFFMAN, M; DOUGALD, M.M. A cell-based model of hemostasis. Thromb Haemost, 85: 958-965,
2001.
HURSTING, M. J.; ZEHNDER, J. L.; JOFFRION, J. L. et al. The international normalized ratio during
concurrent warfarin and argatroban anticoagulation: differential contributions of each agent and effects of the
choice of thromboplastin used. Clinical chemistry, v. 45, n. 3, p. 409, 1999.
INNERHOFER, P; KIENAST, J. Principles of perioperative coagulopathy. Best Practice & Research
Clinical Anaesthesiology, 24(1): 1–14, 2010.
IVANDIC, B.; ZORN, M. Monitoring of the anticoagulants argatroban and lepirudin: a comparison of
laboratory methods. Clinical and Applied Thrombosis/Hemostasis: Official Journal of the International Academy of Clinical and Applied Thrombosis/Hemostasis, v. 17, n. 5, p. 549-555, 2011.
JORDÃO, A. K.; FERREIRA, V. F.; LIMA, E. S. et al. Synthesis, antiplatelet and in silico evaluations of
novel N-substituted-phenylamino-5-methyl-1H-1, 2, 3-triazole-4-carbohydrazides. Bioorganic & medicinal chemistry, v. 17, n. 10, p. 3713–3719, 2009.
KREISNER, P.E. et al., Hemorragia causada por traumatismo em língua numa paciente sob uso de
anticoagulante oral: relato de caso. Rev Bras Cir Traumatol Buco-Maxilo; 1(1):26-9, 2004.
KUMAR, V.; ABBAS, A. K.; FAUSTO, N.; ASTER, J.C. Robbins E Cotran, Patologia – Bases Patológicas
das doenças 8ªEd. Tradução de Patrícia Dias Fernandes – Rio de Janeiro: Editora Elsevier, 2010.
LENSING A.W., PRANDONI P., PRINS M.H., BULLER H.R. Deep-vein thrombosis. Lancet, 353: 479-
485, 1999.
LIMA, L. M.; FRATTANI, F. S.; SANTOS, J. L. DOS; et al. Synthesis and anti-platelet activity of novel
arylsulfonate–acylhydrazone derivatives, designed as antithrombotic candidates. European Journal of
Medicinal Chemistry, v. 43, n. 2, p. 348-356, 2008.
MACKMAN, N. Triggers, targets and treatments for thrombosis. NATURE Vol 451 (21), 2008.

52
MAJERUS P.W., TOLLEFSEN D.M. Anticoagulantes, trombolíticos e fármacos antiplaquetários. In:
Hardman J.G., Limbird L.E. & Gilman A.G. Goodman & Gilman: as bases farmacológicas da terapêutica, 10
ed. McGraw Hill, Rio de Janeiro, 2003.
MARTINICHEN-HERRERO J.C., CARBONERO E.R., SASSAKI G.L., GORIN P.A., IACOMINI M.
Anticoagulant and antithrombotic activities of a chemically sulfated galactoglucomannan obtained from the
lichen Cladonia ibitipocae. Int. J. Biol. Macromol. 35(1-2):97-102, 2005.
MAVRAKANAS T., BOUNAMEAUX H. The potential role of new oral anticoagulants in the prevention and treatment of thromboembolism. Pharmacol. Ther.;130(1):46-58, 2011.
MAZZA, J.J.; YALE, S.H. New oral anticoagulants: a brief review. WMJ. ;108(2):84, 2009.
MATTHEW, R. P.; NAIF, Z. A. J.; MCPHERSON, R.; PINCUS, M. Henry’s Clinical Diagnosis and Management by Laboratory Methods. Henry’s Clinical Diagnosis and Management by Laboratory Methods,
2007.
MITCHELL, R. N. et al. Disfunções Hemodinâmicas, Doença Tromboembólica e Choque. Patologia- Bases
Patológicas das doenças. 7ª ed. Rio de Janeiro: Elsevier Editora, p.125-151, 2006.
MOSESSON, M. W. Update on antithrombin I (fibrin). Thrombosis and Haemostasis, 98: 105–108, 2007.
NICOLAU, J. C.; BARACIOLI, L. M. Prasugel, ticagrelor e antagonista do receptor da trombina nas
síndromes isquêmicas miocárdicas instáveis com e sem supradesnível do segmento ST; Prasugrel, ticagrelor and thrombin receptor antagonist in acute coronary syndromes. Rev. Soc. Cardiol. Estado de São Paulo, v.
20, n. 3, p. 397–404, 2010.
OLIVEIRA, D. C.; SILVA, R. F.; SILVA, D. J.; LIMA, V. C. Aspirin resistance: fact or fiction? Arquivos Brasileiros de Cardiologia, v. 95, n. 3, p. e91–e94, 2010.
PATRONO, C.; ROCCA, B. The future of antiplatelet therapy in cardiovascular disease. Annual review of
medicine, v. 61, p. 49–61, 2010.
PROTOCOLO HEPARINA. Hospital Israelita Albert Einstein. Disponível em: <http://medicalsuite.einstein.br/diretrizes/terapia_intensiva/heparina.pdf>. Acesso em: 25 nov. 2011.
PULCINELLI, F. M.; PIGNATELLI, P.; CELESTINI, A. et al. Inhibition of platelet aggregation by aspirin
progressively decreases in long-term treated patients. J Am Coll Cardiol, v. 43, n. 6, p. 979-984, 2004.
RANG H. P.; DALE, M.M.; RITTER, J. M. Hemostasia e trombose. Farmacologia. 4. ed. Rio de Janeiro:
Guanabara Koogan, 2001.RIBEIRO, L. R.; SALVADORI, D. M. F.; MARQUES, E. K. Mutagenese
Ambiental, Ulbra, 1ª Edição – 2003.
RASCHKE, R. A.; GOLLIHARE, B.; PEIRCE, J. C. The effectiveness of implementing the weight-based
heparin nomogram as a practice guideline. Archives of Internal Medicine, v. 156, n. 15, p. 1645-1649, ago
1996.
RIZZATTI, E. G.; FRANCO, R. F. Investigação diagnóstica dos distúrbios hemorrágicos. Medicina, v. 34, 2001.
RISZATTI, E.; FRANCO, R. Tratamento do tromboembolismo venoso-Simpósio Hemostasia e trombose.
Capitulo V, p. 269–275, 2003.

53
SANFORD, M; PLOSKER, G.L; Dabigatran etexilate. Drugs, 68(12):1699-709, 2008.
SHAH, I. KHAN, S. O. MALHOTRA, S.; FISCHELL, T. Eptifibatide: The evidence for its role in the
management of acute coronary syndromes. Core evidence, v. 4, p. 49, 2009.
SHULGA, O.; BORNSTEIN, N. Antiplatelets in Secondary Stroke Prevention. Frontiers in Neurology, v. 2,
2011.
SILVA SOARES, J. DA; BRITO, F. C. F. DE; PENA, F. M.; MESQUITA, E. T.; MEDINA-ACOSTA, E.
Aspectos Farmacogenéticos Associados à Resistência Terapêutica Antiplaquetária em Pacientes com Síndrome Coronariana Aguda. Editor da Revista, v. 23, n. 2, p. 131–142, 2010.
SILVA, L. L. DA; D’AMICO, E. A. Estudo comparativo entre agregação plaquetária por turbidimetria e
impedância elétrica em pacientes sob terapia antiplaquetária à base de ácido acetilsalicílico; Comparative study of platelet aggregation by turbidimetric and impedance methods in patients under acetylsalicylic acid
antiplatelet therapy. Rev. bras. hematol. hemoter, v. 32, n. 6, p. 463–468, 2010.
STEWART, L. C.; LANGTRY, J. A. A. Clopidogrel: mechanisms of action and review of the evidence
relating to use during skin surgery procedures. Clinical and experimental dermatology, v. 35, n. 4, p. 341–345, 2010.
SWENSON M.J. Circulação sanguínea e sistema cardiovascular. In: Swenson M.J. & Reece W.O. Dukes
Fisiologia dos Animais Domésticos, 11 ed. Guanabara Koogan, Rio de Janeiro, 1996.
THELWELL, C. Fibrinolysis standards: A review of the current status. Biologicals 38(4): 437-448, 2010.
TIMOTEO A.T E PAIS, M. J. Anticoagulacão na prática clínica. -2ª. parte: utilização das heparinas.
Medicina Interna. Vol. 5, N.4, 1998.
TING HJ, KHASAWNEH FT. Platelet function and Isoprostane biology. Should isoprostanes be the newest
member of the orphan-ligand family? J Biomed Sci.;17(1):24, 2010.
TSELEPIS, A. D. GEROTZIAFAS, G. ANDRIKOPOULOS, G. ANNINOS, H.; VARDAS, P. Mechanisms
of platelet activation and modification of response to antiplatelet agents. Hellenic Journal of Cardiology: HJC = Hellēnikē Kardiologikē Epitheōrēsē, v. 52, n. 2, p. 128-140, 2011.
TURPIE, A; ESMON, C. Venous and arterial thrombosis – pathogenesis and the rationale for
anticoagulation. Thromb Haemost, 105(4):586-96, 2011
ULRICHTS, H; SILENCE, K; SCHOOLMESTER, A; JAEGERE, P; ROSSENU, S; ROODT, J; PRIEM, S;
LAUWEREYS, M; CASTEELS, P, BOCKSTAELE, F. V; VERSCHUEREN, K; STENSSENS, P;
BAUMEISTER, J; HOLZ, J. B. Antithrombotic drug candidate ALX-0081 shows superior preclinical efficacy and safety compared to currently marketed antiplatelet drugs. Blood, Epub, 2011.
VICENTE, V.; LOZANO, M.; ROLDÁN, V.; RIVERA, J. Resistencia y variabilidad en la respuesta a
antiagregantes plaquetarios: diagnóstico, relevancia clínica y opciones terapêuticas, 2009.
VINE, A. K. Recent advances in haemostasis and thrombosis. Retina, v. 29, n. 1, p. 1-7, 2009.
VOLSCHAN, A. Tratamento anticoagulante do tromboembolismo pulmonar. Rev. SOCERJ, v. 14, n. 1, p.
63, 2001.
WARKENTIN, T.E. Agents for the Treatment of Heparin-Induced Thrombocytopenia. Hematol Oncol Clin North Am. 24(4):755-75, ix, 2010.

54
WEBER, R. WEIMAR, C.; DIENER, H. C. Antiplatelet agents in stroke prevention. Hämostaseologie, v. 29,
p. 326–333, 2009.
WEITZ, J.I. AND HIRSH, J. New anticoagulant drugs. Chest 119, 95S-107S, 2001.
WOHNER, N. Role of cellular elements in thrombus formation and dissolution. Cardiovasc Hematol Agents
Med Chem, 6(3):224-8. 2008.
WOLBERG, A .S.; CAMPBELL, R .A. Thrombin generation, fibrin clot formation and hemostasis. Transfus
Apher Sci. 38(1):15-23, 2008.
WORLD HEATLH ORGANIZATION (2009) WHO Health, Geneve: Site do WHO, http://www.who.int/en
acessado em fevereiro de 2011.
WUN, T. C. Lipoprotein-associated coagulation inhibitor (LACI) is a cofactor for heparin: synergistic anticoagulant action between LACI and sulfated polysaccharides. Blood, v. 79, n. 2, p. 430-438, 1992.
XIANG, Y.Z; XIA, Y; GAO, X.M; SHANG, H.C; KANG, L.Y; ZHANG, B.L. Platelet activation, and
antiplatelet targets and agents: current and novel strategies. Drugs, 68(12):1647-64, 2008.
YIP, J. et al. Primary platelets adhesion receptors. IUBMB Life, v. 57, n. 2, p. 103-8, 2005.
YOSHIDA W.B. O processo aterosclerótico: da disfunção endotelial à lesão complexa”. Sitrângulo CJ,
Kauffman P (eds.). Doença aterosclerótica periférica. São Paulo: BBS; v. 1, p. 27, 2004.
ZUCKER MB. Platelet aggregation measured by the photometric method. Methods Enzymol;(169):117-133, 1989.