Metais e metalurgia Capítulo 23 Fernando Seidi Sakashita nº:14445 Caio Kenji Hirose nº: 14429.
Transcript of Metais e metalurgia Capítulo 23 Fernando Seidi Sakashita nº:14445 Caio Kenji Hirose nº: 14429.

Metais e metalurgia Capítulo 23
Fernando Seidi Sakashita nº:14445
Caio Kenji Hirose nº: 14429

Introdução
Neste capítulo, vamos estudar como obtemos os metais a partir de suas fontes naturais, a ligação nos sólidos e como os metais e suas misturas (chamadas ligas) são empregadas na tecnologia moderna.

Distribuição
• Partes do nosso planeta• A maioria dos metais úteis não é encontrada em abundância na litosfera, a qual é de fácil acesso.

Minerais
• Com exceção do ouro e dos metais do grupo da platina, a maioria dos elementos metálicos é encontrada na natureza em compostos inorgânicos chamados minerais.
• Curiosidade: os nomes dos minerais são geralmente baseados nos locais onde eles foram descobertos.

Fontes de alguns metais

Metalurgia 1875
• designa um conjunto de procedimentos e técnicas para extração, fabricação, fundição e tratamento dos metais e suas ligas.
Metalurgia

Pirometalurgia
• É um processo metalúrgico que utiliza altas temperaturas para alterar o metal quimicamente para que no final se reduza a um metal livre
• Tipos:-Calcinação-Ustulação-Fusão

Calcinação
Alguns minérios se decompõem durante o aquecimento e acabam eliminando na maior parte das vezes H2O ou CO2.
A calcinação serve para eliminar o CO2, formando óxido metálico.
Exemplo: PbCO3(s) PbO(s) + CO2(g)

Ustulação
Consiste em aquecer um mineral de sulfeto na presença de gás oxigênio, convertendo o metal a óxido. A ustulação é conhecida também como "queima de sulfeto".
Exemplo: 2 ZnS(s) + 3 O2(g) 2 ZnO(s) + 2 SO2(g)

Fusão
É um processo em que os materiais formados durante as reações químicas são separados em duas ou mais camadas. Dois tipos de camadas importantes são formadas na fundição: metais e escória (resíduo silicoso).
Exemplo: CaO(l) + SiO2(l) CaSiO3(l)

Refinamento
É um processo metalúrgico utilizado para melhorar a pureza e definir uma melhor composição do metal impuro e bruto.

Pirometalurgia do ferro
• Fonte: hematita (Fe2O3) e magnetita (Fe3O4)
• Produção

No forno, o carbono do coque reage com o oxigênio para formar o monóxido de carbono
2 C(s) + O2(g) 2 CO(g) ΔH = -221 kJ
O vapor de água presente no ar reage com o carbono
C(s) + H2O(g) CO(g) + H2(g) ΔH = +131 kJ
No topo do forno, o calcário se decompõe formando CaO e CO2. E, no mesmo local, os óxidos de ferro são reduzidos pelo CO e H2. Reações de Fe3O4:
Fe3O4(s) + 4 CO(g) 3 Fe(s) + 4 CO2(g) ΔH = -15 kJ
Fe3O4(s) + 4 H2(g) 3 Fe(s) + 4 H2O(g) ΔH = +150 kJ

Formação do açoO aço é uma liga de ferro. Na sua produção, as impurezas são removidas por oxidação em um recipiente chamado conversor. Nas usinas, o agente oxidante é O2 puro ou diluído com argônio. A reação do O2 com o enxofre forma o SO2 que serve para remover o fosfóro:
3 CaO(l) + P2O5(l) Ca3(PO4)2(l)

Hidrometalurgia
• Para alguns metais a extração do metal de seus minérios é feita por meio de reações aquosas, a vantagem deste método é que ele não polui a atmosfera como a pirometalurgia.
Exemplo: Hidrometalurgia do alumínio

Hidrometalurgia do alumínioFonte: Bauxita (Al2O3 · xH2O)
Impurezas presentes: SiO2 e Fe2O3.
Processo para purificar a bauxita: Processo de Bayer.- Consiste primeiramente na trituração e depois digestão em uma solução
de NaOH, a uma temperatura de 150ºC a 230ºC e a uma pressão suficiente para impedir a ebulição;
- Al2O3, ele se dissolve nessa solução, formando o íon complexo aluminato, Al(OH)4
-;
- Óxidos de ferro (III) não se dissolvem na solução fortemente básica;- A solução de aluminato pode ser filtrada para separar as impurezas;- O pH da solução é reduzido para que o hidróxido de alumínio se precipite;- O precipitado é calcinado na preparação por eletrorredução- No fim, a solução é aquecida para evaporar a água (procedimento que
requer mais energia e portanto encarece a operação)

Eletrometalurgia
• Muitos processos usados para reduzir minerais metálicos ou metais refinados são baseados na eletrólise. Coletivamente denominamos de eletrometalurgia, são úteis na produção do sódio, magnésio e alumínio.

Eletrometalugia do alumínio
A passagem da corrente elétrica do ânodo para o cátodo reduz a alumina em alumínio e oxigênio. O oxigênio reage com o carbono do ânodo (elétrodo positivo) e o metal se deposita no cátodo (elétrodo negativo) sob a forma líquida.

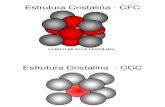
Ligação Metálica

Modelo do mar de elétrons• Características mostradas no
modelo:
Vantagens:
1- Uma rede de cátions metálicos num “mar” de elétrons de valência;
2- Elétrons confinados ao metal por atração eletrostática aos cátions;
3- Elétrons fluem livremente através do metal, pois nenhum elétron é localizado entre dois átomos de metal;
4- Não possui ligações definidas e mostra facilidade de deformação (maleabilidade e ductilidade);

Desvantagens:
1- Com o aumento do número de elétrons de valência, a força de ligação deveria aumentar, junto com o ponto de fusão;2- No entanto os metais do grupo 6B (Cr, Mo, W), que estão no centro dos metais de transição, possuem os maiores pontos de fusão;

Propriedades físicas dos metais 1- Alta condutividade térmica; 2- Alta condutividade elétrica; 3- Maleáveis; 4- Dúcteis; 5- Estruturas sólidas;X 6- Pontos de fusão aumentam para o centro dos grupos de metais de transição (tendem ao grupo 6B).

Modelo do orbital molecular• Superposição dos orbitais atômicos de valência de um átomo
metálico com os orbitais atômicos dos vários átomos metálicos ao seu redor;
• Resulta na formação de orbitais moleculares ligantes e antiligantes;
• Os orbitais moleculares de uma dada faixa de energia são pouco espaçados, mesmo quando se considera a energia do mais alto e a do mais baixo;
• Quanto maior o número de orbitais, menos espaçada será a diferença de energia entre esses;
• Nos metais há um número muito grande de orbitais;• Devido às separações serem tão pequenas, pela praticidade
podemos definir uma banda de energia;


POR QUE ESSE MODELO É MAIS ADEQUADO? 1- Caráter metálico: o número de elétrons disponíveis não preenche completamente a banda de energia; 2- Facilita o movimento de elétrons excitados para um orbital de maior energia (condutividade elétrica e térmica); 3- Ponto de fusão mais alto no meio da série dos metais de transição (grupo 6B); 4- Elétrons livres para se mover ao redor do sólido (maleabilidade e ductilidade).

Propriedades físicas dos metais 1- Alta condutividade térmica; 2- Alta condutividade elétrica; 3- Maleáveis; 4- Dúcteis; 5- Estruturas sólidas; 6- Pontos de fusão aumentam para o centro dos grupos de metais de transição (tendem ao grupo 6B).

Ligas• Mais de um elemento com propriedades
características dos metais;• Usado para fins comerciais (exemplo ouro);

• Ligas de solução: misturas homogêneas, componentes dispersos de forma aleatória e uniforme;
a) liga substitucional;
b) liga intersticial;
• Ligas heterogêneas: não estão dispersas uniformemente;• Compostos intermetálicos: ligas homogêneas que têm propriedades e composições definidas.(exemplo Ni3Al);

Metais de transição Propriedades físicas:• Ocupam o bloco d da tabela periódica;• Crescente importância dos metais de transição
antes desconhecidos, devido à sua utilização na tecnologia moderna (exemplo motor de jato).
38% - Titânio
37% - Níquel 12% - Cromo 06% - Cobalto 05% - Alumínio 01% - Nióbio
0,02% - Tântalo

• Propriedades atômicas (exemplo raios atômicos);- tendência de maneira regular ao longo de cada série;

Configurações eletrônicas e estados de oxidação
• Estados de oxidação:- +2, devido à perda de seus dois elétrons ns mais externos;- caso acima de +2, deve-se às perdas sucessivas de elétrons (n-1)d;- exceção: Sc, íon +3 tem configuração particularmente estável.

Magnetismo• O ‘spin’ do elétron fornece a ele um momento
magnético;• Três tipos de comportamento magnético: Situação inicial:
a) Diamagnético: sem átomos ou íons com momento magnético;b) Paramagnético: momentos magnéticos não alinhados;c) Ferromagnético: elétrons de átomos ou íons influenciados pelas orientações dos elétrons dos seus vizinhos.

Na presença do campo elétrico:a) Diamagnético: movimento dos elétrons provocam uma pequena repulsão em relação ao campo elétrico;b) Paramagnético: momentos magnéticos tornam-se alinhados paralelamente, provocando uma atração em relação ao campo elétrico;c) Ferromagnético: tendem a se alinhar fortemente em relação ao campo elétrico (chega a ser um milhão de vezes mais forte do que no comportamento paramagnético).

Química em alguns metais de transição
• Cromo (Cr) - Na ausência de ar, o Cr se dissolve em ácido clorídrico ou
ácido sulfúrico, formando uma solução azul com íon de Cr2+;
- Na presença de ar, o Cr2+ oxida facilmente para Cr3+;

• Ferro (Fe) - Em solução aquosa existem os estados de oxidação
+2 (ferroso) e +3 (férrico); - Geralmente aparece em solução aquosa devido ao
contato com depósitos de FeCO3, com ajuda do CO2 dissolvido na água:
FeCO3(s) + CO2(aq) + H2O(l) Fe2+(aq) + 2 HCO3
-(aq)
- Na presença de ar, o Fe2+ é oxidado a Fe3+:
4 Fe2+(aq) + O2(g) + 4 H+
(aq) 4 Fe3+(aq) + 2 H2O(l) E°=+0,46 V

Referências bibliográficas
• QUÍMICA – A ciência central – 9ª edição Brown – Lemay – Bursten
• www.wikipedia.com