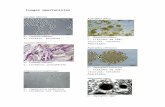
Micologia clinica
-
Upload
cesar-matias -
Category
Documents
-
view
19.412 -
download
6
Transcript of Micologia clinica

UNIVERSIDADE FEDERALUNIVERSIDADE FEDERALUNIVERSIDADE FEDERALUNIVERSIDADE FEDERAL DO RIO DE JANEIRO DO RIO DE JANEIRO DO RIO DE JANEIRO DO RIO DE JANEIRO FACULDADE DE FARMÁCIFACULDADE DE FARMÁCIFACULDADE DE FARMÁCIFACULDADE DE FARMÁCIAAAA
LABORATÓRIO DE MICOLLABORATÓRIO DE MICOLLABORATÓRIO DE MICOLLABORATÓRIO DE MICOLOGIA CLÍNICAOGIA CLÍNICAOGIA CLÍNICAOGIA CLÍNICA
MICOLOGIA CLÍNICA MICOLOGIA CLÍNICA MICOLOGIA CLÍNICA MICOLOGIA CLÍNICA
PROF. PAULO MURILLO PROF. PAULO MURILLO PROF. PAULO MURILLO PROF. PAULO MURILLO NEUFELDNEUFELDNEUFELDNEUFELD
[[[[[email protected]@[email protected]@pharma.ufrj.br
2003200320032003

ÍNDICE
MICOLOGIA GERAL 01
MICOLOGIA CLÍNICA 14
PROCEDIMENTOS LABORATORIAIS 24
ASPERGILOSE 48
BLASTOMICOSE NORTE-AMERICANA 50
BLASTOMICOSE QUELOIDIANA [LOBOMICOSE] 52
CANDIDÍASE 53
COCCIDIOIDOMICOSE 55
CRIPTOCOCOSE 57
CROMOMICOSE 59
DERMATOFITOSE 61
ESPOROTRICOSE 63
FEOHIFOMICOSE 65
HIALOHIFOMICOSE 66
HISTOPLASMOSE AMERICANA 67
HISTOPLASMOSE AFRICANA 69
MICETOMA 71
PARACOCCIDIOIDOMICOSE 73
PITIRÍASE VERSICOLOR 75
RINOSPORIDIOSE 77
ZIGOMICOSE 78
BIOSSEGURANÇA NO LABORATÓRIO DE MICOLOGIA 82
REFERÊNCIAS BIBLIOGRÁFICAS 94
ANEXO: MODELO DE LAUDO MICOLÓGICO 98

1
MICOLOGIA GERAL
1. CONCEITO
Micologia é o ramo da microbiologia que estuda os fungos, organismos enquadrados em um
reino bem definido, denominado de reino Fungi.
1. IMPORTÂNCIA GERAL DOS FUNGOS
Os fungos têm existência bastante difusa. Eles são considerados ubiquitários por estarem
presentes no solo, na água e no ar e cosmopolitas por serem encontrados em todas as partes do
planeta.
Estes microrganismos necessitam de matéria orgânica para a obtenção de carbono e de
energia para o seu metabolismo, por isso, estarão sempre associados ao material orgânico
como sapróbios ou decompositores, simbiontes, comensais e parasitas. São os efeitos
decorrentes destas manifestações que, dependendo do sentido, poderão ser considerados úteis
ou prejudiciais.
1.1. Ação benéfica
• Decomposição: a decomposição da matéria orgânica resulta na produção de húmus e
auxilia na eliminação de resíduos orgânicos. Os fungos, como decompositores, são
importantes na reciclagem de elementos contidos em material orgânico de origem vegetal e
animal.
• Líquens: os líquens são resultantes da associação de fungos com algas. São importantes
na colonização da rocha núa, transformando-a em solo aproveitável. Elaboram enzimas e
ácidos que são liberados sobre a rocha, quebrando-a em suas estruturas formadoras e
produzindo uma espécie de solo que permitirá a implantação dos vegetais.
• Micorrizas: são estruturas formadas pela associação de raízes não lenhosas de vegetais
superiores e fungos especializados do solo. As micorrizas aumentam a absorção de água e
nutrientes; fornecem proteção contra ataques de pragas; aumentam a tolerância dos vegetais a
excessos de metais, a condições extremas de acidez, aridez e temperatura do solo.

2
• Controle biológico de vetores: muitos fungos parasitam e matam diversos insetos que
constituem verdadeiras pragas de culturas, dentre eles: Metharizium anisopliae que parasita
a cigarrinha da cana-de-açúcar, Beauveria bassiana que parasita a broca da cana-de-açúcar, a
broca da batata doce e a broca do coqueiro.
• Alimentação: os fungos podem ser consumidos como alimentos, os cogumelos dos
gêneros Agaricus campestris, Morchella hortensis, Clavaria fava, Cantharellus cibarius,
Lactarius deliciosus, Russula alutalea, Psalliota arvensis, Amanita caesarea, Boletus sp,
e Helvellae sp. e trufas do gênero Tuber sp., são os mais frequentemente utilizados. Podem
ainda ser empregados no preparo de numerosos alimentos como: pão (Saccharomyces
cerevisiae); bebidas alcoólicas: cervejas, vinhos, uísques, rum, gim e saquê (Saccharomyces
cerevisiae, Saccharomyces carlsbergensis, Aspergillus oryzae); queijos: roquefort e
gorgonzola (Penicillium roquefortii ), camembert (Penicillium camembertii); molhos e
pastas: shoyu (Aspergillus oryzae, Aspergillus soye), missó (Aspergillus oryzae).
• Indústria: os fungos são empregados em processos industriais de importância indiscutível.
Podem produzir: álcool (etanol e glicerol); vitaminas ( complexo B e vitamina D); antibióticos
(penicilina e griseofulvina); esteróides (progesterona); corticóides (cortisona).
1.1. Ação prejudicial
• Fitopatógenos: os fungos podem devastar culturas inteiras ou determinar alterações na
taxa de crescimento dos vegetais de interesse agronômico.
• Deterioração de madeira e derivados: atacam madeiras de construção, dormentes de
ferrovia, postes de luz e telegráficos, móveis e utensílios em geral, molduras e telas de
quadros, papel e etc.
• Deterioração de alimentos e intoxicações alimentares: são agentes de deterioração de
alimentos, produzindo alterações organolépticas, ou seja, alterações na aparência, na
consistência, no sabor e no aroma. Crescem sobre grãos, carnes, leites, ovos, mel, produtos
enlatados, além de frutas, legumes e hortaliças. Podem produzir também toxinas exógenas
(micotoxinas) e toxinas endógenas que quando ingeridas desencadeiam quadros de
intoxicação alimentar, denominados de micotoxicoses e micetismos respectivamente. As
micotoxinas são elaboradas e liberadas para o meio ambiente durante o crescimento dos
fungos. Para que ocorra intoxicação (micotoxicose) é necessário a ingestão de alimentos
contaminados com estas toxinas. Os gêneros mais comumente implicados na produção

3
micotoxicoses são: Aspergillus spp., Penicillium spp. e Fusarium spp. As endotoxinas
fazem parte da própria estrutura dos fungos, não sendo liberadas para o meio ambiente. Para
que ocorra intoxicação (micetismo) é necessário a ingestão do próprio fungo e não apenas da
toxina, como no caso das micotoxicoses. Os fungos incriminados como produtores de
micetismos são os chamados cogumelos venenosos: Amanita verna, Amanita muscaria,
Amanita phalloides, Amanita pantherina, Coprinus atramentarius, Cantharellus
auratialus, Lactarius tormentosum, Russula emetica, Lepiota helveola, Entoloma
lividum , Gyromitra esculenta, Cortinarius orelanus, Psilocybe sp., Stropharia sp.,
Conocybe sp. e Tricholona sp. A ingestão de ambos os tipos de toxinas leva à produção de
variado quadro anátomo-patológico como: vômitos, tremores, diarréias, hemorragias e
neoplasias.
• Micoses e alergias: estes microganismos podem causar diversos processos patológicos no
homem e nos animais. Muitos são agentes de enfermidades conhecidas como micoses
(esporotricose, causada pelo fungo Sporothrix schenckii; histoplasmose, causada pelo
Histoplasma capsulatum; blastomicose, causada pelo Blastomyces dermatitidis;
paracoccidioidomicose, causada pelo Paracoccidioides brasiliensis) ou agentes de processos
alérgicos em indivíduos imunologicamente sensíveis, devido a inalação de elementos fúngicos
em suspensão no ar.
• Outros: os fungos podem se desenvolver em combustíveis (petróleo e derivados: gasolina,
óleo diesel e querosene; álcool) causando enormes problemas para refinarias e para a aviação.
Os aviões abastecidos com querosene podem apresentar crescimento de fungos em seu
tanque de combustível, o que pode levar a entupimentos do sistema de condução do
combustível ou ainda podem causar corrosão microbiológica, atacando a camada interna de
poliesteruretano e as chapas de duralumínio dos tanques de querosene dos aviões.
3. CITOLOGIA DOS FUNGOS
A célula fúngica é menor e mais simples do que a célula dos vegetais e animais, porém
apresenta basicamente os mesmos componentes encontrados nestas células eucariontes:
• Parede Celular: pode ser fundamentalmente de quitina, celulose ou composta de uma
mistura das duas substâcias. Alguns fungos durante um período de seu ciclo de vida perdem a
parede (esporos dos fungos aquáticos).
• Lomassoma: estrutura formada a partir da membrana celular e que se localiza entre a
parede e a membrana plasmática. Apresenta as seguintes funções:

4
� Secreção e formação de parede celular.
� Proliferação de citomembranas.
� Micropinocitose.
� Síntese de glicogênio.
� Manutenção do turgor celular.
� Funções de complexo de Golgi.
� Estrutura de resposta a tensões, sendo produzida em momentos de parasitismo ou
traumatismo.
• Membrana Celular : apresenta permeabilidade seletiva, segue o modelo do mosaico
fluido e, em alguns fungos que perdem a parede durante parte de seu ciclo biológico, dá a
forma e protege a célula.
• Núcleo: com membrana nuclear e fuso acromático intra-nuclear (durante a divisão celular
por mitose não há desorganização da membrana nuclear).
• Vacúolos: existem basicamente dois tipos, o de reserva que contém glicogênio e o
digestivo que contém enzimas digestivas, semelhantemente ao lisossoma.
• Septos: são projeções da parede celular que divide transversalmente a hifa. Os septos
podem ser falsos ou verdadeiros. Os septos falsos são aqueles que apresentam um poro central
que permite a passagem do citoplasma de um compartimento para o outro da hifa. Os septos
verdadeiros não apresentam poro e são formados em dois momentos: no traumatismo para
evitar o estravasamento do material citoplasmático para o meio ambiente e na reprodução
quando um septo é formado para isolar a área reprodutiva do restante do corpo vegetativo.
• Flagelo: nas células móveis (esporos de fungos aquáticos) encontram-se dois tipos, o
Tinsil ou Penado que apresenta um diâmetro uniforme ornamentado externamente por fibrilas
e o Whiplash ou Chicote que afila progressivamente para a extremidade livre e não é
ornamentado.
4. MORFOLOGIA DOS FUNGOS.
4.1. Morfologia vegetativa:
Os fungos podem ser divididos de acordo com a sua morfologia vegetativa em:
• Filamentosos: as células têm forma de filamentos tubulares denominados de hifas e o seu
conjunto é chamado de micélio. As hifas ou o micélio, segundo a coloração que apresentem
em sua parede celular, podem ser classificadas em hialinas quando apresentam cores claras

5
ou são transparentes e demáceas quando apresentam cores escuras. Também podem ser
divididas em septadas e asseptadas.
• Leveduriformes: as células têm formato arredondado ou ovalado e são chamadas de
leveduras.
4.1. Morfologia reprodutiva:
Os esporos são as unidades reprodutivas dos fungos e se caracterizam por também apresentar
formas e colorações variadas. Os principais tipos de esporos são:
• Basidiosporos: esporos sexuados exógenos, formados no exterior de células chamadas
basídias.
• Ascosporos: esporos sexuados endógenos, formados no interior de hifas em forma de
saco denominadas de asco.
• Conídios: esporos assexuados exógenos, formados sobre hifas reprodutivas chamadas de
células conidiogênicas.
• Esporângiosporos: esporos assexuados endógenos, formados dentro de hifas
reprodutivas chamadas de esporângios.
• Zoosporos: esporos assexuados endógenos, formados no interior de hifas reprodutivas
chamadas de zoosporângios.
• Blastosporos: esporos assexuados, representados pelas gêmulas ou brotos das leveduras.
As estruturas que formam e dão sustentação aos esporos são genericamente conhecidas como
esporóforos. Estas estruturas apresentam denominações específicas de acordo com o tipo de
esporos que produzem. Assim, quando produzem conídios, são denominados de conidióforos;
quando produzem esporângios com esporângiosporos, são denominados de esporângióforos;
quando produzem zoosporângios com zoosporos, são chamados de zoosporângióforos. Os
esporóforos podem ser ainda simples ou compostos. Conidióforos e esporangiosporos
exemplos de esporóforos simples que dão origem a esporos assexuados, enquanto que
sinêmios, esporodóquios, soros e acérvulos e picnídios são exemplos de esporóforos
compostos e que também dão origem a esporos assexuados (conídios). Os esporóforos
compostos que dão origem a esporos sexuados são chamados de ascocarpos quando ascos e
ascosporos são produzidos em seu interior e de basidiocarpos (basidióforos) quando
basidiosporos são produzidos sobre as suas estruturas (basídias). Os ascocarpos podem ser
divididos em peritécios, apotécios, cleistotécios e gmnotécios de acordo com seu modo de
comunicação com o meio exterior.

6
5. FISIOLOGIA DOS FUNGOS
5.1 Nutrição
• Heterotróficos para carbono.
• Tomada de nutrientes feita por absorção.
• Produção de exoenzimas e enzimas adaptativas.
5.1. Respiração
• Aeróbios.
• Respiração celular: Ciclo de Krebs, Cadeia Respiratória e Fosforilação Oxidativa.
5.3. Fermentação
• Oxidação parcial do substrato com produção de álcool e dióxido de carbono.
5.4. Dimorfismo
• Alguns fungos apresentam duas morfologias que variam principalmente em função da
temperatura: filamentosos a 15o C e leveduriformes a 37o C.
5.5. Reprodução
O ciclo biológico dos fungos começa e termina no esporo, que pode ser oriundo de
reprodução sexuada e/ou assexuada e ainda pode ser endógeno (quando produzido no interior
de células ou hifas especializadas) e exógeno (quando produzido no exterior de células ou
hifas especializadas). As formas conhecidas de reproduções nos fungos são:
• Assexuada (Imperfeita ou Anamórfica): divisão nuclear por mitose. Ocorre puramente por
transformações do sistema vegetativo. É importante para a propagação da espécie porque
produz grande número de esporos, porém, a variabilidade genética é baixa e dependente de
mutações.
• Sexuada (Perfeita ou Teleomórfica): divisão nuclear por meiose. É derivada da união de
núcleos compatíveis. É composta de três fases: Plasmogamia: fusão ou anastomose de hifas;
Cariogamia: união de dois núcleos haplóides compatíveis (formação de núcleo diplóide);
meiose: divisão nuclear por meiose, retornando à condição haplóide (crossing-over
meiótico).

7
Esta reprodução produz baixo número de esporos (ocorrendo apenas após um período de
“stress” ambiental), mas com grande variabilidade genética.
• Ciclo Parassexuado: divisão nuclear por mitose. Não ocorre em um período ou ponto
específico do ciclo biológico do fungo e não há formação de estruturas de reprodução. É
composto pelas seguintes fases: plasmogamia; cariogamia.; mitose (com eventual crossing-
over mitótico).
Este ciclo fornece algumas vantagens que só seriam obtidas no ciclo sexuado. Desta forma,
um certo grau de variabilidade genética é conseguido. O Ciclo Parassexuado é muito
importante para aqueles fungos que não se reproduzem sexuadamente e que dependem
exclusivamente de mutações para que haja alguma variação em seu código genético. O
homem utiliza este ciclo, aliado a mutações artificiais, fazer melhoramento genético, ou seja ,
obtenção de novas linhagens em fungos de interesse comercial, industrial e médico cuja
reprodução sexuada não se conhece.
6. CARACTERIZAÇÃO DOS FUNGOS
Os fungos estão enquadrados no reino FUNGI, sendo suas principais características:
• Eucariontes: possuem membrana nuclear, o que caracteriza os núcleos verdadeiros. No
interior de seus núcleos, o número de cromossomos é variável, mas sempre diferente de um.
• Unicelular ou Filamentoso;
• Parede Celular: quitinosa e/ou celulósica;
• Aeróbios;
• Aclorofilados (não fazem fotossíntese);
• Nutrição heterotrófica por absorção;
• Armazenam glicogênio e não armazenam amido;
• Reproduzem-se por esporos oriundos de reprodução assexuada ou sexuada.
7. TAXONOMIA DOS FUNGOS
A exata posição dos fungos com relação aos outros organismos tem sido motivo de muita
discussão. Inicialmente, os fungos foram tratados como pertencentes ao reino vegetal.
Todavia, quando comparadas, as características dos fungos se chocavam com as
características dos demais representantes deste reino. Somado a isso, algumas características
observadas nas células animais eram compartilhadas pelos fungos. Com o objetivo de
minimizar as diferenças, os fungos foram então separados em um reino particular.

8
Tradicionalmente, o reino Fungi tem sido dividido em dois filos (ou divisões): o
Myxomycota, para as forma plasmodiais, e o Eumycota (fungos verdadeiros), para as forma
não plasmodiais que são usualmente miceliais ou leveduriformes. Os fungos verdadeiros, por
sua vez, têm sido classificados a partir de suas relações filogenéticas e estruturas de
reprodução sexuada nos subfilos (ou subdivisões): Basidiomycotina, Ascomycotina,
Zygomycotina e Mastigomycotina. A exceção fica por conta do subfilo (ou subdivisão)
Deuteromycotina que não é formada a partir de graus de parentesco e nem a partir de formas
sexuadas de reprodução. Nele são colocados todos aqueles fungos cuja reprodução sexuada é
inexistente ou desconhecida, independentemente de sua origem filogenética (evolutiva). Na
maioria das vezes, os deuteromicetos são formas assexuadas de ascomicetos ou
basidiomicetos.
Classificação tradicional dos fungos
FILO EUMYCOTA
EUCARIONTES, UNICELULARES OU FILAMENTOSOS, PAREDE
CELULAR COM QUITINA E / OU CELULOSE, AERÓBIOS,
ACLOROFILADOS, NUTRIÇÃO HETEROTRÓFICA POR ABSORÇÃO,
GLICOGÊNIO COMO RESERVA GLICÍDICA, REPRODUÇÃO POR
ESPOROS PRODUZIDOS ASSEXUADA E / OU SEXUADAMENTE.
SUBFILOFILO BASIDIOMYCOTINA MICÉLIO SEPTADO OU CÉLULAS DE LEVEDURA E ESPORO
SEXUADO (BASIDIOSPORO) FORMADO SOBRE BASÍDIAS.
SUBFILO ASCOMYCOTINA MICÉLIO SEPTADO OU CÉLULAS DE LEVEDURA E ESPORO
SEXUADO (ASCOSPORO) FORMADO DENTRO DE ASCOS.
UBFILO ZYGOMYCCOTINA MICÉLIO ASSEPTADO E ESPORO SEXUADO (ZIGOSPORO) E
ASSEXUADO (ESPORANGIOSPORO) FORMADOS DENTRO DE
ESPORÂNGIOS.
SUBFILO MASTIGOMYCOTINA MICÉLIO ASSEPTADO OU FORMA UNICELULAR E ESPORO
ASSEXUADO FLAGELADO (ZOOSPORO).
SUBFILO DEUTEROMYCOTINA MICÉLIO SEPTADO OU CÉLULAS DE LEVEDURA E ESPORO
ASSEXUADO NÃO FORMADO EM ESPORÂNGIOS (CONÍDIO).

9
Com o avanço das técnicas de estudo, muitos organismos anteriormente considerados fungos
foram retirados do reino Fungi por apresentarem características que conflitiam com aquelas
reconhecidas para este grupo. Assim, o reino Fungi foi reestruturado e atualmente passou a
conter os Filo Basidiomycota, Ascomycota, Zygomycota e Chytridiomycota. O antigo
Sbufilo Mastigomycotina foi retirado do reino Fungi, pois muitos organismos considerados
neste taxon tinha pouca relação com os fungos verdadeiros, ficando apenas a antiga classe
dos Chytridiomycetes como filo Chytridiomycota. O subfilo Deuteromycotina foi extinto por
não ser uma unidade monofilética e seus componentes passaram a ser designados como
“fungos mitospóricos”. Recentemente, o termo “fungo mitospórico” foi substituído pelo o
termo “fungo anamórfico”. É importante ressaltar que estes termos não correspondem a uma
classificação taxonômica, mas sim, apenas a uma designação sob a qual estão agrupadas as
formas assexuadas de alguns fungos.
Classificação moderna dos fungos
REINO FUNGI
EUCARIONTES, UNICELULARES OU FILAMENTOSOS, PAREDE
CELULAR COM QUITINA, AERÓBIOS, ACLOROFILADOS, NUTRIÇÃO
HETEROTRÓFICA POR ABSORÇÃO, GLICOGÊNIO COMO RESERVA
GLICÍDICA, REPRODUÇÃO POR ESPOROS PRODUZIDOS
ASSEXUADA E / OU SEXUADAMENTE.
FILO BASIDIOMYCOTA MICÉLIO SEPTADO OU CÉLULAS DE LEVEDURA E ESPORO
SEXUADO (BASIDIOSPORO) FORMADO SOBRE BASÍDIAS.
FILO ASCOMYCOTA MICÉLIO SEPTADO OU CÉLULAS DE LEVEDURA E ESPORO
SEXUADO (ASCOSPORO) FORMADO DENTRO DE ASCOS.
FILO ZYGOMYCOTA
MICÉLIO ASSEPTADO E ESPORO SEXUADO (ZIGOSPORO) E
ASSEXUADO (ESPORANGIOSPORO) FORMADOS DENTRO DE
ESPORÂNGIOS.
FILO CHYTRIDIOMYCOTA MICÉLIO ASSEPTADO OU FORMA UNICELULAR E ESPORO
ASSEXUADO FLAGELADO (ZOOSPORO).

10
Outra classificação proposta inclui os filos Basidiomycota, Ascomycota, Zygomycota e
Deuteromycota. Nesta, nenhum dos membros do antigo subfilo Mastigomycotina é
considerado fungo verdadeiro e, mesmo não sendo uma unidade monofilética, o antigo subfilo
Deuteromycotina foi mantido como filo Deuteromycota.
Classificação moderna dos fungos
REINO FUNGI
EUCARIONTES, UNICELULARES OU FILAMENTOSOS, PAREDE
CELULAR COM QUITINA, AERÓBIOS, ACLOROFILADOS, NUTRIÇÃO
HETEROTRÓFICA POR ABSORÇÃO, GLICOGÊNIO COMO RESERVA
GLICÍDICA, REPRODUÇÃO POR ESPOROS PRODUZIDOS
ASSEXUADA E / OU SEXUADAMENTE.
FILO BASIDIOMYCOTA MICÉLIO SEPTADO OU CÉLULAS DE LEVEDURA E ESPORO
SEXUADO (BASIDIOSPORO) FORMADO SOBRE BASÍDIAS.
FILO ASCOMYCOTA MICÉLIO SEPTADO OU CÉLULAS DE LEVEDURA E ESPORO
SEXUADO (ASCOSPORO) FORMADO DENTRO DE ASCOS.
FILO ZYGOMYCOTA MICÉLIO ASSEPTADO E ESPORO SEXUADO (ZIGOSPORO) E
ASSEXUADO (ESPORANGIOSPORO) FORMADOS DENTRO DE
ESPORÂNGIOS.
FILO DEUTEROMYCOTA MICÉLIO SEPTADO E ESPORO ASSEXUADO (CONÍDIO) NÃO
FORMADO EM ESPORÂNGIOS OU CÉLULAS DE LEVEDURA
GEMULANTES (BLASTOSPORO)

11
Esquema taxonômico dos principais grupos de fungos
Filo
Classe
Ordem
Família
Gênero
Zygomycota
Zygomycetes
Entomophthorales Mucorales
Entomophthoraceae Mucoraceae Cunninghamellaceae Syncephalastraceae
Basidiobolus Conidiobolus Absidia Mortierella Mucor Rhizomucor Rhizopus Cunnighamella Syncephalastrum
Ascomycota Hemiascomycetes Endomycetales Endomycetaceae Saccharomycetaceae
Endomyces Lodderomyces Kluyveromyces Pichia Saccharomyces
Loculoascomycetes
Myriangiales Pleosporales
Saccardinulaceae Microascaceae
Piedraia Pseudoallecheria boydii
Plectomycetes Eurothiales Gymnoascaceae Ajellomyces Arthroderma Nannizzia
Basidiomycota Teliomycetes
Ustilaginales Filobasidiaceae Filobasidiella
Hymenomycetes
Aphyllophorales Schyzophillaceae Schyzophillum
Blastomycetes Aureobasidium Cryptococcus Candida/Torulopsis Malazzesia/Pityrosporum Rhodotorula Trichosporon Sporobolomyces
Deuteromycota Hyphomycetes
Moniliales
Moniliaceae
Acremonium/Cephalosporium Aspergillus Blastomyces Chrysosporium Coccidioides Epidermophyton Geotrichum Gliocladium Histoplasma Microsporum Paecilomyces Paracoccidioides Penicillium
Dematiaceae Tuberculariaceae
Sepedonium Scopulariopsis Sporothrix Trichoderma Trichophyton Alternaria Cladosporium Curvularia Drechslera Exophiala Fonsecaea Helmintosporium Madurella Nigrospora Phialophora Rhinocladiella Ulocladium Wangiella Epicoccum Fusarium
Ceolomycetes Sphaeropsidales Phoma

12
A classificação dos fungos está apoiada na micromorfologia das estruturas reprodutivas.
Como alguns fungos podem se reproduzir tanto sexuada quanto assexuadamente, estes
irão apresentar duas denominações, uma em função da morfologia sexuada e outra em
função da morfologia assexuada. Isto ocorre por que as estruturas de reprodução
sexuada e assexuada são morfologicamente diferentes. Assim, um mesmo fungo poderá
ser conhecido pelo seu nome sexuado (perfeito ou teleomórfico) ou pelo seu nome
assexuado (imperfeito ou anamórfico). Taxonomicamente, quando a reprodução
sexuada for conhecida, deve se dar preferência de uso para o nome teleomórfico.
Contudo, na prática, os fungos são tratados por seu nome anamórfico, já que as culturas
são manipuladas, no laboratório clínico, na fase assexuada.
Nomenclatura anamórfica e teleomórfica de alguns fungos de interesse médico
Anamorfo
Teleomorfo
Anamorfo
Teleomorfo
Alternaria
Clathrospora Leptosphaeria Pleospora
Penicillium
Eupenicillium Penicilliops Talaromyces
Aspergillus Emericella Eurotium Sartorya
Phialophora Gaeumannomyces Mollisia
Blastomyces Ajellomyces Rhodotorula Rhodosporidium
Candida Hansenula Kluyveromyces Leucosporidium Lodderomyces Pichia Saccharomyces
Scedosporium Petrielle Petriellidium Pseudoallescheria
Chrysosporium Arthroderma
Scopulariopsis Chaetonium Kernia Microascus Petriella
Cryptococcus Filobasidiella Filobasidium
Scytallidium Handersonula
Curvularia Cochliobolus Sepedonium Corynoascus Hypomyces Peckiella Thielavia
Dreschslera Cochliobolus Pyrenophora
Sporobolomyces Aessosporon
Fusarium Calonectria Giberella Micronetriella Nectria
Sporothrix Ceratocystis
Geotrichum Dipodascus Endomyces
Stachybotrys Melanopsamma

13
Continuação
Anamorfo
Teleomorfo
Anamorfo
Teleomorfo
Histoplasma
Ajellomyces
Torulopsis
Debaryomyces Hansenula Kluyveromyces Saccharomyces Filobasidium
Microsporum Arthroderma Trichoderma Hypocrea Podostroma
Paecyllomyces Byssochlamyces Cephalotheca Thermoascus
Em micologia médica, uma classificação (não taxonômica) orientada segundo a
enfermidade causada por esses organismos, pode ser útil. Neste esquema, os fungos são
agrupados em três grandes categorias: micoses superficiais (pele, pêlos e unhas),
micoses subcutâneas (músculos, ossos e tercido conectivo) e micoses profundas ou
sistêmicas (diversos órgãos ou tecidos: pulmões, sistema linfático e sangüineo).
Classificação clínica dos agentes fúngicos
Superficiais
Subcutânea
Sistêmica
Piedra Branca
Trichosporon beigelii
Piedra Preta Piedraia hortae
Tinea Nigra Exophiala werneckii
Candidíase Candida spp.
Dermatofitose Epidermophytom floccosum Microsporum spp. Trichophyton spp.
Pitiríase Versicolor Malassezia furfur
Cromoblastomicose
Cladosporium carrionii Fonsecaea compacta Fonsecaea pedrosoi Phialophora verrucosa Rhinocladiella aquaspersa
Esporotricose Sporothrix schenckii
Micetoma Eumicótico Acremonium spp. Aspergillus nidulans Curvularia spp. Exophiala jeanselmei Fusarium spp. Madurella spp. Pseudallescheria boydii
Feohifomicose Alternaria spp. Cladosporium spp. Curvularia spp. Exophiala spp. Phialophora spp.
Aspergilose
Aspergillus spp.
Blastomicose Blastomyces dermatititdis
Candidíase Candida spp.
Coccidioidomicose Coccidioides immitis
Cryptococcose Cryptococcus neoformans
Hialohifomicose Acremonium spp. Fusarium spp. Paecilomyces spp. Penicillium spp. Scopulariopsis spp.
Histoplasmose Histoplasma capsulatum
Paracoccidioidomicose Paracoccidioides brasiliensis
Zigomicose Absidia spp. Cunninghamella spp. Mucor spp. Rhizopus spp. Syncephalastrum spp. Basidiobolus sp. Conidiobolus sp.

14
MICOLOGIA CLÍNICA
1. DEFINIÇÃO: MICOSE
A patogenicidade dos fungos tem sido relacionada com a sua capacidade de
desenvolvimento nos tecidos do hospedeiro. A ação espoliativa dos fungos patogênicos
pode levar a um variado quadro mórbido, genericamente, denominado de micose.
1. TERMINOLOGIA
1.1. Localização Anátomo-clínica: segundo o sítio anatômico, as micoses podem ser
denominadas como dermatomicose (micoses da pele), otomicose (micoses do conducto
auditivo), oftalmomicose (micoses dos olhos), onicomicose (micoses das unhas) e
pneumomicose (micoses dos pulmões).
1.1. Agente etiológico: segundo o fungo responsável, as micoses podem ser
denominadas como aspergilose (micoses produzidas por fungos do genêro Aspergillus),
paracoccidioidomicose (micose produzida pelo Paracoccidioides brasiliensis),
esporotricose (micose produzida pelo Sporothrix schenckii) e etc.
3. CLASSIFICAÇÃO
3.1. Localização do processo: superficial, subcutânea e profunda
3.1. Origem do processo: primária, secundária e associadas
4. FATORES PRÉ-DISPONENTES
4.1. Fatores biológicos
• Hospedeiro: raça (fatores genéticos); idade (imaturidade ou degeneração do sistema
imunológico); sexo (alterações fisiológicas: gravidez, lactação e ciclo menstrual);
Patologias (processos infecciosos, processos metabólicos, processos neoplásicos,
desnutrição e estados imunossupressivos).

15
• Fungo: fatores indutores de fase tecidual (dimorfismo); Afinidade tecidual
(equipamento enzimático); presença de cápsula; parasitismo intracelular; toxicidade
(exo e endotoxinas); poder invasor (orgãos perfurantes: ação mecânica)
4.1. Fatores ecológicos
• Clima: de maneira geral as micoses são mais freqüentes em climas quentes do que
em climas temperados e frios. Há, porém, algumas micoses em que a influência
climática é predominante. Neste casos, o fungo só sobrevive no ambiente em condições
climáticas estritas.
• Solo: a influência da natureza do terreno sobre o desenvolvimento sapróbio dos
fungos patogênicos, em geral, é mal estudada. Entretanto, parece haver certa relação
entre algumas áreas de maior prevalência de micoses e a constituição do solo
(histoplasmose ou coccidioidomicose).
4.3. Fatores sociológicos
• Meio Social: considera-se o solo e os vegetais como sendo o principal habitat dos
fungos patogênicos, assim, compreende-se que a incidência das micoses seja maior no
meio rural do que no meio urbano.
• Hábitos e Costumes: podem ser um fator de predisposição ou proteção contra
determinadas micoses. Alguns desses fatores estão ligados, por exemplo, ao vestuário, à
segregação e à migração.
• Profissão: médicos, veterinários, laboratoristas, espeleologistas, entre outros, estão
mais expostos aos fungos patogênicos.
• Higiene: é importante para a prevenção de muitas micoses, porém, pode ser um
tanto quanto ineficaz para as doenças produzidas por fungos da microbiota.

16
5. DINÂMICA DAS MICOSES
5.1. Fontes de infecção e reservatórios
• Solo
• Vegetais
• Animais
• Homem.
5.1. Vias de infecção
• Inalação de elementos fúngicos em suspensão no ar
• Traumatismo
• Ingestão
5.3. Vias de disseminação
• Hematogênica
• Linfática
• Contiguidade
Epidemiologia das micoses
Fonte
Porta de Entrada
Micoses
Sapróbica (solo, matéria orgânica em decomposição)
Pulmão
Histoplasmose Blastomicose Coccidioidomicose Paracoccidioidomicose Criptococcose Aspergilose Mucormicose Pseudoallescheriose Esporotricose Adiaspiromicose Hialohifomicose Feohifomicose
Epiderme e fio de cabelo
Dermatofitose por fungos geofílicos
Pele e tecido subcutâneo Micetoma Esporotricose Cromoblastomicose Feohifomicose Rinosporidiose Entomoftoromicose Hialohifomicose Tinea nigra

17
Continuação
Fonte
Porta de Entrada
Micoses
Seios paranasais
Mucormicose Aspergilose Feohifomicose Entomoftoromicose
Aquática Pele e tecido subcutâneo, mucosa nasal e conjuntiva
Rinosporidiose
Animal Pele e pêlos
Dermatofitose por fungos zoofílicos
Humana Epiderme e pêlos Dermatofitose por fungos antropofílicos e pitiríase versicolor
Pele, membranas mucosas e trato gastrointestinal
Candidíase
6. TRANSMISSÃO
6.1. Micoses superficiais: a transferência de agentes fúngicos ocorre por contacto direto
entre indivíduos.
6.1. Micoses subcutâneas e profundas: a doença adquirida por contacto direto é pouco
freqüente. Na realidade, nestas o agente fúngico é transmitido de maneira indireta, ou
seja, pelo contacto com solo, ambientes e objetos contaminados.
7. SINTOMATOLOGIA DAS MICOSES
7.1. Micoses pulmonares
• Geral: sindrome gripal passageira ou pneumonia localizada em um dos lobos ou
espalhada. Considerado como infecção inicial;
• Tosse: produção mínima de escarro, dispnéia, taquipnéia e hemoptíase. A dor no
peito é freqüentemente de natureza pleural. Roncos e fricção pleural podem ser
detectados pela auscultação. Radiografias podem revelar pequeno infiltrado pulmonar e
adenopatia hilar ou opacidade difusa e confluente;
• Alergia broncopulamonar: sintomas característicos de asma e tosse não produtiva.
Broncoespasmo episódico. Atalectasia causada por tampões mucóides nos bronquíolos.
Cristais de “Charcot-Leyden” e eosinófilos no escarro. Eosinofilia do sangue periférico

18
e reação de hipersensibilidade cutânaea aos antígenos do Aspergillus spp. Elevada
concentração sérica de Ig G anti-Aspergillus;
• Aspergiloma (bola fúngica): crescimento de uma colônia dentro de uma cavidade
pré-formada. Hemoptíase pode ocorrer a despeito de pouca ou nenhuma invasão da
parede da cavidade. A disseminação é rara mesmo em pacientes submetidos a terapia
com corticóides;
• Invasiva: sintomas de pneumonia aguda, febre baixa e inconstante, tosse produtiva
ou não produtiva, dor no peito usualmente presente e dispnéia progressiva com
respiração difícil. A ocorrência de hemoptíase pode indicar enfarto e necrose do
parênquima pulmonar. Radiografias do tórax podem revelar um infiltrado difuso na
região hilar, fibrose finamente nodular, abscessos multifocais ou cavitários, dependendo
da espécie fúngica: fibrose com pontos difusos: histoplasmose; lesão periférica tipo
moeda: coccidioidomicose; lesão cavitária: histoplasmose e coccidioidomicose; bola
fúngica: aspergilose, pseudoallescheriose e zigomicose; alergia: Aspergillus fumigatus
e Aspergillus flavus
7.1. Micoses superficiais
• Lesões com descamação superficial, variando no tamanho forma e coloração
(acromia, hipopigmentação ou hiperpigmentação) na região do tórax e costas: infecção
por Malassezia furfur (pitiríase versicolor);
• Lesões descamativas, pruriginosas, eritematosas com bordos elevados e conhecidas
com impigem: Epidermophyton floccosum, Micropsporum spp. e Trichophyton spp.
(dermatofitoses);
• Lesões descamativas, hiperqueratose, crostas, formação de escútulas:
Trichophyton schoenleinii (tinea favosa);
• Lesões descamativas ou crostosas confinadas em áreas úmidas e intertriginosas da
pele: Candida albicans (leveduroses);

19
• Lesão nodular subcutânea no sítio de infecção com espalhamento ascendente e
evolução secundária de úlceras cutâneas no trajeto dos vasos linfáticos: Sporotrix
schenckii;
• Lesões tumefeitas subcutâneas, pustulares, ulcerosas com tratos sinuosos drenantes
e produção de grãos: micetoma;
• Lesões tumefeitas subcutâneas, verrucosas, descoloradas e hemorrágicas:
cromoblastomicose;
• Lesões purpuráceas e cistos subcutâneas: feohifomicose;
7.3. Micoses do sistema nervoso central
• Cefaléia de início insidioso que aumenta em freqüência e severidade, aconpanhada
de náusea, irritabilidade e instabilidade mental e emocional: criptococcose;
• Meningite e meningoencefalite: zigomicose em diabéticos descompensados em
acidose;
7.4. Micoses do trato urinário
• Pielonefrites associadas com terapia de longa duração com corticóides, antibióticos,
imunossupressores e drogas antineoplásicas ou uso prolongado de cateteres para
drenagem urinária: candidíase;
• Piúria: dor no baixo ventre, ato de urinar freqüente, cistite: candidíase;
7.5. Micose ocular
• infecção da cónea, da conjuntiva e do globo ocular após traumatismo ou interveção
cirúrgica: aspergilose e hialohifomicose;
7.6. Micoses cardíacas
• Febre baixa, murmúreo cardíaco, ecograma positivo: candidíase, aspergilose e
hialohifomicose;

20
7.7. Micoses dos seios paranasais
• Dor facial e hiperemia cutânea, cefaléia, febre baixa, evidência radiográfica de
preenchimento dos seios paranasais: aspergilose, hialohifomicose e pseudoalescheriose.
8. HISTOPATOLOGIA DAS MICOSES
A resposta tecidual à agressão dos patógenos fúngicos é tão variada quanto a
diversidade dos agentes. Nas infecções dos tecidos queratinizados (pele, pêlos e unhas),
geralmente, a lesão é resultado de uma resposta irritativa à presença dos fungos ou de
seus metabólitos. No caso dos organismos que invadem os tecidos vivos, como aqueles
que causam enfermidades subcutâneas ou profundas, se produz uma resposta piogênica
uniforme.
8.1. Reações inflamatórias crônicas
• Linfócitos, células plasmáticas, neutrófilos, fibroblastos e ocasionalmente células:
zigomicose crônica, histoplasmose crônica e rinosporidiose
8.1. Reações piogênicas
• Agudas ou crônicas, infiltrado neutrofílico supurativo: Actinomyces israelii
(grânulos de enxofre e histiócitos saturados de lipídios na periferia), Nocardia
asteroides e aspergilose aguda e outras infecções oportunistas
8.3. Reações piogênicas e reações granulomatosas mistas
• Infiltrado neutrofílico e reação granulomatosa, linfócitos e células plasmáticas:
Blastomyces dermatitidis, Paracoccidioides brasiliensis, Coccidioides immitis
(neutrófilos ao redor de esférulas rompidas), Sporothrix schenckii (raros nos tecidos),
cromoblastomicose (reação piogênica crônica, nódulos de células epitelióides e células
gigante tipo corpo estranho), micetoma; além disso, podem ocorrer células gigantes
espumosas semelhantes às do xantoma
8.4. Hiperplasia pseudoepiteilomatosa (após inflamação crônica da pele)
• Hiperplasia das células epidérmicas, hiperqueratose e alongamento das cristas
reticulares: Blastomyces dermatitidis, Paracoccidioides brasiliensis, Coccidioides
immitis , cromoblastomicose

21
8.5. Granuloma histiocítico
• Histiócitos com microrganismo intracelulares, podendo se transformar em células
gigantes: Histoplasma capsulatum e Cryptococcus neoformans nas meninges
8.6. Granuloma com caseificação
• Reação granulomatosa, célula gigante de Langhans e necrose central: Histoplasma
capsulatum e Coccidioides immitis
8.7. Granuloma tipo sarcóide
• Não necrosante: Cryptococcus neoformans, Histoplasma capsulatum
8.8. Granuloma pulmonar fibro-caseoso
• Parede fibrosa espessa envolvida por células epitelióides, micorganismos dentro das
células gigantes de Langhans localizadas no centro da lesão, frequentemente ocorre
calcificação: Histoplasma capsulatum
• Parede fibrosa delgada, raramente calcificada: Coccidioides immitis
• Pobremente definida: Cryptococcus neoformans
8.9. Arterite trombótica
• Trombose, necrose coagulativa purulenta, invasão dos vasos: aspergilose e
zigomicose aguda: Aspergillus spp., zigomicose aguda
8.10. Fibrose
• Proliferação de fibroblastos, depósito de colágenos semelhante a quelóides:
Paracoccidioide loboi
8.11. Granuloma esclerosante por corpo estranho (em seios paranasais ou após
infecção viral)
• Hifas atípicas em células gigantes: Aspergillus spp.

22
9. IMUNOLOGIA DAS MICOSES
A imunidade natural contra as micoses é muito elevada, por isso, a infecção fúngica
depende da exposição maciça de microrganismos e da resistência geral do hospedeiro.
Esta situação está bem demonstrada por duas categorias principais de enfermidade
micótica. A primeira, infecção por fungos patogênicos verdadeiros, ocorre em pacientes
que se encontram em áreas endêmicas particulares e que inalam uma quantidade
elevada de elementos fúngicos em suspensão no ar. A maior parte dessas infecções são
assintomáticas ou resolvem com rapidez e normalmente ocorre resitência à reinfeção.
Somente em raras ocasiões, a enfermidade chega ser grave. Por outro lado, as infecções
oportunistas são causadas por microrganismos presentes de maneira universal que
possuem virulência muita baixa. O estabelecimento de uma enfermidade depende
exclusivamente da resistência do hospedeiro. Neste casos, se o paciente se recupera
desta situação, incluindo a infecção fúngica, se observa a ocorrência de resistência não
específica à reinfecção.
Na atualidade, até onde se sabe, os anticorpos desempenham um papel muito pequeno
na defesa frente as infeções micóticas. A imunidade celular parece ser a única
resistência eficaz contra a invasão dos fungos. Esta situação está bem ilustrada pelos
dois tipos de infecção que ocorrem em pacientes portadores de enfermidades
linfomatosas ou que apresentam defeitos genéticos da função linfocitária. Em pacientes
que apresentam discrasias ou defeitos da função do linfócito T são freqüentes as
infecções fúngicas oportunistas. Se o defeito só ocorre em células B, raramente ocorrem
enfermidades causadas por fungos, todavia, são comuns as infecções bacterianas, em
particular, as causadas por cocos Gram positivos. A importância dos mecanismos
celulares de defesa também se refletem nas manifestações histológicas. No hospedeiro
normal, os fungos patogênicos produzem reações piogênicas seguidas de reação
granulomatosas. A resposta gerada por organismos oportunistas se traduz por necrose e
supuração e o hospedeiro não é capaz de conter os microrganismos.
Os fungos são fracamente antigênicos. Por esta razão, na maior parte dos casos, a
sorologia não é um bom auxílio diagnóstico ou prognóstico. Além disso, a ocorrência de
reações cruzadas e a falta de padronização dos antígenos tornam os procedimentos
sorológicos de emprego limitado.
A hipersensibilidade e alergia aos fungos se manifestam de diversas formas. Uma
alergia intensa pode ser devido a inalação de conídios. Estes podem provocar asma,

23
enfermidades asmatiformes, fibrose e consolidação pulmonar. Os estados alérgicos
também podem manifestar-se como processos secundários (“micedes” ou “ides”) à
focos de infecção cutânea por dermatófitos (dermatofítides) ou candida (levedurídes).
As lesões de “ide” ocorrem pela liberação de alérgenos fúngicos circulantes, os quais,
em pessoas sensíveis, são capazes de provocar erupções cutâneas distantes do foco
primário. As reações alérgicas como eritema nodoso podem ser parte da infecção
primária de alguma enfermidade sistêmica como histoplasmose e coccidioidomicose.
Com freqüência, a hipersensibilidade, segundo se tem demonstrado por reações
cutâneas positivas, está relacionada a uma boa resistência à infecção ou reinfecção.

24
PROCEDIMENTOS LABORATORIAIS
1. COLETA E TRANSPORTE DO ESPÉCIMEN CLÍNICO
1.1. Escarro: três amostras matutinas devem ser coletadas após levantar, mas antes do
café da manhã. Os pacientes são instruidos para lavar a cavidade bucal com água
imediatamente antes da obtenção do escarro. A produção de escarro pode ser induzida
por nebuliação com salina se um adequado espécimen não for produzido. O espécimen
de escarro deve ser colocado em um frasco estéril e enviado ao laboratório no máximo
até duas horas após coletado. Se demoras são inevitáveis, o espécimen clínico deve ser
refrigerado a 4o C.
1.1. Broncoscopia: escovamento brônqüico, lavagem broncoalveolar ou biópsia devem
ser transportados prontamente para o laboratório em frasco fechados e estéreis. O
escarro pós-broncoscopia deve ser coletado quando possível.
1.3. Fluido cerebroespinhal: fluido cerebroespinhal deve ser coletado sempre que se
suspeita de infecções do sistema nervoso central. Se o processamento não for imediato,
a amostra deve ser deixada a temperatura ambiente e não refrigerada, já que o fluido
cerebroespinhal é um adequado meio de cultura no qual os elementos fúngicos podem
sobreviver até serem subcultivados.
1.4. Urina: amostras matutinas são preferidas. Estas devem ser coletadas em frascos
estéreis e transportadas imediatamente para o laboratório. Demoras no processamento
não devem exceder 1 horas, todavia, se atrasos forem inevitáveis, a amotra deve ser
mantida a temperatura de 4o C.
1.5. Secreções prostáticas: algumas micoses profundas, notadamente a blastomicose e
menos comumente a histoplasmose e coccidioidomicose, podem ser diagnosticadas pela
coleta do líqüido prostático. A bexiga é primeiro esvasiada, em seguida, processasse
uma massagem prostática. as secreções devem ser inoculadas diretamente em
apropriado meio de cultura; também 5-10ml de urina devem ser coletados em um
recipiente a parte.

25
1.6. Exudatos: a pele sobre as lesões pustulares deve ser desinfectada e o exudato
aspirado, usando uma seringa e agulha estéreis. A seringa pode servir com recipiente de
transporte. Biópsias das lesões podem ser necessárias, se o aspirado falhar na
recuperação dos fungos.
1.7. Pele, pêlos e unhas: a lesão deve ser higienizada com gaze embebida em álcool
70% para remover as bactérias contaminantes. As amostras de pele devem ser obtidas
por raspados das margens das lesões com uma lâmina de bisturi ou com bordo cortante
da lâmina de microscopia. O material de unhas infectadas deve ser coletado por
raspagem profunda das áreas quebradiças, distróficas e descoloradas da lâmina ungueal
e/ou dos depósitos subungueais. Os espécimens de cabelo devem ser coletados por
arrancamento com pinça, já que o foco infeccioso se encontra no bulbo piloso, técnica
da escova de cabelo, técnica do quadro de cabelo ou lampada de Wood.
1.8. Tecidos: biópsias de sítios suspeitos devem ser transportadas em gaze estéril
umedecida em salina ou em frasco estéril contendo salina. Os espécimens de biópsia
devem apresentar uma área de tecido são e lesado. O material não deve estar congelado,
desidratado ou formolisado.
1.9. Sangue: coleta de sangue venoso feita por punção com seringa e agulha estéreis.
Frasco de hemocultura bifásico (agar BHI-caldo BHI) ventilados devem ser empregados
para cultura.
Fungos patogênicos mais comuns e principais sítios anatômicos
Sangue
LCR
Trato Genitourinário
Trato Respiratório
Pele e Anexos
C. immitis
H. capsulatum
S. schenckii
Candida spp.
C. neoformans
P. brasiliensis
B. dermatitidis
C. immitis
H. capsulatum
Aspergillus spp.
Candida spp.
C. neoformans
S. schenckii
B. dermatitidis
C. immitis
H. capsulatum
Candida spp.
C. neoformans
B. dermatitidis
C. immitis
H. capsulatum
P. brasiliensis
S. schenckii
Aspergillus spp.
Candida spp.
C. neoformans
Zigomicetes
B. dermatitidis
C. immitis
Dermatófitos
H. capsulatum
P. brasiliensis
S. schenckii
Aspergillus spp.
Candida spp.
C. neoformans
Zigomicetes

26
Critérios de recusa de amostras clínicas para cultivo micológico
Critério para recusa
Ação
Sem identificação no recipiente que contém o material clínico ou discrepância de informação sobre o paciente na requisição do exame e na etiqueta de identificação do material clínico
Devolver a quem enviou para esclarecimentos
Esfregaço de escarro corados pelo Gram com 15 células epiteliais por campo microscópico
Quando se suspeita de uma infecção de trato respiratório baixo, a presença de grande quantidade de células epiteliais em amostras de escarro indica contaminação com secreções orais; isto não é necessariamente um critério de recusa já que se pode recuperar fungos patogênicos particularmente se são empregados meios seletivos; cada caso deve ser analisado individualmente
Swab seco ou material insuficiente
Pedir uma nova amostra se a condição clínica justifica; se uma nova amostra é viável, mas não é possível obtê-la por e técnicas não invasivas, pode ser necessário a coleta por biópsias
Amostras de urina ou escarros de 14 horas
Notificar que as amostras de 14 horas são inaceitáveis e pedir o envia de amostras matinas com no máximo 1 horas de colhidas
Material adequado remetido em recipiente inapropriado; falta de esterilidade, presença de vasamentos, não refrigeração
Pedir o reenvio de amostras em frascos apropriados
1. PROCESSAMENTO DO ESPÉCIMEN CLÍNICO
1.1. Pré-tratamento
a. Secreções Respiratórias: lise com agentes mucolíticos (N-acetil-l-cisteína, pancreatina
0,5%, fluimicil). É um procedimento opcional, pode melhorar a recuperação dos
microganismos patogênicos, mas fungos contaminates também são benificiados.
b. Fluidos Corporais (líquido céfalo-raquidiano, líquido sinovial): filtração (filtro de
0,11µm) ou centrifugação (1500 a 1500g). É necessário para uma ótima recuperação,
dev ser procedida em espécimens com volume maior que 1-1ml.
c. Urina: centrifugação(1500 a 1500g). É necessária para uma ótima recuperação,
especialmente quando se tratar de agentes de micoses profundas.

27
d. Tecido: trituração com gral e pistilo ou cortes em pequenos fragmentos (zigomicetos)
com bisturi ou tesoura estéreis. É necessário para melhorar a recuperação dos fungos
agentes de micoses profundas.
e. Unhas: macaração prolongada (pernoites) com hidróxido de potássio. É necessário
para uma ótima recuperação de dermatófitos e outros agentes (hifomicetos e leveduras).
1.1. Exame microscópico direto dos espécimens clínicos
a. Azul de Alciano
Uso: detecção de Cryptococcus neoformans
Tempo requerido: 1 minutos
Vantagem: quando positivo em LCR é diagnóstico
Desvantagem: não é comumente empregado, como a tinta da china não detecta todos os
casos
b. Álcool-ácido resistência
Uso: detecção de Mycobacteria e Nocardia spp.
Tempo requerido: 11 minutos
Vantagem: cora Nocardia spp e Blastomyces dermatitidis
Desvantagem: espécimens de tecido são difíceis de interpretar poe causa da forte
coloração de fundo
c. Branco de Calcoflúor
Uso: detecção específica de fungos
Tempo requerido: 1 minuto
Vantagem: pode ser misturado ao KOH; detecta fungos rapidamente como resutado de
fluorescência brillhante (reação específica com a quitina da parede fúngica)
Desvantagem: requer microscópio de fluorescência; prominente fundo
fluorescente’porém o fungo apresenta uma fluorescencia mais intensa; secreções
vaginais são difíceis de interpretar
d. Giemsa
Uso: exame de medula óssea ou esfregaço de sangue periférico
Tempo requerido: 15 minutos

28
Vantagem: detecção de Histoplasma capsulatum intracelular
Desvantagem: detecção usualmente limitada ao Histoplasma capsulatum
e. Gram
Uso: detecção de bactérias
Tempo requerido: 3 minutos
Vantagem: empregado no exame bacterioscópico do espécimen clínico; permite a
identificação da maioria dos fungos
Desvantagem: alguns fungos se coram bem, outros, por exemplo o Cryptococcus
neoformans, coram-se fracamente e exibem apenas um aspecto pontilhado. Alumas
Nocardia isoladas falham em corar ou coram fracamente. Artefatos mimetizam as
leveduras
f. Tinta da China
Uso: detecção de Cryptococcus neoformans
Tempo requerido: 1 minuto
Vantagem: quando positivo no LCR é diagnóstico de meningite
Desvantagem: negativo em muitos casos de meningite, não confiável
g. Hidróxido de Potássio
Uso: detecção clarear o espécimen para tornar o fungo mais visível
Tempo requerido: 5 minutos, se o clareamento não é completo, um tempo maior é
necessário (10 minutos)
Vantagem: rápida detecção de elementos fúngicos
Desvantagem: requer experiência, já que os artefatos podem confundir o analista. O
clareamento de alguns espécimens pode ser demorado (unha)
h. Azul de Metileno
Uso: detecçãodetecção do fungo em escamas de pele
Tempo requerido: 1 minutos
Vantagem: usualmente adicionado ao KOH, fornece contraste para a detecção dos
elementos fúngicos
Desvantagem: o contraste das células pode ser difícil

29
l. Gromori Metanamina Silver (impregnação pela prata)
Uso: detecção detecção de fungos em cortes histológicos
Tempo requerido: 1 hora
Vantagem: cora especificvamente os elementos fúngicos
Desvantagem: método de coloração fúngica que não está usualmente disponível no
laboratório de micologia clínica
m. Papanicolaou
Uso: exame de secreção vaginal para a presença de células malígnas
Tempo requerido: 30 minutos
Vantagem: citotécnico pode identificar elementos fúngicos
Desvantagem: requer coloração especializada e analista familiarizado com essa
coloração
n. Ácido periódico de Schiff (PAS)
Uso: detecção específica de fungos
Tempo requerido: 10 minutos, 5 minutos adicionais se coloração com contraste for
empregada
Vantagem: cora elementos fúngicos bastante bem, hifas e leveduras podem ser
prontamente distingüidos
Desvantagem: Nocardia spp. não se coram bem, Blastomyces dermatitidis aparece
pleomorfisado, artefatos PAS positivos podem aparecer com células de levedura
o. Wright
Uso: exame de medula óssea ou esfregaço de sangue periférico
Tempo requerido: 7 minutos
Vantagem: detecta Histoplasma capsulatum
Desvantagem: detecção limitada ao Histoplasma capsulatum

30
Característica dos elementos fúngicos vistos em exame direto dos espécimens clínicos
Morfologia em Tecido
Organismos
Tamaho (µm)
Aspectos Característicos
Leveduras
Histoplasma capsulatum
1-5
pequenas, ovaladas a arredondadas; gemulantes; frequentemente encontradas em cachos dentro de histiócitos; detecção difícil quando em pequenas quantidades, normalmente intracelulares
Sporothrix schenckii 1-6 pequenas, ovais a arredondadas ou em forma de charuto; gemulação simples ou múltipla; raramente vistas em espécimens clínicos
Cryptococcus neoformans 1-15 as células variam de tamanho, usualmente são esféricas, mas podem ter a forma de uma “bola de football americano”; gêmulas são normalmente simples; cápsulas podem ser ou não evidentes; raramente pseudohifas são formadas
Blsatomyces dermatitidis 8-15 as células são comumente grandes e esféricas, com paredes duplas e refratárias; gemulação normalmente simples, gêmulas podem manter-se ligadas à célula mãe, a ligação entre célula mãe e célula filha é estreita
Paracoccidioides brasiliensis
5-60 as células são normalmente grandes e envolvidas por pequenas leveduras periféricas (leme de navio, chapéu de Mickey); pequenas células podem estar presentes e lembrar as de H. capsulatum
Esférulas Coccidioides immitis 10-100 as esférulas variam muito no tamnho, algumas contêm endosporos, outras estão vazias; duas esférulas juntas podem lembrar células de B. dermatitidis gemulantes; endosporos podem lembrar as células de H. capsulatum, mas não mostram evidências de gemulação; as eférulas podem produzir múltiplos tubos germinativos, se a preparação direta for mantida em câma úmida por mais de 14h.; hifas podem ser encontradas em lesões cavitárias
Esporângios Rhinosporidium seeberi 6-300 grandes com paredes espessas e contendo endosporos; maduros esporângios são maiores do que as esférulas de C. immitis

31
Continuação
Morfologia em Tecido
Organismos
Tamaho (µm)
Aspectos Característicos
Leveduras, pseudohifas ou hifas vedadeiras
Candida spp.
Levedura: 3- 4 Pseudohifa: 5-10
as células usualmente exibem simples gemulação; pseudohifas quando presentes apresentam constricções nos pntos de constricções e matêm-se unidas com “cordão de salsichas”; hifas verdadeiras quando presentes têm paredes paralelas e são septadas
Leveduras e hifas Malassezia furfur Levedura: 3- 8 Hifa: 1,5-4
elementos hifálicos curtos e encurvados estão presentes com cachos de células de leveduras esféricas
Hifas septadas largas
Zygomycetes 10-30 hifas são grandes, em forma de fita, freqüentemente encurvadas, ocasionalmente septadas e com ramificações em ângulo reto; pequenas hifas podem ser confundidas com as do Aspergillus spp., particularmente A. flavus
Hifas septadas hialinas
Dermatófitos:
Pele e unhas Pêlos
3-15
3-5
hifas hialinas septadas são comumente vistas; cadeias de artrosporos podem estar presentes artrosporos na periferia do fio de cabelo, produzindo uma bainha que indica infecção ectotrix; artropsoros formados pela fragmentação de hifas dentro do fio de cabelo são indicativos de infecção endotrix; filamentos hialinos longos ou canais dentro dos pêlos são indicativos de favus
Aspergillus spp. 3-11 as hifas são septadas e exibem ramificação dicotômica com ângulo de 45o; grandes hifas atípicas podem lembrar as de zigomicetos
Geotricchum spp. 4-11 hifas e artrosporos retangulares estão presentes; formas irrregulares podem ser observadas
Trichospporon spp. 1-4/8 hifas e artrosporos retangulares a ovalados estão presentes; blastosporos podem ser difíceis de ser em observados

32
Continuação
Morfologia em Tecido
Organismos
Tamaho (µm)
Aspectos Característicos
Penicillium spp. Scopulariopsis spp. Paecilomyces spp. Fusarium spp. Pseuallescheria boydii
hifas são septadas e impossíveis de distingüir das outras dos demais fungos hialinos, p.ex. Aspergillus spp.
Hifas septadas demáceas
Alternaria spp. Bipolaris spp. Cladosporium spp. Curvularisa spp. Drechslera spp. Exophiala spp. Phialophora spp. Wangiella dermatitidis
1-6
hifas demáceas polimórficas são vistas; células gemulantes com septos simples e cadeias de células arredondadas e entumescidas podem estar presentes; ocasionalmente agragados podem ser encontrados em infecção por Phialophora e Exophiala
Corpúsculos Muriformes
Cladosporium carrionii Fonsecaea compacta Fonsecaea pedrosoi Phialophora verrucosa Rhinocladiella aquaspersa
5-10
células de paredes marrom e espessas, arredondadas e pleomórficas asseptadas, unissetadas e septadas em dois planos; comumente as células contêm duas divisões que formam 4 células; ocasionalmente hifas septadas ramificadas podem ser encontradas além dos corpúsculos muriformes
Grânulos Acremonium falciforme Acremonium kiliensi Acremonium recifei Curvularia geniculata Curvularia lunata Aspergillus nidulans Exophiala jeanselmei
100-300
500-1000
65-160
100-300
grânulos brancos, macios sem matriz cementada grânulos negros, duros com matriz cementada na periferia grânulos negros, macios, sem matriz cementada grânulos negros, macios, vacuolados, sem matriz cementada, formados a partir de hifas escuras e células entumescidas
Fusarium moniliforme Fusarium solani Leptosphaeria senegalensis Leptosphaeria tompkinsii
100-500 300-600
400-600 500-1000
grânulos brancos e macios, sem matriz cementada grânulos negfros, duros, com matriz cementada; periferia composta de células poligonais; centro formado por rede de hifas

33
Continuação
Morfologia em Tecido
Organismos
Tamaho (µm)
Aspectos Característicos
Madurella grisea
50-500
grânulos negros e macios, sem matriz cementada; periferia composta de células poligonais entumescidas; centro formado por rede de hifas
Madurella mycetomatis
100-900
grânulos negros a marrons-escuros, duros que podem ser de dois tipos:
marrom ferrugem, compacto e preenchido com matriz cementada
marrom escuro e preenchido com numerosas vesículas (6-14µm), matriz cementada na periferia e área central de hifas claras
Neotestudina rosatii
300-600
grânulos brancos com matriz cementada presente na periferia
Pseudoallescheria boydii 100-300 grânulos brancos, macios, compostos de hifas e células entumescidas na periferia dentro de uma matriz cementada
Pyrenochaeta romeroi 300-600 grânulos negros, macios, compostos de células poligonais entumescidas na periferia; centro formado por rede de hifas; sem matriz cementada
3. CULTURA
3.1. Meios de cultura
a. Isolamento primário
• Agar de Sabouraud 1% (SDA): recuperação primária de fungos sapróbios e
patogênicos (não aconselhável)
• Agar infusão de cérebro-coração (BHIA): recuperação primária de fungos sapróbios
e patogênicos
• Agar infusão de cérebro-coração com cloranfenicol e cicloheximida: recuperação
primária de fungos sapróbios e patogênicos, excluindo-se os dermatófitos
• Agar de Sabouraud e Agar BHI (SABHI): recuperação primária de fungos
sapróbios e patogêncios
• Agar mycosel: principal meio de recuperação primária de dermatofitos

34
• Frasco de hemocultura bifásico (agar BHI e caldo BHI): recuperação primária de
fungos do sangue
Meios de cultivo para recuperação de fungos de amostras clínicas
Sangue medula óssea
• agar infusão de cérebro-coração com ou sem sangue de carneiro
LCR
• agar infusão de cérebro-coração com ou sem sangue de carneiro
Pele, pêlos e unhas
• agar mycosel
Membranas mucosas
• agar de Sabouraud com infusão de cérebro-coração; • agar infusão de cérebro-coração com ou sem sangue de carneiro, gentamicina e cloranfenicol; • agar infusão de cérebro coração com ou sem sangue de carneiro, gentamicina, cloranfenicol e cicloheximida.
Abscessos, úlceras e lesões subcutâneas
• agar de Sabouraud com infusão de cérebro-coração; • agar infusão de cérebro-coração com ou sem sangue de carneiro, gentamicina e cloranfenicol; • agar infusão de cérebro-coração com ou sem sangue de carneiro, gentamicina, cloranfenicol e cicloheximida.
Escarro e secreções pulmonares
• agar de Sabouraud com infusão de cérebro-coração; • agar infusão de cérebro-coração com ou sem sangue de carneiro e gentamicina e cloranfenicol; • agar infusão de cérebro-coração com ou sem sangue de carneiro, gentamicina, cloranfenicol e cicloheximida; • agar semente de niger.
Estomatite
• agar de Sabouraud com infusão de cérebro-coração; • agar infusão de cérebro-coração com ou sem sangue de carneiro, gentamicina e cloranfenicol; • agar infusão de cérebro-coração com ou sem sangue de carneiro, gentamicina, cloranfenicol e cicloheximida.
Biópsia
• agar de Sabouraud com infusão de cérebro-coração; • agar infusão de cérebro-coração com ou sem sangue de carneiro, gentamicina e cloranfenicol; • agar infusão de cérebro-coração com ou sem sangue de carneiro, gentamicina, cloranfenicol e cicloheximida.
Urina
• agar de Sabouraud com infusão de cérebro-coração; • agar infusão de cérebro-coração com ou sem sangue de carneiro, gentamicina e cloranfenicol; • agar infusão de cérebro-coração com ou sem sangue de carneiro, gentamicina, cloranfenicol e cicloheximida; • agar semente de niger.

35
Antimicrobianos adicionados aos meios micológicos
ANTIMICROBIANOS
CONCENTRAÇÃO NO MEIO
Antibacterianos
Cloranfenicol 16µg/ml
Gentamincina 5µg/ml
Antifúngico
Cicloheximida 500µg/ml
b. Isolamento secundário
• Agar milho com tween 80: identificação de Candida albicans por produção de
clamidosporos; identificação de outras leveduras por micromorfologia
• Agar base nitrogênio-leveduras (YNB): identificação de leveduras por
determinação de assimilação de açúcares
• Agar base carbono-leveduras (YCB): identificação de espécies de Cryptococcus
pela redução de nitratos
• Agar semente de niger: recuperação e identificação de Cryptococcus neoformans
• Agar ascosporos: detecção de ascosporos em leveduras ascosporogênicas
• Agar uréia: detecção de espécies de Cryptococcus neoformans; diferenciação de
Trichophyton mentagrophytes e Trichophyton rubrum ; detecção das espécies de
Trichosporon
• Agar batata dextrosado: demontração da produção de pigmentos por Trichophyton
rubrum
• Meio de arroz: identificação de Microsporum audoiunii
• Agares “tricofitons” 1-7: identificação dos membros do gênero Trichophyton
• Agar Czapeck: recuperação e identificação diferencial de espécies de Aspergillus e
Penicillium

36
Meios aconselháveis para subcultura de fungos
Grupo
Meios de cultivo
Zygomycetes
agar milho agar de Sabouraud 1%
Fungos hialinos
agar milho agar de Sabouraud
Aspergillus spp.
agar Czapec-Dox
Dermatófitos
agar de Sabouraud
Fungos demáceos
agar milho
Fungos dimórficos
agar infusão de cérebro-coração
Comparação: Placas x Tubos
Característica
Placa
Tubo
Área superficial
grande (aproximadamente
7500mm1 para 100mm de
placa)
pequena (aproximadamente
1500mm1 por tubo de
15x115mm)
Suprimento de oxigênio
bom
pobre
Taxa de desidratação do
meio
rápida
lenta
Segurança no manuseio
pobre
boa
Possibilidade de
disseninação de fungos
grande
pequena
Detecção de culturas mistas
fácil
difícil
Taxa de Crescimento
Grupo
Taxa de crescimento (dias)
Fungos
Crescimento rápido
<5
sapróbios, oportunistas e leveduras
Crescimento intermediário
6-10
oportunistas, subcutâneos e dermetófitos
Crescimento lento
>11
sistêmicos e subcutâneos

37
Distinção entre fungos contaminantes e patogênicos
São os sintomas da infecção consistentes com os sintomas de uma infecção fúngica ?
Os elemtos fúngicos foram visualizados no tecido ou em outro material obtido da lesão ?
Houve crescimento fúngico a partir da cultura do material clínico ?
Houve mais de uma cultura positiva para a mesma espécie fúngica ?
O fungo isolado é capaz de causar os sintomas observados na infecção sob investigação ?
3.1. Inoculação nos meios de cultura a. Equipamentos
• Alça em “L” (dobrada em ângulo reto): fungos filamentosos
• Alça em “gota” (bacteriológica): fungos leveduriformes
• Alça de Drigalski: espalhamento sobre o meio de cultura
• Alça de Hockey: espalhamento sobre o meio de cultura b. Técnicas de inoculação
• Esgotamento sobre a superfície do meio: fungos leveduriformes
• Perfuração do meio: fungos filamentosas
3.4. Tempo de incubação
• Uma semana para fungos sapróbios e oportunistas
• Duas semanas para os dermatófitos
• Quatro semanas até 11 semanas para os fungos patogêncios (dimórficos)
3.5. Temperatura de incubação
• Temperatura ambiente ou 30o C para isolamento primário
• Trinta e sete graus para obtenção do dimorfismo
4. PROCEDIMENTOS GERAIS
4.1. Escarro e secreções respiratórias: selecione as partes mais purulentas,
sanguinolentas, caseosas e necróticas. Se a amostra é muito viscosa, deve-se

38
homogeneizar pela adição de NALC; NAOH e outros agentes de digestão química,
usados para o processamento de espécimens suspeitos de tuberculose, não devem ser
empregados. Prepare uma montagem úmida da amostra para realização de exame direto
e inocule 0,5ml no meio de cultura empregado; como as secreções são freqüentemente
contaminada com bactérias, meios contendo antibióticos devem ser empregados; uma
cobinação de meios seletivos, tal como BHIA com cloranfenicol e cicloheximida, e não
seletivos, tal como SABHI, devem ser utilizada.
4.1. LCR: as amostras podem ser centrifugadas a 1500-100g por 10 minutos e o
sedimento inoculado sobre a superfície do meio de cultura não seletivo (SABHI);
havendo pouca quantidade disponível, inocule no meio 3-4 gotas de espécimen clínico;
montagens com tinta da china (nigrosina) devem ser preparadas quando o C.
neoformans for suspeito; para preparar a montagem microscópica tanto uma gota do
sedimento centrifugado quanto uma alíquota do material in natura devem ser
misturadas a uma gota de tinta china sobre a lâmina; uma lamínula é aplicada e a
preparação microscópica e examinada para a presença de leveduras gemulantes com
cápsulas.
4.3. Urina: entorno de 10 ml de urina deve ser centrifugado e 0,5 ml de sedimento deve
ser inoculado tanto em agar não seletivo (SABHI) quanto em meios seletivos (BHIA
com cloranfenicol e cicloheximida); montagens diretas podem ser preparadas e
examinadas microscopicamente para a presença de leveduras e hifas.
4.4. Pele, pêlos e unhas: escamas de pele, fragmentos de unha e fios de cabelos
arrancados podem ser examinados em preparações microscópicas com KOH; o
propósito do KOH é clarear ou macerar as estruturas proteináceas e escleróticas que
podem dificultar a visualização dos elementos fúngicos (a maceração pode ser acelerada
pelo rápido aquecimento da lâmina sobre a chama do bico de Bunsen); uma lamínula é
aplicada e os espécimens são examinados para a presença de hifas estreitas e regulares
que caracteristicamente se quebram em artrosporos; a visualização da hifa é melhorada
pela adição de calcoflúor ao KOH (microscópio de fluorescência); em pêlos o arranjo
dos esporos na superfície do pêlo (ectotrix) e intrapilarmente (endotrix) podem ser
vistos; fragmentos de hifas podem ser também encontrados dentro dos pêlos; escamas
de pele, fragmentos de unha e pêlo devem ser colacados diretamente sobre a superfície e
dentro do agar mycosel com uma alça em “L”; as áreas inoculadas devem ser

39
examinadas em intervalos freqüentes para o desenvolvimento de colônias; as culturas
devem ser mantidas por pelo menos 30 dias antes de descartar como negativas.
4.5. Tecido: o processamento dos espécimens de tecido pode ser feito a partir da
trituração com gral e pistilo (não recomendável) ou a partir de cortes com tesoura ou
bisturi estéreis; os fragmentos (1mm3) devem ser inoculados diretamente sobre o meio
de cultura e abaixo de sua superfície; homogeneizados de tecido, medula óssea ou
centrifugados de espécimens clínicos (5-10 ml) devem ser depositados sobre meios não
seletivos (SABHI), já que esses espécimens são normalmente estéreis e meios com
antimicrobianos não são necessários.
4.6. Sangue: frascos de hemocultura bifásicos (agar BHI e caldo BHI.
5. IDENTIFICAÇÃO DOS FUNGOS
5.1. Fungos filamentosos
a. Exame Macroscópico:
A morfologia colonial deve ser interpretada com cautela, pois fatores como tipo de meio
de cultura, temperatura de incubação e tempo de incubação interferem no aspecto
macroscópico das culturas fúngicas. As características a serem investigadas são:
• Textura: algodonosa; velutina; granular; pulverulenta ou glabrosa
• Topografia: rugosa; umbeliforme; umbilicada ou verrucosa
• Coloração: negra; cinza; branca; marrom; amarela; creme; laranja; verde; violeta ou
vermelha
b. Exame microscópico
A observação da micromorfologia reprodutiva dos fungos filamentosos é a base do
diagnóstico micológico.
• Exame microscópico direto: um fragmento de cultura é retirado da colônia em tubo
ou placa e montado sobre lâmina e lamínula com líquido de montagem apropriado
(lactofenol de Aman ou lactofenol com azul de algodão) e observado em microscópio
óptico com objetivas de 10x e 40x e luz de baixa intensidade. O exame microscópico

40
direto é de preparação fácil e rápida e normalmente é suficiente para a identificação de
muitos fungos isolados no laboratório. A principal desvantagem do método é a
desorganização das estruturas morfológicas durante a preparação da montagem
microscópica.
• Microcultivo em lâmina: o cultivo de fungos em meios sólidos (agar de Sabouraud)
ou líquidos (caldo de Sabouraud) depositados diretamente sobre lâminas e/ou lamínulas
preservam as estruturas morfológicas, já que não se manipula diretamente os elementos
fúngicos. A principal desvantagem do método é a demora no diagnóstico, pois há a
necessidade de se esperar o crescimento da microcultura. A observação microscópica é
feita como no exame direto.
• Corantes: lactofenol com azul de algodão: fungos hialinos; lactofenol de Aman:
fungos demáceos
Métodos complementares para a identificação de fungos filamentosos
Teste ou Procedimento
Aplicação
Fungos
Dimorfismo
Permite diferenciar os fungos dimórfico pela obtenção de sua fase leveduriforme ou de esférulas quando cultivados à tempratura de 37o C
Blatomyces dermatitidis Coccidioides immitis Histoplasma capsulatum Paracoccidioides brasiliensis Sporothrix schenckii
Exoantígeno
Permite a identificação específica de vários fungos por imunodifusão
Blastomyces dermatitidis Coccidioides immitis Histoplasma capsulatum
Taxa de Crescimento
Permite diferenciar os fungos pela velocidade des crescimento que apresentem
Fungos oportunistas: rápido Dermatófitos: intermediário Fungos sistêmicos: intermediário a lento
Termo-tolerância
Permite diferenciar as espécies patogênicas que apresentam habilidade de crescimento em temperaturas elevadas
Absidia corymbifera: 45-50o C Aspergillus fumigatus: 48-50o C Cladosporium batianum: 41-43o C Cladosporium trichoides: 37-41o C Cunnighamella bertholletie: 41o C Cunnighamella elegans: 40o C Rhizomucor pusillus: 50-55o C Rhizopus microsporus: 45o C Rhizopus oryzae: 45o C

41
Continuação
Teste ou Procedimento
Aplicação
Fungos
Resistência à Cicloheximida
Permite diferenciar as espécies patogênicas a partir da capacidade de crescimento em agar mycosel a 30o C
Epidermophyton floccosum Microsporum spp. Trichophyton spp. Blatomyces dermatitidis Coccidioides immitis Histoplasma capsulatum Paracoccidioides brasiliensis Sporothrix schenckii
Demonstração de Balistosporos
Permite diferenciar alguns fungos da classe dos Zygomycetes pela produção de esporos que são lançados violentamente e aderem na parede do tubo ou placa
Basidiobolus ranarun Conidiobolus coronatus
Perfuração do Fio de Cabelo
Permite diferenciar o Trichophyton mentagrophytes e o Trichophyton rubrum quando cultivados em fios de cabelo esterilizados por autoclavação em tubo ou placa
T. mentagrophytes: perfurações cônicas no fio de cabelo, observadas em microscópio óptico T. rubrum: não produz perfurações no pêlo
Urease
Permite diferenciar o Trichophyton mentagrophytes e o Trichophyton rubrum quando cultivados em agar uréia de Christensen
T. mentagrophytes: urease positivo T. rubrum: urease negativo
Agares “Tricofitons” 1-7
Permite diferenciar nutricionalmente alguns membros do gênero Trichophyton quando cultivados em uma série de meios com ou sem nutrientes agregados
T. tonsurans e T. violaceum: tiamina T. equinum: ácido nicotínico M. megninii: histidina
Crescimento em Arroz
Permite diferenciar o Microsporum canis e o Microsporum audouinii quando cultivados em meios de arroz a 30o C
M. canis: crescimento M. audouinii: sem crescimento
Produção de Pigmentos
Permite diferenciar o Trichophyton rubrum do Trichophyton mentagrophytes quando cultivados em agar batata dextrosado ou agar milho com 1% de glicose e o Microsporum persicolor do Trichophyton mentagrophytes quando cultivados em agar peptona 1%
T. rubrum: pigmento cor de vinho M. persicolor: pigmento cor de rosa T. mentagrophytes: sem pigmentos
Assimilação de Nitrato
Permite diferenciar a Wangiella spp. das outras espécies de fungos dematiáceos
Wangiella dermatitidis: negativo Exophiala jeanselmei: positivo
Proteólise
Permite diferenciar alguns patógenos dematiáceos de sapróbios quando cultivados em caldo contendo gelatina a 11%
Fonsecaea spp.: negativo Cladosporium spp.: positivo
Tolerância ao Cloreto de Sódio
Permite diferenciar alguns fungos dematiáceos quando cultivados na presença de 15% de NaCl
Exophiala werneckii: positivo Exophiala jeanselmei: negativo

42
5.1. Identificação dos fungos leveduriformes a. Exame Macroscópico
É menos distintivo para as espécies de levedura. Também aqui a morfologia colonial
deve ser interpretada com cautela, pois os mesmos fatores (tipo de meio de cultura,
temperatura de incubação e tempo de incubação) que interferem no aspecto
macroscópico das culturas filamentosas influenciam as características
macromorfológicas das colônias levedudriformes. Normalmente, essas colônias têm
uma aparência mucóide ou pastosa e uma topografia lisa ou rugosa. Como nas colônias
filamentosas, diversas cores podem ser descritas, todavia, as colônias de coloração
esbranquiçadas são as mais frequentemente encontradas.
b. Exame Microscópico
Por terem poucas estruturas micromorfológicas que permitam a identificação das
espécies, o exame microscópico deve ser acompanhado de estudo do pefil biquímico.
Empregando-se microscópico óptico, objetivas de 10x e 40x e luz de baixa intensidade,
a observação microscópica pode ser procedida em preparações diretas e/ou em
microcultivos corados com azul de algodão. Células de levedura, blastosporos,
pseudohifas, clamidosporos, artrosporos e hifas vedadeiras são as estruturas
visualizadas.
Métodos de identificação de fungos leveduriformes
Teste ou Procedimento
Aplicação
Fungos
Morfologia em Agar Milho
Permite a diferenciação micromorfológica de algumas leveduras a partir da produção em agar milho com tween 80 de blastosporos, pseudohifas, blastosporos, clamidosporos, hifas verdadeiras e/ou artrosporos
C. albicans: pseudohifas, blastosporos e clamidosporos
Candida spp.: pseudohifas e blastosporos
Trichosporon spp.: hifas e artrosporos
Geotrichum spp.: hifas e artrosporos
Cryptococcus spp.: blastosporos
Candida glabrata: blastosporos
Saccharomyces spp.: blatosporos
Hansenula spp.: blastosporos
Tubo Germinativo
Permite diferenciar a Candida albicans pela produção de tubo germinativo em 0,5ml de soro sanguíneo ou clara de ovo a 37o C por 1-3 horas
C. albicans: tubo germinativo positivo

43
Continuação
Teste ou Procedimento
Aplicação
Fungos
Tinta da China
Permite a diferenciação de leveduras patogênicas pela detecção de cápsulas em coloração de contraste com tinta da china
Cryptococcus neoformans: tinta da china positiva
Assimilação de Carbohidratos
Permite a identificação definitiva das espécies de levedura a partir do de padrões de assimilação de açúcares obtidos em meios sólidos (YNB)
Tabela de valores: crescimento (+), sem crescimento (-)
Fermentação de Carbohidratos
Permite a diferenciação de espécies de levedura a partir de padrões de fermentação de açúcares obtidos em meios líquidos
Tabela de valores: produção de gás (+), sem produção de gás (-)
Assimilação de Nitrato
Permite a diferenciação de espécies de Cryptococcus pela redução do nitrato de potássio obtida em meios sólidos (YCB) ou pelo teste rápido da nitrato-redutase
C. albidus e C. terreus: positivos
Hidrólise da Uréia
Permite a diferenciação de espécies de leveduras patogênicas a partir da produção de urease verificada em agar uréia de Christensen, teste rápido da urease ou teste rápido urease -seletivo
Cryptococcus neoformans: positivo
Trichoporon spp.: positivo
Detecção da Fenol-oxidase
Permite a diferenciação de espécies patogênicas de levedura a partir da síntese de fenol-oxidase verificada pela produção de colônias negras ou marrons em agar semente de niger
Cryptococcus neoformans: positivo
Formação de Ascosporos
Permite diferenciar espécies de levedura pela produção de ascosporos em meio ascosporo-indutor
Saccharomyces e Hansenula: ascosporo positivo

44
Continuação
Teste ou Procedimento
Aplicação
Fungos
Crescimento a 37o C
Permite a diferenciação de espécies patogênicas de levedura pela demonstração de termo-tolerância em agar de Sabouraud a 37o C
Candida albicans: positivo
Cryptococcus neoformans: positivo
Trichospporon beigelii: positivo
Saccharomyces cerevisiae: positivo
Geotrichum candidum: negativo
Formação de Película
Permite a diferenciação de espécies de levedura pela habilidade de formação de película superficial em caldo de Sabouraud
Candida tropicalis: positivo
Candida krusei: positivo
Trichoporon spp.: positivo
Geotrichum candidum: positivo

Fungos Leveduriformes (Cultura Pura)
Tinta da China + Candida albicans Agar Milho
(Micromorfologia)
Tubo Germinativo
+ -
Blastosporos Pseudohifas, Blastosporos e Clamidosporos
Pseudohifas e Blastosporos Hifas e Artrosporos
Urease
+ -
Candida albicans
Candida spp.
Urease
+ -
Assimilação de Carbohidratos
Trichosporon
(presença de blastosporos)
Geotrichum
(ausência de blastosporos)
Assimilação de Inositol
+ -
Ascosporos
+ -
Assimilação de Nitrato
+ -
Rhodotorula (ausência de balistosporos)
Assimilação de Carbohidratos
Agar Semente de Niger + -
Cryptococcus spp. (identificação final)
Cryptococcus neoformans
Assimilação de Carbohidratos
Cryptococcus spp. (identificação final)
Assimilação de Carbohidratos
Saccharomyces e Hansenula
Assimilação de Carbohidratos
Candida glabrata
Outros Padrões de Assimilação
Candida spp.

46
5.3. Diagnóstico histopatológico
Colorações úteis para o diagnóstico histopatológico das micoses
Coloração
Cor do Fungo
Vantagens
Limitações
Hematoxilina & Eosina
Rosa a rosa azulado
Mostra a resposta tecidual; cora alguns
fungos; não mascara a coloração natural
fúngica; revela o fenômeno de Splendore-
Hoppli
Muitos fungos são pobremente corados ou não se
coram
Gormori-Grocott
Marron escuro sobre um fundo
verde claro
Os fungos são mais prontamente detectados
Mascara a coloração fúngica natural e pode encobrir
detalhes internos dos fungos; a resposta tecidual pode
ser detectada
Ácido Periódico de
Schiff
Rosa avermelhado sobre um
fundo verde
Os fungos são mais prontamente detectados
Mascara a coloração fúngica natural e pode encobrir
detalhes internos dos fungos; a resposta tecidual pode
ser estudada; muitos elementos teciduais também se
coram
Co
lora
ções
Esp
ecia
is p
ara
Fu
ngos
Gridley
Vermelho púrpura sobre um
fundo amarelo
Os fungos são mais prontamente detectados;
detalhes morfológicos dos fungos são
visíveis
Mascara a coloração fúngica natural; fungos não
viáveis no momento da fixação tecidual podem não ser
corados
Mucicarmin de Mayer
Cápsula de Cryptococcus
neoformans vermelha sobre um
fundo púrpura
Permite a diferenciação do C. neoformans das
outras leveduras
Não é específica para C. neoformans e algumas células
podem não se corar; o Rhinosporidium seeberi e o
Blastomyces dermatitidis podem ser corados

47
5.4. Diagnóstico imunológico
Testes imunológicos para a detecção de micoses sistêmicas
Micoses Sistêmicas Fix
ação
de
Com
plem
ento
Con
trai
mun
oele
trof
ores
e
Ens
aio
imun
oenz
imát
ico
Exo
antí
geno
Ant
icor
po F
luor
esce
nte
Imun
odifu
são
Agl
utin
ação
em
Lát
ex
Pro
va d
o Á
cid
o N
ucl
éico
(D
NA
)
Rad
ioim
unoe
nsai
o
Tes
te d
e S
sens
ibili
dade
Cut
ânea
A
glut
inaç
ão e
m T
ubo
Pre
cipi
taçã
o em
Tub
o
Aspergilose
X
X
X
X
X
X
X
Blastomicose X X X X X X X X
Candidíase X X X X X X
Coccidioidomicose X X X X X X X X
Criptococose X X X X X
Histoplasmose X X X X X X X X X
Paracoccidioidomicose X X X X X X X
Esporotricose X X X X X X X X

ASPERGILOSE
a. SINONÍMIA: sem referência
b. DEFINIÇÃO: a aspergilose é um espectro de doenças causadas por membros do genêro
Aspergillus. A manifestação clínica e a severidade da doença dependem do estado fisiológico
do paciente e da espécie de Aspergillus envolvida. Hospedeiros com resistência diminuída
por doença debilitante, quimioterapia, perda da microbiota normal e imunocomprometimento
pelo uso de antimicrobiano e esteróides podem predispor o paciente à colonização e/ou à
doença invasiva. Aspergillus spp. são frequentemente patógenos secundários oportunísticos
em pacientes com bronquiectasia, carcinomas, outras micoses e tuberculose.
c. FORMAS CLÍNICAS: colonização; infecção; alergias e toxicoses.
d. PROGNÓSTICO E TRATAMENTO: o prognóstico depende do tipo e da severidade da
doença e também do status fisiológico do paciente. A aspergilose alégica se torna tipicamente
crônica. Contudo, a colonização pode se manter crônica ou mesmo se tornar invasiva. A
aspergilose alérgica tem sido tratada com sucesso com a predinisona, com cromoglicato de
sódio e inalação de nistatina. O uso prolongado de esteróides nos caso de aspergilose crônica
deve ser visto com cautela. Os aspergilomas podem ser tratados por ressecção cirúrgica e
anfotericina B. A aspergilose infecção pode ser tratada com anfotericina B, porém os
Aspergillus não são muito sensíveis nem a este antifúngico e nem à 5-fluorocitosina. Formas
sistêmicas e meningíticas são geralmente fatais, mesmo depois de instituída a terapia.
e. PATOLOGIA: a reação tecidual na aspergilose é representada por uma inflamação
supurativa aguda com áreas de necrose isquêmica. O fungo prolifera como hifas septada com
diâmetro 1,5 a 4,5 µm. As hifas podem apresentar caracteristicamente ramificações
dicotômicas (aproximadamente 45o) com uma aparência geral de “exército em marcha”. As
hifas podem se ramificar irregularmente e ter um aspecto similar a hifas encontradas nos
zigomicetos. Cabeças aspergilares e micélio (aspergilomas) podem ser produzidas em
cavidades pulmonares. Invasão de vasos sangüíneos, trombose, enfartamentos e disseminação
são extremamente comuns.
f. LABORATÓRIO: Exame Direto: os materiais clínicos, tais como fluídos, escarro ou
tecidos, são montados em KOH a 10%. Hifas septadas, hialinas, ramificadas e longas,

49
medindo aproximadamente 3.0µm de diâmetro são observadas nas aspergiloses. A
demonstração das hifas nos espécimens clínicos e a recuperação repetida da mesma espécie de
Aspergillus em cultura é um forte indício de aspergilose. Deve sempre ser lembrado que um
número de outros fungos pode ser morfologicamente idêntico ao Aspergillus no tecido. Em
ocasiões raras, o micélio pode dar origem a corpos de frutificação (cabeçAqs aspergilares) e
conídios na fase parasitária. Isolamento: o material clínico deve ser inoculado em SDA com
cloranfenicol e incubados a 30o C. Os Aspergillus são sensíveis à cicloheximida, dessa forma,
eles não irão crescer em meio que contenham este antifúngico. O descarte de culturas
negativas deve ocorrer só depois de 4 semanas.
g. MICOLOGIA: Aspergillus flavus; A. fumigatus; A. glaucus; A. nidulans; A. niger e A.
terreus.
h. HABITAT NATURAL: solo e vegetais

50
BLASTOMICOSE NORTE AMERICANA
a. SINONÍMIA: Doença de Chicago, Doença de Gilchrist..
b. DEFINIÇÃO: a blastomicose norte americana pode ser uma infecção benigna e
autolimitada ou ainda uma micose crônica granulomatosa e supurativa, na qual a infecção
primária é iniciada nos pulmões com freqüente disseminação para outros orgãos do corpo,
especialmente pele e ossos. A doença é mais prevalente em homens de 40 a 60 anos de idade
e em crianças. A blastomicose pode coexistir com carcinoma broncogênico, histoplasmose,
doença pulmonar severa e tuberculose.
c. FORMAS CLÍNICAS: crônica óssea; primária pulmonar e sistêmica.
d. PROGNÓSTICO E TRATAMENTO: a terapia é necessária. A anfotericina B é a droga de
escolha.
e. PATOLOGIA: a resposta do tecido é uma combinação de inflamação granulomatosa e
supurativa aguda. Estas podem variar proporcionalmente de pessoa a pessoa e de um sítio
anatômico para o outro no mesmo indivíduo. Os pulmões geralmente apresentam um
processo inflamatório granulomatoso disseminado com pequenas áreas abscedadas. Os fungos
são geralmente demosntrados nos bordos ou margens dos abscessos. O envolvimento cutâneo
mostra uma hiperplasia pseudoepiteliomatosa com microabscessos focais nas papilas
dérmicas. As células de levedura são globosas a ovóides com aproximadamente 8 a 15µm de
diâmetro. Um simples blastosporos está unido à célula mãe por uma base de inserção larga.
Na maioria das vezes, é visto predominantemente celulas simples sem a presença de
blastosporos. A parede celular da levedura é espessa e duplamente refratária.
f. LABORATÓRIO: Exame Direto: o material clínicos, tais como fluídos prostáticos, escarros
ou tecidos, são examinadso ao KOH a 10%. O fungo usualmente ocorre como uma levedura
globosa de paredes espessas e refringentes que mede de 8 a 15µm de diâmetro, contudo,
algumas leveduras podem apresentar um diâmetro de até 30µm. O fungo pode apresentar
também células de levedura que têm menos do que 8µm. Cada blastosporo está ligado à célula
mãe por uma base larga. Pelo seu tamanho, o Blastomyces dermatitidis, sob certas
circunstâncias, pode ser confundido com o Coccidioides immitis ou Cryptococcus
neoformans. Isolamento: inocular o material clínico em SDA com cloranfenicol, em agar

51
infusão de cérebro coração com cloranfenicol (BHIA), em agar extrato de levedura-fosfato e
em um meio com cicloheximida e incubar a 30o C. As culturas devem ser mantidas por pelo
menos 4 semanas antes de serem despresadas como negativas. O Blastomyces dermatitidis
cresce melhor em agar extrato de levedura. Confirmação Laboratorial: a conversão da forma
filamentosa à leveduriforme é necessária para assegurar que o fungo suspeito é o
Blastomyces dermatitidis e não outro fungo similar, tal como o Chrysosporium ou o
Sepedonium. A conversão do fungo pode ser prontamente acompanhada no agar de Kelley
ou em agar sangue suplementado com vitaminas. Incubar os tubos inoculados a 37o C. A
forma de levedura irá crescer dentro de alguns dias.
g. MICOLOGIA: Blastomyces dermatitidis; Ajellomyces dermatitidis (forma sexuada).
h. HABITAT NATURAL: America do Norte

52
BLASTOMICOSE QUELOIDIANA
a. SINONÍMIA: Lobomicose, Doença de Jorge lobo.
b. DEFINIÇÃO: a lobomicose é uma infecção cutânea crônica que se manifesta como
quelóides, lesões verrucosas a nodulares, placas crostosas e tumores. O fungo cresce como
células globosas que se conectam umas com as outras por uma base de inserção estreita. As
células podem formar ainda cadeias ramificadas. As lesões desenvolvidas são bem definidas,
macias, indolores e móveis, já que estas se encontram livres nos tecidos mais profundos.
Lesões antigas tornam-se verrucosas e ulceradas com lesões satélites resultantes de
autoinfecção.
c. FORMA CLÍNICA: cutânea.
d. Prognóstico e Tratamento: as lesões são tratadas por excisão cirúrgica, pois
reincidências comumente ocorrem. Esta excisão deve ser ampla, o que pode resultar em novas
cicatrizes.
e. PATOLOGIA: os nódulos são formados por granulomas histiocitários subepidermais que
se encontram sob a pele e o tecido subcutâneo. Tecido fibroso está disperso por entre um
grande número de celulas gigantes e histiócitos. As células gigantes têm de 40 a 80µm de
diâmetro. Nas lesões antigas, infiltrados piogênicos, paraceratose e acantose estão presentes.
Hiperplasia pseudoepiteliomatosa e abscessos intraepidérmicos estão ausentes. O fungo
ocorre como cadeias de células globosas de 7 a 14 µm de diâmetro. Cada célula está
conectada à células adjacentes por uma base de inserção estreita. Algumas destas células
ocorrem dentro de células gigantes e magrófagos, mas a maioria está entre elas.
f. LABORATÓRIO: Exame direto: o material clínico, tecidos cutâneo e subcutâneo, é
montado em KOH a 10% e examinado para a presença de cadeias de células globosas em
forma de “limão” ou “ampulheta”. Isolamento: o fungo não tem sido cultivado.
g. MICOLOGIA: Paracoccidioides loboi (ou Loboa loboi ).
h. HABITAT NATURAL: desconhecido.

53
CANDIDÍASE
a. SINONÍMIA: Candidose, Monilíase.
b. DEFINIÇÃO: cadidíase é uma infecção micótica primária ou secundária causada por
diversos fungos do gênero Candida. As manifestações clínicas podem ser agudas, subagudas,
crônicas ou episódicas. A doença apresenta certa dificuldade de diagnóstico devido ao fato
dos membros do gênero Candida serem também comumente recuperados de indivíduos
saudáveis.
c. FORMAS CLÍNICAS: alérgica; cutânea; mucocutânea e sistêmica.
d. PROGNÓSTICO E TRATAMENTO: o prognóstico depende quase que inteiramente do
tipo e da severidade dos fatores predisponentes e da subsequente forma clínica da candidíase.
A nistatina é efetiva no controle do “thrush”, da doença cutânea, periníquea, doença
esofagiana crônica, vaginites e infecções gastrointestinais. A anfotericina B pode ser usada
topicamente e é a droga de escolha no tratamento da candidíase disseminada ou sistêmica e
candidíase mucocutânea crônica. Aproximadamente 60% dos isolados de C. albicans
recuperados de pacientes previamente não tratados são sensíveis à 5-fluorocitosina. A droga
tem sido útil no tratamento da doença sistêmica. O teste de susceptibilidade e monitoramento
dos níveis séricos da 5-fluorocitosina são obrigatórios quando este agente antifúngico é
empregado.
e. PATOLOGIA: a reação tecidual é inicialmente uma inflamação supurativa aguda seguida
por uma reação inflamtória granulomatosa. A formação de abscessos é bastante comum.
Blastosporos e pseudohifas são ambos vistos em secções teciduais. Essas formas são melhor
visualizadas por colorações especiais, tais como PAS (periodic acid-Schiff) e GMS (Gomori
menthenamine silver). Os blastosporos são ovóides e usualmente de 3 a 4µm de diâmetro.
Algumas espécies de Candida podem produzir, sob certas condições, hifas verdadeiras.
f. LABORATÓRIO: Exame Direto: células de levedura gemulantes, de forma ovóide e com 3
a 7µm de diâmetro; pseudohifas; hifas verdadeiras são usualmente visualizadas nos
espécimens clínicos montados em KOH a 10%. Pode ser extremamente difícil diferenciar a
Candida sp. de fungos como Aspergillus, Trichosporon e Geotrichum porque eles são
todos capazes de produzir hifas verdadeiras morfologicamente muito semelhantes. Tubos

54
germinativos e clamidosporos são observados em C. albicans. Isolamento: incubar o material
clínico em SDA com cloranfenicol. Muitas espécies de candida (C. krusei, C. parapsilosis e
C. tropicalis) são sensíveis à cicloheximida. Meios com cicloheximida devem ser usados com
cautela. Incubar a 30o C. O crescimento está presente em 1 a 5 dias. Fluido espinhal e sangue
devem ser processados por filtração. Identificação: baseada na produção de tubo
germinnativo, pseudohifas, hifas verdadeiras, clamidosporos, zimograma e auxanograma de
carbohidratos, auxanograma dos compostos nitorgenados.
g. MICOLOGIA: Candida albicans; C. krusei; C. guilhermondii; C. parapsilosis; C.
pseudotropicalis; C. stellatoidea e C. tropicalis.
h. HABITAT NATURAL: homem, animais, solo e vegetais

55
COCCIDIOIDOMICOSE
a. SINONÍMIA: Febre do Vale de São Joaquim, Granulomatose Coccidióidica
b. DEFINIÇÃO: a coccidiodomicose é uma infecção respiratória que apresenta resolução
rápida. A micose pode se tornar aguda, crônica, severa ou fatal. A doença pode levar a uma
condição pulmonar crônica ou disseminar para meninges, ossos, articulações ou tecido
cutâneo e subcutâneo. A resposta tecidual inicial na doença disseminada é a supuração,
contudo, a doença progressiva e crônica é caracterizada por uma reação granulomatosa com
algumas áreas apresentando resposta celular mista. Acredita-se que o restabelecimento
resulte em imunidade a reinfecção. Aproximadamente 60% dos pacientes com infecção
primária são assintomáticos, 40% têm uma doença pulmonar moderada a aguda e entorno de
0,5% desenvolvem doença extremamente grave. Mais ou menos 15% dos pacientes com
doença disseminada têm meningite.
c. FORMAS CLÍNICAS: primária: pulmonar e cutânea; secundária: pulmonar e
disseminada.
d. PROGNÓSTICO E TRATAMENTO: a coccidioidomicose primária é tratada com repouso
e restrição da atividade. Esteróides podem ser usados para controlar reações alérgicas. A
doença secundária não tratada tem um prognóstico grave. A droga de escolha é a anfotericina
B. A meningite usualmente requer adminstração intratecal e intravenosa de anfotericina B. A
5-fluorocitosina tem pouco valor no tratamento das coccidioidomicose. Alguns pacientes
tratados com miconazole apresentam uma alta taxa de recorrência.
e. PATOLOGIA: a reação tecidual é uma inflamação granulomatosa e supurativa aguda. A
supuração aguda está usualmente presente entorno dos artrosporos e depois da ruptura das
esférulas. Inflamação granulomatosa normalmente ocorre ao redor da esférula em
desenvolvimento. Hifas podem estar presentes na cavidade pulmonar e em lesões
meningianas sem formar artrosporos, o que pode levar a confusões com hifas de Aspergillus.
f. LABORATÓRIO: Exame Direto: espécimens clínicos, tais como flúidos, escarro e tecidos,
são examinados em KOH a 10%. Esférulas com paredes espessas (entorno de 1µm) de 30 a
60µm de diâmetro e endosporos de 1 a 5µm de diâmetro são característicos de Coccidioides
immitis . Os endosporos são liberados quando a parede da esférula é rompida. Confusões

56
podem ser feitas com o Blastomyces dermatitidis se os endosporos não estão em grande
quantidade dentro das esférulas. Isolamento: inocular o material clínico em SDA com
cloranfenicol e em um meio contendo cicloheximida e cloranfenicol e incubar a 30o C. As
culturas devem ser mantidas por 4 semanas antes de serem descartadas como negativas. O
fungo cresce muito rápido e prontamente produz artrosporos em forma de “barri” de 1,5 a
4µm e 3 a 6µm com uma célula dijuntora (sem contúdo citoplasmático) entre cada artrosporo.
O C. immitis é um fungo perigoso e deve ser manipulado todo o tempo em cabine de
segurança biológica classe II ou III. Confirmação Laboratorial: a confirmação laboratorial
com C. immitis é necessária porque outros fungos, tais como os membros da família
Gymnoascaceae, podem desenvolver anamorfos semelhantes ao C. immitis. Procedimentos
laboratoriais incluem meios especiais para a conversão e também técnica de exoantígenos.
Estudos com modelos animais podem ser necessários, em alguns casos.
g. MICOLOGIA: Coccidioides immitis.
h. HABITAT NATURAL: Solos alcalinos da américa do norte e latina.

57
CRIPTOCOCOSE
a. SINONÍMIA: Blastomicose Européia, Torulose.
b. DEFINIÇÃO: a criptococcose é uma doença crônica, subaguda a aguda pulmomar,
sistêmica ou meningítica. A infecção primária ocorre nos pulmões após a inalação dos
elementos fúngicos em suspensão no ar. A infecção pode manter-se localizada nos pulmõesz
ou disseminara outros orgãos. Na disseminação, o fungo normalmente mostra predileção pelo
sistema nervoso central. A infecção pulmonar primária não tem sintomas caracteríticos e, na
maioria das vezes, é assintomática. A doença encefálica é a forma mais freqüentemente
diagnosticada.
c. FORMAS CLÍNICAS: encefálica; cutânea e mucocutânea; óssea; pulmonar e viceral.
d. PROGNÓSTICO E TRATAMENTO: as lesões pulmonares localizadas em pacientes não
imunocomprometidos têm um bom prognóstico, regredindo normalmente sem tratamento. A
disseminação hematogênica para o SNC têm um mau prognóstico, a menos que seja tratada
imediatamente. Infecções sistêmicas são usualmente fatais, especialmente em pacientes
debilitados. Contudo, lesões primárias cutâneas ou mucocutâneas regridem espontaneamente.
A doença crônica é caracterizada, na maioria dos vezes, por intervalos alternados de remissão
ou exarcerbação, mas só eventualmente é fatal. A anfotericina B é a droga de escolha. Lesões
pulmonares crônicas e lesões ósseas podem ser tratadas por excisão cirúrgica. Muitas
amostras rapidamente desenvolvem resistência à 5-fluorocitosina durante a quimioterapia, por
isso, testes de susceptibilidade são requeridos correntemente no tratamento das meningites.
e. PATOLOGIA: a reação tecidual é inicialmente uma degeneração mucóide com áreas de
inflamação, assumindo uma aparência gelatinosa. Grande número de células arredondadas são
encontradas na matriz mucóide. Com o progresso das lesões, reação granulomatosa pode
ocorrer. Os organismos decrescem numericamente e são normalmente encontrados em células
gigantes e histiócitos. Com a resolução, os granulomas antigos apresentam células de levedura
mortas com a cápsula desintegrada. Eles podem ser difíceis de serem vistos nas preparações
corados pela H & E. As leveduras são redondas, tipicamente encapsuladas e com 5 a 15µm de
diâmetro. Os blastosporos estão ligados por uma base estreita. As cápsulas se coram de rosa
pela técnica de mucicarmin.

58
f. LABORATÓRIO: Exame Direto: células de leveduras globosas são facilmente visualizadas
na maioria dos materiais clínicos (Líquido cérebro-epinhal e tecidos) montado em KOH a
10% ou em tinta da china (coloração de fundo). A cápsula pode estar ou não presente.
Isolamento: inocular aspirados e tecidos (processado em homogeneizador) em SDA com
cloranfenicol e incubar a 30o C. O C. neoformans é sensível à cicloheximida. O crescimento
está presente em 1 a 5 dias. O líquido céfalo-raquidiano pode ser processado pela técnica da
filtração ou centrifugação. Identificação: baseada na presença de cápsula, prova da urease,
assimilação de acúcares e nitratos, crescimento a 37o C e patogenicidade para animais.
g. MICOLOGIA: Cryptococcus neoformans (forma assexuada); Filobasidiella neoformans
(forma sexuada).
h. HABITAT NATURAL: fezes de pombos, solo e vegetais (eucalipto).

59
CROMOMICOSE
a. SINONÍMIA: Cromoblastomicose, Dermatite Verrucosa Cromomicótica ou
Cromoparasitária, Blastomicose Negra.
b. DEFINIÇÃO: a cromomicose é uma infecção localizada crônica da pele e tecido
subcutâneo que se segue a uma implantação traumática do agente. As lesões são verrucosas,
ulceradas e crostosas, podendo ainda ser planas ou elevadas. Lesões satélites podem se
desenvolver depois de auto-inoculações e por espalhamento linfático à áreas adjacentes. A
micose usualmente se mantém localizada com extensa formação de quelóides. Depois de
muitos anos as lesões podem lembrar a cabeça de uma “couve-flor”. Alguns agentes
etiológicos dessa doença (Fonsecaea pedrosoi e Phialophora verrucosa) podem disseminar
para o cérebro. Elefantíase e estase linfática podem também ocorrer como resultado de
infecções bacterianas.
c. FORMA CLÍNICAS: dermatite verrucosa; síndrome cerebral; cistos simples e múltiplos e
lesões locais ou assintomáticas.
d. PROGNÓSTICO E TRATAMENTO: a infecção usualmente mantém-se localizada, mas
disseminações hamatogênicas para o cérebro podem ocorrer com grave prognóstico. Estágios
precoces de cromomicose são tratados com excisão cirúrgica, eletrodessecação ou
criocirurgia. A anfotericina B e a 5-fluorocitosina usadas em combinação é a terapia de
escolha.
e. PATOLOGIA: as lesões de pele mostram uma hiperplasia pseudoepiteliomatosa
hiperquerática e microabscessos queratinolíticos na epiderme. Hifas demáceas e corpos
escleróticos ou muriformes são encontrados nas áreas de inflamação dérmica no extrato
córneo. Os corpos escleróticos são redondos, de parede espessa, coloração acastanhada,
asseptados, unisseptados e septados em dois planos e com 5 a 11µm diâmetro. Os abscessos
cerebrais são bem demarcados pela espessa parede. Hifas demáceas irregulares estão dentro
desses abscessos.
f. LABORATÓRIO: Exame Direto: em materiais clínicos como crostas superfíciais,
montados em KOH a 10%, podem ser visualiszadas hifas ramificadas, septadas e escuras,
com 1 a 5µm de diâmetro ao exame microscópio. Pús e tecido granulomatoso obtidos por

60
curetagem ou biópsia de tecido subcutâneo e pele contêm corpúsculos muriformes que são
arredondados, demáceos, de parede espessa e com 5 a 11µm de diâmetro. Isolamento:
inocular os espécimens clínicos em SDA com cloranfenicol e em meio contendo
cicloheximida e cloranfenicol. Incubar a 30o C e descartar como negativas somente depois de
4 semanas.
g. MICOLOGIA: (principais fungos): Cladosporium carreonii; Fonsecaea pedrosoi;
Fonsecaea compacta e Phialophora verrucosa e Rhinocladiella aquaspersa.
h. HABITAT NATURAL: solo e vegetais.

61
DERMATOFITOSE
a. SINONÍMIA: Tinha (Tinea) ou Ringworm.
b. DEFINIÇÃO: O grupo de alterações cutâneas designadas como dermatofitose, ou mais
correntemente como tinha, é considerado, de forma genérica, como um conjunto de lesões
provocadas na pele, nos pêlos e nas unhas, independentemente do tipo clínico e da respectiva
localização, por um grupo de fungos denominados de dermatófitos.
c. FORMAS CLÍNICAS: tinea capitis; tinea barbae; tinea corporis; tinea manuum; tinea
pedis; tinea cruris; tinea unguium; tinea favosa; tinea dos animais e favo dos animais.
d. PROGNÓSTICO E TRATAMENTO: A doença tem um bom prognóstico. As lesões de
pele podem ser tratadas com medicação tópica ou sitêmica. Quando pêlos e unhas são
infectados, o tratamento sistêmico é preferível. Os derivados imidazólicos e triazólicos, a
terbinafina e a griseofulvina são as drogas de eleição. A infecção normalmente está restrita à
pele e seus anexos. Algumas formas regridem espontâneamente.
e. PATOLOGIA: As alterações cutâneas apresentam-se de uma forma geral como pápulas,
vesículas, deformações, destruição de pêlos e unhas, e descamação superficial. As lesões
pápulo-vesiculosas tendem a se agrupar e adquirir aspectos figurados anulares ou policíclicos
que constituem a impigem (lesões arredondadas de bordos elevados e eritematosos). Em
regra, as lesões acantonam-se em áreas limitadas da superfície cutânea, mas eventualmente
adquirem distribuição regional ou dispersa, e em casos mais raros, generalizam-se. Em
determinadas circunstâncias, surgem na evolução das lesões, fenômenos inflamatórios mais
ou menos intensos, particularmente nas áreas pilosas, com aparecimento de tumefação,
nódulos e supuração que clinicamente são chamados de Kerion . A detecção de fluorescência
nos pêlos parasitados pode ser feita utilizando-se uma fonte de radiação ultra-violeta (lampada
de Wood).
f. LABORATÓRIO: Exame Direto: materiais clínicos, tais como pele, pêlos e unhas, são
montados em KOH a 10%. Hifas septadas e grande número de artrosporos estão presentes. O
parasitismo dos pêlos pode apresentar um padrão ectotrix, endotrix ou endo-ectotrix de acordo
com a localização extra ou intrapilar das estruturas fúngicas. Isolamento: Os espécimens são
inoculados em SDA com cloranfenicol e em um meio contendo cicloheximida e cloranfenicol

62
(mycosel) e incubados a 30o C. Colônias são observadas nos meios de culturas depois de 5 a
10 dias de incubação, mas são frequentes períodos mais prolongados. As culturas negativas
devem ser descartadas somente após 4 semanas. Identificação: baseada em características
morfológicas, prova da urease, provas nutricionais e perfuração do pêlo.
g. MICOLOGIA: Microsporum spp.; Trichophyton spp. e Epidermophyton floccosum.
h. HABITAT NATURAL: geofílicos, zoofílicos e antropofílicos.

63
ESPOROTRICOSE
a. SINONÍMIA: sem referência
b. DEFINIÇÃO: a esporotricose é uma infecção crônica caracterizada por lesões nodulares
cutâneas ou subcutâneas com comprometimento de linfonodos adjacentes que supuram,
ulceram e drenam. O espalhamento secundário para as articulações, ossos e músculos podem
ocorrer. A micose pode, ocasionalmente, envolver o sistema nervoso central, pulmões,
sistema genito-urinário ou todos os orgãos. Em caso de doença pulmonar, o fungo ganha
entrada pela inalação de elementos fúngicos em suspensão no ar ou via traumatismo da pele.
c. FORMAS CLÍNICAS: cutânea; disseminada; linfocutânea (linfangite nodular ascendente)
e pulmonar.
d. PROGNÓSTICO E TRATAMENTO: a esporotricose linfocutânea, cutânea e mucocutânea
são infecções crônicas. Disseminações são raras. O prognóstico da doença disseminada é
grave e cura espontâneas são desconhecidas. Iodeto de potássio oral é usado em muitos casos.
O tratamento deve ser feito por pelo menos 4 semanas para que ocorra a cura clínica. A
anfotericina B é usada para o tratamento da doença linfocutânea reincidente, para a
esporotricose pulmonar e para a doença disseminada. Outra droga com variado grau de
sucesso terapêutico é a 5-fluorocitosina. Antibióticos são usados quando infecção bacteriana
secundária está presente.
e. PATOLOGIA: o padrão de infecção é caracteristicamente bem circunscrito e
granulomatoso com área central de supuração aguda. Na pele esse modelo é similar ao que é
visto na blastomicose e na coccidioidomicose. A demonstração do microrganismo é muito
difícil no tecido, por não ser muito numeroso. O fungo é leveduriforme, globoso a ovóide,
com 3 a 5µm de diâmetro e com múltiplos blastosporos. As leveduras não são encapsuladas.
Corpos asteróides podem estar presentes e consistir de uma célula basófila, globosa a ovóide,
de 3 a 5µm de diâmetro, com um raio eosinofílico de 10µm de diâmetro. Os corpos
asteróides parecem ser mais comuns nas lesões secundárias do que nas primárias.
f. LABORATÓRIO: Exame Direto: de execução difícil. A técnica de anticorpos fluorescentes
pode ser útil. A digestão pela diastase antes da coloração pela H & E ou PAS pode ajudar.
Isolamento: inocular aspirados, material de curetagem ou “swabs” de lesões abertas em SDA

64
com cloranfenicol e em um meio contendo cicloheximida e cloranfenicol. Incubar o meio a
30o C. O crescimento ocorre usualmente em três dias. Confirmação Laboratorial: a
conversão da forma filamentosa em leveduriforme é necessária, já que outros fungos são
morfologicamente semelhantes. O fungo deve ser transferido para o agar infusão de cérebro
coração e incubados a 37o C em ambiente com 5 a 10% de CO1.
g. MICOLOGIA: Sporothrix schenckii.
h. HABITAT NATURAL: solo e vegetais.

65
FEOHIFOMICOSE
a. SINONÍMIA: Cisto Feohifomicótico, Feosporotricose, Cisto Micótico Subcutâneo.
b. DEFINIÇÃO: a feohifomicose consiste de um grupo de infecções fúngicas caracterizadas
pela presença de micélio septado demácea nos tecidos. As hifas podem ser curtas ou longas,
tortuosas, entumescentes ou regularmente formadas, ou ainda, podem apresentar uma
combinação de todas essas formas. Os fungos demáceos causadores da feohifomicose
pertencem à classe dos Hyphomycetes, Coelomycetes, Ascomycetes, Blastomycetes e
Deuteromycetes.
c. FORMAS CLÍNICAS: cutânea; córnea; subcutânea e disseminada.
d. PROGNÓSTICO E TRATAMENTO: a maioria dos casos de feohifomicose pode ser
controlada por excisão cirúrgica e quimioterapia. A anfotericina B e a 5-fluorocitisina são
drogas de escolha. O miconazol pode ser útil em alguns casos. A invasão do cérebro tem um
grave prognóstico.
e. PATOLOGIA: a histopatologia varia bastante, indo desde reações teciduais associadas a
abscessos até ativas invasões teciduais pela hifa.
f. LABORATÓRIO: Exame Direto: materiais clínicos, tais como pús e tecidos, são montados
em KOH a 10% para exame. A natureza demácea do elemento hifálico é a chave para o
diagnóstico da feohifomicose. A hifa pode ser variável ou regular em sua forma. Isolamento:
os espécimens são inoculados em SDA com cloranfenicol e em um meio contendo
cicloheximida e cloranfenicol e incubados a 30o C. Todavia, muitos dos seus agentes
etiológicos são sensíveis à cicloheximida. As culturas são descartadas como negativas em 4
semanas. O fungo isolado deve ser compatível com a doença clínica e a morfologia no tecido
(demáceo).
g. MICOLOGIA: (principais fungos): Cladosorium bantianum; Curvularia sp.; Drechslera
sp. e Exophiala jeanselmei.
h. HABITAT NATURAL: solo e vegetais.

66
HIALOHIFOMICOSE
a. SINONÍMIA: sem referência.
b. DEFINIÇÃO: a hialohifomicose consiste de um grupo de infecções fúngicas caracterizadas
pela presença de micélio septado hialino nos tecidos. Os fungos hialinos causadores da
hialohifomicose pertencem à classe dos Hyphomycetes, Coelomycetes, Ascomycetes,
Basidiomycetes e Deuteromycetes. Nos tecidos parasitados esses fungos apresentam
morfologia semelhante, provocando o mesmo tipo de reação tecidual.
c. FORMAS CLÍNICAS: cutânea; onicomicose; ocular; osteoarticular; meningítica; cerebral;
pulmonar; cardíaca e septicêmica.
d. PROGNÓSTICO E TRATAMENTO: a doença em imunocomprometidos pode apresentar
um prognóstico grave. Para o tratamento, pode-se usar a anfotericina B associada ou não à 5-
fluorocitosina. Derivados imidazólicos e triazólicos podem ser empregados. Interveções
cirúrgicas podem ser procedidas nas formas localizadas. O uso de colírio de pimaricina pode
ser empregado nos casos de ceratite.
e. PATOLOGIA: a reação tecidual é bastante variada.
f. LABORATÓRIO: Exame Direto: materiais clínicos, tais como pús e tecidos, são montados
em KOH a 10% para exame. A natureza hialina do elemento hifálico é um aspecto
importamte para o diagnóstico. A hifa pode apresentar uma forma variável ou regular.
Isolamento: os espécimens são inoculados em SDA com cloranfenicol e em um meio
contendo cicloheximida e cloranfenicol e incubados a 30o C. Todavia, muitos dos seus
agentes etiológicos são sensíveis à cicloheximida. As culturas são descartadas como negativas
em 4 semanas. O fungo isolado deve ser compatível com a doença clínica e a morfologia no
tecido (hialino).
g. MICOLOGIA: Acremonium spp.; Beauveria spp.; Fusarium spp.; Paecilomyces spp.;
Penicillium spp.; Pseudoallescheria boydii e Scopulariopsis spp.
h. HABITAT NATURAL: solo e vegetais.

67
HISTOPLASMOSE AMERICANA
a. SINONÍMIA: Histoplasmose Norte Americana
b. DEFINIÇÃO: Aproximadamente 95% dos casos de histoplasmose são inaparentes,
subclínicos e benignos. Cinco porcento têm uma doença pulmonar progressiva crônica ou
uma doença sistêmica aguda fulminante. Todos os estágios dessa doença podem mimetizar a
tuberculose. A histoplasmose pode coexistir com a actinomicose, outra micoses, sarcoidiose
ou tuberculose.
c. FORMAS CLÍNICAS: disseminada e pulmonar.
d. PROGNÓSTICO E TRATAMENTO: a doença disseminada, crônica cavitária,
mucocutânea ou sistêmica requer terapia. A anfotericina B é a droga de eleição. A
recuperação é rápida e essencialmente sem recaídas, se o tratamento adequado é instituido e o
paciente não apresenta doença debilitante associada.
e. PATOLOGIA: o quadro histopatológico na histoplasmose disseminada aguda é diferente
daquele visto na doença mais crônica e nos nódulos pulmonares solitários. Na primeira
entidade, o Histoplasma capsulatum está localizado nos histiócitos e nas células
reticuloendoteliais. As células aumentam, mas sem evidências de inflamação. As leveduras
gemulantes intracelulares são aproximadamente de 3µm de diâmetro e similares às da
Leishmania spp., mas sem apresentarem os cinetoplastos. Em adição, as Leismania não se
coram pelas técnicas especiais de coloração utilizadas para os fungos (PAS, GMS). Lesões
antigas apresentam granulomas bem desenvolvidos e têm uma área central caseosa
semelhante à tuberculose. Os nódulos pulmonares solitários são bem organizados e
frequentemente têm um bordo de calcificação arredondado detectável ao raio-X de tórax. Os
fungos no interior dos nódulos estão normalmente mortos.
f. LABORATÓRIO: Exame Direto: a detecção do fungo no material clínico, tal como medula
óssea, escarro e tecidos, é usualmente difícil. O material corado pela técnica do PAS, Giemsa,
ou GMS são superiores às preparações com KOH. Isolamento: inocular o material em SDA
com cloranfenicol, em agar extrato de levedura-fosfato com cloranfenicol, em um meio
contendo cicloheximida e cloranfenicol, em Sabhi com cloranfenicol e em agar sangue com
cloranfenicol. Incubar as culturas a 30o C e não descartar com menos de 11 semanas.

68
Confirmação Laboratorial: a conversão das formas filamentosas em leveduriformes é
necessária para assegurar que o fungo não é uma espécie de Chrysosporium ou
Sepedonium. Transferir o fungo para um tubo teste contendo agar infusão de cérebro
coração com vitaminas e incubar a 37o C. Técnicas de exoantígenos podem ser empregadas.
g. MICOLOGIA: Histoplasma capsulatum; Ajellomyces capsulatus (forma sexuada).
h. HABITAT NATURAL: solo com altos teores de nitrogênio (cavernas habitadas por
morcegos e deltas de rios).

69
HISTOPLASMOSE AFRICANA
a. SIMONÍMIA: Histoplasmose de Grandes Formas.
b. DEFINIÇÃO: a histoplasmose africana é uma infecção micótica que envolve
primariamente a pele, pulmão, figado, rins, linfonodos, tecido subcutâneo e ossos. Os ossos
são os sítios mais frequentemente invadidos. O agente etiológico cresce como uma grande
levedura dentro das células gigantes e também como células pequenas semelhantes àquelas
vistas na histoplasmose clássica. Os aspectos clínicos primários da histoplasmose africana são
representados por lesões nodulares, cutâneas ulceradas e osteolíticas que podem se disseminar
ou se manter localizadas.
c. FORMAS CLÍNICAS: disseminada e localizada.
d. PROGNÓSTICO E TRATAMENTO: lesões isoladas podem ter cura espontânea ou
requerer intervenção cirúrgica. A doença disseminada tem um prognóstico grave,
especialmente se o pulmão e o baço estão envolvidos. A anfotericina B é a droga preferida.
e. PATOLOGIA: pequena reação celular ao fungo é notada, com excessão do grande número
de células gigantes (com até 80µm) e macrófagos. Neutrófilos estão usualmente presentes,
especialmente durante a necrose. O fungo apresenta paredes grossas, são globosos a ovóides,
têm de 7 a 15µm de diâmetro e podem formar pseudohifas rudimentares com 3 a 5 células.
Grandes agregados de leveduras podem ser prontamente visualizados dentro das células
gigantes e no espaço extracelular, juntamete com necrose do tecido do hospedeiro.
Diferentemente do Blastomyces dermatitidis, os blastosoporos não estão unidos à célula mãe
por uma base de inserção larga.
f. LABORATÓRIO: Exame Direto: espécimens clínicos, tais como tecidos, são examinados
em KOH a 10%. Grandes células de levedura são prontamente observadas. Frequentemente o
Blastomyces dermatitidis é confundido com o agente a histoplasmose africana, já que ambas
ocorrem na África. Isolamento: inocular o material em SDA com cloranfenicol, em agar
extrato de levedura-fosfato com cloranfenicol, em meio contendo cicloheximida e Sabhi com
sangue e cloranfenicol. Incubar as culturas a 30o C e descartar como negativas depois de 11
semanas. Confirmação Laboratorial: a conversão da forma filamentosa à leveduriforme é
requerida para assegurar que o fungo recuperado não é do gênero Chrysosporium ou

70
Sepedonium. Os agentes etiológicos da histoplamose clássica e da histoplasmose africana
são morfologicamente idênticos a 30o C. A conversão das fases é feita em agar infusão de
cérebro coração com vitamina, incubado a 37o C.
g. MICOLOGIA: Histoplasma capsulatum var. duboisii (ou Histoplasma duboisii) e
Ajellomyces capsulatus (forma sexuada)
h. HABITAT NATURAL: solo

71
MICETOMA
a. SINONÍMIA: Pé de Madura, Maduromicetoma, Maduromicose.
b. DEFINIÇÃO: o micetoma é uma síndrome clínica caracterizada por tumefação, fistulação e
granulação. Os micetomas são infecções localizadas que envolvem o tecido cutâneo e
subcutâneo, fácias e ossos. As lesões consistem de abscessos, granulomas e fítulas (tratos
sinuosos drenantes). Após a implantação do agente etiológico, a lesão primária torna-se
localmente invasiva, indolente e tumefeita ou surge como um inchaço subcutâneo, indolor e
pequeno que se torna flegmoso. A ruptura da lesão resulta em trato sinuoso, inchaço e
deformação da parte do corpo afetada. Grânulos estão presentes no pús e no tecido entorno
deste trato sinuoso.
c. PROGNÓSTICO E TRATAMENTO: os micetomas causados por fungos (eumicetomas)
são normalmente resistentes à quimioterapia. Drogas antimicóticas têm sido usadas em
conjunto com cirurgias, com variado grau de sucesso. A amputação é geralmente a ação final.
d. PATOLOGIA: as úlceras e tratos sinuosos abertos são envolvidos por bordas planas ou
elevadas. Os abscessos são preenchidos com material piogênico e grânulos que
freqüentemente são cobertos por um exudato. A parede do abscesso é formada por reação
granulomatosa, inflamação crônica e tecido de granulação.
e. LABORATÓRIO: Exame Direto: pús, exudato ou tecidos devem ser observados
macroscopicamente para a presença de grânulos. Os grânulos são montados em salina estéril,
comprimidos entre lâmina e lamínula e visualizados ao microscópio óptico. Os micetomas
produzidos pelos actinomicetos (actinomicetomas) têm grânulos compostos por filamentos de
0,5 a 1,0µm de diâmetro e elementos bacilares e coccóides. Aqueles produzidos por fungos
são formados por hifas de 1 a 5µm de diâmetro com células dilatadas intercalarmente.
Isolamento: os espécimens contendo fungos são inoculados em SDA com cloranfenicol e
incubados a 30o C. Os grânulos devem ser lavados em água destilada estéril ou salina estéril,
ou ainda em solução antibiótica, antes da inoculação no meio. Alguns fungos são sensíveis à
cicloheximida, por isso, meios contendo esse antifúngico devem ser empregados sempre em
associação com meios livres de antimicrobianos.

72
f. MICOLOGIA: (principais fungos):
Fungo Coloração dos Grânulos
Acremonium falciforme
branco
Acremonium recifei branco
Aspergillus nidulans branco
Exophiala jeanselmi preto
Leptosphaeria senegalensis preto
Madurela grisea preto
Madurela mycetomatis preto
Neotestudina rosatii branco
Petriellidium boydii branco
Pyrenochaeta remoroi preto
g. HABITAT NATURAL: solo e vegetais

73
PARACOCCIDIOIDOMICOSE
a. SINONÍMIA: Blastomicose Sul Americana, Blastomicose Brasileira.
b. DEFINIÇÃO: a paracoccidioidomicose é uma doença granulomatosa crônica que se origina
como uma infecção pulmonar. A disseminação resulta em granuloma ulcerativo na cavidade
nasal e bucal (estomatite ulcerada muriforme), e ainda, ocasionalmente, na mucosa
gastrointestinal. Nódulos linfáticos são comumente envolvidos. A paracoccidioidomicose é
frequentemente encontrada em associação com outras doenças, tal como chagas, infecções
helmínticas, má nutrição, esquistossomose ou tuberculose. A infecção produz basicamente
lesões na orofaringe, gengivas e, menos frequentemente, no trato digestivo e mucosa ano-
retal.
c. FORMAS CLÍNICAS: disseminada; mucocutânea linfática e pulmonar.
d. PROGNÓSTICO E TRATAMENTO: o prognóstico é similar ao de outras micoses
sistêmicas. A anfotericina B é a droga de escolha. As sulfonamidas podem ser usadas no
tratamento e controle de várias formas moderadas da doença.
e. PATOLOGIA: áreas de inflamação granulomatosa apresentando regiões caseosas centrais e
associadas a abscessos piogênicos estão usualmente presentes. Muitas células gigantes
contendo o organismo compõem o granuloma. O fungo ocorre como uma levedura gemulante
de paredes duplas e refringentes, medindo de 11 a 14µm de diâmetro. A célula central é
circundada por numerosos blastosporos de variados tamanhos, ligados à célula mãe por base
de inserção estreita.
f. LABORATÓRIO: Exame Direto: escarro, material de biópsia (base e margem externa das
úlceras), crosta e pus (linfonodos supurativos) contêm as células de levedura. O material é
montado em KOH a 10% para o exame. O fungo é caracterizado por múltiplas gemulações de
pequenas células globosas (1 a 10µm de diâmetro) observadas entorno de uma célula madura
globosa (30µm de diâmetro) de paredes espessas e refringentes, formando figuras
denominadas de “roda de leme” ou “chapéu de mickey”. Isolamento: inocular o material
clínico em BHIA com cloranfenicol e em um meio contendo cicloheximida. Incubar as
células a 30o C e não descartar o material com menos de 4 semanas. As colônias podem
necessitar de 10 ou mais dias para alcançarem 1cm de diâmetro. Confirmação Laboratorial: a

74
conversão da fase filamentosa à fase leveduriforme é necessária, já que o Paracoccidioides
brasiliensis é geralmente estéril na forma filamentosa. Além disso, os conídios quando
formados são muito semelhante àqueles encontrados no gênero Chrysosporium e
Sepedonium. Inocular o fungo em Agar infusão de cérebro coração suplementado com
sangue e vitaminas e incubar a 37o C.
g. MICOLOGIA: Paracoccidioides brasiliensis
h. HABITAT NATURAL: solo e vegetais

75
PITIRÍASE VERSICOLOR
a. SINONÍMIA: Tinea Versicolor, Dermatite furfurácea.
b. DEFINIÇÃO: a pitiríase versicolor é uma dermatomicose muito difundida em todas as
partes do mundo. A doença é caracterizada pelo aparecimento de pequenas manchas bem
delimitadas, de coloração variável, localizadas principalmente no pescoço, ombros, tronco e
abdômen. A superfície das lesões podem se apresentar lisas ou pulverulentas. As manchas
são de coloração amarelada ou parda, e raspando-as com a unha, nota-se ligeira descamação
que constitui o chamado sinal de unhada ou sinal de Besnier.
c. FORMAS CLÍNICAS: folicular; generalizada; inguinal; da face; do couro cabeludo; das
mãos; circinada; pápulo-acromiante e pseudopapulosa.
d. PROGNÓSTICO E TRATAMENTO: A pitiríase versicolor é assintomática, causando
apenas incômodos estéticos. Os derivados imidazólicos e triazólicos são os de preferência de
uso.
e. LABORATÓRIO: Exame Direto: o material clínico, tal como as escamas epidérmicas, é
montado em KOH a 10% para exame. A microscopia revela células de leveduras
arredondadas com um aspecto de “botijão de gás” dispostas como cachos e formas
filamentosas. As células apresentam brotamento polar e a célula mãe se separa da célula filha
por um colarete ou pescoço bem nítido. Apenas com o exame direto é possivel fechar o
diagnóstico. Isolamento: inocular as escamas epidérmicas em Sabouraud dextrose agar
(SDA) acrescido de óleo de oliva (1%), bile bovina (3%), cicloheximida (50mg%) e
cloranfenicol (5mg%) e incubar a 37o C.
f. PATOLOGIA: A principal característica clínica da doença são as manchas associadas à
descamação furfurácea superficial. Lesões acromiantes, hipopigmentadas ou
hiperpigmentadas irão produzir manchas brancas, amareladas, cor de café com leite ou
castanho escuro. O mecanismo patogênico dessa discromia continua por esclarecer, mas não
parece que seja apenas devido ao efeito de “filtro solar” desempenhado pela descamação.
Modificações do fenômeno de queratinização e dificuldades no transporte dos grânulos de
melanina são observados. É possível que exista também uma ação sobre o próprio melanócito.
Essas alterações são decorrentes da ação dos metabólitos do fungo sobre a fisiologia da pele.

76
Os achados histopatológicos revelam sinais de dermite crônicas, hiperqueratose com
penetração folicular, hipergranulose com vacuolização e acantose. Nas lesões
hipopigmentadas registram-se incontinência de melanina. Por vezes há inflamação
perifolicular, outra vezes, há inflamação perivascular.
g. MICOLOGIA: Malassezia furfur (Pityrosporum orbiculare) e Pityrosporum ovale.
h. HABITAT NATURAL: microbiota da pele humana e couro cabeludo.

77
RINOSPORIDIOSE
a. SINONÍMIA: sem referência
b. DEFINIÇÃO: a rinosporidiose é uma infecção micótica das membranas mucosas
caracterizada pelo desenvolvimento de pólipos. Os sintomas variam de acordo com o estágio
de desenvolvimento do tumor e do sítio anatômico. Os pólipos são geralmente rosa ou
púrpura e friáveis.
c. FORMAS CLÍNICAS: cutânea; disseminada (rara); nasal e ocular.
d. PROGNÓSTICO E TRATAMENTO: os pólipos são crônicos, mas indolores. A remoção
cirúrgica e instilação local de anfotericina B são as formas de tratamento mais usadas.
e. PATOLOGIA: grande número de cistos bem definidos estão logo abaixo do epitélio
hiperplásico. O estroma é denso com infiltração crônica e microabscessos purulentos
ocasionais. As esférulas alcançam um tamanho de 300µm de diâmetro e contêm grande
número de endosporos que variam de 7 a 10µm de diâmetro na maturidade. A liberação dos
endoporos produz uma reação inflamatória polimorfonuclear, formação de abscessos e algum
tecido necrótico. Tecidos de granulação são normalmente proeminentes.
f. LABORATÓRIO: Exame Direto: tecido macerado, excisado ou descarga nasal são
montado em KOH a 10% para exame. Esférulas e grande número de endosporos estão
presentes. Isolamento: o organismo não tem sido cultivado.
g. MICOLOGIA: Rhinosporidium seeberi
h. HABITAT NATURAL: águas paradas.

78
ZIGOMICOSE
1. Entomoftoromicose
1.1. Entomoftoromicose causada por Conidiobolus sp. (conidiobolomicose)
a. DEFINIÇÃO: a infecção é um processo inflamatório crônico ou granulomatoso, restrita à
mucosa nasal e caracterizada por pólipos ou massas subcutâneas limitadas e palpáveis. Os
sintomas incluem inchaço nasal, começando nos ossos turbinados inferiores e que podem se
estender por toda a região da orofaringe. As infecções são tipicamente bilaterais, mas podem
ser unilaterais. As massas podem ser desfigurantes, palpáveis e ancoradas. A epiderme pode
tornar-se acantonada (acantótica) e eritematosa. As pálpebras podem apresentar-se inchadas.
O raio-x mostra antro opaco, obliteração dos espaços aéreos nasais e engrossamento da
mucosa. Cerca de 80% dos casos ocorrem em homens.
b. FORMAS CLÍNICAS: mucosa nasal, subcutânea
c. PROGNÓSTICO E TRATAMENTO: a doença é relativamente benigna, algumas vezes
cura espontaneamente. Iodeto de potássio e/ou anfotericina B são drogas de escolha.
d. PATOLOGIA: as hifas são regularmente septadas com 4 a 10µm de diâmetro. Uma bainha
eosinofílica com um arranjo digitiforme semelhante àquela encontrada na esporotricose,
coccidioidomicose, blastomicose, paracoccidioidomicose e mais raramente na candidíase é
observada. Invasão vascular está ausente. A reação celular pode ser aguda e/ou crônica. As
reações inflamatórias crônica são granulomatosas com infiltrados contendo células gigantes
do tipo corpo estranho e hifas fagocitadas. A reação aguda consiste de eosinófilo, linfócitos e
células plasmáticas. Os eosinófilos podem originar abscessos eosinofílicos.
e. LABORATÓRIO: Exame Direto: vesículas macias e/ou raspados de mucosas infectadas
são montados em KOH a 10% e examinados para a presença de hifas septadas, largas e com
paredes duplamente refratarias. Isolamento: incubar o material clínico em SDA com
cloranfenicol e não usar meio contendo cicloheximida, já que o fungo é sensível a este
antimicrobiano. Incubando a 30o C, o crescimento esta presente em 48 horas.
f. MICOLOGIA: Conidiobolus coronatus

79
g. HABITAT NATURAL: solo
1.1. Entomoftoromicose causada por Basidiobolus sp. (basidiobolomicose)
a. DEFINIÇÃO: A micose é uma doença inflamatória crônica ou granulomatosa, geralmente
restrita ao tórax, costas, membros e nádegas. Ela é caracterizada por uma grande quantidade
de massas subcutâneas não ulceradas, endurecidas e palpáveis. A doença ocorre
principalmente em crianças com predominância de meninos. A micose começa como um
nódulo subcutâneo. O inchaço é firme, bem circunscrito, sem dor e com algum prurído. A
massa é palpável e unida a parte superficial da pele, mas não a fáscia. A pele é atrófica e
descolorada ou hiperpigmentada. A massa aumenta de tamanho e pode envolver todo o braço,
ombros, face, pescoço, pernas e nádegas. Comprometimento de orgãos internos têm sido
relatado ocasionalmente. Leucositose de até 19.000 e eosinofilia de até 30% podem estar
presentes.
b. FORMAS CLÍNICAS: subcutânea
c. PROGNÓSTICO E TRATAMENTO: O prognóstico é geralmente bom e a deformação
corporal usualmente resolve. Iodeto de potássio e/ou anfotericina B são drogas de eleição.
d. PATOLOGIA: Os processos patológicos são semelhantes aos observados na zigomicose
por Conidiobolus coronatus. Todavia, os elementos hifálicos têm de 10 a 40µm de diâmetro
e as hifas estão esparsamente dispostas no granuloma.
e. LABORATÓRIO: Exame Direto: o exame de biópsia em KOH a 10% deve revelar hifas
refringentes, septadas e largas. Isolamento: deve-se proceder como indicado para o isolamento
do Conidiobolus coronatus.
f. MICOLOGIA: Basidiobolus ranarum.
g. HABITAT NATURAL: solo e fezes animais.
1. Mucormicose
a. DEFINIÇÃO: As micoses causadas por membros da ordem Mucorales são geralmente
agudas e desenvolvem-se rapidamente em paciente debilitado. A doença envolve áreas crânio-
rino-facial, pulmões, trato gastrointestinal, pele e menos comumente outros sistemas. A

80
doença esta associada com o diabetes descompensado em acidose (alteração na migração e
fagocitose), má nutrição, pacientes gravemente queimados e outras doenças tais como
leucemia e linfoma, ou terapia imunossupressora com o uso de citotoxinas e corticóides. Os
fungos mostram uma predileção pelos vasos (artérias). A invasão resulta em embolias e
necrose do tecido adjacente. Reações piogênicas supurativas podem ocorrer. As infecções são
tipicamente agudas e fulminantes. A doença rinocerebral em pacientes com acidose
usualmente leva à morte em poucos dias.
b. FORMA CLÍNICAS: orbito-rino-cerebral; toráxica; pélvica-abdominal e gástrica e
cutânea.
c. PROGNÓSTICO E TRATAMENTO: o prognóstico é grave, especialmente quando áreas
rino-cerebrais são envolvidas em pacientes com diabetes descompensado. A maioria dos caso
de doença gástrica e pélvica são diagnosticados em autópsia. Muitos casos ocorrem em
pacientes com leucemia ou linfoma. Esses são usualmente fatais. O controle da diabetes, o
desbridamento cirúrgico dos tecidos envolvidos e o emprego da anfotericina B são
recomendados.
d. PATOLOGIA: a reação tecidual é normalmente leve. Inflamação supurativa aguda com
áreas focais de inflamação granulomatosa predomina. As hifas variam de 6 a 50µm de
diâmetro, são esparsamente septadas ou não septadas e irregularmente ramificadas. O
organismo invade caracteristicamente a parede dos vasos sangüíneos adjacentes, produzindo
trombose e infartamento, mas raramente disseminam através das vasos.
e. LABORATÓRIO: Exame Direto: é crítico um diagnóstico rápido. Os elementos fúngicos
são normalmente pouco numerosos nas supurações. Raspados dos ossos turbinados, material
aspirado dos tratos sinuosos, escarro na doença pulmonar e material de bióspia montados em
KOH a 10% contêm hifas de parede espessas refratárias com 6 a 15µm de diâmetro. Células
entumescidas com mais ou menos 50µm e hifas distorcidas podem estar presentes.
Isolamento: inocular o material clínico em SDA com cloranfenicol e incubar a 30o C. Meios
contendo cicloheximida não são empregados porque esses fungos são sensíveis a este
antimicrobiano. Fatias de pão esterilizado em tubos de ensaio podem ser úteis para a
recuperação de zigomicetes quando outros meios falharem. Um tubo com pão esterilizado não
inoculado deve ser usado como controle.

81
f. MICOLOGIA: Absidia corymbifera; Rhizomucor pusillus; Rhizopus oryzae; Rhizopus
arrhizus; Cunninghamella bertholetiae; Syncephalastrum racemosum.
g. HABITAT NATURAL: solo e vegetais.

82
BIOSSEGURANÇA NO LABORATÓRIO DE MICOLOGIA CLÍNICA Profa. Cintia de Moraes Borba,
FIOCRUZ
DEFINIÇÃO : É o conjunto de normas e procedimentos considerados seguros e adequados à
manutenção da saúde em atividades de risco de aquisição de doenças profissionais (Hoefel &
Schneider, 1997).
LABORATÓRIO DE ANÁLISES CLÍNICAS : COMO TRABALHAR COM SEGURANÇA ?
Em um Laboratório de Análises Clínicas muita atenção deve ser dada ao manuseio de
material biológico, como excreções, secreções, enfim qualquer tipo de matéria orgânica
úmida proveniente do corpo humano, até mesmo escamas secas de pele, pois estes podem
conter agentes potencialmente infectantes.
Nunca se deve assumir que as pessoas que trabalham em laboratório tenham conhecimento
adequado sobre as práticas de segurança, individual ou coletiva, sendo portanto necessário
treinamento constante. Mimica, 1997 descreve que a infecção adquirida a partir de materiais
no laboratório pode não somente comprometer os funcionários do mesmo, mas também seus
familiares, estudantes e outras pessoas que visitam suas dependências, e, às vezes, até mesmo
de pessoas de laboratórios ou locais vizinhos. Assinala ainda que não é conhecida a real
incidência de infecção adquirida no laboratório clínico. Nos Estados Unidos a incidência
anual estimada é de 1,4 a 3,5 infecções adquiridas no laboratório em cada 1000 funcionários
por ano.
Como neste capítulo trataremos especificamente de fungos, toda a atenção será voltada a estes
microorganismos. No caso de um acidente envolvendo fungos vivos, as seguintes normas
gerais de segurança deverão ser cumpridas (McGinnis, 1980):
a) Prenda a respiração e deixe a sala imediatamente, fechando a porta;
b) Avise todas as pessoas do laboratório e não permita a entrada na área contaminad
c) Descontamine o local do acidente (veja “O que se deve fazer em caso de acidentes”).

83
Collins, 1983 descreve que a exposição aos microorganismos, inclusive os fungos, pode
ocorrer por:
1. Inalação de partículas fúngicas - pelo ar; após derramamento ou quebra de vidrarias; após
remoção de buchas de algodão ou tampa de rosca;
1. Ingestão - por pipetagem com a boca; pela falta de lavagem das mãos após manuseio de
culturas e/ou animais infectados;
3. Inoculação direta como resultado de acidentes com - agulhas; quebra de vidrarias; contato
com a pele e subsequente entrada no organismo através de cortes e arranhões.
NORMAS GERAIS PARA O TRABALHO NO LABORATÓRIO DE ANÁLISES CLÍNICAS :
1- Todos os acidentes devem ser comunicados à Chefia;
1- Não fumar;
3- Não comer, nem beber;
4- Não aplicar cosméticos no laboratório;
5- Não usar lentes de contato. Em caso de necessidade, proteger os olhos com óculos de
segurança;
6- Utilizar roupa de proteção de mangas compridas e de comprimento abaixo dos joelhos.
Retirá-la caso saia do laboratório;
7- Lavar as mãos freqüentemente;
8- Usar luvas quando se manipular espécimens patogênicos, sangue, líquidos biológicos e
animais infectados;
9- Não pipetar com a boca;
10- Evitar a formação de aerossóis durante os procedimentos técnicos;
11- Utilizar tubos com meio inclinado, sempre que possível, ao invés de placa de Petri para
fungos patogênicos. Nunca usar placas para semear Coccidioides immitis, ou quando se
suspeita deste (Larone, 1987);
11- Esterilizar materiais contaminados ou potencialmente infecciosos antes de serem lava- dos
ou descartados. Esta esterilização pode ser química ou física;
13- Desinfetar regularmente as bancadas, os pisos, os equipamentos e outros materiais
onde são manipulados materiais biologicamente perigosos, com hipoclorito de sódio a 5%
diluído a razão de 1:10, recentemente preparado, para obter uma concentração final de 5g/litro
de cloro livre, ou fenol a 5%. Sempre é bom lembrar que ambos são tóxicos e irritantes para a
pele, os olhos e o sistema respiratório (Costa, 1996). Existem outros desinfetantes eficazes
para fungos. Maiores detalhes, consulte Romão, 1996;

84
14- Fungos perigosos, tais como, Blastomyces dermatitidis, Coccidioides immitis,
Histoplasma capsulatum entre outros, devem ser manipulados em cabines de segurança
biológica Classe II ou III.
Segundo McGinnis, 1980 acidentes envolvendo espécimens clínicos e fungos podem ocorrer
dentro ou fora da cabine de segurança. Um acidente fora da cabine de segurança é mais difícil
de administrar.
O QUE SE DEVE FAZER EM CASO DE ACIDENTES:
1. Acidentes fora da cabine de segurança com espécimens clínicos e culturas de fungos
que não são potencialmente perigosos:
1.1. Feche a ventilação da área e espere aproximadamente por 1h antes de entrar até que os
aerossóis possam ser depositados;
1.1. Vista um jaleco de mangas compridas, máscara, e luvas de borracha; cubra o material
clínico ou a cultura quebrada com hipoclorito de sódio a 5% diluído a razão de 1:50 para obter
uma concentração final de 1g/litro de cloro livre, ou fenol (ácido fênico) a 5%;
1.3. Mantenha a área molhada com o desinfetante por aproximadamente 1h antes de limpá-la;
1.4. Todos os equipamentos contaminados ou potencialmente contaminados devem ser
desinfetados;
1.5. Após a desinfecção do local do acidente, autoclave e descarte todos os resíduos. Se as
mãos entrarem em contato com o material contaminado, lave-as com sabão e água, ou álcool
isopropílico a 70%, ou ambos.
1. Acidentes fora da cabine de segurança envolvendo fungos perigosos:
1.1. Feche a ventilação da área e espere, aproximadamente, por 1h antes de entrar na sala;
1.1. Vista um macacão ajustado nos pulsos, respirador e cubra os sapatos. Coloque na área do
acidente fenol a 5%, ou hipoclorito de sódio a 5%, diluído a 1:10. Espalhe o desinfetante ao
redor do sítio do acidente, mas não diretamente sobre o derramado para não produzir
aerossóis;
1.3. Coloque papel toalha embebido com desinfetante sobre o derramado por 1h. A
descontaminação com formaldeído se faz necessária, quando se tratar de agentes do grupo de
risco 3;
1.4. Autoclave todos os materiais contaminados durante o acidente;
1.5. Limpe os equipamentos e acessórios do laboratório com desinfetante.

85
3. Acidentes ocorrendo em uma centrífuga:
3.1. Prenda a respiração e desligue a centrífuga imediatamente e deixe a sala fechando a porta;
3.1. Comunique ao pessoal do laboratório e feche a ventilação da área;
3.3. Espere aproximadamente por 1h;
3.4. Vista roupa protetora, entre na sala e desinfete a centrífuga com hipoclorito de sódio a 5%
diluído a 1:10 ou fenol a 5%;
3.5. Limpe os equipamentos e desinfete a sala;
3.6. Autoclave o material contaminado.
4. Acidentes dentro da cabine de segurança com fungos perigosos:
4.1. Deixe a cabine;
4.1. Vista luvas, esfregue todas as paredes, superfícies de trabalho e equipamentos com
hipoclorito de sódio a 5%, diluído a 1:10 ou fenol a 5%, deixando o desinfetante em contato
com as superfícies da cabine por 10 a 15 min.;
4.3. Autoclave as luvas e esponjas.
5. Acidentes ocasionando a contaminação do laboratorista:
Passe no local material absorvente embebido em povidine e procure atendimento médico, no
caso de contato com fungos. Porém, se o trabalhador tiver contato acidental, certo ou
duvidoso com materiais biológicos humanos deverá ser submetido pelo menos à sorologia
para AIDS, hepatite B e hepatite C, nos tempos zero (data do acidente), três e seis meses após
o acidente.
Os riscos de contaminação laboratorial variam de acordo com o tipo de agente manipulado. O
Center for Disease Control (CDC) em 1988 elaborou normas de segurança a serem seguidas
nos laboratórios. Nestas normas foram estabelecidos quatro níveis de biossegurança (NB-1,
NB-1, NB-3, NB-4) de acordo com as classes de risco dos microorganismos. As classes são:
a) Classe de risco 1- (baixo risco individual e baixo risco para a comunidade) - organismo que
não causa doença ao homem ou animal;
b) Classe de risco 1- (risco individual moderado e risco limitado para a comunidade) -
patógeno que causa doença ao homem ou aos animais, mas que não consiste em sério risco a
quem o manipula em condições de contenção, à comunidade, aos seres vivos e ao meio
ambiente. As exposições laboratoriais podem causar infecção, mas a existência de medidas
eficazes de tratamento e prevenção limitam o risco, sendo o risco de disseminação bastante
limitado;

86
c) Classe de risco 3- (elevado risco individual e risco limitado para a comunidade) - patógeno
que geralmente causa doença grave ao homem ou aos animais e pode representar sério risco a
quem o manipula. É um risco se disseminado na comunidade, mas usualmente existem
medidas de tratamento e de prevenção;
d) Classe de risco 4- (elevado risco individual e elevado risco para a comunidade) -
patógeno que representa grande ameaça para o ser humano e para os animais. Grande risco de
contaminação para quem o manipula e com grande poder de transmissibilidade de um
indivíduo a outro.
Os fungos conhecidos se enquadram nas classes de risco 1, 1 e 3. Não existem fungos classe
de risco 4. Os níveis de biossegurança (NB) de um experimento serão determinados segundo
o organismo de maior classe de risco envolvido no experimento.
Laboratório NB-1: é adequado ao trabalho que envolva agentes de menor grau de risco.
Normas de biossegurança a serem seguidas:
• treinamento específico do pessoal;
• proibido comer, beber, fumar, aplicar cosméticos;
• proibido guardar alimentos nas áreas de trabalho;
• uso de pipetadores: é proibido pipetar com a boca;
• uso obrigatório de roupas de proteção;
• acesso restrito ao laboratório;
• descontaminação das superfícies de trabalho e dos resíduos antes do descarte;
• descontaminação dos resíduos, produzidos durante os trabalhos, antes do descarte;
• retirada de materiais contaminados em recipientes rígidos e à prova de vazamentos;
• superfícies resistentes a água, ácidos, álcalis, solventes orgânicos, e ao calor moderado;
• espaço suficiente entre as bancadas, cabines e equipamentos para permitir fácil acesso à
limpeza;
• controle rotineiro de insetos e roedores;
• existência obrigatórioa de pia para lavar as mãos;
• lavar as mãos antes de deixar o laboratório;

87
Laboratório NB-2: é adequado ao trabalho que envolva agentes de risco moderado. Deve-se
seguir as indicações para NB-1 e as normas específicas para NB-1 descritas abaixo:
• além de treinamento específico, deve haver supervisão competente einformação
específica do risco;
• acesso limitado durante procedimentos operacionais;
• procedimentos que podem originar aerossóis infecciosos devem ser efetuados em
contenção (cabines de segurança biológica);
• usar roupas apropriadas (jalecos, gorros, máscaras, etc.);
• a roupa protetora deve ser retirada antes de sair do laboratório e deixada na área de
trabalho;
• laboratório sinalizado com: agente de risco, possibilidades de contato, aviso dos
requisitos necessários para a entrada na área de trabalho, pesquisador responsável e endereço;
• proibida a entrada de animais não correlacionados ao trabalho;
• obrigatório o uso de luvas;
• descontaminação obrigatória do lixo antes do descarte;
• evitar o uso de objetos perfuro/cortantes; nunca separar agulha/seringa, bisturi/suporte;
alocá-los em recipiente apropriado para descontaminação antes
do descarte;
• cuidados especiais obrigatórios para evitar a formação de aerossóis;
• derramamento e acidentes devem ser imediatamente comunicados para manutenção de
registro. Providências adequadas devem ser tomadas (descontaminação, atendimento médico,
vigilância);
• quando apropriado, amostras de soro referência do pessoal de laboratório devem ser
mantidas e amostras adicionais colhidas periodicamente;
• manual de biossegurança específico deve existir e estar disponível;
• equipamentos de contenção devem ser usados (cabines de segurança biológica classe I ou
II) sempre que houver o risco de produção de aerossóis (centrifugação, trituração,
homogeneização, agitação vigorosa, ruptura por sonicação, abertura de recipientes contendo
material sob pressão diferente da ambiental, inoculação intranasal em animais e em cultura de
tecidos infectados);
• normas específicas para a manipulação de volumes grandes (maiores de 10 litros) existem
e devem ser seguidas;

88
• autoclave deve estar disponível para a descontaminação no interior ou próximo do
laboratório.
Laboratório NB-3: é aplicável aos locais onde são desenvolvidos trabalhos com agentes
infecciosos classe de risco 3. Seguir as indicações para NB-1 e as normas específicas para
NB-3 descritas abaixo:
O laboratório deverá ter instalações específicas para o trabalho com agentes de NB-3. Para
alguns casos, quando não existirem condições específicas para NB-3, particularmente em
instalações laboratoriais sem área de acesso específica, ambientes selados ou fluxo de ar
unidirecional, as atividades de rotina e operações repetitivas podem ser realizadas em
laboratório com instalações NB-1, acrescidas das práticas recomendadas para NB-3 e o uso de
equipamentos de contenção para NB-3. Cabe ao pesquisador principal a decisão de implantar
essas modificações, comunicando-as a CIBio e CTNBio;
• menores de 18 anos não poderão entrar no laboratório;
• devem ser usadas toalhas absorventes com uma face de plástico voltada para baixo,
recobrindo as superfícies de trabalho;
• roupas de proteção de uso limitado ao laboratório devem ser usadas e descontaminadas
antes de lavadas ou descartadas;
• devem ser usadas máscaras faciais ou respiradores nas salas de manipulação de animais;
• animais de laboratório em NB-3 devem ser mantidos em sistemas de confinamento parcial
(sistemas de caixas com filtros e paredes rígidas ou sistemas de contenção de caixas
equipados com radiação ultravioleta e refletores);
• os sistemas convencioanais de caixas só poderão ser usadas quando todo o pessoal utilizar
dispositivos e roupas protetoras;
• todo o pessoal deve tomar banho ao deixar as áreas de trabalho;
• as linhas de vácuo devem estar protegidas com filtro de ar com elevada eficiência (filtros
HEPA-high efficiency particulated air) e coletores com líquido desinfetante;
• cabines de segurança biológica (classes I, II, III) ou outra combinação apropriada de
dispositivos de proteção pessoal e contenção física devem ser usadas para a manipulação de
culturas e de material clínico ou ambiental, operações de desafio de animais, cultivo de tecido
ou fluidos infectados de animais ou ovos embrionados, necrópsia de animais infectados;
• o laboratório deverá estar separado de áreas de acesso comum. Deve ter sistema de dupla
porta a partir de áreas contíguas;

89
• o laboratório com superfícies lisas e resistentes deve ser selado e sem reentrâncias;
• próximo a saída deve existir uma pia com torneira de sistema automático de acionamento
ou pedais;
• as janelas do laboratório devem ser fechadas ou lacradas;
• as portas devem possuir fechamento automático;
• deve existir autoclave para descontaminação de resíduos, localizada no interior do
laboratório ou em áreas contíguas, preferencialmente com sistema de dupla porta;
• o laboratório deve ter um sistema de ar independente, com ventilação unidirecional, onde o
ar penetre pela área de entrada. Não deve existir exaustão do ar para outras áreas do prédio. O
ar exaurido não pode ser circulado e deve ser filtrado por filtro HEPA antes de eliminado ao
exterior do laboratório. Deve haver verificação constante do fluxo de ar no laboratório;
• o ar de saída das cabines de segurança biológica após passar por filtros HEPA deve ser
eliminado para o exterior do edifício por sistema de exaustão;
• o ar de saída das cabines pode recircular no interior do laboratório se a cabine for testada e
certificada anualmente.
Laboratório NB-4: é aplicável aos locais onde são desenvolvidos trabalhos com agentes
infecciosos classe de risco 4. Seguir as indicações para NB-3 e as normas específicas para
NB-4 descritas abaixo:
• nenhum material deverá ser removido do laboratório de contenção máxima, a menos que
tenha sido autoclavado ou descontaminado, exceção para materiais que tenham que sair
viáveis;
• material a serem usados no laboratório devem ser descontaminados em autoclave de dupla
porta, câmara de fumigação, ou sistema de ante-câmara pressurizada;
• material viável a ser removido de cabines classe III ou do laboratório deve ser
acondicionado em recipeinte inquebrável e selado. Este, por sua vez, deve ser colocado dentro
de um segundo recipiente que será desinfetado ou fumigado;
• equipamentos que não resistam a temperaturas elevadas devem ser descontaminados por
gases ou vapor em câmara específica;
• somente os trabalhadores do laboratório podem ter permissão para entrar;
• as portas devem ser hermeticamente fechadas e a entrada deve ser controlada;
• deve-se avisar a todos aqueles que entrarem no laboratório do potencial risco e as medidas
de segurança;

90
• deve haver um registro de entrada e saída de pessoal, com data, horário e assinaturas;
• protocolos definidos para situações de emergência devem ser elaborados;
• a entrada e a saída de pessoal do laboratório deve ocorrer após uso de chuveiro e troca de
roupa. A roupa protetora utilizada para o trabalho deve ser descontaminada antes do descarte;
• deve se organizar um sistema de notificação de acidentes e vigilância médica;
• todos os procedimentos laboratoriais devem ocorrer em cabine de segurança classe III, ou
classes I ou II usadas em associação com roupas de proteção pessoal com pressão positiva,
ventiladas por sistema de suporte de vida;
• o laboratório de contenção máxima deve estar localizado em prédio separado;
• as paredes, tetos e pisos do laboratório devem ser construídos com sistema de vedação
interna, para aumentar a eficiência da fumigação e evitar o acesso de animais e insetos;
• as superfícies internas do laboratório devem ser resistentes a líquidos e produtos químicos;
• sistema de drenagem do solo deve conter depósito com desinfetante químico eficaz,
conectado a um sistema coletor de descontaminação. O sistema de esgoto e ventilação deve
estar acoplado a filtros HEPA;
• sistema de luz, dutos de ar e linhas utilitárias devem estar posicionados verticalmente para
evitar acúmulo de poeira;
• os líquidos liberados de chuveiros ou de sanitários devem ser descontaminados
quimicamente ou pelo calor;
• deve haver sistema de ar com pressão diferencial e fluxo direcional para assegurar o
diferencial de pressão não permitindo a saída do agente de risco. Deve estar acoplado ao
sistema manômetros com alarmes.
COMO TRABALHAR COM AGENTES FÚNGICOS PATOGÊNICOS ?
COCCIDIOIDES IMMITIS (NB 3)
. Fungo dimórfico
. Fase micelial: hifas que se quebram em artroconídios
. No tecido: esférula repleta de endosporos
A coccidioidomicose é uma infecção respiratória benigna que pode se resolver
espontaneamente ou progredir para uma doença sistêmica severa.
Riscos laboratoriais: inalação de artroconídios e esférulas. A inoculação subcutânea da
forma de esférula pode resultar na formação de granulomas locais que regridem
espontaneamente.

91
Precauções recomendadas: nível de biossegurança 1 nas instalações laboratoriais e no
trabalho com espécimens clínicos; identificação de isolados; processamento de tecidos
animais e no manuseio de dejetos de animais, pois a urina pode conter o fungo. Nível de
biossegurança 3 no trabalho com a fase filamentosa esporulada ou processamento de solo
com suspeita de conter artroconídios.
PARACOCCIDIOIDES BRASILIENSIS (NB 1)
. Fungo dimórfico. Fase micelial: hifas e clamidoconídios
. Fase leveduriforme: elementos esféricos uni e/ou multibrotantes
As manifestações clínicas resultam da inalação de elementos infectantes do fungo, com
envolvimento dos pulmões, áreas mucocutâneas e outros órgãos.
Riscos laboratoriais: com a fase filamentosa o perigo está em se inalar elementos
infectantes. Com a fase leveduriforme o risco está na inoculação acidental do fungo.
Precauções recomendadas: nível de biossegurança 1 ao se trabalhar com espécimens
clínicos, animais, culturas filamentosas e leveduriformes em meios ricos. nível de
biossegurança 3 para a manipulação de culturas filamentosas em meios pobres e solo.
BLASTOMYCES DERMATITIDIS (NB 1)
. Fungo dimórfico
. Fase micelial: hifas com conídios esféricos a ovais
. Fase leveduriforme: células esféricas com unibrotamentos
A blastomicose é uma doença crônica supurativa e granulomatosa. As manifestações clínicas
podem ser: forma pulmonar, formas disseminada e cutânea.
Riscos laboratoriais: inoculação de formas de levedura presentes em tecidos de animais e em
espécimens clínicos. Outro perigo é a manipulação de culturas filamentosas.
Precauções recomendadas: nível de biossegurança 1 para o trabalho com animais, materiais
clínicos e culturas leveduriformes. Nível de biossegurança 3 para o trabalho com culturas
filamentosas, solo e outros materiais contendo conídios.
HISTOPLASMA CAPSULATUM (NB 3)
. Fungo dimórfico
. Fase micelial: hifas com conídios de dois tipos, microconídios e macroconídios
(tuberculados)
. Fase leveduriforme: elementos ovalados com brotamento unipolar

92
. Nicho ecológico: solo e restos orgânicos contaminados com fezes de galinha, morcego e
pássaros.
A histoplasmose pode ser uma micose pulmonar aguda, subaguda, crônica ou sistêmica.
Riscos laboratoriais: manuseio de culturas na fase filamentosa, processamento de solo
contaminado e de material biológico.
Precauções recomendadas: nível de biossegurança 1 no manuseio de espécimens clínicos e
no trabalho com tecidos animais. nível de biossegurança 3 na manipulação de culturas
filamentosas identificadas como H. capsulatum e processamento de solo contendo conídios.
CRYPTOCOCCUS NEOFORMANS (NB 1)
. Levedura patogênica
. Aspecto parasitário: elementos esféricos com um só brotamento
. Aspecto em cultivo: lêvedo unibrotante encapsulado
A criptococose é uma micose que pode ser pulmonar ou disseminada. A partícula infecciosa,
acredita-se ser propágulos de leveduras desidratadas e/ou basidiosporos que são inalados. Nos
casos de exposição laboratorial o nível de patogenicidade para adultos imunocompetentes
normais é baixo.
Riscos laboratoriais: inoculação acidental de culturas e outros materiais contaminados,
mordidas de camundongos infectados experimentalmente, manipulação de materiais
ambientais infectados (ex: fezes de pombo) e contato com material contaminado com urina de
animais infectados.
Precauções recomendadas: nível de biossegurança 1 para o trabalho com materiais clínicos,
com culturas e com animais infectados experimentalmente. Cabine de segurança biológica
classe II deverá ser usada durante o manuseio de solo e outros materiais contendo células de
leveduras ou quando se trabalha com o estado perfeito do agente (Filobasidiella neoformans).
SPOROTHRIX SCHENCKII (NB 1)
. Fungo dimórfico
. Fase micelial: hifas delicadas e conídios formando pequenos “bouquets”
. Fase leveduriforme: elementos com forma navicular e de charuto, além de corpos asteróides
O fungo vive na natureza, usualmente associado a vegetais, e é inoculado acidentalmente na
pele ou tecido subcutâneo determinando as lesões nodulares. Ocasionalmente o fungo pode
ser inalado causando a forma sistêmica.

93
Riscos laboratoriais: respingos de materiais de culturas nos olhos, arranhão ou injeção de
material infectado na pele ou mordidas de animais infectados experimentalmente,
manipulação de culturas ou necrópsia de animais.
Precauções recomendadas: nível de biossegurança 1 no trabalho com culturas e animais.
Luvas deverão ser usadas.
DERMATÓFITOS - EPIDERMOPHYTON, MICROSPORUM E TRICHOPHYTON (NB 1)
. Aspecto em cultivo: hifas delicadas com macro e microconídios
. Aspecto parasitário: hifas hialinas que podem se desarticular formando os artroconídios.
As dermatofitoses são lesões da pele, pêlos e/ou unhas. Os dermatófitos são saprófitas do
solo, onde vivem sobre restos de queratina.
Riscos laboratoriais: contato com animais infectados experimentalmente ou naturalmente.
Precauções recomendadas: nível de biossegurança 1 durante todo o trabalho. Usar luvas ao
manusear animais experimentais.
FUNGOS EM GERAL
Segundo o CDC vários fungos têm causado sérias infecções em hospedeiros
imunocompetentes que inalaram ou se inocularam acidentalmente por via subcutânea de
fontes ambientais. Os agentes são: Cladosporium trichoides, C. bantianum, Penicillium
marneffei, Exophiala dermatitidis e outros. Além destes, existem os Aspergillus fumigatus,
A. flavus e Candida albicans que podem causar sérios problemas em humanos. Atualmente
uma série de fungos estão surgindo como patógenos oportunísticos (Torres-Rodriguez, 1996).
Precauções recomendadas: nível de biossegurança 1 ao se trabalhar com fungos que estejam
esporulando ou ao se inocular animais experimentais.

94
REFERÊNCIAS BIBLIOGRÁFICAS
BARON, E. J.; PETERSEN, L. R. & FINEGOLD, S. M. BAILE & SCOTT’S
DIAGNOSTIC MICROBIOLOGY . 9ª ED. ST. LOUIS, MOSBY, 1994
FISHER, F. & COOK,N. B. FUNDAMENTALS OF DIAGNOSTIC MYCOLOGY . 1ª ED.
PHILADELPHIA. SAUNDERS, 1998.
KERN, M. E. & BLEVINS, K. S. MEDICAL MYCOLOGY . A SELF-
INSTRUCTIONAL TEXT . 1a ED. PHILADELPHIA. F. A. DAVIS COMPANY, 1997.
KONEMAN, E. W.; ALLEN, S. D.; JANDA, W. M.; SCHRECKENBERGER, & WINN Jr.,
W. C. COLOR ATLAS AND TEXT BOOK OF DIAGNOSTIC MICROBIOLOG Y.
5a ED. PHILADELPHIA. LIPPINCOTT, 1997.
KONEMAN, E. W. & ROBERTS, G. D. MICOLOGIA . PRACTICA DE
LABORATORIO . 3a ED. BUENOS AIRES. PANAMERICANA, 1987.
KWONG-CHUNG, K. J. & BENNETT, J. E. MEDICAL MYCOLOGY . PHILADELPHIA.
LEA & FEBIGER, 1991.
MCGINNIS, M. R. HANDBOOK OF MEDICAL MYCOLOGY . NEW YORK.
ACADEMIC PRESS, 1980.
RIPPON, J. W. MEDICAL MYCOLOGY . THE PATHOGENIC FUNGI AND THE
PATHOGENIC ACTINOMYCETES . 3a ED. PHILADELPHIA. LEA & FEBIGER,
1988.
ROSE, N. R.; DE MACARIO, E. C.; FAHLEY, J. L.; FRIEDMAN, H. & PENN, G. M.
MANUAL OF CLINICAL LABORATORY IMMUNOLOGY . 4ª ED. AMERICAN
SOCIETY FOR MICROBIOLOGY. WASHINGTON, 1991.

95
BIOSSEGURANÇA NO LABORATÓRIO DE MICOLOGIA CLÍNICA
CENTER FOR DISEASE CONTROL - NATIONAL INSTITUTES OF HEALTH.
BIOSAFETY IN MICROBIOLOGICAL BIOMEDICAL LABORATORIE S. 3A ED.,
1993.
CENTER FOR DISEASE CONTROL - HEALTH PROTECTION BRANCH.
LABORATORY BIOSAFETY GUIDELINES. 1A ED., 1996.
COLLINS, C. H. LABORATORY-ACQUIRED INFECTIONS. LONDON,
BUTTEWORTH & CO (PUBLISHERS) LTDA., 1983.
COMISSÃO TÉCNICA NACIONAL DE BIOSSEGURANÇA. INSTRUÇÃO
NORMATIVA NÚMERO 8 CNTBIO. DIÁRIO OFICIAL DA UNIÃO, 1997.
COSTA, M. A. F. DA. BIOSSEGURANÇA - SEGURANÇA QUÍMICA BÁSICA EM
BIOTECNOLOGIA E AMBIENTES HOSPITALARES. LIVRARIA SANTOS
EDITORA. SP, 1996.
DISALVO, A. F. MYCOTIC MORBIDITY-AN OCCUPATIONAL RISK FOR
MYCOLOGISTS. MYCOPATHOLOGIA 99: 147-153, 1987.
FURR, A. K. HANDBOOK OF LABORATORY SAFETY. 3A ED., BOCA RATON, CRC
PRESS, 1990.
GRIST, N. R. MANUAL DE BIOSSEGURANÇA PARA O LABORATÓRIO.
LIVRARIA SANTOS EDITORA. SP. 1A.ED. 1995.
HANEL, E. J R. & KRUSE, R. H. LABORATORY-ACQUIRED MYCOSES.
DEPARTMENT OF THE ARMY, MISCELLANEOUS PUBLICATION 18: 1-51, 1967.

96
HOEFEL, H. H. K. & SCHNEIDER, L. O. O PROFISSIONAL DA SAÚDE NA CADEIA
EPIDEMIOLÓGICA. IN: RODRIGUES, E.A.C., MENDONÇA, J.S.DE, AMARANTE,
J.M.B., FILHO, M.B.A., GRINBAUM, R.S. & RICHTMANN, R. (ORG.) INFECÇÕES
HOSPITALARES PREVENÇÃO E CONTROLE. SÃO PAULO, SARVIER, 1997 P. 351-
366.
KWON-CHUNG, K. J. & BENNETT, J. E. MEDICAL MYCOLOGY. PHILADELPHIA,
LEA & FEBIGER 1991.
LARONE, D. H. MEDICALLY IMPORTANT FUNGI - A GUIDE TO
IDENTIFICATION. 1A ED. NEW YORK, ELSEVIER 1987.
MIMICA, I. O LABORATÓRIO CLÍNICO. IN: RODRIGUES, E.A.C., MENDONÇA,
J.S.DE, AMARANTE, J.M.B., FILHO, M.B.A., GRINBAUM, R.S. & RICHTMANN, R.
(ORG.) INFECÇÕES HOSPITALARES PREVENÇÃO E CONTROLE. SÃO PAULO,
SARVIER, 1997 P. 470-476.
MCGINNIS, M. R. LABORATORY SAFETY. LABORATORY HANDBOOK OF
MEDICAL MYCOLOGY . NEW YORK, ACADEMIC PRESS 1980.
PIKE, R. M. LABORATORY-ASSOCIATED INFECTIONS. SUMMARY AND
ANALYSIS OF 3911 CASES. HEALTH LABORATORY SCIENCE 13: 104-114, 1976.
PIKE, R. M. LABORATORY-ASSOCIATED INFECTION: INCIDENCE,
FATALITIES, CAUSES, AND PREVENTION. ANN. REV. MICROBIOL. 33: 41-66,
1979.
ROMÃO, C. M. C. A. DESINFECÇÃO E ESTERILIZAÇÃO QUÍMICA. IN:
TEIXEIRA, P & VALLE, S. (ORGS.). BIOSSEGURANÇA - UMA ABORDAGEM
MULTIDISCIPLINAR. EDITORA FIOCRUZ, RJ, 1996.

97
TEIXEIRA, P. & VALLE, S. BIOSSEGURANÇA - UMA ABORDAGEM
MULTIDISCIPLINAR. EDITORA FIOCRUZ, RJ, 1996.
TORRES-RODRIGUEZ, J. M. NUEVOS HONGOS PATÓGENOS OPORTUNISTAS
EMERGENTES. REV. IBEROAM. DE MICOLOGIA 13(S1): 30-38, 1996.

98
ANEXO: MODELO DE LAUDO MICOLÓGICO
UNIVERSIDADE FEDERAL DO RIO DE JANEIRO
CENTRO DE CIÊNCIAS DA SAÚDECENTRO DE CIÊNCIAS DA SAÚDECENTRO DE CIÊNCIAS DA SAÚDECENTRO DE CIÊNCIAS DA SAÚDE
FACULDADE DE FARMÁCIAFACULDADE DE FARMÁCIAFACULDADE DE FARMÁCIAFACULDADE DE FARMÁCIA
LABORATÓRIO DE MICOLOGIA CLÍNICA CGC: 33.663.683/0012CGC: 33.663.683/0012CGC: 33.663.683/0012CGC: 33.663.683/0012----79797979
Laudo No.:
RESULTADOSRESULTADOSRESULTADOSRESULTADOS
Paciente: XXXXX Protocolo de Origem: XXXX
Sexo: XXXXX Idade: XX Data de Entrada: XX.XX.XXXX
Solicitante: Laboratório XXXXXXX Data de Emissão: XX.XX.XXXX
Material Escamas de pele da região das costas e axilas
Exame Micológico Direto Presença de hifas hialinas e ramificadas e cadeias de artrosporos compatíveis com dermatófito
Cultura de Fungos Cultura positiva para Microsporum canis
________________________
Prof. Paulo Murillo Neufeld Chefe do Laboratório de Micologia Clínica
Faculdade de Farmácia – UFRJ
Laboratório de Micologia Clínica Laboratório de Micologia Clínica Laboratório de Micologia Clínica Laboratório de Micologia Clínica –––– Faculdade de Farmá Faculdade de Farmá Faculdade de Farmá Faculdade de Farmácia cia cia cia ---- UFRJ UFRJ UFRJ UFRJ Prédio do CCS Prédio do CCS Prédio do CCS Prédio do CCS ---- bloco A bloco A bloco A bloco A ---- 2 2 2 2o.o.o.o. andar andar andar andar ---- sala 025 sala 025 sala 025 sala 025 Ilha do Fundão Ilha do Fundão Ilha do Fundão Ilha do Fundão ---- Rio de Janeiro Rio de Janeiro Rio de Janeiro Rio de Janeiro----RJ RJ RJ RJ ---- 21941 21941 21941 21941----590 590 590 590 Tel/Fax (021) 2562Tel/Fax (021) 2562Tel/Fax (021) 2562Tel/Fax (021) 2562----6421642164216421