Processos de Desnaturação Proteica
-
Upload
joaquim-jose-da-silva-goncalves -
Category
Documents
-
view
22.269 -
download
46
description
Transcript of Processos de Desnaturação Proteica
Processos de Processos de
desnaturação proteicadesnaturação proteica
L 7 | Grupo 1
Ana Beatriz Moreira | Joaquim Gonçalves
Bioquímica I 2008/2009
Mestrado integrado em Ciências Farmacêuticas1º ano | 2º semestre
Objectivos – conceitos a abordarObjectivos – conceitos a abordar Conformação tridimensional das proteínas
◦ Estrutura primária
◦ Ligações que intervêm na estrutura espacial das proteínas
◦ Estrutura tridimensional das proteínas
Desnaturação proteica◦ Desnaturação como um processo reversível ou irreversível
◦ Desnaturação e precipitação de proteínas
Processos de desnaturação proteica◦ Variações extremas de temperatura
◦ Variações de pH
◦ Solventes orgânicos
◦ Sais de metais pesados
◦ Reagentes alcalóides
Renaturação
Conformação tridimensional das Conformação tridimensional das proteínasproteínas
Aminoácido
Estrutura primária
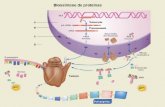
Agentes que provocam desnaturação:
Desnaturação proteicaDesnaturação proteica
Modificações na estrutura tridimensional de uma proteína que
levam à perda da sua função.É reversível ou irreversível.
• Variações extremas de temperatura;
• Radiações ultravioleta e ionizantes;
• Variações de pH (ácidos e bases fortes);
• Detergentes;
• Solventes orgânicos;
• Soluções de ureia ou
guanidina;
• Pressão ou agitação;
• Reagentes alcalóides;
• Sais de metais pesados;
• Soluções concentradas de sais.
Proteínanativa Proteína desnaturada
Variações extremas de temperaturaVariações extremas de temperatura Aumento da temperatura
Aumenta a velocidade de vibração molecular
Interacções mais fracas como as pontes de hidrogénio rompem-se
Alteração da conformação das proteínas.
Desnaturação
Exemplo: A coagulação da ovalbumina do ovo.
Variações de pHVariações de pH(Ácidos e bases fortes)(Ácidos e bases fortes)
Meios + ácidos ou + básicos
Rompimento de atracções
eléctricas que ajudam manter
a configuração espacial (ligações
de hidrogénio e ligações iónicas)
Exemplo: produção de queijos
Desnaturação
Alteram o estado de ionização
das cadeias laterais dos aminoácidos
Solventes orgânicos e detergentesSolventes orgânicos e detergentes
Ruptura das pontes de hidrogénio e das ligações
hidrofóbicas
Ruptura das ligações hidrofóbicas
Desnaturação
Desnaturação
(Interferem com as cadeias laterais dos aminoácidos)
Os aniões de reagentes alcalóides (tricloroacético, pícrico, etc) são capazes de se
combinar com proteínas que possuam resíduos de aminoácidos na forma de catiões,
formando complexos insolúveis.
Sais de metais pesados
Reagentes alcalóides
Os catiões dos sais de metais pesados (cloreto de mercúrio, acetato de chumbo, etc)
são capazes de se combinar com proteínas que possuam resíduos de aminoácidos na
forma de aniões, formando complexos insolúveis.
Precipitação Desnaturação
Precipitação Desnaturação