PRODUÇÃO DE PIRUVATO E ACETALDEÍDO
description
Transcript of PRODUÇÃO DE PIRUVATO E ACETALDEÍDO
-
Mestrado Integrado em Cincias Farmacuticas
Bioqumica II
1
PRODUO DE PIRUVATO E ACETALDEDO DURANTE A FERMENTAO
DA GLUCOSE PELA LEVEDURA
I. INTRODUO
O significado da palavra fermentao sofreu, durante os dois ltimos sculos, muitas alteraes. Originalmente aplicada ao processo pelo qual o vinho e outras bebidas alcolicas eram obtidas, significava uma efervescncia ou ebulio lenta. Mais tarde, devido s investigaes de Gay-Lussac e de outros, a palavra fermentao
associou-se ao processo pelo qual o "acar" (glucose) era convertida em lcool (etlico) e dixido de carbono, ou seja o processo que hoje designamos por fermentao alcolica.
Actualmente, fermentao um termo bastante geral e implica a degradao anaerbia de um substrato. Pode assim ser definida como um processo metablico (catablico) que ocorre na ausncia de oxignio e, no qual, atravs de uma srie de reaces de oxi-reduo, hidrlise e outras, os enzimas existentes em determinado organismo/tecido levam a cabo a modificao qumica de um substrato (metabolito), formando-se outros compostos como produtos finais dessas reaces sequenciais (ou vias), como por exemplo etanol, cidos carboxlicos, dixido de carbono, etc. Nos vrios organismos, particularmente nos microbianos, existem numerosas vias fermentativas, cada uma delas dando origem a um produto(s) final(is) especfico(s). Entre as mais relevantes salientam-se duas vias, ambas tendo o piruvato como metabolito inicial: a fermentao alcolica em clulas de levedura e a fermentao lctica (ou homolctica) no tecido muscular de animais, originando respectivamente etanol e lactato. Embora o estudo da sequncia da via de fermentao alcolica tenha sido iniciado h cerca de dois sculos com Lavoisier, s em 1951 Embden, Meyerhof e Parnas integram todos os conhecimentos at ento adquiridos, propondo um esquema conjunto (Fig. 1) para as transformaes sofridas anaerobiamente pela glucose (gliclise) nas leveduras e no msculo.
-
Mestrado Integrado em Cincias Farmacuticas
Bioqumica II
2
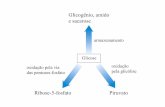
Figura 1 - Esquema proposto por Embden, Meyerhof e Parnas para a gliclise incluindo a fermentao alcolica e lctica.
Glicognio (ou amido)
1-Fosfato de glucose
Fosforilase
6-Fosfato de frutose
6-Fosfato de glucoseD-glucose
FrutoseHexocinase
Fosfatase
Hexocinase
Fosfatase
1,6-Difosfato de frutose
Fosfato de dihidroxicetona 3-Fosfato de D-gliceraldedo
Aldolase
Isomerase
1,3-Difosfato de D-gliceraldedo
1-Fosfato de D-gliceraldedo
2-Fosfato de D-gliceraldedo
Fosfato de enolpiruvatoPiruvatocido lctico
Acetaldedo + CO2
Etanol
H3PO4
H3PO4-+
H2-+
H2O-+
H3PO4-+
H2-+
Enolase
-
Mestrado Integrado em Cincias Farmacuticas
Bioqumica II
3
Neste trabalho pretende-se demonstrar a formao de intermedirios metablicos - piruvato e acetaldedo - durante a fermentao da glucose pela levedura. Uma vez que
tanto o piruvato como o acetaldedo s esto presentes em pequenas quantidades nesta via, dado que se transformam rapidamente no intermedirio seguinte, uma maneira de demonstrar a sua existncia impedir a reaco seguinte de prosseguir, levando assim sua acumulao. Para isso vo ser usadas duas estratgias:
1. Para detectar o piruvato, leva-se a cabo a incubao das clulas de levedura na
presena de glucose sob condies ligeiramente alcalinas, as quais inactivam o enzima piruvato descarboxilase (na nomenclatura dos enzimas: 2-oxocido carboxilase, E.C. 4.1.1.1.), que catalisa o passo seguinte da via, conduzindo assim acumulao daquele composto. A sua presena posteriormente
duplamente demonstrada pelas reaces com o nitroprussiato (colorao azul) e com a 2,4-dinitrofenilhidrazina (colorao vermelha).
2. A presena do acetaldedo posta em evidncia mediante a sua reaco com um agente (sulfito de sdio), adicionado mistura de incubao, dando origem a um composto que j no metabolizado por no servir de substrato ao enzima lcool desidrogenase. O acetaldedo presente ser ento identificado atravs da sua reaco com o nitroprussiato de sdio na presena de piperidina, dando uma
caracterstica cor azul.
II. TRABALHO EXPERIMENTAL
A) PREPARAO DE SOLUES
1. Na2HPO4 0,5 M 50 ml/turma 2. KH2PO4 0,5 M 50 ml/turma 3. Glucose 100 g/l 150 a 200 ml/turma 4. cido tricloroactico (TCA) 100 g/l 50 ml/turma 5. Nitroprussiato de sdio 50 g/l 10 a 20 ml/turma 6. HCl 2 M 50 ml/turma
-
Mestrado Integrado em Cincias Farmacuticas
Bioqumica II
4
7. Soluo saturada de hidrocloreto de 2,4-dinitrofenilhidrazina em HCl 2M 25 ml/turma
8. NaOH 100 g/l 25 ml/turma 9. Usando o fermento de padeiro, faa trs suspenses de clulas de levedura (50
ml/turma) concentrao de 100 g/l: a) uma em Na2HPO4 0,5 M (suspenso ligeiramente alcalina); b) outra em KH2PO4 0,5 M (suspenso ligeiramente cida) e c) outra em H2O (suspenso neutra).
B) FORMAO DO PIRUVATO
1. Pipete 5 ml de soluo de glucose 100 g/l para cada um de dois tubos de centrfuga (A e B)
2. Adicione 5 ml da suspenso de levedura ligeiramente cida ao tubo A e 5 ml da suspenso de levedura ligeiramente alcalina ao tubo B.
3. Coloque ambos os tubos (A e B) num banho termostatizado a 37 C durante 1 hora.
4. Aps a incubao, adicione 2 ml de cido tricloroactico (100 g/l) a cada tubo. Agite.
5. Centrifugue durante 10 min. a 2 500 g. 6. Remova os sobrenadantes para tubos de ensaio (tambm identificados com A e B)
C) TESTE DO NITROPRUSSIATO PARA O PIRUVATO
1. Retire 3 ml de cada um dos sobrenadantes A e B para outros tubos de ensaio (A1 e B1)
2. Coloque estes dois tubos num banho de gua fervente durante 5 mim. 3. Entretanto, em dois novos tubos de ensaio (A1 e B1), coloque cerca de 1 cm de
sulfato de amnio slido. 4. Adicione 2 ml de cada um dos sobrenadantes fervidos aos tubos preparados no
ponto anterior.
5. Adicione a cada um duas gotas de soluo de nitroprussiato de sdio a 50 g/l. 6. Adicione amnia concentrada, deixando cair ao longo das paredes de cada tubo,
de modo a formar duas fases.
-
Mestrado Integrado em Cincias Farmacuticas
Bioqumica II
5
7. Observe e registe o aparecimento (e eventualmente a alterao) de cor no anel de juno das duas fases.
D) TESTE DA DINITROFENILHIDRAZINA PARA O PIRUVATO
1. Retire para dois tubos de ensaio (identificados A2 e B2), 2 ml de cada um dos sobrenadantes obtidos em B.6, ou seja, no fervidos.
2. Adicione a cada um 1 ml de soluo saturada de 2,4-dinitrofenilhidrazina. Agite.
ATENO: TRABALHAR NA HOTTE! Esta soluo contm cido clordrico.
3. Retire 2 ou 3 gotas de cada tubo para novos tubos de ensaio (tambm A2 e B2). 4. Adicione 1 ml de NaOH 100 g/l. 5. Dilua com gua at cerca de 5 ml. 6. Observe e registe o aparecimento de cor em cada um dos tubos.
E) FORMAO DE ACETALDEDO A PARTIR DA GLUCOSE
1. Pipete 5 ml de soluo de glucose 100 g/l para cada um de dois tubos de centrfuga (C e D).
2. Adicione a ambos, 5 ml da suspenso de levedura em gua (suspenso neutra). Agite.
3. Adicione 0,5 g de sulfito de sdio ao tubo D. Agite. 4. Coloque ambos os tubos (C e D) num banho termostatizado a 37 C durante 1
hora.
5. Aps a incubao, centrifugue ambos os tubos durante 10 min. a 2 500 g. 6. Remova os sobrenadantes para tubos de ensaio (C e D) 7. Em dois novos tubos de ensaio (C e D), coloque 2 ml de cada um dos
sobrenadantes obtidos no ponto anterior. 8. Adicione a cada tubo 0,5 ml de nitroprussiato de sdio a 50 g/l e,
TRABALHANDO NA HOTTE, adicione 2 ml de piperidina. 9. Observe e registe o aparecimento de cor em cada um dos tubos.
-
Mestrado Integrado em Cincias Farmacuticas
Bioqumica II
6
III. CONCLUSES
Interprete o aparecimento de cor nos tubos A1 e B1, A2 e B2, e C e D, explicando esquematicamente as reaces ocorridas.
-
Mestrado Integrado em Cincias Farmacuticas
Bioqumica II
7
EXTRACO DO GLICOGNIO DO FGADO.
HIDRLISE EM MEIO CIDO
I. INTRODUO
Os organismos vivos contm frequentemente glcidos como material de reserva. Estas substncias so armazenadas na forma de polisidos como o amido nas plantas e o glicognio nos animais. As propriedades fsicas e qumicas de muitos polisidos so suficientemente diferentes das de outras substncias naturais, permitindo assim, o seu
isolamento. Numa soluo de cido tricloroactico (TCA) muitos compostos de elevada massa molecular, tais como as protenas e os cidos nucleicos precipitam,
enquanto que o glicognio se mantm em soluo. Por outro lado, os polisidos so menos solveis em soluo alcolica do que as "oses" ou outras substncias solveis em gua, o que permite a sua separao.
A hidrlise cida do glicognio origina uma srie de produtos intermedirios com
massas moleculares sucessivamente menores, obtendo-se como produto final a glucose. O curso da hidrlise pode assim ser seguida pela determinao do carcter
redutor da soluo.
II. TRABALHO EXPERIMENTAL
A) PREPARAO DE SOLUES
10. Soluo de TCA a 20 % 11. Soluo de glicognio (4 mg/ml) 12. Soluo de HCl 2,5 N 13. Soluo de NaOH 1,25 N 14. Soluo de 3,5-dinitrosalicilato - dissolver 1 g de cido 3,5-dinitrosalicilato em
200 ml de NaOH 2 N, aquecendo e agitando vigorosamente. Dissolver 100 g de tartarato de sdio e potssio tetrahidratado em 500 ml de H2O. Misturam-se as duas solues e perfaz-se o volume para 1 litro com gua destilada.
-
Mestrado Integrado em Cincias Farmacuticas
Bioqumica II
8
B) EXTRACO DO GLICOGNIO
1. Pese o fgado completo. Pese aproximadamente 15 g de fgado (tome nota do peso rigoroso) e corte-o em pedaos pequenos com uma tesoura. Coloque-os num homogenizador contendo gua (1 ml por grama de tecido). Use gua destilada gelada de preferncia.
2. Homogenize o fgado tendo o cuidado de no deixar elevar muito a temperatura
3. Transfira o homogenizado para um gobelet e aguarde cerca de 5 min. agitando frequentemente com uma vareta de vidro
4. Adicione um volume igual de TCA a 20 % (a soluo resultante ficar a 10 %) 5. Transfira o conjunto para um tubo de centrfuga e centrifugue durante cerca de 8
min.
6. Decante o sobrenadante para uma proveta, adicione dois volumes de etanol a pouco e pouco, agitando sempre com a vareta de vidro.
7. Deixe repousar at que se forme um precipitado (se no observar precipitao junte um pouco de cloreto de sdio slido e aquea o tubo suavemente colocando-o num gobelet com gua quente at se formar um precipitado).
8. Transfira a suspenso para tubos de centrfuga. Equilibre-os e centrifugue o conjunto durante cerca de 5 min.
9. Despreze o lquido sobrenadante e dissolva o precipitado em cerca de 5 ml de gua e reprecipite o glicognio pela adio de 10 ml de etanol
10. Separe de novo o precipitado por centrifugao e lave-o no tubo de centrfuga com 3 ml de ter, agitando o resduo com uma vareta de vidro. Centrifugue novamente
11. Pese o precipitado
Nota: a quantidade de glicognio existente no fgado depende grandemente do estado nutricional do animal. possvel, portanto, que em certos casos, tais como jejum prolongado, aquela quantidade seja to pequena que no se chegue a observar precipitado.
-
Mestrado Integrado em Cincias Farmacuticas
Bioqumica II
9
C) HIDRLISE DO GLICOGNIO
1. Numere 8 tubos de ensaio de 1 a 8 2. Adicione ao tubo n 1, que servir de branco, 0,5 ml de gua destilada 3. Adicione aos restantes tubos 0,5 ml da soluo de glicognio 4. Junte a cada tubo 0,5 ml de HCl 2,5 N e tome nota da hora a que se verificou a
adio
5. Junte imediatamente aos tubos 1 e 2, 1 ml de NaOH 1,25 N e coloque os tubos de 3 a 8 num banho-maria em ebulio
6. Com intervalos de 5 min. retire os tubos 3 a 7 do banho-maria e neutralize o contedo de cada um adicionando 1 ml de NaOH 1,25 N
7. Aps o tubo n 8 ter estado no banho-maria 60 min., retire-o e adicione 1 ml de NaOH 1,25 N
8. Junte a todos os 8 tubos, 2 ml da soluo de 3,5-dinitrosalicilato e aquea todos os tubos no banho-maria durante 5 min.
9. Arrefea os tubos com gua fria e junte a cada um 6 ml de gua destilada. Agite 10. Leia no espectrofotmetro as absorvncias a 540 nm usando como branco o tubo
n 1
III. TRATAMENTO DOS RESULTADOS
Determine a quantidade de glicognio obtido por grama de fgado total. Ter em
conta que o ensaio foi efectuado em apenas 15 g do peso total do fgado. Considere o poder redutor da soluo do tubo n 8 (hidrlise completa) como equivalente a 100 % de converso do glicognio em glucose e faa um grfico das percentagens de hidrlise em funo do tempo. Comente os resultados obtidos.
-
Mestrado Integrado em Cincias Farmacuticas
Bioqumica II
10
ISOLAMENTO, PURIFICAO E CARACTERIZAO DO CITOCROMO C DE
UMA ESTIRPE DE Saccharomyces cerevisiae
I. INTRODUO
O ltimo passo do metabolismo aerbio, a fosforilao oxidativa, permite a sntese de ATP a partir de um gradiente quimiosmtico de protes formados durante a passagem de electres atravs da cadeia de transferncia de electres. O citocromo c o componente mais conhecido desta cadeia e o mais estudado, por diversas razes:
disponvel em grande quantidade e em inmeras fontes estabilidade e solubilidade em gua
simplicidade da sua funo e da sua estrutura.
O citocromo c mitocondrial dos eucariontes o membro mais conhecido de uma imensa famlia de protenas. Trata-se de uma protena perifrica que se encontra
fracamente ligada membrana interna mitocondrial. Muitos e vrios citocromos c j foram isolados de procariontes e muitos mais ficaram provavelmente por descobrir.
O citocromo c uma hemoprotena, ou seja, possui um heme, grupo prosttico organometlico constitudo por uma estrutura tetrapirrlica com um io ferro (Fe2+ ou Fe3+) no seu meio. O citocromo c possui um heme do tipo c, ligado protena por ligaes covalentes com dois resduos de cistena, fig 1.
Figura 1 - Estrutura qumica do grupo heme c.
N
CH2
H3C
CH2
NCH3
N
CH2CH2
CH3
CH
Fe3+
H3C
CH3
S
Cys
Cys
S
CH
NH3C
COO- COO-a)
-
Mestrado Integrado em Cincias Farmacuticas
Bioqumica II
11
O citocromo c transporta um electro do complexo III da cadeia respiratria at ao complexo IV: quando o citocromo transporta o electro tem o io ferro na forma Fe2+
que, depois de ter transferido o electro fica na forma de Fe3+, pronto para receber outro electro.
II. TRABALHO EXPERIMENTAL
A) PREPARAO DE SOLUES
1. Tris-HCl 10 mM, pH 7,6 2. NaCl 1 M 3. Tris-HCl 1 M, pH 7,6 4. Reagentes para mtodo de Lowry (ver alnea E) 5. NaOH 0,075 M 6. Solues para electroforese (ver alnea C)
B) PROCEDIMENTO
12. Suspender 1 kg de fermento de padeiro, previamente desfeito no maior nmero de
pedaos possvel em 250 ml de acetato de etilo e 500 ml de uma soluo de NaCl 1 M, adicionados por esta ordem. Deixar a agitar, no frio, at manh seguinte.
13. Retirar a suspenso do agitador e adicionar cerca de 3,5 litros de gua destilada. Juntar em seguida 100 ml de resina CMC-32, previamente inchada em gua e agitar a mistura durante cerca de 30-45 min. Deixar depositar a resina a qual em seguida decantada e lavada sucessivamente com Tris-HCl 10 mM, pH 7,6 at que o sobrenadante fique lmpido. Colocar numa coluna de cromatografia (10 cm 5 cm), previamente montada, a resina preparada anteriormente. Proceder eluio do citocromo com tampo Tris-HCl 1 M, pH 7,6.
-
Mestrado Integrado em Cincias Farmacuticas
Bioqumica II
12
C) ELECTROFORESE EM GEL DE POLIACRILAMIDA (SDS)
Preparao de solues 1. Tampo para as amostras (A) - preparar 5 ml Glicerol 0,5 ml; Stock II 1,25 ml; azul de bromofenol 1 mg, SDS a 10% 2 ml, -mercaptoetanol 0,25 ml Stock II - Tris Base 0,5 M (3,03 g); HCl at pH 6.6-6.8. Perfazer volume at 50 ml 2. Tampo para as amostras (B) - preparar 5 ml Glicerol 0,5 ml; Stock II 1,25 ml; azul de bromofenol 1 mg, SDS a 10% 2 ml,
3. Tampo de electroforese Tris-Glicina (10 conc.) pH 8.3 - preparar 100 ml Tris Base 0,25 M (3,03 g); Glicina 1,92 M (14,41 g); SDS (1 g). Perfazer volume at 100 ml. Diluir de 1:10 antes de usar.
4. Soluo corante - preparar 100 ml Coomassie Blue G-250 (40 mg); cido perclrico a 60% (5,8 ml). ). Perfazer volume at 100 ml
Preparao das amostras
Pipetar para dois eppendorfs 10 l de amostra (citocromo obtido no ponto B.2). Adicionar 10 l de tampo A ao eppendorf 1 e 10 l de tampo B ao eppendorf 2. Preparar as solues padro (eppendorf 3) adicionando a 10 l de padro e 10 l de tampo A. Fazer um spin-down. Ferver durante 2 min. os eppendorfs 1 e 3.
Preparao do gel
1. Remover os Ready Gel da embalagem de acondicionamento. 2. Retirar o pente e lavar os poos com gua destilada ou tampo de electroforese. 3. Cortar com o auxlio de uma lmina a cassete do Ready Gel (em baixo ao longo da
linha a ponteado). 4. Puxar a fita existente na parte debaixo da cassete de modo a expor o fim do gel. 5. Colocar a cassete no Electrode Assembly. Encaixar primeiro a parte debaixo do
gel nas reentrncias existentes de cada lado e em baixo do Electrode Assembly. Colocar a cassete de modo que o vidro pequeno fique virado para o interior do
Electrode Assembly.
-
Mestrado Integrado em Cincias Farmacuticas
Bioqumica II
13
6. Como se vai correr dois gis no necessrio colocar um vidro do outro lado do Electrode Assembly.
7. Colocar o Electrode Assembly com a cassete do Ready Gel no Clamping Frame. Este dispositivo permite manter o Electrode Assembly com o Ready Gel num sistema fechado.
8. Pressionar o Electrode Assembly para baixo, enquanto fecha os dois clips, situados na parte debaixo do Clamping Frame. Ao conjunto constitudo pelo Electrode Assembly (com os gis colocados) e Clamping Frame designa-se de Inner Chamber.
9. Colocar o Inner Chamber na tina de electroforese para mini-gis. 10. Encher o Inner Chamber com tampo de electroforese (diludo 10 ). Verificar se
existem fugas.
11. Se no houver fugas colocar entre 200 a 300 ml de tampo de electroforese na tina de electroforese. Caso existam fugas encher a tina de electroforese com o tampo
at cima (mais ou menos at ao nvel do tampo existente no Inner Chamber). 12. Verificar se no existem bolhas de ar no fundo do Inner Chamber. A existncia de
bolhas de ar perturba a migrao das protenas.
13. Aplicar 20 l de amostra em cada um dos poos com uma pipeta automtica. Cada amostra deve ser aplicada devagar, de modo a permitir que a amostra assente no fundo do poo. Ter o cuidado de no tocar com a ponta da pipeta no fundo do
poo de modo a evitar que este se rompa. 14. Colocar a tampa da tina de electroforese, tendo o cuidado de colocar as bananas
(uma preta e outra vermelha) a condizer com os elctrodos. 15. Ligar os fios elctricos da tina fonte de alimentao, tendo o cuidado de
assegurar a polaridade correcta das ligaes (banana vermelha no +; banana preta no -).
16. Programar a fonte para 150 mV durante 10 min., ou at as amostras j se encontrarem no topo do gel de resoluo (o gel de baixo). Aumentar a voltagem para 160 mV e deixar correr at a frente de migrao das bandas estar a 5 - 10 mm do fim do gel.
17. Aps a corrida do gel, desligar a fonte de alimentao e desligar os fios. 18. Retirar o Inner Chamber e verter o tampo. Desmontar o sistema de modo a
remover a cassete do Ready Gel.
-
Mestrado Integrado em Cincias Farmacuticas
Bioqumica II
14
19. Remover o gel da cassete, separando os dois vidros. necessrio retirar a fita que rodeia a cassete do Ready Gel.
20. Transferir o gel para a soluo corante. Deixar a corar num agitador para gis at aparecerem as bandas (entre 30 a 45 min).
D) DETERMINAO DO ESPECTRO NATIVO E REDUZIDO DO CITOCROMO
Usando uma cuvette de quartzo, trace o espectro de UV-Vs. (entre 250 e 800 nm) do citocromo (estado nativo). Adicione alguns gros de ditionito de sdio cuvette e trace novo espectro (estado reduzido).
E) DETERMINAO DO NMERO DE HEMOS POR MOLCULA DE PROTENA
A determinao da quantidade total de protena feita pelo mtodo de Lowry, enquanto que o contedo em hemos obtido a partir do espectro do derivado piridina hemocromo. Tenha, no entanto, em ateno que o citocromo obtido no se encontra
puro pelo que o nmero de hemos no ser proporcional quantidade de protena existente na amostra (existem contaminantes/protenas que no tm hemo).
Determinao da quantidade total de protena
Mtodo de Lowry
Reagente A (preparar 100 ml) Na2CO3 (anidro) a 2 % em NaOH 0.1 M Reagente B1 (preparar 10 ml) CuSO4.5H2O a 1 % Reagente B2 (preparar 10 ml) Tartarato de sdio e potssio
tetrahidratado a 1 %. Reagente de Lowry C (preparar 100 ml) Misturar, agitando, 1 ml de B1, 1 ml de
B2 e 100 ml de A Reagente de Lowry D (preparar 25 ml). Diluir 2 vezes o reagente de Folin
comercial com gua destilada
-
Mestrado Integrado em Cincias Farmacuticas
Bioqumica II
15
Construir uma recta padro para uma soluo de citocromo c de corao de cavalo de concentrao 0,225 mg/ml, de acordo com os volumes indicados na tabela seguinte:
Tubos 1 2 3 4 5 6
Vol (sol. padro) l ---- 100 200 300 400 500 Vol (gua) l 500 400 300 200 100 ---- Vol (sol. C)* ml 2,5 2,5 2,5 2,5 2,5 2,5 Vol (Reagente de Folin) l 500 500 500 500 500 500
*Aps a adio do reagente C, agitar e esperar 10 min. Adicionar s depois os 0,5 ml de reagente de Folin e ler aps 30 min. a absorvncia a 500 nm.
Fazer o doseamento da amostra em triplicado (utilizar de preferncia diferentes diluies).
Determinao do contedo em hemos
Efectuar uma diluio do citocromo c purificado, equivalente da determinao da quantidade total de protena, numa soluo contendo 0,075 M NaOH e 25 % (p/v) de piridina, para um volume final de 1 ml. Reduzir esta soluo com ditionito de sdio e ler a absorvncia a 550 nm. Determinar o contedo em hemos com base no coeficiente de extino molar para o hemo c: 29.1 mM-1 cm-1.
III. TRATAMENTO DOS RESULTADOS
Apresente os espectros de UV-Vis. traados entre 250 e 800 nm correspondentes forma nativa e reduzida do citocromo c. Comente eventuais diferenas. Determine o peso molecular, e o contedo hmico deste citocromo e comente.
Conclua sobre a possibilidade da existncia de formas multimricas neste citocromo.
-
Mestrado Integrado em Cincias Farmacuticas
Bioqumica II
16
DETERMINAO DA ACTIVIDADE ENZIMTICA DAS TRANSAMINASES NA
FRACO CITOSLICA DAS CLULAS DO FGADO
I. INTRODUO
A disrupo de clulas (ou seja, a ruptura da membrana celular) pode ser levada a cabo por diferentes mtodos: choque osmtico, ultra-sons, uso de detergentes especficos, triturao, etc. (ver Principais Tcnicas Usadas na Purificao de Protenas, notas das aulas prticas de Bioqumica I). Se tais mtodos forem aplicados com os devidos cuidados, os organitos intracelulares ficaro intactos e as vrias partculas apresentaro, in vitro, a maior parte das propriedades bioqumicas dos
organitos originais da clula intacta (ou seja in vivo). O extracto de clulas (ou tecido) ficar assim reduzido a uma espessa suspenso de partculas de vrios tipos, cada qual com o seu tamanho, carga e densidade. A separao dos vrios componentes celulares possvel por centrifugao. normal usar-se a centrifugao diferencial - permite a separao dos componentes sub-celulares atravs de centrifugaes sucessivas a velocidades crescentes do rotor -
sendo possvel obter quatro fraces:
Fraco nuclear - contm essencialmente os ncleos, mas tambm alguns restos de clulas que sofreram disrupo parcial, ou que no sofreram disrupo. Os ncleos contm o material gentico, ou seja o DNA, mas tambm RNA, tanto mensageiro, como ribossomal e de transferncia, resultante da actividade de transcrio e que no transitou ainda para o citoplasma. Existem tambm pequenas molculas de RNA,
constituintes das snRNPs (smal nuclear ribonuclear particles).
Fraco mitocondrial - contm no s os mitocndrios, mas tambm os peroxissomas e lisossomas (se se tratasse de clulas de plantas superiores, obter-se-iam tambm os cloroplastos).
Fraco microssomal - contm ribossomas e polissomas (ribossomas envolvidos na traduo e que se encontram ligados entre si pelo RNA mensageiro). Tambm se encontram nesta fraco pequenas vesculas.
-
Mestrado Integrado em Cincias Farmacuticas
Bioqumica II
17
Fraco citoslica - constitui a parte solvel da clula. Contm as protenas solveis, (grande nmero de enzimas) e outras molculas de pequenas dimenses. nesta fraco que se encontram enzimas como as lipases ou as transaminases. Os valores de concentrao destas ltimas possui grande interesse clnico e a sua presena ir ser detectada neste trabalho.
A entrada dos produtos de degradao dos aminocido no ciclo dos cidos tricarboxlicos (TCA) pode ocorrer em vrios passos do ciclo, sendo um dos modos de entrada o que envolve toda a estrutura carbonada ("esqueleto") do aminocido. Para tal, os diferentes aminocido entram nas diferentes vias degradativas (catablicas) que so especficas de cada tipo de aminocido. Algumas das transformaes das diferentes vias so, porm, comuns a todos os aminocidos. Entre estas esto as
reaces de transaminao, processo pelo qual o grupo amina de um aminocido
dador transferido para um -cetocido aceitador, resultando assim na formao de
um novo -cetocido (derivado do aminocido original) e num novo aminocido (resultante do -cetocido original). Os enzimas envolvidos nestas reaces designam-se por transaminases e ocorrem, na sua maioria, no citoplasma.
Figura 1 - As reaces de transaminao catalisadas pela GTP e pela GOT.
Entre as vrias transaminases que existem, muitas evidenciam uma preferncia na
utilizao de -cetoglutarato com cetocido aceitador, originando glutamato, ou vice-
versa e quase todas usam fosfato de piridoxal como co-enzima. Assim, temos por exemplo (fig. 1) a transaminase pirvica, ou GPT (glutamato-piruvato transaminase) e a transaminase oxaloactica, ou GOT (glutamato-oxaloacetato transaminase). Ambas so enzimas muito estudados em Bioqumica Clnica, funcionando como indicadores
de vrias doenas, nomeadamente as de natureza heptica.
+ +Tr ansaminase pirvica
Fosfato de pir idoxalCH3CHCOO-
NH3+
alaninaglutamato-OOCCH2CH2CHCOO-
NH3+
piruvato
OCH3CCOO-
-cetoglutarato-OOCCH2CH2CCOO-
O
++
glutamato-OOCCH2CH2CHCOO-
NH3+
-OOCCH2CCOO-O
Oxaloacetato
Tr ansaminase oxaloactica
Fosfato de pir idoxal -cetoglutarato-OOCCH2CH2CCOO-
O-OOCCH2CHCOO-
NH3+
aspar tato
-
Mestrado Integrado em Cincias Farmacuticas
Bioqumica II
18
II. TRABALHO EXPERIMENTAL
A) PREPARAO DE SOLUES
15. Tampo fosfato 0,1 M pH 7.4 16. Soluo de alanina 0,2 M em tampo fosfato 0,1 M pH 7.4
17. Soluo de -cetoglutarato 0,002 M em tampo fosfato 0,1 M pH 7.4
18. HCl 0,1 N 19. NaOH 0,4 N 20. 2,4-dinitrofenilhidrazina 1 mM em HCl 0,1 N
21. Meio de Isolamento - (0,25 M de sacarose e 1 mM de EDTA em HEPES 0,01 M pH 7.4). Dissolver 427,5 g de sacarose, 1,86 g de EDTA (sal dissdico, dihidratado) e 13,0 g de HEPES (sal dissdico) em 4,0 litros de gua destilada. Acertar o pH a 7.4 com KOH 0,1 M. Diluir para 5 litros. Guardar a 4 C.
B) OBTENO DA FRACO CITOSLICA
1. Pese 3 g de fgado e corte-o em pequenos pedaos e adicione meio de isolamento
gelado (10 ml / 3 g de fgado) 2. Transfira pores desta mistura para um homogeneizador pr-arrefecido.
Mantenha o copo do homogeneizador em gelo durante esta operao 3. Coloque a mistura num Erlenmeyer pr-arrefecido e colocado em gelo
4. Transfira o homogeneizado para tubos de centrfuga e centrifugue a 4000 g durante 10 min. a 4 C. O precipitado ser a fraco nuclear. Mantenha os tubos em gelo
5. Remova o sobrenadante para outros tubos de centrfuga 6. Centrifugue o sobrenadante a 15 000 g durante 20 min. a 4 C 7. Recolha o sobrenadante
-
Mestrado Integrado em Cincias Farmacuticas
Bioqumica II
19
C) DETERMINAO DA ACTIVIDADE DAS TRANSAMINASES
1. Para cada um de quatro tubos de ensaio (A triplicado e B), pipete 1 ml de soluo de alanina 0,2 M e 1 ml de -cetoglutarato 0,002 M em tampo de fosfato 0,1 M
pH 7.4, respectivamente.
2. Adicione aos tubos A 0,5 ml da fraco citoslica obtida na alnea B. 3. Adicione ao tubo B 0,5 ml de gua destilada (tubo controlo) 4. Incube os tubos a 37 C durante 30 min.
5. Aps o perodo de incubao, adicione a cada tubo 1 ml de soluo 1 mM de dinitrofenilhidrazina em HCl 0,1 N. misture e aguarde 20 min.
6. Adicione a cada tubo 10 ml de NaOH 0,4 N. Agitar, deixe repousar durante cerca de 5 min.
7. Leia a absorvncia do contedo dos tubos A a 540 nm, usando o contedo do tubo B como branco.
III. TRATAMENTO DOS RESULTADOS
Usando os valores do Quadro 1, trace a curva que relaciona a absorvncia a 540 nm com a actividade enzimtica das transaminases.
Quadro 1 - Relao entre a absorvncia de uma soluo a 540 nm e a sua actividade enzimtica.
Abs 540 nm Actividade enzimtica (miliunidades) 0,025 2 0,050 5 0,075 9 0,100 12 0,125 16 0,150 20 0,175 24 0,200 29
-
Mestrado Integrado em Cincias Farmacuticas
Bioqumica II
20
A partir do valor de absorvncia lido para os tubos A, determine, usando a curva traada no ponto anterior, o valor de actividade enzimtica referente s transaminases
na fraco citoslica das clulas de fgado.