QUÍMICA 25) - · PDF file01. a estrutura do álcool secundário admite...
Transcript of QUÍMICA 25) - · PDF file01. a estrutura do álcool secundário admite...

QUÍMICA 25) Dada a reação química expressa pela equação:
a H3PO4 + b Na2O c Na3PO4 + d H2O e, sendo:
(A) + (B) (C) + (D) os reagentes e produtos, respec-
tivamente, assinale a(s) proposição(ões) CORRETA(S).
(OBSERVAÇÃO: Os coeficientes a, b, c e d devem estar na sua proporção mínima de números inteiros).
01. As substâncias reagentes (A) e (B) são, respectivamente, um ácido triprotônico e uma monobase.
02. O Na3PO4 é um sal neutro. 04. A soma dos coeficientes dos reagentes da equação (a + b) é 4. 08. A soma de todos os coeficientes da equação (a + b + c + d) é 10. 16. A dissociação iônica do ácido (A) é feita em três etapas. 32. O produto (D) é um óxido ácido. 64. O coeficiente do reagente (B) é 3. Gabarito: 90 (02 + 08 + 16 + 64) Número de acertos: 175 (2,05%) Grau de dificuldade previsto: Médio Grau de dificuldade obtido: Difícil (Acerto total) Grau de dificuldade obtido: Médio (Acerto parcial) ANÁLISE DA QUESTÃO
A questão foi formulada com base nos conteúdos ministrados na 1a série do Ensino Médio, abordando dois assuntos “ajustamento dos coefi-cientes dos reagentes e produtos numa equação química”, dada a respecti-va reação química, que poderia ser feito pelo método de tentativa, aplican-do-se as regras básicas para determinar os coeficientes da cada substância, e a “classificação de duas substâncias da Química Inorgânica”, sendo uma da função “sal” e a outra da função “ácido”.
Ambas tinham como objetivo principal verificar o grau de conhe-cimento dos estudantes, considerando os aspectos cognitivos: aplicação e aquisição, respectivamente.
Constatando que somente 2,05% dos candidatos responderam cor-reta e integralmente a questão; que 27,62% responderam corretamente apenas as proposições 08 + 64, as quais versavam sobre o processo de ajustamento da equação química, não sabendo classificar o tipo de sal e as etapas de dissociação iônica do ácido; e que, 6,48% responderam apenas as proposições 08 + 16 + 64, deixando de reconhecer o sal neutro, a Banca concluiu que o grau de dificuldade inicialmente previsto, não foi alcança-do, devido ao desconhecimento, por parte maioria dos candidatos, acerca dos conteúdos programados para a série “Funções da Química Inorgânica ou Mineral”.

26) Uma das principais partículas atômicas é o elétron. Sua descoberta
foi efetuada por J. J. Thomson em uma sala do Laboratório Cavendi-sh, na Inglaterra, ao provocar descargas de elevada voltagem em ga-ses bastante rarefeitos, contidos no interior de um tubo de vidro.
c á to d o
â no d o
TUBO “A”
c á to d o
â no d o
TUBO “B”
c á to d o
â no d o
TUBO “C ”
No tubo de vidro “A”, observa-se que o fluxo de elétrons (raios ca-tódicos) colide com um anteparo e projeta sua sombra na parede oposta do tubo.
No tubo de vidro “B”, observa-se que o fluxo de elétrons (raios ca-tódicos) movimenta um catavento de mica.
No tubo de vidro “C”, observa-se que o fluxo de elétrons (raios ca-tódicos) sofre uma deflexão para o lado onde foi colocada uma placa carregada positivamente.
Observando os fenômenos que ocorrem nos tubos, podemos a-firmar CORRETAMENTE que:
01. os elétrons se propagam em linha reta. 02. os elétrons possuem massa – são corpusculares. 04. os elétrons possuem carga elétrica negativa. 08. os elétrons partem do cátodo. 16. gases são bons condutores da corrente elétrica. 32. o catavento entrou em rotação devido ao impacto dos elétrons na sua
superfície. Gabarito: 47 (01 + 02 + 04 + 08 + 32) Número de acertos: 166 (1,94%) Grau de dificuldade previsto: Fácil Grau de dificuldade obtido: Difícil (Acerto total) Grau de dificuldade obtido: Médio (Acerto parcial) ANÁLISE DA QUESTÃO
A questão foi formulada com base nos conteúdos ministrados na 1a série do Ensino Médio, abordando apenas um assunto: “estrutura atômi-ca”, considerando o aspecto cognitivo: aquisição de conhecimentos.
Para responder a questão os candidatos tinham que relacionar as figuras representadas pelos tubos “A”, “B” e “C”, com as respectivas ob-servações fornecidas no enunciado.
Constatando que somente 1,94% dos candidatos responderam cor-reta e integralmente a questão, que 21,00% responderam corretamente apenas as proposições 04 + 08, e que 12,97% responderam corretamente as proposições 04 + 08 + 32, a Banca concluiu que o grau de dificuldade inicialmente previsto não foi alcançado. Talvez devido ao estado emocio-nal durante a realização do vestibular, os candidatos não conseguiram interpretar os dados fornecidos no enunciado ou a maioria desconhece que os elétrons possuem massa e se propagam em linha reta. Sugerimos que as escolas revisem, quando do planejamento da disciplina, a aborda-gem do assunto em pauta.

27) A energia de ionização dos elementos químicos é uma propriedade periódica, isto é, varia regularmente quando os mesmos estão dis-postos num sistema em ordem crescente de seus números atômicos. O gráfico, a seguir, mostra a variação da energia de ionização do 1o elétron, em e.V, para diferentes átomos.
Com base na ilustração, assinale a(s) proposição(ões) CORRETA(S).
01. No intervalo Z = 3 a Z = 10, observa-se que o aumento da carga
nuclear tende a aumentar a força de atração do elétron pelo núcleo. 02. Selecionando-se três átomos com maior dificuldade para formarem
cátions monovalentes, teríamos os átomos de He, Li e Na. 04. O potássio é o metal que apresenta o menor potencial de ionização,
entre os elementos representados. 08. A carga nuclear é o único fator determinante da energia de ionização. 16. Os elevados valores da energia de ionização para os gases He, Ne e
Ar são evidências de que “camadas eletrônicas completas” são um ar-ranjo estável.
32. Considerando os elementos que formam um período da tabela pe-riódica, a tendência da energia de ionização é diminuir com o aumen-to do número atômico.
64. As menores energias de ionização correspondem aos metais alca-linos.
Gabarito: 85 (01 + 04 + 16 + 64) Número de acertos: 502 (5,87%) Grau de dificuldade previsto: Médio Grau de dificuldade obtido: Difícil (Acerto total) Grau de dificuldade obtido: Médio (Acerto parcial)
ANÁLISE DA QUESTÃO Nesta questão são apresentadas quatro proposições corretas 01;
04; 16 e 64. A maior incidência de respostas (85%) não contempla a pro-posição 01, em que é exposto que o aumento da carga nuclear tende a au-mentar a força de atração do elétron pelo núcleo. Ora, todos os alunos do Nível Médio sabem que sinais contrários se atraem e, portanto, se a carga nuclear aumenta, então não há motivo para que os elétrons não sejam mais fortemente atraídos. O que faltou aos candidatos foi a fundamentação do conceito de E.I. Por outro lado, algumas respostas parcialmente corretas indicam que muitos candidatos não souberam identificar, no gráfico, o elemento químico potássio, dentre os elementos dados, como o que apre-sentava a menor E.I. Outros, ainda, não souberam identificar corretamente os períodos da classificação dos elementos químicos, quando representa-dos graficamente: Z=3-10 (2o período), Z=11-18 (3o período) e Z=19-20 (4o período). Em síntese, acreditamos que uma dificuldade acrescida às propriedade periódicas foi a sua representação gráfica E.I versus Z, mas que tal dificuldade pode ser facilmente corrigida, com um número maior de exercícios em classe, envolvendo as diferentes propriedades periódicas.
2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 32
5
10
15
20
25
Ener
gia
de io
niza
ção
(eV
)
Número atômico (Z)

28) Considere um átomo representado pelo seu número atômico Z = 58 e
em seu estado normal.
É CORRETO afirmar que: 01. o mesmo possui um total de 20 elétrons em subnível f. 02. sua última camada contém 2 elétrons no total. 04. se um de seus isótopos tiver número de massa 142, o número de
nêutrons desse isótopo é 82. 08. os subníveis 5s 4d 5p 6s 4f não estão escritos na sua ordem crescen-
te de energia. 16. o primeiro nível de energia com elétrons em orbitais d é o n = 4. 32. um de seus elétrons pode apresentar o seguinte conjunto de números
quânticos: n = 2, λ = 0, m = +1, s = +1/2. Gabarito: 02 (02) Número de acertos: 1.850 (21,65%) Grau de dificuldade previsto: Fácil Grau de dificuldade obtido: Médio ANÁLISE DA QUESTÃO
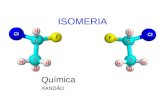
Estão envolvidos conceitos de estrutura atômica moderna, em que os elétrons de um dado átomo estão representados por seus números quân-ticos. A maior incidência de respostas ocorreu sobre a proposição correta (21%), significando que o assunto é abordado de forma correta. Entretan-to, um número importante de respostas, 32 e 38, incidiu sobre as proposi-ções 02 + 32, indício de que os candidatos não souberam avaliar que os números quânticos impõem certas restrições; no caso, o elétron com núme-ro l = 0 (orbital s) só poderia possuir número quântico magnético m = 0 e não m = +1 como estava proposto. 29) Um álcool secundário, de fórmula molecular C4H10O, quando aque-
cido na presença de alumina (Al2O3) sofre desidratação, dando ori-gem ao composto orgânico A que, por sua vez, é tratado com um á-cido halogenídrico (HX), produzindo o composto orgânico B. Conside-re que os produtos A e B são aqueles que se formam em maior quan-tidade.
Como as informações acima são verdadeiras, assinale a(s) proposi-ção(ões) CORRETA(S):
01. a estrutura do álcool secundário admite isomeria ótica. 02. o álcool secundário é denominado oficialmente 2-butanol. 04. o composto A formado admite isomeria geométrica ou cis-trans. 08. o composto A formado é o 1-buteno. 16. o composto B formado admite isomeria ótica. 32. o composto B formado admite simultaneamente isomeria geométrica e
isomeria ótica. Gabarito: 23 (01 + 02 + 04 + 16) Número de acertos: 320 (3,75%) Grau de dificuldade previsto: Difícil Grau de dificuldade obtido: Difícil (Acerto total) Grau de dificuldade obtido: Médio (Acerto parcial)

ANÁLISE DA QUESTÃO
A questão foi formulada com base nos conteúdos ministrados na disciplina Química Orgânica, abordando os assuntos “reações orgânicas” e “isomeria espacial”.
As proposições tinham como objetivo principal verificar o grau de conhecimento dos estudantes, considerando o aspecto cognitivo: aplicação de conhecimentos.
Constatando que somente 3,75% dos candidatos responderam cor-reta e integralmente a questão, que 8,40% responderam corretamente apenas a proposição 02, que 7,10% responderam as proposições 02 + 16, e que 7,58% deram como resposta o somatório 10, que não se enquadra em nenhuma possibilidade de combinação das proposições corretas, a Banca concluiu que o grau de dificuldade inicialmente previsto foi alcançado, devido ao grande número de reações químicas estudadas na disciplina. 30) O narcotráfico tem sempre uma novidade para aumentar o vício. A
última é o GHB, com a seguinte fórmula estrutural plana:
Entre os principais malefícios da droga estão: - dificuldade de concentração - perda de memória - parada cardiorrespiratória - diminuição dos reflexos - perda da consciência - disfunção renal
Com base na estrutura orgânica acima, assinale a(s) proposi-ção(ões) CORRETA(S):
01. a fórmula representa um composto orgânico de função mista: ácido
orgânico e enol. 02. o carbono onde está ligado o grupo hidroxila é o carbono delta. 04. a hidroxila está ligada ao carbono 4 da cadeia principal. 08. a nomenclatura do composto é ácido gama-hidróxi-butanóico. 16. na estrutura do referido composto existe um carbono insaturado. 32. todos os carbonos da cadeia são saturados. 64. o composto possui isômeros óticos que apresentam os mesmos
princípios maléficos acima referidos. Gabarito: 28 (04 + 08 + 16) Número de acertos: 404 (4,73%) Grau de dificuldade previsto: Médio Grau de dificuldade obtido: Difícil (Acerto total) Grau de dificuldade obtido: Médio (Acerto parcial)
H - C - C - C - C O O HHO H
H H H
H

ANÁLISE DA QUESTÃO
A questão foi formulada com base nos conteúdos ministrados na disciplina Química Orgânica, em nível de Ensino Médio, abordando os assuntos “identificação e nomenclatura de substâncias orgânicas” e “clas-sificação das cadeias carbônicas”. Ambas tinham como objetivo principal verificar o grau de aquisição de conhecimento dos estudantes no aspecto cognitivo.
Constatando que somente 4,73% dos candidatos responderam cor-reta e integralmente a questão, que 8,83% responderam corretamente apenas as proposições 04 + 16, não estabelecendo relação da sigla GHB inserida no enunciado da questão com a proposição 08, a Banca concluiu que o grau de dificuldade, inicialmente previsto não foi alcançado, tendo em vista que 12,58% dos candidatos atribuíram o somatório 36, conside-rando como correta, entre outras, a proposição 32, revelando seu desco-nhecimento da interpretação da estrutura molecular. 31) A estrutura do hidrocarboneto aromático benzeno (C6H6) é repre-
sentada pelo híbrido de ressonância a seguir, que possui:
01. três carbonos híbridos em sp3 e três carbonos híbridos em sp2. 02. seis orbitais não-híbridos denominados “p puro”. 04. todos os átomos de hidrogênio ligados aos de carbono através de
ligações (s-sp2). 08. três ligações do tipo π. 16. apenas seis ligações do tipo . 32. três carbonos saturados e três carbonos insaturados. 64. todos os carbonos híbridos em sp2. Gabarito: 78 (02 + 04 + 08 + 64) Número de acertos: 128 (1,50%) Grau de dificuldade previsto: Médio Grau de dificuldade obtido: Difícil (Acerto total) Grau de dificuldade obtido: Médio (Acerto parcial) ANÁLISE DA QUESTÃO
A questão foi formulada com base nos conteúdos ministrados na disciplina Química Orgânica, em nível de Ensino Médio, abordando o assunto “teoria da hibridização“. O objetivo principal era verificar o grau de conhecimento dos estudantes nos aspectos cognitivos: aquisição e apli-cação.
Constatando que somente 1,50% dos candidatos respondeu corre-ta e integralmente a questão, que 13,61% responderam apenas as propo-sições 04 + 08 + 16, que 3,46% eram como resposta o somatório 24 e 3,92% o somatório 40, os dois últimos não se enquadrando em nenhuma das possibilidades de combinação das proposições corretas, a Banca con-cluiu que o grau de dificuldade inicialmente previsto não foi alcançado. Sugerimos que as escolas que ministram no Ensino Médio revisem com seus alunos a programação da disciplina Química Orgânica, dando mais ênfase ao assunto “hibridização”.

32) Assinale a(s) proposição(ões) CORRETA(S) a respeito da cadeia
carbônica de fórmula estrutural plana que segue: 01. representa uma cadeia carbônica acíclica heterogênea. 02. é uma amida primária monossubstituída. 04. é uma amina primária. 08. o radical orgânico ligado ao grupo amino (-NH2) é uma alcoíla ou
alquila. 16. é isômero de cadeia da substância: H2N – CH2 – CH2 – CH2 – CH3. 32. todos os seus carbonos são saturados. 64. possui um carbono assimétrico. Gabarito: 60 (04 + 08 + 16 + 32) Número de acertos: 384 (4,49%) Grau de dificuldade previsto: Fácil Grau de dificuldade obtido: Difícil (Acerto total) Grau de dificuldade obtido: Médio (Acerto parcial) ANÁLISE DA QUESTÃO
A questão foi formulada com base nos conteúdos ministrados na disciplina de Química Orgânica, em nível de Ensino Médio, abordando vários assuntos, como “classificação das cadeias carbônicas”, “identifica-ção de substâncias orgânicas”, “identificação de radicais orgânicos”, “i-dentificação do tipo de isomeria plana” e “identificação do tipo de átomo de carbono numa estrutura orgânica”.
Todas as proposições apresentadas tinham como objetivo principal verificar o grau de conhecimento dos candidatos considerando o aspecto cognitivo aquisição.
Constatando que 4,49% dos candidatos responderam correta e in-tegralmente a questão, que 12,45% responderam corretamente apenas as proposições 04 + 16 + 32 e que 11,24% responderam corretamente as pro-posições 04 + 32, a Banca concluiu que o grau de dificuldade inicialmente previsto não foi alcançado. Sugerimos que no Ensino Médio os tópicos das questões acima citados sejam mais exercitados. 33) Soluções ácidas e soluções alcalinas exibem propriedades importan-
tes, algumas delas ligadas à força do ácido ou da base. Uma solução aquosa de um ácido genérico HA poderá ser classificada como solu-ção de um ácido fraco quando:
01. não se alterar na presença de uma base. 02. apresentar coloração avermelhada na presença do indicador fenolfta-
leína. 04. mantiver uma concentração de HA muito maior que a concentração
dos íons H+. 08. apresentar uma concentração de íons H+ maior que a concentração
de íons A-. 16. a solução for altamente condutora de corrente elétrica. Gabarito: 04 (04) Número de acertos: 1.611 (18,86%) Grau de dificuldade previsto: Fácil Grau de dificuldade obtido: Fácil
CH 3
H C 3 CH NH 2 CH 2

Concentração de glicose (g/100mL)
Inte
nsid
ade
da c
or
ANÁLISE DA QUESTÃO O conteúdo abordado envolveu conhecimentos de soluções ácidas e básicas. Pelo resultado apresentado e o grau de dificuldade previsto, pode-se deduzir que o assunto é corretamente abordado no Ensino Funda-mental. 34) A glicose, fórmula molecular C6H12O6, se presente na urina, pode ter
sua concentração determinada pela medida da intensidade da cor re-sultante da sua reação com um reagente específico, o ácido 3,5-dinitrossalicílico, conforme ilustrado na figura:
Imaginemos que uma amostra de urina, submetida ao tratamento a-cima, tenha apresentado uma intensidade de cor igual a 0,2 na esca-la do gráfico. É então CORRETO afirmar que:
01. a concentração de glicose corresponde a 7,5 g/L de urina. 02. a amostra apresenta aproximadamente 0,028 mol de glicose por litro. 04. observa-se, na figura, que a intensidade da cor diminui com o au-
mento da concentração de glicose na amostra.
08. a intensidade da cor da amostra não está relacionada com a con-centração de glicose.
16. uma vez que a glicose não forma soluções aquosas, sua presença na urina é impossível.
Gabarito: 02 (02) Número de acertos: 3.698 (43,31%) Grau de dificuldade previsto: Médio Grau de dificuldade obtido: Fácil ANÁLISE DA QUESTÃO
Inicialmente foi previsto para esta questão um índice de facilidade médio; contudo os resultados apontam que, dentre todas as questões da prova de Química, foi esta em que os candidatos apresentaram a maior incidência de respostas corretas: mais de 43% . O resultado é um tanto surpreendente, pois o caminho que levaria à resposta correta passaria ne-cessariamente por extrair-se um valor do gráfico dado, calcular-se a massa molecular de glicose para, então, converter-se o resultado obtido no gráfi-co, expresso em g/100 mL, em mol/L. Por outro lado, um número expres-sivo de respostas incidiu sobre as proposições 01 + 02, que são conflitantes entre si, pois representam diferentes resultados numéricos.
0,0 0,2 0,4 0,6 0,8 1,0 1,2 1,4 1,6 0,0
0,2
0,4
0,6

35) Dados os potenciais de redução E0 (em volts, em solução aquosa 1M,
a 25oC e 1atm.) das semi-reações:
assinale a(s) proposição(ões) CORRETA(S).
01. O Ca2+ recebe mais facilmente elétrons. 02. O Ni0 perde mais facilmente elétrons. 04. O Ni2+ recebe mais facilmente elétrons. 08. O Zn2+ perde mais facilmente elétrons. 16. O Ca0 perde mais facilmente elétrons. 32. O Zn2+ é o melhor agente redutor. 64. O Ni2+ é o melhor agente oxidante. Gabarito: 84 (04 + 16 + 64) Número de acertos: 848 (9,93%) Grau de dificuldade previsto: Médio Grau de dificuldade obtido: Difícil (Acerto total) Grau de dificuldade obtido: Médio (Acerto parcial) ANÁLISE DA QUESTÃO
Esta questão foi formulada com base nos conteúdos ministrados na disciplina Físico-Química, abordando o assunto “eletroquímica”. O obje-tivo principal era verificar o grau de conhecimento dos candidatos, consi-derando os aspectos cognitivos aplicação e aquisição.
Constatando que 9,93% dos candidatos responderam correta e in-tegralmente a questão; que 5,92% responderam corretamente apenas as proposições 04 + 16; que 1,66% dos candidatos responderam corretamente a proposição 16 e que 1,33% responderam corretamente a proposição 04, a Banca concluiu que o grau de dificuldade inicialmente previsto não foi alcançado, devido ao desconhecimento, por parte dos candidatos, acerca dos conteúdos da unidade “Eletroquímica”. Sugerimos que, no Ensino Médio, os tópicos abordados na questão sejam mais exercitados.

36) Verifica-se, experimentalmente, que a pressão de vapor de um líquido
aumenta com a elevação da temperatura e que, na temperatura de ebulição, seu valor é máximo.
A 100oC a pressão máxima de vapor da água pura é de 1 atmosfera, e nessa temperatura a água pura entra em ebulição, conforme ilus-tração a seguir:
0 100t (ºC )
p (m m H g )
50
200
400
600
800760
Numa cidade, cuja altitude é superior à do nível do mar, a tempera-tura de ebulição da água pura é: 01. igual a 100oC, porque a fórmula da água não se altera, seja qual for a
temperatura ou pressão. 02. maior que 100oC, porque a pressão atmosférica é menor. 04. menor que 100oC, porque a pressão atmosférica é maior. 08. maior que 100oC, porque a pressão atmosférica é maior. 16. menor que 100oC, porque a pressão atmosférica é menor. Gabarito: 16 (16) Número de acertos: 3.294 (38,56%) Grau de dificuldade previsto: Médio Grau de dificuldade obtido: Médio ANÁLISE DA QUESTÃO
Esta questão foi formulada com base nos conteúdos ministrados na 1a série do Ensino Médio, abordando dois assuntos: “mudanças de estado físico” e “pressão atmosférica”.
O objetivo principal era verificar o grau de conhecimento dos can-didatos, considerando o aspecto cognitivo aquisição.
13,62% responderam como correta a proposição 01; 10,57% responderam como correta a proposição 02; 17,98% responderam como correta a proposição 04; e 11,96% responderam como correta a proposição 08. Constatando que somente 38,56% dos candidatos responderam
corretamente a questão, a Banca concluiu que o grau de dificuldade inici-almente previsto não foi alcançado. Sem comentários. Ensejamos apenas uma reflexão a respeito.

CONSIDERAÇÕES FINAIS:
Provavelmente, devido ao grande número de proposições nas
questões e o número de proposições corretas
Questão No de proposições
No de proposições corretas
25 07 04 26 06 05 29 06 04 30 07 03 31 07 04 32 07 04 35 07 03
o “grau de dificuldade previsto”, não foi alcançado.
A diversidade dos conteúdos abordados numa única questão, tal-vez tenha produzido um diferencial muito grande na expectativa do “grau de dificuldade alcançado”.
Ressaltamos que, na questão 36, o número de proposições foi 05,
com uma única proposição correta, e entretanto, o “grau de dificuldade previsto” também falhou.
CONCLUSÃO A Banca conclui, com base nos percentuais de acertos, que o can-didato está mais propenso a assinalar um número restrito das proposições propostas, mesmo que estas lhe confiram apenas os pontos obtidos nos acertos parciais, como garantia do seu desempenho.
Assim, quanto ao “grau de dificuldade obtido”, consideram-se duas situações: 1a) acertos totais 2a) acertos parciais.