UNIVERSIDADE FEDERAL DE PERNAMBUCO CENTRO DE … · 1.1.3. RESPOSTAS DO SISTEMA MUSCULAR À...
Transcript of UNIVERSIDADE FEDERAL DE PERNAMBUCO CENTRO DE … · 1.1.3. RESPOSTAS DO SISTEMA MUSCULAR À...
UNIVERSIDADE FEDERAL DE PERNAMBUCO
CENTRO DE CIÊNCIAS DA SAÚDE
DEPARTAMENTO DE FISIOTERAPIA
PROGRAMA DE PÓS-GRADUAÇÃO EM FISIOTERAPIA
EMANUELA VIRGINIA VALE CAVALCANTE
OS EFEITOS DA ELETROESTIMULAÇÃO NA REGENERAÇÃO DO NERVO
ISQUIÁTICO DE RATOS SUBMETIDOS À LESÃO POR ESMAGAMENTO
RECIFE
2011
EMANUELA VIRGINIA VALE CAVALCANTE
OS EFEITOS DA ELETROESTIMULAÇÃO NA REGENERAÇÃO DO NERVO
ISQUIÁTICO DE RATOS SUBMETIDOS À LESÃO POR ESMAGAMENTO
Dissertação apresentada ao Programa de Pós-
Graduação em Fisioterapia do Centro de Ciências da
Saúde da Universidade Federal de Pernambuco para
obtenção do Grau de Mestre em Fisioterapia.
Linha de Pesquisa: Fisioterapia: desempenho
físico-funcional e qualidade de vida.
Orientador: Profº Drº Nicodemos Teles de Pontes
Filho.
Co-orientador: Profº Drº Eduardo José Nepomuceno
Montenegro.
RECIFE
2011
DEDICATÓRIA
Aos meus pais, Virgílio Cavalcante e Maria
Delian Cavalcante, por toda uma vida de amor,
dedicação e esforço em favor da minha formação
pessoal e profissional.
AGRADECIMENTOS
À Deus, pela presença constante e que nesta fase se traduziu em esperança
e superação.
Aos meus pais, Virgilio de Souza Cavalcante e Maria Delian Alves Vale
Cavalcante, os grandes responsáveis pelo o que sou. Muito obrigada pelo amor e
apoio incondicional.
Ao meu irmão, Emanuel Vale Cavalcante, pelos seus ensinamentos, pelas
críticas construtivas, pelo incentivo e por acreditar na minha capacidade, antes de
mim mesma.
Ao meu orientador, Profº Dr. Nicodemos Pontes de Filho Teles, que contribui
para a minha formação profissional. Obrigada pela sua paciência e confiança.
Ao Profº Dr. Eduardo José Nepomuceno Montenegro, pelos seus
ensinamentos e seus preciosos conselhos.
À profª Maria Bernadete Souza Maia, por abrir as portas do Laboratório de
Farmacologia de Compostos Bioativos para realização dos procedimentos
experimentais.
Às minhas parceiras Thaysa de Oliveira Lima Souza e Leila Maria Alvares
Barbosa, pelo apoio moral e técnico, indispensáveis para a realização deste
trabalho, e pelos momentos de descontração e vitórias compartilhados. Uma grande
surpresa que o destino guardou para mim.
À Lívia Gabriely Melo da Silvia, pela sua disponibilidade e dedicação, também
indispensável para a realização deste trabalho.
À Eryventon Franco e Ana Paula Oliveira, pela receptividade no Laboratório
de Farmacologia de Compostos Bioativos e por partilhar preciosos ensinamentos no
manejo com os ratos.
À José Antônio Santos, pelo exemplo, por sua disponibilidade e por seus
ensinamentos metodológicos.
Aos Técnicos de laboratório, Silvania Paz e Rafael Padilha, pelo seu auxílio
que contribuiu para o desenvolvimento deste trabalho.
Aos docentes do programa de pós-graduação em Fisioterapia, que
contribuem para o crescimento da Fisioterapia.
A todos os meus colegas de mestrado, Adriana, Alana, Antônio; Dinalva,
Jacqueline, João, Leila, Pedro, Silvana, Roberta, Rodrigo, Thaysa e Thales pelos
estudos e debates que tanto promoveram o conhecimento da primeira turma do
curso (2009), assim como pelos encontros sociais realizados;
Às secretárias da pós-graduação, Niége Melo e Maria Carolina Henrique,
sempre solícitas e disponíveis. Obrigada pelo apoio principalmente no processo final
desta dissertação.
Aos meus familiares e amigos, em especial Ione Natália Nunes, pela torcida e
incentivo.
RESUMO
Objetivo: avaliar os efeitos da eletroestimulação (EE) sobre a regeneração
nervosa e recuperação funcional de ratos submetidos à lesão do nervo isquiático.
Métodos: quinze ratos wistar foram distribuídos em três grupos (n=5): controle (GC),
desnervado (GD) e desnervado com eletroestimulação (GD+E). O protocolo de EE
consistiu em uma sessão diária de 30 minutos, por 42 dias. Os parâmetros da EE
utilizados foram: corrente exponencial com freqüência de 1Hz, largura de pulso de
100ms e intensidade padronizada a partir da visualização da contração do músculo.
A avaliação funcional foi dada pelo índice de funcionalidade do ciático (IFC)
realizada no pré-operatório e 7º, 14º, 21º, 28º, 35º e 42º dias pós-operatório e a
regeneração axonal foi verificada por meio da análise morfométrica do nervo.
Resultados: O IFC do GD e GDE atingiu o valor pré-operatório, respectivamente, no
42º e 35º dia pós-operatório. Os grupos desnervados apresentaram maior densidade
de fibras (p<0,05) e menor diâmetro médio da fibra e do axônio (p<0,05), quando
comparados ao GC. A espessura média da bainha de mielina do GD foi menor em
relação ao GC (p<0,05). A razão G não variou entre os grupos. Conclusão: Os
resultados deste estudo demonstram uma recuperação funcional antecipada no
grupo submetido à EE e assim, indica o efeito benéfico da EE tratamento da lesão
nervosa periférica.
Palavras-chave: Sistema Nervoso Periférico; Desnervação; Estimulação
Elétrica.
ABSTRACT
Objective: to evaluate the effects of electrical stimulation (ES) on nervous
regeneration and functional recovery of rats underwent a sciatic nerve lesion.
Methods: fithteen Wistar rats were distributed into three groups (n=5): control (CG);
denervated (DG) and denervated with ES (DEG). The EE protocols were formed by
one session per day of 30 minutes, for 42 days. The protocol parameters were:
exponential current, 1 Hz of frequency, 100ms of phase duration and intensity
enough to produce a visible muscle contraction. The functional evaluation was
performed by the sciatic functional index (SFI) at the preoperative day, 7th, 14th, 21th,
28th, 35th and 42th postoperative day and the axonal regeneration was check by nerve
morphometric analysis. Results: The DG and DEG SFI´s reached the preoperative
value at, respectively, 42th and 35th postoperative day. The denervated groups
showed higher fiber density (p<0,05) and lower fiber and axon diameters (p<0,05),
compared with CG. The myelin sheath thickness in DG was lower than CG (p<0,05).
The G ratio did not vary among all groups. Conclusion: The results showed a
premature functional recovery at the group subject to ES and thus, indicated a
beneficial effect of ES in peripheral nervous lesion treatment.
Key Words: Peripheral Nervous System; Denervation; Electric Stimulation.
LISTA DE FIGURAS
Figura 1. Esquema da passarela de análise da marcha ........................................... 21
Figura 2. Representação esquemática dos parâmetros medidos para calcular o
Índice Funcional do Ciático (IFC). ............................................................................. 21
Figura 3. Exposição e lesão do nervo isquiático ....................................................... 27
Figura 4. Aspecto macroscópico do nervo isquiático imediatamente após a lesão. . 27
Figura 5. Posicionamento dos eletrodos de superfície ............................................. 29
Figura 6. Desenho esquemático do corte transversal do nervo, demonstrando a
distribuição heterogênea das fibras. .......................................................................... 32
Figura 7. Desenho esquemático do corte transversal do nervo, demonstrando a
seleção aleatória dos campos do nervo .................................................................... 33
LISTA DE ABREVIATURAS E SIGLAS
ºC Graus Celsius
cm Centímetro
CPE Comprimento da pegada experimental
CPN Comprimento da pegada normal
Crx Cronaxia
CS Células de Schwann
DPO Distância ao pé oposto
EE Eletroestimulação
g Grama
Hz Hertz
IFC Índice funcional do ciático
KCl Cloreto de potássio
LIPE Largura intermediária da pegada experimental
LIPN Largura intermediária da pegada normal
LPE Largura da pegada experimental
LPN Largura da pegada normal
MEC Matriz extracelular
Ml Mililitro
mm Milímetro
MMP Metaloproteinases da matriz
MPD Membro posterior direito
MPE Membro posterior esquerdo
ms Milisegundo
MyoD Fator D de diferenciação miogênica
N-CAM Moléculas de adesão celular
PBS Tampão fosfato-salino (Phosphate buffered saline)
PVP Polivinilpirrolidona
RAch Receptores da acetilcolina
Reo Reobase
SNC Sistema nervoso central
TC Tecido conjuntivo
SUMÁRIO
CAPÍTULO 1 – INTRODUÇÃO ........................................................................................... 13
1.1 LESÃO NERVOSA PERIFÉRICA ............................................................................... 14
1.1.1. LESÃO NERVOSA PERIFÉRICA POR ESMAGAMENTO .................................. 15
1.1.2. PROCESSO DE DEGENERAÇÃO E REGENERAÇÃO NERVOSA
PERIFÉRICA ................................................................................................................ 16
1.1.3. RESPOSTAS DO SISTEMA MUSCULAR À DESNERVAÇÃO ........................... 18
1.1.4. AVALIAÇÃO FUNCIONAL DA MARCHA ............................................................ 20
1.2. ELETROESTIMULAÇÃO E SEUS EFEITOS ............................................................ 22
1.3. OBJETIVOS .............................................................................................................. 24
1.3.1 GERAL ................................................................................................................ 24
1.3.2 ESPECÍFICOS ..................................................................................................... 24
CAPÍTULO 2 – MATERIAIS E MÉTODOS .......................................................................... 25
2.1 ASPECTOS ÉTICOS.................................................................................................. 25
2.2 ANIMAIS .................................................................................................................... 25
2.3 GRUPOS EXPERIMENTAIS ...................................................................................... 25
2.4 PROCEDIMENTO CIRÚRGICO ................................................................................. 25
2.4.1 ANESTESIA ......................................................................................................... 26
2.4.2 PROCEDIMENTO PRÉ-CIRÚRGICO .................................................................. 26
2.4.3 TÉCNICA CIRÚRGICA ........................................................................................ 26
2.5 PROTOCOLO DE ELETROESTIMULAÇÃO .............................................................. 28
2.6 ANÁLISE FUNCIONAL DA MARCHA ........................................................................ 29
2.7 COLETA E PROCESSAMENTO DO NERVO ............................................................ 30
2.8 EUTANÁSIA DOS ANIMAIS ....................................................................................... 31
2.9 ANÁLISE MORFOMÉTRICA ...................................................................................... 31
2.10 ANÁLISE ESTATÍSTICA .......................................................................................... 34
CAPÍTULO 3. REFERÊNCIAS ............................................................................................ 35
CAPÍTULO 4. ARTIGO ORIGINAL ..................................................................................... 42
CAPÍTULO 5. CONSIDERAÇÕES FINAIS .......................................................................... 63
ANEXO A – Artigo de Revisão Sistemática ......................................................................... 64
ANEXO B – Submissão do Artigo de Revisão Sistemática .................................................. 83
ANEXO C – Carta de Aprovação do Comitê de Ética .......................................................... 84
ANEXO D – Normas utilizadas para publicação dos artigos aos periódicos ........................ 85
13
CAPÍTULO 1 – INTRODUÇÃO
Os nervos periféricos são alvos comuns de lesões de origem traumática,
tais como esmagamento, estiramento ou secção, que comprometem a transmissão
dos impulsos nervosos e causam a degeneração das fibras nervosas distais à lesão
(RODRÍGUEZ, VALERO-CABRÉ, NAVARRO, 2004).
O comprometimento, parcial ou total, das funções sensitiva, motora e
autonômica dos segmentos inervados constitui a principal conseqüência da lesão
nervosa periférica, que por sua vez, conduz o indivíduo à perda de sua capacidade
funcional e à redução na qualidade de vida. Além disso, ela gera conseqüências
sócio-econômicas em termos de cuidados com saúde (NAVARRO, VIVÓ, VALERO-
CABRÉ, 2007).
Após a lesão, uma seqüência complexa e bem regulada de processos
moleculares se desenvolve com o objetivo de remover o tecido danificado e
promover a regeneração do nervo (LUNDBORG, 2000). No entanto, evidencias
clínicas e experimentais demonstram que essa regeneração nervosa por si só não
promove uma recuperação funcional satisfatória (AYDIN et al, 2004; NAVARRO,
VIVÓ, VALERO-CABRÉ, 2007).
Dessa forma, temas relacionados à recuperação da lesão nervosa
periférica tem sido alvo crescente de investigações científicas, que se desenvolvem
no mais diversos aspectos, como: desenvolvimento de métodos e técnicas para
reconstrução do tecido nervoso (BATTISTON et al, 2009; SIEMIONOW, BRZEZICKI,
2009); métodos de avaliação funcional (COSTA et al., 2009; NAVARRO, UDINA,
2009); e abordagens terapêuticas através do uso de agentes biomoleculares
(TERENGHI, WIBERG, KINGHAM, 2009), farmacológicos (MAGNAGHI,
PROCACCI, TATA, 2009) e físicos (GORDON, SULAIMAN, LADAK, 2009) para a
promoção da regeneração nervosa e recuperação funcional.
No campo da fisioterapia, o emprego de agentes físicos com fins
terapêuticos é freqüente no tratamento da lesão nervosa periférica. A
eletroestimulação (EE) (CANCELIERI, 2005), ultra-som (MONTE-RASO, 2006) e
laser de baixa freqüência (ENDO, 2002; ANDRAUS, 2009) constituem os principais
agentes físicos empregados e estudados no tratamento desta condição. Em comum,
14
o uso destes recursos tem o intuito de favorecer uma melhor recuperação funcional
para o paciente.
Em particular, a EE visa manter o músculo desnervado no estado mais
saudável possível enquanto este aguarda a reinervação Nesse sentido, o estudo de
revisão sistemática (Anexo A) demonstra que o uso da EE é valido em minimizar os
efeitos da lesão do nervo sobre o sistema muscular contudo, os efeitos desse sobre
a regeneração do nervo e recuperação funcional ainda são controversos.
1.1 LESÃO NERVOSA PERIFÉRICA
Os nervos periféricos compõem uma linha de condução que leva
informações sensoriais da pele, músculos e outros órgãos ao sistema nervoso
central (SNC) e informações motoras do SNC para músculos somáticos e órgãos
efetores controlado pelo sistema autônomo. Eles são constituídos de feixes de fibras
nervosas (axônios), revestidas pela bainha de mielina (células de Schwann),
reunidas por tecido conjuntivo de maneira específica (RIET-CORREA et al., 2002).
O tecido que reveste os nervos mais externamente é conhecido como
epineuro, dotado de características histo-morfológicas que garantem proteção ao
tecido nervoso frente a traumas externos. No interior de cada envoltório epineural,
as fibras nervosas estão agrupadas em feixes, denominados fascículos, que são
revestidos por uma membrana conjuntiva chamada de perineuro. Por fim, no interior
do fascículo, as fibras nervosas são revestidas pelo endoneuro (DAHLIN, 2004).
A classificação das lesões dos nervos periféricos é baseada no grau de
ruptura das estruturas internas do nervo periférico, na funcionalidade nervosa e na
capacidade de recuperação espontânea, que por sua vez, estarão correlacionados
com o prognóstico da lesão. Seddon (1943) publicou uma classificação baseada em
três níveis, conforme o grau de lesão sofrido pelo nervo, como se segue:
Neuropraxia – É a forma mais branda de uma lesão nervosa, no qual
existe um bloqueio localizado da condução nervosa, porém, os segmentos proximais
e distais à lesão preservam a sua condutibilidade. Portanto, neste tipo lesão não há
perda da continuidade do axônio, sendo a recuperação rápida e completa em
poucas semanas.
15
Axonotmese – É uma lesão mais grave, onde os danos são suficientes
para promover uma ruptura da continuidade axonal, desencadeando uma
degeneração Walleriana. O prognóstico de recuperação funcional é bom, desde que
seja mantida a continuidade dos tecidos conectivos de suporte e a integridade das
células satélites e da membrana basal.
Neurotmese – É o tipo mais grave de lesão nervosa periférica. Neste
caso, há uma ruptura completa do nervo periférico e o prognóstico de recuperação
não é favorável, a menos que a continuidade do nervo seja restabelecida.
Posteriormente, Sunderland (1951) propôs um sistema de classificação
mais detalhado, baseado na anatomia e funcionalidade pós-traumática do nervo,
dividindo-as em 5 graus. O grau I e II corresponde, respectivamente, à neuropraxia e
axonotmese definidas por Seddon. Os demais graus são denominados de acordo
com o acometimento dos envoltórios conjuntivos, onde o grau III representa uma
perda da continuidade axonal somada à lesão do endoneuro; o grau IV é
considerado uma lesão do axônio, do endoneuro e, também, do perineuro; e o grau
V caracteriza-se pela ruptura de todas as estruturas do nervo.
1.1.1. LESÃO NERVOSA PERIFÉRICA POR ESMAGAMENTO
As lesões nervosas periféricas podem ser obtidas por meio de vários
modelos experimentais, como o esmagamento, transecção, estiramento e
congelamento. A lesão por esmagamento constitui o modelo mais freqüente nos
estudos que envolvem a lesão nervosa periférica.
De Medinacelli, Freed, Wyatt (1982) e Bain et al. (1994) estabeleceram
que lesão nervosa produzida por esmagamento é uma modelo útil para se estudar a
regeneração nervosa periférica, uma vez que o esmagamento produz uma lesão do
tipo axonotmese, onde a preservação das estruturas de sustentação determinam
bom prognóstico para a regeneração e recuperação funcional do nervo.
A metodologia utilizada no modelo de lesão nervosa por esmagamento é
variável, sendo descrito o uso de um ou dois pinçamentos que podem variar de 15 a
60 segundos (BRIDGE et al. 1994) ou de 4 pinçamentos de 20 segundos de duração
16
e intervalo de 1 segundo entre eles (FERNANDES et al. 2005). Esta última
corresponde a uma das metodologias mais adotada, conforme visto nos trabalhos de
Oliveira et al. (2008), Caierão et al. (2008) e Sobral (2007).
Dahli e Rydevik (1991) demonstraram que a lesão do nervo por
esmagamento ocorre através da alteração do fluxo sanguíneo intraneural e da
permeabilidade vascular, que quando submetidas a forças de compressão dão início
a um processo degenerativo. As fibras de maior calibre são as mais atingidas e a
gravidade da lesão depende da intensidade da força aplicada.
Com o objetivo de quantificar e qualificar a lesão nervosa periférica por
esmagamento, Mazzer et al. (2008) avaliou as características morfológicas e
morfométricas do nervo ciático de ratos submetidos à lesão por esmagamento com
cargas controladas de 500, 1.000, 5.000, 10.000 e 15.000 gramas. Os autores
concluíram que todas as cargas produziram uma lesão do tipo axonotmese, em que
gravidade de lesão foi diretamente proporcional ao aumento da carga.
Quanto à recuperação funcional deste tipo de lesão, De Medinacelli,
Freed, Wyatt (1982), por meio da avaliação funcional da marcha, observaram que a
recuperação do nervo ciático esmagado de ratos ocorria entre o 16º e 20º dia após a
lesão. Semelhantemente, Luís et al. (2007) descrevem que o início da recuperação
funcional deu-se entre o 14º e 21º dia pós-lesão e o retorno dos valores da avaliação
funcional da marcha aos valores do período pré-lesão em torno do 42º dia após a
lesão.
1.1.2. PROCESSO DE DEGENERAÇÃO E REGENERAÇÃO NERVOSA
PERIFÉRICA
Nas lesões em que há perda da continuidade axonal, diversas
modificações celulares e moleculares se desenvolvem imediatamente após a lesão
com a finalidade de remover o segmento danificado, de promover a regeneração
axonal e assim, a recuperação do nervo (BURNNET E ZAGER, 2004).
No segmento distal à lesão, os axônios, desconectados dos seus
respectivos corpos celulares, juntamente com a bainha de mielina inicia um
17
processo de degradação denominado degeneração Walleriana. Os produtos dessa
degeneração são eliminados através de uma ação cooperativa das células de
Schwann (CS) e macrófagos (RODRÍGUEZ, VALERO-CABRÉ, NAVARRO, 2004).
A perda do contato axonal faz com que as CS dediferenciem e assumam
características fenotípicas de CS não-mielinizantes, indispensáveis para a
regeneração do nervo. As CS não-mielinizantes atuam neste processo através da
síntese de moléculas de adesão celular; elaboração de uma membrana basal que
contém várias proteínas da matriz extracelular, denominada banda de Bünger; e
produção de diversos fatores neurotróficos e seus receptores (FROSTICK, YIN,
KEMP, 1998; JESSEN, MIRSKY, 2008).
A banda de Bünger atua como um canal dentro do qual o crescimento
axonal é guiado e as moléculas de adesão celular juntamente com os fatores
neurotróficos são essenciais para o crescimento axonal no interior deste canal. As
primeiras promovem orientação e adesividade dos axônios e CS, enquanto os
fatores neurotróficos correspondem a agentes tróficos específicos que aumentam a
regeneração nervosa periférica (FU, GORDON, 1997; FROSTICK, YIN, KEMP,
1998).
Por outro lado, no coto proximal da lesão há o desenvolvimento do
processo de regeneração axonal. Cada axônio envia um grande número de brotos
que atravessam o local da lesão e continuam seu crescimento no interior das
bandas de Bügner. Terminalmente em cada broto axonal, há a formação de um cone
de crescimento, que tem a função de explorar o ambiente através de movimentos
constantes a fim de promover o direcionamento e acurácia da regeneração axonal
em direção aos órgãos-alvo (FAWCETT, KAEYNES, 1990; LUNDBORG, 2000).
O prognóstico da lesão nervosa periférica é variável e depende da
integridade da membrana basal. Quando existe lesão significativa desta estrutura,
que serve de arcabouço para o crescimento axonal em direção aos órgãos-alvo, os
axônios regenerados assumem um crescimento tortuoso e formam brotos
denominados de neuromas, cuja composição é dada por axônios imaturos e tecido
cicatricial que forma uma barreira à regeneração (FRIED et al., 1991).
18
No entanto, quando a membrana basal é preservada, a regeneração
nervosa ocorre de forma satisfatória (FAWCETT, KAEYNES, 1990). Neste caso,
cada axônio do coto proximal passa a produzir uma grande quantidade de brotos
que avançam distalmente em direção aos órgãos-alvo. Aqueles que formam uma
conexão com o órgão terminal sobrevivem, enquanto aqueles que não
estabeleceram nenhuma conexão desaparecem (BURNNET, ZAGER, 2004).
A reinervação do órgão-alvo só é restabelecida após a regeneração
completa do axônio e no caso dos axônios motores esta re-conexão com o músculo
ocorre no antigo local de ligação, as placas motoras (BRUSHART, 1988, 1993).
Porém, mesmo diante da habilidade regenerativa do sistema nervoso periférico, a
recuperação funcional após uma lesão é, em geral, insatisfatória devido a fatores
intrínsecos e extrínsecos ao sistema nervoso, como o tipo e nível de lesão, presença
de patologias associadas e alterações nos órgãos-alvo (GORDON, BOYD, 2003).
1.1.3. RESPOSTAS DO SISTEMA MUSCULAR À DESNERVAÇÃO
A alteração mais significativa do sistema muscular após a desnervação é
a atrofia, que afeta tanto as fibras rápidas quanto as fibras lentas, resultando da
diminuição do diâmetro da fibra e da força muscular (LIEBER, 2002).
A interrupção do suprimento nervoso promove a diminuição da atividade
muscular e desencadeia uma resposta adaptativa para remodelação do sarcômero.
Resposta esta, caracterizada pela degradação das proteínas musculares,
especialmente das proteínas contráteis, através da ativação do sistema proteolítico
formado pela atividade coordenada da enzima Calpaína e do complexo Ubiquitinina-
proteassoma (SULTAN, DITTRICH, PETTE, 2000; KOSTROMINOVA et al., 2005).
A Calpaína é ativada pelo aumento no influxo de cálcio nas células
musculares, decorrente da diminuição na atividade muscular, e promove o
rompimento dos filamentos intermediários e o comprometimento da arquitetura
miofibrilar, deixando-a vulnerável à posterior degradação. Uma vez vulneráveis, a
Ubiquitina estabelece uma ligação com as proteínas contráteis e sinaliza a chegada
do complexo proteassoma 26S, responsável pela degradação das proteínas
(FERREIRA et al., 2004).
19
Em contrapartida à proteólise muscular, observa-se a elevação na
expressão de genes específicos do músculo, que incluem o Fator D de diferenciação
miogênica (myoD) e miogenina dentre outros, que atuam no processo de
regeneração muscular. Porém, o processo de degradação é mais rápido que o
regenerativo, determinando a atrofia do músculo desnervado (KASTROMINOVA et
al., 2005; RUSSO et al., 2007). Além disso, há redução drástica no número das
células satélites por apoptose, que reduz ainda mais a capacidade regenerativa do
músculo desnervado (KUJAWA, BARANB, JANKOWSKA-STEIFERA, 2005).
Outra alteração morfológica encontrada no músculo desnervado é o
aumento da densidade do tecido conjuntivo (TC), que ocorre através da proliferação
e síntese de componentes da matriz extracelular (MEC), principalmente no
endomísio e perimísio. Essas modificações iniciam imediatamente após a
desnervação e persistem enquanto o músculo estiver desprovido de inervação (LU,
HUANG, CARLSON, 1997; CAIERÃO et al., 2008).
Caso a desnervação permaneça por um longo período de tempo o TC
substituirá os elementos contráteis do músculo, submetidos à proteólise, e esse
tecido atuará como barreira ao crescimento axonal e à difusão dos fatores de
crescimento, prejudicando a chegada do nervo ao músculo, além de inibir da
regeneração muscular após a reinervação (VIRTANEN et al. 1992; MINAMOTO,
2007).
Além destas alterações morfológicas, observam-se também modificações
na excitabilidade muscular. O músculo passa a responder somente a estímulos
diretos e não mais através da estimulação indireta do nervo, como ocorre nos
músculos inervados, e assim, a intensidade necessária para excitar o músculo e a
duração do pulso necessária para produzir a contração tornam-se maiores (RUSSO
et al., 2004).
Por fim, há o desenvolvimento de processos reversos àqueles durante o
desenvolvimento, como a proliferação extrajuncional dos receptores de acetilcolina
(RACh) e a re-expressão da molécula de adesão celular nervosa (neuronal cell
adhesion molecule – N-CAM). Em comum, estes eventos sinalizam a perda da
comunicação com nervo, bem como a receptividade da fibra muscular à inervação, e
20
assim, atuam como guia para o crescimento axonal (LIEBER, 2002; NELSON e
CURRIER, 2002).
1.1.4. AVALIAÇÃO FUNCIONAL DA MARCHA
A recuperação funcional após a lesão traumática do nervo é um dos
principais objetivos da intervenção terapêutica em pesquisa do nervo periférico.
Nesse sentido, e em situações experimentais, a avaliação funcional da marcha tem
se mostrado um método confiável e reprodutível (VAREJÃO et al., 2001).
Inicialmente, Gutmann e Gutmann (1942) demonstraram que a perda da
capacidade de espalhar os dedos da pata traseira durante a marcha de coelhos com
lesão do nervo fibular era um parâmetro confiável para avaliar o grau de lesão
nervosa.
Dessa forma, De Medinaceli, Freed, Wyatt (1982) desenvolveram um
método quantitativo seguro e reprodutível da condição funcional do nervo isquiático
de ratos para a avaliação do grau de lesão, denominado índice funcional do ciático
(IFC). Este método é baseado na medida de parâmetros pré-estabelecidos nas
impressões das patas traseiras, obtidas quando os animais caminhavam numa
passarela, construída especificamente para este fim.
A passarela consta de um corredor, medindo 42 cm de comprimento e 8,2
cm de largura, com uma caixa escura localizada em uma de suas extremidades
(figura 1). No método de De Medinaceli, Freed, Wyatt (1982), o registro das pegadas
era obtido a partir do posicionamento de um filme de raio X no corredor, por onde o
animal caminha com as patas impregnadas de solução reveladora deixando o
registro de suas pegadas.
21
Figura 1. Esquema da passarela de análise da marcha (Andraus, 2009)
A partir deste registro das pegadas, era realizada a análise dos seguintes
parâmetros: distância ao pé oposto (DPO), medida ortogonal entre os dedos mais
longos de ambas as patas; comprimento da pegada (CP), distância entre a
extremidade do terceiro dedo e o calcâneo; largura da pegada (LP): medida entre o
primeiro e o quinto dedo; e largura intermediária da pegada (LIP), distância entre o
segundo e quarto dedo, conforme ilustrado na figura 2 .
Figura 2. Representação esquemática dos parâmetros medidos para calcular o Índice Funcional do
Ciático (IFC). N: Normal; E: experimental (lesionada); LP: Largura da pegada (1º ao 5º dedo); LIP:
Largura intermediária da pegada (2° ao 4º dedo); CP: Comprimento da pegada (calcanhar ao 3°
dedo); e DPO: Distância ao pé oposto (Gigo-Benato, 2010).
22
Em seguida, estes valores eram aplicados em uma equação onde todas
as variáveis possuíam o mesmo peso. Posteriormente, Carlton e Goldberg (1986)
desenvolveram um estudo para a correção desta equação, com a retirada do
parâmetro DPO, e o desenvolvimento de novas equações para avaliação dos nervos
fibular e tibial.
Por fim, Bain, Mackinnon e Hunter (1989) elaboraram uma equação mais
confiável que as demais, onde as variáveis apresentam um peso diferente de acordo
com a variabilidade de cada uma, conforme segue abaixo. Os resultados obtidos
nesta equação expressam a perda funcional em porcentagem, onde o valor 0 (zero)
significa função normal ou ausência de disfunção e o valor -100 (cem) expressa a
perda total da função.
IFC = -38.3 x [(CPE – CPN)/ CPN] + 109.5 x [(LPE - LPN)/LPN] + 13.3 x [(
LIPE – LIPN)/LIPN] – 8.8
O uso do filme radiográfico para a obtenção das pegadas torna a
avaliação funcional trabalhosa e dispendiosa. Dessa forma, Lowdon, Seader e
Urbaniak (1988) descreveram um método alternativo, com a utilização de tiras de
papel tratadas em solução de azul de bromofenol. Mais recentemente, Johnston et
al, 1991 propôs um método mais simples e econômico que os anteriores, baseado
na utilização de papel de sulfite e tinta de impressão digital para a marcação das
patas.
1.2. ELETROESTIMULAÇÃO E SEUS EFEITOS
Como explanado no tópico 1.1.3, a atrofia e proliferação do tecido
conjuntivo são alterações comuns no músculo desnervado que, em conjunto,
comprometem a arquitetura miofibrilar e o retorno da atividade contrátil após a
reinervação muscular.
No que se refere à atrofia muscular, os estudos apontam resultados
divergentes sobre os efeitos da EE, provavelmente devido à diversidade de
protocolos terapêuticos adotados. Porém, dentre aqueles que adotaram um
23
protocolo compatível com a excitabilidade do músculo desnervado, os resultados
são favoráveis ao uso deste recurso em minimizar ou até mesmo impedir a atrofia
(KANAYA, TAJIMA, 1992; DOW et al., 2005, 2004; TOMORI et al., 2010). Para mais
informações acerca destes estudos, recomenda-se a leitura do artigo 1 de revisão
sistemática (Anexo A).
O mecanismo pelo qual a EE promove o trofismo em músculos
desnervados parece estar relacionado com a expressão de genes envolvidos nos
processo de degradação e regeneração das proteínas contráteis. Após a
desnervação, a expressão destes genes se eleva, porém a EE reduz a expressão
destes ao valor mais próximo do músculo inervado. Dessa forma, a EE conduz o
músculo desnervado a uma condição do músculo normal e inervado onde os
processos de degradação e regeneração estão em equilíbrio (KOSTROMINOVA et
al., 2005; RUSSO et al., 2007).
Em relação ao TC, Russo et al. (2008) relataram o aumento na expressão
das metaloproteinases da matriz (MMP), MMP-2, com o uso da EE. Estas moléculas
desempenham a atividade proteolítica sobre a matriz extracelular e assim,
promovem o remodelamento desta última. Fernandes et al. (2005), por meio de
análise morfométrica, concluíram que a EE minimizou a proliferação do TC de
músculo desnervado.
A EE exerce, também, efeitos sobre a regeneração axonal, contudo, estes
efeitos ainda são controversos. Mendonça et al. (2003) demonstraram que animais
submetidos à lesão nervosa e EE apresentaram melhor regeneração axonal e
recuperação funcional em relação àqueles não tratados. Resultado semelhante foi
descrito por Oliveira et al. (2008), em que a EE melhorou a regeneração axonal sem
contudo, favorecer a melhora na funcionalidade do músculo desnervado.
Por outro lado, alguns autores apontam o efeito prejudicial da EE sobre a
reinervação dos músculos desnervados e conseqüentemente, sobre a recuperação
funcional. Baptista et al. (2008) relatam que a EE promove o retardamento na
regeneração do nervo, além disso, Love, Son e Thompson et al. (2003) e Tam et al.
(2001) descreveram o atraso na reinervação do músculo desnervado submetidos à
EE.
24
Segundo estes últimos autores, a atividade promovida pela EE inibiria a
oferta da N-CAM, molécula responsável pela orientação do crescimento axonal nas
fibras musculares. Hipótese esta, posteriormente, confirmada por Kostrominova et al.
(2005), ao relatar a redução na expressão da molécula de N-CAM em decorrência
ao uso da EE.
Parte destes estudos possui um delineamento metodológico distante
daquele realizado na prática clínica, principalmente dentre os que citam o efeito
deletério da EE. No geral, os protocolos envolvem o uso crônico da EE, acima de 8
horas/dia e aplicação invasiva com eletrodos internos (TAM et al., 2001; LOVE,
SON, THOMPSON et al., 2003; DOW et al., 2004, 2005), diferentemente do
protocolo realizado na prática clínica, que se caracteriza pela EE não invasiva
através de eletrodos transcutâneos e duração média de 20 a 30 minutos.
Assim, diante da carência de estudos propostos a avaliar a influência de
um protocolo de EE não invasivo e em molde mais próximo daqueles utilizados na
prática clínica, faz-se necessário a realização de trabalhos com objetivo de
esclarecer o efeito desta forma de emprego da EE no tratamento da lesão nervosa
periférica.
1.3. OBJETIVOS
1.3.1 GERAL
Analisar a influência do protocolo de EE não invasivo e duração fásica (30
minutos) sobre a regeneração nervosa em um modelo de lesão por esmagamento
do nervo isquiático de ratos.
1.3.2 ESPECÍFICOS
Verificar o efeito da EE:
Nas características morfométricas do nervo isquiático
(densidade dos axônios, diâmetro dos axônios, diâmetro da fibra, espessura
da bainha de mielina e razão G);
Na recuperação funcional do nervo isquiático (Índice funcional
do ciático – IFC).
25
CAPÍTULO 2 – MATERIAIS E MÉTODOS
2.1 ASPECTOS ÉTICOS
Este estudo foi aprovado pelo Comitê de Ética em Experimentação
Animal do Centro de Ciências Biológicas da Universidade Federal de Pernambuco,
sob ofício nº 268/2010 (Anexo C).
2.2 ANIMAIS
Foram utilizados 15 ratos albinos da linhagem Wistar (Rattus Norvegicus),
machos, com idade aproximada de 9 semanas e peso inicial médio de 279 32g,
provenientes do laboratório de criação do Departamento de Nutrição. Os animais
foram mantidos em ambiente climatizado e ventilado, em gaiolas plásticas coletivas
(máximo de três animais/gaiola) com livre acesso a dieta (Labina - Purina PetCare
Company) e água ad libitum.
2.3 GRUPOS EXPERIMENTAIS
Os animais foram alocados aleatoriamente em 3 grupos (n=5):
Grupo I – Controle (GC), animais submetidos à exposição do nervo, sem
lesão.
Grupo II – Desnervado (GD), animais submetidos à lesão nervosa por
esmagamento e sem intervenção terapêutica.
Grupo III – Desnervado associado à EE (GDE), animais submetidos à
lesão nervosa por esmagamento e tratados com protocolo não invasivo de EE.
2.4 PROCEDIMENTO CIRÚRGICO
O procedimento cirúrgico foi realizado com a finalidade de produzir
uma lesão nervosa por esmagamento do nervo ciático nos grupos II e III. Os animais
do grupo I também foram submetidos ao mesmo procedimento cirúrgico, porém com
o objetivo de expor o nervo ciático, sem lesioná-lo.
26
2.4.1 ANESTESIA
Os animais foram anestesiados com uma mistura de Ketamina (5%) e
Xilazina (2%) na proporção de 1:1, em doses de 0,1mL para cada 100g de peso
corporal do animal (MASSONE, 2003), injetado por via intramuscular, glúteo do
membro posterior esquerdo (MPE).
2.4.2 PROCEDIMENTO PRÉ-CIRÚRGICO
Uma vez anestesiados, realizou-se a tricotomia da região glútea e da
face lateral da coxa do membro posterior direito (MPD). Em seguida, o animal foi
posicionado em decúbito ventral e anti-sepsia na região operatória foi realizada com
uma gaze estéril umedecida em Polivinilpirrolidona (PVP) a 10%.
2.4.3 TÉCNICA CIRÚRGICA
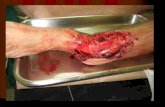
Uma incisão de cerca de 3 cm de comprimento foi realizada na face
lateral da coxa direita (figura 3A), indo do trocanter maior do fêmur até um pouco
abaixo do joelho, e o plano muscular foi divulsionado até a exposição e visualização
da bifurcação do nervo ciático (figura 3B). Uma vez identificado e isolado, a lesão do
nervo era realizada a 5 mm acima da bifurcação, mensurado com auxílio de um
paquímetro digital (Mitutoyo Absolute, série 500) (figura 3C).
A lesão foi conduzida segundo o procedimento proposto por Fernandes et
al (2005). Para tal, utilizou-se uma pinça hemostática mosquito reta de 12 cm
(Quinelato), com as extremidades envoltas por esparadrapo (Cremer®) para evitar a
lesão do epineuro. O esmagamento foi realizado por meio de 4 pinçamentos com 20
segundos de duração, cada, e intervalo entre os mesmos de 1 segundo (figura 3D).
A pressão gerada pela pinça foi padronizada pelo fechamento da mesma no 2º
dente da cremalheira e todas as lesões foram exercidas pelo mesmo avaliador a fim
de se evitar variações no procedimento.
Por fim, a ferida cirúrgica foi lavada com soro fisiológico e o plano
muscular e cutâneo suturados com fio de nylon 4-0 e 3-0, respectivamente. A ferida
27
foi lavada com solução anti-séptica de PVP a 10% e o animal foi devolvido à gaiola
de origem. A figura 4 mostra o aspecto macroscópico do nervo imediatamente após
a lesão.
Figura 3. A. Incisão na face lateral da coxa direita; B. Visualização da bifurcação do nervo
isquiático; C. Marcação do local da lesão, 5mm acima da bifurcação; D. Lesão por esmagamento.
Figura 4. Aspecto macroscópico do nervo isquiático imediatamente após a lesão.
28
2.5 PROTOCOLO DE ELETROESTIMULAÇÃO
O protocolo de EE do músculo sóleo foi baseado nas características
daqueles utilizados na prática clínica de fisioterapia, em que a aplicação da corrente
se dá de forma não invasiva e com duração média de 30 minutos/sessão.
Além disso, levando em consideração a necessidade de pulsos elétricos
adequados à mudança de excitabilidade do músculo desnervado (Artigo A – Revisão
sistemática), o protocolo de EE foi baseado, também, na cronaxia. Para isto,
realizou-se semanalmente a avaliação da excitabilidade muscular, dada pelos
valores da reobase e cronaxia.
A reobase corresponde ao estímulo de menor intensidade capaz de
promover a contração muscular visualmente perceptível e a cronaxia representa o
valor mínimo da duração do pulso necessário para desencadear uma contração
visível com intensidade igual ao dobro da reobase.
A avaliação da excitabilidade seguiu o modelo proposto por Nelson e
Currier (2003) e ocorreu da seguinte maneira: primeiramente, foi estabelecido o
valor da reobase com o uso de uma corrente galvânica e na seqüência, com a
intensidade igual ao dobro deste valor, avaliou-se a cronaxia do músculo sóleo em 4
quatro larguras de pulso: corrente farádica (<1ms), corrente exponencial de 100, 200
e 500ms.
Dessa maneira, o protocolo de EE foi aplicado com os seguintes
parâmetros: 1 Hz de freqüência, largura de pulso determinado pela avaliação da
cronaxia e intensidade padronizada a partir da visualização da contração do
músculo. O protocolo teve início 24 horas após a lesão e prosseguiu por 6 semanas,
através de uma sessão diária de 30 minutos e com freqüência de 5 veses/semana.
A aplicação da corrente foi dada pelo uso do eletroestimulador (Bio-
System EMC-01) e aplicada por meio de 2 eletrodos de superfície (1,5 cm²) untados
com gel eletrocondutor e posicionados uma na região inguinal e outro sobre o
músculo sóleo direito (figura 5). A relação tempo ON/OFF foi igual a 1:4 segundos,
totalizando 360 abalos musculares a cada sessão de EE. Para realização dos
procedimentos de avaliação e aplicação da corrente, os animais eram anestesiados
conforme descrito no iten 2.4.1. Anestesia.
29
Tendo em vista as características de excitabilidade do músculo
desnervado, sabe-se que o mesmo perde a capacidade de responder a pulsos de
curta duração, menor que 10ms, e que apresentam pouca ou nenhuma
acomodação, que o torna capaz de responder a um estímulo que aumente a sua
amplitude de forma lenta, como é o caso da corrente exponencial. Dessa maneira,
os animais que respondessem à corrente farádica na 1ª semana pós-lesão foram
excluídos.
Figura 5. Posicionamento dos eletrodos de superfície (1,5 cm2): um na região inguinal e outro
sobre o músculo sóleo direito.
2.6 ANÁLISE FUNCIONAL DA MARCHA
O Índice Funcional do Ciático (IFC) foi avaliado através da análise
funcional da marcha, conforme proposto por De Medinacelli et al. (1982). Para isto,
utilizou-se uma passarela de 8,2x42cm com um abrigo escuro na extremidade, onde
os animais foram postos para caminhar.
Após o treino inicial para o reconhecimento do ambiente, os animais
foram postos para caminhar na passarela revestida com papel sulfite, com as patas
posteriores dos animais marcadas com tinta de carbono, para realizar o registro das
impressões plantares das patas normal e experimental, segundo o método proposto
30
por Johnston et al., 1991 (figura 1). O registro das impressões foi obtido no período
pré-operatório, 7º, 14º, 21º e 28º, 35º e 42º dias do pós-operatório.
Em seguida, foram obtidos os valores dos seguintes parâmetros,
ilustrados na figura 2: Comprimento da pegada (CP): entre a extremidade do terceiro
dedo e o calcâneo; Largura da pegada (LP): entre o primeiro e o quinto dedo; e
Largura intermediária da pegada (LIP): entre o segundo e quarto dedo.
As medidas foram calculadas tanto na pata normal, quanto na pata
experimental, por meio do software ImageJ 1.44 (disponível em:
http://rsb.info.nih.gov/ij/) e os valores foram aplicados na equação proposta por Brain
(1989), onde o IFC = -38.3 x [(CPE – CPN)/ CPN] + 109.5 x [(LPE - LPN)/LPN] +
13.3 x [( LIPE – LIPN)/LIPN] – 8.8 (Varejão et al., 2001).
Os resultados obtidos pela equação expressam a perda funcional em
termos percentuais, sendo que o valor 0 (zero) representa função normal ou
ausência de disfunção e o valor -100 (menos cem) representa a perda total da
função nervosa. Portanto, quanto mais próximo de 0, melhor a função do nervo.
2.7 COLETA E PROCESSAMENTO DO NERVO
No 43º dia pós-operatório, os animais foram anestesiados (mesmo
procedimento do item 2.4.1. Anestesia) e uma nova incisão na face lateral da coxa
direita foi realizada para a visualização e exposição do nervo. Uma vez localizado, o
nervo foi fixado in situ com paraformaldeído a 4% em tampão fosfato-salino
(Phosphate buffered saline - PBS) por 5 minutos.
Em seguida, a cerca de 3 mm distal ao local da lesão (ou do local
equivalente ao da lesão no nervo íntegro), um segmento de 5mm de comprimento foi
dissecado e fixado em paraformaldeído a 4% (x) em PBS por 4 horas, depois lavado
e estocado em 0.2g de glicina em 100mL de PBS até o dia da pós-fixação com o
tetróxido de ósmio.
No dia da inclusão do material na parafina, os nervos foram lavados em
PBS por alguns minutos e em seguida, imersos por 2 horas em tetróxido de ósmio a
1% em solução de PBS. Em seguida, os nervos foram desidratados em soluções
crescentes de álcool (30, 50, 70, 90 e 100%), submetidos à diafanização em xilol por
20 minutos e incorporados na parafina por 20 minutos na estufa a 60ºC.
31
Uma vez obtidos os blocos, realizou-se cortes transversais de 5µm na
porção distal do nervo através do micrótomo, em seguida, os cortes foram
transferidos para lâminas de vidro, contendo uma gota de albumina, e secados na
estufa a 60ºC por 20 minutos. Anteriormente ao procedimento de coloração, os
cortes foram submersos em xilol por 5 minutos e em uma série decrescente de
álcool etílico (100 – 70%).
A coloração de tricômio de Masson (TM) foi realizada e, na seqüência, os
cortes foram novamente desidratados em soluções crescentes de álcool etílico (70 –
100%) e imersos em xilol. Por fim, realizou-se a montagem das lâminas com
aplicação das lamínulas.
O processamento do nervo, descrito acima, foi realizado de forma
análoga àquele descrito por Di Scipio et al. (2008) e todos os procedimentos foram
realizados no Laboratório de Imunopatologia Keizo Asami – LIKA e no laboratório do
Departamento de Pós-graduação em Patologia, ambos na UFPE.
2.8 EUTANÁSIA DOS ANIMAIS
Após a coleta do nervo isquiático para análise, os animais foram
submetidos à eutanásia através de uma injeção intracardíaca de cloreto de potássio
(KCl) a 10%.
2.9 ANÁLISE MORFOMÉTRICA
Sabe-se que as fibras nervosas possuem uma distribuição heterogênea
ao longo de um corte transversal do nervo. Em diferentes áreas do nervo, as fibras
podem ser vistas em maior ou menor densidade, além disso, o tamanho do diâmetro
das fibras pode ser muito diferente de uma área para outra no mesmo fascículo
nervoso (Figura 6).
Portanto, a seleção dos campos histológicos, de onde são retiradas as
imagens das amostras, pode influenciar fortemente as estimativas finais da análise
morfométrica. Assim, a seleção dos campos histológicos deverá respeitar a regra de
igualdade de oportunidades para os diferentes perfis de fibras, a fim de evitar uma
estimativa tendenciosa.
32
Dessa forma, a seleção dos campos histológicos ocorreu de maneira
aleatória, contemplando igualmente a área periférica e central, com o objetivo de
oferecer oportunidades iguais para os diferentes perfis de fibras nervosas e sua
heterogênea distribuição ao longo nervo.
Os cortes transversais do segmento distal do nervo foram observados no
microscópio de luz (Leitz Wetzlar) sob uma magnificação de 1.000 X. As imagens do
nervo foram digitalizadas com o auxílio de uma câmera (Celestron, modelo 44420),
acoplado a um microcomputador equipado com uma interface digitalizadora de
imagens.
Figura 6. Desenho esquemático do corte transversal do nervo, demonstrando a distribuição
heterogênea tanto da localização, quanto o tamanho do diâmetro das fibras no mesmo feixe nervoso
(Geuna et al., 1999).
Primeiramente, a superfície superior esquerda do endoneuro era
identificada e a partir deste local foi realizada a seleção e digitalização aleatória de
16 campos (retângulos de 0,09 mm2) por nervo. Foram obtidos 4 campos em cada
linha, no total de 4 linhas (Figura 7).
33
Figura 7. Desenho esquemático do corte transversal do nervo, demonstrando a seleção
aleatória dos campos do nervo (Geuna et al., 1999).
Os campos digitalizados foram transferidas para o software ImageJ 1.44
para a subseqüente análise. Com auxílio de uma grade, foi estabelecido um novo
campo medindo 0,04 mm2 sobre o campo digitalizado com o objetivo de selecionar
as amostras. As fibras localizadas no interior do campo e aquelas que tocassem a
borda superior e esquerda do mesmo foram incluídas para a análise morfométrica
(GEUNA et al. 1999, 2004).
Em cada feixe nervo, avaliou-se o número de fibras mielínicas, o diâmetro
da fibra e o diâmetro do axônio. A partir destes dados foi calculada a densidade
média de fibras, diâmetro médio das fibras, diâmetro médio dos axônios, espessura
média da bainha de mielina e razão G.
A densidade média de fibras foi calculada dividindo-se o número de fibras
pela área analisada. O diâmetro médio dos axônios e das fibras de cada animal foi
obtido a partir da somatória dos diâmetros dos axônios divido pelo número de
axônios e da somatória dos diâmetros das fibras dividido pelo número de fibras
mensuradas, respectivamente.
A espessura da bainha de mielina foi adquirida a partir da subtração do
diâmetro da fibra pelo diâmetro do axônio, dividido por dois. A espessura média da
bainha de mielina foi estabelecida pela somatória das espessuras das bainhas de
mielina pelo número de fibras nervosas analisadas. Por fim, o valor da razão G,
34
relacionado com a velocidade de impulso nervoso, foi calculado a partir da divisão
do diâmetro do axônio pelo diâmetro da fibra nervosa (OLIVEIRA et al., 2008).
2.10 ANÁLISE ESTATÍSTICA
Aplicou-se o teste Kolmogorov-Smirnov para avaliar a normalidade das
variáveis, sendo encontrada uma distribuição não-normal para todas elas. Dessa
maneira, os testes não-paramétricos foram escolhidos para a análise estatística dos
dados.
O teste de Kruskal Wallis foi utilizado para comparar as variáveis
morfométricas e IFC intergrupos. No caso de diferença entre os grupos, aplicou-se o
teste de Mann-Whitney para verificar onde a diferença estava. Para análise
intragrupo do valor do IFC pré-operatório com os demais dias pós-operatórios, foi
usado o teste de Wilcoxon. O nível de significância adotado para todas as análises
foi o de p < 0,05. No texto e tabelas, os valores das variáveis estão expressos em
média ± desvio padrão (DP).
35
CAPÍTULO 3. REFERÊNCIAS
ANDRAUS, Rodrigo Antônio Carvalho. Os efeitos da irradiação com laser de baixa potência na regeneração do nervo fibular comum do rato submetido a lesão por esmagamento. 2009. 86f. Dissertação (Mestrado em Ciência Médicas) – Faculdade de Medicina de Ribeirão Preto, Universidade de São Paulo, São Paulo, 2009 AYDIN, M.A. et al. Force deficits in skeletal muscle after delayed reinnervation. Plastic and Reconstructive surgery, v. 113, n. 6, p. 1712-18, Maio. 2004. (Mackinnon SE, Gu XM, Kobayashi J, Kuzon WM.) BAIN, J.R.; MACKINNON, S.E.; HUNTER, R.T. Functional evaluation of complete sciatic, peroneal e posterior tibial nerve lesions in the rat. Plastic and Reconst. Surgery, v. 83, p. 129-138. 1989. BAPTISTA, A. F. et al. High- and low-frequency transcutaneous electrical nerve stimulation delay sciatic nerve regeneration after crush lesion in the mouse. Journal of the peripheral nervous system, v. 13, p. 71-80. 2008. BATTISTON, B. et al. Tissue Engineering of Peripheral Nerves. International Review of Neurobiology, v.87, p. 227-49. 2009. BRUSHART, T.M. Preferential reinnervation of motor nerves by regenerating motor axons. Journal Neuroscience, v. 8, p.1026-1031. 1988. BRUSHART, T.M. Motor axons preferentially reinnervate motor pathways. Journal Neuroscience, v. 13, p. 2730-2738. 1993. BURNETT, M.G.; ZAGER, E.L. Pathophsiology of peripheral nerve injury: a brief review. Neurosurgical Focus, v. 16, n. 5, p. 1-7. 2004. CAIERÃO, Q.M. et al. O efeito do intervalo da estimulação elétrica no músculo desnervado de rato. Revista Brasileira de Fisioterapia, v. 12, n. 2, p. 143-8. 2008. CANCELIERI, Andréia S. Estudo histoquímico, bioquímico e morfométrico do músculo extensor longo dos dedos de ratos denervado e eletroestimulado. 2005. 73f. Dissertação (Mestrado em Fisioterapia) – Faculdade de Ciências da Saúde, Universidade Metodista de Piracicaba, São Paulo, 2005.
36
CARLTON, J.M.; GOLDBERG, N.H. Quantitating integrated muscle function following reinervation. Surgical Forum, v. 37, p. 611-612. 1986. COSTA, L.M. et al. Chapter 7: Methods and protocols in peripheral nerve regeneration experimental research: part IV-kinematic gait analysis to quantify peripheral nerve regeneration in the rat. International Review of Neurobiology, v. 87, p. 127-39. 2009. (SIMÕES MJ, MAURÍCIO AC, VAREJÃO ASP) DAHLIN, L.B. The biology of nerve injury and repair. Journal of the American Society for Surgery of the Hand, v.4, p.143-155. 2004. DAHLIN, L.B.; RYDEVIK, B. Pathophysiology of nerve compression. In: Gelberman, R.H. Operative nerve repair and reconstruction. Philadelphia. JB Lippincott Company. v.2, p. 847-862. 1991. DE MEDINACELLI, L.; FREED, W.J.; WYATT, R.J. An index of the functional condition of rat sciatic nerve based on measurements made from walking tracks. Experimental Neurology, v. 77, n. 3, p. 634-43. 1982. DI SCIPIO et al. A simple protocol for paraffin-embedded myelin sheath staining with osmium tetroxide for light microscope observation. Microscopy Research and Technique, v. 71, p. 497-502. 2008. DOW, D.E.; FAULKER, J.A.; DENNIS, R.G. Artificial Organs. Distribution of rest periods between electrically generated contractions in denervated muscles of rats. Artificial Organs, v. 29, n. 6, p. 432-435. 2005. DOW, D.E. et al. Number of contractions to maintain mass and force of a denervated rat muscles. Muscle & Nerve, v. 30, p. 77-86. 2004. ENDO C. Estudo dos efeitos do tratamento com laser num modelo experimental de lesão nervosa por esmagamento do nervo ciático em ratos. 2002. 70f. Dissertação (Mestrado em Bioengenharia) – Faculdade de Medicina de Ribeirão Preto, Universidade de São Paulo, São Paulo, 2002. FAWCETT, J.W.; KEYNES, R.J. Peripheral nerve regeneration. Annual Review of Neuroscience, v. 13, p. 43-0. 1990.
37
FERNANDES K.C.B.G. et al. Análise morfométrica dos tecidos musculares e conjuntivo após desnervação e estimulação elétrica de baixa freqüência. Revista Brasileira de Fisioterapia, v. 9, n. 2, p. 235-241. 2005. FERREIRA, R. Atrofia muscular esquelética. Modelos experimentais, manifestações teciduais e fisiopatologia. Revista Portuguesa de Ciências do Desporto, v. 4, n. 3, p. 94-111. 2004. FRIED, K. et al. Ultrastructure of afferent axon endings in neuroma. Journal of Neurocytology, v. 20, p. 682-701. 1991. FROSTICK, S.P.; YIN, Q.; KEMP, G.J. Schwann cells, neurotrophic factors and peripheral nerve regeneration. Microsurgery. v. 18, p. 397-405. 1998. FU S.Y.; GORDON, T. The cellular and molecular basis of peripheral nerve regeneration. Molecular Neurobiology, v. 14, p. 67–116. 1997. GEUNA, S. et al. Verification of the two-dimensional disector, a method for the unbiased estimation of density and number of myelinated nerve fibers in peripheral nerves. Annals of Anatomy, v. 181, p. 23-4.1999. GEUNA, S.; GIGO-BENATO, D.; RODRIGUES, A.C. On sampling and sampling errors in histomorphometry of peripheral nerves fibers. Microsurgery, v. 24, n.1, p. 72-6. 2004. GORDON, T.; BOYD, S.O. Experimental strategies to promote functional recover after peripheral nerve injuries. Journal of the Peripheral Nervous System, v. 8, p. 236-250. 2003. GORDON, T.; SULAIMAN, O.A.R.; LADAK, A. Chapter 24: Electrical stimulation for improving nerve regeneration: where do we stand? International Review of Neurobiology, v. 87, p. 433-44. 2009. GUTMANN, E.; GUTMANN, L. Factors affecting recovery of sensory function after nerve lesions. Journal of Neurology and Phychiatry, v. 5, p. 117-129. 1942. JESSEN, K.R.; MIRSKY, R. Negative Regulation of Myelination: Relevance for Development, Injury, and Demyelinating Disease. Glia, v. 56, p. 1552-1565. 2008.
38
JOHNSTON, R.B. et al. Improved imaging of rat hind foot prints for walking track analysis. Journal of Neuroscience Methods, v. 38, p. 111-4. 1991. KANAYA, F.; TAJIMA, T. Effect of electrostimulation on denervated muscle. Clinical Orthopaedics and Related Research. v. 283, p. 296-301. 1992. KOSTROMINOVA, T.Y. Comparison of gene expression of 2-mo denervated, 2-mo stimulated-denervated, and control rat skeletal muscles. Physiological Genomics, v. 22, p. 227–243. 2005. KUJAWA, M.; BARANB, W.; JANKOWSKA-STEIFERA, E. Quantitative ultrastructural changes in satellite cells of rats immobilized after soleus muscle denervation. Experimental and Molecular Pathology. v. 78, p. 78-85. 2005. LIEBER, R.L. Skeletal muscle structure, function & plasticity: the physiological basis of rehabilitation. 2ª edição: Lippincott Wlliams & Wilkins, 2002. LOVE, F.M.; SON, Y.; THOMPSON, W.J. Activity alters muscle reinnervation and terminal sprouting by reducing the number of Schwann cell pathways that grow to link synaptic sites. Journal of Neurobiology, v. 54, n. 4, p. 566-576. 2003. LOWDON, I.M.R.; SEABER, V.; URBANIAK, J.R. An improved method of recording rat tracks for measurement of the sciatic functional index of De Medinaceli. Journal of Neuroscience Methods., v. 24, p. 279-281. 1988. LU, D. X.; HUANG, S. K.; CARLSON, B. M. Electron microscopy of long-term denervated rat skeletal muscle. The Anatomical Record. 248: 355, 1997. LUIS, A.L. et al. Long-term functional and morphological assessment of a standardized rat sciatic crush nerve injury with a non-serrated clamp. Journal of Neuroscience Methods, v.163, p. 92-104. 2007. LUNDBORG, G. A 25-year perspective of peripheral nerve surgery: evolving neuroscientific concepts and clinical significance. Journal of Hand Surgery, v. 25A, n. 3, p. 391-414. 2000. MAGNAGHI, V.; PROCACCI, P.; TATA, A.M. Chapter 15: Novel pharmacological approaches to Schwann cells as neuroprotective agents for peripheral nerve regeneration. International Review of Neurobiology, v. 87, p. 295-315. 2009.
39
MASSONE, F. Anestesiologia veterinária: farmacologia e técnicas. 4ª Ed. Guanabara Koogan, 2003.
MAZZER, P.Y.C.N. et al. Morphologic and morphometric evaluation of experimental acute crush injuries of the sciatic nerve of rats. Journal of Neuroscience Methods, v. 173, p. 249–258. 2008. MENDONÇA, A.C.; BARBIERI, C.H.; MAZZER, N. Directly applied low intensity direct electric current enhances peripheral nerve regeneration in rats. Journal of Neuroscience Methods, v. 129, p. 183-/190. 2003. MINAMOTO, V.B. Efeitos da desnervação no músculo esquelético: uma revisão. Fisioterapia em Movimento, v. 20, n. 3, p. 63-69. 2007. MONTE-RASO, V.V. et al. Os efeitos do ultra-som terapêutico nas lesões por esmagamento do nervo ciático de ratos: análise funcional da marcha. Revista Brasileira de Fisioterapia, v. 10, n. 1, p. 113-119. 2006. NAVARRO, X.; VIVÓ, M.; VALERO-CABRÉ, A. Neural plasticity after peripheral nerve injury and regeneration. Progress in Neurobiology, v. 82, p.163-201. 2007 NAVARRO, X.; UDINA, E. Chapter 6: Methods and protocols in peripheral nerve regeneration experimental research: part III-electrophysiological evaluation. International Review of Neurobiology, v. 87, p. 105-26. 2009. NELSON. R.M.; CURRIER, D.P. Eletroterapia clínica. 3ª edição: Editora Manole, 2003. OLIVEIRA, L.S. et al. Electrical stimulation and swimming in the acute phase of axonotmesis: Their influence on nerve regeneration and functional recovery. Revista de Neurologia, v. 47, n. 1, p. 11-15. 2008. RIET-CORREA, G.R. et al. Ethidium bromide-induced demyelination of the sciatic nerve of adults Wistar rats. Brazilian Journal of Medical and Biological Research, v. 35, n. 1, p. 99-104. 2002. RODRÍGUEZ, F.J.; VALERO-CABRÉ, A.; NAVARRO, X. Regeneration and functional recovery following peripheral nerve injury. Drug Discovery Today: Disease Models, v. 1, n. 2, p.177-85. 2004.
40
RUSSO, T. L. et al. Alterações na cronaxia, da reobase e da acomodação no músculo esquelético desnervado submetido à eletroestimulação. Revista brasileira de Fisioterapia. v. 8, n. 2, p. 169-175 .2004. RUSSO, T.L. et al. Electrical stimulation based on chronaxie reduces atrogin-1 and myoD gene expressions in denervated rat muscle. Muscle & Nerve, v. 35, p. 87-97. 2007. RUSSO, T.L. et al. Electrical stimulation increases matrix metalloproteinase-2 gene expression but does not change its activity in devervated rat muscle. Muscle & Nerve, v. 37, p. 593-600. 2008. SEDDON, H.J. Three types of nerve injury. Brain, v.66, p.237-288. 1943. SIEMIONOW, M.; BRZEZICKI, G. Chapter 8: Current techniques and concepts in peripheral nerve repair. International Review of Neurobiology, v. 87, p.141-72. 2009. SOBRAL, Luciane Lobato. Exercício imediato versus tardio na regeneração do nervo isquiático de ratos após axoniotmese: análise morfométrica e funcional. 2007. 94f. Dissertação (Mestrado em Fisioterapia) – Faculdade de Ciências da Saúde - Universidade Metodista de Piracicaba, São Paulo, 2007. SULTAN, K.R.; DITTRICH, B.T.; PETTE, D. Calpain activity in fast, slow, transforming, and regenerating skeletal muscles of rat. American Journal of Physiology – Cell Physiology, v. 279, p. C639-C647. 2000. SUNDERLAND, S. A classification of peripheral nerve injuries producing loss of fuction. Brain, v. 74, p. 491-516. 1951. TAM, S.L. et al. Increased neuromuscular activity reduces sprouting in partially denervated muscles. The Journal of Neurosience, v. 21, n. 2, p. 654-667. 2001.
TERENGHI, G.; WIBERG, M.; KINGHAM, P.J. Chapter 21: Use of stem cells for improving nerve regeneration. International Review of Neurobiology, v.87, p. 393-403. 2009. TOMORI, K. et al. Low-intensity electrical stimulation ameliorates disruption of transverse tubules and neuromuscular junctional architecture in denervated rat
41
skeletal muscle fibers. Journal of Muscle Research and Cell Motily, v. 31, p. 195-205. 2010. VAREJÃO, A.S.P. et al. Functional evaluation of peripheral nerve regeneration in the rat: walking track analysis. Journal of Neuroscience Methods, v. 108, p. 1-9. 2001. VIRTANEN, P. et al. Effect of reinnervation on collagen synthesis in rat skeletal muscle. Journal of Applied Physiology, v.72, n. 6, p. 2069-2074. 1992.
42
CAPÍTULO 4. ARTIGO ORIGINAL
EFEITOS DA ELETROESTIMULAÇÃO NA RECUPERAÇÃO
MORFOFUNCIONAL DE RATOS SUBMETIDOS À LESÃO DO NERVO ISQUIÁTICO
EMANUELA CAVALCANTE 1, EDUARDO MONTENEGRO
2, NICODEMOS
TELES 3.
1. Programa de Pós-Graduação em Fisioterapia, Universidade Federal de Pernambuco,
Recife/PE, Brasil.
2. Departamento de Fisioterapia Universidade Federal de Pernambuco, Recife/PE, Brasil.
3. Programa de Pós-Graduação em Fisioterapia, Universidade Federal de Pernambuco,
Recife/PE, Brasil
Departamento de Patologia, Universidade Federal de Pernambuco, Recife/PE, Brasil.
Endereço para correspondência:
Rua Dr Vicente Meira, n 180, Apt. 1002, Espinheiro, Recife-PE, CEP: 52.020-130
E-mail: [email protected]
Palavras-chave: Sistema Nervoso Periférico; Denevação; Estimulação Elétrica.
43
RESUMO
A influência da eletroestimulação (EE) no tratamento da lesão nervosa periférica ainda
é controversa. Objetivo: avaliar os efeitos da eletroestimulação (EE) sobre a regeneração
nervosa e recuperação funcional de ratos submetidos à lesão do nervo isquiático. Métodos:
quinze ratos wistar foram distribuídos em três grupos (n=5): controle (GC), desnervado (GD)
e desnervado com eletroestimulação (GD+E). O protocolo de EE consistiu em uma sessão
diária de 30 minutos, por 42 dias. Os parâmetros da EE utilizados foram: corrente exponencial
com freqüência de 1Hz, largura de pulso de 100ms e intensidade padronizada a partir da
visualização da contração do músculo. A avaliação funcional foi dada pelo índice de
funcionalidade do ciático (IFC) realizada no pré-operatório e 7º, 14º, 21º, 28º, 35º e 42º dias
pós-operatório e a regeneração axonal foi verificada por meio da análise morfométrica do
nervo. Resultados: O IFC do GD e GDE atingiu o valor pré-operatório, respectivamente, no
42º e 35º dia pós-operatório. Os grupos desnervados apresentaram maior densidade de fibras
(p<0,05) e menor diâmetro médio da fibra e do axônio (p<0,05), quando comparados ao GC.
A espessura média da bainha de mielina do GD foi menor em relação ao GC (p<0,05) e não
diferiu entre o GDE e GC. A razão G não variou entre os grupos. Conclusão: Os resultados
deste estudo demonstram uma recuperação funcional antecipada no grupo submetido à EE e
assim, indica o efeito benéfico da EE tratamento da lesão nervosa periférica.
44
THE EFFECTS OF ELECTRICAL STIMULATION ON MORPHOFUNCTIONAL
RECOVERY OF RATS SUBJECTED TO SCIATIC NERVE LESION
ABSTRACT
The influence of electrical stimulation (ES) in peripheral nervous lesion treatment is
controversial, yet. Objective: to evaluate the effects of electrical stimulation (ES) on nervous
regeneration and functional recovery of rats underwent a sciatic nerve lesion. Methods:
fithteen Wistar rats were distributed into three groups (n=5): control (CG); denervated (DG)
and denervated with ES (DEG). The EE protocols were formed by one session per day of 30
minutes, for 42 days. The protocol parameters were: exponential current, 1 Hz of frequency,
100ms of phase duration and intensity enough to produce a visible muscle contraction. The
functional evaluation was performed by the sciatic functional index (SFI) at the preoperative
day, 7th
, 14th
, 21th
, 28th
, 35th
and 42th
postoperative day and the axonal regeneration was check
by nerve morphometric analysis. Results: The DG and DEG SFI´s reached the preoperative
value at, respectively, 42th
and 35th
postoperative day. The denervated groups showed higher
fiber density (p<0,05) and lower fiber and axon diameters (p<0,05), compared with CG. The
myelin sheath thickness in DG was lower than CG (p<0,05) and did not differ between DEG
and CG. The G ratio did not vary between all groups. Conclusion: The results showed a
premature functional recovery at the group subject to ES and thus, indicated a beneficial
effect of ES in peripheral nervous lesion treatment.
Key Words: Peripheral Nervous System; Denervation; Electric Stimulation.
45
INTRODUÇÃO
As lesões do nervo periférico promovem a interrupção dos impulsos nervosos, que por
sua vez, resulta no comprometimento parcial ou total das funções sensitiva, motora e
autonômica dos segmentos inervados. 1
Após a lesão nervosa periférica, uma seqüência complexa e bem regulada de processos
moleculares, incluindo a degeneração Walleriana, proliferação das células de Schwann (CS),
liberação de fatores neurotróficos e brotamento axonal se desenvolvem com a finalidade de
remover o tecido danificado e promover a regeneração do nervo. 2,3,4
Contudo, apesar desta capacidade regenerativa do sistema nervoso periférico,
evidências clínicas e experimentais demonstram que a regeneração nervosa por si só não
promove a recuperação satisfatória após a lesão. 5,6
Fatores intrínsecos e extrínsecos ao
sistema nervoso periférico estão relacionados com a recuperação destas lesões, incluindo a
condição do músculo esquelético no momento da reinervação. 1
A atrofia e proliferação do tecido conjuntivo constituem as principais alterações
morfológicas do sistema muscular decorrentes da desnervação. 7 Em conjunto, estas
modificações podem atuar como barreira ao crescimento axonal e à difusão dos fatores de
crescimento e, conseqüentemente, prejudicar a chegada do nervo ao músculo ou inibir a
regeneração muscular após a reinervação. 8,9
O emprego da corrente elétrica com objetivo de favorecer a recuperação após a lesão
nervosa periférica data deste a metade do século XIX, entretanto, os efeitos da
eletroestimulação (EE) no tratamento desta lesão ainda é controversa. Autores demonstram
que EE do músculo desnervado retarda a atrofia muscular e dessa forma, minimiza a
influência negativa da atrofia sobre a recuperação funcional da lesão nervosa. 10,11
46
No entanto, os relatos de que a EE pode reduzir o brotamento axonal intramuscular
suscitaram a idéia de que a EE também possui influência sobre a regeneração nervosa. 12,13
Para explicar tal resultado, os autores postulam a teoria de que a atividade promovida pela EE
inibiria a oferta da molécula de adesão neuronal (N-CAM), responsável pela orientação do
crescimento axonal nas fibras musculares.
Posteriormente, Katrominova et at. 14
demonstraram que o emprego de um protocolo
de EE semelhante ao utilizado por Love et al. 12
e Tam et al. 13
gerou redução na expressão da
N-CAM. Os protocolos utilizados por estes autores caracterizam-se pelo uso de eletrodos
invasivo e aplicação crônica da EE (acima de 8 horas/dia), diferentemente daqueles adotados
na prática clínica da fisioterapia.
Assim, o interesse de estudos que avaliassem o efeito de um protocolo EE semelhante
àquele usado na prática clínica, ou seja, de aplicação fásica da corrente através de eletrodos de
superfície sobre a regeneração axonal tornou-se crescente. Não obstante esse interesse, a
influência da EE sobre a regeneração e recuperação da lesão nervosa ainda não é clara, sendo
reportados efeitos favoráveis 15,16
ou não 17
ao uso deste recurso.
Portanto, este estudo visa avaliar o efeito do uso da EE muscular sobre a regeneração
nervosa, bem como, sobre a recuperação funcional de ratos submetidos à lesão nervosa
periférica por esmagamento.
MATERIAIS E MÉTODOS
O estudo foi conduzido em 15 ratos albinos da linhagem Wistar, machos, com idade
de 9 semanas e peso inicial médio de 279 32g. Os animais foram distribuídos
aleatoriamente em 3 grupos (n=5): controle (GC), desnervado (GD) e desnervado com
47
eletroestimulação (GDE) e mantidos em gaiolas plásticas coletivas, em ambiente climatizado
e ventilado, com livre acesso a dieta e água ad libitum por um período de 43 dias.
Prodecimento cirúrgico
Inicialmente, os animais foram anestesiados com uma mistura de Ketamina e Xilazina,
na proporção de 1:1, em doses de 0,1mL para cada 100g de peso corporal, e posicionados em
decúbito ventral com as patas anteriores e traseiras fixadas com auxílio de fita adesiva.
Em seguida, realizou-se a tricotomia e anti-sepsia na região glútea e na face lateral da
coxa do membro posterior direito e uma incisão na face lateral da coxa direita para a
exposição do nervo. Depois de exposto, o nervo foi submetido a 4 pinçamentos com 20
segundos de duração, cada, e intervalo entre os mesmos de 1 segundo na região localizada 5
mm acima da bifurcação. 18
Todos os grupos foram submetidos à exposição do nervo, no entanto, a lesão foi
conduzida apenas no GD e GDE. A pressão gerada pela pinça foi padronizada pelo
fechamento da mesma no 2º dente da cremalheira e todas as lesões foram exercidas pelo
mesmo avaliador a fim de se evitar variações no procedimento.
Por fim, a ferida cirúrgica foi lavada com soro fisiológico e o plano muscular e
cutâneo suturados com fio de nylon 4-0 e 3-0, respectivamente. A ferida foi lavada com
solução anti-séptica e o animal foi devolvido à gaiola de origem.
Protocolo de eletroestimulação
A estimulação elétrica do GDE teve início 24 horas após a lesão e prosseguiu por 42
dias, através de uma sessão diária de 30 minutos e freqüência de 5 vezes por semana. Após a
anestesia (dada por uma solução e dose igual à anestesia do procedimento cirúrgico), 2
eletrodos de superfície (1,5 cm²) untados com gel eletrocondutor foram posicionados na
48
região inguinal e sobre o músculo sóleo direito. A corrente elétrica foi gerada pelo o
eletroestimulador Bio-System EMC-01 e seguiu os seguintes parâmetros: corrente
exponencial, freqüência de 1 Hz, largura de pulso igual a 100ms e intensidade padronizada a
partir da visualização da contração do músculo, relação tempo ON/OFF igual a 1:4 segundos,
totalizando 360 abalos musculares a cada sessão de EE.
Análise funcional da marcha
O Índice Funcional do Ciático (IFC) consiste num método quantitativo seguro e
reprodutível que avalia a condição funcional do nervo isquiático de ratos após a lesão. Este
índice foi avaliado segundo o modelo proposto por De Medinacelli et al. 19
e modificado por
Johnston et al. 20
Após o treino inicial para o reconhecimento do ambiente, os animais foram postos
para caminhar na passarela, de 8,2x42cm com um abrigo escuro na extremidade, revestida
com papel sulfite e com as patas posteriores marcadas com tinta de carbono. O registro das
impressões plantares foi obtido no período pré-operatório, 7º, 14º, 21º e 28º, 35º e 42º dia pós-
operatório. As impressões foram digitalizadas e analisadas no software ImageJ 1.44, onde
foram mensurados os seguintes parâmetros: comprimento da pegada (CP): entre a
extremidade do terceiro dedo e o calcâneo; largura da pegada (LP): entre o primeiro e o
quinto dedo; e largura intermediária da pegada (LIP): entre o segundo e quarto dedo.
Em seguida, estes valores foram aplicados na equação proposta por Bain et al. 21
, onde
o IFC = -38.3 x [(CPE – CPN)/ CPN] + 109.5 x [(LPE - LPN)/LPN] + 13.3 x [( LIPE –
LIPN)/LIPN] – 8.8 . O resultado obtido pela equação expressa a perda funcional do nervo e
podem varia de 0 (zero) a -100 (menos cem), onde 0 (zero) representa função normal ou
ausência de disfunção e o valor -100 (menos cem) representa a perda total da função nervosa.
Portanto, quanto mais próximo de 0, melhor a função do nervo.
49
Análise morfométrica
No 43º dia pós-operatório foi realizada a coleta do nervo e eutanásia dos animais.
Primeiramente, o nervo isquiático direito de todos os animais foi novamente exposto e fixado
in situ com paraformaldeído a 4% em tampão fosfato-salino (PBS) por 5 minutos e um
segmento de 5mm foi dissecado, a cerca de 3 mm distal ao local da lesão (ou do local
equivalente ao da lesão no nervo íntegro). Em seguida, os animais foram submetidos à
eutanásia através da uma injeção intracardíaca de HCl.
Na seqüência, o segmento do nervo dissecado foi fixado em paraformaldeído a 4% em
PBS por 4 horas, pós-fixado por 2 horas em tetróxido de ósmio a 1% em solução de PBS,
desidratado em soluções crescentes de álcool (30, 50, 70, 90 e 100%), submetidos à
diafanização em xilol e incorporados na parafina. Cortes transversais de 5µm na porção distal
do nervo foram obtidos e corados em tricômio de Masson. 22
A análise destes cortes procedeu
no microscópio de luz (Leitz Werzlar) com aumento de 1000X e imersão em óleo. As
imagens do nervo foram digitalizadas com o auxílio de uma câmera (Celestron, modelo
44420), acoplado a um microcomputador, equipado com uma interface digitalizadora de
imagens.
Para cada nervo, foi realizada a seleção e digitalização aleatória e sistemática de 16
campos histológicos, onde através do software ImageJ 1.44, foi estabelecido um novo campo
para selecionar as amostras. As fibras localizadas no interior do novo campo ou aquelas que
tocassem a borda superior e esquerda do mesmo foram incluídas para a análise morfométrica,
que incluiu o número de fibras mielínicas, o diâmetro da fibra e o diâmetro do axônio. A
partir destes dados foi calculada a densidade média de fibras, diâmetro médio das fibras,
diâmetro médio dos axônios, espessura média da bainha de mielina e razão G.
50
A densidade média de fibras foi calculada dividindo-se o número de fibras pela área
analisada. O diâmetro médio dos axônios e das fibras de cada animal foi obtido a partir da
somatória dos diâmetros dos axônios divido pelo número de axônios e da somatória dos
diâmetros das fibras dividido pelo número de fibras mensuradas, respectivamente.
A espessura da bainha de mielina foi adquirida a partir da subtração do diâmetro da
fibra pelo diâmetro do axônio, dividido por dois. A espessura média da bainha de mielina foi
estabelecida pela somatória das espessuras das bainhas de mielina pelo número de fibras
nervosas analisadas. Por fim, o valor da razão G foi calculado a partir da divisão do diâmetro
do axônio pelo diâmetro da fibra nervosa.
Estatística
O teste de Kruskal Wallis foi utilizado para comparar as variáveis morfométricas e
IFC intergrupos. No caso de diferença entre os grupos, aplicou-se o teste de Mann-Whitney
para verificar onde a diferença estava. Para análise intragrupo do valor do IFC pré-operatório
com os demais dias pós-operatórios, foi usado o teste de Wilcoxon. O nível de significância
adotado para todas as análises foi o de p < 0,05. No texto e tabelas, os valores das variáveis
estão expressos em média ± desvio padrão (DP).
RESULTADOS
A tabela 1 apresenta os resultados da análise funcional da marcha dada pelo IFC. No
GC, o valor do IFC manteve-se estável ao longo do experimento, variando entre -7 e -5, sem
diferença significativa entre os dias. Por outro lado, no GD e GDE o valor do IFC reduziu
para em torno de -80 no 7º dia pós-operatório, demonstrando a perda funcional do nervo
isquiático. A partir do 14º dia pós-operatório, o IFC destes grupos apresentou um retorno
51
gradual até o valor pré-operatório. Este fato ocorreu no 35º dia pós-operatório para GDE e no
42º dia pós-operatório para GD.
Quando comparado entre os grupos, figura 1, o IFC no GC, GD e GDE não apresentou
diferença significativa no período pré-operatório. Após a lesão do nervo, o IFC do GD e GDE
manteve-se inferior ao do GC do 7º ao 28º dia pós-operatório (p<0,05), no 35º dia pós-
operatório o IFC no GDE foi equivalente ao do GC e no 42º dia pós-operatório todos os
grupos experimentais apresentaram IFC equivalente. Entre o GD e GDE, o IFC não diferiu
entre os grupos, exceto no 28º e 35º dia pós-operatório, onde o IFC do GDE foi superior ao do
GD (p<0,05).
Os dados referentes á análise morfométrica estão sumarizados na tabela 2. O GD e
GDE apresentaram aumento na densidade de fibras e redução do o diâmetro médio da fibra e
do axônio, quando comparado ao GC (p<0,05). A espessura média da bainha de mielina no
GD foi inferior ao do GC (p<0,05) e no GDE foi equivalente ao GC. Por fim, a razão G
manteve-se entre 0,6 e 0,7 nos grupos experimentais.
DISCUSSÃO
Os resultados deste estudo demonstram que ambos os grupos desnervados
apresentaram a tendência de recuperação funcional após a lesão do nervo isquiático, contudo,
essa recuperação foi mais acentuada no GDE em relação ao GD.
As lesões do sistema nervoso periférico apresentam um melhor prognóstico quando
comparado com as lesões do sistema nervoso central devido à capacidade regenerativa de suas
células. No entanto, a recuperação funcional destas lesões nem sempre é completa e podem
resultar em perda significativa das funções motoras e sensoriais e diminuição da qualidade de
vida. 1
52
O modelo de lesão por esmagamento, adotado neste estudo, corresponde a uma lesão
do tipo axonotmese, caracterizada pela ruptura da continuidade axonal e preservação das
estruturas de sustentação, que determinam a degeneração Walleriana e bom prognóstico de
recuperação. 23
Assim, este método de lesão torna-se adequado para avaliar a influência de
algum tratamento sobre a recuperação da lesão nervosa periférica.
Neste modelo, a carga aplicada durante o esmagamento é diretamente proporcional à
gravidade da lesão, sendo demonstrado, por exemplo, que cargas entre 500 e 15 000g
produzem uma lesão do tipo axonotmese de diferentes gravidades. 24
No presente estudo, a
carga aplicada durante o esmagamento não foi diretamente mensurada, sendo apenas
padronizada no 2º dente da cremalheira da pinça. Porém, considerando que no 7º dia pós-
operatório o IFC do GD (-80,0) e GDE (-80, 9) foi análogo, pode se concluir que a gravidade
da lesão produzida foi homogênea entre os grupos.
O IFC no grupo GC manteve-se estável ao longo dos dias pós-operatórios, não
excedendo o valor – 7. Valores acima de – 10 é considerado uma função normal do nervo
isquiático 15, 25
, o que indica que a exposição do nervo por si só não promoveu alguma lesão
do nervo, sendo esta, portanto, causada exclusivamente pelo esmagamento. Nos GD e GDE,
ao contrário, o IFC apresentou um declínio no 7º dia pós-operatório, seguido pelo aumento
gradual até o valor pré-operatório. No entanto, no GDE este aumento foi mais acentuado, de
modo que, a partir do 28º dia pós-operatório o IFC deste grupo era significativamente maior
ao do GD e no 35º pós-operatório este valor era equivalente ao IFC pré-operatório, enquanto
no GD o IFC só atingiu o valor pré-operatório no 42º dia pó-operatório.
A melhora na recuperação funcional associado ao uso da EE foi relatada por
Mendonça et al. 15
e Ahlborn et al. 26
O primeiro autor descreve que avaliação funcional no
21º dia pós-operatório do grupo desnervado com EE foi significativamente superior ao do
53
grupo desnervado sem EE, onde os valores do IFC foram de, respectivamente, – 16 e – 50.
Ahlborn et al. 26
, por sua vez, referem que na 12ª semana pós-lesão a recuperação funcional
do grupo submetido à EE era equivalente a 73% da função pré-operatória, contra 63% do
grupo sem EE.
Contrariamente, Gigo-Benato et al. 17
apontam que o uso da EE em músculos
desnervado promoveu prejuízo na recuperação funcional de ratos após a lesão do isquiático.
Contudo, este resultado deve ser interpretado com ressalva, visto que a EE foi aplicada apenas
a cada 48 horas sobre o músculo tibial anterior e a funcionalidade avaliada pelo IFC. O grau
de função do nervo isquiático dado pelo IFC é baseado na capacidade de espalhar os dedos da
pata posterior, função esta não exercida pelo músculo tibial anterior. 27
Os resultados da avaliação morfométrica demonstram que a densidade de fibras foi
maior nos dois grupos desnervados, bem como o diâmetro médio das fibras e axônios foram
menores nestes grupos em relação ao GC. O aumento na densidade de fibras deve-se ao fato
de que cada axônio emite dois ou três prolongamentos durante a regeneração axonal. 3
No que se refere à redução no diâmetro da fibra e axônio nos grupos desnervados,
Verdú et al. 28
afirmam que a maturação das fibras nervosas regeneradas é raramente
alcançada. Como exemplo, estes autores citam que, mesmo após que a recuperação funcional
já tenha sido restabelecida, o valor do diâmetro médio da fibra regenerada corresponde a 75%
do valor normal do nervo isquiático. No presente estudo, a média do diâmetro da fibra
manteve-se em 68% no GD e 73% no GDE.
A espessura média da bainha de mielina foi significativamente maior no GDE, quando
comparado ao GD, e semelhante ao GC, ao passo que a razão G manteve-se entre 0,6 e 0,7
nos três grupos avaliados. A razão G é um parâmetro relacionado à velocidade de condução
do impulso nervoso e valores entre 0,6 e 0,7 são considerados normais para fibras mielínicas.
54
Dessa maneira, a EE promoveu a maior espessura da bainha de mielina sem, contudo,
interferir da velocidade de condução.
O aumento na espessura média da bainha de mielina associado à precoce recuperação
funcional em ratos submetidos à lesão nervosa e EE foi relatado por Ahlborn et al. 26
, em
concordância os resultados vistos no presente estudo. Wang et al. 29
, também descreve o
aumento na espessura média da bainha de mielina após lesão e uso da EE, resultado este,
acompanhado pelo aumento na expressão do fator neurotrófico derivado do cérebro (BDNF),
da proteína Par-3 e na quantidade das células de Schwann (CS).
A formação da bainha de mielina pelas CS é um processo altamente polarizado, que
constituí no envolvimento concêntrico e unidirecional de várias camadas da membrana em
torno do axônio, a partir do local onde a CS se anexa ao axônio. Somente as CS
despolarizadas possuem a capacidade de enviar invólucros no axônio e assim, mielinizá-los. 30
Algumas moléculas atuam como sinalizadoras deste processo, que incluem a Par-3, uma
proteína do complexo de polaridade Par, e o BDNF. 31
A Par-3 fica localizada tanto no núcleo quanto no citoplasma das CS e a partir do
momento em que as CS estabelecem o contato com o axônio, esta proteína se distribui
assimetricamente no citoplasma, sinalizando a convergência de várias moléculas de adesão e
receptores essenciais para a formação da bainha de mielina, em particular, o receptor de
neurotrofina p75NTR
. Este receptor promove a secreção do BDNF, que por sua vez, tem a
função de inibir a migração das CS e de promover a mielinização. Assim, o Par-3 funciona
como ativador inicial da mielinização, onde o pico de expressão desta molécula coincide com
o início do processo de mielinização. 31
No trabalho desenvolvido por Wang et al. 29
, o pico de expressão da proteína Par-3
ocorreu na 2ª semana pós-operatória no grupo com EE, enquanto no grupo sem EE este pico
55
aconteceu, apenas, na 4ª semana pós-operatória. Uma semana após a lesão nervosa, o nível do
BDNF elevou-se em ambos os grupos, contudo na 8ª semana pós-operatória este nível era
quase igual a zero no grupo sem EE, à medida que no grupo com EE manteve-se expresso.
Diante deste resultado, os autores concluem que o aumento na espessura média da
bainha de mielina, seguido da lesão do nervo e tratamento com EE, provavelmente está
relacionado à ativação antecipada do processo de mielinização por meio da liberação precoce
da Par-3 e manutenção do nível do BDNF, molécula que possui papel-chave na mielinização
nervosa.
A mesma justificativa pode ser utilizada para explicar os resultados do presente
estudo, uma vez que o aumento da espessura média da bainha de mielina pode ter sido
resultado de uma ativação precoce no processo de mielinização, que por sua vez, repercutiu
sobre recuperação funcional dos animais submetidos ao tratamento com EE, que ocorreu de
maneira mais acelerada em relação aos animais não tratados.
No 42º dia pós-operatório, ambos os grupos apresentaram o retorno da função análogo
ao período pré-operatório, mas como afirmado anteriormente, este retorno para o GDE foi
uma semana mais precoce. Acelerar a recuperação funcional é considerado um importante
objetivo terapêutico, pois, diferentemente do que ocorre nos ratos, o processo de recuperação
em seres humanos requer um período de tempo maior para se estabelecer.
A baixa taxa de regeneração axonal, em média de 1 a 2 mm/dia, e a extensão que
axônios precisam regenerar determinam longos períodos de tempo para que os axônios
atinjam os órgãos-alvo, incluindo os músculos. O prolongado período de desnervação é
responsável pelo declínio na liberação dos fatores neurotróficos proveniente das CS, que
deixam de favorecer, progressivamente, a regeneração axonal. 5,32
Assim é que esperado que a
aceleração na recuperação nervosa possa ser mais benéfica ao ser humano do que ao rato.
56
Em resumo, os resultados deste estudo demonstraram o efeito benéfico de um
protocolo de EE no tratamento da lesão nervosa periférica, que promoveu melhora na
regeneração nervosa e conseqüentemente, uma recuperação funcional mais precoce em ratos
submetidos à lesão do nervo isquiático.
57
REFERENCIAS
1. Navarro X, Vivó M, Valero-Cabré A. Neural plasticity after peripheral nerve injury and
regeneration. Progress in Neurobiology 2001; 82: 163-201.
2. Jessen KR, Mirsky R. Negative Regulation of Myelination: Relevance for Development,
Injury, and Demyelinating Disease. Glia 2008; 56: 1552-1565.
3. Fawcett JW, Keynes RJ. Peripheral nerve regeneration. Annual Review of Neuroscience
1990; 13: 43-0.
4. Lundborg G. A 25-year perspective of peripheral nerve surgery: evolving neuroscientific
concepts and clinical significance. Journal of Hand Surgery. 2000; 25A (3): 391-414.
5. Gordon T, Boyd SO. Experimental strategies to promote functional recover after peripheral
nerve injuries. Journal of the Peripheral Nervous System 2003; 8: 236-250.
6. Rodríguez FJ, Valero-Cabré A, Navarro X. Regeneration and functional recovery following
peripheral nerve injury. Drug Discovery Today: Disease Models 2004; 1 (2): 177-85.
7. Lieber RL. Skeletal muscle structure, function & plasticity: the physiological basis of
rehabilitation. 2 ed. San Diego: Lippincott Williams & Wilkins; 2002.
8. Brushart TM, Hoffman PN, Royall RM, Murinson BB, Witzel C, Gordon T. Electrical
stimulation promotes motoneuron regeneration without increasing its speed or conditioning
the neuron. Journal of Neuroscience 2002; 22: 6631-6638.
9. Virtanen P, Tolonen U, Savolainen J, Takala TE. Effect of reinnervation on collagen
synthesis in rat skeletal muscle. Journal of Applied Physiology 1992; 72 (6): 2069-2074.
10. Cole BG, Gardiner PF. Does electrical stimulation of denervated muscle, continued after
reinnervation, influence recovery of contractile function? Experimental Neurology 1984; 85:
52-62.
11. Dow DE, Cerdena PS, Hasset CA, Kostrominova TY, Faulkner JA, Dennis RG.. et al.
Number of contractions to maintain mass and force of a denervated rat muscles. Muscle &
Nerve 2004; 30: 77-86.
12. Love FM, Son Y, Thompson WJ. Activity alters muscle reinnervation and terminal
sprouting by reducing the number of Schwann cell pathways that grow to link synaptic sites.
Journal of Neurobiology 2003; 54 (4): 566-576.
58
13. Tam SL, Archibald V, Tyreman N, Gordon T. Increased neuromuscular activity reduces
sprouting in partially denervated muscles. The Journal of Neurosience 2001; 21 (2): 654-667.
14. Kostrominova TY, Dow DE, Dennis RG, Miller RA, Faulkner JA. Comparison of gene
expression of 2-mo denervated, 2-mo stimulated-denervated, and control rat skeletal muscles.
Physiological Genomics 2005; 22: 227–243.
15. Mendonça AC, Barbieri CH, Mazzer N. Directly applied low intensity direct electric
current enhances peripheral nerve regeneration in rats. Journal of Neuroscience Methods
2003; 129: 183-/190.
16. Lima SC, Caierão QM, Peviani SM, Russo TL, Somazz MC, Salvini TF, Teodori RM,
Minamoto VB. Muscle and nerve responses after different intervals of electrical stimulation
sessions on denervated rat muscle. American Journal of Physical Medicine & Rehabilitation
2009; 88 (2): 126-135.
17. Gigo-Benato D, Russo TL, Geuna S, Domingues NRSR, Salvini TF, Parizotto NA.
Electrical stimulation impairs early functional recovery and accentuates skeletal muscle
atrophy after sciatic nerve crush injury in rats. Muscle & Nerve 2010; 41: 685-693.
18. Fernandes KCBG, Polacow M L O, Guirro R R J, Campos GER, Somazz MC, Pinto V F,
Fuentes CB, Teodori R M. Análise morfométrica dos tecidos musculares e conjuntivo após
desnervação e estimulação elétrica de baixa freqüência. Revista Brasileira de Fisioterapia
2005; 9 (2): 235-241.
19. De Medinacelli L, Freed WJ, Wyatt RJ. An index of the functional condition of rat sciatic
nerve based on measurements made from walking tracks. Experimental Neurology 1982; 77
(3): 634-43.
20. Johnston RB, Zachary L, Dellon AL, Sailer WA, Teplica DM. Improved imaging of rat
hind foot prints for walking track analysis. Journal of Neuroscience Methods 1991; 38:
111-4.
21. Bain JR.; Mackinnon SE.; Hunter RT. Functional avaluation of complete sciatic, peroneal
e posterior tibial nerve lesions in the rat. Plastic and Reconstructive Surgery 1989; 83: 129-
138.
22. Di Scipio F, Raimondo S, Tos P, Geuna S. A simple protocol for paraffin-embedded
myelin sheath staining with osmium tetroxide for light microscope observation. Microscopy
Research and Technique 2008; 71: 497-502.
59
23. Seddon HJ. Three types of nerve injury. Brain 1943; 66: 237-288.
24. Mazzer PYCN, Barbieri CH, Mazzer N, Fazan VPS. Morphologic and morphometric
evaluation of experimental acute crush injuries of the sciatic nerve of rats. Journal of
Neuroscience Methods 2008; 173: 249-258.
25. Oliveira LS, Sobral LL, Takeda SYM, Betini J, Guirro RRJ, Somazz MC, Teodori RM.
Electrical stimulation and swimming in the acute phase of axonotmesis: their influence on
nerve regeneration and functional recorevy. Revista de Neurologia 2008; 47(1): 11-15.
26.Ahlborn P, Schachner M, Irintchev A. One hour electrical stimulation accelerates
functional recovery after femoral nerve repair. Experimental Neurology 2007; 208: 137-144.
27. Salmons S. Is stimulation of denervated muscle contraindicated when there is potential for
reinnervation? Muscle & Nerve 2011; 43(2):300.
28. Verdú E, Ceballos D, Vilches JJ, Navarro X. Influence of aging on peripheral nerve
function and regeneration. Journal of Peripheral Nervous System 2000; 5(4): 191-208.
29. Wang L, Zhang S, Xia R, Ding W. Short-term low-frequency electrical stimulation
enhanced remyelination of injured peripheral nerves by inducing the promyelination effect of
brain-derived neurotrophic factor on Schwann cell polarization. Journal of Neuroscience
Research 2010; 88: 2578-2587.
30. Chan JR, Jolicoeur C, Yamauchi J, Elliott J, Fawcett JP, Ng BK, Cayouette M. 2006. The
polarity protein Par-3 directly interacts with p75NTR to regulate myelination. Science
314:832–836.
31. Taveggia C, Salzer JL. PARsing the events of myelination. Nature Neuroscience 2007,
10: 17-18.
32. Fenrich K., Gordon T. Axonal regeneration in the peripheral and central nervous
systems—current issues and advances. Canadian Journal Neurological Science 2004; 31:
142–156.
60
TABELAS E FIGURAS
Tabela 1. Valores do índice de funcionalidade do ciático (IFC) nos grupos experimentais para
cada dia de análise.
GC GD GDE
Pré-operatório - 7,11 ± 1,22 - 6,06 ± 1,61 - 4,7 ± 1,35
7º dia - 5,41 ± 2,91 - 80,98 ± 6,14a - 80,23 ± 6,67
b
14º dia - 6,66 ± 1,76 - 59,28 ± 10,44 a - 66,03 ± 5,67
b
21º dia - 7,59 ± 1,82 - 30,20 ± 4,16 a - 34,39 ± 6,13
b
28º dia - 7,68 ± 1,67 - 24,49 ± 1,59 a - 18,37 ± 1,93
b
35º dia - 7,40 ± 1,81 - 15,78 ± 4,09 a - 6,46 ± 1,70
42º dia - 7,47 ± 1,96 - 7,33 ± 0,81 - 5,45 ± 1,22
GC: grupo controle; GD: grupo desnervado; GDE: grupo desnervado com eletroestimulação.
a p<0,05:
comparado a valor pré-operatório do GD;
b p<0,05:
comparado a valor pré-operatório do GDE.
61
Tabela 2. Análise morfométrica nos diferentes grupos experimentais
GC GD GDE
Densidade das fibras 158 ± 15,99 225 ± 65,39b 262 ± 27,80
a
Diâmetro do axônio (μm) 4,70 ± 0,39 3,33 ± 0,66 a 3,70 ± 0,46
b
Diâmetro da fibra (μm) 6,98 ± 0,63 4,81 ± 0,99 a 5,10 ± 0,68
a
Espessura da bainha de mielina (μm) 1,10 ± 0,11 0,60 ± 0,18 a 0,86 ± 0,48
Razão G 0,67 ± 0,00 0,69 ± 0,01 b 0,72 ± 0,05
GC: grupo controle; GD: grupo desnervado; GDE: grupo desnervado com eletroestimulação.
a p< 0,01: comparado ao grupo controle;
b p<0,05: comparado ao grupo controle.
62
Figura 1. Comparação entre grupos para cada dia de análise do índice de
funcionalidade do ciático (IFC).
GC: grupo controle; GD: grupo desnervado; GDE: grupo desnervado com eletroestimulação.
* p< 0,05: comparado ao grupo controle; † p<0,05: comparado ao grupo desnervado.
63
CAPÍTULO 5. CONSIDERAÇÕES FINAIS
A lesão nervosa periférica conduz ao comprometimento das funções motoras
e sensoriais que repercutem sobre a capacidade funcional e qualidade de vida do
indivíduo. A sua recuperação depende da interação de diversos fatores, intrínsecos
e extrínsecos ao sistema nervoso periférico.
O longo período de desnervação se traduz em redução da capacidade
regenerativa do nervo, devido ao declínio na liberação de fatores neurotróficos e
modificações na morfologia muscular. Em conjunto, estas alterações deixam de
favorecer a regeneração axonal e conseqüentemente, podem comprometer a
recuperação funcional da lesão.
Assim, o uso de estratégias terapêuticas que minimizem estas modificações e
criem um ambiente favorável à regeneração e recuperação nervosa torna-se
necessárias no tratamento destas lesões. Neste cenário, a eletroestimulação (EE)
tem demonstrado ser eficaz ao minimizar a atrofia muscular decorrente a
desnervação e favorecer a recuperação da função motora, contudo o efeito deste
recurso sobre a regeneração nervosa ainda é controverso.
Protocolos de com o uso crônico da EE descrevem o efeito nocivo deste
recurso sobre a regeneração nervosa, contudo, o protocolo EE com aplicação fásica,
adotado no presente estudo, mostrou-se benéfico no tratamento da lesão nervosa
periférica, uma vez que favoreceu a recuperação funcional.
64
ANEXO A – Artigo de Revisão Sistemática
EFEITO DA ELETROESTIMULAÇÃO NO MÚSCULO DESNERVADO DE ANIMAIS:
REVISÃO SISTEMÁTICA.
THE EFFECT OF ELECTRICAL STIMULATION ON ANIMALS DENERVATED
MUSCLE: A SYSTEMATIC REVIEW.
Emanuela Virginia Vale Cavalcante1, Lívia Grabriely Melo da Silva
2, Eduardo José
Nepomuceno Montenegro3, Nicodemos Tele de Pontes Filho
4.
1. Mestranda do Programa de pós-graduação em Fisioterapia – Universidade Federal de
Pernambuco, Recife, PE, Brasil.
2. Aula do curso de Fisioterapia, Departamento de Fisioterapia – Universidade Federal de
Pernambuco, Recife, PE, Brasil.
3. Docente do Departamento de Fisioterapia – UFPE, Recife, PE, Brasil.
4. Docente do Programa de pós-graduação em Fisioterapia Universidade Federal de
Pernambuco, Recife, PE, Brasil.
Endereço para correspondência para: Emanuela Cavalcante, rua Dr. Vicente Meira n° 180,
apt. 1002, Espinheiro, CEP: 52.020.130. Recife-PE, e-mail: [email protected]
RESUMO
A recuperação funcional após a lesão nervosa periférica está relacionada a fatores intrínsecos e
extrínsecos ao sistema nervoso periférico, tais como a gravidade da lesão e a condição dos órgãos-
alvo. A atrofia constitui uma das principais alterações do músculo após a lesão nervosa, e uma vez
instalada, atua como barreira ao crescimento axonal durante a reinervação muscular. O uso da
eletroestimulação é rotineiro no campo da fisioterapia e tem o objetivo de minimizar ou impedir a
atrofia muscular e assim, favorecer a recuperação da lesão nervosa periférica. Objetivo: Avaliar os
efeitos da eletroestimulação sobre as características tróficas do músculo desnervado. Métodos:
Artigos publicados entre 1990 e 2010 e indexados aos bancos de dados da PUBMED foram
selecionados utilizando os seguintes descritores: ―muscle denervation AND electric stimulation‖ e
―muscular atrophy AND electric stimulation”. Foram considerados como critério de inclusão os
estudos experimentais em animais (ratos) que utilizassem a lesão nervosa periférica como modelo de
desnervação e que avaliassem o efeito da eletroestimulação muscular sobre a área de secção transversa
e/ou massa muscular de músculos desnervados. Resultados: 9 artigos foram selecionados para a
revisão. Conclusões: O efeito da EE está diretamente relacionado com a característica do protocolo de
intervenção, que quando aplicados de maneira adequada, apresenta efeito de retardar, em alguns casos,
impedir a atrofia do músculo desnervado.
Palavras-Chave: Desnervação muscular, estimulação elétrica, atrofia muscular.
65
ABSTRACT
The functional recovery after peripheral nerve injury is related to extrinsic and intrinsic factors of
peripheral nervous system, like trauma severity and conditions of the end-organs. The atrophy is a
major change of muscles after nerve injury, and once installed, it acts as a barrier to axonal growth
during muscle reinnevation. The use of electrical stimulation is routine in the field of physical therapy
and aims to minimize or prevent muscle atrophy and facilitate recovery from peripheral nerve injury.
Objective: The aim of this review is evaluate the effects of electrical stimulation on tropics
characteristics of denervated muscle. Methods: Articles published between 1990 and 2010 from
periodicals indexed in the PUBMED were selected, using the following keywords: ―muscle
denervation AND electric stimulation‖ e ―muscular atrophy AND electric stimulation”. Were
included experimental studies in animals (rats) that had used a peripheral nerve lesion as a model of
muscle denervation and that had evaluated the effect of electrical muscle stimulation on cross-
sectional area and/or muscle mass weight of denervated muscles. Results: 9 articles were selected for
this review. Conclusion: The effect of electrical stimulation is directly related to the intervention
protocol’s characteristics, which when applied properly, had the effect of delaying, in some cases, or
prevents the atrophy of denervated muscle.
Key words: Muscle denervation, electric stimulation, muscular atrophy.
66
INTRODUÇÃO
A lesão nervosa periférica é uma ocorrência comum na prática clínica de fisioterapia.
Em geral, é decorrente de traumas, como de acidentes veiculares, com objetos penetrantes,
por quedas e acidentes industriais (1).
O comprometimento na transmissão dos impulsos nervosos é uma das conseqüências
deste tipo de lesão nervosa (2), que conduz a diversas alterações no sistema muscular, tais
como a atrofia muscular (3,4), proliferação do tecido conjuntivo (TC) (5), mudanças na
excitabilidade muscular (6) e modificações nas células satélites (7,8).
A perda do suprimento nervoso promove a diminuição da atividade muscular, por sua
vez, desencadeia uma resposta adaptativa para a remodelação do tecido muscular marcada
pela degradação das proteínas contráteis do músculo via sistema proteolítico (9,10). Como
resultado, observa-se a diminuição da massa (5,11), do diâmetro da fibra (12) e produção de
força (13,14), que em conjunto caracterizam a atrofia do músculo.
Essas modificações iniciam imediatamente após a desnervação e persistem enquanto o
músculo estiver desprovido de inervação. Caso a desnervação permaneça por um longo
período de tempo o TC substituirá os elementos contráteis do músculo, submetidos à
proteólise, e atuará como inibidor da regeneração muscular após a reinervação (11,15).
O prognóstico das lesões do nervo periférico é variável e dependem da gravidade das
mesmas. Nos casos em que há preservação da estrutura mesenquimal, seja ela dada por reparo
cirúrgico ou pelo próprio trauma, o prognóstico é favorável, pois a presença desta estrutura
intacta serve como guia para o crescimento axonal até sua reinervação com órgão-alvo (16-
19).
No entanto, apesar da capacidade regenerativa do sistema nervoso periférico, a
recuperação após a lesão nem sempre é completa e satisfatória devido a fatores intrínsecos e
extrínsecos ao sistema nervoso periférico, como o tipo e nível de lesão, presença de patologias
associadas e alterações nos órgãos-alvo (20,21).
A condição do músculo no momento da reinervação é determinante na recuperação
funcional, tendo em vista que, o músculo atrofiado atua como uma barreira ao crescimento
axonal e impede que o desenvolvimento e maturação axonal ocorram9. Dessa forma, é comum
na prática clínica da fisioterapia o emprego da eletroestimulação com o objetivo de minimizar
a atrofia muscular e favorecer boa recuperação funcional da lesão nervosa periférica (22-25).
67
Nesse contexto, o presente estudo tem por objetivo realizar uma revisão sistemática dos
estudos experimentais a fim de verificar o efeito trófico da eletroestimulação em músculos
desnervados.
MATERIAIS E MÉTODO
Artigos publicados entre 1990 e 2010 e indexados aos bancos de dados da PUBMED
foram selecionados para este trabalho de revisão. A estratégia de busca utilizada foi: ―muscle
denervation AND electric stimulation‖ e ―muscular atrophy AND electric stimulation” e
foram inclusos, também, os seguintes limites: animals, english, spanish e portuguese.
A seleção dos artigos foi realizada por dois avaliadores independentes e no caso de
discordâncias, um terceiro examinador foi convocado para o consenso final. Inicialmente
foram analisados os títulos e resumos dos artigos e aqueles considerados como
potencialmente relevantes, segundos os critérios de inclusão e exclusão, foram obtidos na sua
versão completa para a análise mais criteriosa.
Foram inclusos estudos experimentais em animais, especificamente em ratos, que
utilizassem a lesão nervosa periférica como modelo de desnervação e que avaliassem o efeito
da eletroestimulação muscular sobre a área de secção transversa e/ou massa muscular destes
músculos nos períodos de desnervação.
Foram exclusos os estudos em que o emprego da EE ocorresse, também ou
exclusivamente, no período de reinervação muscular, pois neste caso, não há a possibilidade
de diferenciar o efeito trófico promovido pela EE, daquele proporcionado pelo retorno do
suprimento nervoso.
Os estudos que fizessem uso da eletroestimulação associada à terapia com células
tronco e fármaco, ou ainda, que não descrevesse os dados concernentes ao procedimento de
lesão, bem como do protocolo de intervenção também foram excluídos.
RESULTADOS
Dentre os 254 artigos identificados inicialmente na busca eletrônica, apenas 12 foram
retirados na versão completa para uma análise mais detalhada e, entre estes, 02 foram
68
excluído por avaliar o efeito da EE durante a fase de reinevervação e 01 por não fornecer
informações a cerca da metodologia de lesão e da intervenção (Figura 1).
Dessa forma, segundo os critérios de inclusão e exclusão, 9 artigos foram selecionados
para a revisão: Gigo-Benato et al, 2010 (26); Tomori et al, 2010 (27); Russo et al, 2010 (28);
Lima et al, 2009 (29); Russo et al, 2007 (30); Dow et al, 2006 (31); Dow et al, 2005 (32);
Dow et al, 2004 (33); e Kanaya et al, 1992 (34).
Em todos os estudos selecionados o planejamento de intervenção foi realizado pela
combinação de aspectos temporais, como a duração (período de tempo por dia), freqüência
(número de sessões por semana) e período (quantidade de semanas); e aspectos específicos da
eletroestimulação, que inclui os parâmetros da amplitude, freqüência, duração do impulso,
intervalo do repouso e número de contrações, conforme ilustrado na tabela 1. Os resultados da
análise dos desfechos de interesse: área de secção transversa e peso da massa muscular estão
apresentados na tabela 2.
69
Tabela 1. Características dos estudos da eletroestimulação do músculo desnervado na fase de desnervação.
Autor Amostra Idade Alocação Lesão Intervenção Protocolo de eletroestimulação
Gigo-Benato et al
(2010)26
27 ratos (Wistar)
GC (n=9)
GD (n=9)
GDE (n=9)
12 semanas - Nervo: Ciático (MID)
Método: Esmagamento
(Pinçamento único de 10
seg)
Músculo: TA
Eletrodo: Transcutâneo
Duração: -
Freqüência: 1 sessão/48hr
Período: 14 dias
Corrente exponencial
Freqüência: 20Hz
Amplitude: 0,25 – 0,8 mA
Duração do pulso: 4-10 ms
Nº de contraçõe/dia: 20
Tomori et al
(2010)27
39 ratos (Wistar)
GC 8 (n=8)
GD (n=8)
GDE-I4 (n=8)
GDE-I8 (n=8)
GDE-I16 (n=8)
7 semanas Randomizada Nervo: Ciático
Método: Congelamento
(5seg)
Músculo: TA
Eletrodo: Transcutâneo
Duração: 30 minutos/sessão
Freqüência: 6 sessões/semana
Período: 3 semanas
Corrente retangular simétrica.
Freqüência: 10Hz
Amplitude: 4mA (GDE-I4),
8mA (GDE-I8), 16mA (GDE-
I16)
Duração do pulso: 250µs
Nº de contraçõe/dia: -
Russo et al
(2010)28
30 ratos (Wistar)
GC (n=6)
GD (n=)6
GDE+A (n=6)
GDE (n=6)
GDA (n=6)
12 semanas Randomizada Nervo: Ciático (MID)
Método: Esmagamento
(2 pinçamentos de 10
seg/cada, intervalo de 5 seg
entre eles).
Músculo: TA
Eletrodo: Transcutâneo
Duração: 52,8 min/sessão
Freqüência: 1 sessão/dia
Período: 6 dias
Corrente exponencial
Freqüência: 50Hz
Amplitude: 0,3 -0, 7mA
Duração do pulso: 2-7 ms
Nº de contraçõe/dia: 200
Lima et al
(2009)29
21 ratos (Wistar)
GC (n=5)
GD (n=6)
GDE-D (n=5)
GDE-DA (n=5)
6 a 7
semanas
Randomizada Nervo: Ciático (MIE)
Método: Esmagamento
(4 pinçamentos de 20
segundos, cada um, com
intervalo de 1 segundo entre
eles)
Músculo: GM
Eletrodo: Transcutâneo
Duração: 30 minutos/sessão
Freqüência: 5 sessões/semana
(GDE-D) e 3 sessões/semana
(GD-DA)
Período: 10 dias
Corrente bifásica quadrada e
simétrica.
Freqüência: 10Hz
Amplitude: 5mA com adição de
1mA a cada 5 minutos
Duração do pulso: 3ms
Nº de contraçõe/dia: -
70
Russo et al
(2007)30
34 ratos (Wistar)
GC (n=5)
GCE-Ed (n=5)
GP (n=5)
GD (n=8)
GDE-Ed (n=8)
12 semanas Randomizada Nervo: Ciático (MID)
Método: Ressecção de 1 cm
do nervo
Músculo: TA
Eletrodo: Transcutâneo
Duração: -
Freqüência: 1 sessão/48hr
Período: 28 dias
Corrente exponencial
Freqüência: 20Hz
Amplitude: 0,4 -0, 8mA
Duração do pulso: 1-12 ms
Nº de contraçõe/dia: 20
Dow et al
(2006)31
41 ratos
(WI/HickisCar)
GC*(n=21) -
4meses
GC*(n=19) -
7meses
GD (n=9) -
4meses
GD ( n=8) -
7meses
GDE (n=9) -
4meses
GDE (n=4) -
7meses
- - Nervo: Ciático (MID)
Método: Secção do nervo
com sutura independentes
dos cotos, mantidos por 4 ou
7 meses
Músculo: ELD
Eletrodo: Interno (implantado)
Duração: 24horas/dia**
Freqüência: 7dias/semana
Período: 4 ou 7 meses
Corrente bipolar.
Freqüência: 100Hz
Amplitude: 6-12mA
Duração do pulso: 0,4ms
Nº de contrações/dia: 200.
** O intervalo de tempo entre
cada contração era constante e
igual a 7,2 minutos
Dow et al
(2005)32
64 ratos
(WI/HickisCar)
GC*
GD (n=5)
GDE-C (n=31)
GDE-I (n=28)
5,8 a 7,6
meses
- Nervo: Ciático (MID)
Método: Secção do nervo
com sutura independentes
dos cotos
Músculo: ELD
Eletrodo: Interno (implantado)
Duração: 24horas/dia***
Freqüência: 7dias/semana
Duração: 5 semanas
Corrente bipolar.
Freqüência: 100Hz
Amplitude: 6 -12 mA
Duração do pulso: 0,4ms
Nº de contrações/dia: 100 a 800
*** No GDE-C cada contração
muscular era separada por um
intervalo constante de tempo e
distribuída ao longo de 24h. No
GDE-I, um grupo de 5
contrações (separadas por 30seg
entre si) era distribuído em
intervalos constantes de tempo.
71
Dow et al
(2004)33
79 ratos
(WI/HickisCar)
machos e adultos:
GC (n=6)
GP (n=6)
GD (n=5)
GDE (n=53)
5,6 a 7
meses
Randomizada Nervo: Ciático
Método: Secção do nervo
com sutura independentes
dos cotos
Grupo: Todos os GD
Músculo: ELD
Eletrodo: Interno (implantado)
Duração: 24horas/dia****
Freqüência: 7dias/semana
Duração: 5 semanas
Corrente bipolar
Freqüência: 100Hz
Amplitude: 6-12 mA
Duração do pulso: 0,4ms
Nº de contrações/dia: 25, 50,
100, 200, 300, 500, 800, 1.200,
2.000 e 5.000.
**** O nº de contrações foi
distribuído ao longo de 24h,
com intervalos constantes de
tempo. Ex: no protocolo de 25
contrações, cada uma delas era
separada por 57,6 minutos e no
protocolo de 5.000, o intervalo
era de 17,3 segundos
Kanaya et al
(1992)34
50 ratos (Wistar)
GD (n=25)
GD+EE (n=25)
- - Nervo: Fibular (MIE);
Método: Secção do nervo
com sutura independentes
dos cotos
Grupo: Todos os GD
Músculo: TA;
Eletrodo: Transcutâneo
Duração: 30 minutos/dia
Freqüência: 5 dias/semana
Duração: 12 semanas
Corrente retangular.
Freqüência: 2Hz;
Amplitude: -
Duração do pulso: 100 ms.
Nº de contrações/dia: -
GC, grupo controle; GC*, músculo controle constituído pelo músculo contralateral; GP, grupo placebo; GD, grupo desnervado; GDE, grupo desnervado com
eletroestimulação; GDE-I4, GDE-I8, GDE-I16, grupo desnervado com eletroestimulação de intensidade de 4mA, 8mA e 16mA, respectivamente; GDE+A, grupo
desnervado com eletroestimulação e alongamento; GDA, grupo desnervado com alongamento; GDE-D, grupo desnervado com eletroestimulação diária; GDE-DA, grupo
desnervado com eletroestimulação em dias alternados; GDE-Ed, grupo desnervado com eletroestimulação e eletrodiagnóstico; GCE-Ed, grupo desnervado com
eletroestimulação e eletrodiagnóstico; GDE-C, grupo desnervado com eletroestimulação contínua; GDE-I, grupo controle com eletroestimulação intervalada; MID, membro
inferior direito; MIE, membro inferior esquerdo; GM, músculo gastrocnêmio; ELD, músculo extensor longo dos dedos; TA, músculo tibial anterior; Hz, hertz; mA,
miliampère; ms, millisegundos; µs, microsegundos.
72
Tabela 2. Efeitos da eletroestimulação nos grupos desnervado com eletroestimulação em relação aos grupos desnervado e controle.
Autor Peso da massa muscular Área de secção transversa
GDE x GD GDE x GC GDE x GD GDE x GC
Gigo-Benato et al
(2010)26
Nenhuma diferença ↓ (p<0.05) ↓ em 55% (GDE) e 38% (GD)
(p<0.05)
↓ (p<0.05)
Tomori et al
(2010)27
↑ nos GDE-I8 e I16
(p<0.05)
↓ (p<0.05) - -
Russo et al
(2010)28
Nenhuma diferença ↓ (p<0.05) Nenhuma diferença ↓ em 26% (GDE), 25% (GD) e
24% (GDE-A) (p<0.05)
Lima et al
(2009)29
Nenhuma diferença. ↓ (p = 0.000) Nenhuma diferença ↓ em torno 68% em todos os
grupos com eletroestimulação
(p=0.000)
Russo et al
(2007)30
Nenhuma diferença ↓ em 62% (GD) e 66 (GDE)
(p<0.05)
Dow et al
(2006)31
↑ ↓ (p<0.05) - -
Dow et al
(2005)32
O GD manteve apenas 53% do peso
muscular, quanto os GDE
mantiveram o peso em torno de 80 e
90% em relação ao GC.
Nenhuma diferença, o peso
manteve-se em torno de 90%
(200 a 800 Cd ) e em 80% (GDE-
C com 100Cd)
- -
73
Dow et al.
(2004)33
↑, exceto no GDE+25Cd (p<0.05) Nenhuma diferença , exceto o
GDE com 25Cd
Atenuou a redução nos grupos
de 300 a 2.000 Cd, sendo
observado hipertrofia no grupo
com 300 Cd
↓ (p<0.05)
Kanaya et al
(1992)34
↑ (p<0.05) ↓ (p<0.05) - -
GDE, grupo desnervado com eletroestimulação; GD, grupo desnervado; GC, grupo controle; GDE-C, grupo desnervado com eletroestimulação contínua; GDE+A, grupo
desnervado com eletroestimulação e alongamento; Cd, número de contrações por dia.
74
DISCUSSÃO
A eletroestimulação (EE) não é um recurso terapêutico novo, entretanto, algumas
controvérsias acerca de sua influência sobre o trofismo de músculos desnervados ainda
persistem conforme demonstrado nos resultados desta revisão.
A literatura descreve que as mudanças tróficas de músculos desnervado podem ser
resultantes de dois fatores: carência de fatores tróficos e da atividade neuromuscular. Para
alguns autores, as alterações morfológicas na desnervação são resultantes tanto da inatividade
muscular, quanto da ausência dos fatores tróficos. Assim, o desempenho insatisfatório da EE,
apresentados em alguns trabalhos nesta revisão, seria justificado por ele suprir somente a
ausência de um único fator, o neuromuscular (35,36).
No entanto, ainda não há respaldo suficiente para garantir a influência dos fatores
tróficos sobre as características morfológicas do músculo desnervado, visto que estes parecem
estar mais relacionados à estabilização pós-sináptica da junção neuromuscular. De modo
contrário, tem sido descrito que a atividade muscular é quem desempenha o papel
predominante, senão exclusivo sobre estas propriedades do músculo (37).
Dessa forma, considerando que não há evidência suficiente para demonstrar a
influência dos fatores tróficos sobre a morfologia muscular, em que o fator neuromuscular
parece ser soberano, a provável causa para os resultados contraditórios apresentados nesta
revisão pode ser atribuída à variável metodologia dos estudos.
Dow et al. (32, 33) descrevem que o peso da massa de músculos desnervados e
submetidos a EE apresentaram valores significativamente maior ao de músculos desnervado,
sem intervenção, e similares ao do músculo ileso. Dow et al.(33) descreve ainda a preservação
do diâmetro das fibras de músculos desnervados. Nestes estudos, os autores destacam que há
uma relação direta entre o número de contrações geradas por dia e a distribuição destas com o
75
efeito trófico da EE em músculos desnervados, sendo indicado entre 200 a 800 contrações/dia,
com distribuição contínua e constante ao longo do dia.
Em contrapartida, a utilização do mesmo protocolo de intervenção proposto por Dow
et al. (31), porém por um período mais prolongado de tempo, proporcionou nenhum aumento
significativo da massa muscular. Neste caso, a divergência é explicada pelo defeito em
algumas unidades do dispositivo gerador de EE, elaborado inicialmente por Dennis e Dow
(38) para o uso em menor período de tempo, que neste estudo apresentaram falhas na bateria.
Os autores, ao avaliar a correlação entre a falha do dispositivo e a massa muscular,
observaram que entre os animais que não necessitaram a reposição do dispositivo, o valor da
massa muscular apresentou-se significativamente superior aos que realizaram reposição do
aparelho e mais próximo aos músculos de animais do grupo controle. Na análise final dos
dados não houve distinção entre os que falharam ou não, o que torna questionável os dados
deste trabalho.
Gigo-Benato et al. (26), Tomori et al. (27), Russo et al. (28, 30), Lima et al. (29) e
Kanaya et al. (34) também propuseram verificar o efeito trófico da EE na fase de desnervação,
mas diferentemente dos trabalhos de Dow et al. (31,33), estes autores empregaram um
protocolo de intervenção não invasivo e com duração fásica, menor que 8 horas/dia. Dentre
esses, somente Tomori et al. (27) e Kanaya et al. (34) apontaram o efeito benéfico da EE em
minimizar a atrofia muscular.
Tomori et al. (27), verificaram que o uso da corrente de baixa intensidade (4mA)
mostrou-se ineficaz em minimizar a atrofia muscular, ao contrário das correntes de maior
intensidade (8 e 16mA), que foram efetivas em reduzir a atrofia do músculo desnervado.
Outras variáveis também foram avaliadas neste estudo e os autores chamam atenção para o
efeito adverso da corrente de 16mA sobre a regeneração dos terminais nervosos na placa
76
motora. Assim, os autores concluem que a intensidade da corrente possui relação direta com
os efeitos da EE e não recomendam intensidades muito baixas e nem muito altas.
Kanaya et al. (34) constataram que um protocolo de EE com a duração de pulso maior
(igual a 100ms) promoveu aumento significativo da massa muscular no grupo desnervado e
tratado em relação ao grupo desnervado e não tratado.
Por outro lado, Gigo-Benato et al. (26) e Russo et al. (30) relataram nenhum efeito da
EE sobre o estado trófico dos músculos desnervados. A possível causa para este resultado
pode estar relacionado ao número de contrações geradas pelo protocolo, apenas 20
contrações/dia. Como explanado anteriormente, Dow et al. (33) descreveram a relação direta
entre o efeito trófico da EE e o número de contrações/dia, onde o efeito trófico da EE só foi
observado nos protocolos acima de 25 contrações/dia.
Nesse sentido, Russo et al. (28) elaboraram um novo estudo com o protocolo de
intervenção semelhante ao estudo anterior (30), porém com o número de contrações/dia igual
a 200, conforme recomendado por Dow et al. (33). Os resultados deste trabalho, no entanto,
demonstraram nenhum efeito benéfico da EE. Neste caso, a baixa intensidade da corrente, que
não ultrapassou 0,7mA, pode ser a causa deste resultado.
Lima et al. (29) também não observaram diferença nos valores da massa muscular e
área de secção transversa entre os grupos de intervenção e o de desnervação, resultado
semelhante visto por Caierão et al. (15) e Fernandes et al. (5) para o uso do mesmo protocolo
de intervenção.
Sabe-se que os valores da reobase e cronaxia conferem uma eficiente descrição da
excitabilidade muscular e que se apresentam mais elevados em músculos desnervado,
demonstrando menor excitabilidade destes em relação ao músculo sadio21
. Graças a esta
77
pouca excitabilidade é que os músculos desnervado necessitam de maior amplitude (reobase)
e duração de pulso (cronaxia) para se contrair (40,41).
Dessa forma, os protocolos de EE em que os parâmetros da corrente elétrica
correspondiam às características da baixa excitabilidade do músculo desnervado, com o
emprego de uma amplitude (27) ou duração (34) e pulso maiores, foram os que se mostraram
eficazes em minimizar a perda do trofismo em músculos desnervados.
Semelhantemente ao protocolo proposto por Kanaya et al. (34) e tendo em vista esta
característica do músculo desnervado, Mokrusch et al. (42) aplicou um protocolo com uma
largura de pulso maior e duração da intervenção menor, onde verificou-se que o diâmetro das
fibras musculares para o grupo tratado foi de 72 a 86% do controle. Neste estudo, os autores
sugerem que maior duração de pulso pode ter contrabalanceado a menor duração da
intervenção, justificativa esta, provável para explicar os resultados de Kanaya et al. (34) em
detrimento aos de Gigo-Benato et al. (26) , Russo et al. (28, 30) e Lima et al. (29).
O mesmo, porém de forma contrária, pode ter ocorrido nos trabalhos de Dow et al.
(32, 33) em comparação a estes últimos citados, que embora tenham utilizado uma largura e
intensidade de pulso semelhante, somente os resultados descritos pelo primeiro autor foram
favoráveis, onde a aplicação da EE por um período maior pode ter compensado a curta
duração de pulso.
No que se refere à metodologia dos estudos, observou-se a omissão de dados
relevantes do protocolo de EE, em particular, o número de contrações geradas por dia, que
como demonstrado com Dow et al. (33) tem uma relação direta com ganho de trofismo.
Verificou-se ainda que o peso da massa muscular foi o desfecho mais avaliado entre os
estudos.
78
A pesagem da massa é uma técnica simples, porém, reflete indiretamente o trofismo
das fibras, visto que também é influenciada por outros fatores como a proliferação do tecido
conjuntivo. Dessa forma, o uso desta medida pode favorecer o mascaramento da atrofia e,
nesse sentido, a análise histológica com a determinação da área de secção transversa parece
ser mais confiável e indicada para avaliação do trofismo muscular (40).
Em suma, os estudos apresentados nesse estudo de revisão apresentaram variabilidade
metodológica entre eles, que por sua vez, pode ter influenciado na diversidade de resultados.
Todavia, os resultados destes indicam que o efeito da EE está diretamente relacionado com as
características do protocolo de intervenção, que quando aplicados de maneira adequada e
respeitando as características da excitablidade do músculo desnervado, apresenta efeito de
retardar e em alguns casos, de impedir a atrofia do músculo desnervado.
Por fim, recomenda-se para estudos posteriores o melhor detalhamento do protocolo
de intervenção, bem como, a utilização da área de secção transversa como o parâmetro
avaliativo do trofismo muscular.
79
REFERENCIAS
1. Lawrence RR. Traumatic injury to peripheral nerves. Muscle Nerve. 2000; 23: 863-873.
2. Sunderland S. Nerve and Nerve Injure. 2nd ed. London: Churchill Livingstone, 1985.
3. Liu M, Zhang D, Shao C, Liu J, Ding F, Gu X. Expression pattern of myostatin in
gastrocnemius muscle of rats after sciatic nerve crush injury. Muscle Nerve. 2007; 35:649-
656.
4. Hulataa D, Hughesa WF, Shott S, Kroinc JS, Gonzalezd MH, Kernsa JM. Early behavioral
and histological outcomes following a novel traumatic partial nerve lesion. Journal of
Neuroscience Methods. 2008; 172:236-244.
5. Fernandes KCBG, Polacow MLO, Guirro RRJ, Campos GER, Somazz MC, Pinto VF,
Fuentes CB, Teodori RM. Análise morfométrica dos tecidos musculares e conjuntivo após
desnervação e estimulação elétrica de baixa freqüência. Revista Brasileira de fisioterapia
2005; 9(2):235-241.
6. Russo TL, França CN, Castro CES, Salvini TF. Alterações da cronaxia, reobase e da
acomodação no músculo esquelético desnervado submetido à eletroestimulação. Revista
Brasileira de Fisioterapia. 2004; 8(2):169-175.
7. Kujawa M, Baranb W, Jankowska-Steifera E. Quantitative ultrastructural changes in
satellite cells of rats immobilized after soleus muscle denervation. Experimental and
Molecular Pathology. 2005;78: 78-85
8. Schmalbruch H, Lewis DM. Dynamics of nuclei of muscle fibers and connective cells in
normal and denervated rat muscles. Muscle Nerve. 2000; 23:617-626.
9. Sultan KR, Dittrich BT, Pette D. Calpain activity in fast, slow, transforming, and
regenerating skeletal muscles of rat. Am J Physiol Cell Physiol. 2000; 279:C639-C647.
10. Ferreira R, Neuparth MJ, Ascensão A, Magalhães J, Duarte J. Amado F. Atrofia muscular
esquelética. Modelos experimentais, manifestações teciduais e fisiopatologia. Revista
Portuguesa de Ciências do Desporto. 2004; 4(3):94-111.
80
11. Marqueste T, Decherchi P, Desplanches D, Favier R, Grelot L, Jammes Y. Chronic
electrostimulation after nerve repair by self-anastomosis: effects on the size, the mechanical,
histochemical and biochemical muscle properties Acta Neuropathology 2006; 111:589-600.
12. Cole BG, Gardiner PF. Does stimulation of denervated muscle, continued after
reinnervation, influence recovery of contractile function? Experimental neurology. 1984; 85:
52-62.
13. Aydin MA, Mackinnon SE, Gu XM, Kobayashi J, Kuzon WM. Force Deficits in Skeletal
Muscle after Delayed Reinnervation. Plastic and Reconstructive Surgery. 2004; 113(6):1712-
1718.
14.Minamoto VB. Efeitos da desnervação no músculo esquelético: uma revisão. Fisioterapia
em Movimento 2007; 20(3):63-69.
15. Caierão QM, Betini J, Teodori RM, Minamoto VB. O efeito do intervalo da estimulação
elétrica no músculo desnervado de rato. Revista Brasileira de Fisioterapia 2008; 12(2):143-8.
16. Burnett MG, Zager EL. Pathophsiology of peripheral nerve injury: a brief review.
Neurosurg Focus 2004; 16(5):1-7.
17. Siqueira R. Lesões nervosas periféricas: uma revisão. Revista de neurociência 2007;
15(3):226-233.
18. Rodríguez FJ, Valero-Cabré A, Navarro X. Regeneration and functional recovery
following peripheral nerve injury. Drug Discovery Today: Disease Models 2004; 1(2):177-85.
19. Fawcett JW, Keynes RJ. Peripheral nerve regeneration. Annu. Rev. Neurosci. 1990;
13:43-0.
20. Navarro X, Vivó M, Valero-Cabre A. Neural plasticity after peripheral nerve injury and
regeneration. Progress in Neurobiology. 2007; 82:163-201.
21. Geuna S, et al. Chapter 3: Histology of the peripheral nerve and changes occurring during
nerve regeneration. Int. Rev. Neurobiology. 2009; 87:27-46.
22. Lim J, Han TR. Effect of electromyostimulation on a apoptosis-related factors in
denervation and reinnervation of rat skeletal muscles. Muscle Nerve. 2010; 42:422-430, 2010
81
23. Eberstein A, Pachter. The effect of electrical stimulation on reinnervation of rat muscle:
contractile properties and endplate morphometry. Brain Research. 1986; 384:304-310.
24. Jaweed MM, Herbison GJ, Ditunno JF. Direct electrical stimulation of rat soleus during
denervation-reinnervation. Experimental Neurology. 1982; 75:589-599.
25. Dow DE, Cederna PS, Hassett CA, Dennis RG, Faulkner JA. Electrical stimulation prior
to delayed reinnervation does not enhance recovery in muscles of rats. Restorative Neurology
and Neuroscience 2007; 25: 601–610.
26. Gigo-Benato D, Russo TL, Geuna S, Domingues NRSR, Salvini TF, Parizotto NA.
Electrical stimulation impairs early functional recovery and accentuates skeletal muscle
atrophy after sciatic nerve crush injury in rats. Muscle Nerve. 2010; 41:685-693.
27. Tomori K, Ohta Y, Nishizawa T, Tamaki H, Takekura H. Low-intensity electrical
stimulation ameliorates disruption of transverse tubules and neuromuscular junctional
architecture in denervated rat skeletal muscle fibers. J Muscle Res Cell Motil. 2010; 31:195-
205.
28. Russo TL, Peviani SM, Durigan JLQ, Gigo-Benato D, Delfino GB, Salvini TF. Stretching
and electrical stimulation reduce the accumulation of MyoD, myostatin and atrogin-1 in
denervated rat skeletal muscle. J Muscle Res Cell Motil. 2010; 31:45-57.
29. Lima SC, Caierão QM, Peviani SM, Russo TL, Sommaz MC, Salvini TF, Teodori RM,
Minamoto VB. et al. Muscle and nerve responses after different intervals of electrical
stimulation sessions on denervated rat muscle. American Journal of Physical Medicine &
Rehabilitation 2009; 88(2): 126-135.
30. Russo TL, Peviani SM, Freria CM, Gigo-Benato D, Geuna S, Salvini TF. Electrical
stimulation based on chronaxie reduces atrogin-1 and myoD gene expressions in denervated
rat muscle. Muscle Nerve. 2007; 35:87-97.
31. Dow DE, Carlson BM, Hassett CA, Dennis RG, Faulkner JA. Electrical stimulation of
denervated muscles of rats maintains mass and force, but not recovery following grafting.
Restorative Neurology and Neuroscience. 2006; 24: 41-54.
82
32. Dow DE, Faulkner JA, Dennis RG. Artificial Organs. Distribution of rest periods between
electrically generated contractions in denervated muscles of rats. 2005; 29(6):432–435.
33. Dow DE, Cederna PS, Hassett CA. Kostrominova TY, Faulkner JA, Dennis RGl. Number
of contractions to maintain mass and force of a denervated rat muscles. Muscle Nerve 2004;
30: 77–86.
34. Kanaya F, Tajima T. Effect of electrostimulation on denervated muscle. Clin. Orthop.
Relat Res. 1992; 283:296-301.
35. Tower S. Trophic control of non-nervous tissue by the nervous system: a study of a
muscle and bone innervated from an isolated and quiescent region of spinal cord. J. Comp.
Neurology 1937; 67: 241-261.
36. Hyatt JPK, et al. Nerve activity-independent regulation of skeletal muscle atrophy: role of
MyoD and myogenin in satellite cells and myonuclei. Am. J of Physiol. Cell Physiol. 2003;
285: 1161-1173.
37. Midrio M. The denervated muscle: facts and hypotheses. A historical review. Eur. J. Appl.
Physiol. 2006; 98: 1-21.
38. Dennis RG, Dow DE, Faulkner JA. An implantable device for stimulation of denervated
muscles in rats. Medical Engineering & Physics 2003; 23: 239–253.
39. Dennis RG, Dow DE. Excitability of skeletal muscle during development, denervation
and tissue culture. Tissue Engineering 2007; 13(10): 2395-2404.
40. Salmons S, et al. Functional electrical stimulation of denervated muscles: basic issues.
Artificial Organs 2004; 29(3): 199-202.
41. Nelson RM, Hayes KW, Currier DP. Eletroterapia clínica. 3ª Ed. São Paulo: Manole;
2003.
42. Mokrusch T, et al. Effects of long-impulse electrical stimulation on atrophy and fiber type
composition of chronically denervated fast rabbit muscle. J Neurol. 1990; 5:134-139.
85
ANEXO D – Normas utilizadas para publicação dos artigos aos periódicos
1. Norma utilizada para a confecção do artigo de Revisão sistemática
REVISTA FISIOTERAPIA EM MOVIMENTO
Forma e preparação dos manuscritos
A Revista Fisioterapia em Movimento recebe artigos das seguintes
categorias:
Artigos Originais: oriundos de resultado de pesquisa de natureza
empírica, experimental ou conceitual, sua estrutura deve conter: Introdução,
Materiais e Métodos, Resultados, Discussão, Conclusão, Referências. O texto deve
ser elaborado com, no máximo, 6.000 palavras e conter até 5 ilustrações.
Artigos de Revisão: oriundos de estudos com delineamento definido e
baseado em pesquisa bibliográfica consistente com análise crítica e considerações
que possam contribuir com o estado da arte (máximo de 8.000 palavras e 5
ilustrações).
Os manuscritos devem ser submetidos pelo site na seção “submissão de artigos”.
Os trabalhos devem ser digitados em Word for Windows, fonte Times New Roman,
tamanho 12, espaçamento entre linhas de 1,5 respeitando o número de palavras de
cada manuscrito, incluindo referências, ilustrações, quadros, tabelas e gráficos. O
número máximo permitido de autores por artigo é seis.
As ilustrações (figuras, gráficos, quadros e tabelas) devem ser limitadas
ao número máximo de cinco (5), inseridas no corpo do texto, identificadas e
numeradas consecutivamente em algarismos arábicos. A arte final, figuras e gráficos
devem estar em formato .tiff. Envio de ilustrações com baixa resolução (menos de
300 DPIs) pode acarretar atraso na aceitação e publicação do artigo.
Os trabalhos podem ser encaminhados em português ou inglês.
Abreviações oficiais poderão ser empregadas somente após uma primeira
menção completa. Deve ser priorizada a linguagem científica.
Deverão constar, no final dos trabalhos, o endereço completo de todos os
autores, afiliação, telefone, fax e e-mail (atualizar sempre que necessário) para
encaminhamento de correspondência pela comissão editorial.
Outras considerações:
• sugere-se acessar um artigo já publicado para verificar a formatação dos
artigos publicados pela revista;• todos os artigos devem ser inéditos e não podem ter
sido submetidos para avaliação simultânea em outros periódicos (anexar carta,
assinada por todos os autores, na qual será declarado tratar-se de artigo inédito,
86
transferindo os direitos autorais e assumindo a responsabilidade sobre aprovação
em comitê de ética, quando for o caso.);
• afirmações, opiniões e conceitos expressados nos artigos são de
responsabilidade dos autores;
• todos os artigos serão submetidos ao Comitê Editorial da revista e, caso
pertinente, à área da Fisioterapia para avaliação dos pares;
• não serão publicadas fotos coloridas, a não ser em caso de absoluta
necessidade e a critério do Comitê Editorial.
No preparo do original, deverá ser observada a seguinte estrutura:
Cabeçalho
Título do artigo em português (LETRAS MAIÚSCULAS em negrito, fonte
Times New Roman, tamanho 14, parágrafo centralizado), subtítulo em letras
minúsculas (exceção para nomes próprios) e em inglês (somente a primeira letra do
título em maiúscula, as demais palavras em letras minúsculas – exceção para
nomes próprios), em itálico, fonte Times New Roman, tamanho 12, parágrafo
centralizado. O título deve conter no máximo 12 palavras, sendo suficientemente
específico e descritivo.
Apresentação dos autores do trabalho
Nome completo, titulação, afiliação institucional (nome da instituição para
a qual trabalha), vínculo (se é docente, professor ou está vinculado a alguma linha
de pesquisa), cidade, estado, país e e-mail.
Resumo estruturado / Structured Abstract
O resumo estruturado deve contemplar os tópicos apresentados na
publicação. Exemplo: Introdução, Desenvolvimento, Materiais e métodos, Discussão,
Resultados, Considerações finais. Deve conter no mínimo 150 e máximo 250
palavras, em português/inglês, fonte Times New Roman, tamanho 11, espaçamento
simples e parágrafo justificado. Na última linha, deverão ser indicados os descritores
(palavras-chave/keywords). Para padronizar os descritores, solicitamos utilizar os
Thesaurus da área de saúde (DeCS) (). O número de descritores desejado é de no
mínimo 3 e no máximo 5, sendo representativos do conteúdo do trabalho.
Corpo do Texto
• Introdução: Deve apontar o propósito do estudo, de maneira concisa, e
descrever quais os avanços que foram alcançados com a pesquisa. A introdução
não deve incluir dados ou conclusões do trabalho em questão.
87
• Materiais e métodos: Deve ofertar, de forma resumida e objetiva,
informações que permitam que o estudo seja replicado por outros pesquisadores.
Referenciar as técnicas padronizadas.
• Resultados: Devem oferecer uma descrição sintética das novas
descobertas, com pouco parecer pessoal.
• Discussão: Interpretar os resultados e relacioná-los aos conhecimentos
existentes, principalmente os que foram indicados anteriormente na introdução. Esta
parte deve ser apresentada separadamente dos resultados.
• Conclusão ou Considerações finais: Devem limitar-se ao propósito das
novas descobertas, relacionando-as ao conhecimento já existente. Utilizar apenas
citações indispensáveis para embasar o estudo.
• Agradecimentos: Sintéticos e concisos, quando houver.
• Referências: Devem ser numeradas consecutivamente na ordem em
que são primeiramente mencionadas no texto.
• Citações: Devem ser apresentadas no texto, tabelas e legendas por
números arábicos entre parênteses.
Exemplos:
“o caso apresentado é exceção quando comparado a relatos da
prevalência das lesões hemangiomatosas no sexo feminino (6, 7)” ou “Segundo
Levy (3), há mitos a respeito dos idosos que precisam ser recuperados”.
Referências
Todas as instruções estão de acordo com o Comitê Internacional de
Editores de Revistas Médicas (Vancouver), incluindo as referências. As informações
encontram-se disponíveis em: (). Recomenda-se fortemente o número mínimo de
referências de 30 para artigos originais e de 40 para artigos de revisão. As
referências deverão originar-se de periódicos que tenham no mínimo o Qualis desta
revista ou equivalente.
Artigos em Revistas
- Até seis autores: Naylor CD, Williams JI, Guyatt G. Structured abstracts
of proposal for clinical and epidemiological studies. J Clin Epidemiol. 1991;44:731-
37.
- Mais de seis autores: Listar os seis primeiros autores seguidos de et al.
Parkin DM, Clayton D, Black RJ, Masuyer E, Friedl HP, Ivanov E, et al Childhood
leukaemia in Europe after Chernobyl: 5 year follow-up. Br J Cancer. 1996;73:1006-
12.
88
- Suplemento de volume: Shen HM, Zhang QF. Risk assessment of nickel
carcinogenicity and occupational lung cancer. Environ Health Perspect. 1994; 102
Suppl 1:275-82.
- Suplemento de número: Payne DK, Sullivan MD, Massie MJ. Women´s
psychological reactions to breast cancer. Semin Oncol. 1996;23(1 Suppl 2):89-97.
- Artigos em formato eletrônico: Al-Balkhi K. Orthodontic treatment
planning: do orthodontists treat to cephalometric norms. J Contemp Dent Pract.
[serial on the internet] 2003 [cited 2003 Nov. 4]. Available from: URL:
www.thejcdp.com.
Livros e monografias
- Livro Berkovitz BKB, Holland GR, Moxham BJ. Color atlas & textbook of
oral anatomy. Chicago:Year Book Medical Publishers; 1978.
- Capítulo de livro: Israel HA. Synovial fluid analysis. In: Merril RG, editor.
Disorders of the temporomandibular joint I: diagnosis and arthroscopy. Philadelphia:
Saunders; 1989. p. 85-92.
- Editor, Compilador como Autor: Norman IJ, Redfern SJ, editors. Mental
health care for elderly people. New York: Churchill Livingstone; 1996.
- Livros/Monografias em CD-ROM: CDI, clinical dermatology illustrated
[monograph on CD-ROM], Reeves JRT, Maibach H. CMEA Multimedia Group,
producers. 2 nd ed. Version 2.0. San Diego: CMEA; 1995.
- Anais de congressos, conferências congêneres: Damante JH, Lara VS,
Ferreira Jr O, Giglio FPM. Valor das informações clínicas e radiográficas no
diagnóstico final. Anais X Congresso Brasileiro de Estomatologia; 1-5 de julho 2002;
Curitiba, Brasil. Curitiba, SOBE; 2002.
Bengtsson S, Solheim BG. Enforcement of data protection, privacy and
security in medical informatics. In: Lun KC, Degoulet P, Piemme TE, Rienhoff O,
editors. MEDINFO 92. Proceedings of the 7th World Congress of Medical
Informatics;1992 Sept 6-10; Geneva, Switzerland. Amsterdam:North-Holland; 1992.
p. 1561-5.
Trabalhos acadêmicos (Teses e Dissertações): Kaplan SJ. Post-hospital
home health care: the elderly´s access and utilization [dissertation]. St. Louis:
Washington Univ.; 1995.
• É importante que, durante a execução do trabalho, o autor consulte a
página da revista online
(http://www.pucpr.br/pesquisa_cientifica/revistas_cientificas.php) e verifique a
apresentação dos artigos publicados, adotando o mesmo formato. Além de revisar
cuidadosamente o trabalho com relação às normas solicitadas: tamanho da fonte em
89
cada item do trabalho, numeração de página, notas em número arábico, a legenda
de tabelas e quadros, formatação da página e dos parágrafos, citação no corpo do
texto e referências conforme solicitado. O português e/ou inglês do trabalho. E, por
fim, se todos os autores citados constam nas Referências e no final do trabalho.
NOTA: Fica a critério da revista a seleção dos artigos que deverão
compor os fascículos, sem nenhuma obrigatoriedade de publicá-los, salvo os
selecionados pelos pares
2. Norma utilizada para confecção do artigo original
REVISTA BRASILEIRA DE FISIOTERAPIA
FORMA E PREPARAÇÃO DOS MANUSCRITOS
A RBF/BJPT aceita, no máximo, 6 (seis) autores em um manuscrito. O manuscrito deve ser escrito preferencialmente em inglês e pode conter até 3.500 palavras (excluindo Resumo/Abstract, Referências, Figuras, Tabelas e Anexos). Estudos de Caso não devem ultrapassar 1.600 palavras, excluindo Resumo/Abstract, Referências, Figuras, Tabelas e Anexos.
Ao submeter um manuscrito para publicação (http://www.scielo.br/rbfis), os autores devem inserir no sistema, todos os dados dos autores e ainda inserir como documento(s) suplementar(es):
1) Carta de encaminhamento do material, contendo as seguintes informações:
a) Nomes completos dos autores;
b) Tipo e área principal do artigo (ver OBJETIVOS, ESCOPO E POLÍTICA);
c) Número e nome da Instituição que emitiu o parecer do Comitê de Ética para pesquisas em seres humanos e para os experimentos em animais. Para as pesquisas em seres humanos, incluir também uma declaração de que foi obtido o Termo de Consentimento dos participantes do estudo;
d) Número de Ensaio Clínico - Conforme descritos em OBJETIVOS, ESCOPO E POLÍTICA, os manuscritos com resultados relativos aos ensaios clínicos deverão apresentar número de identificação, que deverá ser registrado no final do Resumo/Abstract. (Sugestão de site para registro: http://www.anzctr.org.au/Survey/UserQuestion.aspx);
2) Declaração de responsabilidade de conflitos de interesse. Os autores devem declarar a existência ou não de eventuais conflitos de interesse (profissionais, financeiros e benefícios diretos e indiretos) que possam influenciar os resultados da pesquisa;
90
3) Declaração assinada por todos os autores, com o número de CPF, indicando a responsabilidade pelo conteúdo do manuscrito e transferência de direitos autorais (copyright) para a RBF/BJPT, caso o artigo venha a ser aceito pelos Editores.
Os modelos da carta de encaminhamento e das declarações encontram-se disponíveis no site da RBF/BJPT: http://www.rbf-bjpt.org.br.
É de responsabilidade dos autores a eliminação de todas as informações (exceto na página do título e identificação) que possam identificar a origem ou autoria do artigo.
FORMATO DO MANUSCRITO
O manuscrito deve ser elaborado com todas as páginas numeradas consecutivamente na margem superior direita, com início na página de título. Os Artigos Originais devem ser estruturados conforme sequência abaixo:
Página de título e identificação (1ª. página)
A página de identificação deve conter os seguintes dados:
a) Título do manuscrito em letras maiúsculas;
b) Autor: nome e sobrenome de cada autor em letras maiúsculas, sem titulação, seguidos por número sobrescrito (expoente), identificando a afiliação institucional/vínculo (Unidade/ Instituição/ Cidade/ Estado/ País); para mais de um autor, separar por vírgula;
c) Nome e endereço completo. (É de responsabilidade do autor correspondente manter atualizado o endereço e e-mail para contatos);
d) Título para as páginas do artigo: indicar um título curto, em Português e em Inglês, para ser usado no cabeçalho das páginas do artigo, não excedendo 60 caracteres;
e) Palavras-chave: termos de indexação ou palavras-chave (máximo seis), em Português e em Inglês. A RBF/BJPT recomenda o uso do DeCS - Descritores em Ciências da Saúde para consulta aos termos de indexação (palavras-chave) a serem utilizados no artigo <http://decs.bvs.br/>.
Resumo/Abstract
Uma exposição concisa, que não exceda 250 palavras em um único
parágrafo, em português (Resumo) e em Inglês (Abstract) deve ser escrita e
colocada logo após a página de título. Notas de rodapé e abreviações não definidas
não devem ser usadas. Se for preciso citar uma referência, a citação completa deve
91
ser feita dentro do resumo. O Resumo e o Abstract devem ser apresentados em
formato estruturado, incluindo os seguintes itens separadamente: Contextualização
(Background), Objetivos (Objectives), Métodos (Methods), Resultados (Results) e
Conclusões (Conclusions).
Corpo do texto: Introdução, Materiais e Métodos, Resultados e
Discussão
Incluir, em itens destacados:
Introdução: deve informar sobre o objeto investigado e conter os objetivos
da investigação, suas relações com outros trabalhos da área e os motivos que
levaram o(s) autor(es) a empreender a pesquisa.
Materiais e Métodos: descrever de modo a permitir que o trabalho possa
ser inteiramente repetido por outros pesquisadores. Incluir todas as informações
necessárias - ou fazer referências a artigos publicados em outras revistas científicas
- para permitir a replicabilidade dos dados coletados. Recomenda-se fortemente que
estudos de intervenção apresentem grupo controle e, quando possível, aleatorização
da amostra.
Resultados: devem ser apresentados de forma breve e concisa. Tabelas,
Figuras e Anexos podem ser incluídos quando necessários para garantir melhor e
mais efetiva compreensão dos dados.
Discussão: o objetivo da discussão é interpretar os resultados e relacioná-
los aos conhecimentos já existentes e disponíveis, principalmente àqueles que foram
indicados na Introdução do trabalho. As informações dadas anteriormente no texto
podem ser citadas, mas não devem ser repetidas em detalhes na discussão.
Os artigos de Revisão Sistemática e Metanálises devem incluir uma seção
que descreva os métodos empregados para localizar, selecionar, obter, classificar e
sintetizar as informações.
Agradecimentos
Quando apropriados, os agradecimentos poderão ser incluídos, de forma
concisa, no final do texto, antes das Referências Bibliográficas, especificando:
assistências técnicas, subvenções para a pesquisa e bolsa de estudo e colaboração
de pessoas que merecem reconhecimento (aconselhamento e assistência). Os
autores são responsáveis pela obtenção da permissão documentada das pessoas
cujos nomes constam dos Agradecimentos.
Referências Bibliográficas
O número recomendado é de, no mínimo, 50 (cinquenta) referências
bibliográficas para Artigo de Revisão; 30 (trinta) referências bibliográficas para Artigo
92
Original, Metanálise, Revisão Sistemática e Metodológico. Para Estudos de Caso
recomenda-se, no máximo, 10 (dez) referências bibliográficas.
As referências bibliográficas devem ser organizadas em sequência
numérica, de acordo com a ordem em que forem mencionadas pela primeira vez no
texto, seguindo os Requisitos Uniformizados para Manuscritos Submetidos a Jornais
Biomédicos, elaborados pelo Comitê Internacional de Editores de Revistas Médicas -
ICMJE <http://www.icmje.org/index.html>.
Os títulos de periódicos devem ser referidos de forma abreviada, de
acordo com a List of Journals do Index Medicus <http://www.index-medicus.com>.
As revistas não indexadas não deverão ter seus nomes abreviados.
As citações das referências bibliográficas devem ser mencionadas no
texto em números sobrescritos (expoente), sem datas. A exatidão das referências
bibliográficas constantes no manuscrito e a correta citação no texto são de
responsabilidade do(s) autor(es) do manuscrito. (Ver exemplos no site:
<http://www.nlm.nih.gov/bsd/uniform_requirements.html>).
Tabelas, Figuras e Anexos: as Tabelas, Figuras e Anexos são
limitados a 5 (cinco) no total.
-Tabelas: devem incluir apenas os dados imprescindíveis, evitando-se
tabelas muito longas (tamanho máximo permitido: uma página em espaço
duplo), e devem ser numeradas, consecutivamente, com algarismos arábicos e
inseridas no final do texto. Título descritivo e legendas devem torná-las
compreensíveis, sem necessidade de consulta ao texto do artigo. Não devem ser
formatadas com marcadores horizontais nem verticais, apenas necessitam de linhas
horizontais para a separação de suas seções principais. Devem ser usados
parágrafos ou recuos e espaços verticais e horizontais para agrupar os dados.
-Figuras: as Figuras não devem repetir os dados já descritos nas Tabelas.
Todas devem ser citadas e devem ser numeradas, consecutivamente, em arábico,
na ordem em que aparecem no texto. Não é recomendado o uso de cores. As
legendas devem torná-las compreensíveis, sem necessidade de consulta ao texto.
Digitar todas as legendas em espaço duplo e explicar todos os símbolos e
abreviações. Usar letras em caixa-alta (A, B, C, etc.) para identificar as partes
individuais de figuras múltiplas. Se possível, todos os símbolos devem aparecer nas
legendas; entretanto, símbolos para identificação de curvas em um gráfico podem
ser incluídos no corpo de uma figura, desde que isso não dificulte a análise dos
dados.
Em relação à arte final, todas as Figuras devem estar em alta resolução.
Figuras de baixa qualidade podem resultar em atrasos na aceitação e publicação do
artigo.
93
As Tabelas, Figuras e Anexos publicados em outras revistas ou livros
devem conter as respectivas referências e o consentimento, por escrito, do autor ou
editores.
Para artigos submetidos em língua portuguesa, um conjunto adicional em
inglês das Tabelas, Figuras, Anexos e suas respectivas legendas deve ser anexado
como documento suplementar.
Notas de Rodapé
As notas de rodapé do texto, se imprescindíveis, devem ser numeradas
consecutivamente em sobrescrito no manuscrito e escritas em folha separada,
colocada no final do texto.
OUTRAS CONSIDERAÇÕES
Unidades: usar o Sistema Internacional (SI) de unidades métricas para as medidas e abreviações das unidades.
Cartas ao Editor: críticas às matérias publicadas de maneira construtiva, objetiva e educativa; consultas às situações clínicas e discussões de assuntos específicos da Fisioterapia serão publicados a critério dos editores (com até 700 palavras e até 8 referências). Quando a carta se referir a comentários técnicos (réplicas) sobre os artigos publicados na RBF/BJPT, esta será publicada junto com a tréplica dos autores do artigo objeto de análise e/ou crítica.
Estudos de Caso: devem ser restritos às condições de saúde ou métodos/procedimentos incomuns sobre os quais o desenvolvimento de artigo original seja impraticável. Dessa forma, os relatos de casos clínicos não precisam necessariamente seguir a estrutura canônica dos artigos originais, mas devem apresentar um delineamento metodológico que permita a reprodutibilidade das intervenções ou procedimentos relatados. Recomenda-se muito cuidado ao propor generalizações de resultados a partir desses estudos. Desenhos experimentais de caso único serão tratados como artigos originais e devem seguir as normas estabelecidas pela RBF/BJPT.
Estudos de Revisão Sistemática com Metanálise: Devem incluir: a) uma seção que descreva os métodos empregados para localizar, selecionar, obter, classificar e sintetizar as informações, b) número suficiente de artigos, com qualidade metodológica alta (segundo mecanismos próprios de avaliação) de tal forma que seja possível uma análise apropriada sobre o tema de investigação, e c) técnica de metanálise, que integre os resultados dos estudos selecionados, sobre a questão de pesquisa. Manuscritos de revisão sistemática com metanálise que apresentem uma quantidade insuficiente de artigos selecionados e/ou artigos de baixa qualidade, que não utilizem técnica estatística para síntese ponderada dos efeitos dos estudos (metanálise) e que não apresentem uma conclusão assertiva e válida sobre o tema, não serão considerados para análise de revisão por pares.
94
Conflitos de Interesse: os autores são responsáveis pela declaração de qualquer tipo de conflito de interesse na realização da pesquisa, tanto de ordem financeira como de qualquer outra natureza.
O relator deve comunicar aos editores quaisquer conflitos de interesse que possam influenciar a emissão de parecer sobre o manuscrito e, quando couber, deve declarar-se não qualificado para revisá-lo.
Considerações Éticas e Legais: evitar o uso de iniciais, nomes ou números de registros hospitalares dos pacientes. Um paciente não poderá ser identificado em fotografias, exceto com consentimento expresso, por escrito, acompanhando o trabalho original.
Estudos realizados em humanos devem estar de acordo com os padrões éticos e com o devido consentimento livre e esclarecido dos participantes (reporte-se à Resolução 196/96 do Conselho Nacional de Saúde que trata do Código de Ética para Pesquisa em Seres Humanos).
Para os experimentos em animais, considerar as diretrizes internacionais (por exemplo, a do Committee for Research and Ethical Issues of the International Association for the Study of Pain, publicada em PAIN, 16:109-110, 1983).
Para as pesquisas em humanos e em animais, deve-se incluir, no manuscrito, o número do Parecer da aprovação das mesmas pela Comissão de Ética em Pesquisa, que deve ser devidamente registrado no Conselho Nacional de Saúde do Hospital ou Universidade ou no mais próximo de sua região.
A RBF/BJPT reserva-se o direito de não publicar trabalhos que não obedeçam às normas legais e éticas para pesquisas em seres humanos e para os experimentos em animais.
É recomendável que estudos relatando resultados eletromiográficos sigam os "Standards for Reporting EMG Data", recomendados pela ISEK.
CONSIDERAÇÕES FINAIS
Se o artigo for encaminhado aos autores para revisão e não retornar à RBF/BJPT dentro de 6 (seis) semanas, o processo de revisão será considerado encerrado. Caso o mesmo artigo seja reencaminhado, um novo processo será iniciado, com data atualizada. A data do aceite será registrada quando os autores retornarem o manuscrito após a correção final aceita pelos Editores.
As provas finais serão enviadas aos autores por e-mail, no endereço indicado na submissão, para revisão final (dúvidas e/ou discordâncias de revisão), não sendo permitidas quaisquer outras alterações. Manuscrito em prova final não devolvido em 48 horas poderá, a critério dos editores, ser publicado na forma em que se apresenta ou ter sua publicação postergada para um próximo número.
Após publicação do artigo ou processo de revisão encerrado, toda documentação referente ao processo de revisão será incinerada.