UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE ... · Figura 1 Níveis de energia relativa e...
Transcript of UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE ... · Figura 1 Níveis de energia relativa e...

UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTECENTRO DE CIÊNCIAS EXATAS E DA TERRA
INSTITUTO DE QUÍMICAPROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA
Síntese e propriedades fotofísicas de LOFs mistas
Jarley Fagner Silva do NascimentoTese de Doutorado
Natal/RN, agosto de 2017

JARLEY FAGNER SILVA DO NASCIMENTO
SÍNTESE E PROPRIEDADES FOTOFÍSICAS DE LOFs MISTAS
Tese apresentada ao programa de pós-graduação em Química da
Universidade Federal do Rio Grande do Norte, como requisito
parcial para obtenção do título de Doutor.
Orientador: Prof. Dr. Bráulio Silva Barros.
Co-orientadora: Profa. Dra. Joanna Elzbieta Kulesza
Natal/RN
2017

Universidade Federal do Rio Grande do Norte – UFRNSistema de Bibliotecas – SISBI
Catalogação da Publicação na Fonte - Biblioteca Central Zila MamedeNascimento, Jarley Fagner Silva do.
Síntese e propriedades fotofísicas de LOFs mistas / Jarley Fagner Silvado Nascimento. - 2017.
103 f. : il.
Tese (doutorado) - Universidade Federal do Rio Grande do Norte,Centro de Ciências Exatas e da Terra - Instituto de Química, Programa dePós-Graduação em Química. Natal, RN, 2017.
Orientador: Prof. Dr. Bráulio Silva Barros.Coorientadora: Prof.ª Dr.ª Joanna Elzbieta Kulesza.
1. Lantanídeos – Tese. 2. MLOFs – Tese. 3. Efeito antena – Tese. 4.Fotoluminescência sintonizável – Tese. 4. Redes metalorgânicas – Tese. I.Barros, Bráulio Silva. II. Kulesza, Joanna Elzbieta.
RN/UF/BCZM CDU 546.650


Dedico este trabalho a
companheira de todos os
momentos, Alian Paiva de
Arruda do Nascimento e aos
meus pequenos, Pedro e Igor.

AGRADECIMENTOS
Inicialmente, gostaria de agradecer aos meus Pais, Jario Antonio do Nascimento e Maria
do Socorro Silva do Nascimento, por terem me dado a melhor educação dentro de suas
possibilidades, a minha irmã Suzany Nascimento pelo carinho de sempre, e a minha avó
Maria Rodrigues Silva por ser fundamental na minha criação;
Ao meu tio e sebista Abimael Silva, por ter fornecido praticamente todos os livros para
que eu pudesse cursar a educação básica;
A Rebecca Paiva e ao Hotel do Bebê por cuidar do pequeno Pedro e proporcionar
momentos de ócio que foram fundamentais para a escrita desse trabalho;
Aos amigos da graduação e pós-graduação que fiz na UFRN;
Aos componentes dos grupos de pesquisa SupraMMAT e LAMMEN, por
proporcionarem um ambiente saudável para o desenvolvimento deste trabalho em
especial Antônio Marcos;
Ao Professor Dr. João Bosco Lucena de Oliveira pelas orientações;
Ao departamento de Química fundamental da UFPE e ao MatLan por realizar as análises
necessárias para a consolidação dessa tese;
Ao CNPQ por ter fomentado o grupo de pesquisa;
Ao estado brasileiro por ter investido na minha formação ao longo desses mais de 10 anos
e ao IFRN pelo incentivo a qualificação;
Em especial aos meus orientadores, Bráulio Silva Barros e Joanna Kulesza, por sua
dedicação, disponibilidade e vontade de compartilhar conhecimento, sendo capazes de
direcionar de forma irretocável os caminhos que tive que trilhar para desenvolver essa
Tese. Posso dizer que para mim é um privilégio participar como um dos autores desse
trabalho;
Por fim, a força maior que rege toda a aleatoriedade desse nosso universo que permitiu
que “os bons ventos soprassem ao meu favor”.
Obrigado a todos!

“Há homens que lutam um dia e são bons, há
outros que lutam um ano e são melhores, há os que
lutam muitos anos e são muito bons, mas há os que
lutam toda a vida e estes são imprescindíveis.”
Bertolt Brecht

RESUMO
Neste trabalho, foi sintetizada uma série de redes metalorgânicas mistas a base de íons
lantanídeos (MLOFs) pelo método solvotérmico, utilizando como componente orgânico
o ácido tereftálico (1,4-H2BDC). Inicialmente foram preparadas três matrizes contendo
gadolínio dopadas com 5% molar de íons Eu3+ (Eu/Gd-1,4-BDC). Esta etapa teve como
foco o estudo dos efeitos do tempo de síntese (3, 5 e 7 dias) sobre as propriedades
morfológicas e luminescentes das MLOFs. Tal estudo se torna essencial, já que com o
aumento da cristalinidade da rede, normalmente verifica-se uma diminuição dos canais
de relaxação não radioativos. Posteriormente, foram sintetizadas matrizes com diferentes
percentuais molares de Eu3+ (1, 3, 5, 7 e 9%) com o intuito de determinar a concentração
limite do dopante, assim como investigar o efeito de tal variação percentual, no
crescimento das redes e propriedades fotofísicas. Por fim, uma amostra co-dopada com
2,5% molar de Tb3+ e Eu3+ (Gd/Tb/Eu-1,4-BDC) foi preparada e suas propriedades
luminescentes sintonizáveis estudadas. Os materiais sintetizados na forma de pó, foram
caracterizadas por Difração de raios-X (DRX), Espectroscopia na região do
Infravermelho com Transformada de Fourier por Refletância Total Atenuada (FTIR-
ATR), Microscopia Eletrônica de Varredura (MEV), Análise termogravimétrica (TGA) e
Fotoluminescência (PL). Todas as amostras apresentaram elevada estabilidade térmica, e
o aumento do tempo de síntese teve significativa influência sobre a morfologia dos
cristais. Com base nas análises de DRX, FTIR e PL, identificou-se que a partir de 7%
molar de íons európio uma segunda fase cristalina começa a se formar. Além disso,
observou-se a partir dos espectros de excitação e emissão que ocorreu uma efetiva
transferência de energia intramolecular entre o ligante e os níveis do Eu3+, gerando
luminescência vermelha característica deste íon. Estas amostras apresentaram linhas de
emissão características do Eu3+ atribuídas as transições 5D0 → 7F0, 7F1,
7F2, 7F3 e 7F4. A
amostra co-dopada apresentou eficiente sintonização de cor oriunda da transferência de
energia entre Tb3+ → Eu3+. Nenhum mecanismo de transferência de energia no sentido
inverso foi identificado. Portanto, os materiais descritos são promissores para diversas
aplicações ópticas.
Palavras chave: MLOFs; efeito antena; fotoluminescência sintonizável, Lantanídeos.

ABSTRACT
In this work a series of new metal-organic frameworks containing lanthanide ions
(LOFs) was synthesized by a solvothermal method at 180 0C, using terephthalic acid (1,4-
H2BDC) as an organic component. Initially, three samples containing gadolinium doped
with 5 mol% Eu3+ ions were prepared (Eu/Gd-1,4-BDC-MOFs). The objective of this part
of the work was to study the effect of synthesis time (3, 5 and 7 days) on the
morphological and luminescent properties of these materials. This study is essential
because it is well known that the increase in crystallinity may lead to the decrease in
reticular vibrations and, consequently, a decrease of nonradioactive relaxation channels.
Subsequently, samples with different Eu3+ molar percentages (1, 3, 5, 7 and 9%) were
synthesized to investigate the effect of the dopant content on the structure and
photophysical properties of the LOFs. Finally, a sample co-doped with 2.5 mol% of Tb3+
and Eu3+ (Gd/Tb/Eu-1,4-BDC-MOF) was prepared and its tunable luminescent properties
studied. The samples in powder form, were characterized by X-ray Diffraction (PXRD),
Attenuated total reflectance Fourier transform infrared spectroscopy (FTIR-ATR),
Scanning Electronic Microscopy (SEM), Thermogravimetric Analysis (TGA) and
Photoluminescence (PL). Based on the analyzes of DXRP, FTIR and PL, it was identified
that materials containing up to 7 mol% of europium ions presented a single-phase. In
addition, it was observed from the excitation and emission spectra that an effective
intramolecular energy transfer occurred between the ligand and the Eu3+ levels,
generating characteristic red luminescence of this ion. These samples emission spectra
exhibited characteristic emission lines of the Eu3+ ion ascribed to the 5D0 → 7F0, 7F1,
7F2,
7F3 and 7F4 transitions. The co-doped sample presented efficient luminescent tuning
resulting from the transfer of energy between Tb3+ → Eu3+. Therefore, the described
materials are promising for various optical applications.
Key Words: LOFs; antenna effect; photoluminescence; tunable luminescence.

LISTA DE FIGURAS
Figura 1 Níveis de energia relativa e diferentes configurações eletrônicas 4f n6s2 ou 4f n−15d16s2 de átomos de lantanídeos neutros.........................
24
Figura 2 Funções das distribuições radiais dos elétrons do Európio 4f, 5s, 5p,
5d, 6s e 6p...........................................................................................
26
Figura 3 Relação entre raio iônico e número atômico de íons lantanídicos....... 27
Figura 4 O diagrama dos níveis de energia dos íons lantanídeos trivalentes... 28
Figura 5 Similaridade de cores entre íons com configuração eletrônica 4fn e
4f14-n................................................................................................... 32
Figura 6 Três possíveis mecanismos para explicar a transferência de energia
intramolecular.................................................................................... 35
Figura 7 Ilustração do mecanismo do efeito antena......................................... 36
Figura 8 Estado de valência das terras raras..................................................... 39
Figura 9 (a) Geometria antiprisma quadrada, (b) Prisma trigonal
triencapuzado..................................................................................... 41
Figura 10 Esquema ilustrativo dos blocos de construção utilizados para formar
polímeros de coordenação.................................................................. 43
Figura 11 Representação da estrutura do ácido tereftálico. Os elementos
químicos constituintes estão representados por esferas de diferentes
cores...................................................................................................
44
Figura 12 Possíveis modos de coordenação do ácido tereftálico com íons
terras raras..........................................................................................
45
Figura 13 Algumas topologias de polímeros de coordenação............................ 47
Figura 14 Representação da síntese das LOFs................................................... 59
Figura 15 PXRD patterns of the synthesized Eu/Gd-MOF samples (prepared
within different synthesis time - 3, 5 and 7 days) and of the pure Gd-
MOF matrix, in comparison with the simulated from single crystal
data PXRD patterns of Eu2(BDC)3(DMF)2(H2O) and
Eu2(BDC)3(DMF)2(H2O).DMF…………………………………….. 66
Figura 16
Coordination environment of Eu3+ dimer in the crystal structure of
Gd/Eu-MOF samples. Hydrogen atoms are omitted for clarity. Color
code: gray (carbon), red (oxygen) and green (gadolinium or
europium)…………………………………………………………...
67
Figura 17 Projection along the c axis of the partially expanded net structure of
Gd/Eu-MOF samples. Hydrogen atoms and DMF molecules are
omitted for clarity. Polyhedra in yellow represent the lanthanide
sites…………………………………………………………………. 67
Figura 18 FTIR spectra of the prepared Gd/Eu-MOF samples, the pure 1,4 –
H2BDC, and DMF…………………………………………………..
69
Figura 19 TGA profiles of samples Gd/Eu-MOFs……………………………. 70
Figura 20 SEM images of samples Gd/Eu-MOFs…………………………….. 71
Figura 21 Excitation spectra of samples Gd/Eu-MOFs measured at room
temperature by monitoring the Eu3+ emission at 614 nm…………..
73
Figura 22 Emission spectra of samples Gd/Eu-MOFs acquired at room
temperature upon excitation at (a) 323 nm and (b) 395 nm………...
74

Figura 23 Luminescence decay emission curves obtained at room temperature
upon excitation at 323 and 395 nm of samples Gd/Eu-MOFs. The
inset table shows the values of decay lifetimes……………………...
75
Figura 24 X-ray powder diffraction pattern of the synthesized MLOF samples
in comparison with the simulated from single crystal data PXRD
patterns of Eu2(BDC)3(DMF)2(H2O).DMF <MLOF1> and
Eu2(BDC)3(DMF)2(H2O)2 <MLOF2>……………………………...
83
Figura 25 (a) Projection along the c axis of the partially expanded net structure
and (b) coordination environment of Eu3+ dimer in the crystal
structure of MLOF1 with both coordinated and non-coordinated
DMF molecules. (c) View of lattice plane (01-1) displaying the non-
coordinated DMF molecules and (d) simulated PXRD pattern of
MLOF1 without non-coordinated DMF molecules. Color code:
black (carbon), red (oxygen), blue (nitrogen), grey (hydrogen) and
green (gadolinium or europium). Polyhedra in yellow represent the
lanthanide sites……………………………………………………...
85
Figura 26 Absorption spectra in the infrared region for 1,4 – H2BDC and
MLOF samples. …………………………………………………….
86
Figura 27 SEM images of the powder of MLOF samples…………………… 87
Figura 28 Excitation spectra of the samples MLOF_Eu1%-MLOF_Eu9%
measured at room temperature by monitoring the Eu3+ emission at
614 nm………………………………………………………………
88
Figura 29 Emission spectra of the samples MLOF_Eu1%-MLOF_Eu9%
acquired at room temperature upon excitation at (a) 395 nm and (c)
325 nm. Decay emission curves obtained at 298 K upon excitation
of the samples MLOF_Eu1%-MLOF_Eu9% at (b) 394 nm and (d)
325 nm………………………………………………………………
90
Figura 30 (a-b) Emission spectra of the sample MLOF_Eu9% recorded at
room temperature upon excitation at 280, 298, 325 and 394 nm and
(c) excitation spectra of the sample MLOF_Eu9% obtained by
monitoring the emission at 614 and 618 nm…………………………
92
Figura 31 (a) Emission spectra of MLOF_EuTb acquired at room temperature
upon excitation at 265, 300, 323, 378, 395 and 464 nm (b) CIE
diagram points of MLOF_EuTb for different excitation
wavelengths…………………………………………………………
93
Figura 32 Schematic representation of photophysical processes in doped
samples (antenna effect). A = absorption, S1 = singlet state, IC =
Internal conversion, ISC = intersystem crossing, T1 = triplet state,
ET = transfer energy………………………………………………...
95

LISTA DE TABELAS
Tabela 1 Configuração eletrônica dos lantanídeos............................................ 23
Tabela 2 Potencial padrão de redução dos íons terras raras............................... 36
Tabela 3 Reagentes utilizados na
síntese........................................................................................................... 54
Tabela 4 Lifetime for the samples MLOF_Eu1%, MLOF_Eu3%,
MLOF_Eu5%, MLOF_Eu7% and MLOF_Eu9%..............................
89

LISTA DE ABREVIATURA E SIGLAS
BDC Benzenodicarboxílico
CIS Cruzamento intersistemas
DE Dipolo Elétrico
DM Dipolo Magnético
DMF Dimetilformamida
DRX Difração de raios-X
FTIR- ATR Espectroscopia no Infravermelho com Transformada de Fourier por
R Reflectância total atenuada
IUCr União Internacional de Cristalografia
IUPAC União internacional de Química pura e aplicada
Ln Lantanídeos
LOFs Lanthanide Metal-Organic Frameworks
MEV Microscopia eletrônica de varredura
MOFs Metal-Organic Framework
PL Fotoluminescência
S1 Estado Singleto
SBU Unidade de construção secundária
T1 Estado Tripleto
TGA Análise termogravimétrica
TR Terra raras
UV Ultravioleta

SUMÁRIO
1 INTRODUÇÃO......................................................................................................... 16
1.1 Objetivo geral............................................................................................................ 17
1.2 Objetivos específicos................................................................................................. 17
1.3 Referências................................................................................................................ 18
2 REVISÃO BIBLIOGRÁFICA................................................................................ 20
2.1 Terras Raras.............................................................................................................. 21
2.1.1 Configuração eletrônica dos lantanídeos no estado fundamental............................... 21
2.1.2 Contração lantanídica.................................................................................................. 23
2.1.3 Especificidade e propriedades fotofísicas dos
Lantanídeos................................................................................................................. 25
2.1.3.1 Regras de seleção do espectro atômico........................................................................ 26
2.1.3.2 Interação spin-órbita.................................................................................................. 28
2.1.3.3 Efeito Stark e os íons lantanídeos............................................................................... 28
2.1.4 Espectros de absorção................................................................................................. 28
2.1.5 Tempo de vida............................................................................................................. 30
2.1.6 Espectro de emissão e luminescência de compostos terras raras................................. 31
2.1.7 Efeito antena (sensibilização luminescente) ............................................................... 32
2.1.8 Compostos de Gd3+: Paramagnetismo......................................................................... 35
2.1.9 Especificidades da Química de coordenação dos íons terras raras.......................... 36
2.1.9.1 Estado de valência dos elementos terras raras........................................................... 36
2.1.9.2 Ligações químicas dos elementos terras raras........................................................... 37
2.1.9.3 Número de coordenação dos complexos terras raras................................................. 38
2.2 Polímeros de coordenação........................................................................................ 39
2.2.1 Breve Histórico........................................................................................................... 39
2.2.2 Redes Metalorgânicas a base de íons lantanídeos (LOFs) .......................................... 40
2.2.3 Aspectos topológicos e morfológicos das redes metalorgânicas ................................. 44
2.2.4 Métodos de Síntese ..................................................................................................... 46
2.3 Referências ............................................................................................................... 48
3 MATERIAIS E MÉTODOS.................................................................................... 55
3.1 Materiais e reagentes................................................................................................ 56

3.2 Síntese das Gd-1,4-BDC dopadas com Eu3+............................................................ 56
3.2.1 Estudo do tempo de síntese.......................................................................................... 56
3.2.2 Estudo da variação da concentração do dopante.......................................................... 57
3.3 Síntese da Gd-1,4-BDC co-dopada com Eu3+ e Tb3+.............................................. 57
3.4 Técnicas de caracterização....................................................................................... 57
3.4.1 Difração de Raios-X (DRX)........................................................................................ 57
3.4.2 Espectroscopia no Infravermelho com Transformada de Fourier por Reflectância
Total Atenuada (FTIR)................................................................................................ 57
3.4.3 Análise termogravimétrica (TGA).............................................................................. 58
3.4.4 Microscopia eletrônica de varredura (MEV)............................................................... 58
3.4.5 Espectroscopia de fotoluminescência......................................................................... 58
4 RESULTADOS E DISCUSSÃO………………………………………………….. 59
4.1 Influence of synthesis time on the photophysical and morphological
properties of Gd-MOFs doped with Eu3+ ……………………………………….. 60
4.1.1 Abstract..................................................................................................................... 60
4.1.2 Introduction.............................................................................................................. 61
4.1.3 Experimental section................................................................................................ 62
4.1.3.1 Materials and methods............................................................................................... 62
4.1.3.2 Synthesis of Eu-doped Gd-MOFs................................................................................ 62
4.1.3.3 Sample characterizations............................................................................................ 62
4.1.4 Results and discussion.............................................................................................. 63
4.1.4.1 Sample characterization............................................................................................. 63
4.1.4.2 Photophysical properties............................................................................................ 69
4.1.5 Conclusions ………………………………………………………………............... 73
4.1.6 Acknowledgments ………………………………………………………………… 74
4.1.7 References ………………………………………………………………………… 74
4.2 Photoluminescence in Mixed Lanthanide-Organic Frameworks: effect of the
Eu3+ content and co-doping with Tb3+……………………………………………. 77
4.2.1 Abstract…………………………………………………………………………….. 77
4.2.2 Introduction………………………………………………………........................... 78
4.2.3 Experimental section………………………………………………………………. 79
4.2.3.1 Materials and methods……………………………………………………………………... 79
4.2.3.2 Synthesis of Eu-doped Gd-1,4-BDC……………………………………………………… 79
4.2.3.3 Synthesis of Eu/Tb-co-doped Gd-1,4-BDC……………………………………………… 79
4.2.3.4 Sample characterizations…………………………………………………………………... 79

4.2.4 Results and discussion…………………………………………………………….. 80
4.2.5 Conclusions……………………………………………………………………….... 94
4.2.6 Acknowledgments…………………………………………………………………. 95
4.2.7 References………………………………………………………………………….. 95
4.2.8 Supplementary information………………………………………………............. 98
5 CONCLUSÕES GERAIS ........................................................................................ 101
6 TRABALHOS REALIZADOS E PERSPECTIVAS……………………………. 102
6.1 Trabalhos consolidados durante a tese .................................................................. 103
6.2 Trabalhos futuros .................................................................................................... 103

P á g i n a | 15
Capítulo 1
Introdução Este capítulo traz um panorama geral sobre o que foi abordado neste trabalho, além dos
objetivos do mesmo.

P á g i n a | 16
1. Introdução
As redes metalorgânicas (Metal-Organic Frameworks - MOFs) são classificadas
como materiais híbridos porosos, contendo clusters metálicos conectados através de
ligantes orgânicos multidentados [1, 2]. Devido a sua cristalinidade bem definida, elevada
estabilidade, singularidade na obtenção de diferentes estruturas químicas e vasta gama de
possíveis aplicações, esses materiais tornaram-se uma importante alternativa no campo
de interação, entre a química sintética e a ciência de materiais [3, 4].
Devido às propriedades luminescentes únicas dos íons lantanídeos e à porosidade
inerente das MOFs, Redes metal-orgânicas contendo íons lantanídeos (Lanthanide Metal-
organic framework – LOFs), tem se apresentado como materiais híbridos relevantes nas
últimas duas décadas. Esses novos materiais têm potencial para uma vasta gama de
aplicações como, sensores [1, 5, 6], agentes de contraste de imagens [7], catalisadores [8],
carreamento de fármacos [9, 10] e marcadores de resíduos de pólvoras [11, 12].
Entre inúmeros ligantes utilizados na obtenção das LOFs, os ácidos carboxílicos
aromáticos desempenham um papel proeminente, uma vez que aumentam a robustez e a
porosidade da rede [13]. Desse modo o ácido tereftálico (1,4 – H2BDC) pode ser
considerado um ligante orgânico ideal, pois seu anel é substituído de forma simétrica, o
que proporciona o crescimento da rede de forma homogênea. Desta forma, o ligante atua
como ponte entre os centros metálicos amparando diferentes modos de coordenação,
originando estruturas uni, bi ou tridimensionais [14, 15].
Reportaremos nesta tese, a síntese, caracterização e investigações acerca das
propriedades fotoluminescentes de Gd-1,4-BDC dopadas com Eu3+ (Gd/Eu-1,4-BDC) e
codopadas com Eu3+ e Tb3+ (Gd/Tb/Eu-1,4-BDC). Discutiremos, como o efeito
paramagnético provocado pela presença de íon Gd3+ na matriz pode tornar o ligante
tereftalato uma boa antena para o íon Eu3+, o que é uma versão inovadora com relação ao
que está apresentado na literatura [16]. Investigou-se ainda, a influência da concentração
do dopante Eu3+ nas propriedades fotofísicas de Gd/Eu-1,4-BDC, além da sintonização
de cores promovida a partir da variação do comprimento de onda de excitação na amostra
co-dopada Gd/Tb/Eu-1,4-BDC.

P á g i n a | 17
1.1 Objetivo geral
Sintetizar e estudar as propriedades morfológicas, estruturais e fotofisicas das
Redes Mistas Lantanídeo-Orgânicas obtidas pelo método solvotérmico.
1.2 Objetivos específicos
Avaliar se a presença do íon Gd3+ na matriz é capaz de tornar o BDC uma boa
“antena” para os íons Eu3+;
Sintetizar e caracterizar as redes de coordenação, com os íons Gd3+ e Eu3+, em
diferentes tempos de síntese (3, 5 e 7 dias), e avaliar a influência deste parâmetro
na microestrutura e propriedades fotofísicas das amostras;
Investigar a influência da dopagem (1, 3, 5, 7 e 9% molar do íon Eu3+) e co-
dopagem (2,5% molar dos íons Eu3+ e Tb3+), nas propriedades estruturais e
fotoluminescentes das redes de coordenação estudadas neste trabalho.

P á g i n a | 18
1.3 Referências
[1] CHEN, Banglin et al. A luminescent metal–organic framework with Lewis basic
pyridyl sites for the sensing of metal ions. Angewandte Chemie International Edition,
v. 48, n. 3, p. 500-503, 2009.
[2] CORMA, A.; GARCIA, Hi; LLABRÉS I XAMENA, F. X. Engineering metal organic
frameworks for heterogeneous catalysis. Chemical Reviews, v. 110, n. 8, p. 4606-4655,
2010.
[3] PAPAEFSTATHIOU, Giannis S.; MACGILLIVRAY, Leonard R. Inverted metal–
organic frameworks: solid-state hosts with modular functionality. Coordination
chemistry reviews, v. 246, n. 1, p. 169-184, 2003.
[4] BIAN, Zuqiang; HUANG, Chunhui. Electroluminescence Based on Lanthanide
Complexes. Rare Earth Coordination Chemistry: Fundamentals and Applications,
p. 435-472, 2010.
[5] HARBUZARU, Bogdan V. et al. Metal–organic nanoporous structures with
anisotropic photoluminescence and magnetic properties and their use as
sensors. Angewandte Chemie International Edition, v. 47, n. 6, p. 1080-1083, 2008.
[6] PELLÉ, Fabienne et al. Interactions between Eu 3+ ions in inorganic–organic hybrid
materials. Journal of Solid State Chemistry, v. 183, n. 4, p. 795-802, 2010.
[7] TAYLOR, Kathryn ML; JIN, Athena; LIN, Wenbin. Surfactant‐Assisted Synthesis of
Nanoscale Gadolinium Metal–Organic Frameworks for Potential Multimodal
Imaging. Angewandte Chemie, v. 120, n. 40, p. 7836-7839, 2008.
[8] LEE, JeongYong et al. Metal–organic framework materials as catalysts. Chemical
Society Reviews, v. 38, n. 5, p. 1450-1459, 2009.
[9] SUN, Chun-Yi et al. Metal-organic frameworks as potential drug delivery
systems. Expert opinion on drug delivery, v. 10, n. 1, p. 89-101, 2013.
[10] BARROS, Bráulio Silva et al. Thermostability and photophysical properties of
mixed-ligand carboxylate/benzimidazole Zn (II)-coordination polymers. Materials
Chemistry and Physics, v. 162, p. 364-371, 2015.
[11] WEBER, Ingrid Távora et al. High photoluminescent metal–organic frameworks as
optical markers for the identification of gunshot residues. Analytical chemistry, v. 83,
n. 12, p. 4720-4723, 2011.
[12] WEBER, Ingrid T. et al. Up-conversion properties of lanthanide-organic frameworks
and how to track ammunitions using these materials. Rsc Advances, v. 2, n. 7, p. 3083-
3087, 2012.
[13] PAZ, Filipe A. Almeida et al. Ligand design for functional metal–organic
frameworks. Chemical Society Reviews, v. 41, n. 3, p. 1088-1110, 2012.
[14] LIN, Zhuojia et al. A novel non-centrosymmetric metallophosphate-borate
compound via ionothermal synthesis. Dalton Transactions, n. 27, p. 5287-5289, 2009.

P á g i n a | 19
[15] HILDER, Matthias et al. Spectroscopic properties of lanthanoid benzene
carboxylates in the solid state: Part 1. Journal of Photochemistry and Photobiology A:
Chemistry, v. 202, n. 1, p. 10-20, 2009.
[16] DECADT, Roel et al. Synthesis, crystal structures, and luminescence properties of
carboxylate based rare-earth coordination polymers. Inorganic chemistry, v. 51, n. 21,
p. 11623-11634, 2012.

P á g i n a | 20
Capítulo 2
Revisão bibliográfica Abordamos neste capítulo desde os conceitos fundamentais, até as características
estruturais das redes de coordenação.

P á g i n a | 21
2 REVISÃO BIBLIOGRÁFICA
2.1 Terras Raras
A história das Terras Raras (TR) tem início em 1787 quando o tenente e
mineralogista sueco Carl Axel Arrhenius, descobre um novo mineral [1], denominado
posteriormente de “ytterbite”. Tempos depois, o professor Johan Gadolin consegue isolar
o elemento químico ítrio, a partir desse mineral. Em seguida, os demais elementos
pertencentes à classe das terras raras foram identificados. Dentre eles, destacam-se a série
dos lantanídeos (Ln), a qual compreende os elementos químicos do lantânio (La) ao
lutécio (Lu) [1, 2]. Apesar da maioria destes materiais apresentarem características
peculiares tais como, luminescência, longos tempos de vida, bandas de emissão finas e
bem definidas, alta reatividade e propriedades magnéticas [3], somente nas últimas
décadas esses elementos químicos ganharam destaque.
Os Elementos denominados como TR, possuem número atômico entre 57 e 71.
Entre eles temos o lantânio, cério, praseodímio, neodímio, promécio, samário, európio,
gadolínio, térbio, disprósio, hólmio, érbio, túlio, itérbio, lutécio. Com a inclusão do
escândio e do Ítrio, que são do mesmo subgrupo chegamos a um total de 17 elementos
relacionados as TR. A comissão de Nomenclatura em Química Inorgânica da IUPAC
(International Union of Pure and Applied Chemistry) recomenda o uso da expressão
“Metais das terras-raras” para estes elementos.
As propriedades exibidas pelos lantanídeos estão diretamente relacionadas com a
redistribuição eletrônica dos elétrons na subcamada 4f, que é o mecanismo que rege
grande parte das transições eletrônicas dos íons lantanídeos trivalentes (Ln3+). Todos os
íons lantanídeos, exceto o lantânio (La) e lutécio (Lu), que possuem orbitais 4f sem e com
14 elétrons respectivamente, são luminescentes devido às transições f-f ocorridas nessa
subcamada [3].
2.1.1 Configuração eletrônica dos lantanídeos no estado fundamental
A configuração eletrônica dos lantanídeos no estado fundamental é determinada
pelo número quântico principal n, e pelo número quântico secundário l. Segundo o estado
de menor energia os dois tipos de configurações eletrônicas adotadas para os lantanídeos
são, [Xe]4fn 6s2 e [Xe]4f n−15d16s2, onde o n representa um número entre 1 e 14 [4].
Escândio e ítrio não possuem elétrons 4f, mas possuem propriedades químicas similares
aos lantanídeos, seus elétrons mais externos possuem configuração (n−1) d1ns2. Por esta

P á g i n a | 22
razão estes são considerados lantanídeos. Estes elementos adotam a configuração
[Xe]4fn6s2 ou [Xe]4fn−15d16s2 dependendo do nível de energia relativa dessas duas
configurações eletrônicas. A Fig. 1 mostra o nível de energia relativa dos lantanídeos
neutros nas configurações eletrônicas 4fn6s2 e 4fn−15d16s2 [4].
Figura 1 - Níveis de energia relativa e diferentes configurações eletrônicas 4f n6s2 ou
4f n−15d16s2 de átomos de lantanídeos neutros.
Fonte: Huang e Bian [4].
Para lantânio, gadolínio e cério a configuração [Xe]4fn−15d16s2 é de mais baixa
energia do que a configuração [Xe]4fn6s2, portanto a primeira será a forma de
configuração adotada. Para o térbio as duas configurações [Xe]4f96s2 e [Xe]4f85d16s2 são
energeticamente próximas e o térbio pode adotar qualquer uma das duas [4]. O lutécio
possui 14 elétrons 4f, portanto possui apenas uma possível configuração [Xe]4f 145d16s2.
Todos os outros elementos têm configuração [Xe]4fn6s2. Todas as configurações
eletrônicas dos lantanídeos estão resumidas na Tabela 1 [4].

P á g i n a | 23
Tabela 1 - Configuração eletrônica dos lantanídeos
Z Elemento Configuração eletrônica do átomo
neutro
Configuração do íon
Ln3+
57 Ln [Xe]5d16s2 [Xe]4f0
58 Ce [Xe]4f15d16s2 [Xe]4f1
59 Pr [Xe]4f36s2 [Xe]4f2
60 Nd [Xe]4f46s2 [Xe]4f3
61 Pm [Xe]4f56s2 [Xe]4f4
62 Sm [Xe]4f66s2 [Xe]4f5
63 Eu [Xe]4f76s2 [Xe]4f6
64 Gd [Xe]4f75d16s2 [Xe]4f7
65 Tb [Xe]4f96s2 [Xe]4f8
66 Dy [Xe]4f106s2 [Xe]4f9
67 Ho [Xe]4f116s2 [Xe]4f10
68 Er [Xe]4f126s2 [Xe]4f11
69 Tm [Xe]4f136s2 [Xe]4f12
70 Yb [Xe]4f146s2 [Xe]4f13
71 Lu [Xe]4f145d16s2 [Xe]4f14
Fonte: Adaptado Huang e Bian [4].
2.1.2 Contração lantanídica
Para átomos com muitos elétrons a diminuição do raio atômico é acarretada por um
aumento da carga nuclear, que é parcialmente compensada pela repulsão eletrostática
entre os elétrons. Os efeitos de blindagem originados pelos elétrons mais internos
decrescem na seguinte sequencia: s > p > d > f [4]. Para os lantanídeos o aumento do
número atômico acarreta em um elétron adicional que não é computado à camada mais
externa (quinta camada), mas sim a camada anterior no subnível 4f (Tabela 1). A Fig. 2
mostra as funções de distribuição radial dos elétrons 4f, 5s, 5p, 5d, 6s e elétrons 6p para
o Eu3+. Tal fenômeno se torna importante para a compreensão de como o orbital 4f está
protegido do ambiente químico pelos orbitais 5s e 5p [4-6]
As nuvens eletrônicas dos elétrons 4f de átomos neutros não são difusivas e os íons
lantanídeos trivalentes promovem uma maior blindagem dos elétrons 4f, mas que mesmo
assim é ainda menor que a unidade [4]. Entretanto o aumento do número atômico aumenta
a atração efetiva entre núcleo e elétrons mais externos. O aumento da atração provoca
Probabilidade de um elétron ser encontrado numa dada distância do núcleo independentemente da direção.

P á g i n a | 24
uma diminuição no raio atômico ou iônico. Este fenômeno é chamado de contração
lantanídica [4].
Figura 2 - Funções das distribuições radiais dos elétrons do Európio 4f, 5s, 5p e 5d.
Fonte: Macrino, 2013 [6]
A contração lantanídica é mais fraca nos átomos que nos íons, já que estas espécies
possuem um número inferior de elétrons blindando os seus núcleos quando em
comparação com os átomos [4]. A relação entre o raio iônico e o número atômico é
mostrado na Fig. 3.

P á g i n a | 25
Figura 3 – Relação entre raio iônico e número atômico de íons lantanídeos.
Fonte: Huang e Bian [4].
2.1.3 Especificidade e propriedades fotofísicas dos Lantanídeos
Devido aos subníveis 4f dos lantanídeos não estarem preenchidos, os diferentes
arranjos dos elétrons 4f geram diferentes níveis de energia. Dessa forma as transições dos
elétrons 4f, entre os diversos níveis de energia podem gerar numerosas absorções no
espectro de emissão [4]. Os espectros luminescentes dos íons lantanídeos exibem bandas
de emissão finas em virtude das transições f-f e estão relacionadas aos elétrons blindados
do subnível 4f [4]. Entretanto, essas transições não são as únicas participes na geração de
bandas luminescentes. As transições 5d-4f geram bandas de emissão largas, oriundas do
desdobramento do nível 5d pelo campo ligante ao redor do íon [4]. Estas transições
usualmente ocorrem apenas para os íons cério, praseodímio e térbio, todos nos seus
estados trivalentes [4].
A Fig. 4 mostra o diagrama dos níveis de energia para os íons lantanídeos
trivalentes.

P á g i n a | 26
Figura 4 - O diagrama dos níveis de energia dos íons lantanídeos trivalentes
Fonte: Huang e Bian [4].
2.1.3.1 Regras de seleção do espectro atômico
As regras de seleção determinam quais as transições permitidas e proibidas. A
primeira denominada como regra de seleção de Laporte, afirma que para moléculas
centrossimétricas, as únicas transições permitidas são as que ocorrem com mudança de
paridade. As transições de mesma paridade são fracamente proibidas, se o centro de
simetria for alterado por alguma vibração assimétrica. Devido as transições f-f são
proibidas pela regra de Laporte, as cores produzidas pelos íons lantanídeos tem baixa
intensidade, já que as transições eletrônicas dependem da relaxação dessa regra [12-15].

P á g i n a | 27
Contudo, tal regra pode ser violada de acordo com a teoria de Judd e Ofelt, desde que o
íon lantanídeo se encontre na presença de um campo ligante cuja simetria não apresente
centro de inversão [15]. Tal fenômeno é observado, devido a distorção da simetria esférica
do íon livre promovendo uma mistura de configurações eletrônicas de paridades opostas
[10, 16]. Dessa forma, as transições f-f formalmente proibidas podem ser observadas,
entretanto, com intensidade muito baixa [15, 16].
A segunda regra, chamada de regra de seleção de spin, propõe que transições com
mudanças de multiplicidade são proibidas, isto é, durante as transições eletrônicas, o
campo eletromagnético da radiação incidente não irá mudar as orientações relativas dos
spins dos elétrons. O que proíbe a transição de um estado singleto (S = 0) para um estado
tripleto (S = 1). Logo, as transições permitidas por spin são as que ∆S = 0. Todavia, as
transições proibidas por spin (∆S ≠ 0) tornam-se permitidas devido a mistura de estados
produzidos pelo acoplamento spin-órbita. As intensidades destas transições é muito baixa
quando comparada com as transições permitidas, entretanto, podem apresentar um
aumento a medida que o número atômico cresce, pelo fato do acoplamento ser mais
efetivo nos átomos mais pesados. O relaxamento dessa regra é denominado como efeito
do átomo pesado [15, 17].
Os elétrons 4f dos lantanídeos podem ser promovidos a qualquer orbital, com
exceção do La3+ e Lu3+, que possuem os orbitais 4f vazios e completos respectivamente,
o que resulta em vários termos espectrais e níveis de energia para os lantanídeos [4]. Por
exemplo, o Praseodímio possui 41 níveis de energia na configuração 4f3, 6s2, 500 níveis
de energia na configuração 4f3, 6s1, 6p1, 100 níveis de energia na configuração 4f 2, 5d1,
6s2, 750 níveis de energia na configuração 4f3, 5d1, 6s1, e 1700 níveis de energia na
configuração 4f3, 5d2 [4]. O Gadolínio tem 3106 níveis de energia na configuração 4f7,
5d1, 6s2 enquanto que no seu estado excitado na configuração 4f7, 5d1, 6s1, 6p1, possui
36000 níveis de energia [4]. Entretanto, devido às regras de seleção muitas transições são
restritas entre diferentes níveis de energia, e o número de linhas espectrais visíveis é
menor do que o esperado [4].
No geral, átomos ou íons lantanídeos com um subnível 4f não preenchido
produzem cerca de 30000 linhas espectrais visíveis. Metais de transição, com um subnível
5d não preenchido produzem cerca de 7000 linhas espectrais visíveis [4]. Elementos do
grupo principal, com orbitais p não preenchidos produzem apenas 1000 linhas espectrais
visíveis. Os lantanídeos entretanto, possuem mais níveis eletrônicos de energia, e mais
linhas espectrais do que os elementos comuns [4]. Eles podem absorver ondas

P á g i n a | 28
eletromagnéticas desde o ultravioleta, até o infravermelho emitindo seus espectros
característicos [4].
2.1.3.2 Interação spin-órbita
É uma interação mais fraca que as interações de coulomb, sendo responsável pela
estrutura fina das linhas atômicas. Esta interação, acopla o momento angular de spin com
o momento angular de orbital (acoplamento L-S). Considera-se em tal mecanismo, que a
interação magnética acopla o momento angular de spin de cada elétron opticamente ativo,
com seu próprio momento angular orbital [7, 8].
O acoplamento spin-órbita é originado a partir da interação entre o campo
magnético interno do átomo, gerado pelo momento angular orbital total L, e o momento
angular de spin total S [4]. Esse mecanismo acopla os dois momentos angulares de forma
a gerar um momento angular total J, dado por J = L + S, que promove a mistura
quantomecânica dos estados excitados, deixando o estado singleto (S) com característica
de estado tripleto (T) e vice-versa [7, 8].
Os átomos pesados aumentam a velocidade da transição S → T, pois como as
perturbações são causadas pelo campo magnético próximo ao núcleo, e a magnitude deste
campo é proporcional a carga nuclear.
2.1.3.3 Efeito Stark e os íons lantanídeos
O efeito Stark nos íons lantanídeos, está relacionado ao deslocamento ou divisão
de linhas do espectro, correspondente ao desdobramento dos níveis J, sendo este
fenômeno dependente do ambiente químico onde este íon está inserido [9].
O efeito Stark suspende a degenerescência do número quântico J, acarretando na
possibilidade de desdobramento em (2J + 1) ou (J + ½) níveis, respectivamente para
valores de J inteiros ou semi-inteiros [10]. O número de níveis é dependente da simetria
ao redor do íon terra rara, e a largura que cada nível apresentará, indica a faixa dos
desdobramentos dentro de cada componente J. [9, 10].
O campo originado pela distribuição de cargas dos sítios, também conhecido como
campo ligante, promove uma perturbação que irá atuar quebrando parcialmente a
degenerescência dos níveis J em um multipleto com no máximo 2J + 1 subníveis Stark
[9, 11]. Isto é, o campo ligante atua quebrando a degenerescência contida no número
quântico J. O efeito Stark, gera desdobramentos dos níveis da ordem de 200 cm-1 em
magnitude [9].

P á g i n a | 29
2.1.4 Espectros de absorção
Nos lantanídeos, os subníveis 5s2 e 5p6 são mais externos que o subnível 4f. Os
elétrons 5s2 e 5p6 blindam os elétrons 4f de qualquer campo de coordenação [4]. Observa-
se então um menor efeito nos elétrons 4f dos lantanídeos. Entretanto, a absorção espectral
dos compostos contendo íons lantanídeos apresentam linhas espectrais semelhantes às
dos seus íons livres. Isto é diferente das absorções espectrais dos compostos do bloco d
[4]. Os compostos do bloco d tem seu espectro originado a partir das transições 3d → 3d.
Os subníveis nd mais externos dos átomos não possuem efeitos de blindagem [4]. Logo,
os elétrons 3d são mais facilmente afetados pelos campos de coordenação dos cristais,
como resultado os elementos do bloco d apresentam diferentes absorções espectrais em
diferentes compostos [4]. Porque a mudança nas linhas do espectro do bloco d, promovem
mudanças nas linhas de absorção para as bandas de absorção em íons livres[4].
A maioria dos íons terras raras trivalentes não tem ou apresentam absorção muito
fraca na região do visível. Por exemplo Y+3, La3+, Gd+3, Yb+3, e Lu3+ em soluções aquosas
de ácidos inorgânicos são incolores [4]. É importante salientar que as cores das soluções
aquosas para íons tendo configuração eletrônica 4fn são geralmente similares aqueles que
possuem configuração 4f14-n (Fig. 5).
Outra característica dos íons terras raras (exceto para o Ce3+ e Yb3+) na absorção
espectral está no seu comportamento linear semelhante, que ocorre devido as transições
f-f onde os elétrons transitam entre diferentes níveis de energia [4]. Contudo, as transições
f-f não são permitidas para Ce3+ (4f1) ou Yb3+ (4f13) [4]. Observa-se longas bandas de
absorção que se originam por exemplo das configurações 4fn para 4fn-15d1 [4].
As transições f-f dos íons lantanídeos podem ser divididas em transições de dipolo
magnético e transições de dipolo elétrico. Em apenas alguns casos uma transição de vários
dipolos elétricos pode ser observada. De acordo, com as regras de seleção clássicas das
transições, a transição é proibida quando ∆L = 0 [4]. Sendo assim as transições de dipolo
elétrico f-f, são proibidas. Entretanto, tem sido observado experimentalmente que devido
ao termo de paridade ímpar ou a paridade oposta, o elétron é introduzido na configuração
4fn até certo ponto [4].
A absorção espectral dos complexos terras raras são determinadas principalmente
pela coordenação dos ligantes orgânicos [4].
A soma dos números quânticos azimutais (L) dos orbitais envolvidos com a transição é igual a 0.

P á g i n a | 30
Figura 5 – Similaridade de cores entre íons com configuração eletrônica 4fn e 4f14-n
Fonte: Huang e Bian [4].
2.1.5 Tempo de vida
O tempo de vida (τ) de um extado excitado é um fator importante quando há
necessidade de se compreender o processo cinético [4]. O tempo de vida de uma molécula
não é a medição do seu tempo de existência no estado excitado, mas sim o tempo
necessário para desativação dos estados excitados de uma molécula para 1/exponencial
da população inicial [4]. Sendo definido como:
τ = 1/ ∑kf
Onde kf, é a constante da taxa de desativação e ∑kf é o somatório de todas as
constantes da taxa de desativação do processo, inclusive os processos radioativos e não
radioativos do sistema.
Outra característica dos lantanídeos, é que alguns estados excitados possuem
tempos de vida muito longos (10-2 ~ 10-6 s) enquanto a média dos tempos de vida para
outros átomos ou íons típicos é de 10-8 a 10-10 s [4]. Esses longos tempos de vida para os
estados excitados são explicados pelos estados metaestáveis [4]. Estes estados nos
lantanídeos são causados pelas transições eletrônicas 4f → 4f. De acordo com as regras
de seleção são transições de dipolo elétrico proibidas, mas que podem ser observadas [4].
As duas grandes razões para que essas transições sejam proibidas são: mistura entre
configurações 4f com paridade oposta, e a mudança de simetria a partir de um centro de
inversão [4]. Devido a isso os lantanídeos têm mais transições 4f → 4f em estados
Estado no qual um elétron em um átomo excitado encontra-se em um orbital a partir do qual a transição
para o nível fundamental ou demais níveis de menor energia encontra-se inibida pela regra de transição
inerente ao sistema atômico, o que leva a um tempo de vida médio para este estado consideravelmente
maior do que o tempo de vida médio associado aos demais estados excitados não metaestáveis.

P á g i n a | 31
metaestáveis, acarretando em estados excitados com longos tempos de vida [4]. Isto
permite que alguns materiais contendo lantanídeos possam ser utilizados em lasers e
materiais fluorescentes.
2.1.6 Espectro de emissão e luminescência de compostos terras raras
Na década de 1940, foram observadas as emissões de complexos de terras raras,
e a investigação sobre esse fenômeno tem sido crescente e com atenção permanente por
parte dos pesquisadores devido ao seu potencial de aplicação como, dispositivos óticos,
displays e sensores [4]. Para melhor entendermos as emissões é importante ter em mente
o conceito de luminescência e o mecanismo que rege esse processo.
A IUPAC define luminescência como a emissão espontânea de radiação por uma
espécie que se encontra no estado excitado seja ele vibracional ou eletrônico. Para os íons
terras raras, embora muitos trabalhos nomeiem esses processos de emissão de radiação
como fluorescência ou fosforescência, recomenda-se recentemente a utilização do termo
luminescência para todos os fenômenos.
A fluorescência é definida como a perda de energia por emissão espontânea
quando um luminóforo retorna de um estado excitado, normalmente o estado fundamental
de energia, de mesma multiplicidade de spin (∆S=0) [4]. Já no caso da fosforescência,
ocorre o mesmo processo, no entanto com espécies com multiplicidades diferentes de
spin (ΔS ≠ 0) [4]. De forma mais clara, a fosforescência possui o estado excitado com
maior tempo de vida em relação à fluorescência [18].
A fluorescência e a fosforescência são terminologias utilizadas para explicar
emissões radiativas de espécies orgânicas que ocorrem entre estados singleto-singleto e
tripleto-singleto.
Segundo Carnall et. al [4], podemos dividir em razão das propriedades
luminescentes os íons lantanídeos em três grupos:
Íons que não possuem luminescência (La3+ com orbital 4f0 e Lu3+ com orbital 4f14)
e íons com estados excitados de alta energia no qual o fenômeno de luminescência
é extremamente fraco (Gd3+ com orbital 4f7);
Íons com intensa luminescência, com grande diferença de energia entre os estados
excitados e fundamentais, além de níveis de energia abaixo dos estados tripletos
dos ligantes (Sm3+, Eu+3, Tb+3 e Dy+3);

P á g i n a | 32
Íons cuja intensidade de luminescência é muito fraca em razão da contribuição de
processos não radiativos oriundas da pequena diferença entre as energias dos
estados (Pr3+, Nd3+, Ho3+, Er3+, Tm3+ e Yb3+).
Agora que compreendemos o processo de luminescência já podemos discutir sobre o
processo de sensibilização luminescente.
2.1.7 Efeito antena (sensibilização luminescente)
Uma vez que as transições f-f são formalmente proibidas, um caminho alternativo
que pode ser utilizado é denominado como sensibilização luminescente ou efeito antena,
que ocorre quando um íon luminescente é coordenado a um ligante orgânico em uma
matriz, em seguida a energia absorvida pelo ligante orgânico é transferida por ressonância
para o íon luminescente que decai radioativamente emitindo sua luz característica [4].
Esse fenômeno ocorre devido aos íons lantanídeos possuírem um baixo coeficiente de
absortividade, dessa forma se torna necessário que os mesmos estejam ligados a um
fotosensibilizador [4]. A sensibilização ou fotosensibilização, é um processo fotoquímico
onde se excita um material absorvente através da transferência de energia ou transferência
de elétrons, através da absorção de luz por um composto que vamos denominar como
sensibilizador [19]. Com relação aos íons lantanídeos que serão os metais utilizados neste
trabalho, um ligante orgânico pode ser utilizado e o fenômeno da sensibilização do metal
a partir dos grupos cromóforos do ligante é denominado como efeito antena [19].
Em 1990, foi sugerido por Buono-Core [20] um diagrama simplificado para
mostrar os três diferentes mecanismos de transferência de energia intramolecular em
compostos contendo lantanídeos (Fig. 6).
Na Figura 6a, os ligantes do material são excitados a partir do seu estado
fundamental (S0) para seu estado excitado singleto (S1) pela absorção de energia
luminosa. A energia depois é transferida para o estado excitado tripleto (T1) através do
cruzamento intersistemas (CIS). A energia pode então ser transferida para o íon terra rara
se os elétrons correspondentes aos níveis de energia do íon central puderem se tornar
excitados. Quando os elétrons retornam do seu estado excitado para o estado fundamental
ocorre a emissão dos comprimentos de ondas característicos do íon central. No caso da
Figura 6b, os ligantes do material são excitados de S0 para S1 e a partir daí a energia
absorvida pode ser transferida direta para o íon central e não para o estado T1. No caso da
Figura 6c, os ligantes do composto são excitados de S0 para S1 e em seguida, a energia

P á g i n a | 33
absorvida pode ser transferida de volta entre S1 e T1, em seguida para múltiplos estados
excitados, para finalmente ser transferida para excitar o íon terra rara, e em seguida
retornar para o estado fundamental. Os compostos podem, a partir daí, emitir suas
emissões características. Portanto, o rendimento teórico das emissões seria 100%.
Figura 6 – Três possíveis mecanismos para explicar a transferência de energia
intramolecular.
Fonte: Buono-Core [15].
Para uma visão macro do processo foi inserido nessa discussão um diagrama de
energia contendo os três diferentes mecanismos no efeito antena (Fig. 7). Com base nas
propriedades fotofisicas dos materiais estudados nesta tese, que serão discutidas no
capítulo 5, iremos abordar aqui o mecanismo de transferência de energia mais provável
dos mesmos.
Inicialmente temos a absorção de luz por parte do ligante que está ligado ao íon
lantanídeo trivalente, em seguida a energia é transferida para um ou mais estados
excitados do íon lantanídeo trivalente, e por fim o íon emite radiação na forma de luz
como está ilustrado na Fig. 7.

P á g i n a | 34
Figura 7 - Ilustração do mecanismo do efeito antena.
Fonte: Adaptado de Tanner, 2010 [21].
Existem vários ligantes que podem ser utilizados para produzir tal efeito. Os mais
comuns são as β-dicetonas, carboxilatos, sulfóxidos, fosfinóxidos aromáticos. A escolha
do ligante é fundamental, pois dependendo do caso, o processo de sensibilização pode
não ocorrer. Estudos teóricos demonstraram que o estado excitado tripleto (T1), da
maioria dos ligantes, é o principal estado doador de energia para o centro metálico (Ln3+)
[22]. Diante desse conhecimento, neste trabalho foi utilizado como ligante o ácido
tereftálico (ácido 1,4– dicarboxilbenzeno), que é um dicarboxilato.
Para descrever quantitativamente o efeito de emissão, é introduzido o rendimento
quântico Q que tem a seguinte definição:
Q = número de fótons emitidos/número de fótons absorvidos
De acordo com as propriedades de emissão, os complexos de terras raras podem
ser divididos nos quatro grupos a seguir:
1. Sm3+(4f 5), Eu3+(4f 6), Tb3+(4f 8) e Dy3+(4f 9);
2. Pr3+(4f 2), Nd3+(4f 3), Ho3+(4f 10), Er3+(4f 11), Tm3+(4f 12) e Yb3+(4f 13);
3. Sm2+(4f 6), Eu2+(4f 7), Yb2+(4f 14) e Ce3+(4f 1);
4. Sc3+(4f 0), Y3+(4f 0), La3+(4f 0), Gd3+(4f 7) e Lu3+(4f 14).

P á g i n a | 35
Para o primeiro grupo, as emissões são originadas devido às transições dos
elétrons 4f a partir do menor estado de energia para o estado fundamental e as emissões
ocorrem na região do visível [4]. A probabilidade para que estas transições ocorram é
relativamente alta e fortes emissões podem ser observadas. O tempo de vida destas
transições está na escala de microssegundo ou milissegundo [4]. Para o segundo grupo,
os níveis de energia destes íons são muito próximos um dos outros. Assim, as emissões
são frequentemente na região do infravermelho e suas intensidades são mais fracas do
que aquelas do primeiro grupo por muitas ordens de magnitude [4]. Todos os íons do
terceiro grupo existem em menor estado de oxidação e suas transições são originadas a
partir das transições d-f e não das transições f-f, que pode ser observado através das
bandas de emissões [4]. Obviamente, todos os íons do último grupo têm as chamadas
configurações eletrônicas estáveis, que ocorre devido aos seus orbitais 4f “estarem
vazios”, “preenchidos pela metade” ou “completamente preenchidos” [4]. Por esse
motivo, não ocorrem às transições f-f, exceto nos complexos de gadolínio, que possuem
emissões na região do ultravioleta. Contudo, estes complexos muitas vezes só emitem
quando ligantes adequados são coordenados ao íon central [4]. Nestes casos, as emissões
são causadas devido aos complexos de emissão dos ligantes [4].
2.1.8 Compostos de Gd3+: Paramagnetismo
Compostos paramagnéticos são aqueles em que a ação de um campo magnético
externo, é capaz de alinhar os momentos magnéticos dos seus átomos ou moléculas com
o campo externo [23]. Estes materiais exibem uma magnetização liquida, isto é, diferente
de zero, enquanto está sob a ação de um campo magnético externo.
O paramagnetismo dos materiais está relacionado com o momento dipolo
magnético dos seus constituintes. Onde, um material será paramagnético se seus átomos
possuírem elétrons desemparelhados [23].
O íon Gd3+ apresenta elevado paramagnetismo, por possuir 7 elétrons
desemparelhados. No campo da luminescência esta característica se torna relevante, pois
este íon é capaz de exercer o chamado “efeito paramagnético”, que acarreta no incremento
da taxa do CIS, proporcionando uma maior mistura dos estados eletrônicos S1 e T1 do
ligante, dado pelo efeito do campo magnético não homogêneo exercido pelo íon
paramagnético [24-28].

P á g i n a | 36
2.1.9 Especificidades da Química de coordenação dos íons terras raras
A Química de coordenação das terras raras tem muitas propriedades
características comparadas com os complexos metálicos do bloco d. temos três pontos
principais para serem discutidos nessa seção: O estado de valência, ligações químicas e o
número de coordenação [4].
2.1.9.1 Estado de valência dos elementos terras raras
Os elementos terras raras possuem configurações similares nas duas camadas mais
externas. Eles tendem a perder três elétrons e exibir o estado de valência 3+ [4]. Dos
elementos da tabela periódica, os elementos terras raras são elementos classificados como
menos reativos que os metais alcalinos e metais alcalinos terrosos, mas são mais reativos
que os demais metais [4]. Eles devem ser armazenados em líquidos inertes, pois caso
contrário eles serão oxidados perdendo o seu brilho metálico. A reatividade desses metais
cresce gradualmente do Escândio para o Lantânio e decresce gradualmente do Lantânio
para o Lutécio [4]. Isto é, o Lantânio é o metal mais reativo dos 17 terras raras. Os íons
terras raras podem reagir com água liberando hidrogênio [4], a reação ocorre de maneira
mais vigorosa com ácidos, mas não ocorre com bases [4].
De acordo com a regra de Hund, os níveis eletrônicos são estáveis quando se
encontram vazios, semipreenchidos ou totalmente preenchidos. Por exemplo, as
configurações 4f0 (La3+), 4f7 (Gd3+), e 4f14 (Lu3+) são estáveis. Ce3+, Pr3+, e Tb3+ possuem
um ou dois elétrons a mais do que o necessário para atingir a configuração eletrônica
estável [4]. Desse modo eles possuem uma maior oxidação atingindo o estado de valência
4+. Em contraste, Sm3+, Eu3+ e Yb3+ possuem um ou dois elétrons a menos que o
necessário para ter configuração eletrônica estável, logo eles tendem a receber um ou dois
elétrons, sofrendo redução ao estado de valência 2+ [4]. Estas são as razões para que estes
elementos possuam estados de valência anormais [4].
Os potenciais padrão de redução, E0Ln
4+/Ln
3+ e E0Ln
3+/Ln
2+, representam o caminho
mais estável energeticamente para se chegar a redução de estado. O valor mais positivo
do E0red, será o que terá a maior tendência a sofrer redução. Os potenciais padrão dos íons
terras raras são demonstrados na Tabela 3.

P á g i n a | 37
Tabela 2 – Potencial padrão de redução dos íons terras raras.
Fonte: Huang e Bian [4].
Os dados apresentados na Tabela 2 indicam que quando comparamos E0Ce
4+/Ce
3+
com E0Tb
4+/Tb
3+, os pares de elétrons do Tb4+ são mais fortes agentes oxidantes do que
Ce4+; já para atuar como agente redutor Ce3+ é mais forte do que Tb3+ [4]. Quando
comparamos E0Eu
3+/Eu
2+ com E0Yb
3+/Yb
2+, o Yb2+ atua mais fortemente como agente
oxidante do que o Eu2+ sob as mesmas condições padrão [4]. Essa tendência pode ser
visualizada na Fig. 8, onde o eixo transversal é o número atômico e as linhas curtas no
eixo vertical representam a tendência da variação do estado de valência [4].
Figura 8 – Estado de valência das terras raras
Fonte: Huang e Bian [4].
2.1.9.2 Ligações químicas dos elementos terras raras
Assim como os típicos grupos de elementos metálicos, os lantanídeos podem
formar ligações químicas com a maioria dos elementos não metálicos [4]. Alguns
lantanídeos de baixa valência podem formar ligações originando compostos
organometálicos ou aglomerados de átomos [4]. Isso ocorre com os lantanídeos devido
aos mesmos não possuírem elétrons suficientes, e mostrarem uma forte força repulsiva

P á g i n a | 38
com relação a cargas positivas [4]. As ligações químicas entre os lantanídeos não têm
sido observadas [4].
Do ponto de vista do conceito de ácidos e bases duros e moles, os lantanídeos são
ácidos duros. Assim, eles tendem a formar ligações químicas com átomos pertencentes
ao grupo das bases duras [4]. Por exemplo, o oxigênio tende a formar ligações com os
lantanídeos TR-O. Os lantanídeos também podem formar ligações com grupo de átomos
contendo nitrogênio [4]. Os complexos lantanídicos contendo ligação TR-C não são
estáveis nas condições normais [4].
Uma discussão que é relevante, é se a natureza das ligações químicas nos
complexos lantanídicos depende da contribuição dos elétrons 4f, o que é nestes
complexos um longo e controverso problema [4]. Para entender melhor a estrutura
eletrônica dos complexos lantanídicos, cientistas tem investigado a natureza das suas
ligações em moléculas através da Química Quântica [4]. De forma geral acredita-se
atualmente, que as ligações químicas em complexos lantanídicos exibem propriedades de
ligação covalente polar e que os elétrons 4f não contribuem para a formação da ligação,
sendo a maior contribuição dos orbitais 5d e 6s, enquanto os orbitais 4f encontram-se
mais internamente localizados em relação ao núcleo e por isso, considera-se que
participam fracamente do estabelecimento das ligações químicas [4].
2.1.9.3 Número de coordenação dos complexos terras raras
Os íons lantanídeos trivalentes (Ln3+) possuem modos de coordenação distintos
em relação aos íons metálicos dos blocos p ou d, isso ocorre devido aos íons Ln3+ serem
relativamente maiores (raios de: 0,85 a 1,06 A) [4]. Dessa forma, os números de
coordenação para os íons lantanídeos podem variar entre 6 e 12, tendo como números
mais comuns 8 e 9, que estão relacionadas as geometrias antiprisma quadrada e prisma
trigonal triencapuzado, espectivamente [29] (Fig. 9). Geralmente, os lantanídeos leves
têm como característica apresentar número de coordenação 8 enquanto os lantanídeos
pesados apresentam número de coordenação 9. Já os metais de transição apresentam
números de coordenação mais comuns como 4 e 6, isto ocorre porque os mesmos são bem
menores como por exemplo o raio do Cr3+ é em torno de 0,6 A.

P á g i n a | 39
Figura 9 – (a) Geometria antiprisma quadrada, (b) Prisma trigonal triencapuzado.
Fonte: Vilela, 2009 [24].
2.2 POLÍMEROS DE COORDENAÇÃO
“O que aconteceria se quiséssemos organizar um arranjo de átomos de uma única
forma? [30]” Esta famosa citação de Richard P. Feynman é o objetivo final da ciência dos
materiais. Para alcança-lo, químicos tem estudado intensivamente as estruturas e as
interações dos átomos e moléculas nos sólidos, líquidos e gases. O sucesso parcial seria
se a pergunta pudesse ser respondida com os efeitos dos arranjos e rearranjos de átomos
e moléculas. Os materiais denominados como polímeros de coordenação têm como
princípio da construção a forma como os átomos se arranjam e rearranjam o que irá
influenciar como a estrutura final se organiza no espaço. Para compreender a importância
desses materiais iremos iniciar nossa discussão por um breve histórico.
2.2.1 Breve Histórico
O termo polímero de coordenação foi utilizado pela primeira vez no ano de 1964
por J. C. Bailar [31], em consonância com Biradha et al [32]. Contudo, o primeiro
polímero de coordenação sintetizado ocorreu bem antes de 1964, ao tentar produzir um
pigmento de coloração vermelha Diesbach [33] obteve uma substância totalmente
diferente, o composto de coordenação denominado como azul da Prússia, sendo
considerado este o primeiro polímero de coordenação sintetizado pelo homem, mas vale
salientar que na época não possuía essa denominação. Nos dias atuais o azul da Prússia
não é considerado um polímero de coordenação, pois sua estrutura é finita [34]. No ano

P á g i n a | 40
de 1965, Tomic [35], publicou um dos primeiros artigos científicos relacionados aos
polímeros de coordenação, consistindo em centros metálicos com ácidos carboxílicos.
Nos anos 80, as pesquisas relacionadas aos polímeros de coordenação tornam-se
importantes, depois dos trabalhos desenvolvidos por Robson [36] que abordou o assunto
de uma forma diferente. Ele propôs incorporar na estrutura nós inorgânicos, metais de
transição ou clusters metálicos de figuras geométricas bem definidas, entre os ligantes
orgânicos, que teriam a função de espaçadores para que desta forma fosse possível prever
o design e a estrutura de novos materiais híbridos [37].
A partir da década de 90, surge o termo MOF de acordo com Yaghi et al [38].
Para um material receber essas denominações ele deve apresentar algumas características,
como fortes interações para proporcionar robustez e apresentar uma geometria bem
definida. Sendo esta última propriedade importante, pois está relacionada à cristalinidade
da estrutura [39, 40].
A IUPAC em 2013 lançou um relatório esclarecendo as definições de polímeros
de coordenação, redes metalorgânicas (MOFs) e redes de coordenação. Polímero de
coordenação é definido pela IUPAC como sendo “um composto de coordenação com
repetição de entidades de coordenação que se estende em 1, 2 ou 3 dimensões”. MOFs “é
uma rede de coordenação com ligantes orgânicos contendo espaços vazios”. Redes de
coordenação é “Um composto de coordenação que se estende, através da repetição
entidades de coordenação, em uma dimensão, mas com ligações cruzadas entre duas ou
mais cadeias individuais, ou um composto de coordenação que se estende através da
repetição entidades de coordenação em 2 ou 3 dimensões” [41].
2.2.2 Redes de coordenação contendo íons lantanídeos (LOFs)
Durante a última década vem crescendo de forma considerável o interesse por
materiais luminescentes a exemplo das LOFs (Lanthanide-Organic Frameworks), isso
pode ser explicado pela alta estabilidade, ordenação estrutural e elevada área superficial
desses materiais que em especial podemos destacar a luminescência apresentada pelos
mesmos.
Os polímeros de coordenação constituem uma inovadora e importante classe de
materiais híbridos, formados por íons metálicos ou clusters metálicos. Dentre os ligantes
os mais utilizados são os aromáticos, por propiciar a formação de estruturas mais rígidas,

P á g i n a | 41
onde a formação dessas estruturas é baseada na conectividade M-L-M (metal-ligante-
metal) [42, 43].
Os MOFs e as LOFs são utilizados como sinônimos de materiais metal-orgânicos,
redes de coordenação, polímeros de coordenação entre outros. Essas nomenclaturas são
semelhantes e esses materiais são compostos por uma fase orgânica e outra inorgânica,
que se organizam formando estrutura em uma (1D), duas (2D) ou três (3D) dimensões
(Fig. 10).
Figura 10 – Esquema ilustrativo dos blocos de construção utilizados para formar
polímeros de coordenação.
Fonte: James [44].
Conforme podemos observar na Fig. 10, os ligantes orgânicos desempenham um
importante papel na arquitetura e nas propriedades destas redes de coordenação. Essas
espécies químicas possuem grupos capazes de doar e aceitar elétrons e são os melhores
para esta finalidade. Dentro dessa perspectiva, os carboxilatos desempenham um
importante papel na construção de novas redes de coordenação com íons lantanídeos.
Podemos destacar dentro dessa classe o ácido tereftálico (ácido 1,4-
benzenodicarboxílico) que está representado na Fig. 11.

P á g i n a | 42
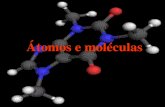
Figura 11 – Representação da estrutura do ácido tereftálico.
Fonte: Autor.
O ácido tereftálico, além de proporcionar a formação de estruturas mais rígidas,
apresenta substituição no anel aromático de forma simétrica, o que possibilita o
crescimento do cristal de maneira uniforme. Dessa forma, existe a influência da posição
dos grupos de coordenação nas moléculas do ligante, pois os mesmos facilitarão a
definição de como o metal estará coordenado, e consequentemente como o crescimento
da rede irá acontecer, definindo a estrutura final do polímero de coordenação. Contudo,
um ligante orgânico não simétrico também pode através da automontagem definir
estruturas resultantes altamente simétricas e porosas. Esse processo pode ser definido
como um processo no qual o material de partida escolhido pode montar uma determinada
estrutura sem a interferência humana, ou seja, de forma reversível e espontânea [43].
Torna-se fundamental a escolha apropriada dos reagentes para obtenção do
polímero de coordenação, já que a propriedade de um dos reagentes irá se sobressair com
relação às propriedades da MOF. Entre elas podemos citar tamanho dos poros e o
ambiente químico dos espaços vazios resultantes, que são definidos pelo comprimento e
funcionamento dos ligantes orgânicos.
Torna-se relevante destacar que os ligantes aniônicos são os mais utilizados nesse
tipo de polímero de coordenação, porque eles têm a capacidade de agregar íons metálicos
e assim formar estruturas mais estáveis.
O ácido tereftálico apresenta-se como um ligante flexível, para a síntese de redes
de coordenação com metais de transição e lantanídeos. Estão ilustrados na Fig. 12 os
possíveis modos de coordenação para o referido ácido com íons terras raras.

P á g i n a | 43
Figura 12 – Possíveis modos de coordenação do ácido tereftálico com íons terras raras
Fonte: Leite [45].
Além do ligante e do íon metálico, a rota sintética empregada na obtenção das
redes de coordenação é um fator a ser considerado, pois elas induzem a formação de uma
unidade de construção secundária (SBU), o que garante modos específicos de
coordenação, arranjos cristalográficos e, principalmente a forma e tamanho dos poros
[46].
Podemos citar entre as SBUs, polígonos regulares ou poliedros para a construção
das redes. Sendo assim, uma SBU pode ser um metal ou um cluster metálico que apresenta
como principal característica a rigidez. Com base nos pontos de extensão da rede é
possível fornecer a previsão da topologia da rede metalorgânica, favorecendo a formação
e manutenção da rede, desde que os blocos de construção moleculares estejam ligados de
forma simples através de ligantes orgânicos politópicos [47].
A síntese de novos polímeros de coordenação depende das SBUs, pois as mesmas
controlam o local onde irá ocorrer a coordenação do metal, e permite que os polímeros
de coordenação, tenham a capacidade de adotar qualquer modo de coordenação entre os
vários existentes. Isso acarretará na formação de estruturas porosas, já que o tamanho da
SBU influência diretamente nas propriedades estruturais, pois quanto maior o seu
tamanho, maior será o volume de poro [48, 49].

P á g i n a | 44
As interações supramoleculares também influenciam na formação do polímero de
coordenação, entre elas temos as interações de Van Der Walls, as π-π e as ligações de
hidrogênio, onde a partir dessas interações é possível um controle mais previsível sobre
a construção dos arranjos e o direcionamento do empacotamento do estado sólido [50].
2.2.3 Aspectos topológicos e morfológicos das redes de coordenação
A rede topológica de uma estrutura é representada a partir do arranjo periódico da
rede. Um dos estudiosos que possui notoriedade nessa abordagem é Wells, que resumiu
as topologias de rede através de nós e os ligantes orgânicos (espaçadores de compostos
inorgânicos), sendo as estruturas resultantes, descritas como poliedros ou redes infinitas
[51, 52].
Torna-se relevante ressaltar que o controle sobre a estrutura topológica é obtido
pelo controle dos fatores que influenciam a reação, tais como: Ligante orgânico,
geometria preferencial de coordenação do metal, contra-íon inorgânico, temperatura,
concentração, solvente, comprimento da porção inorgânica. Estes fatores influenciam
significativamente na geometria e estrutura final do polímero [53-57].
A utilização da topologia ou rede topológica, para melhorar a descrição da
estrutura cristalina dos polímeros de coordenação é altamente recomendável. Pois, como
ainda não existem regras definidas ou recomendações disponíveis, nem pela IUPAC, nem
de nenhum outro órgão de relevância internacional, tal como a União Internacional de
Cristalografia (IUCr), é importante o máximo de clareza e não ambiguidade quando são
utilizados estes termos em trabalhos científicos [52].
A base para esta recomendação é que a topologia é uma ferramenta eficiente e
frequentemente utilizada para a melhoria da compreensão estrutural dos polímeros de
coordenação e redes metalorgânicas. Uma vez que a análise de tais redes foi realizada de
forma mais fácil quando comparamos diferentes materiais, como por exemplo, duas
MOFs apresentam a mesma rede topológica, mas isso não implica que possuam a mesma
morfologia e a mesma estrutura, ou mesmo ter outra relação cristalográfica em termos
das células unitárias e grupos espaciais. Deve-se utilizar de forma rigorosa e cuidadosa
as redes topológicas, para obtermos uma comunicação científica de maneira mais
eficiente [52].
As redes metalorgânicas resultantes podem ser classificadas como zero
dimensional (discretas), unidimensional (correntes), bidimensional e tridimensional

P á g i n a | 45
(camadas), de acordo com a conexão que seus constituintes podem ter com suas cadeias
classificadas em linear, zig-zag, escada, entre outros. As estruturas bidimensionais e
tridimensionais são classificadas de acordo com a topologia [50] (Fig. 13).
Figura 13 – Algumas topologias de polímeros de coordenação
Fonte: Yang [50].
Vale salientar que geometria e topologia são diferentes, segundo Wells [51],
enquanto a topologia está relacionada ao número de nós, já a geometria está relacionada
à forma com que as moléculas se organizam no espaço, o que acarreta na formação de
ângulos de ligação diferentes. Podemos tomar o exemplo de uma molécula tetraédrica e
uma molécula quadrado planar, elas apresentam a mesma topologia, no entanto
apresentam ângulos diferentes, pois, se organizam no espaço de forma diferente e
consequentemente possuem geometrias diferentes.
Em materiais cristalinos a rede deve apresentar um padrão de repetição, sendo
assim apresenta um número finito de nós e ligantes únicos. Ressaltando que uma rede é
uma descrição topológica e não uma descrição geométrica, sendo assim a rede é definida
pela conectividade e não por sua geometria [51, 52].

P á g i n a | 46
2.2.4 Métodos de Síntese
O principal objetivo na síntese de uma MOF é determinar e estabelecer condições
favoráveis para que não ocorra decomposição do ligante orgânico e dos clusters
inorgânicos.
Numa síntese onde se utiliza os mesmos reagentes, mas utiliza-se um método de
síntese diferente, pode conduzir a diferentes MOFs, pois a escolha do método irá interferir
na morfologia das partículas, no rendimento, no tamanho e no tempo para que a síntese
chegue ao final. O parâmetro temperatura, possui forte influência com relação a
morfologia dos cristais, este parâmetro se não for controlado pode levar a degradação da
MOF dependendo se o tempo de reação for muito longo. O pH e o solvente utilizado
também influenciam no resultado final da síntese [58].
Entre as estratégias sintéticas já desenvolvidas, e as que ainda estão por
desenvolver-se podemos citar algumas, tais como:
Síntese Hidro (solvo) térmica – Caracteriza-se como a síntese mais utilizada para
obtenção de polímeros de coordenação. A síntese hidrotérmica ocorre quando no
processo utiliza-se apenas água como solvente. A síntese solvotérmica recebe essa
classificação por utilizar apenas solventes orgânicos no processo, entre eles
podemos citar a dimetilformamida (DMF), que será um dos solventes utilizados
no processo sintético das redes metalorgânicas nessa tese. Uma grande vantagem
de se adotar a síntese solvotermal é a elevada solubilidade dos ligantes orgânicos
nestes solventes, o que é observado de forma arbitrária quando adotamos a síntese
hidrotermal. Com relação a síntese hidrosolvotérmica, temos neste caso uma
mistura de solventes, que seria a água (daí vem o termo hidro) e um solvente
orgânico (daí vem o termo solvo). Este método é o mais eficiente e mais utilizado
no crescimento de sólidos cristalinos, tendo um rendimento considerável ao
término das reações. Contudo, duas desvantagens devem ser citadas com relação
a este método, a primeira é que ele utiliza elevadas temperaturas, e a segunda é o
longo tempo de reação sendo necessário vários dias para o seu término (59-61).
Difusão lenta – Apresenta como fundamento principal a dissolução do material de
partida (ligante orgânico e sal do metal), num solvente adequado. Os reagentes já
solubilizados, são mantidos num sistema aberto ou semiaberto, à medida que o
solvente vai evaporando lentamente vai ocorrendo o crescimento da estrutura
cristalina [57, 58]. Uma desvantagem apresentada por esta via sintética, é que o

P á g i n a | 47
período reacional é muito longo, podendo chegar de quinzena a meses até que
ocorra a obtenção do material. Este método torna-se uma boa alternativa quando
se quer obter cristais de boa qualidade, já que a partir deste método se obtém os
melhores resultados.
Síntese via micro-ondas – Esta via de síntese está sendo frequentemente utilizada
nos dias atuais na obtenção de polímeros de coordenação, onde uma das suas
principais vantagens está na realização de forma rápida das sínteses, entre outras
vantagens que podemos destacar para esses métodos são tais como, avaliação dos
parâmetros de síntese, fácil controle da morfologia e processo de aquecimento
simples com eficiência energética. Todavia, esta técnica possui uma baixa
qualidade para ser analisada através da técnica de raios-X de monocristal [64-66].

P á g i n a | 48
2.3 Referências
[1] ELISEEVA, Svetlana V.; BÜNZLI, Jean-Claude G. Rare earths: jewels for functional
materials of the future. New Journal of Chemistry, v. 35, n. 6, p. 1165-1176, 2011.
[2] BÜNZLI, Jean-Claude G.; ELISEEVA, Svetlana V. Intriguing aspects of lanthanide
luminescence. Chemical Science, v. 4, n. 5, p. 1939-1949, 2013.
[3] CAO, Xiaoyan et al. First-principles study of the separation of AmIII/CmIII from
EuIII with Cyanex301. Inorganic chemistry, v. 49, n. 22, p. 10307-10315, 2010.
[4] HUANG, Chun-Hui. Rare earth coordination chemistry: fundamentals and
applications. John Wiley & Sons, 2011.
[5] MOELLER, Therald. The Chemistry of the Lanthanides: Pergamon Texts in
Inorganic Chemistry. Elsevier, 2013.
[6] MACRINO, C. J. Estudo Comparativo da Fotoluminescência dos Picratos de
Európio (III) com a 2-azaciclooctanona e N-metil-2-azacicloheptanona. 2013.
Dissertação de Mestrado. Universidade Federal do Espírito Santo. [7] Atkins, P., & Paula,
J. (2006). Physical Chemical.
[7] EISBERG, Robert. RESNICK, Robert. Fısica quântica, Ed. Campus, 23a tiragem,
1979.
[8] ASHCROFT, N. W.; MERMIN, N. David. Solid State Physics, Books/Cole Cengage
Learning. 1976.
[9] GÖRLLER-WALRAND, C.; BINNEMANS, K. Handbook on the Physics and
Chemistry of Rare Earths vol 23, ed KA Gschneidner Jr and L Eyring. 1996.
[10] BRITO, Hermi Felinto de et al. Luminescence behavior of Eu3+ with
thenoyltrifluoroacetonate, sulfoxides and macrocyclics. Journal of alloys and
compounds, v. 275, p. 254-257, 1998.
[11] CASCALES, Concepcion et al. Optical spectroscopic study of Eu3+ crystal field
sites in Na 3 La 9 O 3 (BO 3) 8 crystal. Optics express, v. 16, n. 4, p. 2653-2662, 2008.
[12] LIMA, Patrícia P. et al. Energy Transfer Mechanisms in Organic− Inorganic Hybrids
Incorporating Europium (III): A Quantitative Assessment by Light Emission
Spectroscopy. The Journal of Physical Chemistry C, v. 111, n. 47, p. 17627-17634,
2007.
[13] MALTA, Oscar L.; CARLOS, Luís D. Intensities of 4f-4f transitions in glass
materials. Química Nova, v. 26, n. 6, p. 889-895, 2003.
[14] JUDD, B. R. Optical absorption intensities of rare-earth ions. Physical Review, v.
127, n. 3, p. 750, 1962.

P á g i n a | 49
[15] OLIVEIRA, Rosivânia Silva de. Fotoluminescência sintonizável de LaPO4:
Eu3+/Tb3+ hierarquicamente nanoestruturados, sintetizados via rota do etileno
glicol assistida por micro-ondas. 2016. Dissertação de Mestrado. Brasil.
[16] SOUZA, Ernesto Rezende et al. Síntese e caracterização espectroscópica de
complexos de gadolínio, európio e térbio trivalentes contendo grupos amino e tiol livres.
2013.
[17] SHRIVER, Duward F.; ATKINS, Peter. Química Inorgânica. Tradução Roberto de
Barros Faria. 2008.
[18] LATVA, Martti et al. Correlation between the lowest triple t state energy level of the
ligand and lanthanide (III) luminescence quantum yield. Journal of Luminescence, v.
75, n. 2, p. 149-169, 1997.
[19] LIMA, Patrícia P.; MALTA, Oscar L.; ALVES, S. Estudo Espectroscopico de
Complexos de Eu3+, Tb3+ e Gd3+ com Ligantes Derivados de Acidos
Dicarboxilicos. Química Nova, v. 28, n. 5, p. 805, 2005.
[20] BUONO-CORE, G. E.; LI, H.; MARCINIAK, B. Quenching of excited states by
lanthanide ions and chelates in solution. Coordination Chemistry Reviews, v. 99, p. 55-
87, 1990.
[21] TANNER, Peter A. Lanthanide luminescence in solids. In: Lanthanide
Luminescence. Springer Berlin Heidelberg, 2010. p. 183-233.
[22] JANIAK, Christoph; VIETH, Jana K. MOFs, MILs and more: concepts, properties
and applications for porous coordination networks (PCNs). New Journal of Chemistry,
v. 34, n. 11, p. 2366-2388, 2010.
[23] FARIA, Rubens N.; LIMA, Luis FCP. Introdução ao magnetismo dos materiais.
Editora Livraria da Física, 2005.
[24] DREESKAMP, H.; KOCH, E.; ZANDER, M. Fluorescence of bromoperylenes and
the requirements of heavy-atom quenching. Chemical Physics Letters, v. 31, n. 2, p.
251-253, 1975.
[25] TOBITA, Seiji; ARAKAWA, Masayuki; TANAKA, Ikuzo. Electronic relaxation
processes of rare earth chelates of benzoyltrifluoroacetone. The Journal of Physical
Chemistry, v. 88, n. 13, p. 2697-2702, 1984.
[26] TOBITA, Seiji; ARAKAWA, Masayuki; TANAKA, Ikuzo. The paramagnetic metal
effect on the ligand localized S1. apprx.. fwdarw. T1 intersystem crossing in the rare-
earth-metal complexes with methyl salicylate. The Journal of Physical Chemistry, v.
89, n. 26, p. 5649-5654, 1985.

P á g i n a | 50
[27] GULDI, Dirk M. et al. Influence of large metal cations on the photophysical
properties of texaphyrin, a rigid aromatic chromophore. Journal of the American
Chemical Society, v. 122, n. 34, p. 8289-8298, 2000.
[28] VALEUR, Bernard. Effects of intermolecular photophysical processes on
fluorescence emission. Molecular Fluorescence: Principles and Applications, p. 72-
124, 2001.
[29] VILELA, Sérgio Manuel Felipe. Síntese e Caracterização de Polímeros de
Coordenação com Lantanídeos. 2009. Dissertação de Mestrado.
[30] FEYNMAN, Richard P. There's plenty of room at the bottom. Engineering and
science, v. 23, n. 5, p. 22-36, 1960.
[31] BAILAR JR, J. C. Coordination polymers. Interscience: New York, v. 1, p. 1-25,
1964.
[32] BIRADHA, Kumar; RAMANAN, Arunachalam; VITTAL, Jagadese J.
Coordination polymers versus metal− organic frameworks. Crystal Growth and Design,
v. 9, n. 7, p. 2969-2970, 2009.
[33] RDB. On Prussian Blue. Bulletin of the American Group. International Institute
for Conservation of Historic and Artistic Works, p. 19-20, 1964.
[34] BATTEN, Stuart R.; NEVILLE, Suzanne M.; TURNER, David R. Coordination
polymers: design, analysis and application. Royal Society of Chemistry, 2009.
[35] TOMIC, E. A. Thermal stability of coordination polymers. Journal of Applied
Polymer Science, v. 9, n. 11, p. 3745-3752, 1965.
[36] CARLISLE, W. Daniel et al. The crystal and molecular structure of a dinuclear
copper (II) complex of a Robson-type macrocycle,
[Cu2(C26H30N4O2)(H2O)2](BF4)2. Transition Metal Chemistry, v. 11, n. 8, p. 292-
295, 1986.
[37] WANG, Zhenqiang. Design of metal-organic framework materials based upon
inorganic clusters and polycarboxylates. 2006.
[38] YAGHI, Omar M. et al. Open-framework solids with diamond-like structures
prepared from clusters and metal-organic building blocks. In: MRS Proceedings.
Cambridge University Press, 1994. p. 15.
[39] ROWSELL, Jesse LC; YAGHI, Omar M. Metal–organic frameworks: a new class
of porous materials. Microporous and Mesoporous Materials, v. 73, n. 1, p. 3-14, 2004.
[40] CHOI, Sang Beom et al. A Porous and Interpenetrated Metal–Organic Framework
Comprising Tetranuclear IronIII–Oxo Clusters and Tripodal Organic Carboxylates and
Its Implications for (3, 8)-Coordinated Networks. Crystal Growth and Design, v. 7, n.
11, p. 2290-2293, 2007.

P á g i n a | 51
[41] BATTEN, Stuart R. et al. Terminology of metal–organic frameworks and
coordination polymers (IUPAC Recommendations 2013). Pure and Applied
Chemistry, v. 85, n. 8, p. 1715-1724, 2013.
[42] EDDAOUDI, Mohamed et al. Modular chemistry: secondary building units as a
basis for the design of highly porous and robust metal-organic carboxylate
frameworks. Accounts of Chemical Research, v. 34, n. 4, p. 319-330, 2001.
[43] PAZ, Filipe A. Almeida et al. Ligand design for functional metal–organic
frameworks. Chemical Society Reviews, v. 41, n. 3, p. 1088-1110, 2012.
[44] JAMES, Stuart L. Metal-organic frameworks. Chemical Society Reviews, v. 32, n.
5, p. 276-288, 2003.
[45] LEITE, Ana Karina Pereira. Síntese, estrutura e propriedades de polímeros de
coordenação à base de íons lantanídeos e ácidos benzenodicarboxílicos. 2014.
Dissertação de Mestrado. Universidade Federal do Rio Grande do Norte.
[46] WANG, Chih-Chieh et al. Assemblies of two mixed-ligand coordination polymers
with two-dimensional metal-organic frameworks constructed from M (II) ions with
croconate and 1, 2-bis-(4-pyridyl) ethylene (M= Cd and Zn). Crystal Growth & Design,
v. 7, n. 9, p. 1783-1790, 2007.
[47] YAGHI, Omar M. et al. Reticular synthesis and the design of new materials. Nature,
v. 423, n. 6941, p. 705-714, 2003.
[48] GUTSCHKE, Siegfried OH et al. Hydrothermal Synthesis, Structure, and
Magnetism of [Co2 (OH){1, 2, 3‐(O2C) 3C6H3}(H2O)]⋅ H2O and [Co2 (OH){1, 2, 3‐
(O2C) 3C6H3}]: Magnetic Δ‐Chains with Mixed Cobalt Geometries. Angewandte
Chemie International Edition, v. 40, n. 10, p. 1920-1923, 2001.
[49] TRANCHEMONTAGNE, David J. et al. Reticular chemistry of metal–organic
polyhedra. Angewandte Chemie International Edition, v. 47, n. 28, p. 5136-5147,
2008.
[50] YANG, Xiu-Li et al. Porous metalloporphyrinic frameworks constructed from metal
5, 10, 15, 20-tetrakis (3, 5-biscarboxylphenyl) porphyrin for highly efficient and selective
catalytic oxidation of alkylbenzenes. Journal of the American Chemical Society, v.
134, n. 25, p. 10638-10645, 2012.
[51] ZHANG, Jie et al. Photoresponsive coordination assembly with a versatile logs-
stacking channel structure based on redox-active ligand and cupric ion. Journal of the
American Chemical Society, v. 123, n. 48, p. 12105-12106, 2001.
[52] THIRUMURUGAN, A.; RAO, C. N. R. 1, 2-, 1, 3-and 1, 4-Benzenedicarboxylates
of Cd and Zn of different dimensionalities: Process of formation of the three-dimensional
structure. Journal of Materials Chemistry, v. 15, n. 35-36, p. 3852-3858, 2005.

P á g i n a | 52
[53] JEONG, Ok Sang et al. Molecular Networks via Coordination Polymerization.
Synthesis and Characterization of 2-D Polymeric Cobalt (II) Compounds Containing 3,
3'-Dipyridyl Ether Series. Bulletin of the Korean Chemical Society, v. 21, n. 1, p. 39-
43, 2000.
[54] LEE, Yeon-Kyoung; LEE, Soon W. Two-Dimensional Nickel Coordination
Polymers: Ni (OBC)(bipyen)]· H 2 O and [Ni (NDC)(bipyen)(H 2 O)](NDC= 2, 6-
Naphthalenedicarboxylate; OBC= 4, 4'-Oxybis (benzoate); bipyen= trans-1, 2-Bis (4-
pyridyl) ethylene). Bulletin of the Korean Chemical Society, v. 24, n. 7, p. 906-910,
2003.
[55] LÜ, Xing-Qiang et al. 3D Coordination Polymers with Nitrilotriacetic and 4, 4'-
Bipyridyl Mixed Ligands: Structural Variation Based on Dinuclear or Tetranuclear
Subunits Assisted by Na-O and/or OH…O Interactions. Inorganic chemistry, v. 44, n.
13, p. 4515-4521, 2005.
[56] HORIKOSHI, Ryo; MOCHIDA, Tomoyuki; MORIYAMA, Hiroshi. Coordination
Polymers from M (hfac) 2 [M= CuII, MnII] and 4, 4'-Dipyridyldisulfide. Inorganic
chemistry, v. 40, n. 10, p. 2430-2433, 2001.
[57] XU, Haitao; LI, Yadong. A novel microporous coordination polymer constructed by
double-chain molecules. Journal of molecular structure, v. 749, n. 1, p. 74-77, 2005.
[58] NOUAR, Farid et al. Supermolecular building blocks (SBBs) for the design and
synthesis of highly porous metal-organic frameworks. Journal of the American
Chemical Society, v. 130, n. 6, p. 1833-1835, 2008.
[59] QIU, L.‐G.; XIE, A.‐J.; ZHANG, L.‐D. Encapsulation of Catalysts in
Supramolecular Porous Frameworks: Size‐and Shape‐Selective Catalytic Oxidation of
Phenols. Advanced Materials, v. 17, n. 6, p. 689-692, 2005.
[60] CHEN, Xiao-Yan et al. Microporous metal-organic frameworks built on a Ln3
cluster as a six-connecting node. Chemistry of materials, v. 17, n. 11, p. 2866-2874,
2005.
[61] LI, Zong-Qun et al. Ultrasonic synthesis of the microporous metal–organic
framework Cu 3 (BTC) 2 at ambient temperature and pressure: an efficient and
environmentally friendly method. Materials Letters, v. 63, n. 1, p. 78-80, 2009.
[62] YE, Bao-Hui; TONG, Ming-Liang; CHEN, Xiao-Ming. Metal-organic molecular
architectures with 2, 2′-bipyridyl-like and carboxylate ligands. Coordination chemistry
reviews, v. 249, n. 5, p. 545-565, 2005.
[63] STOCK, Norbert; BISWAS, Shyam. Synthesis of metal-organic frameworks
(MOFs): routes to various MOF topologies, morphologies, and composites. Chemical
reviews, v. 112, n. 2, p. 933-969, 2011.

P á g i n a | 53
[64] LIU, Yen-Hsiang et al. Hydrothermal synthesis, crystal structure, and magnetic
property of copper (II) coordination networks with chessboard tunnels. Journal of Solid
State Chemistry, v. 158, n. 2, p. 315-319, 2001.
[65] LU, Jack Y. et al. A New Type of Two-Dimensional Metal Coordination Systems:
Hydrothermal Synthesis and Properties of the First Oxalate-bpy Mixed-Ligand
Framework [M (ox)(bpy)](M= Fe (II), Co (II), Ni (II), Zn (II); ox= C2O42-; bpy= 4, 4'-
bipyridine). Inorganic Chemistry, v. 38, n. 11, p. 2695-2704, 1999.
[66] WANDERLEY, Kaline A.; ALVES JÚNIOR, Severino; PAIVA-SANTOS, Carlos
de Oliveira. Síntese hidrotermal assistida por micro-ondas como metodologia sintética
eficiente para obtenção da rede metalorgânica [ZN (BDC)(H2O)2] n. Química Nova, p.
434-438, 2011.

P á g i n a | 54
Capítulo 3
Materiais e Métodos Esta seção aborda da metodologia a descrição das técnicas utilizadas.

P á g i n a | 55
3. MATERIAIS E MÉTODOS
3.1 Materiais e reagentes
Os reagentes utilizados no processo sintético das redes metalorgânicas encontram-
se listados na Tabela 1. Estes tem seu grau de pureza atestado pelos respectivos
fabricantes e não passaram por nenhuma purificação prévia.
Tabela 3 – Reagentes utilizados na síntese
Reagentes (grau de pureza) Fórmula Química Fabricante
Ácido tereftálico (98%) C6H4(COOH)2 Aldrich
N,N-dimetilformamida (99,7%) (CH3)2NC(O)H Aldrich
Óxido de gadolínio (99,9%) Gd2O3 Aldrich
Óxido de Európio (99,9%) Eu2O3 Aldrich
Óxido de Térbio (99,9%) Tb4O7 Aldrich
Álcool etílico P.A (99,8%) CH3CH2OH Vetec
Ácido nítrico P.A. (69%) HNO3 Vetec
Fonte: Autor
3.2 Síntese das Gd-1,4-BDC dopadas com Eu3+
3.2.1 Estudo do tempo de síntese
Foram dissolvidas quantidades estequiométricas óxidos de gadolínio (Gd2O3) e
európio (Eu2O3), 0,19 mmol e 0,01 mmol, respectivamente em solução aquosa de HNO3.
O sistema foi mantido sob agitação constante a temperatura de 70 oC, até a completa
evaporação do solvente, formando in situ os respectivos nitratos metálicos dos íons
lantanídeos. Subsequentemente, foi adicionado uma solução de 10 ml de DMF contendo
1,6 mmol de 1,4 – H2BDC, mantendo o sistema sob agitação a temperatura ambiente.
A solução resultante foi colocada em um recipiente de teflon, com capacidade de 23 mL,
o recipiente foi vedado em seguida e inserido em um reator de aço inox. O conjunto foi
colocado em uma estufa e submetido à temperatura de 180°C por 3, 5 e 7 dias,
respectivamente. Após a retirada da estufa os materiais foram resfriados até à temperatura
ambiente, e um sólido branco foi obtido por centrifugação. Posteriormente os sólidos
foram lavados em triplicata, com DMF e etanol de forma alternada, sendo denominadas
como amostras 3D, 5D e 7D respectivamente. Os sólidos obtidos por esta rota com

P á g i n a | 56
provável formula química ([Gd1.9Eu0,1(1,4-BDC)3(DMF)2(H2O)]n) foram secos por 24
horas a 60 oC (ver Figura 14).
Figura 14 – Representação da síntese das LOFs
Fonte: Autor.
3.2.2 Estudo da variação da concentração do dopante
Foram sintetizadas amostras contendo, 1, 3, 5, 7 e 9% molar de íons Eu3+, a partir
de quantidades estequiométricas diferentes de Gd2O3 e Eu2O3: 0.198 e 0.002 mmol, 0.194
e 0.006, 0.190 e 0.010, 0.186 e 0.014, 0.182 e 0.018, respectivamente. Utilizou-se o
mesmo procedimento de obtenção dos nitratos metálicos in situ, com adição posterior da
solução de 10 ml de DMF contendo 1,6 mmol de 1,4-H2BDC. As soluções resultantes
foram transferidas para um reator de teflon de mesma capacidade da que já foi citada,
senso o recipiente vedado e inserido num reator de aço inox. O reator foi colocado em um
forno na temperatura de 180 oC, durante 5 dias. Após a retirada do forno os materiais
foram resfriados até à temperatura ambiente, e um sólido branco foi obtido por
centrifugação. Posteriormente os sólidos foi lavado em triplicata, com DMF e etanol de
forma alternada e seco a 60 oC por 24 horas. Os materiais obtidos foram denominados
como MLOF_Eu1%, MLOF_Eu3%, MLOF_Eu5%, MLOF_Eu7%, MLOF_Eu9%,
respectivamente. Para efeito comparativo, uma amostra não dopada Gd-1,4-BDC-MOF
foi preparada obedecendo o mesmo procedimento de síntese (ver Figura 14).

P á g i n a | 57
3.3 Síntese da Gd-1,4-BDC co-dopada com Eu3+ Tb3+
A Gd-1,4-BDC-MOF co-dopada com 2,5% molar de Eu3+ e 2,5% molar de Tb4+
que foi reduzido a Tb3+ utilizando a H2O2 como agente redutor originando a
MLOF_EuTb. Esta rede foi preparada através do mesmo procedimento de sintético, das
amostras dopadas, utilizando as seguintes quantidades estequiométricas de Gd2O3, Eu2O3
e Tb4O7: 0.190, 0.005 e 0.005, respectivamente (ver Figura 14).
3.4 Técnicas de caracterização
Os materiais sintetizados foram analisados por Difração de raios-X,
Espectroscopia no Infravermelho com Transformada de Fourier por Reflectância Total
Atenuada, Análise termogravimétrica, Microscopia Eletrônica de Varredura e
Espectroscopia de Fotoluminescência.
3.4.1 Difração de Raios-X (DRX)
A Difração de Raios-X baseia-se em incidir radiação em uma amostra para
detectar os ângulos dos fótons difratados, que irão produzir um sinal que terá o sinal
registrado sobre detectores eletrônicos de radiação.
Os pós resultantes foram caracterizados por difração de raios-X (DRX) com o
intuito de avaliar as fases presentes e a cristalinidade do material, em um difratômetro
Bruker D2 Phaser utilizando radiação CuKα (λ=1,54Å) com um filtro de Ni, com passo
de 0,02º, corrente de 10mA e voltagem de 30kV num intervalo 2θ de 10° a 70°, a
temperatura de 22 ºC.
3.4.2 Espectroscopia no Infravermelho com Transformada de Fourier por Reflectância
Total Atenuada (FTIR)
Esta técnica é capaz de verificar quantitativamente e qualitativamente os modos
vibracionais das ligações características das fases orgânicas e metálicas, bem, como suas
possíveis interações. É uma técnica analítica muito utilizada, em virtude da possibilidade
de analisar qualquer amostra em praticamente qualquer estado físico.
As análises foram realizadas com um espectrômetro Bruker modelo FT-IR
VERTEX 70 com Platinum ATR na faixa de 400-4000 cm-1.

P á g i n a | 58
3.4.3 Análise termogravimétrica (TGA)
É uma técnica de cunho destrutivo que permite monitorar a variação da massa de
uma amostra em função da temperatura ou do tempo, em um ambiente com temperatura
e atmosfera controladas.
Os materiais foram analisados no Departamento de Química Fundamental da
UFPE, as termogramas foram obtidas na faixa de temperatura de 25–900°C, utilizando
uma termobalança modelo TGA 50 da marca Shimadzu DTG-60H, sob ar atmosférico.
3.4.4 Microscopia eletrônica de varredura (MEV)
Esta técnica consiste na emissão de um feixe de elétrons que irá varrer a amostra
provocando uma série de emissões de sinais relacionados com a interação do feixe de
elétrons incidente. A partir disso é possível obter foto-micrografias do material analisado.
A análise morfológica dos pós foi realizada por Microscopia Eletrônica de
Varredura (MEV), em um microscópio FEI – Inspect F50, com tensão de aceleração 5kV,
modelo TM 3000.
3.4.5 Espectroscopia de fotoluminescência (PL)
Baseia-se no fenômeno da foto-excitação, que consiste em promover os elétrons
dos materiais analisados a transições de estados energéticos maiores. Quando esses
elétrons retornam aos seus estados fundamentais o excesso de energia é expelido do
material e pode incluir a emissão de luz (processo radiativo) ou não (processo não
radiativo). A radiação emitida está relacionada com a diferença entre os dois estados
eletrônicos envolvidos na transição. A quantidade de luz emitida depende da contribuição
relativa ao processo radiativo
Os espectros de excitação e emissão, foram obtidos a partir de amostras sólidas
coletadas a 298 K num espectrofluorímetro Fluorolog Horiba Jobin Yvon.

P á g i n a | 59
Capítulo 4
Resultados e discussão Da síntese a caracterização morfológica e luminescente. Este capítulo encontra-se em
inglês pois está no formato de artigo.

P á g i n a | 60
4.1 Influence of synthesis time on the microstructure and photophysical properties
of Gd-MOFs doped with Eu3+
Jarley Fagner Silva do Nascimento a,d, Bráulio Silva Barros a,b,*, Joanna Kulesza c, João
Bosco Lucena de Oliveira a, Ana Karina Pereira Leite a, Rosivânia Silva de Oliveira a
a Federal University of Rio Grande do Norte, Institute of Chemistry, PO BOX 1662, 59078-970, Natal/RN,
Brazil.
b Federal University of Pernambuco, Department of Mechanical Engineering, 50070-901, Recife/PE,
Brazil.
c Federal University of Pernambuco, Department of Fundamental Chemistry, 50070-901, Recife/PE,
Brazil.
d Federal Institute of Education, Science and Technology of the Rio Grande do Norte, 59500-000,
Macau/RN, Brazil.
*corresponding author: Bráulio Silva Barros
email address: [email protected]
Federal University of Pernambuco, Department of Mechanical Engineering, Av. Prof. Moraes Rego-1235
– Cidade Universitária, 50070-901, Recife/PE, Brazil.
4.1.1 Abstract
Metal Organic Frameworks (MOFs) are hybrid materials, usually crystalline, consisting
of metallic species or clusters, connected by polytopic organic ligands originating bi or
tridimensional porous structures. In this work, Gd-1,4-BDC-MOFs doped with 5% mol
Eu3+ were synthesized via solvothermal method at 180°C. The effect of the synthesis time
(3, 5 or 7 days) on the microstructure and photophysical properties of the obtained MOFs
were evaluated. It was found that porous agglomerates were formed within three days,
gradually changing their morphology to rod-like crystals within seven days. The
photoluminescence excitation and emission spectra revealed an efficient energy transfer
from the ligand to the Eu3+ levels (antenna effect), what is not expected for 1,4-BDC2- in
a Eu(III)-based MOFs. We concluded that the presence of highly paramagnetic Gd3+ ions
in the matrix enhanced the antenna effect, resulting in a strong red emission.
Keywords: MOFs; lanthanides; antenna effect; photoluminescence; microstructure.

P á g i n a | 61
4.1.2 Introduction
Metal-organic frameworks (MOFs) comprise a broad class of crystalline materials
defined as porous networks consisting of metallic ions or clusters linked together by
organic multidentate ligands [1]. Due to their well-defined crystallinity and porosity, high
stability and versatility of structures and topologies, these materials have attracted
considerable attention in the past two decades [2,3].
More recently, MOFs containing lanthanide ions, so-called LOFs (Lanthanide-
Organic Frameworks) have received growing attention due to the unique properties of
lanthanide ions [4-8] combined with the fascinating structural diversity of MOFs.
The potential applications of these materials are very diverse. They can be used
as light-emitting materials, sensors [7,9-10], multimodal imaging contrast agents [11]
catalysts [12], drug delivery carriers [13,14] and markers for gunshot residues [15,16].
Among different organic linkers used for the preparation of LOFs, aromatic
carboxylic acids are preferred as they induce rigidity and porosity to a framework [17].
Moreover, considering a lack of the preferential geometry of lanthanide ions, carboxylate
groups with their diversity of coordination modes, are good candidates for formation of
LOFs. Linear linkers such as terephthalic acid (1,4 - H2BDC) can be considered as an
ideal organic binder. It usually promotes the growth of network homogeneously and acts
as a bridge between metal centers leading to a great variety of structures [17,18]. Several
examples of LOFs based on 1,4 – BDC have been revealed [19-23].
Although the luminescent properties of Eu-1,4-BDC-MOFs have already been
reported [24], little attention has been paid to investigate the relationship between the
morphology of obtained LOFs and their photophysical properties. Since properties such
as photoluminescence, depend directly on structural and morphological characteristics of
materials, it is crucial to understand a mechanism of self-assembly and agglomeration of
LOFs particles [3,24]. Moreover, to the best of our knowledge, Gd-1,4-BDC-MOFs
doped with Eu3+ have never been described before.
Thus, this study aims to evaluate the effect of the synthesis time on the
microstructure and photophysical properties of Gd/Eu-MOFs of the general formula
[Gd1.9Eu0,1(1,4-BDC)3(DMF)2(H2O)]n.

P á g i n a | 62
4.1.3 Experimental section
4.1.3.1 Materials and methods
All reagents and solvents were used as received without further purification.
Terephthalic acid (1,4-H2BDC), gadolinium oxide Gd2O3 and europium oxide Eu2O3
were purchased from Sigma Aldrich. N,N-dimethylformamide (DMF), ethanol (EtOH)
and nitric acid (HNO3, 65%) were acquired from Vetec.
4.1.3.2 Synthesis of Eu-doped Gd-MOFs
Gd-MOFs doped with Eu3+ were prepared as follows: stoichiometric amounts of
gadolinium (Gd2O3) and europium (Eu2O3) oxides, 0.19 mmol and 0.01 mmol,
respectively, were dissolved in an aqueous solution of HNO3 and kept under constant
stirring at 70 °C until complete solvent evaporation. Subsequently, to generated in situ
lanthanide nitrates, 10 ml of DMF solution containing 1.6 mmol of 1,4 – H2BDC were
added under constant stirring at room temperature. The resulting solution was placed in a
23 mL Teflon-lined steel reactor and heated in an oven at 180 °C for 3, 5 or 7 days,
respectively. Next, the mixture was cooled down to room temperature, and the obtained
white solid was filtered, washed with DMF and EtOH and dried at 60°C for 24 hours.
Three samples of a general formula ([Gd1.9Eu0,1(1,4-BDC)3(DMF)2(H2O)]n) prepared
within different synthesis time (3, 5 and 7 days), were then characterized and studied. For
comparison, undoped sample Gd-1,4-BDC was also prepared according to the similar
synthetic procedure.
4.1.3.3 Sample characterizations
Powder X-ray diffraction (PXRD) data were recorded on a Bruker D2 Phaser
diffractometer using Cu Kα radiation (λ = 1.5406 Å) with a Ni filter, operating at 30kV
and 10mA. The PXRD patterns were recorded between 5 and 40o at steps of 0.02o.
Simulated from single crystal data PXRD patterns were calculated using the program
Mercury 3.7.
Thermogravimetric analyses (TGA) were performed on a Shimadzu DTG-60H
thermal analysis system. Samples were heated from 30°C to 900°C at a rate of 10C/min
under nitrogen atmosphere. Attenuated total reflection Fourier transform infrared (ATR-
FTIR) experiments were carried out on a Bruker Vertex 70/v spectrometer.
Morphological analysis of powders was performed on Scanning Electron Microscopy
(SEM) in a Hitachi Tabletop Microscope equipment with 5kV acceleration, TM model
3000. The excitation and emission spectra were collected in a solid state at 298 K on a

P á g i n a | 63
Fluorolog3 Horiba Jobin Yvon spectrofluorometer equipped with Hamamatsu R928P
photomultiplier, SPEX 1934 D phosphorimeter, and a pulsed 150W Xe-Hg lamp.
4.1.4 Results and discussion
4.1.4.1 Sample characterization
The XRD patterns of the Eu/Gd-MOF powders obtained within different synthesis
times are shown in Fig. 15. These diffractograms coincide with a pattern of the Gd-MOF
sample previously prepared by the same route, suggesting that europium has no specific
role in the crystallization process. It can be observed that the sample prepared within three
days showed very low crystallinity compared to other samples, indicating that a longer
time of reaction is needed for producing highly crystalline materials.
All analyzed patterns match well with the simulated pattern from the single-crystal
structure of [Eu2(BDC)3(DMF)2(H2O).DMF], previously reported by Decadt and co-
workers [24]. As the authors described, this structure was solved at a low-temperature
experiment (100 K), what justifies the peak shift observed in comparison to experimental
XRD data collected from powder at room temperature. Because the ionic radii of Eu3+
and Gd3+ are comparable (1.07 Å and 1.05 Å, respectively), Eu3+ ions can substitute Gd3+
ions without any significant changes in the crystal structure. However, it is worth to note
that the intensity ratio between the diffraction peaks at 9.4 and 9.7o (2θ), assigned to the
crystal planes (10-1) and (01-1), respectively, is smaller in the simulated pattern when
compared to the experimental patterns. A second simulated pattern, also shown in Fig.
15, was calculated without considering DMF molecules in the pores. In this case, the
intensity ratio between the diffraction peaks at 9.4 and 9.7o is quite similar to the intensity
ratio observed in the experimental patterns, suggesting the absence of non-coordinated
solvent molecules in the structure.

P á g i n a | 64
Figure 15. PXRD patterns of the synthesized Eu/Gd-MOF samples (prepared within
different synthesis time - 3, 5 and 7 days) and of the pure Gd-MOF matrix, in comparison
with the simulated from single crystal data PXRD patterns of Eu2(BDC)3(DMF)2(H2O)
and Eu2(BDC)3(DMF)2(H2O).DMF.
The crystal structure contains two binuclear inorganic building blocks, in both
cases, trivalent lanthanides (Ln3+) centers are octa-coordinated in a distorted square
antiprism geometry (Fig. 16). In the first building block type, each Ln3+ center is
coordinated to six oxygen atoms from carboxylate groups and two from DMF and water
molecules, respectively. In the second type, each Ln3+ center also has eight oxygen atoms,
seven from carboxylate groups and one oxygen atom from a DMF molecule. These two
building blocks are connected by carboxylate groups from two different 1,4-BDC2-
ligands, forming 1D chains. The chains are cross-linked by 1,4-BDC2- ligands resulting
in a 3D structure with porous channels along the crystallographic direction [111] (Fig.
17).

P á g i n a | 65
Figure 16. Coordination environment of Eu3+ dimer in the crystal structure of Gd/Eu-
MOF samples. Hydrogen atoms are omitted for clarity. Color code: gray (carbon), red
(oxygen) and green (gadolinium or europium).
Figure 17. Projection along the c axis of the partially expanded net structure of Gd/Eu-
MOF samples. Hydrogen atoms and DMF molecules are omitted for clarity. Polyhedra in
yellow represent the lanthanide sites.

P á g i n a | 66
Fig. 18 presents the FTIR spectra of Gd/Eu-MOF samples prepared at different
synthesis times, as well as, of 1,4-H2BDC and DMF. In the IR spectra of MOF samples,
no band at 1670 cm-1 corresponding to the COOH groups is present, indicating the
complete deprotonation of the carboxylic acid and coordination of COO- groups to the
metal center. The bands in the region between 1584 and 1503 cm-1 and at 1386 cm-1
attributed, respectively, to the asymmetric (νas) and symmetric (νs) stretching vibrations
of COO- groups, can be observed. The number of bands present in this spectral region
suggests more than one coordination mode of carboxylate groups, what is in agreement
with the structural description for [Ln2(BDC)3(DMF)2(H2O)], (Ln = Eu, Gd). The
difference between νas and νs, equal to = 152 and 117 cm-1 might indicate a bidentate
bridging and tridentate bridging-chelating coordination mode of carboxylates what was
also found in the structure of [Ln2(BDC)3(DMF)2(H2O)]. A band around 1668 cm-1 may
be attributed to the stretching ν (C=O) vibration of the coordinated DMF molecule. The
band is slightly shifted compared to the stretching vibration ν (C=O) band of a free DMF
(1657 cm-1). Moreover, the δ (OCN) bending vibration band of DMF is shifted to higher
frequencies compared to the absorption band of the pure DMF (from 659 to 676 cm-1)
confirming the presence of coordinated DMF molecule in all samples [25]. The
broadband at around 3450 cm-1 can correspond to the water molecule present in the
structure. The IR spectra of all samples also show bands in the region of 650-730 cm-1
and 500-620 cm-1 indicating the presence of coordinated water molecules. These data are
in line with the crystal description for the reference sample [Ln2(BDC)3(DMF)2(H2O)]
for which coordinated solvent molecules H2O and DMF were also found.

P á g i n a | 67
Figure 18. FTIR spectra of the prepared Gd/Eu-MOF samples, the pure 1,4 – H2BDC,
and DMF.
Thermogravimetric curves of the prepared Gd/Eu samples are shown in Fig. 19.
The initial weight loss of 9.8% starting at around 100°C up to 160°C observed for all
samples can be attributed to the loss of coordinated solvent molecules (DMF and H2O).
No mass loss below 100°C, commonly assigned to the desorption of solvent molecules
from pores, is visible, what corroborates with XRD results.
For the sample prepared within the shortest synthesis time (3 days), the observed
mass loss (9.2%) from 160 to 300°C may be related to the decomposition of the unreacted
ligand. The presence of an amorphous phase in the XRD diffraction pattern of this sample
may also indicate the presence of the unreacted 1,4-H2BDC. In all samples, the weight
loss (45.0, 50.7 and 50.0%, respectively) starting from 650°C is observed and can be
attributed to the framework decomposition following the transformation into Gd and Eu
oxides above 600°C.

P á g i n a | 68
Figure 19. TGA profiles of samples Gd/Eu-MOFs.
The morphology of the prepared powders was analyzed by SEM. As can be seen
in Fig. 20a, the sample prepared within three days presents large porous microcrystals of
the size around 30 µm. By increasing the synthesis time to five days, a decrease in
porosity of the sample is observed (Fig. 20b). Finally, within seven days, apparently,
pores disappear, and microcrystals with a rod-like shape are formed (Fig. 20c).

P á g i n a | 69
Figure 20. SEM images of samples Gd/Eu-MOFs.

P á g i n a | 70
4.1.4.2 Photophysical properties
The photoluminescence excitation spectra of the samples prepared within 3, 5 and
7 days were recorded at room temperature by monitoring the transition 5D0 7F2 at 614
nm (Fig. 21). The presence of the intense broadband with a maximum at 323 nm,
corresponding to the π π* transitions of 1,4-BDC2-, indicates an energy transfer from
the ligand to the metal (antenna effect). The low-intensity narrow bands observed in the
region of 350-550 nm are attributed to the 4f-4f transitions of Eu3+. It is also worth to note
that by increasing the synthesis time, the intensity of the transition 7F0 → 5L6 of Eu3+ ion
decreases, compared to the intensity of the broadband, what may be related with the
crystallinity of the samples. These results suggest that the ligand-sensitized luminescence
process (antenna effect) is more efficient than the direct excitation into the 4F6 levels of
the Eu3+ ion.
Crosby et al. have proposed a commonly accepted mechanism of the energy
transfer from organic ligands to a lanthanide ion [26]. A ligand absorbs ultraviolet
radiation and is excited to a vibrational level of the first excited singlet state (S0 → S1).
The molecule undergoes fast internal conversion to lower vibrational levels of the S1
state, for instance through interactions with solvent molecules. The excited singlet state
can undergo non-radiative intersystem crossing from the singlet state S1 to the triplet state
T1. Subsequently, the system may undergo an intramolecular energy transfer from the
triplet state to a level of the lanthanide ion.
Hilder and co-workers27 have determined the energy level of the terephthalate
triplet, 23.256 cm-1, which is above the emission levels of the Eu3+ ion. This energy gap
might cause numerous non-radiative relaxations before reaching the Eu3+ levels.
Recently, Decadt et al. have reported that the peaks corresponding to the 4f−4f
transitions were comparable in intensity to the broadband originated from the ligand 1,4-
BDC2- in a Eu(III)-based MOF, and therefore concluded that the antenna effect was not
very efficient [24].
On the other hand, our results show that the terephthalate ligand is a good
sensitizer, and the efficient energy transfer observed in our case, may be related to the
presence of the highly paramagnetic Gd3+ ions in the matrix [28]. The 4f levels of this ion
are located above triplet levels of most organic ligands. Consequently, Gd3+-centered
emission cannot be observed. Moreover, the presence of the heavy paramagnetic ion

P á g i n a | 71
enhances the intersystem crossing (ISC) from the singlet (S1) to the triplet (T1) state
because of mixing of the triplet and singlet states (paramagnetic effect) [29-31]. Although
forbidden, this phenomenon occurs due to the spin-orbital coupling [32].
Figure 21. Excitation spectra of samples Gd/Eu-MOFs measured at room temperature
by monitoring the Eu3+ emission at 614 nm.
The emission spectra were recorded using two different excitation wavelengths
(λex = 323 and λex = 395 nm) and are shown in Fig. 22. In both cases, only narrow and
intense peaks assigned to the characteristic transitions of Eu3+ (5D0 →7F0-4) are observed.
The presence of the peak at 578 nm (see inset) corresponding to the strongly forbidden
transition 5D0 → 7F0 indicates that Eu3+ ions occupy a low symmetry site, without an
inversion center such as Cnv, Cn or Cs [7]. The most intense peak with the maximum at
614 nm assigned to the electric dipole 5D0 → 7F2 transition is responsible for the red
luminescence of the prepared samples. The significant difference between peak
intensities attributed to the 5D0 → 7F2 and 5D0 → 7F1 transitions, so called, the asymmetry
factor, confirms the low-symmetry coordination environment around europium center
[7,9]. These data are in good agreement with the results obtained from X-ray diffraction
analysis. As previously presented in Fig. 16, Eu3+ and Gd3+ ions occupy sites with
distorted square antiprism geometry, with low symmetry without an inversion center.

P á g i n a | 72
It is noteworthy to mention that the luminescence intensity is similar for all
samples when excited at 323 nm (emission via energy transfer from the organic ligand to
the Eu3+ levels). However, direct excitation of the Eu3+ ions at 395 nm (7F0 →5L6
transition) causes the increase in the luminescence intensity of the sample prepared within
7 days compared to other samples, what might be associated with the different
crystallinity of the samples.
Figure 22. Emission spectra of samples Gd/Eu-MOFs acquired at room temperature upon
excitation at (a) 323 nm and (b) 395 nm.
Photoluminescence decay curves were obtained by monitoring the most intense
emission at λem= 614 nm upon excitation in the ligand absorption level at 323 nm (π π*)
and upon direct excitation of the Eu3+ at 395 nm. The corresponding profiles are depicted
in Fig. 23. The curves were found to fit a mono-exponential function what usually
indicates the presence of only one coordination site of Eu3+ ions [24]. However, as
previously indicated by XRD data and as observed in Figure 16, there are two different
lanthanide sites in the crystal structure. Although uncommon, some crystal structures may
have two slightly different sites with closely related time-dependent photoluminescence
behavior [24]. In this case, a single exponential term can be used to fit the respective
decay curve.

P á g i n a | 73
The photoluminescence decay times were measured at room temperature with
excitation at 323 (organic ligand) and 395 nm (Eu3+) and are shown in Figure 23 (inset
table). The values lie in the range of 0.296-0.299 and 0.305-0.323 ms, respectively.
Compared to the reported values for europium terephthalate MOFs, which vary from
0.344 and 0.47 ms (hydrated) to 0.94 ms (anhydrous) [24], shorter decay times obtained
in our case may confirm the presence of coordinated water molecules, as expected from
the proposed crystal structure.
Figure 23. Luminescence decay emission curves obtained at room temperature upon
excitation at 323 and 395 nm of samples Gd/Eu-MOFs. The inset table shows the values
of decay lifetimes.
4.1.5 Conclusions
In summary, the synthesis and photophysical properties of intriguing bimetallic
Gd-1,4-BDC MOFs doped with Eu3+ ions were presented here for the first time. Three
syntheses carried out at different synthesis time (3, 5 or 7 days) were performed to
evaluate the influence of the time of reaction on the microstructure, and consequently, the
luminescent properties of such materials. In all samples, the Eu3+ ions were successfully
incorporated in the Gd-1,4BDC MOF matrix without significant distortion of the matrix
structure, what was confirmed by the XRD data analysis. The synthesis time, however,
influenced the crystallinity of the prepared samples. It was observed that the sample

P á g i n a | 74
prepared within 3 days presented very low crystallinity as a result of the short synthesis
time and, moreover, the presence of the unreacted ligand was confirmed by the XRD and
TGA analysis data. In the structure of Gd/Eu-1,4BDC MOF, two slightly different sites
of Eu3+ ions were found, both octa-coordinated in a distorted square antiprism geometry.
The results indicated that the ligand-sensitized luminescence process (antenna effect) is
more efficient than the direct excitation into the 4F6 levels of the Eu3+ ion. We suggested
that the presence of highly paramagnetic Gd3+ ions enhanced the intersystem crossing
(ISC) from the singlet (S1) to the triplet (T1) level and, as a consequence, also the antenna
effect. Unlike excitation via antenna effect, the photoluminescence intensity observed
upon direct excitation of the Eu3+ ions appeared to be dependent on the crystallinity of
the samples. Further research concerning the relation structure/morphology – properties
of Gd/EuMOFs is currently under investigation.
4.1.6 Acknowledgments
The authors thank Federal University of Pernambuco, School of Science and
Technology/UFRN and Federal Institute of Education, Science and Technology of the
Rio Grande do Norte (IFRN). This work was supported by CNPq (grant no. 407445/2013-
7) and PRONEX/FACEPE/CNPq (grant no. APQ-0675- 1.06/14).
4.1.7 References
[1] A. Corma, H. García, F. X. Llabrés i Xamena, Engineering metal organic frameworks
for heterogeneous catalysis, Chem. Rev. 110 (2010) 4606-4655.
[2] G. S. Papaefstathiou, L. R. MacGillivray, Inverted metal–organic frameworks: solid-
state hosts with modular functionality, Coord. Chem. Rev. 246 (2003) 169-184.
[3] Z. Bian, C. Huang, Electroluminescence Based on Lanthanide Complexes in: C.
Huang (Ed.), Rare Earth Coordination Chemistry: Fundamentals and Applications, John
Wiley & Sons (Asia) Pte Ltd, 2010, 435-472.
[4] B. F. Hoskins, R. Robson, Infinite polymeric frameworks consisting of three
dimensionally linked rod-like segments, J. Am. Chem. Soc. 111 (1989) 5962-5964.
[5] B. F. Abrahams, B. F. Hoskins, D. M. Michail, R. Robson, Assembly of porphyrin
building blocks into network structures with large channels, Nature, 369 (1994) 727-729.
[6] H. Li, M. Eddaoudi, M. O'Keeffe, O. M. Yaghi, Design and synthesis of an
exceptionally stable and highly porous metal-organic framework, Nature, 402 (1999)
276-279.

P á g i n a | 75
[7] B. Chen, L. Wang, Y. Xiao, F. R. Fronczek, M. Xue, Y. Cui, G. Qian, A luminescent
metal–organic framework with Lewis basic pyridyl sites for the sensing of metal
ions. Angew. Chem. Int. Ed. 48 (2009) 500-503.
[8] L. Yang, S. Zhang, X. Qu, Q. Yang, X. Liu, Q. Wei, S. Chen, Synthesis, crystal
structure and photoluminescence property of Eu/Tb MOFs with mixed polycarboxylate
ligands, J. Solid State Chem, 231 (2015) 223-229.
[9] B. V. Harbuzaru, A. Corma, F. Rey, P. Atienzar, J. L. Jordá, H. García, J. Rocha,
Metal–organic nanoporous structures with anisotropic photoluminescence and magnetic
properties and their use as sensors, Angew. Chem. Int. Ed. 47, (2008) 1080-1083.
[10] F. Pellé, P. Aschehoug, S. Surblé, F. Millange, C. Serre, G. Férey, Interactions
between Eu3+ ions in inorganic–organic hybrid materials, J. Solid State Chem. 183
(2010) 795-802.
[11] K. M. Taylor, A. Jin, W. Lin, Surfactant‐Assisted Synthesis of Nanoscale
Gadolinium Metal–Organic Frameworks for Potential Multimodal Imaging, Angew.
Chem. 120 (2008). 7836-7839.
[12] J. Lee, O. K. Farha, J. Roberts, K. A. Scheidt, S. T. Nguyen, J. T. Hupp, Metal–
organic framework materials as catalysts, Chem. Soc. Rev. 38 (2009) 1450-1459.
[13] C. Y. Sun, C. Qin, X. L. Wang, Z. M. Su, Metal-organic frameworks as potential
drug delivery systems, Expert Opin. Drug Del. 10 (2013) 89-101.
[14] B. S. Barros, J. Chojnacki, A. A. M. Soares, J. Kulesza, L. L. da Luz, S. A. Júnior,
Thermostability and photophysical properties of mixed-ligand
carboxylate/benzimidazole Zn (II)-coordination polymers, Mat. Chem. Phys. 162 (2015)
364-371.
[15] I. T. Weber, A. J. G. de Melo, M. A. D. M. Lucena, M. O. Rodrigues, S. A. Júnior,
High photoluminescent metal–organic frameworks as optical markers for the
identification of gunshot residues, Anal. Chem. 83 (2011) 4720-4723.
[16] I. T. Weber, I. A. Terra, A. J. de Melo, M. A. D. M. Lucena, K. A. Wanderley, C. D.
O. Paiva-Santos, S. A. Júnior, Up-conversion properties of lanthanide-organic
frameworks and how to track ammunitions using these materials. Rsc Adv. 2 (2012)
3083-3087.
[17] F. A. A. Paz, J. Klinowski, S. M. Vilela, J. P. Tome, J. A. Cavaleiro, J. Rocha, Ligand
design for functional metal–organic frameworks, Chem. Soc. Rev. 41 (2012) 1088-1110.
[18] R. E. Morris, Ionothermal synthesis—ionic liquids as functional solvents in the
preparation of crystalline materials, Chem. Commun. 21 (2009) 2990-2998.
[19] X. P. Yang, R. A. Jones, J. H. Rivers, R. P. J. Lai, Syntheses, structures and
luminescent properties of new lanthanide-based coordination polymers based on 1,4-
benzenedicarboxylate (bdc), Dalton T. 35 (2007) 3936-3942.

P á g i n a | 76
[20] T. M. Reineke, M. Eddaoudi, M. Fehr, D. Kelley, O. M. Yaghi, From condensed
lanthanide coordination solids to microporous frameworks having accessible metal
sites, J. Am. Chem. Soc. 121 (1999) 1651-1657.
[21] A. Deluzet, W. Maudez, C. Daiguebonne, O. Guillou, Interplane distances
modulation in lanthanide-based coordination polymers, Cryst. Growth Des. 3 (2003) 475-
479.
[22] L. Pan, N. Zheng, Y. Wu, S. Han, R. Yang, X. Huang, J. Li, Synthesis,
characterization and structural transformation of a condensed rare earth metal
coordination polymer, Inorg. Chem. 40 (2001) 828-830.
[23] X. Guo, G. Zhu, F. Sun, Z. Li, X. Zhao, X. Li, S. Qiu, Synthesis, structure, and
luminescent properties of microporous lanthanide metal-organic frameworks with
inorganic rod-shaped building units, Inorg. Chem. 45 (2006) 2581-2587.
[24] R. Decadt, K. Van Hecke, D. Depla, K. Leus, D. Weinberger, I. Van Driessche, R.
Van Deun, Synthesis, crystal structures, and luminescence properties of carboxylate
based rare-earth coordination polymers, Inorg. Chem. 51 (2012) 11623-11634.
[25] S. Akopyan, H. Bertagnolli, I. Boyarskaya, D. Leicht, R. Merkle, L. Solovieva, E.
Vilaseca, IR spectra and microstructure of electrolyte solutions. Dependence of
spectroscopic characteristics of solvated molecules on composition of solvates in the
system CH3CN–Mg(ClO4) 2–DMF, Phys. Chem. Chem. Phys. 3 (2001) 2098-2104.
[26] G. A. Crosby, R. E. Whan, J. J. Freeman, Spectroscopic studies of rare earth chelates
J. Phys. Chem. 66 (1962) 2493-2499.
[27] M. Hilder, P. C. Junk, U. H. Kynast, M. M. Lezhnina, Spectroscopic properties of
lanthanoid benzene carboxylates in the solid state: Part 1, J. Photoch. Photobio. 202
(2009) 10-20.
[28] L. Liao, C. W. Ingram, D. Vandeveer, K. Hardcastle, K. M. Solntsev, D. Sabo, R. T.
Weber, Poly-(bis ((μ 4-1, 4-benzenedicarboxylato)-bis (μ 2-N, N-dimethylformamide)-
(nitrato)-gadolinium (III))) metal organic framework: Synthesis, magnetic and
luminescence properties, Inorg. Chim. Acta 391 (2012) 1-9.
[29] K. Binnemans, Lanthanide-based luminescent hybrid materials, Chem. Rev. 109
(2009) 4283-4374.
[30] S. Tobita, M. Arakawa, I. Tanaka, Electronic relaxation processes of rare earth
chelates of benzoyltrifluoroacetone, J. Phys. Chem. 88 (1984) 2697-2702.
[31] S. Tobita, M. Arakawa, I. Tanaka, The paramagnetic metal effect on the ligand
localized S1 T1 intersystem crossing in the rare-earth-metal complexes with methyl
salicylate, J. Phys. Chem. 89 (1985) 5649-5654.
[32] S. P. McGlynn, T. Azumi, M. Kinoshita, Molecular spectroscopy of the triplet state,
Prentice-Hall, (1969).

P á g i n a | 77
4.2 Photoluminescence in Mixed Lanthanide-Organic Frameworks: effect of the
Eu3+ content and co-doping with Tb3+
Jarley Fagner Silva do Nascimento a,b, Antonio Marcos Urbano de Araújo c, Joanna
Kulesza d, Arthur Felipe de Farias Monteiro d, Severino Alves Júnior d, Bráulio Silva
Barros a,e,*.
a
Federal University of Rio Grande do Norte, Institute of Chemistry, PO BOX 1662, 59078-970,
Natal/RN, Brazil. b
Federal Institute of Education, Science and Technology of the Rio Grande do Norte, 59500-000,
Macau/RN, Brazil. c Federal University of Rio Grande do Norte, School of Science and Technology, 59078-970, Recife/PE,
Brazil. d Federal University of Pernambuco, Department of Fundamental Chemistry, 50070-901, Recife/PE,
Brazil. e Federal University of Pernambuco, Department of Mechanical Engineering, 50070-901, Recife/PE,
Brazil.
*corresponding author: Bráulio Silva Barros
Email address: [email protected]
Federal University of Pernambuco, Department of Mechanical Engineering, Av. Prof. Moraes Rego-1235
– Cidade Universitária, 50070-901, Recife/PE, Brazil.
4.2.1 Abstract
Mixed Lanthanide-Organic Frameworks (MLOFs) based on Gd3+, Eu3+ and Tb3+ ions and
terephthalate were synthesized under solvothermal conditions and characterized by
powder X-ray diffraction, infrared spectroscopy, thermal analyses, scanning electron
microscopy and photoluminescence spectroscopy. Analyses of X-ray diffraction data
indicated the Gd/Eu-1,4-BDC single phase formation in samples doped up to 7 mol% of
Eu3+ ions. By increasing the europium content, a second crystalline phase was formed.
Both crystalline phases with a metal-organic structure exhibited a red luminescence due
to the characteristic 4f-4f transitions of Eu3+ ions. Although not observed in the X-ray
diffraction patterns, most probably the second phase was also present in the sample with
7 mol% of Eu3+ ions, based on the results of photoluminescence. The co-doped sample
Gd/Eu/Tb-1,4-BDC with 2.5 mol% of Eu3+ and 2.5 mol% of Tb3+ was prepared and a
single phase was obtained. This sample exhibited both red and green emissions due to the
presence of Eu3+ and Tb3+ ions, respectively. Furthermore, the spectroscopic analysis
indicated the energy transfer from Tb3+ to Eu3+, which allows the color tuning by
changing the excitation wavelength.
Keywords: MOFs; terephthalate; lanthanides; antenna effect; tunable luminescence.

P á g i n a | 78
4.2.2 Introduction
Metal-Organic Frameworks (MOFs) have emerged as an important class of hybrid
porous materials containing metal clusters linked through organic multidentate ligands
[1]. Due to their high crystallinity, chemical stability and versatility of structures and
topologies [2,3], MOFs have received great attention in past two decades for their
applications in magnetism [4], gas adsorption and separation [5], drug delivery [6],
catalysis [7], etc.
Owing to the unique luminescent properties of lanthanide ions and inherent
porosity of MOFs, Lanthanide-Organic Frameworks (LOFs) have been revealed as
promising candidates for light-emitting materials [8], sensors [9-11], multimodal image
contrast agents [12] catalysts [13] and luminescent markers for gunshot residues [14].
Recently, considerable attention has been paid to investigate the structure-
photoluminescence relationship of LOFs. However, the precise design and prediction are
challenging, because of the lability of lanthanide ions combined with the lack of
preferential coordination geometry [15]. Therefore, systematic and profound studies on
photophysical properties of LOFs are still required.
Regarding the diversity and flexibility of their coordination modes, aromatic
polycarboxylate ligands are suitable for constructing lanthanide-organic frameworks
[16]. Linear organic molecules such as terephthalic acid (1,4 - H2BDC) are attractive
organic binders since they promote homogeneous network growth and some LOFs based
on this ligand have already been revealed [17-21]. Organic linkers not only dictate the
structure of the network but also act as efficient sensitizers for lanthanide ions.
Recently, our group has reported a new luminescent Gd-1,4-BDC-MOF doped
with Eu3+ and demonstrated that terephthalate ligand could act as a good sensitizer for
Eu3+ ion due to the paramagnetic effect caused by the presence of Gd3+ in the matrix [22].
As a continuation of our previous study, this paper presents a series of mixed-
lanthanide-MOFs based on terephthalate. This study investigated the influence of the Eu3+
dopant concentration on the photophysical properties of Gd/Eu-1,4-BDC-MOFs. The
effect of the excitation wavelength on color tuning in co-doped sample Gd/Tb/Eu-1,4-
BDC-MOF is also discussed here.

P á g i n a | 79
4.2.3 Experimental section
4.2.3.1 Materials and methods
All reagents and solvents were used as received without further purification.
Terephthalic acid (1,4-H2BDC), gadolinium oxide (Gd2O3), europium oxide (Eu2O3) and
terbium oxide (Tb4O7) were purchased from Sigma Aldrich. N,N-dimethylformamide
(DMF), ethanol (EtOH), hydrogen peroxide (H2O2) and nitric acid (HNO3, 65%) were
acquired from Vetec.
4.2.3.2 Synthesis of Eu-doped Gd-1,4-BDC-MOFs
To synthesize the sample doped with 1 mol% of Eu3+ (MLOF_Eu1%), the
stoichiometric amounts of Gd2O3 and Eu2O3, 0.198 and 0.002 mmol, respectively, were
dissolved in an aqueous solution of HNO3 and kept under constant stirring at 70 oC until
complete solvent evaporation. The resultant nitrates were dissolved together with 1.6
mmol of 1,4-H2BDC in 10 ml of DMF and stirred for five minutes. Then, the solution
was transferred to a Teflon-lined steel reactor and heated in an oven at 180 oC for five
days. Subsequently, the mixture was cooled down to room temperature, and the obtained
white solid was collected by centrifugation, washed three times with DMF and EtOH and
dried at 60 °C for 24 hours.
The samples doped with 3 (MLOF_Eu3%), 5 (MLOF_Eu5%), 7 (MLOF_Eu7%)
and 9 mol% of Eu3+ (MLOF_Eu9%) were prepared following the same procedure,
however within different stoichiometric amounts of Gd2O3 and Eu2O3; 0.194 and 0.006,
0.190 and 0.010, 0.186 and 0.014, 0.182 and 0.018, respectively. For comparison, an
undoped sample Gd-1,4-BDC was also prepared according to the same synthetic
procedure.
4.2.3.3 Synthesis of Eu/Tb-co-doped Gd-1,4-BDC-MOF
The co-doped Gd-1,4-BDC-MOF with 2.5 mol% of Eu3+ and 2.5 mol% of Tb3+
(MLOF_EuTb) was prepared by the same synthetic procedure using the following
stoichiometric amounts of Gd2O3, Eu2O3, and Tb4O7; 0.190, 0.005 and 0.005,
respectively. Hydrogen peroxide was used to reduce Tb4+ to Tb3+.
4.2.3.4 Sample characterizations
Powder X-ray diffraction (PXRD) analyses were conducted on a Bruker D2
Phaser diffractometer using Cu Kα radiation (λ = 1.5406 Å) with a Ni filter, operating at

P á g i n a | 80
30 kV and 10 mA. The PXRD patterns were recorded between 5 and 60o at steps of 0.02o.
Thermogravimetric analyses (TGA) were performed on a Shimadzu DTG-60H thermal
analysis system. Samples were heated from 30 °C to 900 °C at a rate of 20 C/min under
nitrogen atmosphere. Attenuated total reflection Fourier transform infrared (ATR-FTIR)
experiments were carried out on a Bruker Vertex 70/v spectrometer. Morphological
analysis of powders was performed by Scanning Electron Microscopy (SEM) on a FEI
Quanta 200 FEG microscope. The excitation and emission spectra were collected in the
solid state at 298 K on a Fluorolog3 Horiba Jobin Yvon spectrofluorometer equipped with
Hamamatsu R928P photomultiplier, SPEX 1934 D phosphorimeter, and a pulsed 150W
Xe-Hg lamp.
4.2.4 Results and discussion
The synthesized samples were characterized by powder X-ray diffraction (PXRD)
to identify the obtained crystalline phases. The corresponding experimental and simulated
diffractograms are shown in Fig. 24. As can be seen, the samples doped up to 7 mol% of
Eu3+ as well as the sample codoped with Tb3+ present a single-phase, whereas in the
PXRD pattern of the sample doped with 9 mol% of Eu3+ ions two phases are observed.
These phases are isostructural with [Eu2(BDC)3(DMF)2(H2O).DMF], here named
MLOF1, and [Eu2(BDC)3(DMF)2(H2O)2], here named MLOF2, respectively. However,
one can notice the discrepancy of intensity between the diffraction peaks at about 9.4 and
9.7o in the phase MLOF1 in the experimental and simulated patterns.

P á g i n a | 81
Figure 24. X-ray powder diffraction pattern of the synthesized MLOF samples in
comparison with the simulated from single crystal data PXRD patterns of
Eu2(BDC)3(DMF)2(H2O).DMF <MLOF1> and Eu2(BDC)3(DMF)2(H2O)2 <MLOF2>.
The crystal structure of MLOF1 was previously reported by Decadt and coworkers
[23] and most recently by our group [22]. It consists of a 3D structure with porous
channels along the crystallographic direction “[111]”. These channels are formed by 1D
chains cross-linked to each other by 1,4-BDC2- ligands. Fig. 25a exhibits the 3D channels
of MLOF1 without any DMF molecules for better clarity. There are two different types
of binuclear inorganic building blocks in the chains, where lanthanide ions are surrounded
by oxygen atoms from the 1,4-BDC2-, DMF and water molecules. Additional guest DMF
molecules are found in the porous channels (non-coordinated DMF). The two kinds of
building blocks together with the coordinated and non-coordinated DMF molecules
present in the structure are depicted in Fig. 25b. It was observed that the non-coordinated
DMF molecules are distributed through the lattice plane (01-1), contributing to the
diffraction peak intensity with the same Miller indices at 9.7o (Fig. 25c). This peak
appears less intense in the experimental patterns compared to the simulated pattern for
[Eu2(BDC)3(DMF)2(H2O).DMF]. Therefore, another simulated diffraction pattern was
calculated without considering the presence of non-coordinated DMF molecules. Fig. 25d
exhibits both, simulated and experimental patterns of the samples MLOF_Eu1% and

P á g i n a | 82
MLOF_EuTb. It is clearly seen that without non-coordinated DMF, the intensity of the
diffraction peak at 9.7o decreases compared to the peak at 9.4o, what suggests the absence
of guest DMF in the channels of the crystal lattice. In the simulated patterns shown in
Fig. 25d, the peak at 9.4o corresponds to the overlapping of the diffraction peaks related
to the lattice planes (1-10) and (10-1), at 9.33 and 9.41o, respectively. We assume that the
left shoulder of the peak at 9.4o, observed in the experimental patterns, corresponds to the
peak shift related to the lattice plans (1-10) indicating a slight deformation of the unit cell.
Such deformation may be attributed to the slight difference in the cation radius [23] of
the lanthanide ion Gd and Eu, both present in the prepared samples; whereas the simulated
data were calculated for a Eu-based MOF.
It is also worth to mention the phenomenon known as breathing, which has been
observed in several MOFs, such as in the MIL-53(M) family ([M(bdc)(OH)]n with bdc =
1,4-benzenedicarboxylate, and M = Al, Fe, Cr, Sc, Ga, In) [24-31]. These MOFs feature
a change in the unit cell volume upon external stimuli (e.g. guest molecule
adsorption/desorption) [24].
The crystal structure of MLOF2 was previously described by Zhang and
coworkers [32]. There is just one binuclear inorganic building block coordinated by two
water and two DMF molecules. The building blocks are connected to each other by six
1,4-BDC2- molecules (See Fig. S1a), providing the 3D structure with porous channels
along the crystallographic b axis. Fig. S1b exhibits the 3D channels without any DMF or
water molecules for better clarity.

P á g i n a | 83
Figure 25. (a) Projection along the c axis of the partially expanded net structure and (b)
coordination environment of Eu3+ dimer in the crystal structure of MLOF1 with both
coordinated and non-coordinated DMF molecules. (c) View of lattice plane (01-1)
displaying the non-coordinated DMF molecules and (d) simulated PXRD pattern of
MLOF1 without non-coordinated DMF molecules. Color code: black (carbon), red
(oxygen), blue (nitrogen), grey (hydrogen) and green (gadolinium or europium).
Polyhedra in yellow represent the lanthanide sites.
The thermal analyses (TGA-DrTGA) have confirmed the absence of guest DMF
in the lattice channels, as can be seen in Fig. S2 (Supporting Information). Except for the
sample MLOF_Eu9%, only one lower-temperature mass-loss event was observed from
90 to 220 oC, related to the coordinated solvent molecules (DMF and water). In the case
of non-coordinated DMF molecules, the second lower temperature mass-loss event would
be observed, which is not the case. The synthesized MOFs are thermally stable until 450
oC, at which temperature the organic ligand begins to decompose, and the lattice
collapses. The sample MLOF_Eu9%, exhibits the first mass-loss stage longer than for
other samples, until 300 oC, probably due to the presence of the secondary phase.
FTIR spectra of the samples containing different Eu3+ dopant concentrations and
of the terephthalic acid are presented in Fig. 26. The absence of a band at around 1670
cm-1 corresponding to the stretching vibration of the C=O bond in the COOH confirms

P á g i n a | 84
that all carboxylate groups in the MLOF samples are coordinated to the metal center. All
spectra are very similar to each other. The bands in the region between 1555 and 1501
cm-1 and at 1384 cm-1 attributed, respectively, to the stretching, asymmetric (νas) and
symmetric (νs) vibrations of the COO- groups, can be observed for all samples. The
difference between (νas) and (νs), equal to = 171 and 117 cm-1 might indicate the
bidentate bridging and tridentate bridging-chelating coordination modes of carboxylates
[33], what is in agreement with the analysis of the crystal structure of the samples. The
sample MLOF_Eu9%, which is a mixture of phases, presents a very similar IR spectrum
compared to the pure-phase samples. It is noteworthy to mention, however, that the
coordination modes present in the sample MLOF_Eu9% are very similar to that present
in other samples. Therefore, no additional bands are observed in the IR spectrum, or the
bands corresponding to both phases are superimposed in the same region.
The IR spectra evidence the presence of coordinated solvent molecules, what is in
line with the description of the crystal structures. The bands around 1647-1662 cm-1 and
at 676 cm-1 may be attributed to the stretching ν (C=O) and bending δ (OCN) vibrations
of the coordinated DMF molecule [34]. The FTIR spectra of all samples also present
bands at 3427 and 510 cm-1, suggesting the presence of coordinated water molecules.
Figure 26. Absorption spectra in the infrared region for 1,4 – H2BDC and MLOF
samples.

P á g i n a | 85
Morphological analysis of the synthesized samples was conducted by scanning
electron microscopy (SEM). The powders of MLOF_Eu1%-MLOF_Eu7% and
MLOF_EuTb show the same morphology (see Fig. 27a-d, e). The powders are composed
of submicrometer primary particles, which in some cases assemble into soft micrometric
agglomerates. It appears that the increasing content of dopant does not affect the
morphology of these powders. However, when the dopant concentration reaches 9% in
mol and a second phase crystallizes the morphology changes from soft to hard
agglomerates. This seems to be related to the crystalline structure of the second phase and
not to the dopant concentration.

P á g i n a | 86
Figure 27. SEM images of the powder of MLOF samples.

P á g i n a | 87
The excitation spectra of MLOFs were obtained by monitoring the emission of the
5D0 → 7F2 transition of the Eu3+ ions at 614-615 nm (Fig. 28). It can be seen a broadband
at the range of 250-350 nm and two relatively low-intensity 7F0 → 5D4, 5L6 transitions of
the Eu3+ ions at 362 and 394 nm, respectively. Because the 4f sublevels of Gd3+ ions are
located above the triplet levels of most organic linkers, the emissions of these metal
centers cannot be observed. The broadband has two components with maxima at 298 and
325 nm, probably, assigned to the organic ligand (1,4-BDC) excited states. These two
components were also observed for the pure terephthalic acid (1,4-H2BDC) with similar
relative intensities and positions to those observed in the MLOFs excitation spectra (See
Fig. S3). However, the contribution of ligand-to-metal charge transfer (LMCT) cannot be
entirely excluded [35-37].
Figure 28. Excitation spectra of the samples MLOF_Eu1%-MLOF_Eu9% measured at
room temperature by monitoring the Eu3+ emission at 614 nm.
Fig. 29a-d show the emission spectra and the decay curves of MLOFs. The spectra
are composed of sharp emission lines assigned to the 5D0 → 7F0,1,2,3,4 transitions from
Eu3+ ions [14]. It is worth noting the presence of the 5D0 → 7F0 transition at 578 nm,
indicating that the Eu3+ ions are embedded in a low symmetry environment without
inversion center, typically Cnv, Cn or Cs [9]. Moreover, the 5D0 → 7F2 electric dipole
transition, which is sensitive to the first coordination sphere, has a higher intensity than

P á g i n a | 88
the 5D0 → 7F1 magnetic dipole transition, confirming that Eu3+ ions occupy a low
symmetry site and without an inversion center [38, 39].
Upon direct excitation of the 5L6 energy level of the Eu3+ ions (394 nm), the
sample MLOF_Eu9% showed a broadening of its emission lines. Indeed, this is a
consequence of the splitting of the 5D0→7F2 transition due to a perturbation in the
crystalline field (see Fig. 29a). Also, the decay curve obtained by monitoring the emission
at 614 nm (see Fig. 29b) does not match with curves obtained for the other samples. Less
evidently, but the same behavior was also observed for the sample MLOF_Eu7%. On the
other hand, the samples with below 7% in moles of Eu3+ ions show practically the same
decay curve profile. The MLOFs showed very similar emission spectra and decay curve
profiles when excited at 325 nm (see Fig 29c-d). However, it is possible to see that the
relative intensity of the emission lines depends on the Eu3+ ions concentration, what is
also observed in Fig 29a. All decay curves were well reproduced by a mono-exponential
function, except the curve of the sample MLOF_Eu9%, better reproduced by a bi-
exponential function. The emission lifetimes are summarized in Table 1. It seems that the
lifetime values are almost independent of the Eu3+ ions concentrations up to 7%,
increasing substantially only for the sample with the highest content of Eu3+ (9%). We
also note that upon excitation at 394 nm, the average lifetime value is higher than the one
observed upon excitation at 325 nm, what is expected since the phase MLOF2 is not
sensitive to the excitation at 325 nm.

P á g i n a | 89
Figura 29. Emission spectra of the samples MLOF_Eu1%-MLOF_Eu9% acquired at
room temperature upon excitation at (a) 395 nm and (c) 325 nm. Decay emission curves
obtained at 298 K upon excitation of the samples MLOF_Eu1%-MLOF_Eu9% at (b) 394
nm and (d) 325 nm.
Samples λexc (nm) λem (nm) τ (ms) τ1 τ2 τav (ms)
MLOF_Eu1% 394 614 0,30 – – –
MLOF_Eu3% 394 614 0,30 – – –
MLOF_Eu5% 394 614 0,31 – – –
MLOF_Eu7% 394 614 0,32 – – –
MLOF_Eu9% 394 614 – 0,65 0,11 0,572
394 618 – 0,647 0,109 0,568
MLOF_Eu1% 325 614 0,30 – – –
MLOF_Eu3% 325 614 0,31 – – –
MLOF_Eu5% 325 614 0,29 – – –
MLOF_Eu7% 325 614 0,31 – – –
MLOF_Eu9% 325 614 – 0,43 0,27 0,47
Table 4. Lifetime for the samples MLOF_Eu1%, MLOF_Eu3%, MLOF_Eu5%,
MLOF_Eu7% and MLOF_Eu9%.

P á g i n a | 90
Figure 30 shows the emission spectra recorded upon excitation at 280, 300, 325
and 394 nm and the excitation spectra obtained by monitoring at 614 and 618 nm the
sample MLOF_Eu9%. While the emission spectrum obtained upon excitation at 325 nm
presents only one 7F2 Stark level, the spectra recorded upon excitation at 280, 300 and
394 nm show the splitting of the 5D0→7F2 transition in four Stark components (see Fig.
30a-b). It is worth noting that the spectra collected upon excitation at 325 nm are similar
to those obtained for the other samples with a lower concentration of Eu3+ ions, which
present a single crystalline phase (MLOF1). Thus, the Stark components observed at
about 611, 614, 618 and 622 nm seem to be a consequence of the selective excitation of
the second crystalline phase (MLOF2).
In the case of the structure MLOF1, the Eu3+ ions are coordinated by eight oxygen
atoms in a distorted square antiprism geometry with C4v symmetry, while in the structure
of MLOF2, the ions are coordinated by nine oxygen atoms in a distorted monocapped
square antiprism geometry with C2v symmetry or lower [40]. Both coordination spheres
are depicted in Fig. 30a.
Fig 30c shows the excitation spectra obtained by monitoring the emissions at 614
and 618 nm, respectively. In both cases, two broad bands are observed with maxima at
298 and 325 nm, respectively, as well as the 7F0 → 5L6 transition of Eu3+ ions at 394 nm.
We assume that the excitation broadband at 325 nm, which appears to be sensitive to the
monitoring wavelength, belongs to the phase MLOF1; whereas the excitation broadband
at 298 nm is related to both MLOF1 and MLOF2 phases.

P á g i n a | 91
Figure 30. (a-b) Emission spectra of the sample MLOF_Eu9% recorded at room
temperature upon excitation at 280, 298, 325 and 394 nm and (c) excitation spectra of the
sample MLOF_Eu9% obtained by monitoring the emission at 614 and 618 nm.
Tunable luminescence properties may be conferred to hybrid host matrices by co-
doping with different lanthanide ions and controlled by the excitation wavelength. Fig.
31 shows the emission spectra of the Eu3+/Tb3+ co-doped sample (MLOF_EuTb) obtained
under different excitation wavelengths. The spectra obtained under organic ligand
excitation at 298 and 325 nm are much more intense than those obtained via direct
excitation of the lanthanide ions at 378, 394 and 464 nm. Again, the antenna effect is the
most efficient energy transfer mechanism.
By exciting of the 5L6 and 5D2 energy levels of Eu3+ ions at 394 and 464 nm,
respectively, only the transitions 5D0 → 7FJ of the Eu3+ ions are observed. This confirms
that there is no energy transfer from Eu3+ to Tb3+ ions. On the other hand, by exciting the
5G6, 5D3 energy levels of Tb3+ ions at 378 nm both, Tb3+ (5D4 → 7FJ) and Eu3+ (5D0 →
7FJ) transitions are observed. In this case, the energy transfer from Tb3+ to Eu3+ ions may
be confirmed.
The chromatic coordinates (CIE 1931 and field of view 2 degrees) were calculated
by using the program SPECTRA LUX [41] and are also shown in Fig. 31. It is observed

P á g i n a | 92
that the color of the emission can be tuned from green to red passing through the orange
in the function of the excitation wavelength.
Figure 31. Emission spectra of MLOF_EuTb acquired at room temperature upon
excitation at 265, 300, 323, 378, 394 and 464 nm (b) CIE diagram points of MLOF_EuTb
for different excitation wavelengths.
Fig. 32 shows the schematic representation of the most probable energy transfer
mechanisms in the MLOFs. These mechanisms were proposed based on the works of
Crosby and Whan [42-44].
The excitation process may occur from the ground state (S0) to the first excited
singlet state (S1) of the BDC ligand via absorption (A) at 298 e 325 nm. In the first case,
the absorption is followed by an internal conversion (IC) from the higher to the lower
vibrational energy levels of S1 and an exchange of multiplicity for triplet state (T1)
originating from the intersystem crossings (ISC).
The energy transfer from T1 to the excited states of the lanthanides may proceed
by two different ways. In the first case, the energy is transferred to the Eu3+ excited 5D2
state resonant with the linker triplet level. As a rule, the energy gap between triplet state

P á g i n a | 93
and the emitting level should be between 1500 and 5000 cm-1 to observe efficient
luminescence of the Eu3+ [45]. Posteriorly, non-radiative relaxation occurs, followed by
radiative decays from 5D0 (Eu3+) level to 7F0–4. In the second case, we have the energy
transfer to the 5D4 excited state of Tb3+. Then, the photon returns to the ground state
generating the terbium emissions (5D4 → 7F6,5,4) or transfers this energy to the excited 5D1
energy level of Eu3+ followed by the relaxation to the emissive 5D0 level.
The mechanisms related to the direct excitation of the Tb3+ (λexc = 378 nm) and
Eu3+ (λexc = 394 and 464 nm) ions can be described as follow. The direct excitation
process of Tb3+ ions occurs from the absorption of ultraviolet radiation (λ= 378 nm)
promoting the photon transfer from the ground state 7F6 to the excited state 5D3, which
posteriorly decays via multiphonon relaxation (MR) to the 5D4 emitting level. From the
5D4 level, the photon decay originating the characteristic 5D4 →7F6, 5, 4 emissions or
transfer its energy to the excited levels of lower energy (5D0) of the Eu3+ ions [38].
The direct excitation of Eu3+ ions in MLOFs may occur by absorption of
ultraviolet radiation (λ= 394 or 464 nm) promoting the photons from the 7F0 ground state
to the 5D4 and 5D2 excited states, respectively. Subsequently, both decay non-radiatively
to the emitter 5D0 level and then generate the characteristic Eu3+ ions 5D0 → 7F0–4
emissions.

P á g i n a | 94
Figure 32. Schematic representation of photophysical processes in doped samples
(antenna effect). A = absorption, S1 = singlet state, IC = Internal conversion, ISC =
intersystem crossing, T1 = triplet state, ET = transfer energy.
4.2.5 Conclusions
In summary, we presented the synthesis and the characterization of Mixed
Lanthanide-Organic Frameworks with photoluminescent properties. The Gd-BDC
compounds doped with Eu3+ ions showed red luminescence, while the sample co-doped
with Tb3+ ions demonstrated a tunable color as a function of the excitation wavelength.
The results suggested that up to 7 mol% of the trivalent lanthanide ions such as Eu and
Tb may be embedded into the structure of Gd-BDC without the formation of secondary
phases. Both, the primary and the secondary phases present binuclear inorganic building
blocks but with different symmetry environment, which was confirmed based on the
emission spectra and the decay curves. For all samples, including the Eu-Tb co-doped
one, the antenna effect from the organic ligand to the lanthanide ions was the most
efficient excitation mechanism. In the case of the co-doped sample, the antenna effect
was observed for both ions; however, the most efficient mechanism involved the energy
transfer from the ligand to Tb3+ ions, and from Tb3+ to Eu3+ ions. No energy transfer from
Eu3+ to Tb3+ ions was identified. Moreover, the multiple mechanisms of excitation and
energy transfer allow the tuning of the emission color, turning this material an attractive
candidate for optical applications.

P á g i n a | 95
4.2.6 Acknowledgments
The authors thank Federal University of Pernambuco, School of Science and
Technology/UFRN and Federal Institute of Education, Science and Technology of the
Rio Grande do Norte (IFRN). This work was supported by CNPq (grant no. 407445/2013-
7) and PRONEX/FACEPE/CNPq (grant no. APQ-0675- 1.06/14).
4.2.7 References
[1] A. Corma, H. García, F. X. Llabrés i Xamena, Engineering metal organic frameworks
for heterogeneous catalysis, Chem. Rev. 110 (2010) 4606-4655.
[2] G. S. Papaefstathiou, L. R. MacGillivray, Inverted metal–organic frameworks: solid-
state hosts with modular functionality, Coord. Chem. Rev. 246 (2003) 169-184.
[3] Z. Bian, C. Huang, Electroluminescence Based on Lanthanide Complexes in: C.
Huang (Ed.), Rare Earth Coordination Chemistry: Fundamentals and Applications, John
Wiley & Sons (Asia) Pte Ltd, 2010, 435-472.
[4] P. Dechambenoit, J. R. Long, Microporous magnets. Chem. Soc. Rev. 40 (2011) 3249-
3265.
[5] X.-J. Wang, P.-Z. Li, Y. Chen, Q. Zhang, H. Zhang, X.X. Chan, R. Ganguly, Y. Li, J.
Jiang, Y. Zhao, A rationally designed nitrogen-rich metal-organic framework and its
exceptionally high CO(2) and H(2) uptake capability, Sci. Rep. 3 (2013) 1149-1153.
[6] H. Ren, L. Zhang, J. An, T. Wang, L. Li, X. Si, L. He, X. Wu, C. Wang, Z. Su,
Polyacrylic acid@zeolitic imidazolate framework-8 nanoparticles with ultrahigh drug loading
capability for pH-sensitive drug release, Chem.Commun. 50 (2014) 1000-1002.
[7] Y.-B. Huang, J. Liang, X.-S. Wang, R. Cao. Multifunctional metal–organic framework
catalysts: synergistic catalysis and tandem reactions Chem. Soc. Rev. 46 (2017)126-157.
[8] Y. Cui, Ch. Banglin, Q. Guodong, Lanthanide metal-organic frameworks for
luminescent sensing and light-emitting applications, Coord. Chem. Rev. 273 (2014) 76-
86.
[9] B. Chen, L. Wang, Y. Xiao, F. R. Fronczek, M. Xue, Y. Cui, G. Qian, A luminescent
metal–organic framework with Lewis basic pyridyl sites for the sensing of metal
ions. Angew. Chem. Int. Ed. 48 (2009) 500-503.
[10] B. V. Harbuzaru, A. Corma, F. Rey, P. Atienzar, J. L. Jordá, H. García, J. Rocha,
Metal–organic nanoporous structures with anisotropic photoluminescence and magnetic
properties and their use as sensors, Angew. Chem. Int. Ed. 47, (2008) 1080-1083.
[11] F. Pellé, P. Aschehoug, S. Surblé, F. Millange, C. Serre, G. Férey, Interactions
between Eu3+ ions in inorganic–organic hybrid materials, J. Solid State Chem. 183
(2010) 795-802.
[12] K. M. Taylor, A. Jin, W. Lin, Surfactant‐Assisted Synthesis of Nanoscale
Gadolinium Metal–Organic Frameworks for Potential Multimodal Imaging, Angew.
Chem. 120 (2008) 7836-7839.
[13] J. Lee, O. K. Farha, J. Roberts, K. A. Scheidt, S. T. Nguyen, J. T. Hupp, Metal–
organic framework materials as catalysts, Chem. Soc. Rev. 38 (2009) 1450-1459.

P á g i n a | 96
[14] I. T. Weber, A. J. G. de Melo, M. A. D. M. Lucena, M. O. Rodrigues, S. A. Júnior,
High photoluminescent metal–organic frameworks as optical markers for the
identification of gunshot residues, Anal. Chem. 83 (2011) 4720-4723.
[15] Y. Han, X. Li, L. Li, C. Ma, Z. Shen, Y. Song, X. You, Structures and properties of
porous coordination polymers based on lanthanide carboxylate building units. Inorganic
chemistry, 49 (2010) 10781-10787.
[16] F. A. A. Paz, J. Klinowski, S. M. Vilela, J. P. Tome, J. A. Cavaleiro, J. Rocha, Ligand
design for functional metal–organic frameworks, Chem. Soc. Rev. 41 (2012) 1088-1110.
[17] X. P. Yang, R. A. Jones, J. H. Rivers, R. P. J. Lai, Syntheses, structures and
luminescent properties of new lanthanide-based coordination polymers based on 1,4-
benzenedicarboxylate (bdc), Dalton T. 35 (2007) 3936-3942.
[18] T. M. Reineke, M. Eddaoudi, M. Fehr, D. Kelley, O. M. Yaghi, From condensed
lanthanide coordination solids to microporous frameworks having accessible metal
sites, J. Am. Chem. Soc. 121 (1999) 1651-1657.
[19] A. Deluzet, W. Maudez, C. Daiguebonne, O. Guillou, Interplane distances
modulation in lanthanide-based coordination polymers, Cryst. Growth Des. 3 (2003) 475-
479.
[20] L. Pan, N. Zheng, Y. Wu, S. Han, R. Yang, X. Huang, J. Li, Synthesis,
characterization and structural transformation of a condensed rare earth metal
coordination polymer, Inorg. Chem. 40 (2001) 828-830.
[21] X. Guo, G. Zhu, F. Sun, Z. Li, X. Zhao, X. Li, S. Qiu, Synthesis, structure, and
luminescent properties of microporous lanthanide metal-organic frameworks with
inorganic rod-shaped building units, Inorg. Chem. 45 (2006) 2581-2587.
[22] J. F. S. Nascimento, B. S. Barros, J. Kulesza, J. B. L de Oliveira, A. K. P. Leite, R.
S. Oliveira, (2017). Influence of synthesis time on the microstructure and photophysical
properties of Gd-MOFs doped with Eu3+. Mat. Chem. Phys. 190 (2017) 166-174.
[23] R. Decadt, K. Van Hecke, D. Depla, K. Leus, D. Weinberger, I. Van Driessche, R.
Van Deun, Synthesis, crystal structures, and luminescence properties of carboxylate
based rare-earth coordination polymers. Inorg. Chem. 51 (2012), 11623-11634.
[24] A. Schneemann, V. Bon, I. Schwedler, I. Senkovska, S. Kaskel, R. A. Fischer,
Flexible metal–organic frameworks. Chem. Soc. Rev. 43 (2014), 6062-6096.
[25] T. Loiseau, C. Serre, C. Huguenard, G. Fink, F. Taulelle, M. Henry, T. Bataille, G.
Férey, A Rationale for the Large Breathing of the Porous Aluminum Terephthalate (MIL‐53) Upon Hydration. Chemistry – A European Journal, 10 (2004), 1373-1382.
[26] F. Millange, N. Guillou, R. I. Walton, J. M. Grenèche, I. Margiolaki, G. Férey, Effect
of the nature of the metal on the breathing steps in MOFs with dynamic
frameworks. Chem. Commun. 39 (2008), 4732-4734.
[27] F. Millange, C. Serre, G. Férey, Synthesis, structure determination and properties of
MIL-53as and MIL-53ht: the first CrIII hybrid inorganic–organic microporous solids:
CrIII(OH)·{O2C–C6H4–CO2}·{HO2C–C6H4–CO2H}x. Chem. Commun. 8 (2002), 822-823.
[28] C. Serre, F. Millange, C. Thouvenot, M. Noguès, G. Marsolier, D. Louër, G. Férey,
Very Large Breathing Effect in the First Nanoporous Chromium (III)-Based Solids: MIL-
53 or CrIII(OH)·{O2C−C6H4−CO2}·{HO2C−C6H4−CO2H}x·H2Oy. J. Am.Chem. Soc. 124
(2002), 13519-13526.

P á g i n a | 97
[29] J. P. Mowat, V. R. Seymour, J. M. Griffin, S. P., Thompson, A. M. Slawin, D. Fairen-
Jimenez, P. A. Wright, A novel structural form of MIL-53 observed for the scandium
analogue and its response to temperature variation and CO2 adsorption. Dalton T. 41
(2012), 3937-3941.
[30] C. Volkringer, T. Loiseau, N. Guillou, G. Férey, E. Elkaïm, A. Vimont, XRD and IR
structural investigations of a particular breathing effect in the MOF-type gallium
terephthalate MIL-53 (Ga). Dalton T. 12 (2009), 2241-2249.
[31] E. V. Anokhina, M. Vougo-Zanda, X. Wang, A. J. Jacobson, In (OH) BDC0.75
BDCH2 (BDC= Benzenedicarboxylate), a Hybrid Inorganic − Organic Vernier
Structure. J. Am.Chem. Soc. 127 (2005), 15000-15001.
[32] Z. H. Zhang, S. Y. Wan, T. A. Okamura, W. Y. Sun, N. Ueyama. Synthesis and
crystal structure of two lanthanide complexes with benzenecarboxylic
derivatives. ZAAC, 632 (2006), 679-683.
[33] G. B. Deacon, R. J. Phillips, Relationships between the carbon-oxygen stretching
frequencies of carboxylato complexes and the type of carboxylate coordination. Coordin.
Chem. Rev. 33(1980), 227-250.
[34] S. Akopyan, H. Bertagnolli, I. Boyarskaya, D. Leicht, R. Merkle, L. Solovieva, E.
Vilaseca, IR spectra and microstructure of electrolyte solutions. Dependence of
spectroscopic characteristics of solvated molecules on composition of solvates in the
system CH3CN–Mg(ClO4)2–DMF. Phys. Chem. Chem. Phys. 3 (2001), 2098-2104.
[35] M. D. Allendorf, C. A. Bauer, R. K. Bhakta, R. J. T. Houk, Luminescent metal–
organic frameworks. Chem. Soc. Rev. 38 (2009) 1330-1352.
[36] J. Fan, H. F. Zhu, T. A. Okamura, W. Y. Sun, W. X. Tang, N. Ueyama, Three-
dimensional photoluminescent pillared metal-organic framework with 4.8 2 topological
channels obtained from the assembly of cadmium (ii) acetate and trimellitic salt. New J.
Chem. 27 (2003) 1409-1411.
[37] C. D. E. S. Barbosa, L. L. da Luz, F. A. Paz, O. L. Malta, M. O. Rodrigues, S. A.
Júnior, L. D. Carlos, Site-selective Eu (III) spectroscopy of highly efficient luminescent
mixed-metal Pb (II)/Eu (III) coordination polymers. Rsc Adv, 7 (2017), 6093-6101.
[38] R. S. de Oliveira, B. S. de Brito, J. Kulesza, S. Alves-Jr, B. S. Barros, Tunable
photoluminescence of nanostructured LaPO4:Eu3+/Tb3+ synthesized via a microwave-
assisted ethylene glycol route. Ceram. Int. 43 (2017) 8276-8283.
[39] T. Zhu, P. Chen, H. Li, W. Sun, T. Gao, P. Yan, Structural effects on the
photophysical properties of mono-β-diketonate and bis-β-diketonate Eu III
complexes. Phys. Chem. Chem. Phys. 17 (2015), 16136-16144.
[40] C. Cascales, R. Balda, V. Jubera, J. P. Chaminade, J. Fernández, Optical
spectroscopic study of Eu3+ crystal field sites in Na3La9O3(BO3)8 crystal. Optics
express, 16 (2008), 2653-2662.
[41] P. A. Santa-Cruz, F. S. Teles, Spectra Lux Software v. 2.0. Ponto Quântico
Nanodispositivos/RENAMI. 2003.
[42] G. A. Crosby, R. E. Whan, J. J. Freeman, Spectroscopic studies of rare earth
chelates. J. Phys. Chem. 66 (1962) 2493-2499.
[43] R. E. Whan, G. A Crosby, Luminescence studies of rare earth complexes:
benzoylacetonate and dibenzoylmethide chelates. J. Mol. Spectrosc. 8 (1962) 315-327.

P á g i n a | 98
[44] G. A. Crosby, R. E. Whan, R. M Alire, Intramolecular energy transfer in rare earth
chelates. Role of the triplet state. J. Chem. Phys. 34 (1961) 743-748.
[45] K. Binnemans, Interpretation of europium (III) spectra. Coordin. Chem. Rev. 295
(2015) 1-45.
4.2.8 Supplementary Information
Photoluminescence in Mixed Lanthanide-Organic Frameworks: effect of the Eu3+
content and co-doping with Tb3+
Figure S1. (a) Coordination environment and (b) projection along the c axis of the
partially expanded net structure of the second phase in MLOF_Eu9% sample. Polyhedra
in violet represent the lanthanide sites in networks.

P á g i n a | 99
Figure S2. Thermogravimetric analysis of the samples MLOF_Eu1%-MLOF_EuTb.
Figure S3. Excitation spectra of MLOFs and pure 1,4-BDC ligand measured at room
temperature.

P á g i n a | 100
Capítulo 5
Conclusões gerais Considerações finais.

P á g i n a | 101
5. CONCLUSÕES GERAIS
Neste trabalho, foram obtidas via método solvotérmico uma serie de redes
metalorgânicas mistas contendo íons lantanídeos (Gd3+, Eu3+ e Tb3+), tendo como ligante
o ácido tereftálico (1,4-H2BDC).
Os resultados de DRX e FTIR comprovaram a síntese de uma nova Rede
metalorgânica a base de ácido tereftálico contendo íons Gd3+/Eu3+ e Gd3+/Eu3+/Tb3+ neste
trabalho. Os materiais apresentaram elevada estabilidade térmica. Observou-se que o
tempo de síntese apresentou forte influência sobre a morfologia e as propriedades
fotoluminescentes das amostras. A amostra com maior cristalinidade (7D) apresentou
um maior efeito antena, elevada intensidade de emissão e maior tempo de decaimento do
estado excitado tanto no comprimento de onda do ligante, quanto no processo de
excitação direta do íon Eu3+.
Com relação ao processo de dopagem e co-dopagem dos materiais, foi possível
inferir com base nos dados apresentados que as amostras tiveram suas propriedades
fotoluminescentes extremamente influenciadas pela inserção de íons dopantes, uma vez
que foram identificadas mudanças ou no perfil ou nas intensidades de emissão dos
espectros apresentados neste trabalho. As amostras dopadas com diferentes teores de
Eu3+, apresentaram intensa luminescência vermelha tendo uma concentração limite para
o íon dopante em torno de 7%. A amostra co-dopada, mostrou sintonização de cor em
função do comprimento de onda de excitação. O íon Gd3+, foi fundamental para uma
maior efetividade do efeito antena nas amostras promovendo uma maior taxa do CIS,
tornando o BDC um bom sensibilizador tanto para o íon Eu3+ como para o íon Tb3+.
Com base no que foi explanado, os materiais sintetizados incorporam
funcionalidades pois são paramagnéticos devido ao íon Gd3+ e possuem capacidade de
absorver radiação ultravioleta através dos ligantes, que atuam como "antenas”
promovendo a emissão de radiação no visível na cor vermelha, quando dopados apenas
com o íon Eu3+, ou vermelho, laranja e verde quando co-dopados com Eu3+ e Tb3+. Dessa
forma estes podem ser considerados promissores materiais para aplicações como agentes
de imagem bimodal (Fluorescência ou RMI) e sensoriamento respectivamente.

P á g i n a | 102
Capítulo 6
Trabalhos realizados e
perspectivas Abordamos neste capítulo os trabalhos consolidados durante a tese.

P á g i n a | 103
6.1 Trabalhos consolidados durante a tese
Apresentação do trabalho no 7o Simpósio de Química da UFRN, intitulado:
Influência do tempo de síntese na obtenção de redes metalorgânicas;
Apresentação do trabalho no 8o Simpósio de Química da UFRN, intitulado: MOFs
mistas de Gd3+/Eu3+: Investigação das propriedades morfológicas e fotoluminescentes;
Publicação nos anais do 6o Encontro Nacional sobre Terras Raras: Influência do
solvente na obtenção de redes metalorgânicas La(1,3-BDC);
Publicação nos anais do 6o Encontro Nacional sobre Terras Raras: Síntese,
estrutura e propriedade de polímeros de coordenação à base de íons lantanídeos e ácidos
benzenodicarboxílicos;
Apresentação de trabalho no Congresso Brasileiro de Engenharia e Ciências dos
Materiais, intitulado: Propriedades Fotofísicas e Morfológicas de Gd-MOFs dopadas com
Eu3+: Avaliação da Influência do Tempo de Síntese;
Apresentação de trabalho no Congresso Brasileiro de Engenharia e Ciências dos
Materiais, intitulado: Lanthanide inorganic-organic hybrid materials based on
calix[4]arene-carboxylate; Synthesis, characterization and solid-state luminescent
properties;
Publicação nos anais do Congresso Brasileiro de Engenharia e Ciências dos
Materiais: Efeito modulador do ácido acético sobre as propriedades morfológicas e
luminescentes de La/Tb-MOFs;
Publicação do artigo: Influence of synthesis time on the photophysical and
morphological properties of Gd-MOFs doped with Eu3+. Materials Chemistry and
Physics.
Submissão do artigo: Photoluminescence in Mixed Lanthanide-Organic
Frameworks: effect of the Eu3+ content and co-doping with Tb3+.
6.2 Trabalhos futuros
Testar diferentes aplicações para os materiais desenvolvidos nesta tese;
Desenvolver pesquisas com enfoques similares na instituição de ensino onde estou
vinculado (IFRN) com o corpo discente.