UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO …Secure Site...
Transcript of UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO …Secure Site...

UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE BIOCIÊNCIAS
PROGRAMA DE PÓS-GRADUAÇÃO EM BIOLOGIA PARASITÁRIA
Nayana Luíza Soares de Araújo
CARACTERIZAÇÃO DO PADRÃO DE QUIMIOCINAS EM DIFERENTES FORMAS
CLÍNICAS DA DOENÇA DE CHAGAS
Natal
2017

NAYANA LUÍZA SOARES DE ARAÚJO
CARACTERIZAÇÃO DO PADRÃO DE QUIMIOCINAS EM DIFERENTES FORMAS
CLÍNICAS DA DOENÇA DE CHAGAS
Dissertação apresentada ao Programa de Pós-Graduação em Biologia Parasitária da Universidade Federal do Rio Grande do Norte como requisito parcial para obtenção do título de Mestre em Biologia Parasitária
Orientador: Prof. Dr. Paulo Marcos da Matta Guedes
Natal
2017

Universidade Federal do Rio Grande do Norte - UFRN
Sistema de Bibliotecas - SISBI
Catalogação de Publicação na Fonte. UFRN - Biblioteca Setorial do Centro de Biociências - CB
Araújo, Nayana Luíza Soares de.
Caracterização do padrão de Quimiocinas em diferentes formas
clínicas da doença de chagas / Nayana Luíza Soares de Araújo. - Natal, 2017.
63 f.: il.
Dissertação (Mestrado) - Universidade Federal do Rio Grande do
Norte. Centro de Biociências. Programa de Pós Graduação em
Biologia Parasitária. Orientador: Prof. Dr. Paulo Marcos da Matta Guedes.
1. Doença de Chagas - Dissertação. 2. Trypanosoma cruzi -
Dissertação. 3. Quimiocinas - Dissertação. 4. Receptores de
quimiocinas - Dissertação. 5. Formas clínicas - Dissertação. I. Guedes, Paulo Marcos da Matta. II. Universidade Federal do Rio
Grande do Norte. III. Título.
RN/UF/BSE-CB CDU 616.937

NAYANA LUÍZA SOARES DE ARAÚJO
CARACTERIZAÇÃO DO PADRÃO DE QUIMIOCINAS EM DIFERENTES FORMAS
CLÍNICAS DA DOENÇA DE CHAGAS
Dissertação apresentada ao Programa de Pós-Graduação em Biologia Parasitária da Universidade Federal do Rio Grande do Norte como requisito parcial para obtenção do título de mestre em Biologia Parasitária
Natal, 24 de fevereiro de 2017
BANCA EXAMINADORA
Prof. Dr. Paulo Marcos da Matta Guedes
Departamento de Microbiologia e Parasitologia – UFRN
Profª. Drª. Renata Antonaci Gama
Departamento de Microbiologia e Parasitologia – UFRN
Drª. Manuela Sales Lima Nascimento
Instituto Internacional de Neurociência Edmond e Lily Safra – IIN-ELS

AGRADECIMENTOS
Agradeço, em primeiro lugar, a Deus que me deu a vida, a saúde, o
entendimento, a força nas horas de fraqueza e o apoio da família e amigos, além de
todas as oportunidades e condições que me foram proporcionadas para chegar
neste momento.
A minha família. Meus pais, Josiel e Ivane, que sempre presentes, são minha
base, sendo indispensáveis em todas as conquistas que já tive e que terei, agradeço
pelo apoio contínuo, cuidado incessante e diárias orações, pelo carinho, amor e
incentivo. A minha irmã, Nayara, por estar sempre presente e pelo apoio
demonstrado com a sua maneira peculiar.
A Vinícius, meu companheiro de vida e sonhos, estando presente em todos os
momentos, me dando calma, incentivo, carinho e amor.
As minhas queridas amigas, Clara Moura, Emannuelly Medeiros, Ingrid
Gurgel, Jéssica Gadelha e Rafaela Medeiros, que me proporcionaram a alegria de
ter suas amizades, cada uma demonstrada de sua forma única e especial.
Ao professor Paulo Guedes pela oportunidade de fazer parte da equipe do
Laboratório de Imunoparasitologia, pela disponibilidade, incentivo e inestimáveis
ensinamentos. A todos os colegas do laboratório, Denis Dantas, Israelly Sena,
Larissa Henrique, Meire Cruz, Nathalie Sena e Tamyres Queiroga, pelo auxílio nas
várias etapas deste trabalho.
Aos professores que participaram da minha formação profissional, aos
colegas do mestrado e, por fim, a todos que direta ou indiretamente contribuíram
para que eu conseguisse alcançar esta conquista.

RESUMO
Quimiocinas atuam no recrutamento e acumulação de leucócitos durante o processo
inflamatório e por este papel têm importante participação no desenvolvimento das
diferentes manifestações clínicas da doença de Chagas. O objetivo deste estudo foi
avaliar a expressão de quimiocinas e receptores de quimiocinas em pacientes com
as diferentes formas clínicas desta doença. A quantificação do RNA mensageiro
(RNAm) das quimiocinas (CCL1, CCL2, CCL3, CCL4, CCL5, CCL17, CCL22, CCL24,
CCL27, CCL28, CXCL9, CXCL10) e receptores de quimiocinas (CCR2, CCR3,
CCR4, CCR5, CCR6, CCR7, CCR8, CCR10, CXCR3) de pacientes com as formas
indeterminada (n=18), cardíaca (n=17), digestiva (n=15) e cardiodigestiva (n=15) foi
realizada a partir de células mononucleares de sangue periférico (CMSP), por PCR
em tempo real. Pacientes com a forma cardíaca apresentaram maior expressão
relativa de RNAm de CXCL9, CXCL10, CXCR3 e CCR5 quando comparados aos
pacientes com a forma indeterminada. Por outro lado, pacientes com a forma
digestiva mostraram elevada expressão de transcritos de CCR3 em relação aos
pacientes com as formas indeterminada e cardíaca, além disso, houve correlação
positiva entre a expressão desse receptor com a dimensão do sigmoide. A
expressão relativa de CCL5 foi maior em pacientes com a forma cardiodigestiva em
comparação aos pacientes com as formas cardíaca e indeterminada. CXCL9,
CXCL10, CXCR3 e CCR5 participam da migração de células do perfil de resposta
Th1 e a elevada expressão dos seus RNAm em pacientes com cardiomiopatia
chagásica indica a contribuição dessas moléculas no processo inflamatório no tecido
cardíaco. Pacientes com a forma digestiva apresentaram maior expressão relativa
de CCR3, receptor envolvido com o perfil Th2 de resposta imune, indicando a
possível polarização para este perfil no desenvolvimento da forma digestiva. O
envolvimento de quimiocinas e seus receptores no desenvolvimento das diferentes
formas clínicas da doença de Chagas pode fornecer uma melhor compreensão dos
mecanismos de patogênese da doença.
Palavras-chave: Doença de Chagas. Trypanosoma cruzi. Quimiocinas. Receptores
de quimiocinas. Formas clínicas.

ABSTRACT
Chemokines act in the recruitment and accumulation of leukocytes during the
inflammatory process and play an important role in the development of the different
clinical forms of Chagas’ disease. The aim of this study was to evaluate the
expression of chemokines and chemokine receptors in patients with the different
clinical forms of this disease. The mRNA quantification of chemokines (CCL1, CCL2,
CCL3, CCL4, CCL5, CCL17, CCL22, CCL24, CCL27, CCL28, CXCL9, CXCL10) and
chemokine receptors (CCR2, CCR3, CCR4, CCR5, CCR6, CCR7, CCR8, CCR10,
CXCR3) in patients with indeterminated form (n=18), cardiac form (n=17), digestive
form (n=15) and cardiodigestive form (n=15) was performed in peripheral-blood
mononuclear cells (PBMC) by real-time PCR. Patients with the cardiac form
displayed higher mRNA expression of CXCL9, CXCL10, CXCR3 and CCR5, than
patients with indeterminate form. On the other hand, patients with the digestive form
showed high transcript expression of CCR3, when compared to patients with
indeterminate and cardiac clinical forms of the disease. In addition there was positive
correlation beteween CCR3 mRNA expression and sigmoid dimension. The relative
expression of CCL5 was higher in cardiodigestive patients compared to those with
the cardiac and indeterminate forms. CXCL9, CXCL10, CXCR3 and CCR5
participate in the migration of Th1-profile cells and the high expression in patients
with chagasic cardiomyopathy indicates their contribution in the cardiac inflammatory
process. Patients with digestive form showed high of CCR3 mRNA expression which
is involved with Th2 immune profile, indicating possible polarization for this profile in
development of digestive form of disease. The involvement of chemokines and
chemokine receptors in different clinical forms of Chagas’ disease may provide a
better understanding of the mechanism of disease pathogenesis.
Keywords: Chagas’ disease. Trypanosoma cruzi. Chemokines. Chemokine
receptors. Clinical forms.

LISTA DE FIGURAS E TABELAS
Figura 1 – Estrutura das quimiocinas ....................................................................... 20
Figura 2 – Perfil de quimiocinas e receptores de quimiocinas das respostas T helper ..................................................................................................... 22
Figura 3 – Delineamento experimental. .................................................................... 28
Figura 4 – Mapa do RN com destaque aos municípios de origem dos pacientes estudados ................................................................................................. 30
Tabela 1 – Caracterização da população estudada. Dados clínicos dos pacientes chagásicos crônicos. ................................................................................. 31
Tabela 2 – Sequência dos iniciadores utilizados nas q-PCR. ................................... 35
Figura 5 – Quimiocinas e receptores do padrão Th1 aumentados em pacientes cardíacos .................................................................................................. 37
Figura 6 – Expressão de CCR3 e CCL5 aumentadas em pacientes com as formas cardíaca e cardiodigestiva ........................................................................ 37
Figura 7 – Expressão de quimiocinas em pacientes com as diferentes formas clínicas da doença de Chagas ...................................................................... 38
Figura 8 – Expressão de receptores de quimiocinas em pacientes com as diferentes formas clínicas da doença de Chagas ...................................................... 39
Figura 9 – Correlações positivas entre a expressão de CCR3 e a dimensão do sigmoide .............................................................................................. 40
Figura 10 – Correlações entre a expressão de CCR3 e parâmetros digestivos .................................................................................................................. 40
Figura 11 – Correlações entre a expressão de CCL5 e parâmetros cardíacos e digestivos ............................................................................................... 41

Figura 12 – Correlações entre a expressão aumentada de quimiocinas e receptores da resposta Th1 e parâmetros cardíacos.. .............................................. 42

LISTA DE ABREVIATURAS E SIGLAS
CARD Forma cardíaca
CARDIG Forma cardiodigestiva
CCC Cardiomiopatia chagásica crônica
CCL “C-C motif ligand” Ligante tipo C-C
CCR “C-C motif receptor” Receptor tipo C-X-C
CD “Cluster of differentiation” Grupo de diferenciação
cDNA “Complementary deoxyribonucleic acid” Ácido desoxirribonucleico complementar
CMSP Células mononucleares de sangue periférico
CN Controle negativo
CT “Cycle Threshold” Limiar do ciclo
CXCL “C-X-C motif ligand” Ligante tipo C-X-C
CXCR “C-X-C motif receptor” Receptor tipo C-X-C
DAMPs “Damage-asssociated molecular patterns” Padrões moleculares associados a danos
DIG Forma digestiva
DNA “Deoxyribonucleic acid” Ácido desoxirribonucleico
dNTP “Nucleotide triphosphates containing deoxyribose” Nucleotídeos trifosfatos contendo desoxirribose
DP Desvio padrão
DPP Dipeptidil peptidase
DTU “Discrete Typing Unit” Unidades discretas de tipagem
ECG Eletrocardiograma
ELISA “Enzyme-linked immunosorbent assay” Ensaio imunoenzimático

FEVE Fração de ejeção do ventrículo esquerdo
ICT Índice cardiotorácico
IFN Interferon
IgG Imunoglobulina isotipo G
IL Interleucina
IND Forma indeterminada
iNOS “Inducible nitric oxid synthase” Óxido nítrico sintase induzível
kDa KiloDalton
kDNA
“Kinetoplast Deoxyribonucleic acid” Ácido desoxirribonucleico do cinetoplasto
MC Megacólon
ME Megaesôfago
miRNA “Micro ribonucleic acid” Micro ácido ribonucleico
mRNA/RNAm “Messenger ribonucleic acid” Ácido ribonucleico mensageiro
NK “Natural killer” Matadora natural
NO “Nitric oxid” Óxido nítrico
PAMPs “Pathogen-associated molecular patterns” Padrões moleculares associados a patógenos
PBMC “Peripheral blood mononuclear cell” Células mononucleares de sangue periférico
PCR “Polimerase Chain Reaction” Reação em cadeia da polymerase
PRRs “Pattern recognition receptors” Receptores de reconhecimento de padrões
q-PCR “Quantitative PCR” PCR quantitativa
RN Rio Grande do Norte
RNA “Ribonucleic acid” Ácido ribonucleico
RNS “Reactive nitrogen species” Espécies reativas de nitrogênio

Rq “Relative quantity” Quantidade relativa
SESAP Secretaria de Estado da Saúde Pública
SNP “Single nucletide polymorphism” Polimorfismo de um
nucleotídeo
TGF “Transforming growth factor” Fator de crescimento transformante
Th “T helper” Linfócito T auxiliar
TNF “Tumoral necrosis factor” Fator de necrose tumoral
Treg T regulatório (a)(s)
UERN Universidade Estadual do Rio Grande do Norte
UFRN Universidade Federal do Rio Grande do Norte
WHO “World Health Organization” Organização Mundial da Saúde

SUMÁRIO
1 INTRODUÇÃO ................................................................................................... 13
1.1 Aspectos históricos e epidemiológicos da doença de Chagas.............. 13
1.2 Agente etiológico, ciclo biológico e vias de transmissão ...................... 14
1.3 Patogenia da doença de Chagas ............................................................... 15
1.4 Resposta imunológica frente à infecção pelo Trypanosoma cruzi ........ 17
1.5 Quimiocinas, receptores de quimiocinas e seus papéis na doença de
Chagas ........................................................................................................... 20
2 OBJETIVOS ....................................................................................................... 27
2.1 Objetivo geral .............................................................................................. 27
2.2 Objetivos específicos ................................................................................. 27
3 PACIENTES, SUJEITOS CONTROLE, MATERIAIS E MÉTODOS ................... 28
3.1 Delineamento experimental ....................................................................... 28
3.2 População de estudo .................................................................................. 29
3.3 Quantificação de RNAm das quimiocinas e receptores de quimiocinas
em células mononucleares de sangue periférico dos pacientes por PCR
em tempo real ............................................................................................... 32
3.3.1 Coleta de sangue e obtenção de CMSP ............................................. 32
3.3.2 Extração de RNA e síntese de cDNA .................................................. 32
3.3.3 PCR em tempo real (q-PCR)................................................................ 33
3.4 Análises estatísticas .................................................................................. 34
4 RESULTADOS ................................................................................................... 36
5 DISCUSSÃO ...................................................................................................... 43
6 CONCLUSÃO .................................................................................................... 49
REFERÊNCIAS ......................................................................................................... 50
ANEXO A .................................................................................................................. 64

13
1 INTRODUÇÃO
1.1 Aspectos históricos e epidemiológicos da doença de Chagas
No início do século XX, durante a campanha anti-palúdica realizada na região
norte do estado de Minas Gerais, Carlos Chagas descreveu a enfermidade causada
pelo protozoário Trypanosoma (Schisotrypanum) cruzi – a tripanosomíase americana
ou doença de Chagas – em animais e em humanos. O pesquisador realizou a
descrição da morfologia do agente etiológico, ciclo evolutivo, principais reservatórios
e vetor de transmissão, além de fazer o primeiro relato de caso clínico humano da
doença e suas manifestações clínicas (CHAGAS, 1909).
Existem cerca de 6 a 7 milhões de pessoas infectadas com T. cruzi no mundo,
principalmente nas áreas endêmicas dos 21 países da América Latina (WHO, 2016).
A doença de Chagas integra o conjunto de doenças negligenciadas, que são
aquelas causadas por agentes infecciosos e endêmicas em populações de baixa
renda, principalmente em países em desenvolvimento (ACADEMIA BRASILEIRA DE
CIÊNCIAS, 2010). No Brasil, estima-se que haja, pouco mais de 1.100.000
indivíduos infectados, dentre os quais mais de 200.000 apresentam a cardiopatia
chagásica (WHO, 2015); sendo a doença de Chagas causadora de 6.000 mortes por
ano no país (MARTINS-MELO et al., 2014). Na região nordeste, o controle e
prevenção da doença de Chagas são considerados negligenciados, o que resulta na
emergência de novos casos e no aumento da mortalidade, como ocorreu entre 1999
e 2007, período em que a taxa de mortalidade foi crescente (MARTINS-MELO et al.,
2012). No Rio Grande do Norte (RN) a ocorrência de casos está concentrada em
municípios centrais da mesorregião oeste do estado (BRITO et al., 2012). Segundo
dados da Secretaria do Estado da Saúde Pública foram notificados 210 casos da
forma crônica da doença entre os anos de 2007 e 2014, com maior número de
ocorrências nos municípios de Pau dos Ferros, Caicó, Mossoró e Assu (SESAP,
2014). Entretanto, de acordo com um estudo realizado entre os anos de 2007 e 2009,
em municípios da mesorregião oeste, a estimativa de sorologia positiva para
infecção pelo T. cruzi foi de 6,5%, correspondendo a um total de pouco mais de 14
mil indivíduos infectados. A infecção humana pelo parasito continua sendo alta e

14
essa enfermidade ainda é considerada um problema de saúde pública no estado
(BRITO et al., 2012).
1.2 Agente etiológico, ciclo biológico e vias de transmissão
O Trypanosoma cruzi é um protozoário flagelado vetorialmente transmitido por
triatomíneos (BRENER, 1973) e atualmente está classificado filogeneticamente
como a seguir (ADL et al., 2012): Excavata (CAVALIER-SMITH, 2002; corrigido por
SIMPSON, 2003); Discoba, ribogrupo montado a partir de estudos filogenéticos
(HAMPL et al., 2009); Discicristata (CAVALIER-SMITH, 1998); Euglenozoa
(CAVALIER-SMITH, 1981, corrigido por SIMPSON, 1997); Kinetoplastea
(HONIGBERG, 1963); Metakinetoplastina, ribogrupo (MOREIRA, LÓPEZ-GARCÍA e
VICKERMAN, 2004); Trypanosomatida (KENT, 1880; corrigido por MOREIRA,
LÓPEZ-GARCÍA e VICKERMAN, 2004) que contém a espécie T. cruzi (Revisado em
ADL et al., 2012).
Triatomíneos são insetos hematófagos pertencentes à ordem Hemiptera,
subordem Heteroptera família Reduviidae, subfamília Triatominae (TARTAROTTI,
AZEREDO-OLIVEIRA e CERON, 2006), cujos gêneros de maior importância são
Pantrongylus, Triatoma e Rhodnius por reunírem melhor capacidade vetorial na
transmissão da doença de Chagas (REBÊLO, BARROS e MENDES, 1998).
Formas tripomastigotas metacíclicas do parasito, presentes em excretas
contaminadas do inseto (BRENER, 1973), adentram no organismo por mucosas ou
descontinuidades epiteliais (DE SOUZA, DE CARVALHO e BARRIAS, 2010) e
invadem as células no local da inoculação. Há intensa multiplicação no citoplasma
celular sob a forma de amastigota seguida pela conversão à forma tripomastigota,
que são liberadas com a ruptura da célula, se difundindo no organismo e assim
infectam novas células e disseminam a infecção (TYLER e ENGMAN, 2001). As
formas tripomastigotas sanguíneas também podem ser ingeridas por triatomíneos,
durante o repasto sanguíneo, iniciando o ciclo no hospedeiro invertebrado. No tubo
digestivo do inseto há a conversão à forma epimastigota. Sob esta forma há a
multiplicação do parasito. Por meio da metaciclogênese, os epimastigotas presentes

15
no reto do inseto, se diferenciam em tripomastigotas metacíclicas, forma infectante
para o hospedeiro vertebrado (BRENER, 1973).
Além da transmissão vetorial, a infecção pelo T. cruzi pode ocorrer de
diferentes formas, como por transfusões sanguíneas, transplante de órgãos,
acidentes laboratoriais, pela via congênita e pela via oral, por meio de alimentos ou
bebidas contaminadas (WHO, 2015).
1.3 Patogenia da doença de Chagas
A fase aguda da doença de Chagas que é iniciada a partir da infecção pelo T.
cruzi tem pequena duração e geralmente ausência de manifestações clínicas.
Contudo, alguns indivíduos infectados, comumente os infantes, podem exibir uma
série de sinais e sintomas como febre, hepatomegalia, esplenomegalia,
linfoadenopatia, edema palpebral unilateral (sinal de Romaña), chagoma de
inoculação, entre outros. De forma eventual podem ocorrer casos de miocardite
aguda grave, que leva à insuficiência cardíaca, e de meningoencefalite, sendo estas
as principais causas de morte na fase aguda da doença de Chagas, sobretudo em
crianças de baixa idade (CHAGAS, 1916; DIAS, 1984; PRATA, 2001; RASSI
JÚNIOR, RASSI e REZENDE, 2012). A fisiopatogênese dessa fase é baseada na
ação direta do T. cruzi, pela invasão e posterior rompimento das células após a
intensa multiplicação intracelular, somada à reação inflamatória desencadeada pelo
parasito (DIAS, 1985).
Após 2 a 4 meses, com o fim da fase aguda, o paciente entra na fase crônica
que persiste por toda a sua vida, podendo ser classificada em formas clínicas
distintas – indeterminada, cardíaca, digestiva e cardiodigestiva (RASSI JÚNIOR,
RASSI e MARIN-NETO, 2010). Diversos fatores podem ter influência no
desenvolvimento da doença de Chagas. A combinação de fatores inerentes ao
parasito (tropismo tecidual, tamanho do inóculo, modo de transmissão, virulência,
variabilidade genética, entre outros) e ao hospedeiro (idade, sexo, etnia, resposta
imune, constituição genética) pode ser determinante para a evolução das
manifestações clínicas da doença (TAFURI, 1999; GUTIERREZ et al., 2009).

16
A forma indeterminada é caracterizada pela positividade de exames
parasitológicos e/ou reatividade em exames sorológicos, havendo, contudo, a
ausência tanto de manifestações clínicas quanto de anormalidades no
eletrocardiograma (ECG) e em exames radiográficos de tórax, esôfago e cólon
(DIAS et al., 2016). As estimativas de incidência das formas clínicas não são bem
definidas, contudo aproximadamente 50–70% dos indivíduos cronicamente
infectados não desenvolvem doença aparente, sendo enquadrados na forma em
questão, na qual podem permanecer durante toda a vida. Entretanto, uma parcela
desses pacientes desenvolvem uma das outras formas clínicas da doença de
Chagas comumente décadas após a infecção (WHO, 2002; RASSI JÚNIOR, RASSI
e MARIN-NETO, 2010).
A forma cardíaca – ou cardiomiopatia chagásica crônica (CCC) – atinge por
volta de 20 a 30% dos pacientes (RASSI JÚNIOR, RASSI e REZENDE, 2012;
ANDRADE et al., 2015) e assinala-se pela presença de alterações
eletrocardiográficas com apresentações clínicas que variam da ausência de
sintomatologia até manifestações graves do acometimento cardíaco como a
insuficiência cardíaca, a ocorrência de eventos tromboembólicos e de arritmias
complexas (DIAS et al., 2016), decorrentes das perturbações musculares e nervosas
que ocorrem no coração, incluindo a hipertrofia das fibras cardíacas (CHAGAS e
VILLELA, 1922). A geração das lesões é possivelmente relacionada a diversos
fatores como a presença do parasito no tecido cardíaco associada à resposta
inflamatória e fibrosante e à ocorrência de fenômenos autoimunes (MARIN-NETO et
al., 2007; BONNEY e ENGMAN, 2008) marcados pela presença de autoanticorpos e
de linfócitos autorreativos direcionados ao miocárdio (HIGUCHI et al., 2003; NUNES
et al., 2013).
A forma digestiva da doença de Chagas é resultante do comprometimento de
órgãos do trato gastrointestinal e afeta de 8 a 15% dos indivíduos infectados (RASSI
JÚNIOR, RASSI e REZENDE, 2012; ANDRADE et al., 2015). Ao causar alterações
anatômicas e funcionais, manifesta-se especialmente na forma de megaesôfago e
megacólon, tendo por principais sintomas a disfagia e a constipação,
respectivamente. As alterações são diagnosticadas por exames radiográficos
simples e contrastados (DIAS et al., 2016). Tal comprometimento é decorrente da
destruição de neurônios intramurais do sistema nervoso autônomo parassimpático
acarretadas por lesões inflamatórias (TEIXEIRA et al., 2011) causadas pelo

17
parasitismo tecidual e ação do sistema imune (MENEGHELLI, 2004). A forma
cardiodigestiva, que consiste numa combinação entre a CCC e o megaesôfago ou
megacólon ou ambos (RASSI JÚNIOR, RASSI e REZENDE, 2012) e afeta
aproximadamente 8% dos indivíduos infectados (ANDRADE et al., 2015).
1.4 Resposta imunológica frente à infecção pelo Trypanosoma cruzi
As lesões crônicas da doença de Chagas possuem caráter inflamatório e
fibrosante, acometendo tanto as fibras musculares como o sistema nervoso
autônomo dos órgãos envolvidos, sendo responsáveis pela perda progressiva da
função cardíaca e/ou digestiva (TAFURI, 1999; DIAS et al., 2016). A resposta
imunológica à infecção pelo T. cruzi tem participação na formação dessas lesões,
por outro lado é indispensável para a sobrevivência do hospedeiro. O
desenvolvimento adequado da imunidade envolve diversos tipos celulares e
moléculas mediadoras e é essencial para o controle parasitário (MACHADO et al.,
2012a).
A imunidade inata é fundamental para a destruição direta do patógeno por
macrófagos e células dendríticas. A ativação adequada desses tipos celulares
promove a ativação da imunidade adaptativa (TARLETON, 2007) e contribui com a
produção de citocinas e outros mediadores pró-inflamatórios. A imunidade inata é
desencadeada pelo reconhecimento de padrões moleculares associados a
patógenos (PAMPs) por receptores de reconhecimento de padrões (PRRs). Esta
interação deflagra a ativação ou inibição de fatores de transcrição, e consequente
modulação da produção de citocinas, quimiocinas e outras moléculas participantes
da resposta contra a infecção (BAFICA et al., 2006; KAYAMA e TAKEDA, 2010).
Em resposta à infecção parasitária há o aumento da síntese da interleucina
(IL)-12, principalmente pelos macrófagos infectados. Esta citocina é essencial para a
progressão da resposta imune pela ativação de células natural killer (NK) e da
indução do desenvolvimento de linfócitos T CD4+ ao fenótipo Th1 (MACHADO et al.,
2012a). Linfócitos T CD4+ e CD8+ são importantes fontes de interferon (IFN)-γ
(KOGA et al., 2006), citocina fundamental na ativação dos macrófagos e na indução
da expressão da enzima óxido nítrico sintase induzível (iNOS). A iNOS é necessária

18
para produção do óxido nítrico (NO) mediador essencial da morte parasitária
intracelular (BIRON e GAZZINELLI, 1995; KAYAMA e TAKEDA, 2010). O eixo IL-
12/IFN-γ/iNOS é indispensável no controle da replicação parasitária, tendo enorme
importância na resistência do hospedeiro à infecção (MICHAILOWSKY et al., 2001).
O fator de necrose tumoral (TNF)-α, em sinergismo com o IFN-γ, estimula a
produção de NO e funciona assim como um segundo sinal à atividade tripanocida
dos macrófagos (SILVA et al., 1995). Outras citocinas, como IL-4, IL-10 e o fator de
transformação de crescimento (TGF)-β, também produzidas durante o curso da
infecção, são consideradas reguladoras da resposta imune, mirando na prevenção
da exacerbação do processo inflamatório (SOUZA et al., 2014). Contudo essas
citocinas são associadas à susceptibilidade à infecção por inibirem a produção dos
derivados de nitrogênio, como o óxido nítrico (SILVA et al., 1995).
As variadas citocinas produzidas durante a resposta imune inata tem o
importante papel de direcionar a diferenciação dos linfócitos T CD4+ nos diferentes
fenótipos de resposta, como Th1, Th2 (MOSMANN e COFFMAN, 1989), T regulador
(Treg) (SAKAGUCHI, 2000; SAKAGUCHI, 2005), Th17 (BETTELLI et al., 2006;
MANGAN et al., 2006), Th9 (VELDHOEN et al., 2008; CHANG et al., 2010) e Th22
(DUHEN et al., 2009; TRIFARI et al., 2009).
O perfil Th1 é predominante no curso da infecção, tendo caráter protetivo, em
modelo experimental, por ser crucial para o controle do parasitismo pela produção
de citocinas pró-inflamatórias, como o IFN-γ (MARIANO et al., 2008). O IFN-γ é
indutor da troca de isotipos de imunoglobulinas, suscitando anticorpos fixadores de
complemento (MARINHO et al., 2004). Além disso, esta citocina promove a atividade
dos linfócitos T CD8+ (GUEDES et al., 2010a) que são considerados um dos
principais efetores no controle da replicação do T. cruzi por mediar a morte das
células infectadas (MARTIN e TARLETON, 2004), contudo esses linfócitos são
responsáveis pela imunopatogênese da doença de Chagas (BRENER e
GAZZINELLI, 1997).
Os perfis de resposta imunológica são importantes influenciadores do
desenvolvimento das formas clínicas cardíaca e indeterminada da doença de
Chagas. O desenvolvimento da cardiomiopatia chagásica está associado com a
resposta do perfil Th1 exacerbada e a forma indeterminada derivaria da reposta Th1
balanceada por Th2 (GOMES et al., 2005; GUEDES et al., 2012). A ausência de
mecanismos regulatórios que viriam a balancear a resposta Th1, contrapondo-se a

19
ela, foi demonstrada pela redução da expressão de genes característicos de células
T dos fenótipos Th2 e regulador em pacientes que apresentam a cardiopatia
chagásica (CUNHA-NETO et al., 2009). Células do perfil fenotípico Th1, produtoras
de citocinas pró-inflamatórias, principalmente IFN-γ, são indispensáveis para o
controle da infecção pelo T. cruzi, porém a falta de regulação da resposta Th1 por
citocinas anti-inflamatórias produzidas por outros perfis de resposta imune participa
do desenvolvimento da cardiomiopatia chagásica (BASSO, 2013; FRADE et al.,
2013).
Acredita-se que subpopulações de linfócitos Treg estejam envolvidas no
controle do dano cardíaco ao modular as respostas Th1 e Th17 de forma negativa e
positiva, respectivamente. A utilização de anticorpos anti-CD25 induzindo a depleção
de Treg leva à redução do parasitismo e inflamação cardíaca em camundongos
infectados com o T. cruzi (BONNEY et al., 2015). A resposta Th17 está envolvida na
patogenia da doença de Chagas, pela indução da miocardite, contudo participa na
modulação de Th1, controlando dessa forma a inflamação cardíaca (GUEDES et al.,
2010a). O sinergismo entre Th17 e Treg conduziria ao desenvolvimento da forma
indeterminada ou de uma cardiomiopatia leve na doença de Chagas (GUEDES et al.,
2012). Tais perfis podem também estar envolvidos no desencadeamento da forma
digestiva da doença, tendo sido demonstrada uma exacerbação de Th17 frente à
Treg em pacientes com lesões digestivas, enquanto que em pacientes da forma
indeterminada há um favorecimento do perfil Treg (ABREU et al., 2016).
Observou-se que a expressão de RNAm de IL-9 e IL-22, características das
respostas Th9 e Th22, respectivamente, se apresentou elevada em pacientes com a
forma indeterminada em relação aos com a forma cardíaca. Assim as respostas Th9
e Th22 podem ter participação na prevenção do desenvolvimento da cardiomiopatia
chagásica crônica, possivelmente por meio da regulação da resposta Th1 e de
citocinas inflamatórias (GUEDES et al., 2016).
Os diferentes perfis de diferenciação de linfócito T CD4 (Th1, Th2, Th9, Th17,
Th22, Treg) são importantes no mecanismo imunomodulatório envolvido no
desenvolvimento das diferentes formas clinicas da doença de Chagas, assim como
na apresentação da infecção assintomática (RIBEIRÃO et al., 2000; ABEL et al.,
2001; GOMES et al., 2003; GUEDES et al., 2012; GUEDES et al., 2016). O
direcionamento das diversas células efetoras para o sítio inflamatório tem como
principal determinante a expressão seletiva de quimiocinas (MARIANO et al., 2008).

20
Associado ao fato de quimiocinas poderem induzir a produção de mediadores
inflamatórios e microbicidas em leucócitos, como NO, as quimiocinas possuem papel
fundamental no desenvolvimento das diferentes manifestações clinicas da doença
de Chagas bem como na apresentação da forma indeterminada.
1.5 Quimiocinas, receptores de quimiocinas e seus papéis na doença de
Chagas
As quimiocinas constituem uma grande família de moléculas secretadas de
baixo peso molecular, variando entre 6 e 14 kDa. Essas proteínas solúveis têm por
principal função induzir a quimiotaxia de células responsivas, principalmente
leucócitos, participando de diversos processos fisiológicos e patológicos no
organismo. Quimiocinas são caracterizadas por possuírem pares de cisteínas
conservadas ligadas por pontes dissulfeto em sua porção aminoterminal e
atualmente existem cerca de 50 quimiocinas humanas identificadas. Estruturalmente,
as quimiocinas são classificadas em quatro subfamílias – CC, CXC, CX3C e C – de
acordo com o arranjo das cisteínas conservadas. A subfamília CC apresenta as
cisteínas adjacentes, a CXC e CX3C contêm, respectivamente um e três
aminoácidos separando as cisteínas, e a subfamília C, diferentemente das
anteriores possui apenas um par de cisteínas (Figura 1) (BLANCHET et al., 2012;
JUAN, PEDROSA e COLOBRAN, 2013).
Figura 1 – Estrutura das quimiocinas. Modelo esquemático demonstrando a interação entre as cisteínas conservadas e a classificação estrutural das subfamílias das quimiocinas. Modificado de Sahingur e Yeudall, 2015.
De forma ampla, sob a óptica funcional, as quimiocinas podem ser
consideradas homeostáticas, sendo constitutivamente expressas e responsáveis
pela coordenação do tráfego normal e contínuo de leucócitos como ocorre nos

21
processos de hematopoese, homing leucocitário e vigilância imunológica; ou
inflamatórias, quando sua expressão é aumentada frente a estímulos infecciosos,
inflamatórios, tumorais, dentre outros, de forma que participam do desenvolvimento
da resposta imune inata e adaptativa. Algumas quimiocinas, contudo, podem exercer
as duas funções a depender do contexto biológico ou estado patológico (LE et al.,
2004; MOSER e WILLIMANN, 2004; ALLEN, CROWN e HANDEL, 2007).
A partir da interação das quimiocinas com seus receptores tem-se os diversos
efeitos dessas moléculas, como por exemplo: proliferação, maturação, diferenciação
celular, entretanto as principais ações resultantes da ligação quimiocina-receptor são
a quimiotaxia e adesão celular (ROT e VON ANDRIAN, 2004). Cerca de 20
receptores de quimiocinas já foram identificados e são agrupados, de acordo com as
subfamílias de quimiocinas ligantes, em CCR, CXCR, CX3CR e XCR (BLANCHET et
al., 2012). Os receptores de quimiocinas são receptores de superfície associados à
proteína G com sete domínios transmembrana, que ao serem ativados pelos seus
ligantes, desencadeiam uma cascata de transdução de sinais, baseada em
segundos mensageiros, iniciando uma série de eventos coordenados, tanto
bioquímicos como celulares, que incluem alterações no fluxo iônico, na avidez de
integrinas, no potencial transmembrana, além de rearranjo e movimentação da
actina, o que resulta na mudança de forma celular, bem como no aumento da
locomoção das células (MURDOCH e FINN, 2000; CHARO e RANSOHOFF, 2006).
As quimiocinas agem como mediadoras do processo inflamatório pelo
recrutamento, acumulação e ativação leucocitária nos locais de injúria ou infecção
(TALVANI et al., 2004a; GOMES et al., 2005; MARINO et al., 2005). O
desencadeamento da resposta imune inata leva a produção de quimiocinas que,
solúveis ou associadas a moléculas de glicosaminoglicanos, se dispõem em
gradiente promovendo o recrutamento leucocitário (RAMAN, SOBOLIK-DELMARIE,
RICHMOND, 2011). O rolamento leucocitário é intermediado por selectinas e seus
ligantes que estão presentes nos leucócitos e na superfície das células endoteliais.
As integrinas também participam do processo de rolamento e além de mediarem a
adesão mais forte dos leucócitos ao endotélio (Revisado por LEY et al., 2017). A
interação dos receptores de quimiocinas presentes nos leucócitos com as
quimiocinas deflagra um sinal que ocasiona alteração na avidez das integrinas
leucocitárias promovendo firme ligação às moléculas de adesão endoteliais, o que
leva à acumulação leucocitária e possibilita a migração transendotelial (BAGGIOLINI,

22
1998; MURDOCH e FINN, 2000). Vale ressaltar que a expressão diferenciada de
receptores de quimiocinas nos diversos subtipos leucocitários é a responsável pela
amplitude de efeitos das quimiocinas. Linfócitos de diferentes perfis de resposta
imune também expressam receptores de quimiocinas de maneira díspar e,
consequentemente, migram heterogeneamente em resposta as diversas quimiocinas
(Figura 2) (BAGGIOLINI, 1998; BONECCHI et al., 1998).
Figura 2 – Perfil de quimiocinas e receptores de quimiocinas das respostas T helper. Em cada perfil, quimiocinas estão listadas nos quadros da esquerda em cores correspondentes aos seus receptores listados no quadro da direita. Figura elaborada pela autora com dados obtidos de: BONECCHI et al,, 1998; NAKAYAMA et al., 2003; BROMLEY, MEMPEL e LUSTER, 2008; GUEDES et al., 2010a; GUEDES et al., 2010b; YSSEL e BENSUSSAN, 2010; JABEEN et al., 2013; ALVAREZ et al., 2015; ZHANG et al., 2015; QIN et al., 2016; XIAO et al., 2016.
No contexto da doença de Chagas, quimiocinas como CCL2, CCL3, CCL4 e
CCL5 colaboram com a indução da morte parasitária ao causar o aumento de
produção e liberação do óxido nítrico por parte dos macrófagos infectados pelo T.
cruzi (ALIBERTI et al., 1999; TEIXEIRA, GAZZINELLI e SILVA, 2002; MARINO et al.,
2005; MACHADO et al., 2012a). O papel mais notório das quimiocinas e de seus
receptores na doença de Chagas está relacionado ao infiltrado inflamatório nos
órgãos afetados, ao participar da indução do influxo leucocitário e da manutenção da
inflamação local induzida pelo parasito. Desta forma, essas moléculas mediadoras
são essenciais para suscitar a resposta inflamatória, que é fundamental na
CCR2 CCR5
CXCR3
Th1
CCL2 CCL3 CCL4 CCL5
CXCL9 CXCL10
CCR2 CCR3 CCR4 CCR8
Th2
CCL1 CCL2 CCL5 CCL17 CCL22 CCL24 CCL28
CCR4 CCR7 CCR8
Treg
CCL1 CCL17 CCL22
CCR4 CCR6
Th17
CCL17 CCL20 CCL22
CCR4 CCR6 CCR10
Th22
CCL20 CCL22 CCL27 CCL28
CCR4 CCR6 CCR8
Th9
CCL20 CCL22

23
resistência à infecção, mas também responsável pela patogênese da doença
(TEIXEIRA, GAZZINELLI e SILVA, 2002; TALVANI et al., 2004a).
O infiltrado inflamatório durante todo o curso da doença de Chagas é
composto predominantemente por linfócitos T CD8+ (HIGUCHI et al., 1993; SUN e
TARLETON, 1993; HARDISON et al., 2006a) que em sua maioria expressam CCR5,
apontando para um papel central deste receptor, bem como de seus ligantes, no
curso da resposta à infecção pelo T. cruzi (GOMES et al., 2005; MACHADO et al.,
2005).
O papel do receptor CCR5 no âmbito da doença de Chagas tem se
notabilizado pela sua considerável participação na formação do infiltrado inflamatório
nos órgãos afetados, tendo assim, em conjunto com seus ligantes – CCL3, CCL4 e
CCL5, expressos por macrófagos e cardiomiócitos infectados – uma parte crítica no
desencadeamento das lesões inflamatórias e, consequentemente, na patogênese da
doença (MACHADO et al., 2005; MARINO et al., 2005). A ausência de tal receptor
em camundongos knockout resultou na redução significativa do infiltrado inflamatório
cardíaco, demonstrando a sua grande importância no acúmulo leucocitário,
entretanto a deficiência de CCR5 ocasionou maiores parasitismo e mortalidade dos
animais, sugerindo assim uma atuação protetora no controle da infecção
(MACHADO et al., 2005; HARDISON et al., 2006a). CCL3, CCL4 e CCL5, além de
sua função quimioatrativa, incitam o aumento da fagocitose do parasito e da
produção de NO, favorecendo assim a atividade tripanocida dos macrófagos
(VILLALTA et al., 1998).
O eixo CCL2-CCR2 é bastante representativo no curso da infecção pelo T.
cruzi, participando do recrutamento leucocitário para os tecidos e do controle da
replicação do parasito, pelo aumento da atividade fagocitária e produção de óxido
nítrico pelos macrófagos, exercendo assim um importante papel protetivo (PAIVA et
al., 2009; GUEDES et al., 2010b). Em modelo animal foi demonstrado que ausência
de CCL2, em camundongos knockout, levou a uma maior susceptibilidade à infecção
pelo T. cruzi, ocasionando maiores parasitismo e mortalidade dos animais e
apresentando contração do infiltrado inflamatório e redução no recrutamento de
linfócitos T CD8+ ativados (PAIVA et al., 2009). Todavia, essa quimiocina possui
papel essencial na de fibrose cardíaca e, logo, na insuficiência cardíaca (MARINO et
al., 2005), havendo relação entre a concentração plasmática de CCL2 e o grau de
disfunção do coração em pacientes chagásicos cardiopatas crônicos (TALVANI et al.,

24
2004b). Além do mais, CCL2 pode exercer efeitos não imunológicos sobre
cardiomiócitos e fibrócitos, como a modulação da expressão gênica e proteica,
influenciando assim em vias significativas para o desenvolvimento da CCC,
ocasionando, por exemplo, a fibrose e a hipertrofia dos cardiomiócitos (CUNHA-
NETO et al., 2009).
CXCL9 e CXCL10 são expressas principalmente por macrófagos presentes
no miocárdio, nas fases aguda e crônica da doença de Chagas, sendo personagens
importantes na tanto na iniciação como na manutenção da inflamação cardíaca.
Estas quimiocinas cumprem papel protetor na resposta do hospedeiro à infecção
pelo controle da replicação do parasito, demonstrado em modelo animal pela
neutralização dessas quimiocinas por anticorpos que resultou num aumento da
parasitemia e do parasitismo tecidual (HARDISON et al., 2006b). Receptor de
CXCL9 e CXCL10, o CXCR3 tem sua expressão aumentada em pacientes com
cardiopatia chagásica quando comparada com pacientes com cardiopatias não
inflamatórias (CUNHA-NETO et al., 2009).
As expressões das quimiocinas CCL19 e CCL21 estão aumentadas no
miocárdio de pacientes com cardiomiopatia chagásica crônica e estão relacionadas
com a indução da hipertrofia dos cardiomiócitos e também com moléculas
participantes do processo de fibrose (CUNHA-NETO et al., 2009; NOGUEIRA et al.,
2012). O CCR7, receptor dessas quimiocinas, associado ao fenótipo de células de
memória (NOGUEIRA et al., 2012), também tem sua expressão aumentada no
miocárdio de pacientes cursando cronicamente com a cardiomiopatia chagásica
quando comparados a pacientes com cardiopatias não inflamatórias (CUNHA-NETO
et al., 2009).
Quimiocinas podem participar na diferenciação de linfócitos T, nos perfis
fenotípicos Th1 e Th2 (MARINO et al., 2005; MACHADO et al., 2012b), por meio da
modulação da produção de citocinas, influenciando a efetividade da resposta imune
adaptativa frente a infecções. Em camundongos knockout para CCR1 houve
redução no tamanho de granulomas induzidos por ovos de Schistosoma mansoni
associada ao aumento da expressão de IFN-γ e redução de IL-4 (GAO et al., 1997).
A ausência de CCL2 em camundongos levou a menor produção de IL-4, IL-5 e IL-10,
evitando a polarização para o perfil Th2. Esses camundongos knockout mostraram
maior resistência à infecção por Leishmania major (GU et al., 2000). Em
contrapartida, camundongos CCR2-/- tiverem maior resposta Th2 frente à infecção

25
pulmonar por Cryptococcus neoformans, com produção aumentada de IL-4, IL-5 e
reduzida de IFN-γ (TRAYNOR et al., 2000).
Os variados fenótipos de reposta imunológica podem ser particularizados pelo
perfil de expressão de quimiocinas e seus receptores (Figura 2). CXCR3 e CCR5 e
seus respectivos ligantes (CXCL9, CXCL10, CCL3, CCL4 e CCL5) são fortemente
associados à resposta Th1 (GUEDES et al., 2010b). Ambos têm a expressão
notoriamente elevada em células mononucleares de sangue periférico (CMSP) de
pacientes com a forma cardíaca da doença de Chagas quando comparados aos
pacientes enquadrados na forma indeterminada (GOMES et al., 2005). A resposta
Th2 é marcada pela presença dos receptores CCR3, CCR4 e CCR8 e suas
quimiocinas ligantes, CCL1, CCL17, CCL22, CCL24 (Revisado em GUEDES et al.,
2010b) e CCL28 (ALVAREZ et al, 2015). Foi demonstrado que pacientes com a
forma indeterminada tem maior expressão de CCR3 em CMSP, inclusive em
conjunto com citocinas de caráter anti-inflamatório, como IL-4 e IL-10, quando
comparados aos que apresentam a forma cardíaca da doença (GOMES et al., 2005).
Os receptores CCR4 e CCR6 são considerados marcadores do perfil de resposta
Th17 (Revisado em GUEDES et al., 2010a) quando acompanhado das quimiocinas
CCL17, CCL20 e CCL22, ao passo que, a expressão de CCR4 e CCR8 associada a
CCL1, CCL17 e CCL22 caracterizam a presença de linfócitos Treg (Revisado em
GUEDES et al., 2010b). Na resposta Th22 tem-se a expressão preferencial de CCR4,
CCR6 e CCR10 juntamente com as quimiocinas CCL22, CCL20, CCL27 (XIAO et al.,
2016) e CCL28 (YSSEL e BENSUSSAN, 2010). Células do perfil de resposta Th9
são responsivas à CCL20 pelo receptor CCR6 (QIN et al., 2016) e à CCL22 por
meio de CCR4 e também expressam CCR8 (JABEEN et al., 2013). O receptor CCR7
está presentes em linfócitos T indiferenciados além de relacionado a linfócitos Treg
(BROMLEY, MEMPEL e LUSTER, 2008). A quimiocina CCL2 se destaca pelo
recrutamento de monócitos (DESHMANE et al., 2009) e é a principal ligante de
CCR2, altamente expresso em monócitos, mas também expressos em linfócitos Th1
e Th2 (BONECCHI et al., 1998; LUTHER e CYSTER, 2001).
A expressão diferenciada das quimiocinas e seus receptores conduzem a
diferentes perfis de resposta tecidual podendo ser um importante fator influenciador
no desenvolvimento das formas clínicas crônicas da doença de Chagas.
Compreender a participação dos mecanismos imunológicos dessas moléculas e seu
envolvimento na geração e manutenção das lesões das diversas apresentações da

26
doença é fundamental para o melhor entendimento da patogênese da enfermidade,
bem como possibilitaria a identificação de novos marcadores imunológicos e novas
alternativas terapêuticas.

27
2 OBJETIVOS
2.1 Objetivo geral
Avaliar o padrão de expressão de quimiocinas e receptores de quimiocinas
em pacientes portadores das diferentes formas clínicas da doença de Chagas.
2.2 Objetivos específicos
• Avaliar a relação entre a expressão de quimiocinas e o
desenvolvimento das diferentes formas clínicas da doença de Chagas.
• Avaliar a relação entre a expressão de receptores de quimiocinas e o
desenvolvimento das diferentes formas clínicas da doença de Chagas.
• Identificar marcadores de patogenicidade da doença de Chagas.

28
3 PACIENTES, SUJEITOS CONTROLE, MATERIAIS E MÉTODOS
3.1 Delineamento experimental
Figura 3 – Delineamento experimental.
65 indivíduos chagásicos crônicos
18 forma indeterminada
17 forma cardíaca
15 forma digestiva
15 forma cardiodigestiva
Extração de RNAm
Síntese de cDNA
Obtenção de CMSP
Correlacionar o perfil de expressão das quimiocinas e dos receptores de quimiocinas ao grau de dilatação do esôfago ou cólon, ao índice cardiotorácico
e à fração de ejeção do ventrículo esquerdo
15 controles saudáveis
Coleta de sangue
Determinação da expressão dos receptores de quimiocinas (CCR2,
CCR3, CCR4, CCR5, CCR6, CCR7, CCR8, CCR10, CXCR3) por q-PCR
Determinação da expressão das quimiocinas (CCL1, CCL2, CCL3, CCL4, CCL5, CCL17, CCL22, CCL24, CCL27, CCL28, CXCL9 e CXCL10) por q-PCR

29
3.2 População de estudo
Foram selecionados sessenta e cinco indivíduos chagásicos crônicos, os
quais apresentavam faixa etária entre 18 e 69 anos (Tabela 1), residentes de dez
municípios da Mesorregião Oeste do estado do Rio Grande do Norte, a saber:
Alexandria, Apodi, Caraúbas, Governador Dix-Sept Rosado, Ipanguaçu, Mossoró,
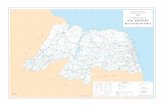
Pendências, Rodolfo Fernandes, Serra do Mel e Severiano Melo (Figura 4). Os
pacientes fazem parte de projetos envolvendo estudos da morbidade da doença de
Chagas e perfil imunológico dos pacientes sororreativos sendo acompanhados por
um médico cardiologista. Quinze indivíduos saudáveis residentes da mesma área
foram empregados como controles não infectados.
Amostras de sangue periférico dos pacientes foram coletadas e nelas
realizada a triagem sorológica pelo Laboratório de Biologia de Parasitos e de
Doença de Chagas (UFRN). O critério de inclusão adotado foi a sorologia reativa na
hemaglutinação indireta e no imunoensaio enzimático, seguindo as recomendações
da Organização Mundial de Saúde e o Consenso Brasileiro em Doença de Chagas
(DIAS et al., 2016).
Os pacientes com sorologia positiva foram submetidos à avaliação clínica e
realização de exames, como ECG, 2D-ecocardiograma (Ecocardiograma
Transtorácico Bidimensional), radiografia do tórax e radiografias contrastadas do
esôfago e cólon (enema opaco). Aos pacientes com alterações eletrocardiográficas
e/ou ecocardiográficas sugestivas de cardiopatia chagásica foi indicada a avaliação
pelo Holter 24 horas. A partir da avaliação clínica e dos resultados dos exames
complementares os pacientes foram classificados, segundo o II Consenso Brasileiro
em doença de Chagas (DIAS et al., 2016), nas diferentes formas clínicas da doença
de Chagas (Tabela 1).

30
Fig
ura
4 –
Ma
pa d
o R
N c
om
dest
aque a
os
munic
ípio
s de o
rig
em
dos
paci
ente
s est
uda
dos.
Os
paci
en
tes
chagási
cos
crôn
icos
e o
s in
div
íduos
con
trole
s sã
o
resi
dente
s d
est
es
10
munic
ípio
s da
M
eso
rreg
ião
Oest
e
potig
uar.
A
uto
r:
Íta
lo
Rafa
el
Ma
chado
de
C
arv
alh
o.

31
Tabela 1 – Caracterização da população estudada. Dados clínicos dos pacientes chagásicos crônicos.
Formas Clínicas
Indeterminada Cardíaca Digestiva Cardiodigestiva
Total
Gênero M 10 11 5 10 36
F 8 6 10 5 29
Total 18 17 15 15 65
Média de idade 41,4±10,7 49,7±11,8 57,6±8,9 65±10,6
MC - - 9 8
ME - - 3 3
MC+ME - - 3 4
FEVE±DP 64,6±3,42 55,8±14,96 65,0±6,48 56,2±13,84
ICT±DP 0,43±0,05 0,48±0,05 0,42±0,03 0,50±0,05
M: masculino; F: feminino; DP: desvio padrão; MC: megacólon; ME: megaesôfago; FEVE: fração de ejeção do ventrículo esquerdo em %; ICT: índice cardiotorácico. Valores de normalidade: ICT ≤ 0,5; FEVE > 55% *Dados cedidos pelo médico colaborador deste trabalho.
Os indivíduos com sorologia positiva e/ou com exame parasitológico positivo
para T. cruzi e ausência de sintomas e de alterações nos exames complementares
foram classificados como forma indeterminada (IND, n=18); os que apresentaram
alterações eletrocardiográficas sugestivas de comprometimento cardíaco, sendo ou
não sintomáticos, foram enquadrados na forma cardíaca (CARD, n=17); aqueles
avaliados clinicamente e que possuíam exames de imagem contrastados alterados
exibindo a presença de megaesôfago e/ou megacólon, classificados como forma
digestiva (DIG, n=15) e os pacientes com cardiomiopatia combinada com
megaesôfago e/ou megacólon, como forma cardiodigestiva (CARDIG, n=15).
Este trabalho foi aprovado pelo Comitê de Ética e Pesquisa da Universidade
do Estado do Rio Grande do Norte (UERN) sobre o protocolo de número Nº
027.2011 (Anexo A). Todos os pacientes assinaram o termo de consentimento livre
e esclarecido estando em conformidade com a Resolução 196/96-CNS/MS. Todos
os experimentos descritos foram realizados em conformidade com os princípios
éticos contidos nas diretrizes do Conselho Nacional de Saúde e declaração de
Helsinki sobre pesquisa envolvendo humanos.

32
3.3 Quantificação de RNAm das quimiocinas e receptores de quimiocinas
em células mononucleares de sangue periférico dos pacientes por PCR
em tempo real
3.3.1 Coleta de sangue e obtenção de CMSP
Quinze mililitros de sangue periférico de cada paciente foram coletados em
tubos a vácuo contendo o anticoagulante EDTA (Vacutainer®, BD Biosciences, USA)
para a separação das células mononucleares de sangue periférico (CMSP). O
sangue foi lentamente transferido para tubos cônicos de polipropileno com
capacidade de 50mL (Falcon, BD Biosciences, USA) contendo uma solução Ficoll-
Hypaque na proporção 2:1 (Histopaque® 1.077-Sigma-Aldrich, USA) e centrifugados
a 800 x g por 30 minutos. O anel de células formado foi transferido para um novo
tubo de 15mL e submetido à nova centrifugação a 110 x g durante 20 minutos. Por
fim, as células que passaram pelo procedimento de separação foram
ressuspendidas em 500µL de Trizol (Invitrogen, Carlsbad, CA, USA) e
armazenadas à -20ºC.
3.3.2 Extração de RNA e síntese de cDNA
A extração de RNA das células mononucleares de sangue periférico foi
realizada através do kit SV RNA Isolation System (Promega, USA). Ao conteúdo de
CMSP obtidas na etapa anterior e ressuspendidas em Trizol (Invitrogen) adicionou-
se 200µL de clorofórmio (Sigma-Aldrich), em seguida tais amostras foram agitadas
durante 30 segundos e incubadas por 15 minutos à temperatura ambiente. Após
esse procedimento, os tubos foram centrifugados a 12000 x g por 15 minutos a 4°C.
A fase aquosa, contendo o RNA, foi transferida para um tubo estéril e acrescidos a
ela 500µL de álcool 95%. Esta mistura foi transferida para uma coluna acoplada a
um tubo coletor, fornecidos pelo kit, e em seguida os tubos foram centrifugados a

33
12000 x g por 2 minutos a 4o C (as centrifugações posteriores seguem o mesmo
parâmetro); o líquido presente no tubo coletor foi descartado. Foram adicionados
400µL de solução de lavagem (RNA wash solution) e realizada nova centrifugação.
Após se desprezar o sobrenadante, foi adicionado 50µL de solução DNAse
(preparada com 40µL do tampão amarelo, 5µL de MgCl2 0,09M e 5µL de DNAse I,
fornecidos no kit) e as colunas foram incubadas por 15 minutos à temperatura
ambiente. Em seguida 200µL de solução de parada (DNAse stop solution) foram
adicionados e os tubos foram centrifugados. O sobrenadante foi desprezado e
adicionado 250µL de solução de lavagem para a posterior centrifugação. A coluna foi
então transferida para tubo estéril e 20µL de água livre de RNAse foram adicionados.
Uma nova centrifugação foi realizada e a coluna foi descartada. O RNA purificado foi
armazenado à -20ºC.
Para a síntese do cDNA, a partir da fita de RNA total, foi utilizado o kit High
Capacity cDNA Reverse Transcription (Applied Biosystems, USA) e o termociclador
convencional (MJ Research PTC-150 MiniCycler). Os ciclos da reação foram de 10
minutos a 25ºC, 120 minutos a 37ºC, 5 minutos a 85ºC e infinito a 4ºC. A preparação
da mistura foi realizada adicionando 2µL da solução tampão 10x, 0,8µL de
nucleotídeos trifosfatos contendo desoxirribose (dNTPs) 25x, 1µL da enzima
(MultiScribe™ Reverse Transcriptase) e 2µL de oligonucleotídeos e 4,2 µL de água
livre de RNAse totalizando 10µL da mistura, a qual foi adicionada à 10µL de cada
amostra de RNA extraído.
3.3.3 PCR em tempo real (q-PCR)
A análise quantitativa da expressão dos genes das quimiocinas e dos
receptores de quimiocinas foi realizada por meio de reações de PCR em tempo real,
utilizando o sistema SYBR Green® Master Mix (Applied Biosystems, USA) em
termociclador 7500 Fast Real time (Applied Biosystems, USA). Os iniciadores
específicos para as quimiocinas e receptores de quimiocinas foram desenhados com
o auxílio do software Primer Express (Applied Biosystems, USA) ou foram utilizados
iniciadores já descritos na literatura (Tabela 2).

34
As reações foram realizadas em placas de 96 poços MicroAmp® Fast Optical
(Applied Biosystems, USA) e, para cada gene alvo foi preparado uma mistura
composta de 0,7µL de cada iniciador (direto e reverso), 5µL de Sybr® green (Applied
Biosystems, USA), 1,6 µL de água livre de RNAse e 2µL do cDNA sintetizado a partir
do RNA mensageiro e oligonucleotídeos específicos. As condições da PCR foram
padronizadas para cada par de iniciadores de acordo com a concentração,
temperatura de anelamento, ausência de formação de dímeros (determinada pela
curva de dissociação do produto gerado pela q-PCR), eficiência de amplificação dos
genes alvos e gene constitutivo.
A determinação dos níveis de expressão dos genes alvo foi realizada por meio
da normalização das amostras quanto à expressão constitutiva de β-actina. Os
cálculos da expressão relativa de quimiocinas e receptores de quimiocinas foi
realizada a partir da fórmula 2-(∆∆CT) utilizando o programa Microsoft Excel 2010
(Microsoft, USA), onde ∆CT corresponde à diferença entre o cycle threshold (CT) da
molécula alvo e o CT da β-actina para cada amostra; e ∆∆CT é resultante da
diferença entre o ∆CT de cada amostra e média de ∆CT dos controles negativos.
3.4 Análises estatísticas
Os dados foram expressos em média ± desvio padrão da média. As análises
estatísticas foram realizadas com o software PRISM® 5.0 (GraphPad, San Diego,
CA, USA). Para a verificação da distribuição normal dos dados, foi empregado o
teste D’Agostino-Pearson. A distribuição dos dados foi não paramétrica e os testes
Kruskall-Wallis e Dunn, foram empregados para a determinação das diferenças entre
expressão dos genes das quimiocinas e seus receptores entre os diferentes grupos
(IND, CARD, CARDIG, DIG). Para a determinação da correlação entre a expressão
de cada molécula que teve expressão diferencial aumentada e os parâmetros
clínicos foi realizado o teste de correlação de Spearman. Em todos os casos, as
diferenças foram consideradas estatisticamente significantes quando o valor de
p<0,05.

35
Tabela 2 – Sequência dos iniciadores utilizados nas q-PCR.
Iniciadores Direto Reverso Tm Referência
Hu-β-actina TGACTCAGGATTTAAAAACTGGAA GCCACATTGTGAACTTTGGG 56,8º Guedes et al., 2016
CCL1 CCTGCGCCTTGGACACAGT CAGAGCCCACAATGGAAAGAAA 60,0º Kato et al.,
2009
CCL2 GATGCAATCAATGCCCCAGTC TCCTTGGCCACAATGGTCTTG 59,9º Hwang et al., 2013
CCL3 TCTGCATCACTTGCTGCTGACAC CACTCAGCTCCAGGTCGCTGAC 63,8º Feuser et al., 2012
CCL4 CGTGTATGACCTGGAACTGAACTG TCCCTGAAGACTTCCTGTCTCTGA 61,9º Kato et al.,
2009
CCL5 GAAGAAATGGGTTCGGAA AGCTAGGACAAGAGCAAGCA 56,4º O presente
estudo
CCL17 GGGATGCCATCGTTTTTGT TCTTCACTCTCTTGTTGTTGGG 56,8º O presente
estudo
CCL22 GTCTCCAAGCCTCTAGCATAGA TGATATGTAACTGCCTTTTGGC 58,2º O presente
estudo
CCL24 CCCTGCTGCATGTTCTTTGT TTCTTGGTGGTGAAGATCACTC 58,0º O presente
estudo
CCL27 CTACAGCAGCATTCCTACTGC ATGGAGCTTTCTCTCTTGGTG 58,9º Hanamoto et al., 2004
CCL28 AGAAGCCATACTTCCCATTGC AGCTTGCACTTTCATCCACTG 58,0º Hanamoto et al., 2004
CXCL9 CCAGTGCACCTGTCATATGCTCT CCAACATGGAGTAGCCAGGAAA 61,0º O presente
estudo
CXCL10 GCCAATTTTGTCCACGTGTTG AGCCTCTGTGTGGTCCATCCT 59,9º Matsuda et
al.,2007
CCR2 CTCTACTCGCTGGTGTTCATCT CACAATGGGAGAGTAATAAGAAAAAGC 59,4º Cheong et al., 2007
CCR3 TGGACATATCAAGGACTTCACTAAA ACAAGAAGACCAGTGGTACCTG 58,5º O presente
estudo
CCR4 GGATATAGCAGATACCACCCTC AAATCATCTTGCACAGACCTAG 58,2º Cardoso et al., 2008
CCR5 CACCTGCAGCTCTCATTTTCC TTGTAGGGAGCCCAGAAGAG 59,4º Seay et al.,
2013
CCR6 ATCGTAATGAAGTTGGGGTT ATCACAAATTTCAGACCCCT 53,7º Jordan et al., 1999
CCR7 GTGCCCGCGTCCTTCTCATCAG GGCCAGGACCACCCCATTGTAG 65,6º Sperveslage et al., 2011
CCR8 AGTATGCACATCTTGGATGG TGTAGTCTACGCTGGAGGAA 56,7º Jordan et al., 1999
CCR10 TGCTGGATACTGCCGATCTACTG TCTAGATTCGCAGCCCTAGTTGTC 61,9º Hanamoto et al., 2004
CXCR3 CCAAGTGCTAAATGACGCCG GCAAGAGCAGCATCCACATC 59,8º Willox et al.,
2010

36
4 RESULTADOS
Pacientes com a forma cardíaca da doença apresentaram elevada expressão
relativa de RNAm das quimiocinas CXCL9 (p<0,05) (Figura 5A) e CXCL10 (p<0,01)
(Figura 5B) e dos receptores de quimiocinas CXCR3 (p<0,05) (Figura 5C) e CCR5
(p<0,05) (Figura 5D), com diferenças significativas quando comparadas às suas
expressões em pacientes com a forma indeterminada e, no caso da quimiocina
CXCL10, com a forma digestiva também (p<0,05) (Figura 5B).
A maior expressão relativa de RNAm de CCR3 foi observada em pacientes
com a forma digestiva da doença de Chagas, diferindo significativamente de sua
expressão em pacientes com a forma cardíaca (p<0,01) e indeterminada (p<0,05)
(Figura 6A). A quimiocina CCL5 apresentou expressão relativa maior em pacientes
com a forma clínica cardiodigestiva, com diferenças significativas quando
comparada à expressão em pacientes com a forma indeterminada (p<0,01) e
cardíaca (p<0,001) (Figura 6B).

37
Figura 5 – Quimiocinas e receptores do padrão Th1 aumentados em pacientes cardíacos. Expressão relativa de RNAm de CXCL9 (A), CXCL10 (B), CXCR3 (C) e CCR5 (D) determinadas por q-PCR a partir de células mononucleares do sangue periférico de pacientes com as formas clínicas indeterminada (IND, n=18), cardíaca (CARD, n=17), cardiodigestiva (CARDIG, n=15) e digestiva (DIG, n=15). Os dados são representativos de experimentos independentes expressos em média ± DP. CN: Controle negativo (indivíduos saudáveis). *p<0,05. **p<0,01.
Figura 6 – Expressão de CCR3 e CCL5 aumentadas em pacientes com as formas cardíaca e cardiodigestiva. Expressão relativa de RNAm de CCR3 (A) e CCL5 (B) determinadas por q-PCR a partir de células mononucleares do sangue periférico de pacientes com as formas clínicas indeterminada (IND, n=18), cardíaca (CARD, n=17), cardiodigestiva (CARDIG, n=15) e digestiva (DIG, n=15). Os dados são representativos de experimentos independentes expressos em média ± DP. CN: Controle negativo (indivíduos saudáveis). *p<0,05. **p<0,01. ***p<0,001

38
As quimiocinas CCL1, CCL2, CCL3, CCL4, CCL17, CCL22, CCL24, CCL27 e
CCL28 (Figura 7) e os receptores de quimiocinas CCR2, CCR4, CCR6, CCR7,
CCR8 e CCR10 (Figura 8) não apresentaram diferenças significativas em suas
expressões entre os diferentes grupos.
Figura 7 – Expressão de quimiocinas em pacientes com as diferentes formas clínicas da doença de Chagas. Expressão relativa de RNAm de CCL1 (A), CCL2 (B), CCL3 (C), CCL4 (D), CCL17 (E), CCL22 (F), CCL24 (G), CCL27 (H) e CCL28 (I) determinadas por q-PCR a partir de células mononucleares do sangue periférico de pacientes com as formas clínicas indeterminada (IND, n=18), cardíaca (CARD, n=17), cardiodigestiva (CARDIG, n=15) e digestiva (DIG, n=15). Os dados são representativos de experimentos independentes expressos em média ± DP. CN: Controle negativo (indivíduos saudáveis).

39
Figura 8 – Expressão de receptores de quimiocinas em pacientes com as diferentes formas clínicas da doença de Chagas. Expressão relativa de RNAm de CCR2 (A), CCR4 (B), CCR6 (C), CCR7 (D), CCR8 (E) e CCR10 (F) determinadas por q-PCR a partir de células mononucleares do sangue periférico de pacientes com as formas clínicas indeterminada (IND, n=18), cardíaca (CARD, n=17), cardiodigestiva (CARDIG, n=15) e digestiva (DIG, n=15). Os dados são representativos de experimentos independentes expressos em média ± DP. CN: Controle negativo (indivíduos saudáveis).

40
No intuito de verificar se há correlação entre a expressão diferencial das
quimiocinas e dos receptores de quimiocinas e as manifestações clínicas crônicas
da doença de Chagas foi realizado o teste de Spearman com os dados de
expressão que apresentaram alterações significativas entre os grupos e os
parâmetros característicos das diferentes formas clínicas, a saber o grau de
dilatação do esôfago e do cólon, o índice cardiotorácico e a fração de ejeção do
ventrículo esquerdo (FEVE). Constatou-se uma correlação positiva (p<0,05) entre a
expressão relativa de RNAm de CCR3 em pacientes com as formas digestiva
(Figura 9A) e cardiodigestiva (Figura 9B) e a dimensão, em centímetros, do
segmento do intestino correspondente ao sigmoide. Não houve correlações
significativas entre outras moléculas e os parâmetros observados (Figuras 10-12).
Figura 9 – Correlações positivas entre a expressão de CCR3 e a dimensão do sigmoide. A correlação foi feita utilizando a expressão de CCR3 e a dimensão em centímetros do sigmoide dos pacientes que apresentam a forma digestiva (A) e dos pacientes que apresentam a forma cardiodigestiva (B). A linha representa a regressão linear da comparação. *p<0,05
Figura 10 – Correlações entre a expressão de CCR3 e parâmetros digestivos. Correlações entre a expressão de CCR3 e o grau de dilatação do esôfago (A) e a dimensão do reto em centímetros (B) em pacientes com a forma digestiva. A linha representa a regressão linear da comparação.

41
Figura 11 – Correlações entre a expressão de CCL5 e parâmetros cardíacos e digestivos. Correlações entre a expressão de CCL5 e o ICT (A), FEVE (B) o grau de dilatação do esôfago (C), a dimensão do sigmoide em centímetros (D) e a dimensão do reto em centímetros (E) em pacientes com a forma cardiodigestiva. A linha representa a regressão linear da comparação. ICT: índice cardiotorácico; FEVE: fração de ejeção do ventrículo esquerdo

42
Figura 12 – Correlações entre a expressão aumentada de quimiocinas e receptores da resposta Th1 e parâmetros cardíacos. Correlações entre a expressão de CXCL9, CXCL10, CXCR3 e CCR5 e o ICT, respectivamente (A), (C), (E), (G) e FEVE (B), (D), (F), (H) em pacientes com a forma cardíaca. A linha representa a regressão linear da comparação. ICT: índice cardiotorácico; FEVE: fração de ejeção do ventrículo esquerdo.

43
5 DISCUSSÃO
O estabelecimento da cardiomiopatia chagásica está associado com uma
intensa resposta Th1 específica contra o T. cruzi (GOMES et al., 2005), aqui refletido
pelas diferenças nos perfis de expressão relativa de RNAm das quimiocinas CXCL9
e CXCL10 e dos receptores de quimiocinas CCR5 e CXCR3. A resposta Th1 induz
intensa produção de IFN-γ, participando da eliminação do parasito, logo, tem um
papel no controle do parasitismo, contudo também agrava a inflamação no coração
durante o curso da infecção, estando assim envolvida no desenvolvimento e
gravidade da doença cardíaca (GOMES et al., 2003). Ademais, essa citocina
estimula e mantém a síntese de quimiocinas como CXCL9 e CXCL10, detectadas no
infiltrado inflamatório cardíaco, composto por células T CD4+ e T CD8+, em modelos
experimentais (TEIXIERA, GAZZINELLI e SILVA, 2002). O receptor dessas
quimiocinas, o CXCR3, é preferencialmente expresso em células T CD4+ do perfil
Th1, células T CD8+ efetoras e células NK (GROOM e LUSTER, 2011), sendo esse
um importante eixo de migração de células da resposta Th1 para os sítios de
inflamação (CRIPPS et al., 2012). Assim como o CXCR3, o receptor CCR5 e seus
ligantes são considerados centrais no perfil de resposta Th1, tendo relevância no
recrutamento leucocitário e na inflamação tecidual, estando envolvidos com a
patogênese da forma cardíaca da doença de Chagas (GOMES et al., 2005). O
RNAm dos ligantes de CCR5 – CCL3, CCL4, CCL5 – não apresentou expressão
diferencial aumentada na forma cardíaca. O IFN-γ teria a capacidade de inibir a
produção de grande parte das outras quimiocinas, levando assim a seletividade na
expressão de CXCL9 e CXCL10 (BAGGIOLOINI, 1998), o que poderia justificar a
ausência de diferença significativa na expressão relativa de outras quimiocinas que
são reconhecidamente integrantes do perfil de resposta Th1 em pacientes com a
cardiomiopatia chagásica.
A susceptibilidade genética tem sido associada com as diferenças nas
apresentações clínicas da doença de Chagas. Esta susceptibilidade provavelmente
é parcialmente resultante da existência de polimorfismos genéticos funcionalmente
relevantes, que quando em genes relacionados à resposta imune, levam a variações
na intensidade dessa resposta influenciando assim os mecanismos inflamatórios que
são fundamentais à patogênese da cardiomiopatia chagásica crônica (BILATE e

44
CUNHA-NETO, 2008; CUNHA-NETO et al., 2009). Estudos têm relacionado
desenvolvimento da forma cardíaca da doença de Chagas com a presença de
polimorfismos de um nucleotídeo (single nucleotide polymorphisms – SNPs) em
genes de quimiocinas, devido à importância destas moléculas na migração
leucocitária e, consequentemente, no processo inflamatório do qual decorre a
patogênese da cardiomiopatia chagásica (CUNHA-NETO et al., 2009).
SNPs no gene do CCR5 têm sido associados tanto com o desenvolvimento
quando com a gravidade da cardiomiopatia na doença de Chagas (DE OLIVEIRA et
al., 2016). Um polimorfismo na região promotora de CCR5 (CCR5 59029 A G) teria a
capacidade de influenciar a apresentação clínica da doença ao reduzir a expressão
desse receptor de quimiocina e, consequentemente, a intensidade da resposta
inflamatória por reduzir a migração de células do perfil Th1. Na população estudada,
a frequência do genótipo CCR5 59029 A/G era maior em pacientes assintomáticos
quando comparados aos que apresentavam a forma cardíaca da doença de Chagas.
O alelo CCR5 59029 G teria um papel protetor no desenvolvimento da
cardiomiopatia chagásica crônica (CALZADA et al., 2001). Outro polimorfismo
associado à progressão da doença é o alelo CCCR5 2733 G, que está relacionado
com baixo risco de desenvolvimento da doença cardíaca, tendo sido observado em
maior frequência em pacientes que apresentam a forma indeterminada em relação
aos com a forma cardíaca. Além disso, há casos em quem se correlaciona a
gravidade da doença com a presença de polimorfismos. A frequência do alelo CCR5
2554 T foi maior em pacientes com menor gravidade da cardiomiopatia chagásica
(FLÓREZ, MARTÍN e GONZÁLEZ, 2012). Estudos mostraram que o genótipo CCR5
rs3176763 C/C teria caráter protetor enquanto que o CCR5 rs3176763 C/A teria
associação com a forma cardíaca da doença (FRADE et al., 2013) e o CCR5
rs1799988 C/C com o risco aumentado desenvolvimento de cardiomiopatia grave
(NOGUEIRA et al., 2012).
Polimorfismos nos genes de CXCL9 e CXCL10 também teriam influência na
progressão da doença de Chagas. O genótipo CXCL9 rs10336 C/C e o CXCL10
rs3921 G/G levariam à diminuição da expressão do RNAm de CXCL9 e CXCL10,
respectivamente, no miocárdio, estando associados à proteção da cardiomiopatia
chagásica grave. Esses genótipos modulariam a expressão local não só de
quimiocinas, mas também a de outras quimiocinas-chave, resultando assim na
variação da intensidade da miocardite por alterar a migração celular para o tecido

45
cardíaco (NOGUEIRA et al., 2012). Vale lembrar que a relação dos polimorfismos
genéticos como a susceptibilidade ao desenvolvimento e gravidade da
cardiomiopatia chagásica é complexa, visto que cada polimorfismo não agiria de
forma independente, mas contribuiria com pequenas parcelas influenciando a
expressão das moléculas e, logo, patogênese dessa forma clínica da doença
(FLÓREZ, MARTÍN, GONZÁLEZ, 2012).
A variabilidade genética do parasito também participa na determinação das
formas clínicas da doença de Chagas. As diversas cepas do T. cruzi são agrupadas,
por critérios genéticos, em discrete typing units (DTUs), sendo separadas em seis
grupos (Tc I–VI). No Rio Grande do Norte há a presença de TcI, TcII e TcIII, os
grupos Tc-I e Tc-II estão associados com o desenvolvimento das formas
indeterminada, cardíaca e digestiva da doença, enquanto o grupo Tc-III é sempre
associado com a forma clínica indeterminada. Estudos mostraram que, in vitro, a
cepa AQ1.7 pertencente ao grupo TcI, aumentou a quantidade de células dendríticas
expressando CCR5 (COSTA et al., 2014). Guedes et al. (2010b) ao investigar os
perfis Th1, Th2 e Th17 de quimiocinas e receptores de quimiocinas no tecido
cardíaco de cães da raça Beagle infectados com as cepas Y, ABC e Berenice-78
(TcII) do T. cruzi verificou que a expressão de CXCL9, CCL1 e CCL5 em cães
infectados com as cepas Y e ABC foi elevada quando comparados com os
infectados com a cepa Berenice-78. O perfil de expressão das quimiocinas e
receptores de quimiocinas se apresentou significativamente diferente entre os
grupos de cães que desenvolveram a forma cardíaca ou a forma indeterminada,
refletindo uma exacerbada resposta Th1 nos grupos de animais que apresentaram a
cardiomiopatia chagásica. É possível então que as diferentes cepas possuam função
na modulação de parâmetros pró-inflamatórios como a expressão das quimiocinas e
seus receptores, tendo assim influência na resposta imune do hospedeiro, e
consequentemente no desenvolvimento das apresentações clínicas da doença.
A expressão relativa de RNAm do receptor CCR3 foi encontrada aumentada
em pacientes com a forma digestiva da doença de Chagas em relação aos que
apresentam as formas indeterminada e cardíaca. Além disso, foi possível
estabelecer correlação positiva entre a expressão relativa do RNAm de CCR3 e a
dimensão do sigmoide. A forma digestiva da doença é resultado inflamação nas
camadas de musculatura lisa e destruição de neurônios autônomos parassimpáticos
(VAGO, 1996; DA SILVEIRA et al., 2005). O receptor CCR3 é expresso

46
preferencialmente em células que compõe a resposta Th2 (SEBASTIANI et al., 2001;
GUEDES et al., 2010b) a qual está associada com a susceptibilidade à infecção,
expressa por maior parasitismo e inflamação tecidual (KUMAR e TARLETON, 2001).
O possível favorecimento à resposta Th2 na forma digestiva poderia ser indicado
como responsável por menor controle parasitário, levando assim a provável
persistência do parasito no local. Vago (1996) e Lages-Silva et al. (2001)
demonstraram a presença do kDNA do T. cruzi no esôfago de pacientes com a forma
digestiva da doença de Chagas. O processo inflamatório que ocorre nas camadas
musculares e nos plexos neuronais juntamente com redução do quantitativo
neuronal local levaria à ocorrência das megassíndromes (DA SILVEIRA et al., 2009).
Em pacientes com forma cardiodigestiva houve uma maior expressão relativa
do RNAm de CCL5 quando comparados com pacientes com a forma cardíaca e
indeterminada. Apesar de CCL5 ter como principal receptor o CCR5, característico
da resposta Th1, esta quimiocina também se liga ao receptor CCR3, marcador da
resposta Th2 (BAGGIOLINI, 1998). A elevada expressão diferencial de CCL5 poderia
induzir migração de células dos perfis de resposta Th1 ou Th2, provavelmente não
favorecendo o estabelecimento de um tipo de resposta em detrimento do outro.
Entender os mecanismos de controle da expressão e de função das
quimiocinas pode ser a chave para o desenvolvimento de terapêuticas de doenças
de cunho inflamatório (PANGANIBAN et al., 2014). Há vários níveis onde o controle
pode ser executado. No nível pós-transcricional existe uma grade variedade de
mecanismos que modulam a expressão proteínas envolvidas na mediação da
resposta inflamatória, como as quimiocinas e seus receptores. O complexo inibidor
da tradução ativado por IFN-γ (gamma-interferon activated inhibitor of translation –
GAIT) ao se ligar em seu sítio de ação no RNAm de um grupo de moduladores
inflamatórios, dentre estes CCL22, CCR3, CCR4, CCR6, leva à inibição da síntese
proteica, tendo assim papel na regulação da inflamação mediada pela resposta
imune (ANDERSON, 2010). Micro-RNAs (miRNA) também são considerados
reguladores pós-transcricionais ao atuarem degradando o RNAm ou impedindo a
tradução proteica, por se ligarem a molécula de RNAm, em ambos os casos,
promovem a inibição da expressão gênica (MASI et al., 2016). A regulação de
quimiocinas como CCL2, CCL4 e CCL8 que estão envolvidas na inflamação alérgica
e asma tem participação da ação conjunta de miRNAs, como por exemplo miR-1248,
Let-7-a (PANGANIBAN et al., 2014) que tem sua expressão relativa reduzida em

47
pacientes asmáticos em relação a pacientes com doença pulmonar obstrutiva
crônica e a indivíduos saudáveis. A repressão desses miRNAs pode levar ao
aumento de mediadores alérgicos tendo possivelmente papel na patogênese
(PINKERTON et al., 2013). miRNAs podem se tornar a alvos de novos agentes anti-
inflamatórios por diversas estratégias, como a administração de miRNAs miméticos
em casos onde há baixa expressão desses reguladores ou, por outro lado, quando
há a expressão aumentada deles, o uso de inibidores de miRNAs (PANGANIBAN et
al., 2014).
Modificações pós-traducionais são capazes de mascarar as quimiocinas, ou
seja, ainda que haja a expressão gênica e também a tradução em proteína, podem
ocorrer mudanças que culminam na perda de sua função. Neste contexto, Molon;
Viola; Bronte (2012) descrevem o efeito que espécies reativas de nitrogênio (RNS)
exercem sobre moléculas sinalizadoras de células T, sendo a rede de quimiocinas
frequentemente afetada por células cancerígenas. O metabolismo desregulado da
arginina leva a produção intratumoral de RNS, ocasionando a formação de CCL2
nitrosilada (N-CCL2), tal molécula não é eficaz no recrutamento de células T,
havendo assim o fracasso por parte das células T em se infiltrar nos tumores.
Portanto as espécies reativas de nitrogênio, ao mascararem a quimiocina CCL2 por
um mecanismo pós-traducional acarreta um bloqueio na entrada de linfócitos T
citotóxicos nos tumores, os tornando ineficazes no combate à massa tumoral.
Outro exemplo de modificação pós-traducional ocorre através da ação da
dipeptidil peptidase 4 (DPP4)/CD26 ao clivar dipeptídeos na porção N-terminal
causa o truncamento de CXCL12, levando a inativação da quimiocina e ao
consequente bloqueio da quimiotaxia mediada por ela. CXCL12 tem participação no
controle da hematopoese e sua inativação influencia na quimiotaxia e sobrevivência
de células progenitoras hematopoeticas. Interessantemente, o produto da ação da
DPP4 sob CXCL12 tem a capacidade de bloquear a atividade quimiotática de
moléculas de CXCL12 que não sofreram ação da enzima. Além de CXCL12, uma
série de fatores estimuladores de colônia e de outras quimiocinas têm sítios de
clivagem para DPP4. A modificação causada por DPP4 modifica as atividades
funcionais das quimiocinas, enquanto a inibição dessa enzima leva a um aumento
da atividade desses mediadores quimiotáticos (BROXMEYER et al., 2016). A
ocorrência de modificações pós-transcricionais e pós-traducionais nas quimiocinas e

48
seus receptores abre possibilidades para utilização do controle de expressão e
função por meio desses mecanismos.
A compreensão do controle biológico do tráfego leucocitário em resposta à
infecção pelo T. cruzi pode embasar novos tratamentos que não prejudiquem o
controle parasitário (LANNES-VIEIRA et al., 2009). O entendimento da expressão
diferencial de quimiocinas e seus receptores nas formas clínicas da doença pode ser
uma alternativa útil no campo da aplicação de novas estratégias terapêuticas.

49
6 CONCLUSÃO
Pacientes com a forma cardíaca da doença de Chagas apresentam maior
expressão relativa de RNAm dos receptores de quimiocinas CCR5 e CXCR3 e das
quimiocinas CXCL9 e CXCL10, moléculas típicas da resposta Th1, sugerindo
prevalência deste perfil de resposta imune nesta forma clínica.
A expressão relativa de RNAm de CCL5, quimiocina contribuiria para
migração de células dos perfis de resposta Th1 e Th2, está elevada em pacientes
com a forma cardiodigestiva da doença de Chagas, esta.
Pacientes com a forma digestiva da doença apresentam elevada expressão
relativa de RNAm do receptor CCR3, característico da resposta Th2. A expressão
deste receptor correlaciona-se positivamente com a dimensão do sigmoide em
pacientes com acometimento do trato digestivo.

50
REFERÊNCIAS
ABEL, L. C. et al. Chronic Chagas' disease cardiomyopathy patients display an increased IFN-gamma response to Trypanosoma cruzi infection. Journal of Autoimmunity, v. 17, n. 1, p. 99-107, 2001. ABREU, M. M. et al. Th17 and Treg cells evaluation with the digestive form of chronic Chagas disease. In: TEODORO, M. M. A. Análise do padrão de resposta Th17 e de células T regulatórias em pacientes com a forma digestiva da doença de Chagas crônica. Botucatu, 2016. p. 13-32. ACADEMIA BRASILEIRA DE CIÊNCIAS. Doenças negligenciadas. Rio de Janeiro, 2010. 56 p. ADL, S. M. et al. The revised classification of eukaryotes. Journal of Eukaryotic Microbiology, v. 59, n. 5, p. 429-493, 2012. ALLEN, S. J.; CROWN, S. E.; HANDEL, T. M. Chemokine: receptor structure, interactions, and antagonism. Annual Review of Immunology, v. 25, p. 787-820, 2007. ALIBERTI, J. C. S. et al. Beta-chemokines enhance parasite uptake and promote nitric oxide-dependent microbiostatic activity in murine inflammatory macrophages infected with Trypanosoma cruzi. Infection and Immunity, v. 67, n. 9, p. 4819-4826, 1999. ALVAREZ, C. et al. Differential expression of CC chemokines (CCLs) and receptors (CCRs) by human T lymphocytes in response to different Aggregatibacter actinomycetemcomitans serotypes. Journal of Applied Oral Science, v. 23, n. 5, p. 536-546, 2015. ANDERSON, P. Post-transcriptional regulons coordinate the initiation and resolution of inflammation. Nature reviews Immunology, v. 10, n. 1, p. 24-35, 2010. ANDRADE, C. M. et al. Chagas disease: morbidity profile in an endemic area of Northeastern Brazil. Revista da Sociedade Brasileira de Medicina Tropical, v. 48, n. 6, p. 706-715, 2015.

51
BAFICA, A. et al. Cutting edge: TLR9 and TLR2 signaling together account for MyD88-dependent control of parasitemia in Trypanosoma cruzi infection. Journal of Immunology, v. 177, n. 6, p. 3515-3519, 2006. BAGGIOLINI, M. Chemokines and leukocyte traffic. Nature, v. 392, p. 565-568, 1998. BASSO, B. Modulation of immune response in experimental Chagas disease. World Journal of Experimental Medicine, v. 3, n. 1, p. 1-10, 2013. BETTELLI, E. et al. Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells. Nature, v. 441, n. 7090, p. 235-238, 2006. BILATE, A. M. B.; CUNHA-NETO, E. Chagas disease cardiomiopathy: current concepts of an old disease. Revista do Instituto de Medicina Tropical de São Paulo, v. 50, n. 2, p. 67-74, 2008. BIRON, C. A.; GAZZINELLI, R. T. Effects of IL-12 on immune responses to microbial infections: A key mediator in regulating disease outcome. Current Opinion in Immunology, v. 7, n. 4, p. 485-496, 1995. BLANCHET, X. et al. Touch of chemokines. Frontiers in immunology, v. 3, p. 1-18, 2012. BONECCHI, B. R. et al. Differential expression of chemokine receptors and chemotactic responsiveness of type 1 T helper cells. Journal of Experimental Medicine, v. 187, n. 1, p. 129-134, 1998. BONNEY, K. M.; ENGMAN, D. M. Chagas heart disease pathogenesis: one mechanism or many? Current molecular medicine, v. 8, n. 6, p. 510-518, 2008. BONNEY, K. M. et al. Depletion of regulatory T cells decreases cardiac parasitosis and inflammation in experimental Chagas disease. Parasitology Research, v. 114, n. 3, p. 1167-1178, 2015. BRENER, Z. Biology of Trypanosoma cruzi. Annual Review of Microbiology, v. 27, p. 347-382, 1973.

52
BRENER, Z.; GAZZINELLI, R. T. Immunological control of Trypanosoma cruzi infection and pathogenesis of Chagas’ disease. International archives of allergy and immunology, v. 114, p. 103-110, 1997. BRITO C.R.N. et al. Seroepidemiology of Trypanosoma cruzi infection in the semiarid rural zone of the State of Rio Grande do Norte, Brazil. Revista da Sociedade Brasileira de Medicina Tropical, v.45, n. 3, p. 46-52, 2012. BROMLEY, S. K.; MEMPEL, T. R.; LUSTER, A. D. Orchestrating the orchestrators: chemokines in control of T cell traffic. Nature immunology, v. 9, n. 9, p. 970-980, 2008. BROXMEYER, H. E. et al. Modulation of Hematopoietic Chemokine Effects In Vitro and In Vivo by DPP-4/CD26. Stem Cells and Development, v. 25, n. 8, p. 575-585, 2016. CALZADA, J. E. et al. Chemokine receptor CCR5 polymorphisms and Chagas’ disease cardiomyopathy. Tissue Antigens, v. 58, n. 3, p. 154-158, 2001. CARDOSO, C. R. et al. Characterization of CD4+CD25+ natural regulatory T cells in the inflammatory infiltrate of human chronic periodontitis. Journal of Leukocyte Biology, v. 84, n. 1, p. 311-318, 2008. CAVALIER-SMITH, T. A revised six-kingdom system of life. Biological Reviews, v. 73, p. 203–266, 1998. CAVALIER-SMITH, T. Eukaryote kingdoms: seven or nine? BioSystems, v. 14, p. 461–481, 1981. CAVALIER-SMITH, T. The phagotrophic origin of eukaryotes and phylogenetic classification of protozoa. International Journal of Systematic and Evolutionary Microbiology, v. 52, p. 297–354, 2002. CHAGAS, C. Nova tripanozomiase humana. Estudos sobre a morfolojia e o ciclo evolutivo do Schizotrypanum cruzi n. gen., n. sp., ajente etiolojico de nova entidade morbida do homem. Memórias do Instituto Oswaldo Cruz, v. 1, p. 159-218, 1909. CHAGAS, C. Tripanozomiase Americana. Forma aguda da moléstia. Memórias do Instituto Oswaldo Cruz, v. 8, p. 37-65, 1916.

53
CHAGAS, C.; VILLELA, E. Forma cardiaca da Trypanosomiase Americana. Memórias do Instituto Oswaldo Cruz, v. 14, n. 1, p. 5-61, 1922 CHANG, H.C. et al. The transcription factor PU.1 is required for the development of IL-9-producing T cells and allergic inflammation. Nature Immunology, v. 11, n.6, p. 527-534, 2010. CHARO, I. F.; RANSOHOFF, R. M. The many roles of chemokines and chemokine receptors in inflammation. New England Journal of Medicine, v. 354, n. 6, p. 610-621, 2006. CHEONG, J. Y. et al. Polymorphisms are not Associated with the Outcome of Hepatitis B Virus Infection : Results from a Large Scale Single Ethnic Population. Journal of Korean Medical Science, n. 13, 2007. COSTA, T. A. et al. Immunomodulation by Trypanosoma cruzi: Toward understanding the association of dendritic cells with infecting TcI and TcII populations. Journal of Immunology Research, v. 2014, 2014. CRIPPS, J. G. et al. Liver inflammation in a mouse model of Th1 hepatitis despite the absence of invariant NKT cells or the Th1 chemokine receptors CXCR3 and CCR5. Laboratory Investigation, v. 92, n. 10, p. 1461-1471, 2012. CUNHA-NETO, E. et al. Immunological and non-immunological effects of cytokines and chemokines in the pathogenesis of chronic Chagas disease cardiomyopathy. Memorias do Instituto Oswaldo Cruz, v. 104, p. 252-258, 2009. DA SILVEIRA, A. B. M. et al. Characterization of the presence and distribution of Foxp3(+) cells in chagasic patients with and without megacolon. Human immunology, v. 70, n. 1, p. 65-67, 2009. DA SILVEIRA, A. B. M. et al. Comparative study of the presence of Trypanosoma cruzi kDNA, inflammation and denervation in chagasic patients with and without megaesophagus. Parasitology, v. 131, p. 627-634, 2005. DE OLIVEIRA, A. P. et al. The role of CCR5 in Chagas disease - a systematic review. Infection, Genetics and Evolution, v. 45, p. 132-137, 2016.

54
DE SOUZA, W.; DE CARVALHO, T. M. U.; BARRIAS, E. S. Review on Trypanosoma cruzi: Host cell interaction. International Journal of Cell Biology, v. 2010, p. 1-19, 2010. DESHMANE, S. L. et al. Monocyte Chemoattractant Protein-1 (MCP-1): An Overview. Journal of Interferon & Cytokine Research, v. 29, n. 6, p. 313-326, 2009. DIAS, J. C. P. Acute Chagas’ disease. Memórias do Instituto Oswaldo Cruz, v. 79, p. 85-91, 1984. DIAS, J. C. P. Etiopatogenia e história natural da doença de Chagas humana. Revista de Patologia Tropical, v. 14, n. 1, p. 17-29, 1985. DIAS, J. C. P. et al. II Consenso brasileiro em doença de Chagas, 2015. Epidemiologia e Serviços de Saúde, v. 25, p. 7-86, 2016. DUHEN, T. et al. Production of interleukin 22 but not interleukin 17 by a subset of human skin-homing memory T cells. Nature Immunology, v. 10, n. 8, p. 857-863, 2009. FEUSER, K. et al. Human intestinal mast cells are a potent source of multiple chemokines. Cytokine, v. 58, n. 2, p. 178-185, 2012. FLÓREZ, O.; MARTÍN, J.; GONZÁLEZ, C. I. Genetic variants in the chemokines and chemokine receptors in Chagas disease. Human immunology, v. 73, n. 8, p. 852-858, 2012 FRADE, A. F. et al. Genetic susceptibility to Chagas disease cardiomyopathy: involvement of several genes of the innate immunity and chemokine-dependent migration pathways. BMC Infectious Diseases, v. 13, 2013. GAO, J. L. et al. Impaired host defense, hematopoiesis, granulomatous inflammation and type 1-type 2 cytokine balance in mice lacking CC chemokine receptor 1. Journal of Experimental Medicine, v. 185, n. 11, p. 1959-1968, 1997. GOMES, J. A. S. et al. Evidence that development of severe cardiomyopathy in human Chagas’ disease is due to a Th1-specific immune response. Infection and Immunity, v. 71, n. 3, p. 1185-1193, 2003.

55
GOMES, J. A. S. et al. Type 1 chemokine receptor expression in Chagas’ disease correlates with morbidity in cardiac patients. Infection and Immunity, v. 73, n. 12, p. 7960-7966, 2005. GROOM, J. R., LUSTER, A. D. CXCR3 ligands: redundant, collaborative and antagonist functions. Immnunology & Cell Biology, v. 89, n. 2, p. 207-215, 2011. GU, L. et al. Control of TH2 polarization by the chemokine monocyte chemoattractant protein-1. Nature, v. 404, n. 6776, p. 407-411, 2000. GUEDES, P. M. M. Deficient regulatory T cell activity and low frequency of IL-17-producing T cells correlate with the extent of cardiomyopathy in human Chagas’ disease. PLoS Neglected Tropical Diseases, v. 6, n. 4, p. e1630, 2012. GUEDES, P. M. M. et al. IL-17 produced during Trypanosoma cruzi infection plays a central role in regulating parasite-induced myocarditis. PLoS Neglected Tropical Diseases, v. 4, n. 2, p. e604, 2010a. GUEDES, P. M. M. et al. Increased type 1 chemokine expression in experimental Chagas disease correlates with cardiac pathology in beagle dogs. Veterinary Immunology and Immunopathology, v. 138, p. 106-113, 2010b. GUEDES, P. M. M. et al. Inflammation enhances the risks of stroke and death in chronic Chagas disease patients. PLoS Neglected Tropical Diseases, v. 10, n. 4, p. 1-18, 2016. GUTIERREZ, F. R. S. et al. The effects of nitric oxide on the immune system during Trypanosoma cruzi infection. Memórias do Instituto Oswaldo Cruz, v. 104, p. 236-245, 2009. HAMPL, V. et al. Phylogenomic analyses support the monophyly of Excavata and resolve relationships among eukaryotic "supergroups". Proceedings of the National Academy of Sciences of the United States of America, v. 106, p. 3859-3864, 2009. HANAMOTO, H. et al. Expression of CCL28 by Reed-Sternberg cells defines a major subtype of classical Hodgkin’s disease with frequent infiltration of eosinophils and/or plasma cells. American Journal of Pathology, v. 164, n. 3, p. 997-1006, 2004.

56
HARDISON, J. L. et al. The CC chemokine receptor 5 is important in control of parasite replication and acute cardiac inflammation following infection with Trypanosoma cruzi. Infection and Immunity, v. 74, n. 1, p. 135-143, 2006a. HARDISON, J. L. et al. The chemokines CXCL9 and CXCL10 promote a protective immune response but do not contribute to cardiac inflammation following infection with Trypanosoma cruzi. Infection and Immunity, v. 74, n. 1, p. 125-134, 2006b. HIGUCHI, M. D. L. et al. Immunohistochemical characterization of infiltrating cells in human chronic chagasic myocarditis: comparison with myocardial rejection process. Virchows Archiv A Pathological Anatomy, v. 423, p.157-160, 1993. HIGUCHI, M. D. L. et al. Pathophysiology of the heart in Chagas’ disease: current status and new developments. Cardiovascular Research, v. 60, p. 96-107, 2003. HONIGBERG, B.M. A contribution to systematics of the non-pigmented flagellates. In Ludvík, J., Lom, J., Vávra, J. (eds.). Progress in protozoology: proceedings of the first International congress on protozoology held at Prague. Academic Press, 1963. HWANG, H. J. et al. Progranulin Protects Vascular Endothelium against Atherosclerotic Inflammatory Reaction via Akt/eNOS and Nuclear Factor-κB Pathways. PLoS ONE, v. 8, n. 9, p. 1-7, 2013. JABEEN, R. et al. Th9 cell development requires a BATF-regulated transcriptional network. Journal Of Clinical Investigation, v. 123, n. 11, p.4641-4653, 2013. JORDAN, N. J. et al. Expression of functional CXCR4 chemokine receptors on human colonic epithelial cells. Journal Of Clinical Investigation, v. 104, n. 8, p. 1061-1069, 1999. JUAN, M.; PEDROSA, E.; COLOBRAN, R. Chemokines and chemokines receptors. eLS, p. 1-7, 2013. KATO, A. et al. Dexamethasone and FK506 inhibit expression of distinct subsets of chemokines in human mast cells. Journal of immunology, v. 182, n. 11, p. 7233-7243, 2009. KAYAMA, H.; TAKEDA, K. The innate immune response to Trypanosoma cruzi infection. Microbes and Infection, v. 12, n. 7, p. 511-517, 2010.

57
KENT, W.S. A manual of the infusoria, including a description of all known flagellate, ciliate, and tentaculiferous protozoa, British and foreign and an account of the organization and affinities of the sponges. London, D. Bogue, v. 1, p. 218-220, 1880. KOGA, R. et al. TLR-dependent induction of IFN-beta mediates host defense against Trypanosoma cruzi. Journal of Immunology, v. 177, n. 10, p. 7059-7066, 2006. KUMAR, S.; TARLETON, R. L. Antigen-Specific Th1 But Not Th2 Cells Provide Protection from Lethal Trypanosoma cruzi Infection in Mice. Journal of Immunology, v. 166, n. 7, p. 4596–4603, Abr 2001. LAGES-SILVA, E. et al. Relationship between Trypanosoma cruzi and Human Chagasic megaesophagus: Blood and tissue parasitism. American Journal of Tropical Medicine and Hygiene, v. 65, p. 435-44, 2001. LANNES-VIEIRA, J. et al. Chronic Trypanosoma cruzi-elicited cardiomyopathy: From the discovery to the proposal of rational therapeutic interventions targeting cell adhesion molecules and chemokine receptors - how to make a dream come true. Memórias do Instituto Oswaldo Cruz, v. 104, n. SUPPL. 1, p. 226-235, 2009. LE, Y. et al. Chemokines and chemokine receptors: their manifold roles in homeostasis and disease. Cellular and Molecular Immunology, v. 1, n. 2, p. 95-104, 2004. LEY, K. et al. Getting to the site of inflammation : the leukocyte adhesion cascade updated. Nature Reviews Immunology, v. 7, n. 9, p. 678-689, 2007. LUTHER, S. A; CYSTER, J. G. Chemokines as regulators of T cell differentiation. Nature Immunology, v. 2, n. 2, p. 102-107, 2001. MACHADO, F. S. et al. CCR5 plays a critical role in the development of myocarditis and host protection in mice infected with Trypanosoma cruzi. Journal of Infectious Diseases, v. 191, n. 4, p. 627-636, 2005. MACHADO, F. S. et al. Current understanding of immunity to Trypanosoma cruzi infection and pathogenesis of Chagas disease. Seminars in Immunopathology, v. 34, n. 6, p. 753-770, 2012a. MACHADO, F. S. et al. Pathogenesis of Chagas disease: time to move on. Frontiers on Bioscience, v. 4, p. 1743-1758, 2012b.

58
MANGAN, P. R. et al. Transforming growth factor-beta induces development of the T(H)17 lineage. Nature, v. 441, n. 7090, p. 231-234, 2006. MARIANO, F. S. et al. The involvement of CD4+CD25+ T cells in the acute phase of Trypanosoma cruzi infection. Microbes and Infection, v. 10, n. 7, p. 825-833, 2008. MARIN-NETO, J. A. et al. Pathogenesis of chronic Chagas heart disease. Circulation, v. 115, n. 9, p. 1109-1123, 2007. MARINO, A. et al. CC-chemokine receptors: a potential therapeutic target for Trypanosoma cruzi-elicited myocarditis. Memórias do Instituto Oswaldo Cruz, v. 100, p. 93-96, 2005. MARINHO, C. R. F. et al. Challenge of Trypanosoma cruzi chronically infected mice with trypomastigotes activates the immune system and reduces subpatent parasitemia levels. Journal of Parasitology, v. 90, n. 3, p. 516-523, 2004. MARTIN, D; TARLETON, R. Generation, specificity, and function of CD8+ T cells in Trypanosoma cruzi infection. Immunological Reviews, v. 201, p. 304-317, 2004. MARTINS-MELO, F. R. et al. Epidemiology of mortality related to Chagas’ disease in Brazil, 1999-2007. PLoS Neglected Tropical Diseases, v. 6, n. 2, p. e1508, 2012. MARTINS-MELO, F. R. et al. Prevalence of Chagas disease in Brazil: A systematic review and meta-analysis. Acta Tropica, v. 130, n. 1, p. 167-174, 2014. MASI, L. N. et al. Regulation of Gene Expression by Exercise-Related Micrornas. Cellular Physiology and Biochemistry, v. 39, n. 6, p. 2381-2397, 2016. MATSUDA, A. et al. Th1/Th2 cytokines reciprocally regulate in vitro pulmonary angiogenesis via CXC chemokine synthesis. American Journal of Respiratory Cell and Molecular Biology, v. 38, n. 2, p. 168-175, 2008. MENEGHELLI, U. G. Chagasic enteropathy. Revista da Sociedade Brasileira de Medicina Tropical, v. 37, n. 3, p. 252-260, 2004.

59
MICHAILOWSKY, V. et al. Pivotal role of interleukin-12 and interferon-gamma axis in controlling tissue parasitism and inflammation in the heart and central nervous system during Trypanosoma cruzi infection. American Journal of Pathology, v. 159, n. 5, p. 1723-1733, 2001. MOLON, B.; VIOLA, A.; BRONTE, V. Smoothing T cell roads to the tumor: Chemokine post-translational regulation. OncoImmunology, v. 1, n. 3, p. 390-392, 2012. MOREIRA, D.; LÓPEZ-GARCÍA, P.; VICKERMAN, K. An updated view of kinetoplastid phylogeny using environmental sequences and a closer outgroup: proposal for a new classification of the class Kinetoplastea. International Journal of Systematic and Evolutionary Microbiology, v. 54, p. 1861-1875, 2004. MOSER, B.; WILLIMANN, K. Chemokines: role in inflammation and immune surveillance. Annals of the Rheumatic Diseases, v. 63, p. 84-89, 2004. MOSMANN, T.R.; COFFMAN, R.L. TH1 and TH2 Cells: Different patterns of lymphokine secretion lead to different functional properties. Annual Review of Immunology, v. 7, p. 145-173, 1989. MURDOCH, C.; FINN, A. Chemokine receptors and their role in inflammation and infectious diseases. Blood, v. 95, n. 10, p. 3032-3043, 2000. NAKAYAMA, T. et al. Cutting edge: profile of chemokine receptor expression on human plasma cells accounts for their efficient recruitment to target tissues. Journal of Immunology, v. 170, n. 3, p. 1136-1140, 2003. NOGUEIRA, L. G. et al. Myocardial chemokine expression and intensity of myocarditis in Chagas cardiomyopathy are controlled by polymorphisms in CXCL9 and CXCL10. PLoS Neglected Tropical Diseases, v. 6, n. 10, p. e1867, 2012. NUNES, D. F. et al. Troponin T autoantibodies correlate with chronic cardiomyopathy in human Chagas disease. Tropical Medicine and International Health, v. 18, n. 10, p. 1180-1192, 2013. PANGANIBAN, R. P. et al. Coordinated post-transcriptional regulation of the chemokine system: messages from CCL2. Journal of Interferon & Cytokine Research, v. 34, n. 4, p. 255-266, 2014.

60
PAIVA, C. N. et al. CCL2/MCP-1 controls parasite burden, cell infiltration, and mononuclear activation during acute Trypanosoma cruzi infection. Journal of Leukocyte Biology, v. 86, n. 5, p. 1239-1246, 2009. PRATA, A. Clinical and epidemiological aspects of Chagas disease. Lancet Infectious Diseases, v. 1, n. 2, p. 92-100, 2001. PINKERTON, M. et al. Differential expression of microRNAs in exhaled breath condensates of patients with asthma, patients with chronic obstructive pulmonary disease, and healthy adults. Journal of Allergy and Clinical Immunology, v. 132, n. 1, p. 217-219.e2, 2013. QIN, S. Y. et al. Role and recruitment of Th9 cells in liver cirrhosis patients. Asian Pacific Journal of Tropical Biomedicine, v. 6, n. 4, p. 330-334, 2016. RAMAN, D.; SOBOLIK-DELMAIRE, T.; RICHMOND, A. Chemokines in health and disease. Experimental Cell Research, v. 317, n. 5, p. 575-589, 2011. RASSI JÚNIOR, A.; RASSI, A.; MARIN-NETO, J. A. Chagas disease. Lancet, v. 375, n. 9723, p. 1388-1402, 2010. RASSI JÚNIOR, A.; RASSI, A.; REZENDE, J. M. American trypanosomiasis (Chagas disease). Infectious Disease Clinics of North America, v. 26, n. 2, p. 275-291, 2012. REBÊLO, J. M. M.; BARROS, V. L. L. DE; MENDES, W. A. Espécies de Triatominae (Hemiptera: Reduviidae) do Estado do Maranhão, Brasil. Cadernos de Saúde Pública, v. 14, n. 1, p. 187-192, 1998. RIBEIRÃO, M. et al. Chagasic patients develop a type 1 immune response to Trypanosoma cruzi trans-sialidase. Parasite Immunology, v. 22, n. 1, p. 49-53, 2000. ROT, A.; VON ANDRIAN, U. H. Chemokines in innate and adaptative host defense: Basic chemokinese grammar for immune cells. Annual Review of Immnunology, v. 22, p. 891-928, 2004. SAHINGUR, S. E.; YEUDALL, W. A. Chemokine function in periodontal disease and oral cavity cancer. Frontiers in Immunology, v. 6, p. 1-15, 2015.

61
SAKAGUCHI, S. Naturally arising Foxp3-expressing CD25+CD4+ regulatory T cells in immunological tolerance to self and non-self. Nature Immunology, v. 6, n. 4, p. 345-352, 2005. SAKAGUCHI, S. Regulatory T cells: key controllers of immunologic self-tolerance. Cell, v. 101, n. 5, p. 455-458, 2000. SEAY, K. et al. Mice transgenic for CD4-specific human CD4, CCR5 and cyclin T1 expression: A new model for investigating HIV-1 transmission and treatment eficacy. PLoS ONE, v. 8, n. 5, 2013. SEBASTIANI, S. et al. Chemokine Receptor Expression and Function in CD4+ T Lymphocytes with Regulatory Activity. The Journal of Immunology, v. 166, n. 2, p. 996-1002, 2001. SESAP – SECRETARIA DE ESTADO DA SAÚDE. Atenção à Saúde com foco na Vigilância Epidemiológica. Relatório de Situação. Rio Grande do Norte 2013. Natal, [2014?]. Disponível em: <http://adcon.rn.gov.br/ACERVO/sesap/DOC/DOC000000000112581.PDF> Acesso em: 4 de fevereiro de 2017 SILVA, J. S. et al. Tumor necrosis factor alpha mediates resistance to Trypanosoma cruzi infection in mice by inducing nitric oxide production in infected gamma interferon-activated macrophages. Infection and Immunity, v. 63, n. 12, p. 4862-4867, 1995. SIMPSON, A.G.B. Cytoskeletal organization, phylogenetic affinities and systematics in the contentious taxon Excavata (Eukaryota). International Journal of Systematic and Evolutionary Microbiology, v.53, p. 1759-1777, 2003. SIMPSON, A.G.B. The identity and composition of Euglenozoa. Archiv für Protistenkunde, v. 148, p. 318-328, 1997. SOUZA, S. M. et al. Dogs infected with the blood trypomastigote form of Trypanosoma cruzi display an increase expression of cytokines and chemokines plus an intense cardiac parasitism during acute infection. Molecular Immunology, v. 58, n. 1, p. 92-97, 2014. SPERVESLAGE, J. et al. Lack of CCR7 expression is rate limiting for lymphatic spread of pancreatic ductal adenocarcinoma. International Journal of Cancer, v. 131, n. 4, p. 371-381, 2012.

62
SUN, J.; TARLETON, R. L. Predominance of CD8+ T Lymphocytes in the inflammatory lesions of mice with acute Trypanosoma cruzi infection. American Journal of Tropical Medicine and Hygiene, v. 48, n. 2, p. 161-169, 1993. TALVANI, A. et al. Chemokine receptor expression on the surface of peripheral blood mononuclear cells in Chagas disease. Journal Infectious Diseases, v. 189, n. 2, p. 214-220, 2004a. TALVANI, A. et al. Elevated concentrations of CCL2 and tumor necrosis factor-alfa a in chagasic cardiomyopathy. Clinical Infectious Diseases, v. 38, p. 943-950, 2004b. TAFURI, W. L. Immunopathology of Chagas disease - A historical overview. Memórias do Instituto Oswaldo Cruz, v. 94, p. 247-248, 1999. TARLETON, R. L. Immune system recognition of Trypanosoma cruzi. Current Opinion in Immunology, v. 19, n. 4, p. 430-434, 2007. TARTAROTTI, E.; AZEREDO-OLIVEIRA, M. T. V; CERON, C. R. Phylogenetic approach to the study of Triatomines (Triatominae, Heteroptera). Brazilian Journal of Biology, v. 66, n. 2B, p. 703-708, 2006. TEIXEIRA, A. R. L. et al. Pathogenesis of chagas’ disease: Parasite persistence and autoimmunity. Clinical Microbiology Reviews, v. 24, n. 3, p. 592-630, 2011. TEIXEIRA, M. M.; GAZZINELLI, R. T.; SILVA, S. Chemokines, inflammation and Trypanosoma cruzi infection. Trends in Parasitology, v. 18, n. 6, p. 262-265, 2002. TRAYNOR, T. R. et al. CCR2 expression determines T1 versus T2 polarization during pulmonary Cryptococcus neoformans infection. Journal of immunology, v. 164, n. 4, p. 2021-2027, 2000. TRIFARI, S. et al. Identification of a human helper T cell population that has abundant production of interleukin 22 and is distinct from Th-17, Th1 and Th2 cells. Nature Immunology, v. 10, n. 8, p. 864-871, 2009. TYLER, K. M.; ENGMAN, D. M. The life cycle of Trypanosoma cruzi revisited. International Journal for Parasitology, v. 31, p. 472-481, 2001.

63
VAGO, A. R. et al. PCR detection of Trypanosoma cruzi DNA in esophageal tissues of patients with chronic digestive Chagas' disease. Lancet, v. 348, n. 9031, p. 891-892, 1996 VELDHOEN, M. et al. Transforming growth factor-beta “reprograms” the differentiation of T helper 2 cells and promotes an interleukin 9-producing subset. Nature Immunology, v. 9, n. 12, p. 1341-1346, 2008. VILLALTA, F. et al. The cysteine-cysteine family of chemokines RANTES , MIP-1α, and MIP-1β induce trypanocidal activity in human macrophages via nitric oxide. Infection and Immunity, v. 66, n. 10, p. 4690-4695, 1998. WHO – WORLD HEALTH ORGANIZATION. Chagas disease (American trypanosomiasis). Fact sheet. 2016. Disponível em: <http://www.who.int/mediacentre/factsheets/fs340/en/> Acesso em: 1 de novembro de 2016 WHO – WORLD HEALTH ORGANIZATION. Chagas disease in Latin America: an epidemiological update based on 2010 estimates. Weekly Epidemiological Record, n. 6, p. 33-44, 2015 WHO – WORLD HEALTH ORGANIZATION. Second report of the WHO Expert Committee: Control of Chagas Disease. Geneva, 2002 WILLOX, I. et al. Evidence for PI3K-dependent CXCR3 agonist-induced degranulation of human cord blood-derived mast cells. Molecular Immunology, v. 47, n. 14, p. 2367-2377, 2010. XIAO, C. et al. Differentiation and recruitment of IL-22-producing helper T cells in lgA nephropathy. American Journal of Translational Research, v. 8, n. 9, p. 3872-3882, 2016. YSSEL, H.; BENSUSSAN, A. Existe-t-il dans la peau une nouvelle population lymphocytaire Th22 distincte des lymphocytes Th17? Medecine/Sciences, v. 26, n. 1, p. 12-14, 2010. ZHANG, Q. et al. CCL5-mediated Th2 immune polarization promotes metastasis in luminal breast cancer. Cancer Research, v. 75, n. 20, p. 4312-4321, 2015.

64
ANEXO A – Protocolo de aprovação pelo Comitê de Ética e Pesquisa da
Universidade Estadual do Rio Grande do Norte.