MÉTODOS DE FUNÇÃO DE GREEN NA ANÁLISE DE GRAFOS QUÂNTICOS E CAMINHADAS QUÂNTICAS
2 LIGAÇÕES ATÔMICAS - WordPress.comA Figura 2.1 ilustra a estrutura atômica do elemento sódio...
Transcript of 2 LIGAÇÕES ATÔMICAS - WordPress.comA Figura 2.1 ilustra a estrutura atômica do elemento sódio...

Estrutura e Propriedades dos Materiais Ligações Atômicas
UFPA – ITEC – FEM Prof. Jorge Teófilo de Barros Lopes 8
2 LIGAÇÕES ATÔMICAS 2.1 A Estrutura do Átomo (Revisão)
Um átomo é composto de um núcleo circundado por elétrons. O núcleo é formado
por nêutrons e prótons. Como os prótons são carregados positivamente e os nêutrons são
eletricamente neutros, então a carga líquida do núcleo é positiva.
Os elétrons são carregados negativamente e são ligados ao núcleo por uma atração
eletrostática.
A carga elétrica dos prótons e dos elétrons, q, é igual a 1,60x10-19 C (coulomb).
Como o número de elétrons e o número de prótons são iguais, o átomo é eletricamente
neutro.
O número atômico de um elemento (Z) é igual ao número de elétrons ou de prótons
em cada átomo. O átomo de ferro, por exemplo, contém 26 elétrons e 26 prótons, o seu
número atômico, portanto, é igual a 26 (Z = 26).
A maior parte da massa do átomo está contida em seu núcleo, pois a massa de cada
próton e de cada nêutron é igual a 1,67x10-24 g, mas a massa de cada elétron é somente
9,11x10-28 g.
A massa atômica de um material (M ou A) é a massa em gramas da Constante de
Avogadro (NA) de átomos. A quantidade NA = 6,02x1023 átomos/mol é o número de átomos
ou moléculas em um mol; portanto, a unidade de massa atômica é g/mol.
Uma unidade alternativa para a massa atômica é a unidade de massa atômica (u.m.a),
a qual vale 1/12 da massa do carbono 12 (carbono com 12 prótons). Um mol de ferro (Fe),
por exemplo, contém 6,02x1023 átomos e tem uma massa de 55,847 g ou 55,847 u.m.a.
2.2 A Estrutura Eletrônica do Átomo (Revisão)
Os elétrons ocupam níveis de energia discretos dentro do átomo. Cada elétron possui
uma energia particular, sendo que não mais que dois elétrons em cada átomo têm a mesma
energia. Isto também implica que há uma diferença discreta de energia entre dois níveis
energéticos.

Estrutura e Propriedades dos Materiais Ligações Atômicas
UFPA – ITEC – FEM Prof. Jorge Teófilo de Barros Lopes 9
2.2.1 Números quânticos
O nível de energia ocupado por cada elétron é determinado por quatro números
quânticos, assim denominados e representados: número quântico principal (n), número
quântico azimutal (l), número quântico magnético (ml) e número quântico de spins (ms).
O número de níveis de energia possível é determinado pelos três primeiros números
quânticos.
O número quântico principal (n) é designado pelos valores 1, 2, 3, 4, 5, 6 e 7, que
correspondem às camadas quânticas nas quais os elétrons estão posicionados. As camadas
quânticas são também designadas por letras: K (n = 1), L (n = 2), M (n = 3), N (n = 4), O
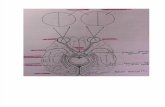
(n = 5), P (n = 6) e Q (n = 7). A Figura 2.1 ilustra a estrutura atômica do elemento sódio (Z
= 11), mostrando os elétrons nas camadas quânticas K, L e M.
Figura 2.1 – Estrutura atômica do sódio (Na).
Cada elétron na camada quântica é caracterizado por quatro números quânticos. O
número de níveis de energia em cada camada quântica é determinado pelo número
quântico azimutal (l) e pelo número quântico magnético (ml).
Os números quânticos azimutais são designados por l = 0, 1, 2, ..., n – 1. Se n = 2,
por exemplo, há dois números quânticos azimutais, l = 0 e l = 1. Os números quânticos
azimutais também são designados por letras minúsculas1: s (l = 0), p (l = 1), d (l = 2) e f (l
= 3).
1 As letras s, p, d e f são as iniciais das palavras inglesas sharp, principal, diffuse e fundamental, respectivamente.

Estrutura e Propriedades dos Materiais Ligações Atômicas
UFPA – ITEC – FEM Prof. Jorge Teófilo de Barros Lopes 10
O número quântico magnético (ms) fornece o número de níveis de energia, ou
orbitais, para cada número quântico azimutal. O total de números quânticos magnéticos
para cada l é dado por 2l + 1, e corresponde a todos os valores inteiros entre –l e +l. Para l
= 2, por exemplo, há 5 números quânticos magnéticos (-2, -1, 0, +1, +2).
2.2.2 Princípio da Exclusão de Pauli
O princípio da exclusão de Pauli especifica que em um orbital encontra-se não mais
que dois elétrons e eles possuem spins eletrônicos opostos. O conjunto dos números
quânticos para os 11 elétrons do sódio (Na) é mostrado na Figura 2.2.
Figura 2.2 – Conjunto dos números quânticos para o sódio (Z = 11).
A notação freqüentemente usada para descrever a estrutura eletrônica de um átomo
combina o número quântico principal, a letra minúscula do número quântico azimutal e o
valor sobrescrito mostrando o número de elétrons em cada orbital (subníveis de energia). A
configuração eletrônica do germânio (Z = 32), por exemplo, é dada por:
1s22s22p63s23p63d104s24p2
A Tabela 2.1 mostra o padrão usado para determinar a quantidade de elétrons nos
níveis de energia, e a Tabela 2.2 resume a distribuição dos números quânticos.
2 1

Estrutura e Propriedades dos Materiais Ligações Atômicas
UFPA – ITEC – FEM Prof. Jorge Teófilo de Barros Lopes 11
Tabela 2.1 – Padrão usado para determinar a quantidade de elétrons nos níveis de energia
Camadas Quânticas
n l = 0 (s)
l = 1 (p)
l = 2 (d)
l = 3 (f)
Máximo de elétrons
K
L
M
N
O
P
Q
1
2
3
4
5
6
7
2
2
2
2
2
2
2
6
6
6
6
6
6
10
10
10
10
14
14
2
8
18
32
32
18
2
Nota: Os valores 2, 6, 10 e 14 referem-se ao nº de elétrons no nível de energia.
Tabela 2.2 – Resumo da distribuição dos números quânticos.
Camada Nº quântico
principal Nº quântico
azimutal Subníveis de energia
Nº de orbitais
máximo de elétrons
K n = 1 l = 0 1s 1 2 L n = 2 l = 0
l = 1 2s 2p
4 8
M n = 3 l = 0 l = 1 l = 2
3s 3p 3d
9 18
N n = 4 l = 0 l = 1 l = 2 l = 3
4s 4p 4d 4f
16 32
O n = 5 l = 0 l = 1 l = 2 l = 3
5s 5p 5d 5f
16 32
P n = 6 l = 0 l = 1 l = 2
6s 6p 6d
9 18
Q n = 7 l = 0 7s 1 2
Desvios na estrutura eletrônica
O ordenamento na formação da estrutura eletrônica nem sempre é seguido,
particularmente quando o número atômico do elemento é grande e os níveis d e f começam
a ser preenchidos, como no caso dos elementos de transição. O Fe (Z = 26), por exemplo,
mostra um desvio entre a estrutura eletrônica esperada e a observada, como segue:

Estrutura e Propriedades dos Materiais Ligações Atômicas
UFPA – ITEC – FEM Prof. Jorge Teófilo de Barros Lopes 12
Esperada → 1s22s22p63s23p6 3d8
Observada → 1s22s22p63s23p6 3d64s
2
O não preenchimento do nível 3d causa o comportamento magnético do ferro.
2.2.3 Valência
A valência de um átomo é o número de elétrons que participa na ligação ou reações
químicas; habitualmente, a valência de um átomo é o número de elétrons nos níveis de
energia s e p mais externos. Alguns exemplos são mostrados a seguir:
Mg → 1s22s22p6 3s2 valência = 2
Al → 1s22s22p6 3s23p
1 valência = 3
Ge → 1s22s22p63s23p63d10 4s24p
2 valência = 4
A valência também depende do meio em torno do átomo ou dos átomos vizinhos
disponíveis para a ligação. O fósforo (P), por exemplo, tem valência 3 (possui 3 elétrons no
nível p), mas quando se combina com o oxigênio (O) passa a ter valência 5. O manganês
(Mn), por outro lado, pode ter valência 2, 3, 4, 6 ou 7, dependendo do elemento a que vai
se ligar.
Se um átomo de um elemento tem valência zero, o elemento é inerte (não-reativo). O
argônio (Ar), por exemplo, apresenta estrutura eletrônica 1s22s22p63s23p
6; portanto possui
valência igual a 0.
2.2.4 Regra do Octeto
Um átomo adquirirá estabilidade química quando possuir oito elétrons na camada
periférica ou, se constituído somente pela camada K, esta possuir dois elétrons; ou seja,
quando apresentar configuração eletrônica semelhante a dos gases nobres, conforme
mostrado na Tabela 2.3.

Estrutura e Propriedades dos Materiais Ligações Atômicas
UFPA – ITEC – FEM Prof. Jorge Teófilo de Barros Lopes 13
Tabela 2.3 – Configuração eletrônica dos gases nobres. Gases
Nobres Camadas quânticas
K L M N O P
Hélio 2
Neônio 2 8
Argônio 2 8 8
Kriptônio 2 8 18 8
Xenônio 2 8 18 18 8
Radônio 2 8 18 32 18 8
O átomo de sódio (Na), por exemplo, possui número atômico 11 (Z = 11) e sua
configuração eletrônica é (2, 8, 1); para adquirir estabilidade ele perde um elétron, ou seja,
passa a ter a configuração eletrônica do átomo de neônio (2, 8).
Átomos não estáveis adquirem estabilidade completando, com oito elétrons, os seus
níveis s e p mais externos, ou esvaziando-os totalmente. O alumínio (Al) tem três elétrons
em seus níveis s e p mais externos; ele facilmente cede esses elétrons para esvaziar os
níveis 3s e 3p e ficar estável (a ligação atômica e o comportamento do Al são determinados
pelo mecanismo por meio do qual esses três elétrons interagem com os átomos vizinhos).
O cloro (Cl), como possui número atômico 35 (Z = 35), contém sete elétrons em seus
níveis mais externos 3s e 3p (2, 8, 18, 7); sua reatividade é causada pela capacidade que
tem de completar o nível de energia mais externo aceitando um elétron e ficando com a
configuração eletrônica do kriptônio (2, 8, 18, 8).
Existem compostos onde os átomos tornam-se estáveis com 4, 6, 12, 18 ou outro
valor de elétrons na camada periférica, constituindo-se exceções à Regra do Octeto.
- Exemplos:
Zn++, Ag+, Cu+ → estáveis com 18 elétrons na camada externa;
Fe++ → estável com 14 elétrons na camada externa;
Fe+++ → estável com 13 elétrons na camada externa.
2.2.5 Eletronegatividade
A eletronegatividade descreve a tendência de um átomo ganhar elétrons. Átomos
com seus níveis mais externos quase completos, tal como o cloro (Cl), são fortemente
eletronegativos e, portanto, facilmente aceitam elétrons. Átomos com seus níveis mais

Estrutura e Propriedades dos Materiais Ligações Atômicas
UFPA – ITEC – FEM Prof. Jorge Teófilo de Barros Lopes 14
externos quase vazios, tal como o sódio (Na), facilmente cedem elétrons e apresentam
baixa eletronegatividade.
Elementos que possuem números atômicos elevados, também apresentam baixa
eletronegatividade, devido os seus elétrons mais externos estarem a uma distância muito
maior do núcleo (positivo), não sendo, desta forma, fortemente atraídos para o átomo.
A Tabela 2.4 lista a eletronegatividade de vários elementos.
Tabela 2.4 - Eletronegatividade de alguns elementos relativa ao número de elétrons nos níveis s e p mais externos. Átomo Distribuição eletrônica Eletronegatividade
F 1s22s22p
5 4,0
Cl 1s22s22p63s23p
5 3,0
Br 1s22s22p63s23p63d104s24p
5 2,8
I 1s22s22p63s23p63d104s24p64d104f145s25p
5 2,5
At 1s22s22p63s23p63d104s24p64d104f145s25p65d105f146s26p
5 2,2
Os elementos com baixa eletronegatividade (< 2,0) são algumas vezes definidos
como eletropositivos, que é o caso dos metais, por exemplo.
2.3 Ligações Atômicas
Existem quatro mecanismos mais importantes pelos quais os átomos são ligados para
formar os materiais de engenharia: ligação iônica, ligação covalente, ligação metálica e
forças de Van der Walls.
Nos três primeiros mecanismos a ligação ocorre quando os átomos completam os
níveis de energia s e p mais externos. Esses três tipos de ligações são relativamente fortes e
recebem a denominação de ligações primárias.
As forças de Van der Walls originam-se de diferentes mecanismos e são
relativamente mais fracas, daí serem denominadas de ligações secundárias.

Estrutura e Propriedades dos Materiais Ligações Atômicas
UFPA – ITEC – FEM Prof. Jorge Teófilo de Barros Lopes 15
2.3.1 Ligação iônica
Quando mais de um tipo de átomo está presente em um material, um deles pode
ceder seus elétrons de valência para o outro, preenchendo a camada de energia mais
externa daquele. Ambos os átomos, então, passam a apresentar os seus níveis de energia
mais externos completos, adquirindo uma carga elétrica e, portanto, comportando-se como
íons.
O átomo que contribui com os elétrons fica com carga elétrica líquida positiva e é
chamado de cátion; enquanto o átomo que recebe os elétrons passará a possuir carga
elétrica líquida negativa e será chamado de ânion.
Os íons com cargas opostas se atraem mutuamente e produzem uma ligação iônica.
Por exemplo, a atração entre os íons sódio (Na+) e cloro (Cl–) produzem o cloreto de sódio
(NaCl). Esse processo está ilustrado na Figura 2.3.
Figura 2.3 – Esquema ilustrativo da ligação iônica entre o cloro e o sódio.
Nas ligações iônicas a atração eletrostática age em todas as direções, daí serem
chamadas de ligações não direcionais, tendo-se assim, forças de coesão que geram
arranjos tridimensionais.
átomo Na átomo Cl íon Na+ íon Cl–
Na+ Cl–
Na+ Na+
Na+
Cl–
Cl– Cl–
Cl–

Estrutura e Propriedades dos Materiais Ligações Atômicas
UFPA – ITEC – FEM Prof. Jorge Teófilo de Barros Lopes 16
2.3.2 Ligação covalente
São ligações formadas pelo compartilhamento dos elétrons de valência entre dois ou
mais átomos, de tal forma que cada átomo complete a sua camada sp mais externa. Por
exemplo, o átomo de silício (Si), que tem valência quatro, obtém oito elétrons em sua
camada de energia mais externa pelo compartilhamento de seus elétrons com outros quatro
átomos de silício vizinhos. Esse tipo de ligação atômica está ilustrado esquematicamente
na Figura 2.4.
Figura 2.4 – Esquema ilustrativo da ligação covalente entre átomos de silício (adaptada de ASKELAND & PHULÉ, 2008).
Esse tipo de ligação primária é muito forte e, como resultado, os materiais ligados
covalentemente são muito duros, como também exibem elevado ponto de fusão. O
diamante, por exemplo, é constituído de átomos de carbono ligados somente por ligações
covalentes, consequentemente, esse material apresenta alta dureza e elevado ponto de
fusão (> 3300oC).
A ligação covalente apresenta caráter direcional, ou seja, cada ligação só ocorre com
um único átomo; no silício (Si), por exemplo, cada átomo é ligado a quatro átomos
Ligação covalente
Si Si
Si
Si
Si Si
Átomo de Silício

Estrutura e Propriedades dos Materiais Ligações Atômicas
UFPA – ITEC – FEM Prof. Jorge Teófilo de Barros Lopes 17
vizinhos por quatro ligações covalentes. Por causa desse caráter direcional, os materiais
ligados covalentemente possuem ductilidade limitada.
Muitos materiais formados por ligações covalentes possuem péssima condutibilidade
elétrica (silício, diamante e muitos materiais cerâmicos), pois os elétrons de valência são
utilizados nas ligações entre os átomos e, portanto, não estão disponíveis para conduzirem
eletricidade.
Em alguns desses materiais (no Si, por exemplo), a introdução deliberada de
pequenas quantidades de outros elementos, denominados dopantes, permite a obtenção de
níveis controlados de condutividade elétrica, formando os materiais semicondutores.
As ligações covalentes podem ser simples, duplas ou triplas; quanto maior o número
de elétrons compartilhados, menores distâncias interatômicas e energias de ligação mais
elevadas são produzidas, conforme pode ser verificado na Tabela 2.5.
Tabela 2.5 – Alguns valores de comprimento de ligação e de energia de ligação (VAN VLACK, 1982)
Ligações Comprimento de ligação aprox.* (Å)
Energia de ligação Aprox.* (kcal/mol)
C – C
C = C
C ≡ C
C – O
C = O
1,5
1,3
1,2
1,5
1,2
83
146
185
86
179
Obs.: * Estes valores apresentam pequenas variações, de acordo com as com as ligações adjacentes; 1Å = 10-8cm; 1nm = 10-9m.
Ligações covalentes dativas
Em alguns casos, apenas um dos átomos envolvidos na ligação contribui com o par
eletrônico na formação da ligação covalente; nesses casos, a ligação covalente recebe o
nome de ligação coordenada ou dativa. Por exemplo, no radical SO4--, o enxofre (S), já
com a sua camada externa completa, se liga com os dois átomos de oxigênio por ligação
covalente; porém, os dois elétrons do par compartilhado são fornecidos somente pelo
enxofre. A Figura 2.5 ilustra esquematicamente esse tipo de ligação.

Estrutura e Propriedades dos Materiais Ligações Atômicas
UFPA – ITEC – FEM Prof. Jorge Teófilo de Barros Lopes 18
Figura 2.5 – Esquema da ligação coordenada ou dativa.
2.3.3 Ligação metálica
São assim denominadas por serem ligações características dos metais.
Os elétrons de valência dos metais estão fracamente ligados ao núcleo (são
eletropositivos); atraídos por núcleos de átomos vizinhos se libertam, compondo uma
“nuvem” que envolve os íons positivos formados, proporcionando, dessa forma, o
aparecimento de forças de atração eletrostática entre os elétrons da “nuvem” e os íons
positivos.
Conforme pode ser observado na Figura 2.6, o átomo de alumínio (Al) cede os seus
três elétrons de valência, tornando-se um íon com carga líquida positiva +3; os elétrons de
valência movem-se livremente pela nuvem de elétrons e começam a se associar com os
outros íons positivos formados; esses íons são mantidos coesos pela atração mútua com os
elétrons da nuvem, produzindo, portanto, fortes ligações metálicas.
Figura 2.6 – Esquema ilustrativo da ligação metálica do alumínio.
O
O– O–
O
S Ligações dativas

Estrutura e Propriedades dos Materiais Ligações Atômicas
UFPA – ITEC – FEM Prof. Jorge Teófilo de Barros Lopes 19
Na ligação metálica os elétrons não se ligam permanentemente a nenhum átomo,
proporcionando grande mobilidade, o que explica a alta condutibilidade térmica e elétrica
dos metais. A grande mobilidade dos elétrons na ligação metálica também explica o fato
dos metais serem bons refletores de radiação visível.
Sob a influência de uma carga elétrica aplicada no metal, os elétrons se movem
causando um fluxo de corrente elétrica, conforme mostrado na Figura 2.7.
Figura 2.7 – Fluxo de corrente elétrica em um metal.
A ligação metálica possui caráter não direcional, daí os metais apresentarem boa
ductilidade.
Como a ligação metálica é forte, geralmente os metais possuem pontos de fusão
relativamente altos.
Vale ressaltar que esse tipo de ligação é apenas um dos fatores que explicam as
propriedades dos materiais metálicos, pois existem outros relacionados à microestrutura
que também têm um papel crucial na determinação das propriedades dos materiais
metálicos.
2.3.4 Forças de Van der Walls
Em um gás nobre (Hélio, Neônio, Argônio, Criptônio, Xenônio e Radônio) a camada
mais externa está completa (dois elétrons para o He e oito para os demais); nestas situações
de estabilidade, nenhum dos tipos de ligação já estudados pode ser efetivo; como
consequência, os átomos desses gases têm pouca atração uns pelos outros, permanecendo
monoatômicos nas temperaturas ordinárias; somente em temperaturas muito baixas,
quando as vibrações térmicas são drasticamente reduzidas, eles se condensam.
Se inexistisse atração atômica entre os átomos dos gases nobres, esses elementos
deveriam passar diretamente do estado gasoso para o sólido quando a energia cinética
fosse nula (Zero Absoluto ≈ –273°C); entretanto, o gás passa ao estado líquido e depois ao

Estrutura e Propriedades dos Materiais Ligações Atômicas
UFPA – ITEC – FEM Prof. Jorge Teófilo de Barros Lopes 20
estado sólido antes do zero absoluto. A Tabela 2.6 fornece as temperaturas de fusão e de
ebulição dos gases nobres.
Tabela 2.6 - Temperaturas de fusão e ebulição dos gases nobres.
Gás Ponto de fusão (°C)
Ponto de ebulição (°C)
He
Ne
Ar
Kr
Xe
Ra
–272,2
–248,7
–189,2
–157,0
–112,0
–71,0
–268,9
–245,9
–185,7
–152,9
–107,1
–61,8 Fonte: VAN VLACK, 1982.
a) Polarização induzida
A maior parte das forças das ligações de van der Walls se originam de dipolos
elétricos. A formação de um dipolo elétrico ocorre quando o centro das cargas positivas
não coincide com o centro das cargas negativas nos átomos ou moléculas, dando origens a
regiões positivas e negativas.
À medida que os átomos vão se aglomerando, os seus elétrons não se apresentarão
distribuídos simetricamente a todo instante. Essa deslocalização de certos elétrons no
átomo causa uma pequena polarização no mesmo. Por outro lado, os elétrons de um átomo
repelem os elétrons de outros átomos e atraem núcleos vizinhos.
Um átomo já desbalanceado eletricamente causa induções elétricas mais sensíveis
nos átomos vizinhos; diz-se, nesse caso, que os átomos sofreram uma polarização
induzida.
As forças que unem os átomos por meio das polarizações induzidas são denominadas
de forças de van der Walls, e são as mais fracas em relação às outras ligações.
Essas ligações são responsáveis pela liquefação e solidificação dos gases nobres e
pelas atrações intermoleculares nos líquidos e sólidos constituídos de moléculas apolares.
Por exemplo, a ligação entre os átomos de cloro para formar a molécula de cloro sólido,
Cl–Cl, é a ligação covalente normal, mas as ligações que mantém as moléculas unidas
entre si são as ligações de forças de van der Walls, conforme ilustrado na Figura 2.8.

Estrutura e Propriedades dos Materiais Ligações Atômicas
UFPA – ITEC – FEM Prof. Jorge Teófilo de Barros Lopes 21
Figura 2.8 – Ligações existentes na estrutura molecular do cloro sólido.
A polarização induzida depende de dois fatores: a quantidade de elétrons da
molécula e a massa molecular. Quanto mais elétrons a molécula possuir, maior será a
intensidade de polarização induzida e mais acentuadas serão as forças de van der Walls.
Quanto maior a massa molecular do material, maior será a energia cinética (maior
temperatura) necessária para que o mesmo passe para o estado gasoso. Esses fatos podem
ser verificados por meio da Tabela 2.7.
Tabela 2.7 - Comparação entre os pontos de ebulição de algumas substâncias com as massas moleculares e número de elétrons por molécula.
Substâncias Massa molecular (g)
Elétrons por molécula Pontos de ebulição (°C)
H2 N2 O2
Cl2 F2
CH4 CF4
CCl4
He Ne Ar
2,016 28,016 32,000 70,910 38,000
16,040 88,010
153,830
4,003 20,18 39,94
2 14 16 34 18
10 42 74
2
10 18
–252,0 –195,0 –183,0 –34,0
–187,0
–161,0 –128,0 +76,0
–268,9 –245,9 –185,7
Fontes: VAN VLACK, 1982; FELTRE & YOSHINAGA, 1979.
b) Polarização permanente
As moléculas que apresentam pontes de hidrogênio possuem uma polarização
permanente. A ponte de hidrogênio é consequência da atração entre os núcleos “expostos”
de hidrogênio de uma molécula pelos elétrons não compartilhados da outra (o pequeno
Cl Cl Cl Cl
Cl Cl Cl Cl
Cl Cl Cl ClLigação covalente
Ligação de Van der Walls

Estrutura e Propriedades dos Materiais Ligações Atômicas
UFPA – ITEC – FEM Prof. Jorge Teófilo de Barros Lopes 22
núcleo do hidrogênio, que é um próton, é atraído por elétrons não compartilhados de uma
molécula próxima).
O metano (CH4) e o silano (SiH4) são moléculas apolares e não apresentam pontes de
hidrogênio.
Cada molécula da água (H2O) apresenta duas pontes de hidrogênio no átomo de
oxigênio; enquanto que na amônia (NH3) e no ácido fluorídrico (HF), tanto o nitrogênio
(N) como o flúor (F) apresentam uma ponte de hidrogênio. A Figura 2.9 mostra exemplos
de pontes de hidrogênio.
Figura 2.9 – Formação de pontes de hidrogênio nas moléculas da água e do ácido fluorídrico.

Estrutura e Propriedades dos Materiais Ligações Atômicas
UFPA – ITEC – FEM Prof. Jorge Teófilo de Barros Lopes 23
Na água, o número de pontes de hidrogênio aliado ao fato do oxigênio ser muito
eletronegativo proporciona o elevado ponto de ebulição dessa substância.
c) Combinação de ligações
Em muitos materiais, as ligações entre os átomos que os formam são de dois ou mais
tipos. No sulfato de cálcio (CaSO4), por exemplo, as ligações entre os átomos do radical
SO4-- são covalentes, mas a ligação entre este e o átomo de cálcio (Ca) é do tipo iônica
(Figura 2.10).
Figura 2.10 – Esquema das ligações existente no sulfato de cálcio.
O cálcio (Ca) cede os seus dois elétrons de valência para completar o grupo SO4-- e,
como resultado, origina-se uma ligação iônica entre os íons Ca++ e SO4--.
2.4 Distância Interatômica e Energia de Ligação
As forças de atração entre os átomos os mantêm próximos entre si, mas existe um
limite para essa proximidade, chamado distância de equilíbrio (ao ou ro) , de tal forma, que
no volume que cerca o núcleo de um átomo há um “espaço” vazio. Esse espaço é causado
por forças de repulsão interatômicas, as quais existem paralelamente às forças de atração.
Portanto, a distância de equilíbrio entre átomos ocorre em função de um balanço
entre forças de atração e de repulsão. Independentemente do tipo de ligação existente entre
dois átomos do agregado atômico em questão (iônica, metálica ou covalente), os pontos de
equilíbrio sempre resultam da interação desses dois tipos de força. A força de atração
resulta da ligação existente e é responsável pela agregação atômica; a força de repulsão é
resultante da proximidade acentuada das nuvens eletrônicas dos átomos.
S O O
O
O
Ca + Ca++ + S O O
O
O –
–

Estrutura e Propriedades dos Materiais Ligações Atômicas
UFPA – ITEC – FEM Prof. Jorge Teófilo de Barros Lopes 24
A distância interatômica é o resultado da interação entre essas forças, dando origem a
uma distância de equilíbrio entre os átomos (ou íons), que é o ponto onde as forças se
igualam.
Em termos de energia, a distância de equilíbrio é conseguida quando a energia
potencial total do par de átomos (ou íons) atinge um mínimo, ou quando nenhuma força
líquida está atuando, tanto para atrair como para repelir átomos.
Na ligação iônica, tais forças podem ser compreendidas e determinadas mais
facilmente, com o auxílio da Figura 2.11.
Figura 2.11 – Forças e energia de ligação em função da distância interatômica.
Atração
Força líquida
F
orça
R
epul
são
A
traç
ão
Umin
U∞
+ –
Distância interatômica (a)
Distância interatômica (a)
Distância de equilíbrio (ao)
Repulsão
E
nerg
ia
r = cátion R = ânion ao = r + R
0

Estrutura e Propriedades dos Materiais Ligações Atômicas
UFPA – ITEC – FEM Prof. Jorge Teófilo de Barros Lopes 25
A força de atração (FA) é dada pela ação de duas cargas pontuais e determinada pela
equação:
onde Z1 e Z2 são os números de elétrons removidos ou adicionados aos átomos na
formação do íon, e é a carga do elétron (1,6 x 10-19 C), εo é a permissividade do espaço
vazio (8,85 x 10-12C2/N.m2) e a é a distância interatômica.
A força de repulsão (FR) é encontrada experimentalmente como sendo inversamente
proporcional à distância de separação entre os íons, conforme a equação:
onde b e n são constantes (para sólidos iônicos n ≈ 9).
A força resultante (FTotal) é dada pela soma das forças de atração e repulsão, como:
A força resultante está associada à tensão necessária para separar dois átomos
(energia de ligação); portanto, materiais que têm forças interatômicas elevadas, também
apresentam energias de ligação bastante elevadas no ponto de equilíbrio.
Consequentemente, esses materiais têm alta resistência mecânica e elevadas temperaturas
de fusão (materiais geralmente duros, como o diamante e o silício). A Tabela 2.8 fornece
os valores de energia para cada tipo de ligação.
Tabela 2.8 - Energias de ligação para os quatro mecanismos de ligação
Ligações Energia de ligação
(kcal/mol)
Iônica Covalente Metálica Van der Walls
150 - 370 125 - 300 25 - 200
< 10 Fonte: (ASKELAND & PHULÉ, 2008).
( )2
221
221
44
)()(
a
eZZ
a
eZeZF
ooA
πεπε
⋅−=
⋅−=
1nR anb
F+
−=
1n2o
221
Total anb
a4
e)ZZ(F
+−
⋅−=
πε

Estrutura e Propriedades dos Materiais Ligações Atômicas
UFPA – ITEC – FEM Prof. Jorge Teófilo de Barros Lopes 26
Particularmente, materiais ligados ionicamente têm alta energia de ligação, em
virtude da grande diferença na eletronegatividade entre os íons.
Os metais têm baixas energias de ligação, em função da eletronegatividade dos
átomos serem semelhantes.
O módulo de elasticidade (E) do material, que mede a sua rigidez, pode ser obtido
pela derivação de FTotal em relação à distância, em posições próximas ao ponto de
equilíbrio.
As ligações atômicas permitem que os átomos exibam o estado de agregação sólido.
Em função da natureza dessas ligações e da forma com que os átomos são arranjados no
espaço, é possível prever as propriedades, as características e o comportamento do
material.
A energia associada (U ou E) a uma ligação iônica é dada pela soma das energias
envolvidas com a atração e a repulsão dos íons. Como energia é dada pelo produto força x
distância, tem-se:
ou
O termo relativo à energia de atração corresponde à energia liberada quando os íons
aproximam-se, e é negativa devido ao produto de uma carga positiva por um negativa
(+Z1).(–Z2). O termo correspondente à energia de repulsão representa a energia absorvida
quando os íons aproximam-se, e é positiva.
A soma destas duas energias tem o seu ponto mínimo quando os íons apresentam
distância de separação igual à de equilíbrio.
A distância de equilíbrio pode ser alterada pelos seguintes fatores: temperatura,
valência do íon, número de átomos adjacentes e ligações covalentes.
• Temperatura: Qualquer aumento de energia acima do mínimo aumentará a distância
interatômica (expansão térmica).
• Valência iônica: Ao serem retirados elétrons da camada de valência de um átomo, o seu
raio diminui, pois os elétrons restantes são atraídos mais fortemente pelo núcleo, em
[ ] daa
nb
a
eZeZdaFU
a
no
a
Total ∫∫∞
+
∞
−
⋅−==
1221
4
)()(
πε
no
221
a
b
a4
e)ZZ(U ++=
πε

Estrutura e Propriedades dos Materiais Ligações Atômicas
UFPA – ITEC – FEM Prof. Jorge Teófilo de Barros Lopes 27
virtude da diminuição da repulsão eletrônica provenientes dos elétrons vizinhos;
contrariamente, se elétrons foram adicionados à camada de valência de um átomo, o seu
raio irá aumentar. Por exemplo, os raios dos cátions de ferro (Fe) são menores que o do
seu átomo neutro:
- Raio do átomo do ferro (Fe) = 1,241Å
- Raio do íon ferroso (Fe+2) = 0,83Å
- Raio do íon férrico (Fe+3) = 0,67Å
• Átomos adjacentes: Quanto maior o número de átomos adjacentes, maior o raio do
elemento, pois a repulsão eletrônica proveniente dos átomos vizinhos aumenta. Por
exemplo:
- Raio do Fe = 1,241Å, quando em contato com 8 átomos de Fe adjacentes (arranjo
normal em temperatura ambiente - estrutura CCC);
- Raio do Fe = 1,269Å, quando em contato com 12 átomos adjacentes (estrutura CFC).
• Número de ligações covalentes: Quanto maior for o número de ligações covalentes,
menor será a distância interatômica, pois os átomos ficam mais fortemente ligados
(Tabela 2.5).
2.5 Número de Coordenação
O número de coordenação (NC) representa o número de vizinhos mais próximos que
um dado átomo (ou íon) possui na estrutura. A molécula H2, por exemplo, apresenta NC =
1, pois o átomo de hidrogênio se liga a somente outro átomo de hidrogênio.
O número de coordenação depende de dois fatores: covalência e empacotamento
atômico.
A Covalência determina o número de ligações covalentes possíveis. O átomo de
carbono pode ter até quatro ligações covalentes (covalência 4); portanto possui um número
de coordenação máximo de 4. No metano (CH4), tem-se NCC = 4 e NCH = 1.
Com relação ao empacotamento atômico, a estrutura será mais estável se os átomos
(ou íons) se arranjarem de forma mais compacta, pois há libertação de energia quando os
átomos se aproximam da distância de equilíbrio; portanto, quanto maior o NC, mais
compacta será a estrutura.
Com base somente em considerações geométricas, o NC pode ser relacionado com a
razão entre os tamanhos dos átomos (ou íons) envolvidos na estrutura, conforme mostrado
no Quadro 2.1.

Estrutura e Propriedades dos Materiais Ligações Atômicas
UFPA – ITEC – FEM Prof. Jorge Teófilo de Barros Lopes 28
Quadro 2.1 – Número de coordenação e empilhamento atômico relacionados com os tamanhos dos átomos envolvidos na estrutura.
Relação entre os raios onde se espera um NC estável
(r/R)
NC
Empilhamento Representação
0 a 0,155 2 Linear
0,155 a 0,225 3 Triangular
0,225 a 0,414 4
Tetraédrico
0,414 a 0,732 6 Octaédrico
0,732 a 1,0
8
CCC
1,0 12 CFC/HC
- Observações:
i) Podem ocorrer exceções onde o NC previsto difere do NC observado;
ii) Nos metais e sólidos iônicos, o NC é governado pelo empacotamento atômico;
iii) Nos sólidos covalentes, o NC é governado pelos limites de compartilhamento.
2.6 Referências Bibliográficas
ASKELAND, Donald R.; PHULÉ, Pradeep P. The science and engineering of materials. 4.ed. California: Brooks/Cole-Thomson Learning, 2008. FELTRE, R.; YOSHINAGA, S. Atomística: teoria e exercícios. São Paulo: Editora Moderna, 1979. VAN VLACK, Lawrence H. Princípios de ciência e tecnologia dos materiais. 1.ed. Rio de Janeiro: Campus Elsevier, 1984.