2007 carcinoma hepatocelular como fator de risco para recorrência da infecção pelo vírus da...
-
Upload
nadia-elizabeth-barbosa-villas-boas -
Category
Health & Medicine
-
view
60 -
download
4
Transcript of 2007 carcinoma hepatocelular como fator de risco para recorrência da infecção pelo vírus da...
LUCIANA COSTA FARIA
Carcinoma hepatocelular como fator de risco para
recorrência da infecção pelo vírus da hepatite B ap ós o
transplante de fígado: possível envolvimento das cé lulas
neoplásicas na replicação viral
FACULDADE DE MEDICINA
UNIVERSIDADE FEDERAL DE MINAS GERAIS
BELO HORIZONTE
2007
LUCIANA COSTA FARIA
Carcinoma hepatocelular como fator de risco para
recorrência da infecção pelo vírus da hepatite B ap ós o
transplante de fígado: possível envolvimento das cé lulas
neoplásicas na replicação viral
Tese apresentada ao Programa de Pós-Graduação em Medicina, Área de Concentração Gastroenterologia, da Faculdade de Medicina da Universidade Federal de Minas Gerais, como requisito parcial à obtenção do Título de Doutor em Medicina Área de Concentração: Gastroenterologia
Orientadora: Profa. Teresa Cristina de Abreu Ferrar i
FACULDADE DE MEDICINA
UNIVERSIDADE FEDERAL DE MINAS GERAIS
BELO HORIZONTE
2007
UNIVERSIDADE FEDERAL DE MINAS GERAIS
REITOR: Prof. Dr. Ronaldo Tadêu Pena
PRÓ-REITOR DE PÓS-GRADUAÇÃO
Prof. Dr. Jaime Arturo Ramirez
Faria, Luciana Costa F224c Carcinoma hepatocelular como fator de risco para recorrência da infecção pelo vírus da hepatite B após o trasnsplante de fígado: papel das células neoplásicas na replicação viral/Luciana Costa Faria. Belo Horizonte, 2007. 81f., il. Tese.(doutorado) – Universidade Federal de Minas Gerais. Faculdade de Medicina. Área de concentração: Gastroenterologia Orientadora: Teresa Cristina de Abreu Ferrari 1.Hepatite B/virologia 2.Hepatite B/prevenção & controle 3.Carcinoma hepatocelular/virologia 4.Transplante de fígado/efeitos adversos 5.Recidiva/prevenção & controle 6.Fatores de risco 7.Replicação viral 8.DNA circular/isolamento & purificação 8.Reação em cadeia da polimerase I.Título NLM: WC 536 CDU: 616.36-002
FACULDADE DE MEDICINA
DIRETOR: Prof. Dr.Francisco José Penna
COORDENADOR DO CENTRO DE PÓS-GRADUAÇÃO
Prof. Dr. Carlos Faria Santos Amaral
COLEGIADO DO PROGRAMA DE PÓS-GRADUAÇÃO EM MEDICINA
ÁREA DE CONCENTRAÇÃO GASTROENTEROLOGIA
Prof. Dr. Marco Túlio Costa Diniz (Coordenador)
Prof. Dr. Luiz Gonzaga Vaz Coelho (Subcoordenador)
Profa. Dra. Cláudia Alves Couto
Profa. Dra. Luciana Dias Moretzsohn
Profa. Dra. Teresa Cristina de Abreu Ferrari
Dr. Luiz Fernando Veloso (Representante discente)
TRABALHO REALIZADO COM SUPORTE FINANCEIRO DAS
INSTITUIÇÕES:
- CAPES, Coordenação de Aperfeiçoamento de Pessoal de Nível
Superior, por meio do programa de bolsa de doutorado sanduíche no
exterior, durante um ano.
- Agence Française de Recherche contre le SIDA et les Hepatites
(ANRS) ANRS HB 022.
Dedico esta tese aos meus pais, Raymundo e Maria de Lourdes, que sempre me
incentivaram e estiveram ao meu lado, mesmo quando a distância física era grande,
e que com seu exemplo de vida, me transmitiram valores éticos sólidos. Também
dedico este trabalho a minha querida irmã, Ana Paula.
AGRADECIMENTOS
- Ao Prof. Didier Samuel, por ter me dado a oportunidade de trabalhar durante dois
anos no Centre Hépato-Biliaire, Hôpital Paul Brousse, onde pude aprimorar
enormemente meus conhecimentos em hepatologia e transplante de fígado, onde
tive a oportunidade de aprender técnicas de biologia molecular e de conviver com
profissionais médicos e pesquisadores de elevado nível. Foi uma grande experiência
profissional e pessoal.
- À Profa. Dra. Teresa de Abreu Ferrari, que desde o momento em que a realização
desse trabalho era apenas uma idéia, me deu todo o apoio necessário, me
incentivou e esteve sempre disponível a me ajudar. Teve participação essencial na
análise e interpretação dos resultados e na redação deste estudo. Espero poder
continuar a contar com sua orientação científica e apoio no prosseguir de minha vida
acadêmica.
- A Michelle Gigou, que me ensinou todas as técnicas de biologia molecular
utilizadas nesse estudo, com muita paciência e que me acolheu de forma muito
carinhosa e amiga no Laboratório de Pesquisa Unité INSERM 785.
- À Dra. Anne Marie Roque-Afonso, virologista do Hôpital Paul Brousse, pelos
ensinamentos em virologia e pela grande ajuda na realização desse trabalho.
- À Dra. Mylene Sebagh, patologista do Hôpital Paul Brousse que participou
ativamente na realização desse estudo.
- Ao Dr. Philippe Ichai e ao Prof. Faouzi Saliba, responsáveis pelo Serviço de
Reanimação do Centre Hépato-Biliaire, Hôpital Paul Brousse, onde durante um ano
aprendi enormemente sobre a Reanimação Hepática.
- Ao Prof. Dr. Agnaldo Soares Lima e a Corinne Andrée Imbs pelo incentivo e ajuda
na busca de novos horizontes.
- Ao Prof. Dr. Luiz Gonzaga Vaz Coelho, pelo apoio e incentivo.
- Ao Prof. Dr. Aloísio Sales da Cunha e à Profa. Dra. Maria de Lourdes de Abreu
Ferrari, pela grande contribuição para a minha formação médica gastroenterológica,
pelo incentivo e pela amizade.
- Ao Prof. Dr. Aloísio Joaquim Freitas Ribeiro, pela grande contribuição à análise
estatística dos resultados desse estudo.
- Aos colegas do Grupo de Transplante de Órgãos do Instituto Alfa de
Gastroenterologia, onde tive o primeiro contato com o Transplante de Fígado e, a
partir dessa experiência, nasceu um grande interesse e desejo de buscar novos
conhecimentos e respostas na área.
- À Profa. Wanessa Clemente Rosenvald, pela amizade e incentivo.
- Ao acadêmico de medicina Felipe Batista Lima Barbosa e ao Dr. Luiz Fernando
Veloso, pela ajuda na confecção dos gráficos desse trabalho.
- A minha prima Cláudia Márcia Costa Mangualde, pela grande, longa e sincera
amizade.
- A toda minha família, tias, tios, primas e primos, pelo carinho e atenção.
RESUMO
Introdução: Nos últimos anos, o transplante hepático (TH) tornou-se importante
opção terapêutica para os pacientes com doenças hepáticas relacionadas ao vírus
da hepatite B (VHB). No entanto, a infecção pelo VHB pode recorrer após o TH e
medidas de profilaxia são necessárias para se evitar tal recorrência. Os objetivos
desse estudo foram investigar o papel do carcinoma hepatocelular (CHC) na
recorrência da infecção pelo VHB após o TH e a ocorrência de replicação viral B em
células do CHC e em células hepáticas não tumorais, pela quantificação do cccDNA
(covalently closed circular DNA) e do DNA total do vírus da hepatite B no fígado
explantado de pacientes AgHBs-positivo com diagnóstico de CHC submetidos a TH.
Métodos: Foram incluídos no estudo, de forma retrospectiva, 113 pacientes AgHBs-
positivo submetidos a TH. Todos receberam globulinas hiperimune anti-HBs (HBIG)
após o transplante e 56 receberam também lamivudina e/ou adefovir. O tempo
mediano de seguimento pós-TH foi de 53 meses (0.25 a 125 meses). 33 pacientes
(29.2%) tiveram o diagnóstico de CHC confirmado pelo exame histopatológico do
fígado nativo. O DNA total do VHB e o cccDNA foram quantificados em células
tumorais e não-tumorais do fígado nativo de 16 desses pacientes por técnica de
reação de polimerase em cadeia em tempo real. O cccDNA foi quantificado em
células do CHC em três pacientes que apresentaram recorrências do VHB e do
CHC. Resultados: Quatorze pacientes (12.4%) apresentaram recorrência da
infecção viral B após o TH. Os fatores de risco independentes para a infecção viral B
recorrente foram o CHC, níveis séricos de DNA viral ≥ 30.000 cópias/mL no
momento do transplante, e a monoprofilaxia com HBIG (vs. profilaxia combinada
pós-transplante). CccDNA foi detectado em células do CHC em 11 pacientes e em
células não tumorais de 12 de 16 pacientes, no fígado explantado. O cccDNA foi
também detectado em células do CHC recidivado em dois dos três pacientes
testados que apresentaram recorrências viral B e do CHC. Conclusões: CHC, carga
viral no momento do transplante e monoprofilaxia com HBIG foram os fatores de
risco independentes para a recorrência viral B após o TH. A recorrência do CHC e
da hepatite B em sete pacientes e a detecção do cccDNA e do DNA total do VHB em
células do CHC são fortemente sugestivas da ocorrência de replicação viral B nas
células tumorais. Esses fatos, provavelmente, estão implicados na recorrência da
hepatite B após o TH e novos estudos são necessários para se investigar essa
associação.
ABSTRACT
Background and aims: In the last years, ortothopic liver transplantation (OLT) has
become an important modality of treatment for hepatitis B virus (HBV)-related liver
disease patients. However, HBV infection may recur in the transplanted liver and
prophylactic measures are necessary to avoid this recurrence. The aims of this study
were to investigate the role of hepatocellular carcinoma (HCC) in HBV recurrence
after OLT and to assess HBV replication by cccDNA (covalently closed circular DNA)
and total HBV DNA quantification in HCC and non-tumor cells from the native liver of
HBsAg-positive transplanted patients. Methods: 113 HBsAg-positive transplanted
patients were retrospectively studied. All patients received hyperimmune anti-HBs
globulins (HBIG) after OLT and 56 also received lamivudine and/or adefovir. Median
follow-up was 53 months (range 0.25 to 125). 33 patients (29.2%) had HCC. Total
HBV DNA and cccDNA were quantified in HCC and in non-tumor cells from the
native liver of 16 patients by a real time polymerase chain reaction assay. CccDNA
was quantified in HCC cells in three patients who presented HBV and HCC
recurrences. Results: 14 patients (12.4%) presented HBV recurrence after OLT. The
independent risk factors for HBV recurrence were HCC, serum levels of hepatitis B
virus DNA ≥ 30,000 copies/mL at the time of OLT, and HBIG monoprophylaxis (vs
combined prophylaxis). CccDNA was detected in HCC cells from 11 patients and in
non-tumor cells from 12 out of 16 patients on the explanted liver. CccDNA was
detected in HCC metastatic cells after tumoral recurrence in two out of three tested
patients who presented HBV and HCC recurrences. Conclusions: HCC, hepatitis B
virus DNA viral load ≥ 30,000 copies/mL at the time of liver transplantation and HBIG
monoprophylaxis were independent risk factors for HBV recurrence after OLT. HBV
replication in HCC cells is strongly suggested by the concomitant recurrence of HCC
and HBV infection and by the detection of cccDNA and HBV DNA in tumor tissues.
These facts are probably implicated in HBV recurrence and other studies are
necessary to investigate this association.
LISTA DE ABREVIATURAS
AgHBc – antígeno do core do vírus da hepatite B
AgHBe – antígeno e do vírus da hepatite B
AgHBs – antígeno de superfície do vírus da hepatite B
Anticorpo anti-HBe – anticorpo anti-antígeno e do vírus da hepatite B
Anticorpo anti-HBs –anticorpo anti-antígeno de superfície do vírus da hepatite B
CccDNA – covalently closed circular DNA
CHC – carcinoma hepatocelular
DNA – ácido desoxirribonucléico
Gene P – gene que codifica a polimerase do vírus da hepatite B
Genes pré-C/C – genes que codificam os antígenos pré-core e do core do vírus
da hepatite B
Genes pré-S1, pré-S2 e S – genes que codificam os antígenos pré-superfície 1,
pré-superfície 2 e de superfície do vírus da hepatite B
Gene X – gene que codifica a proteína X do vírus da hepatite B
HBIG – globulina hiperimune anti-HBs
HBSP – hepatitis B spliced protein
IC 95% - intervalo de confiança a 95%
PCR – reação de polimerase em cadeia
rcDNA – relaxed circular DNA
RNA – ácido ribonucléico
RR – risco relativo
TGF-β - fator transformador de crescimento-β
TH – transplante hepático
VHB – vírus da hepatite B
VHC - vírus da hepatite C
VHD – vírus da hepatite delta
VIH - vírus da imunodeficiência humana
LISTA DE TABELAS
Tabela 1: Características dos 113 pacientes AgHBs-positivo submetidos a
transplante hepático...................................................................................................23
Tabela 2. Características histológicas e virológicas dos 16 pacientes AgHBs-positivo
submetidos a transplante hepático com diagnóstico de carcinoma hepatocelular, nos
quais o DNA total do VHB e o cccDNA foram quantificados em espécimes de tumor
e não-tumor do fígado nativo.....................................................................................25
.
Tabela 3. Risco atuarial de recorrência da infecção pelo VHB em pacientes AgHBs-
positivo submetidos a transplante hepático, em relação às variáveis
analisadas..................................................................................................................37
Tabela 4: Taxas de recorrência da infecção pelo vírus da hepatite B em pacientes
com e sem carcinoma hepatocelular associado no momento do transplante hepático
(TH) e com DNA do VHB no soro ≥ e < 30.000 cópias/mL no momento do TH, que
receberam monoprofilaxia (HBIG) ou profilaxia combinada (HBIG + lamivudina e/ou
adefovir)......................................................................................................................42
Tabela 5: Características clínicas e virológicas, momento da recidiva do CHC e da
recorrência da infecção viral B após o TH e resultados da quantificação do DNA total
do VHB e do cccDNA no tecido do CHC recidivado pós-TH, em sete pacientes que
apresentaram recidiva do VHB e do CHC..................................................................46
Tabela 6: Resultados da quantificação do DNA do VHB e do cccDNA em espécimes
de tumor e não-tumor do fígado explantado de 16 pacientes AgHBs-positivo com
carcinoma hepatocelular submetidos a transplante hepático.....................................55
LISTA DE FIGURAS
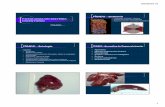
Figura 1: Exame histológico de tecido de congelação, corado por hematoxilina-
eosina, confirmando o diagnóstico de cirrose (fígado não-tumoral)...........................31
Figura 2: Exame histológico de tecido de congelação, corado por hematoxilina-
eosina, confirmando o diagnóstico de carcinoma hepatocelular................................32
Figura 3: Risco atuarial de recorrência da hepatite B em 33 pacientes AgHBs-
positivo com carcinoma hepatocelular (CHC) associado, submetidos a transplante
hepático (TH), e em 80 pacientes AgHBs-positivo sem CHC submetidos a TH (teste
log rank)......................................................................................................................38
Figura 4: Risco atuarial de recorrência da hepatite B pós-transplante hepático em 17
pacientes com DNA do vírus da hepatite B (VHB) no soro ≥ 30.000 cópias/mL e em
79 pacientes com DNA do VHB < 30.000 cópias/mL no momento do transplante
(teste log rank)............................................................................................................39
Figura 5: Risco atuarial de recorrência da hepatite B pós-transplante hepático (TH)
em 57 pacientes que receberam apenas imunoglobulina anti-HBs (HBIG) após o TH
(grupo monoprofilaxia) e em 56 pacientes que receberam lamivudina e/ou adefovir
associado(s) à HBIG (grupo profilaxia combinada) (teste log rank)...........................40
Figura 6: Organograma mostrando pacientes transplantados com carcinoma
hepatocelular (CHC), que apresentaram ou não recidiva tumoral e recorrência da
hepatite B após o transplante de fígado.................................................................... 44
Figura 7: Paciente submetido a transplante hepático (TH) devido aos diagnósticos de
cirrose viral B e carcinoma hepatocelular (CHC). Antes do transplante, a
quantificação do DNA do VHB no soro era de 4,76 x 105 e tornou-se negativa após o
tratamento com lamivudina. Após o TH, como profilaxia da recidiva viral B, ele
recebeu globulina hiperimune anti-hepatite B (HBIG) e lamivudina. Vinte e sete
meses após o TH, ocorreu recorrência da infecção pelo VHB. Nove meses mais
tarde, foi diagnosticada recidiva do CHC na glândula adrenal. Após ressecção da
metástase adrenal, o AgHBs no soro tornou-se negativo. Em seguida a uma nova
recidiva do CHC (mandibular), o AgHBs e o DNA do VHB no soro tornaram-se
positivos. O paciente evoluiu a óbito devido à recidiva do CHC seis anos após o
TH...............................................................................................................................47
Figura 8: Risco atuarial de recorrência da hepatite B após o transplante hepático
(TH) em 10 pacientes que apresentaram recidiva do carcinoma hepatocelular (CHC)
após o TH e em 23 pacientes que não apresentaram recidiva do CHC após o TH
(total de 33 pacientes AgHBs-positivo transplantados com CHC) ............................48
Figura 9: Organograma mostrando pacientes transplantados com carcinoma
hepatocelular (CHC), que receberam quimioterapia, que apresentaram ou não
recidiva tumoral e recorrência da hepatite B após o transplante de fígado...............49
Figura 10: Sobrevida global dos 113 pacientes AgHBs-positivo transplantados no
período de dezembro de 1995 a dezembro de 2004.................................................51
Figura 11: (A) Níveis de cccDNA em células tumorais do carcinoma hepatocelular
(CHC) e em células hepáticas não-tumorais do fígado nativo em pacientes AgHBs-
positivo, submetidos a transplante hepático (TH). (B) Níveis de DNA total do VHB em
células tumorais do CHC e em células hepáticas não-tumorais do fígado nativo em
pacientes AgHBs-positivo, submetidos a TH. Cada ponto representa um paciente e
as barras indicam os valores da mediana. LID: limite inferior de detecção...............54
SUMÁRIO
1- INTRODUÇÃO.....................................................................................................1
2- ANTECEDENTES CIENTĺFICOS.........................................................................5
2.1- O vírus da hepatite B..................................................................................6
2.1.1- Genes e proteínas virais...............................................................7
2.1.2- O ciclo de replicação viral.............................................................8
2.1.3- O cccDNA.....................................................................................9
2.2- Mecanismos da carcinogênese hepática relacionada ao VHB................11
2.2.1- Inflamação crônica......................................................................12
2.2.2 Integração do DNA do VHB ao DNA celular................................13
2.2.3 Expressão dos genes X, pré-S2/S incompleta e da spliced protein
do VHB podem modular a proliferação e a viabilidade celulares.........14
2.3- Transplante hepático para doenças hepáticas relacionadas ao VHB......15
3- OBJETIVOS.......................................................................................................19
4- PACIENTES E MÉTODOS................................................................................21
4.1- Pacientes..................................................................................................22
4.2- Profilaxia da recidiva da hepatite B..........................................................26
4.3- Exames virológicos...................................................................................27
4.4- Definição de recidiva viral B.....................................................................28
4.5 Quantificação do cccDNA e do DNA total do VHB em espécimes de tecido
tumoral e não-tumoral do fígado nativo de pacientes transplantados por
CHC ................................................................................................................28
4.6 Análise estatística......................................................................................33
5- RESULTADOS..................................................................................................35
5.1-Tempo de seguimento e freqüência global de recorrência da infecção pelo
VHB..................................................................................................................36
5.2- Fatores preditivos de maior risco de recorrência da infecção pelo VHB..36
5.3- Evolução da reinfecção pelo VHB............................................................43
5.4- Reinfecção pelo VHB nos pacientes transplantados com CHC...............43
5.5- Sobrevida global.......................................................................................50
5.6- Níveis de cccDNA e de DNA total do VHB no CHC e no fígado não-
tumoral no fígado nativo..................................................................................52
5.7- Níveis de cccDNA e de DNA total do VHB no tecido tumoral após a
recorrência do CHC.........................................................................................53
6- DISCUSSÃO.....................................................................................................56
7- CONCLUSÕES.................................................................................................65
8- REFERÊNCIAS BIBLIOGRÁFICAS.................................................................66
ANEXOS
Anexo 1 - Autorização do Comitê de Ética em Pesquisa da Universidade Federal de
Minas Gerais (COEP)
Anexo 2 - Termo de Consentimento Livre e Esclarecido
2
1 - Introdução
A infecção pelo vírus da hepatite B (VHB) é importante causa de hepatite
crônica, cirrose hepática e carcinoma hepatocelular (CHC) em todo o mundo
(1). Na Europa e nos Estados Unidos, 4% a 9% dos pacientes submetidos a
transplante hepático (TH) apresentam doença hepática relacionada ao VHB (2,
3). A sobrevida pós-TH a longo prazo depende da prevenção da reinfecção do
enxerto pelo VHB. Na ausência de medidas profiláticas, o risco de recidiva da
infecção viral pode chegar a 80% (4, 5). A infecção recorrente pode levar à
disfunção do enxerto, à necessidade de retransplante e ao óbito (4, 5).
Ao longo dos últimos anos, muito se avançou no tratamento dos
pacientes com hepatite B, submetidos ao TH. Inicialmente, o uso por longo
prazo da globulina hiperimune anti-HBs (HBIG) após o TH permitiu a redução
das taxas globais de recorrência da infecção viral B a 20%-36% (6-8).
Entretanto, as taxas de reinfecção permaneceram elevadas nos pacientes de
maior risco, ou seja, aqueles com cirrose viral B com DNA do VHB detectável
no soro por técnica de hibridização (6, 9, 10). Alguns anos mais tarde, com a
disponibilidade de agentes antivirais eficazes como lamivudina e adefovir
dipivoxil, o uso de profilaxia combinada desses agentes com a HBIG
proporcionou melhora significativa dos resultados, mesmo nos grupos de alto
risco, com redução das taxas de reinfecção a aproximadamente 10% (9, 11-
14).
A infecção crônica pelo VHB é um dos mais importantes fatores de risco
para o CHC (15, 16). Diversos mecanismos parecem estar envolvidos na
3
patogênese do câncer na infecção pelo VHB (17). Um fator importante é a
inflamação crônica associada à necrose hepatocelular, aos efeitos das
citocinas e o desenvolvimento de fibrose (18). A integração do DNA do VHB ao
genoma da célula hospedeira pode alterar ou promover a expressão de genes
que são importantes no crescimento e diferenciação celulares (19).
Demonstrou-se que proteínas expressas por esses genes integrados
apresentam atividades intracelulares que poderiam contribuir para o efeito
carcinogênico do VHB (17). Dados recentes têm demonstrado que a carga viral
é um importante fator preditivo do risco de desenvolvimento de CHC,
independentemente da positividade do antígeno e do vírus da hepatite B
(AgHBe), dos níveis de alanina aminotransferase e da presença de cirrose
hepática (20-22), embora seja comumente aceito que os níveis de DNA do
VHB no soro sejam menores nos pacientes com CHC. Em estudos prévios,
utilizando-se métodos menos sensíveis do que as técnicas de reação de
polimerase em cadeia (PCR) atualmente disponíveis, a ocorrência de
replicação viral em células tumorais do CHC permaneceu uma questão
controversa (23, 24).
Em torno de 30% dos pacientes com cirrose viral B submetidos ao TH
apresentam CHC associado. Diversos estudos não observaram associação
entre a presença do CHC no momento do TH e maior risco de recorrência da
infecção pelo VHB pós-TH (9, 25-28). Apenas um estudo mostrou maior risco
de recorrência da hepatite B em pacientes transplantados com CHC (29).
O cccDNA (covalently closed circular DNA) é uma forma replicativa do
DNA do VHB, que acredita-se ser responsável pela manutenção da infecção
crônica pelo VHB. Durante a infecção pelo VHB, o cccDNA acumula-se no
4
núcleo da célula, onde persiste como epissoma estável, e funciona como
“molde” para a transcrição dos genes virais (30, 31). Pouco se conhece sobre a
presença da forma epissomal do DNA do VHB nas células tumorais do CHC e
sua relação com as células do tecido não-tumoral adjacente. Entretanto,
estudos recentes mostraram a presença do DNA do VHB e do cccDNA em
células de CHC (32-34), sugerindo a possibilidade de replicação viral no tecido
neoplásico.
O presente estudo foi realizado objetivando-se responder a lacunas
existentes no conhecimento atual sobre a relação entre o CHC e o risco de
recorrência da hepatite viral B pós-TH e sobre a possibilidade de ocorrência de
replicação do VHB nas células do CHC.
6
2 – Antecedentes científicos
Em todo o mundo, mais de 350 milhões de pessoas estão infectadas
pelo VHB. A infecção crônica pelo VHB é importante causa de hepatite crônica,
cirrose hepática e CHC e é responsável por cerca de um milhão de óbitos
anualmente (1). O Brasil é considerado um país de endemicidade intermediária
(prevalência entre 2% e 7%), exceto na Bacia Amazônica Ocidental, onde a
infecção pelo VHB apresenta alta endemicidade (prevalência maior ou igual a
8%) (36). O CHC é uma das mais freqüentes neoplasias malignas em todo o
mundo (37, 38). A infecção crônica pelo VHB é um dos principais fatores de
risco para o desenvolvimento do CHC (15, 16, 39). Esse risco é atribuído à
presença de cirrose que por si só é um estado pré-neoplásico e também ao
próprio VHB. Sabe-se que os pacientes portadores crônicos do VHB podem
desenvolver CHC mesmo na ausência de cirrose (39, 40).
A infecção crônica pelo VHB é causa comum de doença hepática
avançada, incluindo cirrose hepática descompensada. O prognóstico desta é
ruim: a sobrevida em cinco anos, que varia entre 80% e 86% nos pacientes
com cirrose hepática compensada, reduz para 14% a 28% naqueles com
doença descompensada (40). Muitos pacientes com cirrose hepática causada
pelo VHB tornam-se potenciais candidatos ao TH.
2.1 O vírus da hepatite B
O VHB pertence à família Hepadnaviridae, que inclui outros vírus DNA
hepatotrópicos com características semelhantes. O vírion completo é uma
7
esfera de 42 nm de diâmetro, constituída por envelope lipoprotéico, que
envolve o core ou nucleocapsídeo, o qual contém o genoma viral (1).
2.1.1 Genes e proteínas virais
O genoma do VHB consiste em uma seqüência de DNA circular
parcialmente dupla, constituída por aproximadamente 3.200 pares de base. O
filamento longo de DNA contém toda a informação genética do vírus e liga-se
covalentemente, pela sua extremidade 5’, à polimerase viral. O filamento curto
tem extremidade 5’ fixa, mas extremidade 3’ variável, à qual se liga seqüência
de oligorribonucletídeos. Os dois filamentos se organizam em uma estrutura
circular, não fechada covalentemente, conhecida como relaxed circular DNA
(rcDNA). O DNA do VHB apresenta organização complexa, com quatro janelas
de leitura, que se sobrepõem parcialmente: genes pré-S/S, pré-C/C, gene P e
gene X (1).
As proteínas do envelope viral são codificadas pela região pré-S/S (pré-
superfície – superfície) do genoma viral (genes pré-S1, pré-S2 e S), que
codifica três diferentes antígenos de superfície, de acordo com a região onde
se inicia a transcrição. A proteína mais abundante é a proteína S, que é
conhecida como antígeno HBs (AgHBs). O início da transcrição na região pré-
S2 gera a proteína M (média). A proteína L (large = grande) é gerada pelo
início da transcrição na região pré-S1 e desempenha, provavelmente, papel na
ligação do vírus a receptores da célula hospedeira e sua entrada na mesma e,
ainda, na formação do vírion e sua liberação pela célula (41 – 43). Além dos
vírions, as células infectadas pelo VHB produzem duas partículas lipoprotéicas
8
distintas: esferas e filamentos de 20nm de diâmetro. Essas partículas contêm
proteínas do envelope e lipídeos derivados da célula hospedeira e, em geral,
superam quantitativamente os vírions em 1.000:1 a 10.000:1.
As regiões pré-C/C (pré-core – core) do genoma do VHB codificam o
antígeno do core (AgHBc) e o antígeno e do VHB (AgHBe). O AgHBc é o
polipeptídeo estrutural do capsídeo viral (1).
O gene longo P codifica a DNA polimerase, enzima que também
apresenta função de transcriptase reversa, uma vez que a replicação viral
requer intermediário RNA. O gene X codifica a proteína viral X (HBx), que
modula transmissão de sinal na célula hospedeira e é necessária à replicação
viral (44).
2.1.2 O ciclo de replicação viral
A principal característica da replicação do VHB é a replicação do DNA
por transcrição reversa a partir de RNA intermediário (45). O vírion maduro ou
partícula de Dane entra na célula após ligação a um receptor de superfície.
Após a fusão de membranas, o core é liberado no citoplasma da célula e
transportado até o núcleo. No núcleo, o DNA, que se encontra na forma circular
aberta, “relaxed circular” (rcDNA), é convertido à forma circular fechada,
“covalently closed circular” DNA (cccDNA) (30). A partir do cccDNA, RNAs
virais são sintetizados pela enzima RNA polimerase, sendo, então,
transportados até o citoplasma, onde a sua tradução produz as proteínas virais.
Formam-se capsídeos no citoplasma e, durante esse processo, uma única
molécula de RNA pré-genômico é incorporada ao interior do capsídeo (46). Em
9
seguida, ocorre a transcrição reversa do RNA viral, pela ação da polimerase
viral. A síntese dos dois filamentos do DNA é seqüencial: o primeiro a partir do
RNA e, o segundo, a partir do filamento de DNA recém-sintetizado (45, 47).
Alguns nucleocapsídeos retornam ao núcleo, onde o DNA pode ser convertido
à forma cccDNA, para manter estável o pool intra-nuclear deste (30). A maioria
dos capsídeos, entretanto, migram para o retículo endoplasmático, onde
adquirem o envelope viral e transformam-se em vírions completos, podendo ser
exportados para o exterior da célula.
2.1.3 O cccDNA
Acredita-se que a infecção crônica pelo VHB seja mantida pelo cccDNA.
A formação do cccDNA ocorre após o transporte do nucleocapsídeo e a
entrada do DNA na forma rcDNA no núcleo do hepatócito. Em seguida, a
polimerase é removida do filamento negativo, o segmento de
oligorribonucleotídeos é removido do filamento positivo, o DNA do filamento
positivo é completado e as duas extremidades do DNA são covalentemente
ligadas (48). Durante a infecção pelo VHB, o cccDNA acumula-se no núcleo da
célula, onde persiste como epissoma estável e serve como modelo para a
transcrição dos genes virais, o que dará origem aos RNAs pré-genômico (a
partir do qual ocorre a transcrição reversa) e subgenômicos, necessários à
síntese das proteínas virais (48). Considerando-se a longa meia vida dos
hepatócitos, o fator limitante à eliminação da infecção é o clareamento dos
reservatórios de cccDNA das células infectadas (49).
10
Apesar do papel crucial do cccDNA na persistência da infecção pelo
VHB e da importância do conhecimento dos mecanismos de seu clareamento,
a maior parte do conhecimento atual sobre o cccDNA foi obtida utilizando-se
modelos animais, existindo poucos estudos em seres humanos. Obstáculos
históricos ao estudo do cccDNA foram a necessidade de realização de biópsias
hepáticas e a falta de métodos quantitativos sensíveis e específicos para a sua
detecção (50). Apesar dessas limitações, alguns estudos foram realizados em
fígados de pacientes cronicamente infectados pelo VHB e permitiram a
detecção tanto da presença do cccDNA em tecido hepático, utilizando-se
técnica de Southern Blot (51), como de sua persistência apesar do tratamento
antiviral com interferon, utilizando-se técnica de hibridização molecular (52).
Com o desenvolvimento de tecnologia de PCR, algumas equipes
tentaram desenvolver metodologias para amplificar e quantificar
especificamente o cccDNA viral, escolhendo pares de primers que
amplificassem preferencialmente a forma ccc e não amplificasse as outras
formas, ou o fizesse em pequenas proporções (53, 54) Mais recentemente,
Werle-Lapostolle e colaboradores (35) relataram o desenvolvimento de nova
técnica de PCR em tempo real, que possibilitou a quantificação do cccDNA em
biópsias hepáticas de pacientes com infecção crônica pelo VHB. A
especificidade desse método baseia-se em dois passos principais: (i)
tratamento com DNase ATP-dependente para digerir os intermediários
replicativos não cccDNA; e (ii) utilização de primers localizados em ambos os
lados do intervalo das formas rcDNA, para amplificar preferencialmente a forma
cccDNA.
11
Na literatura, existem poucas informações sobre a presença do cccDNA
em células tumorais do CHC e poucos dados quantitativos sobre os níveis de
DNA do VHB em tecidos tumoral e não-tumoral.
Estudos que utilizaram métodos menos sensíveis do que os atualmente
disponíveis, mostraram resultados controversos quanto à possibilidade de
ocorrência de replicação viral em células neoplásicas do CHC (23, 24).
Raimondo e colaboradores realizaram estudo, utilizando técnica de
hibridização molecular, e detectaram apenas DNA do VHB integrado nos
tecidos de CHC, sugerindo que as células tumorais não mais permitiriam a
replicação viral (23). Loncarevic e colaboradores realizaram outro estudo,
utilizando técnica de Southern blot, e detectaram intermediários replicativos
indicando a ocorrência de replicação viral B em células do CHC em amostra de
um dentre oito pacientes estudados (24).
Estudo recente mostrou a presença de cccDNA em níveis
significativamente mais elevados em tecidos tumorais do que em tecidos não-
tumorais adjacentes em pacientes com CHC (34). No entanto, nesse estudo, foi
utilizada a tecnologia Invader®, cuja especificidade permanece questionável
(50). Pollicino e colaboradores (33) também detectaram a presença de cccDNA
em células de CHC, utilizando técnica de nested PCR.
2.2 Mecanismos da carcinogênese hepática relacionad a ao VHB
A patogênese do câncer na infecção pelo VHB foi amplamente
estudada, e, múltiplos fatores parecem estar envolvidos. Um importante fator é
a inflamação crônica e o efeito de citocinas sobre a proliferação de células
12
hepáticas e sobre a fibrose. A integração de segmentos do DNA do VHB ao
genoma da célula hospedeira também tem papel significativo e pode levar a
alterações na expressão de genes celulares que são importantes para o
crescimento e a diferenciação das células. Além disso, a expressão de
proteínas do VHB pode ter efeitos diretos em funções celulares e alguns
produtos desses genes poderiam favorecer a transformação maligna. Alguns
genes do VHB foram encontrados em tecido hepático de pacientes infectados
em maior freqüência do que outros, incluindo-se o pré-S2/S incompleto, o gene
X, e o gene que codifica uma proteína recentemente descoberta, hepatitis B
spliced protein (HBSP). As proteínas expressas a partir desses genes
integrados apresentam atividades intracelulares que poderiam contribuir para a
associação entre VHB e CHC, incluindo efeitos no crescimento celular e
apoptose (17).
2.2.1 Inflamação crônica
Um importante fator é a inflamação crônica e os efeitos de citocinas no
desenvolvimento de fibrose e na proliferação de células hepáticas. A hepatite
crônica ativa é reconhecida como fator de risco significativo para o
desenvolvimento do CHC. Os mecanismos envolvidos incluem necrose de
células hepáticas, inflamação, síntese de citocinas e fibrose (18). Ciclos de
morte celular, regeneração e reparo resultam em contexto de elevado turnover
celular, o que propiciaria o surgimento de clones de células com atividade da
telomerase reativada, que se tornariam imortalizadas. Essas células seriam
13
então susceptíveis ao desenvolvimento de alterações genéticas adicionais que
poderiam levar ao desenvolvimento de fenótipo maligno (19).
2.2.2 Integração do DNA do VHB ao genoma da célula hospedeira
O papel da integração do DNA do VHB ao DNA da célula hospedeira no
desenvolvimento do CHC ainda não foi completamente compreendido. Alguns
estudos mostraram que a integração de segmentos do DNA do VHB está
presente em 85% - 90% dos casos de CHC relacionados ao VHB (55 - 57). A
ocorrência de CHC em crianças e adultos jovens sem cirrose e cronicamente
infectados pelo VHB é um argumento a favor de um papel específico da
integração do DNA do VHB na carcinogênese hepática (58, 59). A presença de
seqüências do genoma do VHB integradas ao DNA celular pode ser
encontrada em tecido não-tumoral de pacientes com hepatite crônica (60, 61).
Observações prévias, baseadas em método de Southern blot, e recentemente
confirmadas por técnicas de PCR, mostraram que a integração do DNA viral
em células do hospedeiro pode ocorrer em fases precoces da infecção (62, 63).
A integração, portanto, precede o desenvolvimento do CHC e suas
conseqüências funcionais devem ser consideradas um processo dinâmico. A
inflamação crônica prolongada, associada à proliferação celular, induz
rearranjos das seqüências virais integradas. Deleções de parte do genoma
viral, assim como rearranjos mais complexos, são freqüentemente observados
(19, 64). A integração do DNA do VHB pode induzir deleções cromossômicas
no genoma da célula hospedeira nos sítios de integração e, mesmo,
transposições de um cromossoma a outro de seqüências virais, acompanhadas
14
de segmentos de DNA celular adjacentes (18, 64, 65). Portanto, o VHB
integrado ao genoma do hospedeiro pode gerar instabilidade cromossômica. A
integração do DNA do VHB em genes envolvidos na sinalização celular é
evento freqüente. Provavelmente, a integração do DNA do VHB em
determinados genes poderia conferir vantagens de proliferação levando à
seleção de clones celulares. O acúmulo contínuo, ao longo dos anos, dessas
alterações, levaria à progressão e à proliferação tumoral (66).
2.2.3 Expressão dos genes X, pré-S2/S incompleto e da spliced protein
do VHB podem modular a proliferação e a viabilidade celulares
O exame de seqüências do DNA viral presentes em células tumorais
mostrou, em grande proporção dos casos, presença de seqüências que
codificam as proteínas virais HBx, do envelope pré-S2/S incompleta, bem como
o gene que codifica a proteína HBSP (hepatitis B spliced protein) (17, 67).
Na maioria das seqüências de DNA do VHB integradas, o gene HBx é
mantido e transcrito. A proteína HBx tem 154 aminoácidos, é expressa em
baixos níveis durante as hepatites aguda e crônica e desempenha diversas
funções relacionadas à proliferação e à viabilidade celulares (17). Seqüências
de HBx foram identificadas em células tumorais de CHC que apresentam
deleção do segmento de DNA que codifica a porção COOH-terminal da
proteína X. Essa alteração poderia levar à perda de efeitos inibitórios na
proliferação e transformação celulares (68). A seleção dessas seqüências de
HBx em células hepáticas em expansão clonal poderiam favorecer a
proliferação celular e a transformação maligna.
15
Achados in vitro sugerem que a proteína HBSP (hepatitis B spliced
protein) possa induzir apoptose e modular a via de sinalização dependente do
fator transformador de crescimento-β (TGF-β) (17, 18, 67).
Em conclusão, as evidências atualmente disponíveis mostram que o
VHB pode alterar a proliferação, a diferenciação e a viabilidade das células
hepáticas, seja pela síntese de algumas de suas próprias proteínas (HBx, Pré-
S2/S HBSP), ou pela indução de alterações genéticas na célula hospedeira. A
combinação desses eventos e de outros, ainda não conhecidos, estaria
provavelmente envolvida na patogênese do CHC.
2.3 Transplante hepático para doenças hepáticas rel acionadas ao
VHB
Nos últimos anos, o TH tornou-se importante opção terapêutica para os
pacientes com cirrose hepática descompensada, hepatite fulminante e CHC
causados pela infecção pelo VHB. No entanto, durante alguns anos, as
doenças hepáticas causadas pelo VHB foram consideradas má indicação e até
mesmo contra-indicação ao TH, devido às elevadas taxas de reinfecção do
enxerto hepático pelo VHB. Na ausência de medidas de profilaxia, o risco de
reinfecção pelo VHB após o TH é de aproximadamente 80% e pode levar a
insuficiência hepática, necessidade de retransplante e óbito (4, 5). No passado,
a recidiva viral B pós-transplante era a principal causa de redução de sobrevida
do enxerto e de pacientes a mais de dois meses do TH (4, 5).
Atualmente, as doenças hepáticas associadas à infecção pelo VHB
16
correspondem a cerca de 4% a 9% das indicações de TH na Europa e nos
Estados Unidos (2, 3). A sobrevida a longo prazo depende da prevenção da
reinfecção do enxerto pelo VHB ou da redução da progressão do acometimento
do mesmo, naqueles pacientes que apresentaram recorrência da infecção.
Ao longo dos últimos 15 anos, avanços significativos foram alcançados
na prevenção da recorrência da infecção pelo VHB pós-transplante. O primeiro
grande avanço foi a utilização, por longo prazo, da globulina hiperimune anti-
HBs (HBIG) (6 - 8). Diversos estudos mostraram que, utilizando-se HBIG em
altas doses, por via intravenosa e por tempo prolongado, as taxas de
recorrência da infecção puderam ser reduzidas a 20%-36% (6, 7). No entanto,
mesmo utilizando-se essa profilaxia, as taxas de recorrência da hepatite B
permaneceram elevadas (em torno de 80%) no grupo de pacientes com maior
risco, ou seja, aqueles com cirrose viral B e replicação viral elevada antes do
transplante, definida pela detecção do DNA do VHB no soro, por técnicas de
hibridização molecular (6). A administração de HBIG é relativamente bem
tolerada e os efeitos colaterais são pouco comuns; mas, a necessidade de
monitorização freqüente dos níveis séricos dos anticorpos anti-HBs e de
administrações a cada um ou dois meses, de acordo com esses níveis, são
alguns dos seus inconvenientes. Um fator limitante à sua utilização em altas
doses é o custo elevado, principalmente em países com menores recursos
financeiros.
O segundo importante avanço no manejo de pacientes transplantados
por doenças hepáticas relacionadas ao VHB foi a disponibilidade de agentes
antivirais contra o VHB, eficazes e bem tolerados, como a lamivudina e o
adefovir dipivoxil. A utilização desses medicamentos permitiu melhora das
17
condições clínicas de pacientes com cirrose hepática descompensada em lista
de espera de TH (69 - 71) e também possibilitou o tratamento de pacientes
submetidos a transplante com recorrência da infecção pelo VHB (71, 72).
Finalmente, a utilização, por longo prazo, de HBIG em combinação com
lamivudina e/ou adefovir, iniciados antes do TH nos pacientes com replicação
viral e mantidos indefinidamente pós-TH, possibilitou a redução do risco de
reinfecção para cerca de 10%, mesmo nos pacientes com maior risco (9, 11 -
13).
Os fatores de risco para a reinfecção pelo VHB pós-transplante nos
pacientes que recebiam apenas HBIG são bem conhecidos. Pacientes com
cirrose viral B e replicação viral antes do transplante, definida pela presença do
DNA do VHB no soro, detectada por técnicas de hibridização, eram
considerados de elevado risco (6, 7, 9). Os pacientes cirróticos com infecção
pelo vírus da hepatite delta (VHD) e aqueles com hepatite fulminante
apresentam menor risco (6, 8). Mais recentemente, Marzanno e colaboradores
avaliaram um grupo de pacientes transplantados por cirrose viral B que
receberam monoprofilaxia com HBIG ou profilaxia combinada (HBIG +
lamivudina) e observaram que o único fator de risco independente para a
recidiva viral B pós-TH foram os níveis de DNA do VHB no soro acima de
100.000 cópias/mL no momento do TH (27).
Entre os pacientes transplantados por hepatite B, cerca de 20 a 30% têm
diagnóstico de CHC associado. O efeito do CHC sobre o risco de reinfecção do
enxerto pelo VHB é pouco conhecido. Diversos estudos não observaram
associação entre a presença do CHC no momento do TH e maior risco de
recorrência da infecção pelo VHB pós-TH (9, 25-28). Apenas um estudo
20
3 - Objetivos
Constituiram-se objetivos específicos do presente estudo:
• Investigar os fatores de risco para a recidiva viral B pós-transplante em
pacientes submetidos a transplante hepático por doenças hepáticas
relacionadas ao vírus da hepatite B e, especificamente, se o carcinoma
hepatocelular é fator de risco para a recidiva viral B pós-transplante.
• Detectar e quantificar o cccDNA e o DNA total do VHB em amostras de
tecido tumoral e não-tumoral provenientes do fígado nativo de pacientes
com infecção crônica pelo VHB e diagnóstico de carcinoma
hepatocelular, submetidos a transplante hepático.
• Detectar e quantificar o cccDNA e o DNA total do VHB em amostras de
tecido tumoral de pacientes que apresentaram recidiva do carcinoma
hepatocelular e da infecção pelo VHB após o transplante hepático.
22
4 - Pacientes e Métodos
4.1 Pacientes
Durante o período de dezembro de 1995 a dezembro de 2004, 113
pacientes AgHBs-positivo foram submetidos a TH no Centro Hépato-Biliar,
Hospital Paul Brousse, Villejuif, França. Oitenta e nove pacientes eram do sexo
masculino e a idade mediana foi de 49 (10 – 71) anos. Setenta e três dos 113
pacientes (64,6%) tinham o diagnóstico de cirrose viral B, 26 pacientes (23%)
apresentavam cirrose viral B e delta, 10 pacientes (8,8%) foram transplantados
por hepatite fulminante causada pelo VHB, dois (1,8%), por hepatite fulminante
causada pelos vírus B e delta e dois outros (1,8%), por CHC em fígado não-
cirrótico. Dezessete dos 113 pacientes (15%) apresentavam coinfecção pelo
vírus da hepatite C (VHC) e seis pacientes (5,3%) apresentavam coinfecção
pelo vírus da imunodeficiência humana (VIH). Trinta e três dos 113 pacientes
(29,2%) tinham o diagnóstico de CHC antes do TH, confirmado pelo exame
histológico do fígado nativo. Esses dados estão resumidos na Tabela 1.
Dezesseis dentre os 33 pacientes que apresentavam CHC no momento
do TH estavam fora dos critérios de Milão (73) pela análise do fígado
explantado.
23
Tabela 1: Características dos 113 pacientes AgHBs-positivo submetidos a
transplante hepático
Doença hepática
Característica
C-VHB
(n = 73)
C-VHD
(n = 26)
HFB
(n = 10)
HFD
(n = 2)
CHC em fígado não-
cirrótico
(n = 2)
Total
(n = 113)
Sexo masculino 66 18 2 2 1 89
Mediana da idade ao TH
51 41 38 31 33 49
DNA VHB ≥ 30.000 cópias/mL
(no momento do TH)
14
(ND-8 pts)
0
(ND-1 pt)
3
(ND-7 pts)
0
(ND-1 pt) 0
17
(ND- 17 pts)
Profilaxia antiviral: HBIG + LAM, ADV
ou tenofovir 45 6 4 0 1 56
Coinfecção VHC 10 7 0 0 0 17
Coinfecção VIH 4 2 0 0 0 6
CHC no momento do TH
25 6 0 0 2 33
Quimioterapia após o TH
11 2 0 0 2 15
Abreviações: AgHBs: antígeno de superfície do vírus da hepatite B; C-VHB: cirrose hepática pelo vírus da hepatite B; C-VHD: cirrose hepática pelos vírus da hepatite B e delta; HFB: hepatite fulminante pelo vírus B; HFD: hepatite fulminante pelo vírus delta; TH: transplante hepático; ND: não disponível; HBIG: globulina hiperimune anti-HBs; LAM: lamivudina; ADV: adefovir; VHC: vírus da hepatite C; VIH: vírus da imunodeficiência humana; CHC: carcinoma hepatocelular.
24
A terapia imunossupressora consistiu em combinação de
corticosteróides, azatioprina e ciclosporina (11 pacientes), corticosteróides,
azatioprina e tacrolimus (25 pacientes), corticosteróides e tacrolimus (34
pacientes), corticosteróides e ciclosporina (27 pacientes), tacrolimus,
corticosteróides e micofenolato mofetil (16 pacientes).
Quimioterapia anti-tumoral adjuvante pós-TH foi administrada, por via
sistêmica, nos primeiros seis meses após o TH de acordo com os achados
histopatológicos ao exame do fígado explantado. Os critérios utilizados se
fundamentaram no tamanho do tumor, na presença de invasão vascular e de
neoplasia multifocal.
Espécimes de tecido tumoral e não-tumoral do fígado nativo de 16
pacientes com o diagnóstico de CHC, armazenadas a -80°C, foram utilizadas
para o estudo quantitativo do cccDNA e do DNA total do VHB. As
características desses 16 pacientes são mostradas na Tabela 2.
25
Tabela 2. Características histológicas e virológicas dos 16 pacientes AgHBs-
positivo submetidos a transplante hepático com diagnóstico de carcinoma
hepatocelular, nos quais o DNA total do VHB e o cccDNA foram quantificados
em espécimes de tumor e não-tumor do fígado nativo
Paciente
Histologia (fígado
não tumoral)
AgHBe
Terapia antiviral antes do
TH
Níveis séricos do DNA VHB
antes da terapia antiviral
(cópias/mL)
Níveis séricos do DNA VHB
no momento do TH
(cópias/mL)
Coinfecções com outros
vírus
1 Cirrose Neg
0 VHD
2 Cirrose Neg LAM+ADV 5.78 x 108 6.07 x 103
3 Cirrose Neg ADV − 0 VHC, VHD
4 Cirrose Neg 0
5 Cirrose Pos 0 VHC
6 HCA Neg LAM 2.69 x 103 1.96 x 103
7 Cirrose Neg 0
8 Cirrose − 0 VHD
9 Cirrose Neg LAM 2.65 x 104 6.37 x 103
10 Cirrose Neg 0
11 Cirrose Neg 1.42 x 105
12 Cirrose Neg 0 VHD
13 Cirrose − LAM − 0
14 Normal − 2.7 x 104
15 Cirrose − LAM + Tenofovir − 0 VIH
16 Cirrose Pos LAM+ADV 1.47 x 109 6.3 x 105
Abreviações: AgHBs: antígeno de superfície do vírus da hepatite B; cccDNA: covalently closed circular DNA; AgHBe: antígeno e do vírus da hepatite B; TH: transplante hepático; HCA: hepatite crônica ativa; Neg: negativo; Pos: positivo; − : não disponível; LAM: lamivudina; ADV: adefovir; VHD: vírus da hepatite delta; VHC: vírus da hepatite C; VIH: vírus da imunodeficiência humana.
26
Esse estudo foi aprovado pelo Comitê de Ética local (França), pelo
Comitê de Ética em Pesquisa da Universidade Federal de Minas Gerais
(COEP) (ANEXO 1) e Comitê Nacional de Ética em Pesquisa (CONEP, Brasil)
e todos os indivíduos assinaram o Termo de Consentimento Livre e Esclarecido
para participar da investigação (ANEXO 2).
4.2 Profilaxia da recidiva da hepatite B
Todos os 113 pacientes receberam HBIG por via intravenosa. Durante a
fase anhepática, foram administradas 10.000 UI de HBIG (IVHEBEX LFB, Les
Ulis, França), seguidas por 10.000 UI por dia durante seis dias. Em seguida,
durante todo o período de seguimento, 10.000 UI de HBIG eram administradas
por via intravenosa sempre que os níveis circulantes de anticorpos anti-HBs
estivessem abaixo de 150 UI/L para os pacientes com níveis indetectáveis de
DNA do VHB no soro antes do transplante e abaixo de 500 UI/L para aqueles
com DNA do VHB positivo antes do TH. Como descrito abaixo, anticorpos anti-
HBs foram quantificados semanalmente após o TH. Os pacientes que
apresentavam DNA do VHB detectável no soro antes do TH também
receberam lamivudina 100 mg/dia (Zeffix, Glaxo Wellcome, Greenford, United
Kingdom) e/ou adefovir dipivoxil 10 mg/dia (Hepsera, Gilead Sciences, Inc.,
Foster City, CA, USA) antes e após o transplante.
Cinqüenta e sete (50,4%) pacientes não receberam lamivudina ou
adefovir dipivoxil profilaticamente após o transplante e a profilaxia da recidiva
viral foi feita apenas com HBIG indefinidamente após a cirurgia. Cinqüenta e
seis (49,6%) pacientes receberam profilaxia combinada de HBIG e um análogo
27
de nucleosídeo ou de nucleotídeo. Dentre esses 56 pacientes, lamivudina foi
iniciada antes do transplante em 50 (89,3%) pacientes e imediatamente após o
mesmo em seis (10,7%) indivíduos. Em oito (14,3%) desses 56 pacientes,
adefovir dipivoxil foi associado à lamivudina antes e após o TH, devido ao
desenvolvimento de mutações de resistência à lamivudina. Em outros dois
pacientes (3,6%), lamivudina foi substituída por adefovir pelo mesmo motivo.
Cinco pacientes com coinfecção pelo VIH receberam lamivudina e tenofovir
antes e após o TH. Após o TH, todos esses 56 pacientes receberam HBIG e a
terapia antiviral associada continuamente.
4.3 Exames virológicos
A pesquisa do AgHBs no soro (Diasorin, Sallugia, Itália) foi realizada
antes do TH e a cada três meses após o mesmo. As pesquisas do AgHBe e do
anticorpo anti-HBe (BioMérieux, Marcy l’Etoile, França) e dos anticorpos anti-
delta (Diasorin, Sallugia, Itália) foram realizadas antes do TH. Os níveis de
anticorpos anti-HBs (Dade Behring, Marburg, Alemanha) foram medidos
semanalmente após o TH, durante todo o seguimento.
O DNA do VHB foi pesquisado no soro a cada três a quatro meses antes
e depois do TH, pela técnica Digene Hybrid Capture System HBV DNA (Murex
Diagnostics, Chatillon França) entre janeiro de 1996 e agosto de 1997 e pelo
método de DNA ramificado (Quantiplex, Chiron, Emervylle, CA, USA) entre
setembro de 1997 e dezembro de 2000. Após janeiro de 2001, foi utilizada a
técnica de PCR Cobas HBV Monitor (Roche Diagnostics, Meylan, França).
28
A quantificação do DNA do VHB no momento do TH, por técnica de
PCR, foi realizada, retrospectivamente, em soro armazenado, nos pacientes
transplantados antes de 2001, utilizando-se o teste Cobas Taqman HBV
(Roche Diagnostics, França), que apresenta estrita correlação com a técnica
Cobas HBV Monitor (74). Entre os 113 pacientes deste estudo, a quantificação
do DNA do VHB por técnica de PCR no momento do TH foi realizada em 96
(85%) pacientes.
4.4 Definição de recidiva viral B
A recidiva viral B após o TH foi definida como o reaparecimento do
AgHBs no soro após o TH (6).
4.5 Quantificação do cccDNA e do DNA total do VHB e m espécimes
de tecido tumoral e não-tumoral do fígado nativo de pacientes
transplantados por CHC
Werlle-Lapostolle e colaboradores descreveram técnica de PCR em
tempo real (35) para a detecção específica e quantificação do cccDNA e do
DNA total do VHB em espécimes de biópsias hepáticas. Utilizando-se essa
técnica, foram analisados no presente estudo, espécimes de tecido tumoral e
não-tumoral provenientes do fígado nativo de 16 pacientes infectados pelo
VHB, que foram submetidos ao TH e que tiveram o diagnóstico de CHC,
confirmado por exame histopatológico. Amostras de tecido tumoral de CHC e
de tecido não-tumoral do fígado explantado de pacientes AgHBs-positivo
29
foram armazenadas a -80°C, até o momento da realizaçã o da análise
experimental. O diagnóstico foi confirmado por exame histológico de cada
amostra dos espécimes congelados, antes do início dos experimentos (Figuras
1 e 2). O DNA foi extraído de cada espécime utilizando-se o kit MasterPure
DNA purification (Epicentre, Madison, Wisconsin, USA). Antes da amplificação
do cccDNA, alíquotas do DNA foram tratadas com DNase ATP-dependente
(Epicentre, Madison, Wisconsin, USA). PCR em tempo real foi realizada em um
equipamento Light-Cycler (Roche, Grenoble, França) utilizando-se volume de
20 µL por reação, contendo 20 ng de DNA (para a quantificação do cccDNA,
volume equivalente a 20 ng antes do tratamento pela DNase), 3 mmol/L de
MgCl2, 0,5 µL de primers senso e anti-senso, 0,2 µL de sonda marcada com 3’-
fluoresceine (FL), e 0,4 µL de sonda marcada 5’Red640 (R640). Os primers
senso e anti-senso utilizados foram: 5’CTCCCCGTCTGTGCCTTCT-3’ (NCCC1
nt 1548-1566) e 5’GCCCCAAAGCCACCCAAG-3’ (CCCAS2 nt 1903-1886)
para amplificação do cccDNA, respectivamente, e 5’-
CTCGTGGTGGACTTCTCTC-3’ (2RC/CCS nt 256-274) e
5’CTGCAGGATGAAGAGGAA-3’ (2RC/CCAS nt 421-404) para amplificação
do DNA intra-hepático total do VHB, respectivamente. As sondas de
hibridização foram: 5’GTTCACGGTGGTCTCCATGCAACGT-FL-3’ e 5’-R640-
AGGTGAAGCGAAGTGCA- CACGGACC-p-3’ para quantificação do cccDNA e
5’CACTCACCAACCTCCTGTCCTC-CAA-FL-3’ e 5’- R640-
TGTCCTGGTTATCGCTGGATGTGTCT-3’ para quantificação do DNA intra-
hepático total do VHB, respectivamente. A amplificação do cccDNA foi
realizada como se segue: 95°C durante 10 minutos e, em seguida, 45 ciclos a
95°C por 10 segundos, 63°C por 10 segundos, e 72°C por 20 segundos. A
30
amplificação do DNA total do VHB foi realizada como se segue: 95°C durante
10 minutos e, em seguida, 45 ciclos de 95°C por 10 segund os, 57°C por 10
segundos, e 72°C por 15 segundos. O DNA na forma rc ( relaxed circular)
extraído do soro de pacientes com viremia sabidamente positiva pôde ser
amplificado por ambos os pares de primers; no entanto, os primers cccDNA
foram aproximadamente 100 vezes menos eficazes. O tratamento prévio do
DNA extraído do soro com DNase impediu a amplificação, confirmando que a
DNase degrada as formas rc do DNA do VHB. Água foi utilizada como controle
negativo. Diluições seriadas de um plasmídeo VHB (pHBVEcoRI) serviram
como padrões para a quantificação. O cccDNA e o DNA total do VHB foram
quantificados e normalizados a valores em cópias por célula, utilizando-se o
gene celular da β-globina. A amplificação da β-globina foi realizada utilizando-
se o kit LightCycler β-globin control (Roche), segundo as recomendações do
fabricante.
31
Figura 1: Exame histológico de tecido de congelação, corado por
hematoxilina-eosina, confirmando o diagnóstico de cirrose (fígado não-
tumoral)
32
Figura 2: Exame histológico de tecido de congelação, corado por
hematoxilina-eosina, confirmando o diagnóstico de carcinoma hepatocelular
33
4.6 Análise estatística
A análise estatística foi realizada utilizando-se o software estatístico SPSS
10.0 (SPSS Inc. and Microsoft Corp., Chicago, IL). As taxas de sobrevida e de
recorrência da infecção pelo VHB foram calculadas utilizando-se curvas de
sobrevida atuarial. A análise univariada para determinar os fatores preditivos de
recorrência da infecção pelo VHB foi feita utilizando-se o método de Kaplan-
Meier e o teste de log-rank. As variáveis analisadas foram: idade, sexo,
etiologia (cirrose relacionada ao VHB, cirrose relacionada ao VHD e hepatite
fulminante), coinfecção pelo VHC, AgHBe antes do TH, níveis de DNA do VHB
no soro no momento do TH, e profilaxia com análogos de nucleosídeos ou
nucleotídeos. Para a análise de variáveis categóricas, os pacientes foram
agrupados de acordo com a presença ou ausência de cada uma delas. Para a
análise dos níveis de DNA do VHB no soro no momento do TH, diversos
pontos de corte (10.000, 30.000, 50.000, 70.000 e 100.000 cópias/mL) foram
investigados e o menor valor estatisticamente significativo foi selecionado. A
análise multivariada foi realizada utilizando-se o modelo de regressão de Cox.
As variáveis para as quais os valores de P foram inferiores a 0,25 na análise
univariada foram incluídas no modelo de regressão de Cox para se identificar
os fatores preditivos independentes do risco de recorrência da infecção pelo
VHB após o TH. Valor de P inferior a 0,05 foi considerado estatisticamente
significativo.
O teste do qui-quadrado ou o teste exato de Fisher foram utilizados para se
analisar as diferenças entre as freqüências de recorrência da infecção pelo
VHB em subgrupos de pacientes, quando apropriado.
34
Para a análise do DNA total do VHB e do cccDNA nas células tumorais e
não-tumorais, como as variáveis contínuas não apresentavam distribuição
Normal, foram utilizados os testes de Mann-Whitney ou de Wilcoxon, esse
último para a análise de amostras pareadas. As correlações entre variáveis
foram calculadas utilizando-se o coeficiente de correlação de Spearman.
36
5 - Resultados
5.1 Tempo de seguimento e freqüência global de reco rrência da
infecção pelo VHB
As características dos 113 pacientes estudados são mostradas na
Tabela 1. Após o TH, os pacientes foram acompanhados por período mediano
de 1.612 dias (53 meses), variando de sete a 3.804 dias (0,25 a 125 meses). O
AgHBs tornou-se positivo no soro em 14 (12,4%) pacientes, em um tempo
mediano de 15 meses (0,5 a 60 meses). No momento em que o AgHBs tornou-
se positivo, o DNA do VHB foi detectado no soro em 10 (71,4%) desses 14
pacientes (mediana: 6,21 x 106 cópias/mL; 929 a > 6,14 x 108 cópias/mL). As
taxas atuariais de recorrência do VHB em um, dois, cinco e oito anos foram
5,6%, 9,6%, 15,1% e 15,1% respectivamente (Tabela 3).
5.2 Fatores preditivos de maior risco de recorrênci a da infecção
pelo VHB
Na análise univariada, o diagnóstico de CHC, os níveis de DNA do VHB
no soro ≥ 30.000 cópias/mL no momento do TH e a monoprofilaxia com HBIG
(versus profilaxia combinada de HBIG com um análogo de nucleosídeo ou
nucleotídeo) foram as variáveis associadas a maior risco de recorrência da
infecção viral B pós-transplante (P < 0,0001, P = 0,0016 e P = 0,019; Figuras
3, 4 e 5, respectivamente; Tabela 3).
37
Tabela 3. Risco atuarial de recorrência da infecção pelo VHB em pacientes
AgHBs-positivo submetidos a transplante hepático, em relação às variáveis
analisadas
Taxas atuariais de recorrência do VHB após o TH Variável
Valor de P
AgHBs positivo
pós-TH (n) 1 ano 2 anos 5 anos 8 anos
Idade ≥ 50 years
0,06*
10/52
7,8%
11,9%
24%
24%
Sexo masculino
0,17*
3/89
7,1%
12,2%
16,6%
16,6%
C-VHB
0,078*
12/73
8,6%
13,3%
20,2%
20,2%
C-VHD
0,36*
2/26
0,0%
4,0%
8,8%
8,8%
HFB
0,21*
0/10
0,0%
0,0%
0,0%
0,0%
Coinfecção VHC
0,36*
1/17
0,0%
6,7%
6,7%
6,7%
CHC antes do TH
< 0,0001*
11/33
16,0%
26,7%
42,3%
42,3%
AgHBe positivo
0,73*
2/15
0,0%
7,1%
18,8%
18,8%
DNA VHB ≥ 30.000 cópias/mL no momento do
TH
0,0016*
6/17
24.7%
31,6%
48,7%
48,7%
Profilaxia antiviral (LAM,
ADV ou Tenofovir)
associada à HBIG
0,019* 3/56 1,8% 3,7% 6,4% 6,4%
Monoprofilaxia HBIG
0,019* 11/57 9,9% 16,3% 24,3% 24,3%
Global
14/113 5,6% 9,6% 15,1% 15,1%
*teste log-rank
Abreviações: AgHBs: antígeno de superfície do vírus da hepatite B; TH: transplante hepático; C-VHB:
cirrose hepática pelo vírus da hepatite B; C-VHD: cirrose hepática pelos vírus das hepatitis B e delta;
HFB: hepatite fulminante pelo vírus B; VHC: vírus da hepatite C; CHC: carcinoma hepatocelular; AgHBe:
antígeno e do vírus da hepatite B; LAM: lamivudina; ADV: adefovir HBIG: globulina hiperimune anti-HBs.
38
Figura 3: Risco atuarial de recorrência da hepatite B em 33 pacientes AgHBs-
positivo com carcinoma hepatocelular (CHC) associado, submetidos a
transplante hepático (TH), e em 80 pacientes AgHBs-positivo sem CHC
submetidos a TH (teste log rank).
39
Figura 4: Risco atuarial de recorrência da hepatite B pós-transplante hepático
em 17 pacientes com DNA do vírus da hepatite B (VHB) no soro ≥ 30.000
cópias/mL e em 79 pacientes com DNA do VHB < 30.000 cópias/mL no
momento do transplante (teste log rank).
40
Figura 5: Risco atuarial de recorrência da hepatite B pós-transplante hepático
(TH) em 57 pacientes que receberam apenas imunoglobulina anti-HBs (HBIG)
após o TH (grupo monoprofilaxia) e em 56 pacientes que receberam lamivudina
e/ou adefovir associado(s) à HBIG (grupo profilaxia combinada) (teste log
rank).
41
Na análise multivariada, os fatores independentes preditivos de maior
risco de recidiva viral B foram: diagnóstico de CHC no momento do TH (risco
relativo [RR], 8,2; intervalo de confiança a 95% [IC 95%], 2,2 - 30,3; P = 0,002),
DNA do VHB no soro ≥ 30.000 cópias/mL no momento do transplante (RR,
4,96; IC 95%, 1,6 - 15,6; P = 0,006) e ausência de profilaxia com análogo de
nucleosídeo ou nucleotídeo associado à HBIG (RR, 5,0; IC 95%, 1,2 - 20,0; P =
0,024). Os pacientes com CHC que receberam quimioterapia anti-tumoral pós-
TH apresentaram maior risco de recorrência da infecção pelo VHB (RR, 19,0;
IC 95%, 4,2 - 86,9; P < 0,0001) do que aqueles com CHC que não receberam
quimioterapia pós-TH (RR, 4,8; IC 95%, 1,07 - 21,6; P = 0,04).
A recidiva viral B foi mais freqüente nos pacientes com DNA do VHB ≥
30.000 cópias/mL no momento do TH que receberam monoprofilaxia com HBIG
(P = 0,003), mas não no subgrupo de pacientes que receberam profilaxia
combinada (HBIG + análogo nucleosídeo ou nucleotídeo) (P = 0,504) (Tabela
4). A recorrência da infecção viral B foi mais freqüente nos pacientes com CHC,
independentemente do uso de monoprofilaxia (P = 0,006) ou profilaxia
combinada (P = 0,010) (Tabela 4). Nenhum paciente que recebeu profilaxia
combinada e que não tinha o diagnóstico de CHC apresentou recorrência da
infecção viral B após o TH (Tabela 4).
42
Tabela 4: Taxas de recorrência da infecção pelo vírus da hepatite B em
pacientes com e sem carcinoma hepatocelular associado no momento do
transplante hepático (TH) e com DNA do VHB no soro ≥ e < 30.000 cópias/mL
no momento do TH, que receberam monoprofilaxia (HBIG) ou profilaxia
combinada (HBIG + lamivudina e/ou adefovir)
Monoprofilaxia com HBIG
Característica Total Recorrência do VHB após o
TH Valor de P
CHC 20 8 (40,0%)
Sem CHC 37 3 (8,1%) 0,006*
DNA VHB ≥ 30.000
cópias/mL 7 5 (71,4%)
DNA VHB < 30.000
cópias/mL 40 5 (12,5%)
0,003*
Profilaxia combinada (HBIG + lamivudina e/ou adefov ir)
Característica Total Recorrência do VHB após o
TH Valor de P
CHC 13 3 (23,1%)
Sem CHC 43 0 (0,0%) 0,010*
DNA VHB ≥ 30.000
cópias/mL 10 1 (10,0%)
DNA VHB < 30.000
cópias/mL 39 2 (5,1%)
0,504*
* Teste exato de Fisher
Abreviações: TH: transplante hepático; HBIG: globulina hiperimune anti-HBs; VHB:
vírus da hepatite B; CHC: carcinoma hepatocelular.
43
5.3 Evolução da reinfecção pelo VHB
Entre os 14 pacientes que apresentaram recidiva da hepatite B, nove
(64,3%), desenvolveram hepatite aguda. Insuficiência hepática aguda ocorreu
em três pacientes, entre os quais, um foi submetido a retransplante e faleceu
no pós-operatório devido a choque séptico; outro faleceu devido a insuficiência
hepática; e o terceiro evoluiu com recuperação da função hepática, mas
faleceu 10 meses depois devido à recorrência do CHC. Entre os 11 pacientes
restantes, cinco faleceram devido à recidiva do CHC e seis estão vivos, com
função hepática preservada (três pacientes com DNA do VHB no soro
indetectável por técnica de PCR e, nos outros três, DNA do VHB positivo em
baixos níveis).
5.4 Reinfecção pelo VHB nos pacientes transplantado s com CHC
Nos 33 pacientes com AgHBs positivo no soro que foram submetidos a
TH e apresentavam CHC associado, 11 (33.3%) apresentaram recorrência da
hepatite B. As taxas atuariais de recidiva da infecção pelo VHB nos pacientes
com CHC em um, dois, cinco e oito anos foram 16,0%, 26,7%, 42,3% e 42,3%,
respectivamente (Figura 3, Tabela 3). Sete dentre esses 11 pacientes também
apresentaram recidiva do CHC (Figura 6) e o diagnóstico de recidivas da
infecção viral B e do CHC foram feitos em intervalos de tempo variáveis
(Tabela 5).
44
Figura 6: Organograma mostrando pacientes transplantados com carcinoma
hepatocelular (CHC), que apresentaram ou não recidiva tumoral e recorrência
da hepatite B após o transplante de fígado.
Ausência de recidiva do CHC (n = 23)
Ausência de recorrência
do VHB (n = 3)
Recorrência do VHB (n = 4)
Ausência de recorrência
do VHB (n = 19)
Recidiva CHC (n = 10)
Pacientes com CHC
AgHBs +
submetidos a TH
(n = 33)
Recorrência do VHB (n = 7)
45
Sete dentre os 10 pacientes que apresentaram recidiva do CHC não
estavam dentro dos critérios de Milão (73), no momento do TH.
Em um desses pacientes, a recidiva viral B ocorreu nove meses antes
do diagnóstico de recorrência do CHC na glândula supra-renal. O DNA do VHB
foi detectado, por técnica de PCR, na metástase supra-renal, mas não no
enxerto hepático no mesmo momento. O AgHBs no soro tornou-se negativo
após a ressecção da metástase supra-renal e voltou a ser detectado após uma
segunda recidiva tumoral na mandíbula (Figura 7).
A recorrência da infecção viral B foi mais freqüente nos pacientes que
apresentaram recidiva do CHC (7/10) após o transplante do que naqueles que
não apresentaram (4/23) (P= 0,0001) (Figura 8).
Quinze (45,5%) dos 33 pacientes que apresentavam CHC antes do TH
receberam quimioterapia após o transplante. Entre estes, nove (60%)
apresentaram recorrência do CHC e, entre esses nove, a recorrência viral B
ocorreu em seis pacientes. Seis (40%) dentre os 15 pacientes que receberam
quimioterapia não apresentaram recidiva do CHC. Apenas um desses seis
pacientes apresentou recidiva viral B, alguns dias após um ciclo de
quimioterapia (Figura 9).
46
Tabela 5: Características clínicas e virológicas, momento da recidiva do CHC e da
recorrência da infecção viral B após o TH e resultados da quantificação do DNA total
do VHB e do cccDNA no tecido do CHC recidivado pós-TH, em sete pacientes que
apresentaram recidiva do VHB e do CHC
Pts
DNA VHB no soro no momento
do TH
Profilaxia da recidiva
viral B
Recorrência do VHB após
o TH (meses)
Recidiva do CHC
após o TH (meses)
Local da recidiva do CHC
DNA VHB*
(cópias/ célula)
cccDNA* (cópias/ célula)
7 Neg HBIG 6,0 12,0 Anal 5.326,0 −
8 Neg HBIG 11,5 9,5 Hepática 147,6 7,0 x 10-4
11 Neg HBIG 15,0 13,5 Hepática 13,1 −
17 Neg HBIG 24,0 22,5 Óssea Neg −
18 Neg HBIG 2,5 1,5 Óssea − −
19 Neg após LAM
HBIG + LAM 27,0 36,0 Supra-
renal 1.970,0 Neg
20 21.600
cópias/mL após ADV
HBIG + ADV 27,0 31,0 Supra-
renal 0,27 0,52
*No tecido tumoral (recidiva do CHC pós-TH)
Abreviações: CHC: carcinoma hepatocelular; TH: transplante hepático; HBIG: globulina
hiperimune anti-HBs; LAM: lamivudina; ADV: adefovir; cccDNA: covalently closed circular DNA;
Neg: negativo; − : não disponível.
47
Figura 7: Paciente submetido a transplante hepático (TH) devido aos
diagnósticos de cirrose viral B e carcinoma hepatocelular (CHC). Antes do
transplante, a quantificação do DNA do VHB no soro era de 4,76 x 105 e
tornou-se negativa após o tratamento com lamivudina. Após o TH, como
profilaxia da recidiva viral B, ele recebeu globulina hiperimune anti-hepatite B
(HBIG) e lamivudina. Vinte e sete meses após o TH, ocorreu recorrência da
infecção pelo VHB. Nove meses mais tarde, foi diagnosticada recidiva do CHC
na glândula supra-renal. Após ressecção da metástase supra-renal, o AgHBs
no soro tornou-se negativo. Em seguida a uma nova recidiva do CHC
(mandibular), o AgHBs e o DNA do VHB no soro tornaram-se positivos. O
paciente evoluiu a óbito devido à recidiva do CHC seis anos após o TH.
0
2000
4000
6000
8000
10000
Tempo em meses
DN
A V
HB
(có
pias
/mL)
(s
oro)
DNA VHB
12 24 36 48 60 72
AgHBs − − − − − − − − − − + + + + + − − − − − − − − + + + + + + +
Rec
idiv
a C
HC
na
glân
dula
sup
ra-r
enal
Res
secç
ão d
a m
etás
tase
supr
a-re
nal
Rec
idiv
a C
HC
na
man
díbu
la
Óbi
to (
CH
C)
48
Figura 8: Risco atuarial de recorrência da hepatite B após o transplante
hepático (TH) em 10 pacientes que apresentaram recidiva do carcinoma
hepatocelular (CHC) após o TH e em 23 pacientes que não apresentaram
recidiva do CHC após o TH (total de 33 pacientes AgHBs-positivo
transplantados com CHC).
49
Figura 9: Organograma mostrando pacientes transplantados com carcinoma
hepatocelular (CHC), que receberam quimioterapia, que apresentaram ou não
recidiva tumoral e recorrência da hepatite B após o transplante de fígado.
Ausência de recidiva do CHC (n = 6)
Ausência de recorrência
do VHB (n = 3)
Recorrência do VHB (n = 1)
Ausência de recorrência
do VHB (n = 5)
Recidiva CHC (n = 9)
Pacientes com CHC que
receberam quimioterapia (15/33)
Recorrência do VHB (n = 6)
50
5.5 Sobrevida global
A curva de sobrevida atuarial global dos 113 pacientes AgHBs-positivo
submetidos a TH é mostrada na Figura 10. Na análise univariada, os fatores
preditivos de menor sobrevida foram a presença de CHC (P = 0,025), níveis de
DNA do VHB no soro no momento do TH ≥ 30.000 cópias/mL (P = 0,016),
recorrência da infecção pelo VHB (P = 0,003) e recidiva do CHC (P < 0,0001).
Os fatores independentes preditivos de menor sobrevida foram a presença de
níveis séricos de DNA do VHB no momento do TH ≥ 30.000 cópias/mL (RR,
3,04; IC 95%, 1,27 - 7,24; P = 0,01) e a recidiva do CHC (RR, 7,6; IC 95%, 3,1 -
18,8; P < 0,001).
51
Figura 10: Sobrevida global dos 113 pacientes AgHBs-positivo transplantados
no período de dezembro de 1995 a dezembro de 2004.
52
5.6 Níveis de cccDNA e de DNA total do VHB no CHC e fígado não-
tumoral do fígado nativo
Os níveis de cccDNA e de DNA total do VHB nas células tumorais e
não-tumorais do fígado nativo são mostrados nas Figuras 11A e 11B,
respectivamente e na Tabela 6 (pág. 55). O cccDNA foi detectado em
espécimes de CHC do fígado explantado em 11 (68,8%) pacientes e em
espécimes de tecido hepático não-tumoral do fígado nativo em 12 (75%) dentre
os 16 pacientes testados. DNA total do VHB, em tecidos tumoral e não-tumoral
do fígado explantado, foi detectável em todos os 16 pacientes. Não foi
observada diferença significativa entre as medianas dos níveis de cccDNA
entre as amostras pareadas de tecido tumoral e não-tumoral (0,023 vs. 0,024
cópias/célula, respectivamente, P = 0,7) (Figura 11A) como também não foi
observada diferença significativa entre as medianas dos níveis de DNA total do
VHB entre as amostras pareadas de tecido tumoral e não-tumoral (49,3 versus
6,4 cópias/célula, respectivamente, P = 0,9) (Figura 11B). Nos pacientes que
receberam tratamento antiviral com lamivudina e/ou adefovir antes do
transplante, as medianas dos níveis de cccDNA nas células tumorais (0,41
cópias/célula) e nas células não-tumorais (4,87 cópias/célula) foram
significativamente maiores do que aquelas encontradas nos pacientes que não
necessitaram de tratamento antiviral antes do transplante (mediana = 0
cópias/célula nas células tumorais, P = 0,03 e mediana = 0,008 cópias/célula
nas células não-tumorais, P = 0,03).
Foram observadas correlações positivas significativas entre os níveis de
DNA total do VHB nas células tumorais e não-tumorais (r = 0,63, P = 0,009),
53
entre os níveis de cccDNA nas células tumorais e não-tumorais (r = 0,66, P =
0,006), e entre os níveis de DNA total do VHB e os níveis de cccDNA nas
células não-tumorais (r = 0,5, P = 0,04). No entanto, não foi observada
correlação significativa entre os níveis de DNA total do VHB e os níveis de
cccDNA nas células tumorais (r = 0,26, P = 0,33).
Observou-se correlação positiva entre o DNA do VHB no soro no
momento do TH e os níveis de DNA do VHB nas células tumorais (r = 0,627; P
= 0,009) e não-tumorais (r = 0,669; P = 0,005) e, também, com os níveis de
cccDNA nas células tumorais (r = 0,508; P = 0,045) e não-tumorais (r = 0,652;
P = 0,006).
5.7 Níveis de cccDNA e de DNA total do VHB no tecid o tumoral
após a recorrência do CHC
Nos sete pacientes que apresentaram recidiva do CHC e do VHB após o
TH, foi pesquisada a presença do cccDNA no tecido tumoral pós-recidiva em
três, sendo o cccDNA detectado em dois casos (recidiva hepática em um
paciente e supra-renal em outro). A presença do DNA do VHB foi investigada
no tecido tumoral pós-recidiva em seis pacientes e foi detectada em cinco.
Esses resultados são mostrados na Tabela 5.
54
11 A
11 B
Figura 11: (A) Níveis de cccDNA em células tumorais do carcinoma hepatocelular (CHC) e em células hepáticas não-tumorais do fígado nativo em pacientes AgHBs-positivo, submetidos a transplante hepático (TH). (B) Níveis de DNA total do VHB em células tumorais do CHC e em células hepáticas não-tumorais do fígado nativo em pacientes AgHBs-positivo, submetidos a TH. Cada ponto representa um paciente e as barras indicam os valores da mediana. LID: limite inferior de detecção.
0.001
0.01
0.1
1
10
100
1000
10000
DN
A to
tal d
o V
HB
(c
ópia
s/cé
lula
)
Células tumorais
Células não- tumorais
0.000001
0.00001
0.0001
0.001
0.1
10
100
1000
cccD
NA
(c
ópia
s/cé
lula
)
Células tumorais
Células não - tumorais
LID
1
0.01
55
Tabela 6: Resultados da quantificação do DNA do VHB e do cccDNA em
espécimes de tumor e não-tumor do fígado explantado de 16 pacientes AgHBs-
positivo com carcinoma hepatocelular submetidos a transplante hepático.
Abreviações: VHB: vírus da hepatite B; cccDNA: covalently closed circular DNA; T:
tumor; NT: não-tumor.
Pacientes DNA VHB/T
(cópias/célula)
DNA VHB/NT
(cópias/célula)
cccDNA/T
(cópias/célula
cccDNA/NT
(cópias/célula)
1 65,5 2,14 0,0 0,0077
2 61,3 266,0 0,053 7,33
3 39,0 4,26 0,68 0,03
4 0,02 0,022 0,0086 0,07
5 1,06 0,081 0,037 0,0
6 27,2 16,5 226,0 1,33
7 0,16 0,13 0,0 0,02
8 59,6 1,29 0,0 0,0
9 86,4 46,9 0,0023 20,2
10 0,006 0,17 0,0 0,0
11 530,0 1.576 3,78 8,5
12 0,06 137,0 0,0 0,0
13 0,43 7,23 9,8 5,01
14 99,0 5,57 0,042 0,01
15 545,0 66,2 0,00007 0,0016
16 106,0 1.007,0 0,41 4,87
57
6 - Discussão
Neste estudo, analisou-se o risco de recorrência da infecção pelo VHB
em 113 pacientes AgHBs-positivo, que foram submetidos a transplante de
fígado em um único centro francês, no período de dezembro de 1995 a
dezembro de 2004. Os resultados corroboram o fato de que as doenças
hepáticas relacionadas ao VHB tornaram-se uma boa indicação ao TH, desde a
segunda metade da década de 1990 – a sobrevida global em oito anos foi de
71,3% e o risco atuarial de recorrência da infecção viral B em oito anos foi de
15,1%. Evidenciou-se que, na presente era, com uma profilaxia anti-VHB eficaz
e técnicas sensíveis de quantificação do DNA do VHB, a carga viral no
momento do TH permanece sendo fator preditivo independente do risco de
recorrência da infecção viral B pós-TH, entretanto, com um ponto de corte
inferior àquele previamente descrito. Também foi observada, no presente
estudo, associação independente entre presença do CHC no momento do
transplante e risco de recorrência viral B pós-TH. Além disso, nos pacientes
com diagnóstico de CHC, a recidiva do CHC foi associada à recorrência da
infecção viral B.
Com o objetivo de identificar os fatores de risco para a recidiva viral B na
presente era, foi selecionada essa coorte de pacientes, submetidos ao TH,
após a disponibilidade do análogo de nucleosídeo, lamivudina, e da utilização
de estratégia mais eficaz de profilaxia da recorrência da infecção viral.
Os resultados encontrados reforçam os efeitos benéficos da profilaxia
combinada de um análogo de nucleosídeo ou nucleotídeo, iniciado antes do
58
TH, com HBIG, e mantidos indefinidamente após o TH. Tal conduta foi fator
preditivo independente de menor risco de recorrência da infecção viral B, em
relação à monoprofilaxia com HBIG. Os pacientes que receberam lamivudina,
adefovir e/ou tenofovir associado(s) a HBIG apresentaram taxas atuariais de
recorrência da hepatite B em dois, cinco e oito anos de 3,7%, 6,4% e 6,4%,
respectivamente. Esses resultados são comparáveis àqueles obtidos em outros
estudos nos quais a eficácia da profilaxia combinada foi avaliada (9, 75).
No presente estudo, os níveis séricos de DNA do VHB, no momento do
TH, foram fator preditivo independente do risco de recorrência da infecção pelo
VHB. Pacientes com níveis de DNA do VHB no momento do TH ≥ 30.000
cópias/mL apresentaram taxas de recorrência da infecção pelo VHB
significativamente maiores do que aqueles cuja carga viral encontrava-se em
níveis inferiores a 30.000 cópias/mL. Esse resultado confirma que níveis
elevados de DNA do VHB pré-TH representam fator preditivo de maior risco da
recorrência do VHB. No entanto, um ponto de corte inferior ao observado em
estudos anteriores (6, 8, 9, 14, 27, 76, 77) foi detectado, indicando a
importância de maior redução da carga viral antes do TH. Marzanno e
colaboradores (27) observaram correlação linear positiva entre a carga viral no
momento do TH, determinada por PCR, e o risco de recidiva viral B – a
presença no soro do DNA do VHB acima de 100.000 cópias/mL no momento
do TH foi significativamente associada ao risco de recorrência da hepatite B
(27). No entanto, analisando-se os resultados daquele estudo, é possível
observar que, no grupo de pacientes que recebeu apenas HBIG, não ocorreu
recidiva do VHB naqueles com carga viral menor que 10.000 cópias/mL;
entretanto, ela foi observada em 16% dos pacientes com DNA do VHB entre
59
10.000 e 99.999 cópias/mL, sugerindo que, provavelmente, o melhor valor do
ponto de corte esteja entre 10.000 e 100.000 cópias/mL, como observado no
nosso estudo.
Pela primeira vez, demonstrou-se que a presença do CHC no momento
do TH constitui fator de risco independente para a recorrência da infecção pelo
VHB. Entre os 14 pacientes que apresentaram recorrência da hepatite B após o
TH, 11 (78,6%) tiveram o diagnóstico de CHC confirmado por exame
histológico do fígado explantado e sete (50%), apresentaram recidiva do CHC
pós-TH. Diversos estudos não mostraram maior risco de recorrência da
infecção viral B em pacientes transplantados com CHC (9, 25-28). Em um
estudo prévio, a recorrência da infecção viral B ocorreu em maior freqüência
nos pacientes AgHBs-positivo transplantados com CHC no momento do TH e
os piores resultados nesse grupo de indivíduos foi atribuído principalmente à
reinfecção do enxerto pelo VHB e não à recidiva tumoral (29). No entanto,
neste último, grande parte dos pacientes não recebeu nenhuma profilaxia da
recorrência viral B. Em estudo de Anselmo e colaboradores (75), apesar do
CHC não ter sido fator de risco independente para a infecção viral B recorrente,
no grupo de pacientes com CHC, a causa predominante de óbito foi a
recorrência da hepatite B (64%), seguida pela recidiva do CHC (23%). No
presente estudo, onde o CHC foi um fator de risco independente para a
recorrência da infecção viral, a recidiva do CHC e não da hepatite B foi a
principal causa de óbito no grupo de pacientes transplantados que
apresentavam CHC. Essa diferença em relação ao estudo de Anselmo e
colaboradores (75) deve-se, provavelmente, ao fato de, na presente
investigação, ter sido estudada uma coorte mais recente de pacientes, em
60
época na qual os análogos de nucleosídeos/nucleotídeos estavam disponíveis
e foram utilizados no tratamento dos pacientes que apresentaram recorrência
da infecção pelo VHB.
No grupo de pacientes deste estudo que recebeu profilaxia combinada,
a recorrência do VHB não ocorreu em freqüência significativamente maior
naqueles indivíduos com DNA do VHB no soro ≥ 30.000 cópias/mL no
momento do TH; além disto, entre os pacientes que receberam profilaxia
combinada, nenhum paciente transplantado sem CHC apresentou recorrência
viral B, sugerindo que o CHC é o principal fator de risco para a recorrência viral
B em pacientes que recebem HBIG associada a um análogo de nucleosídeo
e/ou nucleotídeo como profilaxia da recorrência viral.
Diversos mecanismos podem estar envolvidos nas maiores taxas de
recorrência viral B em pacientes com CHC. É possível que a quimioterapia,
administrada durante os primeiros meses pós-transplante, contribua para
aumentar o risco da recidiva viral. A reativação da replicação do VHB é
complicação freqüente e reconhecida em pacientes com infecção crônica pelo
VHB que recebem quimioterapia para o tratamento de neoplasia (78 - 81).
Entretanto, de acordo com os nossos resultados, a maioria dos pacientes que
receberam quimioterapia pós-TH e apresentaram recorrência da infecção pelo
VHB, também apresentaram recidiva do CHC (seis recidivas do CHC em sete
pacientes que recidivaram a hepatite B). Somente um paciente que recebeu
quimioterapia pós-transplante apresentou recorrência apenas da infecção viral
B, sem recidiva do CHC. Esse dado sugere que a recidiva do CHC, e não a
quimioterapia, seja, provavelmente, o principal fator responsável pelo aumento
do risco da recorrência da infecção viral B nesse grupo de pacientes. O maior
61
risco relativo de recidiva viral B observado nos pacientes com CHC que
receberam quimioterapia é provavelmente devido à seleção de pacientes com
doença tumoral mais avançada e, portanto, com maior risco de recidiva do
CHC, para receber esse tratamento. Outra possível explicação para a maior
freqüência de recorrência do VHB pós-TH nos pacientes com CHC é a
ocorrência de defeitos na imunidade celular e na produção de citocinas que são
observados nesses indivíduos (82). No entanto, estas não são, provavelmente,
as únicas razões. De fato, a associação significativa entre a presença do CHC
no momento do TH e a recorrência da infecção viral B e entre as recorrências
do tumor e da hepatite B sugerem a possibilidade de replicação viral e
produção de vírions pelas células do CHC, que funcionaria, portanto, como
reservatório do VHB. O desaparecimento do AgHBs do soro de um paciente
que apresentou recorrências do VHB e do CHC após a ressecção de
metástase supra-renal, e o seu reaparecimento após uma segunda recidiva do
CHC também reforçam essa hipótese. Essa idéia é ainda reforçada pelo fato
de que, neste paciente, o DNA do VHB foi detectável na metástase supra-renal,
mas não no parênquima hepático do fígado transplantado, em biópsia hepática
realizada no mesmo momento da ressecção de tal metástase.
O cccDNA foi detectado em células do CHC do fígado nativo de 11 dos
16 pacientes testados e em 12 espécimes pareados de tecido hepático não-
tumoral. O cccDNA também foi detectado em tecido tumoral proveniente do
CHC recidivado após o TH em dois dentre três pacientes testados, que
apresentaram recidiva do CHC e do VHB. Esses resultados sugerem
fortemente a hipótese de que a replicação viral B pode ocorrer em células do
CHC. Micrometástases do CHC poderiam comportar-se como potenciais
62
reservatórios para a reinfecção do enxerto pelo VHB. Após a recidiva do CHC,
com o aumento da massa tumoral, a produção viral pelo tumor aumentaria o
consumo de HBIG o que, finalmente, acabaria por exceder a capacidade desta
de neutralizar todos os vírions produzidos.
Dois mecanismos principais foram propostos para explicar a reinfecção
do enxerto pelo VHB após o TH: (i) o enxerto poderia ser infectado por vírions
circulantes não neutralizados, devido à elevada carga viral, resultando em
baixo nível de replicação e seleção de variantes resistentes à HBIG, com
substituições na proteína de superfície – especialmente no determinante “a” (83
- 85); e (ii) a origem da reinfecção do enxerto poderia ser reservatórios extra-
hepáticos, como as células mononucleares do sangue periférico (85-87), ou
possivelmente, como demonstrado no presente estudo, metástases do CHC.
Existem poucos dados na literatura sobre a quantificação dos níveis de
DNA do VHB intra-hepático nos tecidos tumoral e não-tumoral em pacientes
com CHC. Zanella e colaboradores (32) quantificaram o DNA do VHB intra-
hepático em tecido hepático tumoral e não-tumoral, utilizando técnica de PCR
em tempo real. Entretanto, a técnica utilizada nesse estudo não permite a
distinção entre as formas cccDNA e rcDNA.
Wong e colaboradores (34) quantificaram o DNA total do VHB e os
níveis de cccDNA em tecido hepático tumoral e não-tumoral em pacientes com
CHC e detectaram níveis significativamente maiores de cccDNA em tecido
tumoral que em tecido não-tumoral adjacente. No entanto, nesse estudo, foi
utlizada a técnica Invader®, cuja especificidade pode ser questionada, uma vez
que, em alguns estudos onde ela foi utilizada, foram observados níveis de
cccDNA no soro entre 104 - 106 cópias/mL, o que sugere que a mesma possa
63
detectar também a forma rcDNA e não apenas cccDNA (50, 88). Pollicino e
colaboradores (33), utilizando técnica de nested PCR após digestão dos
extratos de DNA por nuclease, detectaram cccDNA em espécimes de tumor e
não-tumor em 46,7% de 30 pacientes com hepatite B oculta. Nesse estudo,
também foi realizada PCR com transcrição reversa em 10 espécimes de tumor
e não-tumor positivos para o cccDNA, sendo o RNA do VHB detectado em
todos eles, o que demonstra atividade de transcrição persistente.
No presente estudo, utilizou-se uma técnica de PCR em tempo real
recentemente desenvolvida (35), que permite quantificar os níveis de cccDNA
no tecido hepático, cuja especificidade baseia-se em duas etapas
fundamentais: tratamento com DNase ATP-dependente para digerir
intermediários replicativos não-cccDNA, e utilização de primers localizados em
ambos os lados do intervalo da forma rcDNA, para amplificar preferencialmente
o cccDNA.
Os níveis medianos detectados de cccDNA e de DNA total do VHB
foram comparáveis àqueles obtidos em pacientes AgHBs-positivo (AgHBe-
negativo, anticorpo anti-HBe-positivo) em um outro estudo em que a mesma
técnica foi utilizada (35). Nesse mesmo estudo, os níveis de cccDNA e do DNA
total do VHB foram positivamente correlacionados com a carga viral (DNA do
VHB) no soro dos pacientes (35). Da mesma forma, no presente estudo,
encontramos correlação positiva entre os níveis de DNA total do VHB e do
cccDNA nas células tumorais e não-tumorais do fígado explantado, com os
níveis séricos do DNA do VHB no momento do TH.
Os pacientes que receberam tratamento antiviral com lamivudina e/ou
adefovir antes do transplante apresentaram níveis mais elevados de cccDNA
64
nas células tumorais e não-tumorais, quando comparados àqueles que não
tiveram indicação de tratamento antiviral pré-TH. Esse resultado sugere que a
redução espontânea da viremia está associada a uma diminuição mais eficaz
dos níveis intra-hepáticos de cccDNA, do que aquela induzida por tratamento
antiviral. Tais dados também corroboram os achados de outros estudos que
mostraram a persistência do cccDNA apesar da terapia com análogos de
nucleosídeos ou nucleotídeos (35, 49).
No presente estudo, não se observou diferença significativa entre os
níveis de DNA do VHB e os níveis de cccDNA entre as células tumorais do
CHC e as células hepáticas não-tumorais. Nos estudos de Wong e
colaboradores (34) e Zanella e colaboradores (32), os níveis de DNA total do
VHB nos tecidos tumoral e não-tumoral também foram comparáveis.
Entretanto, no estudo de Wong e colaboradores (34), no qual a técnica
Invader® foi utilizada, a mediana dos níveis encontrados de cccDNA no tecido
tumoral foi significativamente superior àquela observada no tecido não-tumoral.
Os dados do presente estudo apontam para a possível replicação do
VHB nas células tumorais e podem parecer contraditórios em relação a estudos
prévios (23, 24). No entanto, previamente, a ausência de replicação em tecidos
tumorais foi sugerida utilizando-se técnicas de hibridização molecular e
Southern blot, muito menos sensíveis que as atuais técnicas de PCR. Nesse
sentido, os níveis encontrados de DNA total e cccDNA do VHB nos tecidos
tumorais não foram muito elevados, o que poderia explicar a necessidade das
técnicas atuais mais sensíveis para a sua detecção.
66
7 – Conclusões • Os fatores de risco independentes para a recorrência da infecção viral B
nessa coorte de 113 pacientes AgHBs-positivo submetidos a transplante
hepático foram a existência de carcinoma hepatocelular no momento do
transplante, a presença de viremia ≥ 30.000 cópias/mL, detectada por
técnica de reação de polimerase em cadeia, no momento do transplante
e a monoprofilaxia com HBIG (vs. profilaxia combinada de HBIG e
análogo de nucelosídeo e/ou de nucleotídeo).
• O cccDNA e o DNA do VHB foram detectados em 69% e 100% das
amostras de tumor do fígado nativo. Não foram observadas diferenças
estatisticamente significativas dos níveis de cccDNA e de DNA total do
VHB entre espécimes de tumor e não-tumor do fígado nativo.
• A recorrência do CHC e da hepatite B em sete pacientes, o
desaparecimento do AgHBs após a ressecção de metástase supra-renal
do CHC em um desses pacientes e a presença do cccDNA no tecido
tumoral do fígado nativo e pós-recidiva do CHC sugerem a ocorrência de
replicação viral B em células do CHC e, também, um provável papel
dessa replicação na recorrência viral B nesse grupo de pacientes.
68
8 - Referências bibliográficas
1- Lee WM. Hepatitis B virus infection. N Engl J Med 1997; 24: 1733-1745.
2- Adam R, McMaster P, O’Grady JG, Castaing D, Klempnauer JL,
Jamieson N, et al and the European Liver Transplant Association.
Evolution of Liver Transplantation in Europe: Report of the European
Liver Transplant Registry. Liver Transplantation 2003; 9: 1231-1243.
3- Camci C, Gurakar A, Rose J, Rizvi S, Wright H, Bader T, et al. Liver
Transplantation for Hepatitis B in the United States. Transplant Proc
2005; 37: 4350-4353.
4- Todo S, Demetris AJ, Van Thiel D, Teperman L, Fung JJ, Starzl TE.
Orthotopic liver transplantation for patients with hepatitis B-virus related
liver disease. Hepatology 1991; 13: 619-626.
5- O’Grady JG, Smith HM, Davies SE, Daniels HM, Donaldson PT, Tan KC,
et al. Hepatitis B virus reinfection after orthotopic liver transplantation.
Serological and clinical implications. J Hepatol 1992; 14: 104-111.
6- Samuel D, Muller R, Alexander G, Fassati L, Ducot B, Benhamou JP, et
al. Liver transplantation in european patients with the hepatitis B surface
antigen. N Engl J Med 1993; 329: 1842-1847.
7- Terrault NA, Zhou S, Combs C, Hahn JA, Lake JR, Roberts JP, et al.
Prophylaxis in liver transplant recipients using a fixed dosing schedule of
hepatitis B immunoglobulin. Hepatology 1996; 24: 1327-1333.
69
8- Shouval D, Samuel D. Hepatitis B immune globulin to prevent hepatitis B
virus graft reinfection following liver transplantation: a concise review.
Hepatology 2000; 32: 1189-1195.
9- Roche B, Feray C, Gigou M, Roque-Afonso AM, Arulnaden JL, Delvart V,
et al. HBV DNA persistence 10 years after liver transplantation despite
successful anti-HBs passive immunoprophylaxis. Hepatology 2003; 38:
86-95.
10- Samuel D. Liver transplantation and hepatitis B virus infection: the
situation seems to be under control, but the virus is still there. J Hepatol
2001; 34: 943-945.
11- Markowitz JS, Martin P, Conrad AJ, Markmann JF, Seu P, Yersiz H, et
al. Prophylaxis against hepatitis B recurrence following liver
transplantation using combination lamivudine and hepatitis B immune
globulin. Hepatology 1998; 28: 585-589.
12- Han SHB, Ofman J, Holt C, King K, Kunder G, Chen P, et al. An efficacy
and cost-effectiveness analysis of combination hepatitis B immune
globulin and lamivudine to prevent recurrent hepatitis B after orthotopic
liver transplantation compared with hepatitis B immune globulin
monotherapy. Liver Transplant 2000; 6: 741-748.
13- Marzanno A, Salizzoni M, Debernardi-Venon W, Smedile A, Franchello
A, Ciancio A, et al. Prevention of hepatitis B virus recurrence after liver
transplantation in cirrhotic patients treated with lamivudine and passive
immunoprophylaxis. J Hepatol 2001; 34: 903-910.
14- Terrault N, Roche B, Samuel D. Management of the hepatitis B virus in
the liver transplantation setting: a European and an American
perspective. Liver Transpl 2005; 11: 716-732.
70
15- Szmuness W. Hepatocellular carcinoma and the hepatitis B virus:
evidence for a causal association. Prog Med Virol 1978; 24: 40-69.
16- Beasley RP, Hwang LY, Lin CC, Chien CS. Hepatocellular carcinoma
and hepatitis B virus. A prospective study of 22,707 men in Taiwan.
Lancet 1981; 2: 1129-1133.
17- Brechot C. Pathogenesis of hepatitis B virus-related hepatocellular
carcinoma: old and new paradigms. Gastroenterology 2004; 127: S56-
S61.
18- Kremsdorf D, Soussan P, Paterlini-Brechot P, Brechot C. Hepatitis B
virus-related hepatocellular carcinoma: paradigms for viral-related human
carcinogenesis. Oncogene 2006; 25: 3823-3833.
19- Guerrero RB, Roberts LR. The role of hepatitis B virus integration in the
pathogenesis of human hepatocellular carcinoma. J Hepatol 2005; 42:
760-777.
20- Yu MW, Yeh SH, Chen PJ, Liaw YF, Lin CL, Liu CJ, et al. Hepatitis B
virus genotype and DNA level and hepatocellular carcinoma: a
prospective study in men. J Natl Cancer Inst 2005; 97: 265-272.
71
21- Chen CJ, Yang HI, Su J, Jen CL, You SL, Lu SN, et al, for the REVEAL-
HBV Study Group. Risk of hepatocellular carcinoma across a biological
gradient of serum hepatitis B virus DNA level. JAMA. 2006; 295: 65-73.
22- Liu CJ, Chen BF, Chen PJ, Lai MY, Huang WL, Kao JH, et al. Role of
hepatitis B virus precore/core promoter mutations and serum viral load
on noncirrhotic hepatocellular carcinoma: a case-control study. J Infect
Dis 2006; 194: 594-599.
23- Raimondo G, Burk RD, Lieberman HM, Muschel J, Hadziyannis SJ, Will
H, et al. Interrupted replication of hepatitis B virus in liver tissue of HBsAg
carriers with hepatocellular carcinoma. Virology 1988; 166: 103–112.
24- Loncarevic IF, Schranz P, Zentgraf H, Liang XH, Herrmann G, Tang ZY,
et al. Replication of hepatitis B virus in a hepatocellular carcinoma.
Virology 1990; 174: 158-168.
25- Mazzaferro V, Regalia E, Montalto F, Pulvirenti A, Brunetto MR, Bonino
F, et al. Risk of HBV reinfection after liver transplantation in HBsAg-
positive cirrhosis. Primary hepatocellular carcinoma is not a predictor for
HBV recurrence. Liver 1996; 16: 117-122.
26- Steinmüller T, Seehofer D, Rayes N, Müller AR, Settmacher U, Jonas S,
et al. Increasing applicability of liver transplantation for patients with
hepatitis B-related liver disease. Hepatology 2002; 35: 1528-1535.
72
27- Marzanno A, Gaia S, Ghisetti V, Carenzi S, Premoli A, Debernardi-
Venon W, et al. Viral load at the time of liver transplantation and risk of
hepatitis B recurrence. Liver Transpl 2005; 11: 402-409.
28- Wong SN, Reddy KR, Keeffe EB, et al. Comparison of clinical outcomes
in chronic hepatitis B liver transplant candidates with and without
hepatocellular carcinoma. Liver Transplantation 2007;13:334-42.
29- Wong PYN, McPeake JR, Portmann B, Tan KC, Naoumov NV, Williams
R. Clinical course and survival after liver transplantation for hepatitis B
virus infection complicated by hepatocellular carcinoma. Am J
Gastroenterol 1995; 90: 29-34.
30- Tuttleman JS, Pourcel C, Summers J. Formation of the pool of covalently
closed circular viral DNA in hepadnavirus-infected cells. Cell 1986; 47:
451-460.
31- Newbold J, Xin H, Tencza M, Sherman G, Dean J, Bowden S, et al. The
covalently closed duplex form of the hepadnavirus genome exists in situ
as a heterogeneous population of viral minichromossomes. J Virol 1995;
69: 3350-3357.
32- Zanella I, Rossini A, Domenighini D, Albertini A, Cariani E. Real-time
quantitation of hepatitis B virus (HBV) DNA in tumorous and surrounding
tissue from patients with hepatocellular carcinoma. J Med Virol 2002; 68:
494-499.
73
33- Pollicino T, Squadrito G, Cerenzia G, Cacciola I, Raffa G, Craxi A, et al.
Hepatitis B virus maintains its pro-oncogenic properties in the case of
occult HBV infection. Gastroenterology 2004; 126: 102-110.
34- Wong DK, Yuen MF, Poon RT, Yuen JC, Fung J, Lai CL. Quantification
of hepatitis B virus covalently closed circular DNA in patients with
hepatocellular carcinoma. J Hepatol 2006; 45: 553-559.
35- Werle-Lapostolle B, Bowden S, Locarnini S, Wursthorn K, Petersen J,
Lau G, et al. Persistence of cccDNA during the natural history of chronic
hepatitis B and decline during adefovir dipivoxil therapy.
Gastroenterology 2004; 126: 1750-1758.
36- Paraná R, Almeida D. HBV epidemiology in Latin America. J Clin Virol;
34 (Suppl 1): S130-S133.
37- Parkin DM, Bray FI, Devessa SS. Cancer burden in the year 2000. The
global picture. Eur J Cancer 2001; 37 (Suppl 8): S4-S66.
38- El-Serag HB. Hepatocellular carcinoma: recent trends in the United
States. Gastroenterology 2004; 127 (Suppl 1): S27-S34.
39- Beasley RP. Hepatitis B virus. The major etiology of hepatocellular
carcinoma. Cancer 1988; 61: 1942-1956.
74
40- Fattovich G. Natural history of hepatitis B. J Hepatol 2003; 39 (Suppl 1):
S50-S58.
41- Bruss V, Ganem D. The role of envelope proteins in hepatitis B virus
assembly. Proc Natl Acad Sci USA 1991; 88: 1059-1063.
42- Klingmüller U, Schaller H. Hepadnavirus infection requires interaction
between the viral pre-S domain and a specific hepatocellular receptor. J
Virol 1993; 67: 7414-7422.
43- Ganem D, Prince AM. Hepatitis B virus infection – natural history and
clinical consequences. N Engl J Med 2004; 350: 1118-1129.
44- Zoulim F, Saputelli J, Seeger C. Woodchuck hepatitis virus X protein is
required for viral infection in vivo. J Virol 1994; 68: 2026-2030.
45- Summers J, Mason WS. Replication of the genome of a hepatitis B-like
virus by reverse transcription of an RNA intermediate. Cell 1982; 29:
403-415.
46- Pollack JR, Ganem D. Site-specific RNA binding by a hepatitis B virus
reverse transcriptase initiates two distinct reactions: RNA packaging and
DNA synthesis. J Virol 1994; 68: 5579-5587.
75
47- Wang GH, Seeger C. Novel mechanism for reverse transcription in
hepatitis B viruses. J Virol 1993; 67: 6507-6512.
48- Seeger C, Mason WS. Hepatitis B virus biology. Microbiol Mol Biol Rev
2000; 64: 51-68.
49- Moraleda G, Saputelli J, Aldrich CE, Averett D, Condreay L, Mason WS.
Lack of effect of antiviral therapy in nondividing hepatocyte cultures on
the closed circular DNA of woodchuck hepatitis virus. J Virol 1997; 71:
9392-9399.
50- Zoulim F. New insight on hepatitis B virus persistence from the study of
intrahepatic viral cccDNA. J Hepatol 2005; 42: 302-308.
51- Miller RH, Robinson WS. Hepatitis B virus DNA in nuclear and
cytoplasmic fractions of infected human liver. Virology 1984; 137: 390-
399.
52- Yokosuka O, Omata M, Imazeki F, Okuda K, Summers J. Changes of
hepatitis B virus DNA in liver and serum caused by recombinant
leukocyte interferon treatment: analysis of intrahepatic replicative
hepatitis B virus DNA. Hepatology 1985; 5: 728-734.
76
53- Addison WR, Wong WW, Fischer KP, Tyrrell DL. A quantitative
competitive PCR assay for the covalently closed circular form of the duck
hepatitis B virus. Antiviral Res 2000; 48: 27-37.
54- He ML, Wu J, Chen Y, Lin MC, Lau GK, Kung HF. A new and sensitive
method for the quantification of HBV cccDNA by real-time PCR. Biochem
Biophys Res Commun 2002; 295: 1102-1107.
55- Brechot C, Pourcel C, Louise A, Rain B, Tiollais P. Presence of
integrated hepatitis B virus DNA sequences in cellular DNA of human
hepatocellular carcinoma. Nature 1980; 286: 533-535.
56- Shafritz DA, Shouval D, Sherman HI, Hadziyannis SJ, Kew MC.
Integration of hepatitis B virus DNA into the genome of liver cells in
chronic liver disease and hepatocellular carcinoma. Studies in
percutaneous liver biopsies and post-mortem tissue specimens. N Engl J
Med 1981; 305: 1067-1073.
57- Matsubara K, Tokino T. Integration of hepatitis B virus DNA and its
implications for hepatocarcinogenesis. Mol Biol Med 1990; 7: 243-260.
58- Yaginuma K, Kobayashi H, Kobayashi M, Morishima T, Matsuyama K,
Koike K. Multiple integration site of hepatitis B virus DNA in
hepatocellular carcinoma and chronic active hepatitis tissues from
children. J Virol 1987; 61: 1808-1813.
77
59- Sezaki H, Kobayashi M, Hosaka T, Someya T, Akuta N, Suzuki F, et al.
Hepatocellular carcinoma in noncirrhotic young adult patients with
chronic hepatitis B viral infection. J Gastroenterology 2004; 39: 550-556.
60- Brechot C, Gozuacik D, Murakami Y, Paterlini-Brechot P. Molecular
bases for the development of hepatitis B virus-related hepatocellular
carcinoma. Semin Cancer Biol 2000; 10: 211-231.
61- Minami M, Daimon Y, Mori K, Takashima H, Nakajima T, Itoh Y, et al.
Hepatitis B-virus related insertional mutagenesis in chronic hepatitis B
patients as an early drastic genetic change leading to
hepatocarcinogenesis. Oncogene 2005; 24: 4340-4348.
62- Lugassy C, Bernuau J, Thiers V, Krosgaard K, Degott C, Wantzin P, et
al. Sequences of hepatitis B virus DNA in the serum and liver of patients
with acute benign and fulminant hepatitis. J Infect Dis 1987; 155: 64-71.
63- Murakami Y, Minami M, Daimon Y, Okanoue T. Hepatitis B virus DNA in
liver, serum, and peripheral blood mononuclear cells after the clearance
of serum hepatitis B virus surface antigen. J Med Virol 2004; 72: 203-
214.
64- Ziemer M, Garcia P, Shaul Y, Rutter WJ. Sequence of hepatitis B virus
DNA incorporated into the genome of a human hepatoma cell line. J Virol
1985 ; 53: 885-892.
78
65- Wang Y, Lau SH, Sham JST, Wu MC, Wang T, Guan XY.
Characterization of HBV integrants in 14 hepatocellular carcinomas:
association of truncated X gene and hepatocellular carcinogenesis.
Oncogene 2004; 23: 142-148.
66- Paterlini-Brechot P, Saigo K, Murakami Y, Chami M, Gozuacik D,
Mugnier C, et al. Hepatitis B virus-related insertional mutagenesis occurs
frequently in human liver cancers and recurrently targets human
telomerase gene. Oncogene 2003; 22: 3911-3916.
67- Soussan P, Garreau F, Zylberberg H, Ferray C, Brechot C, Kremsdorf D.
In vivo expression of a new hepatitis B virus protein encoded by a spliced
RNA. J Clin Invest 2000; 105: 55-60.
68- Tu H, Bonura C, Giannini C, Mouly H, Soussan P, Kew M, et al. Biologic
impact of natural COOH-terminal deletions of hepatitis B virus X protein
in hepatocellular carcinoma tissues. Cancer Res 2001; 61: 7803-7810.
69- Yao FY, Terrault NA, Freise C, Maslow L, Bass NM. Lamivudine
treatment is beneficial in patients with severely decompensated cirrhosis
and actively replicating hepatitis B infection awaiting liver transplantation:
a comparative study using a matched, untreated cohort. Hepatology
2001; 34: 411-416.
70- Fontana RJ, Hann HWL, Perrillo RP, Vierling JM, Wright T, Rakela J, et
al. Determinants of early mortality in patients with decompensated
chronic hepatitis B treated with antiviral therapy. Gastroenterology 2002;
123: 719-727.
79
71- Schiff ER, Lai CL, Hadziyannis S, Neuhaus P, Terrault N, Colombo M, et
al. Adefovir dipivoxil therapy for lamivudine-resistant hepatitis B in pre-
and post-liver transplantation patients. Hepatology 2003; 38: 1419-1427.
72- Perrillo R, Rakela J, Dienstag J, Levy G, Martin P, Wright T, et al.
Multicenter study of lamivudine therapy for hepatitis B after liver
transplantation. Lamivudine Transplant Group. Hepatology 1999; 29:
1581-1586.
73- Mazzaferro V, Regalia E, Doci R, et al. Liver transplantation for the
treatment of small hepatocellular carcinomas in patients with cirrhosis. N
Engl J Med 1996; 334:728-729.
74- Hochberger S, Althof D, Gallegos de Schrott R, Nachbaur N, Rock H,
Leying H. Fully automated quantitation of hepatitis B virus (HBV) DNA in
human plasma by the COBAS AmpliPrep/COBAS Taqman System. J
Clin Virol 2006; 35: 373-380.
75- Anselmo DM, Ghobrial RM, Jung LC, Weaver M, Cao C, Saab S, et al.
New era of liver transplantation for hepatitis B. A 17-year single-center
experience. Ann Surg 2002; 235: 611-620.
76- Samuel D, Bismuth A, Mathieu D, Arulnaden JL, Reynes M, Benhamou
JP, et al. Passive immunoprophylaxis after liver transplantation in
HBsAg-positive patients. Lancet 1991; 337: 813-815.
77- Neff GW, O’Brien CB, Nery J, Shire N, Montalbano M, Ruiz P, et al.
Outcomes in liver transplant recipients with hepatitis B virus: resistance
and recurrence patterns from a large transplant center over the last
decade. Liver Transplantation 2004; 10: 1372-1378.
80
78- Lok AS, Liang RH, Chiu EK, Wong KL, Chan TK, Todd D. Reactivation of
hepatitis B virus replication in patients receiving cytotoxic therapy. Report
of a prospective study. Gastroenterology 1991; 100:182-188.
79- Kumagai K, Takagi T, Nakamura S, Sawada U, Kura Y, Kodama F, et al.
Hepatitis B virus carriers in the treatment of malignant lymphoma: an
epidemiological study in Japan. Ann Oncol 1997; (Suppl 1):107-109.
80- Markovic S, Drozina G, Vovk M, Fidler-Jenko M. Reactivation of hepatitis
B but not hepatitis C in patients with malignant lymphoma and
immunosuppressive therapy. A prospective study in 305 patients.
Hepatogastroenterology 1999; 46:2925-2930.
81- Liang R, Lau GK, Kwong YL. Chemotherapy and bone marrow
transplantation for cancer patients who are also chronic hepatitis B
carriers: a review of the problem. J Clin Oncol 1999; 17:394-398.
82- Saibara T, Maeda T, Miyazaki M, Onishi S, Yamamoto Y. Assessment of
lymphokine-activated killer activity and γ-interferon production in patients
with small hepatocellular carcinomas. Hepatology 1993; 17:781-787.
83- Protzer-Knolle U, Naumann U, Bartenschlager R, Berg T, Hopf U, Meyer
zum Buschenfelde KH, et al. Hepatitis B virus with antigenically altered
hepatitis B surface antigen is selected by high-dose hepatitis B immune
globulin after liver transplantation. Hepatology 1998; 27: 254-263.
84- Ghany MG, Ayola B, Villamil FG, Gish RG, Rojter S, Vierling JM, et al.
Hepatitis B virus S mutants in liver transplant recipients who were
reinfected despite hepatitis B immune globulin prophylaxis. Hepatology
1998; 27: 213-222.
85- Trautwein C. Mechanisms of hepatitis B virus graft reinfection and graft
damage after liver transplantation. J Hepatol 2004; 41: 362-369.
81
86- Feray C, Zignego AL, Samuel D, Bismuth A, Reynes M, Tiollais P, et al.
Persistent hepatitis B virus infection of mononuclear blood cells without
concomitant liver infection. The liver transplant model. Transplantation
1990; 49: 1155-1158.
87- Brind A, Jiang J, Samuel D, Gigou M, Feray C, Brechot C, et al.
Evidence for selection of hepatitis B mutants after liver transplantation
through peripheral blood mononuclear cell infection. J Hepatol 1997;
26:228-235.
88- Wong DK, Yuen MF, Yuan H, Sum SS, Hui CK, Hall J, et al. Quantitation
of covalently closed circular hepatitis B virus DNA in chronic hepatitis B
patients. Hepatology 2004; 40:727-737.