Aula Prática Geometria Molecular.
-
Upload
abraao-mattos -
Category
Documents
-
view
63 -
download
0
description
Transcript of Aula Prática Geometria Molecular.

ASSUNTO: Geometria Molecular
OBJETIVOS:
Observar as características e tipos de geometrias moleculares bem como o conceito de molécula e ligações químicas.
1- INTRODUÇÃO:
1.1 – Molécula:As moléculas são espécies químicas eletricamente neutras constituídas por pelo menos dois átomos (de um mesmo elemento ou não). Sendo que, estes se unem por ligações estritamente covalentes (moleculares ou coordenadas); dessa forma, os compostos iônicos (ânion + cátion) não são formados por moléculas.Exceto metais (Ferro, Níquel, Sódio...), gases nobres (Hélio, Argônio, Kriptônio) e aglomerados iônicos (Cloreto de Sódio, Carbonato de Cálcio...), boa parte das outras substâncias são formadas por moléculas (Nitrogênio, Água, Açúcar, Ácidos hidrogenados...).
Molécula de Biotina
Durante uma ligação química, as eletrosferas de cada átomo ou íon encontram-se interagidas entre si e constituem uma nuvem eletrônica de aparência variável. Sendo esta aparência dependente da intensidade de atração de cada um sobre os elétrons.A visível diferença entre as ligações iônicas e covalentes está justamente na distribuição da nuvem: nas moléculas-íon (formadas por ânions e cátions) a diferença de atração eletrônica é suficientemente grande para que a maior parte da nuvem se concentre em apenas um dos íons. Enquanto que nas moléculas, essa desigualdade de distribuição é menor (ou nula, se considerarmos as moléculas diatômicas de um mesmo elemento).
1.2 - Ligações Covalentes
AULA PRÁTICA Data:__/08/2015Aluno (a): _________________________________________nº: ______Série: 1º Ano ______________________________________Prof.: Abraão Matos
Unidade III

Como já mencionado, as moléculas são formadas por pelo menos dois átomos unidos através de uma ligação covalente (com compartilhamento de elétrons). Sendo esta dividida em dois tipos:Ligação covalente molecular – Neste tipo de ligação, pares eletrônicos são compartilhados e passam a fazer parte das duas eletrosferas simultaneamente. Assim, ambos atingem estabilidade eletrônica.Ligação covalente coordenada (ou dativa) – Geralmente, quando um átomo atinge o número de elétrons necessário para sua estabilidade eletrônica, não é possível realizar mais nenhuma ligação covalente molecular (exceto algumas moléculas que violam a regra do octeto). Entretanto, podem compartilhar pares de elétrons (como uma doação) a átomos de uma mesma molécula desde que continuem eletronicamente estáveis. Assim, os dois elétrons compartilhados proveem de um mesmo átomo.
Molécula de SO3 – O enxofre realiza duas ligações dativas e duas moleculares
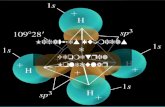
1.3 – Teoria VSEPR:
A teoria ou método de VSEPR foi formulado em 1957 pelo cientista Ron Gillespie, com o intuito de ser utilizada como uma ferramenta na predição da geometria das moléculas, ou seja, a forma como a molécula está disposta no espaço. A sigla inglesa VSEPR (pronuncia-se vésper) significa Valence Shell Electron Pair Repulsion ou repulsão eletrônica entre os pares de elétrons na camada de valência, também apresentada em alguns livros texto como REPECV. Esta teoria enfoca principalmente o que diz o seu nome. Em relação à máxima distancia que os pares solitários devem manter na organização da nuvem de elétrons ao redor do átomo central. De acordo com os passos mostrados a seguir fica mais fácil fazer esta predição:Passos para determinação da forma de uma molécula no espaço:1. Observar e desenhar a estrutura de Lewis para a molécula;2. Contar o número de pares de elétrons ligados e isolados presentes na molécula e determinar o número estérico (soma de todos os pares solitários e ligados).3. Fazer uma disposição arranjando dos pares de elétrons nos vértices de uma figura geométrica, de forma a diminuir ao máximo a repulsão entre os pares solitários.
2- MATERIAIS E MÉTODOS:
2.1 – Materiais:
Modelos moleculares (bolas de isopor, palitos de madeira)
Tinta guache e pincel;

Livro Didático
Câmera ou celular
2.2 – Metodologia:
A disposição dos átomos numa molécula determina a sua geometria. Sendo esta intrinsecamente ligada à quantidade de pares eletrônicos ligantes e não-ligantes dos átomos constituintes.
Dentre as possíveis geometrias, as mais comuns são: a linear, triangular, angular, tetraédrica, piramidal, bipiramidal e octaédrica.
GeometriaPares eletrônicos
totaisPares eletrônicos
não ligantesPares eletrônicos
ligantes
Linear 2, 5, 6 0, 3, 4 2, 2, 2
Triangular 3 0 3
Angular 3, 4 1, 2 2, 2
Tetraédrica 4 0 4
Piramidal 4 1 3
Bipiramidal 5 0 5
Octaétrica 6 0 6
Geometria linear
Geometria triangularGeometria angular
Geometria tetraédrica Geometria piramidal Geometria bipiramidal

Geometria octaédrica
3- RESULTADOS E DISCUSSÃO
Apresente aqui imagens dos modelos construídos por seu grupo em sala e explique com suas palavras o que você compreendeu sobre o tema geometria molecular e comente sobre cada imagem apresentada.
4- REFERÊNCIAS BIBLIOGRÁFICAS
JAMES Brady, Humiston Gerard E. QUÍMICA GERAL - 2ª EDIÇÃO
LEE, J.D.. Química inorgânica não tão concisa – tradução da 4ª edição inglesa. São Paulo, Edgard Blücher, 1996.
MAHAN, B. M. Química: um curso universitário. 4a ed. São Paulo: Edgard Blücher, 2003.
RUSSEL, J. B. Química geral. São Paulo: Makron Books, 2004.
SARDELLA, Antônio. Curso de química: Química geral, São Paulo – SP: Editora Ática, 2002. 25ª Edição, 2ª impressão. 448 págs.
SHRIVER, DUWARD; ATKINS, PETER. Química inorgânica - 4ª edição. Porto Alegre, Bookman, 2008.
VOGEL, Arthur Israel, 1905-Química Analítica Qualitativa / Arthur I. Vogel ; [tradução por Antonio Gimeno da] 5. ed. rev. por G. Svehla.- São Paulo : Mestre Jou, 1981 .