Componentes químicos da célula 2
-
Upload
luzineide-oliveira -
Category
Education
-
view
382 -
download
1
Transcript of Componentes químicos da célula 2
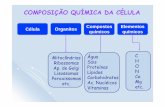
Componentes Químicos da Célula:
Composto Porcentagem
Água 75 a 85%
Íons inorgânicos 1%
Carboidratos 1%
Lípideos 2 a 3%
Proteínas 7 a 10%
Ácidos nucléicos 1%
Classificação dos Compostos Químicos:
Orgânicos: contém ao menos uma molécula de carbono e uma de hidrogênio em sua composição Ex.: Proteínas, carboidratos, etc...
Inorgânicos: São compostos formados em geral por moléculas (compostos iônicos) pequenas, em que podem ou não conter carbono em sua composição.Ex.: H2O, CO2 HCN, NaCl, etc...
Íons
- Cátions: derivados de átomos que perderam e-, carga (+). Ex: Na+, o át. de Na perdeu 1 e-- Ânions: derivados de átomos que ganharam e-, carga (-). Ex.:Cl-, o át. de Cl ganhou 1 e-
Os íons são partículas carregadas (+ ou -), onde o nº de e- não é mesmo que o nº de p+.
• Íons
Íons importantes
• Na+: importante para transmissão do impulso nervoso.
• Ca+2: contração muscular e processo de cicatrização.
• Mg+2: presente na clorofila. Ex. Rubisco• Fe+2: hemoglobina.• Fe-: importante p/a manutenção dos ossos e
dos dentes.
componente mais abundante na superfície terrestre vida originou-se, evoluiu e desenvolveu-se nos oceanos estruturas e funções celulares: adaptadas as propriedades
físico-químicas da águasolubiliza grande número de substâncias H2O: quimicamente estável, mas com propriedades incomuns
que fazem dela um bom solvente.
ÁGUA
PROPRIEDADESDA ÁGUA
Molécula de H2O: ESTRUTURA
OHH
OHH
Molécula de H2O: é polar
O: átomo muito eletronegativoH: átomo pouco eletronegativoEletronegatividade: afinidade por elétrons
PONTES DE HIDROGÊNIO Definição: ligação não-covalente que se forma entre dois
átomos eletronegativos (O ou N) onde um deles está ligado covalentemente a um átomo de H (doador).
OHH
doador aceptor
Ligação covalente Ponte de hidrogênio
N ou O N ou O
São ligações fracas que podem ser rompidas e refeitas facilmente → grande importância biológica
Pontes de hidrogênio entre moléculas de água dão força coesiva que faz a água líquida à temperatura ambiente e sólida à baixas temperaturas.
PONTES DE HIDROGÊNIO
OH H
--
++
O
HH
+
+-
-
Cada molécula de H2O pode fazer no máximo 4 pontes de H com outras moléculas de H2O ao mesmo tempo
PONTES DE HIDROGÊNIO
OHH
OHH
OHH
OHH
OHH
H2O no estado sólido (gelo): 4 ptes H/H2O H2O no estado líquido: 3,4 ptes H/H2O H2O no estado gasoso: 1-2 ptes H/H2O
Importância Biológica das Ligações Fracas
• Permitem à célula montar, alternar e desmontar estruturas supramoleculares.
Ex.: Atuação enzimática, formação dos microtúbulos.
• Aumentar a versatilidade e eficiência funcional s/ grandes gastos de energia.
Obs.: Se as ligações fossem apenas estáveis e de alto valor energético a atividade celular seria impossível.
• H2O: pode realizar com outras substâncias pontes de hidrogênio e interação eletrostática
• Dissolver = “envolver” uma substância com moléculas de água• SEMELHANTE DISSOLVE SEMELHANTE
substância podem ser classificadas em: hidrofílicas: solúveis em água hidrofóbicas: insolúveis em água anfifílicas ou anfipáticas: a substância apresenta parte da
molécula hidrofóbica e parte hidrofílica
SOLUBILIDADE EM H2O
substância polares: formam pontes de hidrogênio com a H2O. Exemplos: açúcar, álcool e acetona.
SUBSTÂNCIAS HIDROFÍLICAS
GLICOSE
substância apolares: não interagem com a H2O, não sendo, portanto, dissolvidas. Os hidrocarbonetos (composto de C e H somente) são altamente apolares. Exemplos: gasolina, petróleo, óleo diesel, etc.
SUBSTÂNCIAS HIDROFÓBICAS
parte da molécula é hidrofóbica e outra parte é hidrofílica. Exemplos: ácido graxo, detergente, sabão, etc.
SUBSTÂNCIAS ANFIFÍLICAS
Cauda apolar(Hidrofóbica)
Cabeça Polar
(Hidrofílica)
REPRESENTAÇÃO
COMPORTAMENTO DE ANFIFÍLICOS EM H2O
MICELA: monocamada de anfifílico
VESÍCULA: dupla camada de anfifílico com água no interior
AGITAÇÃO
AGITAÇÃO INTENSA
EMULSIFICAÇÃO “SOLUBILIZAÇÃO” de gorduras pela formação de uma
micela
GORDURADETERGENTE O
HHO
HH
OHH
OHH
O
HH
OH H
O
H
H
O
HH
O HH
Macromoléculas Orgânicas
Macromoléculas ou polímeros
Unidades repetidas Monômero
sUnem-se por ligações covalentes
Homopolímeros
Polímeros formados por monômeros semelhantes .
Heteropolímeros
Polímeros formados por monômeros diferentes .
Macromoléculas Orgânicas
Polímeros
Grupamentos químicos
grupamentos polares ou hidrofílicosgrupamentos apolares ou hidrofóbicos
Moléculas com alto teor de grupamentos polares
Carboidratos, DNA, RNA e proteínas
Moléculas com baixo teor de grupamentos polares
Gorduras, parafinas e óleos
Moléculas Anfipáticas Detergentes, algumas proteínas e fosfolipídeos
CLASSIFICAÇÃO PEPTÍDICA
peptídeo: polímeros curtos de aminoácidos (aas)
dipeptídeo: dois resíduos de aas tripeptídeo: três resíduos de aas oligopeptídeos: 12 a 20 resíduos de aas. polipeptídeos: mais de 20 resíduos de aas Proteínas: compostos formados por uma ou
mais cadeias polipeptídicas
PROTEÍNAS Definição - São macromoléculas constituídas por unidades chamadas de aminoácidos; São as moléculas mais abundantes e com maior diversidade de funções nos sistemas vivos;
Aminoácidos (aas) – apresenta um grupo carboxila, um grupo amino e uma cadeia lateral distinta (“grupo R”) ligados ao átomo de carbono α (exceto a prolina, que possui um grupo imino). Embora mais de 300 aas diferentes tenham sido descritos na natureza, apenas 20 deles são normalmente encontrados como constituintes de proteínas em mamíferos; São, principalmente classificados de acordo com a sua cadeia lateral, pois é a natureza dessas cadeias que determina o papel de um aa em uma proteína: apolares, polares, ácidos, básicos.
Lehninger, 2004.
PROLINA
Único aminoácido que faz ligação com o carbono alfa e o grupo amina, formando um composto imino.
NÍVEIS ESTRUTURAIS DAS PROTEÍNAS
Estrutura primária: a sequência linear de aas em uma proteína.
ESTRUTURA PRIMÁRIA
Ligações peptídicas: Os aminoácidos são unidos entre si por ligações peptídicas, nas quais o grupo amina de um deles se liga ao grupo carboxila do próximo, havendo a perda de uma molécula de água, ou seja, a formação de uma ligação peptídica é uma síntese por desidratação.
NÍVEIS ESTRUTURAIS DAS PROTEÍNAS
Estrutura secundária: consiste em um primeiro nível de enrolamento helicoidal da proteína, graças às interações, geralmente pontes de hidrogênio, entre seus aminoácidos.
ESTRUTURASECUNDÁRIA
*Exemplos: queratinas – família de proteínas fibrosas intimamente relacionadas, que constituem os principais componentes de tecidos como
cabelo e a pele!!
Hélice α: existem várias hélices polipeptídicas diferentes na natureza, mas a hélice α é a mais comum. O filamento de aminoácidos se enrola ao redor de um eixo central, formando uma “escada helicoidal”. É uma estrutura estável, cujas voltas são mantidas por pontes de hidrogênio
NÍVEIS ESTRUTURAIS DAS PROTEÍNAS
ESTRUTURASECUNDÁRIA
Folha β: ao contrário da hélice α, são compostas de duas ou mais cadeias peptídicas (fitas β) ou segmentos de cadeias polipeptídicas, as quais apresentam-se quase totalmente estendidas.As pontes de hidrogênio são perpendiculares ao esqueleto polipeptídico!!!!As folhas podem ser paralelas ou antiparalelas, e, ainda, pode ser formada por uma única cadeia, dobrando-se sobre si mesma!!!
NÍVEIS ESTRUTURAIS DAS PROTEÍNAS
Estrutura terciária: a beta folha ou as alfa hélice começam a se enrolar fazendo com que interações de aminoácidos que, antes, estavam distantes, através de ligações de ponte de hidrogênio e de dissulfeto, se aproximem, e, com isso, a proteína assume a sua estrutura tridimensional conferindo a atividade biológica das maiorias das proteínas.
*As cadeias laterais hidrofóbicas são posicionadas no interior, enquanto os grupos hidrofílicos geralmente são encontrados na superfície da molécula!!*A estrutura primária determina a terciária!!
ESTRUTURA TERCIÁRIA
NÍVEIS ESTRUTURAIS DAS PROTEÍNAS
Papel das chaperonas no dobramento proteíco: constituem uma família de muitas proteínas diferentes com função semelhante: elas usam energia da hidrólise de ATP para desnovelar proteínas, possibilitando novo enovelamento, dessa vez na forma correta ou no lugar correto, e, também, encaminha a proteína à destruição, caso não seja possível atingir a configuração correta.
ESTRUTURA TERCIÁRIA
*“chaperons” foram aqueles meninos que ajudavam os nobres renascentistas a vestir as roupas complicadíssimas e colocar as
perucas enormes
NÍVEIS ESTRUTURAIS DAS PROTEÍNAS
Estrutura quartenária: duas ou mais cadeias polipeptídicas interagem através de interações hidrofóbicas, ligações iônicas e por ponte de hidrogênio. Cada cadeia polipeptídica possui o terceiro nível de organização.
Desnaturação de proteínas: resulta no desdobramento e na desorganização das estruturas secundária e terciária, sem que ocorra hidrólise das ligações peptídicas. *Agentes: calor, solventes orgânicos, agitação mecância, ácidos e bases fortes, detergentes e ínos ou metais pesados, como chumbo e mercúrio!!!
*Pode ser reversível ou não!!!
ESTRUTURA QUATERNÁRIA
TIPOS DE PROTEÍNAS
Hemeproteínas Globulares: são um grupo especializado de proteínas, as quais contêm o heme (protoporfirina + íon) como grupo prostético firmemente ligado e que desempenha diferentes papéis, de acordo com a estrutura tridimensional da proteína. Catalase; Citocromo; Hemoglobina e mioglobina...
TIPOS DE PROTEÍNAS Proteínas fibrosas: o colágeno e a elastina são os exemplos de proteínas fibrosas bem caracterizados, que apresentam função estrutural no organismo, Por exemplo, o colágeno e a elastina são componentes da pele, do parede dos vasos sanguíneos e da córnea... Cada proteína fibrosa apresenta propriedades mecânicas especiais, resultado de sua estrutura única, a qual é obtida pela combinação de aas específicos em elementos regulares de estrutura secundária!!!!
TIPOS DE PROTEÍNAS
Proteínas de membrana: São proteínas encontradas em
associação com os vários tipos de membrana das células.
CromatografiaUm dos métodos mais utilizados para separação de proteínas é a cromatografia;
Primeiramente desenvolvida para separação de moléculas pequenas como a aminoácidos e açúcares;Amostra (soluto) interage fiscamente com duas fases- Uma móvel (gás ou líquido) e um suporte sólido (fase estacionária; solvente ou Matriz). A fase móvel movimenta o soluto através da fase estacionária. A atração diferencial do soluto pelas fases móvel e estacionária afetará a sua mobilidade. Aplicações:Separação de misturas complexas de biomoléculas em componentes individuais para propósitos analíticos ou quantitativos. Isolamento em uma forma pura de uma biomolécula simples a partir de uma mistura complexa
MÉTODOS DE PURIFICAÇÃO E CARACTERIZAÇÃO DE PROTEÍNAS
Qual a importância das proteínas p/ a cél.?
• Estrutura das céls. e tecidos Ex.:Queratina• Reparos Ex.: proteínas responsáveis pela coagulação• Crescimento Ex.:hormônios• Defesa Ex.:anticorpos• Manutenção do organismo Ex.: Insulina• Biocatalizadores Ex.: Enzimas
Regulam milhares de reações
químicas diferentes
Enzimas = Catalisadores biológicos
• Definição: catalisadores de reações químicas (aceleram as reações) altamente específicas. A grande maioria são proteínas (exceção: ribozima)
• Propriedades:– Aceleram as reações– Não são consumidos na reação– Atuam em pequenas concentrações– Não alteram o equilíbrio das reações– Podem ter sua atividade regulada
Reações químicas catalisadas (enzimas) EE ++ SS EE SS EE ++ PP
Ene
rgi a
Ene
rgi a
Caminho da ReaçãoCaminho da Reação
Energia de ativação Energia de ativação semsem enzima enzima
SSPP
Energia de ativação Energia de ativação com com enzimaenzima
Enzimas nomenclatura e classificação• Nomenclatura: SUBSTRATO + FUNÇÃO + ASEEx.: superóxido dismutase, nitrato redutase, isocitrato desidrogenase,
etc.
Enzimas - Cofatores
Porção protéicaAPOENZIMA Cofator
HOLOENZIMA
Ativador
Coenzima
Grupamento prostético
Moléculas orgânicas ou inorgânicas que condicionam a atividade das enzimas
Enzimas - Cofatores
• Cofatores inorgânicos: íons metálicos. Exemplos:– Magnésio – Manganês– Zinco -
• Cofatores orgânicos– Maioria deriva de vitaminas hidrossolúveis– Classificam-se em:
• transportadoras de hidrogênio• transportadoras de grupos químicos
EnzimasCentro Catalítico / Sítio Ativo
Região da molécula enzimática que participa da reação com o substrato
Pode possuir componentes não protéicos: cofatores
EnzimasSubstratos
Complexo ES (Enzima-Substrato)
Ligação ao Sítio Ativo ou sítio catalíticoChave-fechadura
Liberação do Produto + Enzima inalterada
Fatores que alteram a atividade de uma enzima
• Fatores decorrentes da natureza protéica das enzimas- pH- temperatura
• Fatores decorrentes da formação do complexo ES- concentração do substrato- concentração da enzima
• Presença de inibidores
LIPÍDEOS
Classe de moléculas bastante variada
Baixa solubilidade em água, muitos são compostos anfifílicos
Desempenham várias funções no organismo: Combustível celular Hormônios ou precursores hormonais Reserva de energia Componente estrutural das membranas
biológicas Isolamento e proteção de órgãos Isolamento térmico Vitaminas A maioria dos lipídeos é derivada ou possui na sua
estrutura ácidos graxos.
ÁCIDOS GRAXOS (AG)
ácidos orgânicos com mais de 12 carbonos,
cadeia alquil pode ser saturada ou insaturada
Ácidos graxos saturados Não possuem duplas ligações
Geralmente sólidos à temperatura ambiente;
Gorduras de origem animal são geralmente ricas em AG saturados
Ácidos graxos insaturados:
Possuem uma ou mais duplas ligações,
mono ou poliinsaturados;
geralmente líquidos à temperatura ambiente;
Os óleos de origem vegetal são ricos em AG insaturados;
TRIACILGLICEROL (TAG)
lipídeos formados pela ligação de 3 moléculas de ácidos graxos com o glicerol.
ácidos graxos que participam da estrutura de um triacilglicerol são geralmente diferentes entre si
principal função: reserva de energia
armazenados no tecido adiposo
fornecem por grama aproximadamente o dobro da energia fornecida por carboidratos
(FOSFOLIPÍDEOS)
Lipídios "Polares", que contém fosfato na sua estrutura
desempenham importante função na estrutura e
função das membranas biológicas, por serem anfipáticos.
CERASCeras são insolúveis em H2O têm ação
impermeabilizante na superfície da pele de animais, nas folhas de plantas e nas penas de aves.
Exemplos: cera de carnaúba: usada no polimento de carros,
sapatos, pisos, isolante em chips, revestimento de comprimidos etc.
lanolina: protege a lã. É rapidamente absorvida pela pele humana sendo por isso utilizada em cosméticos e produtos farmacêuticos.
ESTERÓIDES lipídeos que não possuem AG em sua estrutura.
Destes, o principal exemplo é o Colesterol.
COLESTEROL esteróide importante na estrutura das membranas
biológicas,
atua como precursor na biossíntese dos esteróides biologicamente ativos, como os hormônios esteróides, os ácidos e sais biliares e a vitamina D.
LIPOPROTEÍNAS
A fração lipídica das lipoproteínas é muito variável, e permite a classificação das mesmas em 5 grupos, de acordo com suas densidades e mobilidade eletroforética:
Quilomicron Lipoproteína de muito baixa densidade (VLDL) Lipoproteína de densidade intermediária (IDL) Lipoproteína de baixa densidade (LDL) Lipoproteína de alta densidade (HDL)
Quilomícron = É a lipoproteína menos densa, transportadora de triacilglicerol exógeno na corrente sanguínea.
VLDL = "Lipoproteína de Densidade Muito Baixa", transporta triacilglicerol endógeno. IDL = "Lipoproteína de Densidade Intermediária", é formada na transformação de VLDL em LDL.
LDL = "Lipoproteína de Densidade Baixa", é a principal transportadora de colesterol para os tecidos; seus níveis aumentados no sangue aumentam o risco de infarto agudo do miocárdio.
HDL = "Lipoproteína de Densidade Alta"; atua retirando o colesterol da circulação. Seus níveis aumentados no sangue estão associados a uma diminuição do risco de infarto agudo do miocárdio.
LIPOPROTEÍNAS
LDL = “colesterol ruim”
HDL = “bom colesterol”
LDL: transporta o colesterol para os tecidos e sua oxidação leva a produção da placa de ateroma
HDL: tira o excesso de colesterol dos tecidos e leva de volta ao fígado.
O colesterol é o mesmo em ambas lipoproteínas
Função Biológica dos Lipídeos
Combustível: reservas energéticas (gorduras e óleos) armazenados nos adipócitos.Estrutural: estão relacionados na formação de membranas. Isolantes: são excelentes isolantes encontram-se nas gorduras neutras em tecidos subcutâneos e em torno de alguns tecidos (proteção térmica e mecânica). Funções Especiais: sinalização (hormonal), cofatores de reações enzimáticas (vitamina K) ou ubiquinona. O lipídeo retinal carotenóide por ser sensível à luz tem papel central no processo de visão.
CARBOIDRATOS
também chamados sacarídeos, glicídios, oses, hidratos de carbono ou açúcares
biomoléculas mais abundantes na natureza maior parte da ingestão calórica da maioria dos
organismos fórmula geral é: [CH2O]n, daí o nome "carboidrato"
ou "hidrato de carbono" Fonte de energia Reserva de energiaEstruturalMatéria-prima para a biossínteseInformacional glicocálix
MONOSSACARÍDEOS sólidos, cristalinos, incolores, solúveis em H2O,
alguns têm sabor doce fórmula geral é: [CH2O]n, n≥3 cadeia não ramificada de átomos de C ligados entre
si por ligações simples. Um dos C é ligado ao O por uma dupla ligação (carbonila), os outros C estão ligados a OH (hidroxila)
Classificação dos monossacarídeos também pode ser baseada no número de carbonos de suas moléculas:
TRIOSES (3C),TETROSES (4C), PENTOSES(5C): Ribose, Arabinose, XiloseHEXOSES (6C): Glicose, Galactose, Manose,
Frutose etc
POLISSACARÍDEOS Macromoléculas formadas por centenas a milhares
de unidades monossacarídicas ligadas entre si por ligações glicosídicas.
Polissacarídeos importantes → formados pela polimerização da glicose: amido, glicogênio e celulose.
AMIDO: polissacarídeo de reserva da célula vegetal Formado por moléculas de glicose ligadas entre
si através de numerosas ligações
AMILOSE
AMILOPECTINA
GLICOGÊNIO: Polissacarídeo de reserva da célula animal (fígado –
manutenção da glicemia; e músculos – fornecimento energia exercício intenso).
semelhante ao amido, mas possui um número bem maior de ligações , o que confere um alto grau de ramificação à sua molécula
Alto número de ramificações facilita a ação da enzima glicogênio fosforilase (do músculo e do fígado) liberando grandes quantidades de monossacarídeo rapidamente.QUEBRA DA LIGAÇÃO GLICOSÍDICA Digerida por -amilases (enzimas que hidrolisam a
ligação glicosídica) ptialina (ou amilase salivar): inicia a degradação dos
carboidratos na boca dos mamíferos.
CELULOSE:
Carboidrato mais abundante na natureza.
Função estrutural na célula vegetal, como um componente importante da parede celular.
Este tipo de ligação glicosídica confere à molécula uma estrutura espacial muito linear, que forma fibras insolúveis em água e não digeríveis pelo ser humano.
BIBLIOGRAFIA
• ALBERTS, B. Biologia molecular da Célula. Artmed, 2004• Earnshaw, W. C.; Pollard T.D. Biologia Celular. Elsevier, 2006• CAMPBELL, M.K. Bioquímica. Artmed, 2000• NELSON, D.L. & COX, M.M. Lehninger Princípios de
Bioquímica. 2002
Ácidos Nucléicos
Prof. Msc. Tadaiti Ozato Junior
Profa. Dra. Maria Tercília Vilela de Azeredo Oliveira
HistóricoEstrutura do DNA: determinada em 1953 pelos ingleses Watson e Crick (prêmio Nobel).Obs.: Britânica Rosalind Franklin teve participação na determinação da estrutura do DNA
Ácidos NucleicosDNA: ácido desoxirribonucleico;
RNA: Ácido ribonucleico
DNA e RNA: principais moléculas informativas das células.
DNA: única função de material genético.
RNA - Diferentes tipos:
RNAm: carrega informação do DNA aos ribossomos servindo como molde para a síntese proteica.
RNAt e RNAr: envolvidos na síntese proteica.
RNAs: podem catalisar várias reações químicas (ribozimas)
DNA e RNA
DNA
RNA
•Núcleo – eucariotos
(maior parte)
Cromatina / Cromossomos
•Citoplasma
(menor parte)Cloroplastos / Mitocôndrias
•Núcleo – síntese de RNA
•Citoplasma – síntese de Proteínas
Composição dos Ác. nucleicos
São polímeros compostos por nucleotídeos
Nucleotídeo
• Açúcar - pentose
• Grupo fosfato
• Base nitrogenada
Ligação FosfodiésterO fosfato localizado na
posição 5´ se liga à hidroxila localizada na posição 3´, liberando uma molécula de água.
DNA•Reservatório para informações genéticas
•Constituído de duas cadeias de polinucleotídeos antiparalelas(direções opostas).
• Dupla hélice em torno do eixo giro p/ direita.
• Ligações fosfodiéster 5´ 3´.
• Proporciona mecanismo da hereditariedade.
• Replicação semi-conservativa
• As duas cadeias de polinucleotídeos interagem entre si através das pontes de hidrogênio entre as bases nitrogenadas, em que a A pareia com T e C com G.
Tipos de DNA• DNA B: maior parte do DNA giro p/ direita (10 nucleotídeos por volta), conformação mais estável e alto grau de hidratação.
• DNA Z: região do DNA rica em (G-C) giro p/ esquerda (12 nucleotídeos por volta), conformação mais flexível mais sucetível a mutações.• DNA A: Aparece em algumas partes do DNA natural quando há alta conc. de cátions e baixa hidratação, possuindo 11 nucleotídeos por volta.
• Obs.: Os DNAs C e D são subclasses do DNA tipo B
Tipo C: grau de hidratação menor que 45%.
Tipo D: somente obtido de forma artificial.
Existe também uma forma de Tripla hélice
Genes• Seqüência específica de nucleotídeos, que codifica informações necessárias para a síntese de proteínas.
Esquema de um gene de eucarioto.
Obs.:Em procariotos raramente há ocorrência de íntrons.
RNAExistem três tipos de RNA:
•RNA mensageiro (RNAm): atua transferindo a informação contida no DNA para a síntese de proteínas nos ribossomos.
• RNA transportador (RNAt): possuem o formato de trevo e atuam no transporte de aminoácidos para os ribossomos para a síntese proteica.
• RNA ribossômico (RNAr): faz parte da composição dos ribossomos (50% da massa) proporciona suporte molecular para a síntese de polipeptídeos.
RNAMolécula de
RNA
1 cadeia de polinucleotídeos
• Não é uma estrutura linear simples.
• Bases complementares em certas regiões.
• Pontes de hidrogênio entre A-U e C-G conseqüência a molécula se dobra formando alças ao DNA.
RNA transportador (RNAt)• Sintetizado na cromatina (núcleo interfásico cromossomos descondensados)
• Moléculas menores com forma de trevo.
• Propriedade de se ligar à aminoácidos.
• Reconhece determinados locais na molécula de RNAm (códon) RNAt (anti-códon) seqüências complementares.
• Ocorrem ponte de H segmentos formados por dupla-hélice.
RNA mensageiro (RNAm)• Sintetizado na cromatina (núcleo interfásico cromossomos descondensados).
• Transcrição de uma das cadeias da hélice de DNA
RNAm
•Prolongamento (cauda de poli-A) adicionado na extremidade 3´ ainda no núcleo logo após a transcrição.
•Na outra extremidade (5´) do RNAm há a adição de um cap (capuz nucleotídico)
RNA ribossômico (RNAr)• Mais abundante que os outros tipos de RNA 80% do RNA celular.
• Combinado com com proteínas RNP (ribonucleoproteínas)
• Formam os ribossomos principal constituinte.
• Ribossomos + RNAm polirribossomos.
• Função dos Ribossomos: Tradução de proteínas.