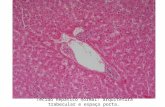
COMPORTAMENTO HISTOLÓGICO DA ESTEATOSE …livros01.livrosgratis.com.br/cp021921.pdf · Milhares de...
Transcript of COMPORTAMENTO HISTOLÓGICO DA ESTEATOSE …livros01.livrosgratis.com.br/cp021921.pdf · Milhares de...
1
COMPORTAMENTO HISTOLÓGICO DA ESTEATOSE
HEPÁTICA EM PACIENTES OBESOS MÓRBIDOS APÓS A
PERDA DE PESO INDUZIDA PELA CIRURGIA BARIÁTRICA
CLÁUDIO CORÁ MOTTIN
Porto Alegre
2005
2
PONTIFÍCIA UNIVERSIDADE CATÓLICA DO RIO GRANDE DO SUL
FACULDADE DE MEDICINA
PÓS-GRADUAÇÃO EM MEDICINA E CIÊNCIAS DA SAÚDE
ÁREA DE CONCENTRAÇÃO EM CLÍNICA CIRÚRGICA
COMPORTAMENTO HISTOLÓGICO DA ESTEATOSE
HEPÁTICA EM PACIENTES OBESOS MÓRBIDOS APÓS A
PERDA DE PESO INDUZIDA PELA CIRURGIA BARIÁTRICA
CLÁUDIO CORÁ MOTTIN
Tese apresentada como requisito para a obtenção do título de Doutor em Medicina.
Área de concentração: Clínica Cirúrgica
Orientador: Prof. Dr. Jefferson Braga da Silva
Porto Alegre
2005
3
Para minha esposa Myriam Moretto, amiga e parceira,
cujo estímulo, dedicação e ajuda foram inestimáveis,
sem o que esta tese não seria possível.
4
AGRADECIMENTOS
Aos meus amigos, companheiros, e colaboradores
incansáveis, Alexandre Vontobel Padoin,
Carlos Kupski, Luis Glock e Rejane von Muhlen.
Ao meu orientador Jefferson Braga da Silva,
pelo estímulo e incentivo para iniciar e continuar
esta jornada, e pela orientação no caminho dela.
SUMÁRIO
LISTAS................................................................................................................. IX LISTA DE ABREVIATURAS...............................................................................X LISTA DE TABELAS ......................................................................................... XI LISTA DE FIGURAS ........................................................................................XIII LISTA DE ANEXOS .........................................................................................XIV RESUMO ............................................................................................................XV ABSTRACT .................................................................................................... XVIII 1 INTRODUÇÃO.................................................................................................22 2 REFERENCIAL TEÓRICO ............................................................................25 2.1 OBESIDADE MÓRBIDA................................................................................26 2.2 ESTEATOSE HEPÁTICA.............................................................................350 2.2.1 DEFINIÇÃO.................................................................................................35 2.2.2 DOENÇA HEPÁTICA GORDUROSA NÃO-ALCOÓLICA........................37 2.2.3 ESTEATOHEPATITE NÃO-ALCOÓLICA .................................................39 2.3 CIRURGIA BARIÁTRICA .............................................................................47 2.4 BIÓPSIA HEPÁTICA......................................................................................60 3 OBJETIVOS .....................................................................................................69 3.1 OBJETIVO PRINCIPAL .................................................................................70 3.2 OBJETIVOS SECUNDÁRIOS ........................................................................70 4 PACIENTES E MÉTODOS .............................................................................71 4.1 DELINEAMENTO ..........................................................................................72 4.2 PACIENTES....................................................................................................72 4.2.1 Critérios de inclusão......................................................................................72 4.2.2 Critérios de exclusão .....................................................................................72 4.3 PROCEDIMENTOS ........................................................................................73 4.3.1 Técnicas utilizadas ........................................................................................76 4.3.1.1 Técnica cirúrgica ........................................................................................76 4.3.1.2 Técnica das biópsias...................................................................................76 4.3.1.3 Análise das amostras hepáticas ....................................................................77 4.3.2. Criterio de classificacao de esteatose .............................................................77 4.4 OUTRAS VARIÁVEIS ESTUDADAS............................................................77 4.5 TAMANHO DA AMOSTRA...........................................................................78 4.6 ANÁLISE ESTATÍSTICA...............................................................................78 4.7 ASPECTOS ÉTICOS.......................................................................................78 5 RESULTADOS .................................................................................................80 6 DISCUSSÃO .....................................................................................................93 7 CONCLUSÃO .................................................................................................103 8 REFERÊNCIAS BIBLIOGRÁFICAS ...........................................................105 9 ANEXOS .........................................................................................................118
VII
LISTA DE ABREVIATURAS
DHGNA Doença hepática gordurosa não-alcoólica
EUA Estados Unidos da América
MHWT Metropolitan Height and Weight Tables
IMC Índice de massa corporal
OMS Organização Mundial da Saúde
ATP III Adult Treatment Panel III
IOTF International Obesity Task Force
IASO International Association for Study of Obesity
IBGE Instituto Brasileiro de Geografia e Estatística
NAFLD Non-alcoholic fatty liver disease
EHNA Esteatohepatite não-alcoólica
NASH Non-alcoholic steatohepatitis
BG Banda gástrica
GVB Gastroplastia vertical com banda
RGYR Redução gástrica com derivação em Y de Roux
DBP Derivação bíleopancreática
SOS Swedish Obese Subjects
DGYR Derivação gástrica com Y de Roux
IBSR International Bariatric Surgery Registry
ASBS American Society of Bariatric Surgery
COM Centro da Obesidade Mórbida
VIII
LISTA DE TABELAS
Tabela 1 Fórmula para o cálculo do peso ideal .................................................... 22
Tabela 2 IMC, classificação e grau de obesidade e risco de doença ................... 23
Tabela 3 Potenciais causas de DHGNA ................................................................ 33
Tabela 4 Características histológicas da EHNA ................................................... 34
Tabela 5 Patogênese da esteatose e esteatohepatite ............................................... 35
Tabela 6 Contra-indicações para biópsia hepática percutânea ............................... 57
Tabela 7 Histologia no trans-operatório ................................................................ 69
Tabela 8 Perfil dos pacientes no pré-operatório .................................................... 70
Tabela 9 Distribuição dos graus de esteatose ......................................................... 71
Tabela 10 Biópsia em cunha x agulha .................................................................... 71
Tabela 11 Esteatose trans-operatória x modificação histológica ............................ 73
Tabela 12 Esteatose hepática antes e após o emagrecimento ................................... 73
Tabela 13 Perfil dos pacientes x histologia após o emagrecimento ....................... 74
Tabela 14 Características dos pacientes quanto ao gênero ....................................... 75
IX
LISTA DE FIGURAS
Figura 1 IMC x Mortalidade ................................................................................ 24
Figura 2 Emagrecimento x Modificação do padrão histológico ........................... 76
X
LISTA DE ANEXOS
Anexo 1 Fluxograma de atendimento ................................................................... 100
Anexo 2 Rotinas de pós-operatório ...................................................................... 103
Anexo 3 Exemplo do banco de dados do COM .................................................... 105
Anexo 4 Planilha de exames ................................................................................ 107
Anexo 5 e-mail da aceitação para publicação no periódico Obesity Surgery ...... 109
XII
RESUMO
INTRODUÇÃO: A esteatose tem uma alta prevalência entre os obesos mórbidos.
Sua relação com a esteatohepatite e cirrose tem sido estudada
entre estes pacientes. O objetivo deste estudo foi avaliar a
evolução da esteatose hepática com a perda de peso um ano após
a cirurgia bariátrica.
MÉTODOS: Este estudo é uma coorte histórica que compara biópsias hepáticas
obtidas de pacientes obesos mórbidos durante o trans-operatório
da cirurgia bariátrica, com biópsias percutâneas obtidas dos
mesmos pacientes um ano após a cirurgia. Os resultados foram
comparados com a perda de peso, com o perfil dos pacientes
(gênero, idade, índice de massa corporal e relação cintura-quadril)
e com a presença ou não de co-morbidades como diabete,
hipertensão e dislipidemia.
RESULTADOS: De um total de 186 pacientes submetidos à cirurgia bariátrica,
num período de dois anos, 163 (87%) apresentaram esteatose
hepática. Destes 163 pacientes, 90 preencheram os critérios de
inclusão. A média de perda do excesso de peso foi de 81,4%.
Após o emagrecimento, 16 pacientes (17,8%) permaneceram com
o mesmo grau de esteatose, 25 (27,8%) melhoraram seu padrão
histológico e 49 (54,4%) apresentaram tecido hepático normal na
XIII
segunda biópsia. Não houve diferença estatística significativa em
relação à idade, ao índice de massa corporal, à relação cintura-
quadril e às co-morbidades (P>0,05), mas houve uma diferença
quanto ao gênero dos pacientes (P=0,044).
CONCLUSÃO: Na maioria dos pacientes analisados observou-se melhora ou
resolução do processo de esteatose após a perda de peso induzida
pela cirurgia bariátrica em torno de um ano. Nenhum paciente
apresentou piora de esteatose.
Palavras-chave: esteatose, obesidade mórbida, cirurgia bariátrica.
XV
ABSTRACT
BACKGROUND: Hepatic steatosis has a high prevalence among morbidly obese
patients. Its relation to steatohepatitis and cirrhosis has been
extensively studied among these patients. The aim of this study was
to evaluate the behavior of hepatic steatosis with weight loss one
year after bariatric surgery.
METHODS: This study is a historical cohort that compared liver biopsies obtained
from morbidly obese patients during the trans-operatory of bariatric
surgery, with percutaneous biopsies taken from the same patient, one
year after surgery. The results were compared with weight loss,
patients’ profile (gender, age, body mass index and waist/hip ratio),
and with the presence or not of comorbidities such as diabetes,
hypertension, and dyslipidemia.
RESULTS: From the 186 patients that underwent bariatric surgery, in a two-year
period, 163 (87%) had hepatic steatosis confirmed by liver biopsy.
From the 163 patients, 90 met the inclusion criteria and were
considered for the study. The percent average of excess weight loss
was 81.4%. After weight lost, 16 (17.8%) remained with the same
degree of steatosis, 25 (27.8%) improved their steatosis pattern and
49 (54.4%) had normal hepatic tissue on the second biopsy. There
was no statistical difference regarding age, body mass index,
XVI
waist/hip ratio, and comorbidities (P>0.05), but there was a
difference in gender (P=0.044).
CONCLUSION: Significant improvement in the histology of hepatic steatosis was
observed after weight loss induced by bariatric surgery in most
patients. There was no patient with a worsening in the histology.
Key words: steatosis, morbid obesity, bariatric surgery.
18
1 INTRODUÇÃO
A esteatose hepática é definida como um acúmulo de gordura no fígado, sendo
identificada como componente da doença hepática gordurosa não-alcoólica (DHGNA),
que representa um espectro de condições caracterizadas principalmente por esteatose
hepática em indivíduos que não consomem álcool em quantidades danosas ao fígado(1).
A DHGNA inclui vários achados histológicos de dano hepático que englobam desde
esteatose, esteatohepatite, fibrose avançada até cirrose (2-4).
Estes achados histológicos de dano hepático têm sido relacionados a várias
condições, entre elas a obesidade mórbida (5-7), que é considerada um fator de risco
independente para a ocorrência da lesão hepática, e pode contribuir para a fibrose
hepática (8).
A progressão da DHGNA para cirrose tem sido cada vez mais relatada (9,10), e
qualquer quantidade de gordura no fígado já é considerada suficiente para permitir esta
evolução (11). Contudo, a severidade da esteatose parece ser muito importante no
desenvolvimento da fibrose e no dano hepático progressivo (12).
A esteatohepatite, um estágio mais avançado da DHGNA, já é vista como uma
importante causa para o estágio final da doença hepática, e pode, também, ser a causa de
um grande número de casos de cirrose criptogênica (13).
É interessante observar que numa série descrita, 1,4% dos pacientes obesos
mórbidos submetidos à cirurgia antiobesidade apresentaram cirrose (14). Infelizmente,
quando a cirrose já está estabelecida, o único tratamento disponível para a doença
avançada é o transplante hepático (15). Entretanto, foi relatada em um trabalho, alguma
19
melhora na cirrose em pacientes submetidos à cirurgia antiobesidade que tiveram perda
de peso (16).
Também é importante salientar que há um crescente aumento das evidências de
que a DHGNA representa o componente hepático da síndrome metabólica, caracterizada
por obesidade, hiperinsulinemia, resistência periférica à insulina, diabete mélito,
hipertrigliceridemia e hipertensão arterial sistêmica (1,17). Esta síndrome ocasiona um
risco bem maior para doença coronariana, outras doenças arteriais obstrutivas (acidente
vascular cerebral e doença vascular periférica) e diabete mélito tipo 2.
O tratamento para DHGNA, em todos os seus níveis, permanece empírico e
limitado a tratar as condições associadas a ela, tais como diabete mélito, obesidade e
hipertrigliceridemia, tanto quanto evitar drogas hepatotóxicas e outros fatores que
danifiquem o fígado (1).
A perda de peso então, é considerada tratamento para a DHGNA, e a cirurgia
antiobesidade é, geralmente, o único método que consegue significativa e duradoura
perda de peso na maioria dos pacientes obesos mórbidos (16).
O objetivo principal deste estudo é verificar o comportamento histológico da
esteatose hepática nos pacientes obesos mórbidos após o emagrecimento induzido pela
cirurgia bariátrica.
21
2 REFERENCIAL TEÓRICO
2.1 OBESIDADE MÓRBIDA
“A obesidade é, provavelmente, a enfermidade metabólica mais antiga que
se conhece. Pinturas e estátuas em pedra, de 20.000 anos, já representavam figuras de
mulheres obesas. As mesmas evidências de obesidade foram vistas em múmias egípcias,
pinturas e porcelanas chinesas da era pré-cristã, em esculturas gregas e romanas e, mais
recentemente, em vasos dos maias, astecas e incas na América pré-colombiana.” (18)
O parágrafo acima, descrito no livro Obesidade, de Halpern e cols, define muito
bem o quanto, e há quanto tempo, a obesidade acompanha a humanidade, talvez por toda
a sua existência.
O início da abordagem científica da obesidade foi provavelmente, quando o
médico e filósofo italiano Santorio, em 1568 inventou uma cadeira-balança, com o
objetivo de quantificar o peso corporal em várias condições. O método foi utilizado por
ele por mais de 30 anos e os resultados foram publicados e traduzidos para diversos
idiomas (18).
Já no século XVII, Sydenhan publicou uma monografia definindo a obesidade
como uma doença com distúrbio de caráter, iniciando o registro das manifestações
clínicas destas pessoas, suas relações com outras doenças e catalogando a obesidade
propriamente como doença (18).
No início do século XX, o periódico The Lancet publicou um artigo relatando a
experiência de companhias de seguro com pessoas obesas. Nesta publicação foi
mostrado que estes indivíduos viviam menos e que suas circunferências abdominais
22
eram maiores que as torácicas. Também foi feita uma projeção do peso ideal, cujo
exemplo era um homem de 45 anos, com 1,80m de altura que deveria ter 70 kg de peso
(10 kg menos que os centímetros que excedessem a 1 metro de altura). Esta idéia persiste
até os dias de hoje na população em geral (18).
Já os critérios atuais aceitos no mundo, que definem antropometricamente as
alterações do peso das pessoas, são oriundos de pesquisa realizada nos Estados Unidos
da América (EUA) na década de 70. Ela teve como base de dados a mortalidade de
4.200.000 pessoas, num período de até 22 anos, fornecida por 25 companhias de seguro
norte-americanas. Os dados originaram as tabelas do Metropolitan Heigh and Weight
Tables (MHWT) que definiram os critérios de peso normal, e como calculá-lo. Um
resumo sucinto destes cálculos e das tabelas está apresentado na Tabela 1, onde podemos
ver um exemplo que corresponde ao peso médio de um indivíduo com estatura média, e
como ocorrem as variações em torno disto. A tabela está convertida em metros e
quilogramas e adaptada para as variações de peso e altura (19,20).
TABELA 1 - Fórmula para o cálculo do peso ideal mulher adulta: 1,52 m = 54 kg; + 2,5 cm = + 1,4 kg
homem adulto: 1,60 m = 61 kg; + 2,5 cm = + 1,4 kg
Fonte: adaptação da tabela MHWT
Estes dados populacionais foram verificados com o objetivo de avaliar em que
faixa de peso havia os maiores riscos de doenças, e entre os dados colhidos estavam as
alturas e os pesos das pessoas.
Além das tabelas da MHWT, utiliza-se outro cálculo para determinar a relação do
peso com a estrutura corporal de cada pessoa, o índice de massa corporal (IMC). Ele foi
23
definido pelo astrônomo belga Quetelet, e por isso, pode ser chamado também, índice de
Quetelet. O IMC é calculado pelo peso do indivíduo dividido pelo quadrado de sua altura
(P/h²), e implica num resultado em kg/m². Isto reflete a carga corporal, ou seja, quantos
kg o indivíduo carrega por m² de corpo. Esta medida antropométrica não é a única para
mensurar as relações do peso e sua distribuição corporal e, inclusive, ela não discrimina
a massa magra da massa gorda e nem o peso ósseo. Apesar destas falhas ela é aceita,
pela maioria das instituições no mundo, para avaliar o excesso de peso e a obesidade,
provavelmente por ser simples e prática e se aproximar muito da realidade dos
indivíduos. De qualquer forma, as outras medidas de peso corporal utilizadas, não
refletem exatamente o aumento ou diminuição de gordura e são na maioria das vezes, um
reflexo muito aproximado da variação da mesma (21).
Baseada no IMC, a Organização Mundial da Saúde (OMS) definiu uma tabela
relacionando níveis de IMC, classificação da obesidade, grau de obesidade e risco de
doenças relacionadas, como mostra a Tabela 2.
TABELA 2 - IMC, classificação e grau de obesidade e risco de doença
IMC (kg/m2) CLASSIFICAÇÃO DE OBESIDADE GRAU RISCO DE DOENÇA
≤ 19,9 Magro 0 Elevado
20 – 24,9 Normal 0 Baixo
25 – 29,9 Sobrepeso I Elevado
30 – 39,9 Obesidade II Muito Elevado
≥ 40 Obesidade Mórbida III Muitíssimo Elevado
Fonte: OMS
24
A partir de então, se estudou cada vez mais, a relação do peso corporal com a
prevalência e incidência de doenças. Foi observado que no nível de peso considerado
normal é onde há a menor incidência de doenças.
A Figura 1 exemplifica estes fatos, nos dando uma noção da relação do IMC
com a mortalidade dos indivíduos quanto ao peso.
FIGURA 1 - IMC x Mortalidade
Fonte: Obesidade, Halpern A et al, ed. 1998
Atualmente se sabe que a obesidade é fator de risco independente para várias
doenças, entre elas, a esteatose hepática, que já é reconhecida como sendo a
manifestação hepática da síndrome metabólica. A síndrome metabólica, ou síndrome X,
é caracterizada por um grupo de fatores de risco metabólico que ocorrem numa pessoa.
Tais fatores são: obesidade central, dislipidemia (triglicerídios elevados e/ou colesterol
HDL baixo), resistência à insulina ou intolerância à glicose, estado pró-trombótico
25
(fibrinogênio elevado), pressão arterial elevada e estado pró-inflamatório (proteína C
reativa sérica elevada) (21).
As causas predisponentes conhecidas para esta síndrome são excesso de peso,
obesidade, inatividade física e fatores genéticos. Pessoas com síndrome metabólica têm
risco maior para doença coronariana, outras doenças obstrutivas arteriais (acidente
vascular cerebral e doença vascular periférica) e diabete mélito tipo 2. Ela também é
chamada de síndrome insulino-resistente pela característica do corpo de não conseguir
usar a insulina eficientemente. Os fatores biológicos que determinam esta situação não
estão completamente esclarecidos e parecem ser complexos (21).
Para o diagnóstico de síndrome metabólica são aceitos, atualmente, pela maioria
dos médicos, os critérios propostos pelo Third Report of the National Cholesterol
Education Program (NCEP), Adult Treatment Panel III (ATP III) (22). O ATP III define
que havendo 3 ou mais componentes dos abaixo citados teremos diagnóstico definido:
- obesidade central definida pela circunferência abdominal em homens maior
do que 102 cm, e em mulheres maior do que 88 cm;
- triglicerídios séricos em jejum, maiores que 150 mg/dl;
- colesterol HDL alterado: em homens, menor que 40 mg/dl e em mulheres
menor que 50 mg/dl;
- pressão arterial maior ou igual a 130/85 mmHg;
- glicemia de jejum maior ou igual a 110 mg/dl.
O critério da obesidade central também pode ser expresso pela relação cintura-
quadril, que é obtida pela divisão do perímetro da cintura pelo do quadril. Como regra
geral, uma relação maior que 1,0 para homens e 0,85 para mulheres pode ser aceita como
indicativo de aumento de risco das doenças relacionas à obesidade (21).
26
A relação da síndrome metabólica com o foco deste estudo é importante, pois em
seu centro está a obesidade, e a esteatose talvez seja sua manifestação mais prevalente.
Também, nesta mesma linha de raciocínio, está a recomendação principal da American
Heart Association (23) que é diminuir o peso e aumentar a atividade física para controle
da síndrome metabólica e diminuição de seus riscos.
Isto tudo é motivo de grandes inquietações, mas o que mais preocupa os órgãos
responsáveis pela saúde em todo mundo é que a obesidade ainda não é vista, na maioria
das vezes, como doença. Além disto, ela vem apresentando comportamento epidêmico
crescente, tanto no mundo ocidental quanto no oriental, inclusive com o aparecimento de
co-morbidades associadas à obesidade em pessoas com índice de massa corporal cada
vez mais baixo, principalmente nos de origem asiática (24, 25).
Com a obesidade vem o crescimento da ocorrência de doenças cardiovasculares,
diabete mélito tipo 2, hipertensão arterial sistêmica, acidente vascular cerebral, alguns
tipos de câncer, problemas respiratórios e problemas articulares, entre outros (26).
Nos EUA, 64% das pessoas têm excesso de peso (33%) ou obesidade (31%),
causando um custo de U$ 75 bilhões de dólares ao ano em despesas de saúde diretas. Isto
significa em torno de 6% dos gastos anuais do sistema de saúde americano, o que já se
aproxima das despesas com o fumo. Nestes valores não está considerada a diminuição da
produtividade e o absenteísmo (27). Um estudo norte-americano recente, mostra que a
expectativa de vida entre obesos diminui 22%, o que implica, em média, menos 12 anos
de vida (28).
A OMS em colaboração com a International Obesity Task Force (IOTF) e a
International Association for Study of Obesity (IASO) estima que haja, no mundo, em
torno de 1,7 bilhões de pessoas com excesso de peso ou obesas, e que as formas mais
27
graves de obesidade são as que estão crescendo mais rápido do que o restante da
epidemia (29).
Há estimativas de que morram anualmente, em todo o mundo, mais de 2,5
milhões de pessoas relacionadas à obesidade, sendo 220.000 na Europa e mais de
300.000 nos EUA, o que já é a 2ª causa de morte evitável neste país, só perdendo para o
fumo (25).
A OMS identifica regularmente as 20 principais causas de risco de morte
mundiais responsáveis por 50% da mortalidade global. No relatório de 2003, obesidade
aparece como a 10ª causa, sendo a 3ª a hipertensão, a 7ª o colesterol elevado e a 14ª a
inatividade física, todas diretamente relacionadas com a obesidade (30).
Em relação a estes dados, há estudos americanos que mostram que a perda de
peso pode prevenir uma em cada 6 mortes por câncer, mais de 90.000 anuais, o que
significa 14% de todas as mortes por câncer em homens e 20% em mulheres (31).
Tal situação, grave e crescente, mobiliza várias entidades governamentais e não-
governamentais para tomar medidas preventivas e terapêuticas visando impedir a
evolução da epidemia. A 55ª Assembléia Mundial de Saúde, realizada em maio de 2002,
reuniu 80 países-membros para formular uma Estratégia Global no controle da
obesidade. A OMS levou o esboço da proposta desta Estratégia Global na Assembléia de
janeiro de 2004 para aprovação e implementação. Nesta ocasião, houve um bloqueio
para aprovação das medidas por parte da delegação norte-americana, o que foi apelidado
de “McSpiracy” (conspiracy), pois, aparentemente, o poder da indústria da alimentação
influenciou a posição dos EUA (32).
No Brasil, uma pesquisa publicada em dezembro de 2004, pelo Instituto
Brasileiro de Geografia e Estatística (IBGE), em parceria com o Ministério da Saúde, a
28
Pesquisa de Orçamentos Familiares (POF) de 2002-2003, verificou hábitos alimentares,
peso e altura, entre outros dados, de 179.000 pessoas. A conclusão foi que a freqüência
do excesso de peso na população é oito vezes maior que o déficit de peso entre mulheres,
e 15 vezes entre os homens. Em 95,5 milhões de pessoas ≥ de 20 anos há 3,8 milhões
abaixo do peso (4%) e 38,8 milhões (40,6%) com excesso de peso. Entre estes, 10,5
milhões são considerados obesos (IMC ≥ do que 30 kg/m²) (33).
No caso específico do estado do Rio Grande do Sul, a prevalência de excesso de
peso e obesidade já está em torno de 48%, acima da média brasileira (33).
O padrão descrito acima se reproduz, com variações não-significativas, na
maioria dos grupos populacionais analisados (33).
Os dados acima nos obrigam a algumas reflexões, pois 4% de desnutridos
colocam o Brasil entre os países sem risco de desnutrição, e expõe a obesidade e o
excesso de peso, somados, como um problema de saúde pública maior que a desnutrição.
Estes mesmos dados mostram o comportamento epidêmico crescente do
problema, pois entre 1974 e 2003 a prevalência do excesso de peso e obesidade
praticamente dobrou, especialmente no sul do país. Com isto todas as co-morbidades e
mortalidade associadas à esta doença certamente aumentaram (33).
Há estimativas que, entre os obesos mórbidos (IMC ≥ 35 Kg/m² com co-
morbidades, ou IMC ≥ 40 kg/m²), esta mortalidade seja de 4,5% ao ano (34), e que, no
Brasil, devemos ter em torno de 2% da população neste nível e com este patamar de
mortalidade (35,36). É importante salientar, que a cirurgia antiobesidade é uma
alternativa terapêutica para obesos mórbidos, e que diminui esta mortalidade para 1% em
acompanhamento de grupos operados e não-operados (34,37).
29
2.2 ESTEATOSE HEPÁTICA
2.2.1 DEFINIÇÃO
A esteatose hepática é definida como um acúmulo de gordura, em grande parte
triglicerídios, que excede 5% do peso do fígado (38), mas é estimada, do ponto de vista
prático, como percentagem de hepatócitos com gordura observado na microscopia (11).
Pode ser causada por insuficiência do metabolismo hepático decorrente de algum
distúrbio intrínseco do hepatócito, ou por excessivo aporte de gordura, ácidos graxos, ou
carboidratos, que excede a capacidade de secreção lipídica da célula hepática (38).
Quanto à síntese e ao metabolismo dos ácidos graxos o fígado é um dos elementos
mais importantes. Ele funciona como um centro que recebe ácidos graxos e colesterol da
dieta e dos tecidos periféricos, os acondiciona em complexos de lipoproteína e libera
estes complexos na circulação. O fígado tem um papel central na regulação da
necessidade corporal total de ácidos graxos. Os lipídios podem ser guardados
temporariamente no fígado como gotículas de gordura, excretados diretamente na bile,
ou metabolizados em ácidos biliares (39).
Os ácidos graxos são uma importante fonte de energia para o fígado, mas também
são uma forma de combustível armazenado dentro e fora do fígado. Excesso de glicose
também pode ser convertido em ácidos graxos para depósito energético (39).
A síntese de ácidos graxos ocorre no citosol e é regulada pela disponibilidade de
seus precursores. A cadeia de ácidos graxos aumenta até que um comprimento
apropriado tenha sido alcançado, e o ácido graxo é esterificado com glicerol para formar
triglicerídios (39).
30
A beta-oxidação de ácidos graxos proporciona uma significativa fonte de
combustível para múltiplos órgãos, incluindo o fígado, e ocorre em dois distintos locais
subcelulares: o peroxisoma e a mitocôndria.
Teoricamente, a gênese da esteatose hepática se daria por, pelo menos, 4
mecanismos (38,40):
1. Aporte aumentado de gordura, ou ácidos graxos alimentares, para o fígado.
A gordura proveniente da alimentação é transportada na circulação,
principalmente sob a forma de quilomicrons. No tecido adiposo a
lipólise libera os ácidos graxos que são incorporados em triglicerídios
dentro do adipócito, mas alguns ácidos graxos são liberados na
circulação e absorvidos pelo fígado. Os resíduos de quilomicrons
também são captados pelo fígado. Quando a quantidade de ácidos
graxos que chegam ao fígado excede a quantidade necessária para a
oxidação mitocondrial, a síntese de fosfolipídios e a síntese de ésteres
de colesterol ocorrem acúmulo hepático de triglicerídios.
2. Síntese mitocondrial aumentada de ácidos graxos, ou oxidação reduzida
Ambas as situações aumentam a produção de triglicerídios.
3. Secreção inadequada de triglicerídios pelo hepatócito.
A secreção de triglicerídios pelos hepatócitos depende de seu
acondicionamento em apoproteínas, fosfolipídios e colesterol, para
formar lipoproteína de muito baixa densidade, e este processo pode ser
inibido por alguns fatores.
4. O carboidrato em excesso, que é destinado ao fígado, pode ser convertido em ácidos
graxos.
31
2.2.2 DOENÇA HEPÁTICA GORDUROSA NÃO-ALCOÓLICA
A esteatose é identificada como um componente da doença hepática gordurosa
não-alcoólica (DHGNA), em inglês nonalcoholic fatty liver disease (NAFLD), que é
definida por características clínicas e histopatológicas (41). Ela representa um espectro
de condições caracterizadas histologicamente, principalmente por esteatose hepática
macrovesicular, e ocorre em indivíduos que não consomem álcool em quantidades
geralmente consideradas danosas ao fígado (1), e na ausência de outras doenças
hepáticas crônicas. O termo DHGNA foi criado para incorporar toda a gama de achados
histológicos de dano hepático que englobam desde esteatose, esteatohepatite não-
alcoólica (EHNA), fibrose avançada até cirrose (2-4). As características histológicas da
DHGNA são muito similares àquelas descritas para a doença hepática alcoólica que
também tem esteatose predominantemente macrovesicular. O metabolismo do etanol
pode causar aumento na síntese de triglicerídios e diminuição da beta-oxidação dos
ácidos graxos. O etanol também pode aumentar diretamente a via de esterificação,
levando a mais aumento na síntese de triglicerídios (39).
Não há uma distinção bem marcada entre o que é considerada doença hepática
alcoólica e não-alcoólica. Muitos centros aceitam o consumo de até 20-40 g álcool/dia
para homens e 20 g/dia em mulheres, enquanto outros investigadores usam o cut-off de
10 g/dia. Parece que o mais razoável é aceitar a quantidade 20 g/dia, sendo que este nível
de cut-off está bem abaixo do tradicional limiar para doença hepática induzida por álcool
(11).
A prevalência de DHGNA na população geral é paralela com a prevalência de
obesidade e de resistência à insulina, que são os dois fatores de risco mais comuns para
este tipo de doença hepática (39). Sabe-se que pode ocorrer progressão para cirrose e que
32
manifestações clínicas de hipertensão porta, insuficiência hepática e carcinoma
hepatocelular podem se desenvolver em pacientes com DHGNA (42,43).
A prevalência da DHGNA, e a falta de informações sobre sua história natural,
têm gerado controvérsia sobre o critério de recomendação de testes diagnósticos
invasivos e sobre tentativas de desenvolver terapias específicas para pacientes com esta
doença (39).
Muitos agentes e condições diversas têm sido associados com DHGNA, como
mostra a Tabela 3.
TABELA 3 - Potenciais causas de DHGNA
DESORDENS METABÓLICAS ADQUIRIDAS Diabete Mélito
Obesidade Dislipidemias Bypass jejunoileal Nutrição parenteral total Inanição e caquexia Doença inflamatória intestinal
TOXINAS E DROGAS
Metais (bário, fósforo, tálio) Drogas citotóxicas (metotrexate) Antibióticos (tetraciclina) Outras drogas Amiodarona Estrógenos Glicocorticóides Hidrazida Maleato perexilene
ERROS INATOS DO METABOLISMO Abetalipoproteinemia Hepatoesteatose familial Galactosemia Síndrome de Weber-Christian Doença de Wilson Fonte: tabela adaptada de Gastrointestinal and Liver Disease, Sleisenger, 7th ed.
33
2.2.3 ESTEATOHEPATITE NÃO-ALCOÓLICA
Outro componente da DHGNA, importante na evolução para cirrose é a
esteatohepatite não-alcoólica (EHNA), em inglês nonalcoholic steatohepatitis (NASH).
Este termo foi criado por Ludwig e colaboradores (44) em 1980 para descrever uma
condição, na maioria das vezes assintomática, caracterizada por hepatomegalia, aumento
dos níveis séricos de transaminases e achados histológicos semelhantes aos observados
na hepatite alcoólica, mas em pacientes sem história de abuso de álcool.
Caracteriza-se histologicamente por esteatose (acúmulo de triglicerídios nos
hepatócitos) e hepatite (inflamação do parênquima com ou sem necrose focal) e estágios
variados de fibrose (40,44,45). Como na doença hepática alcoólica a esteatose é
predominantemente macrovesicular e, geralmente, distribuída difusamente por todo
lóbulo hepático, embora tenha sido reportado também esteatose microvesicular, ou
esteatose perivenular (39).
Entretanto, os critérios histológicos necessários para a definição de EHNA
variam muito entre os diversos autores, não sendo até agora estabelecidos os critérios
mínimos para definir EHNA. Existe uma heterogeneidade histológica muito grande, o
que leva a discrepâncias clínicas e patológicas significativas.
As principais características histológicas estão na Tabela 4.
.
34
TABELA 4 - Características histológicas da EHNA
CARACTERÍSTICAS PRESENTES EM TODOS, OU NA MAIORIA DOS CASOS
esteatose macrovesicular inflamação do parênquima necrose de hepatócitos degeneração de hepatócitos em balão
CARACTERÍSTICAS OBSERVADAS COM FREQÜÊNCIA VARIÁVEL
fibrose perivenular, perisinusoidal ou periportal corpúsculos de Mallory núcleos glicogenados lipogranulomas corpúsculos de Councilman
Fonte: Gastrointestinal and Liver Disease, Sleisenger, 7th ed.
Nenhum mecanismo comum foi identificado para explicar a patogênese da
EHNA com tantos fatores causais diferentes associados. Mesmo sendo de ocorrência
comum sua patogênese ainda é desconhecida (46).
Como hepatite e cirrose são menos freqüentes que a esteatose, é possível, que só
algumas causas de esteatose possam provocar progressão histológica para cirrose, ou que
um insulto adicional seja necessário para produzir este resultado num fígado já
esteatótico (39). Vários mecanismos têm sido propostos incluindo desequilíbrio de
aminoácidos, hiperglicemia, níveis séricos excessivos de hormônios anabólicos
(insulina) em relação aos catabólicos (leptina) e endotoxemia (causada por sepsis, ou
jejum associado à translocação bacteriana). E todos estes processos podem alterar o
metabolismo em favor da lipogênese e não da lipólise. Existem similaridades nas
características histológicas e na história natural da doença hepática alcoólica e da não-
35
alcoólica, sugerindo que diversos mecanismos possam estar envolvidos na patogênese
destas duas desordens, como demonstrado na Tabela 5.
TABELA 5 - Patogênese da esteatose e esteatohepatite
FATOR CONTRIBUINTE DOENÇA HEPÁTICA DOENÇA HEPÁTICA
ALCOÓLICA NÃO-ALCOÓLICA
Ativação das enzimas microssomais + + Endotoxinas + + Ativação de TNF-α de macrófagos + + Anormalidades mitocondriais + + Diminuição de ATP nos hepatócitos + +
Fonte: Gastrointestinal and Liver Disease, Sleisenger, 7th ed.
Processos que aumentam a produção oxidante no fígado durante a exposição
crônica ao álcool incluem o metabolismo do etanol no seu intermediário reativo, o
acetaldeído; indução de enzimas microssomais oxidantes do etanol, como o citocromo
P450 2E1; inibição da atividade mitocondrial de transporte de cadeia de elétrons; e
depleção de glutationa mitocondrial (47).
A observação de que camundongos com fígado gorduroso relacionado à
obesidade têm aumento na produção endógena de etanol (48), na ativação de enzimas
microssomais (49) e na produção mitocondrial de espécies de oxigênio reativo (50)
sugerem que o stress oxidativo crônico também pode estar envolvido na patogênese da
DHGNA.
Estudos de DHGNA em modelos animais têm levantado a intrigante
possibilidade de que a produção endógena de etanol pode ter um papel na patogênese da
DHGNA. O aumento da produção de etanol pela flora gastrointestinal tem sido
demonstrada em camundongos ob/ob (camundongos geneticamente modificados para
36
serem obesos) mais velhos, nos quais o fígado gorduroso se desenvolve quando ficam
progressivamente mais obesos durante a fase adulta (48). Estes estudos preliminares
sugerem que o etanol endógeno pode promover o estágio inicial da DHGNA relacionado
à obesidade, que é a esteatose.
Endotoxinas e citocinas induzíveis por endotoxinas, principalmente o fator de
necrose tumoral α (TNF-α), são necessárias para a patogênese da doença hepática
induzida por álcool em experimentos animais (51). Os níveis séricos no tecido adiposo
de TNF-α estão aumentados na obesidade (52), e a leptina, um fator sacietógeno
produzido pelo tecido adiposo, modula a ação tóxica do TNF-α (53). Camundongos
obesos com deficiência de leptina têm defeitos em macrófagos e linfócitos que
promovem o dano hepático mediado pelo TNF-α (54), e estes animais são notavelmente
suscetíveis ao dano hepático induzido por endotoxinas (53). De maneira semelhante, a
esteatohepatite ocorre comumente em pacientes obesos que se submeteram à cirurgia de
bypass jejunoileal, e em pacientes recebendo nutrição parenteral total por longos
períodos, e ambas as condições promovem supercrescimento bacteriano intestinal,
endotoxemia portal e produção hepática de TNF-α (55).
Ainda é pouco entendido como o stress oxidativo e o TNF-α promovem a
progressão da doença hepática gordurosa relacionada ao álcool ou à DHGNA. Estudos
em camundongos obesos sugerem que os hepatócitos de fígados gordurosos sofrem
apoptose e stress oxidativo crônicos e sobrevivem com várias adaptações mitocondriais
que fazem a célula ser mais vulnerável à necrose (50). Anormalidades estruturais em
mitocôndrias hepáticas têm sido documentadas em pacientes com DHGNA (56).
37
Alguns estudos sugerem que defeitos herdados ou adquiridos em uma ou mais
enzimas beta-oxidantes de ácidos graxos podem promover a progressão de esteatose para
esteatohepatite em alguns pacientes com DHGNA (39).
Pacientes com esteatose e EHNA têm níveis séricos de insulina mais altos que os
indivíduos normais (57), sendo, por isso, considerados associados com resistência à
insulina que, sabidamente, está associada à obesidade, à diabete mélito, à
hipertrigliceridemia e à hipertensão arterial sistêmica (58). Entretanto, a natureza dos
desarranjos metabólicos e os sites de resistência à insulina não foram caracterizados (46).
Mas sabe-se que a insulina por si só inibe a beta-oxidação mitocondrial de ácidos
graxos, levando a um acúmulo de triglicerídios e ácidos graxos no fígado (59), e esta
observação pode explicar a correlação entre hiperinsulinemia e EHNA (57,60). A
metformina, um agente anti-hiperglicêmico, que reduz a hiperinsulinemia em pacientes
com diabete tipo 2, reverte a EHNA em camundongos obesos com deficiência de leptina
(61), uma observação que suporta a possibilidade de que a hiperinsulinemia promova a
progressão de esteatose para esteatohepatite. Também tem crescido bastante a idéia de
que a resistência à insulina pode ser um fenômeno primário no desenvolvimento da
esteatose hepática e da EHNA (40).
A hipótese mais aceita hoje em dia é a de que o desenvolvimento da EHNA
ocorra em 2 “golpes”, em inglês 2 “hits” (62):
1o. a resistência periférica à insulina aumenta a lipólise e a liberação
de ácidos graxos livres para o fígado, o que é um dos fatores predisponentes para o
desenvolvimento do fígado gorduroso (esteatose), e, também, causador do stress
oxidativo (excesso de oxidação) no fígado por causa da aumentada beta-oxidação de
ácidos graxos livres;
38
2o. um defeito intra-hepático específico, mais provavelmente na
mitocôndria, que torna os hepatócitos mais suscetíveis à lesão mediada por radicais
livres do stress oxidativo atribuído à aumentada beta-oxidação de ácidos graxos.
Concentrações aumentadas de ácidos graxos intracelulares podem ser diretamente
tóxicas aos hepatócitos, ou levar ao stress oxidativo, o que leva à inflamação e
fibrogênese (40).
A principal causa da indução da hepatite alcoólica é a peroxidação lipídica e o
stress oxidativo os quais também parecem ser os causadores do 2o “hit” na patogênese da
EHNA (62).
O atual volume de evidências sustenta o stress oxidativo como sendo o fator
essencial no segundo passo deste processo (12). Entretanto, tem ficado cada vez mais
evidente que a peroxidação lipídica, o stress oxidativo, a inflamação e a fibrose na
EHNA podem ser mediados por vários fatores, incluindo a indução do CYP2E1
(citocromo P450 2E1), endotoxinas bacterianas, ferro, citocinas, disfunção das células de
Kupffer e homeostase alterada de ATP. A interação exata entre estes fatores ainda
precisa ser elucidada (40).
Em relação às características clínicas a maioria dos pacientes é assintomática, por
isso a DHGNA é, geralmente, diagnosticada por alterações bioquímicas séricas de
enzimas hepáticas em exames de rotina, embora os exames normais não excluam a
presença da doença. Alguns pacientes podem apresentar sintomas vagos como mal estar,
fadiga e desconforto em quadrante superior direito do abdômen.
As alterações laboratoriais mais freqüentes são aumentos na alanina
aminotransferase (ALT) e na aspartato aminotransferase (AST). Também são comuns
aumentos na fosfatase alcalina e na gama glutamiltranspeptidase (GGT) séricas. Existem
39
evidencias de que a GGT elevada é um marcador sensível para resistência à insulina, por
isso, aumentos na GGT podem estar entre os mais precoces achados bioquímicos da
DHGNA (39). Até o momento não há nenhum teste diagnóstico que possa acuradamente,
prognosticar quais pacientes irão desenvolver DHGNA avançada, isto é, fibrose em
ponte, ou cirrose.
Alguns trabalhos (60,63) sugerem que existem alguns fatores clínicos como idade
avançada, obesidade, diabete e hipertrigliceridemia que poderiam ser usados para
identificar pacientes de alto risco, nos quais um diagnóstico mais acurado e estadiamento
seriam importantes.
Um crescente número de trabalhos sugere que, embora a infecção por vírus da
hepatite C (HCV) não cause DHGNA, a DHGNA pode aumentar a severidade do dano
hepático relacionado ao HCV. Análises de regressão têm identificado esteatose hepática
como fator preditivo independente para cirrose em pacientes com hepatite C crônica
(64,65).
Os exames de imagem mais comumente utilizados atualmente são pouco
sensíveis e com especificidade variável, não podendo, definitivamente, estabelecer o
diagnóstico da DHGNA, nem seu grau de severidade (66). Por isso, a biópsia hepática
permanece como o melhor teste diagnóstico para confirmar a suspeita clínica de
DHGNA e, principalmente, estadiar a severidade do dano hepático e da fibrose.
A história natural ainda é pouco conhecida, principalmente porque existem
poucos trabalhos de longo prazo, prospectivos, com follow-up histológico nos pacientes
com EHNA. Os dados disponíveis sugerem que a EHNA é uma doença benigna na
maioria dos pacientes, mas está bem estabelecido que em alguns pacientes ela pode levar
à cirrose, à insuficiência hepática ou ao carcinoma hepatocelular (4,5,13,40,42,43,56,67).
40
Devido à similaridade entre as características histológicas da DHGNA e da doença
hepática induzida por álcool é provável que estas duas doenças tenham uma história
natural similar. Em ambas a esteatose é o principal achado inicial, mas episódios de
esteatohepatite podem pontuar o curso e a cirrose se desenvolver em alguns pacientes.
Poucos trabalhos incluíram o follow-up histopatológico, sendo que em três
(42,43,68), com um total de 28 pacientes, o resultado combinado mostrou que num
período de 1 a 9 anos ocorreu estabilidade histológica em 15 pacientes (54%), melhora
em 1 paciente (4%) e progressão da fibrose, ou cirrose em 12 pacientes (43%), incluindo
carcinoma hepatocelular em 1 paciente (40).
Evidências que vêm surgindo, sugerem que doença hepática significativa não é
menos freqüente na DHGNA do que na hepatite crônica C, ou outros tipos de hepatite
crônica (4).
Também tem sido cada vez mais sugerido que a DHGNA é, provavelmente, a
causa da maioria das ocorrências de cirrose criptogênica (13,56) nos pacientes, e que a
DHGNA pode ser uma causa de cirrose tão importante quanto álcool ou hepatite C nos
EUA.
Uma série de autópsias mostrou que a obesidade foi a única causa identificável de
doença hepática em 12% de pacientes cirróticos, e que a cirrose é aproximadamente seis
vezes mais prevalente em obesos do que na população geral (69).
A terapia atual da DHGNA enfatiza a eliminação ou modificação dos fatores que
são comumente associadas com DHGNA. Os principais suportes da terapia são a perda
de peso, o tratamento da dislipidemia e da hiperglicemia, e a suspensão do uso de drogas
potencialmente tóxicas (67).
41
Não há nenhum tratamento médico estabelecido para EHNA, mas uma perda de
peso moderada e sustentada, é o principal suporte no tratamento desta patologia (40).
2.3 CIRURGIA BARIÁTRICA
Cirurgia bariátrica, cirurgia de redução de estômago, cirurgia dos grampos,
cirurgia do anel, bypass gástrico, cirurgia do intestino, derivação jejunoileal, são as
várias denominações dadas, hoje em dia, para referenciar uma cirurgia antiobesidade.
Muitas com definição técnica e outras originárias do desconhecimento da matéria, tanto
da população, quanto dos profissionais da saúde que não estão habituados a lidar com
esta área.
O termo bariátrico vem do grego “barys” que significa pesado, e é aceito
universalmente para identificar as cirurgias feitas para pessoas pesadas, obesas mórbidas,
ou severas (37,70).
Arnold Kremen é reconhecido como o primeiro a realizar uma operação com o
intuito específico de emagrecer pessoas. Ele, John H. Lineer e Charles Nelson, em
Minnesota, EUA, no Hospital Mount Sinai, de Minneapolis, em 1954, operaram uma
paciente de 155 kg e fizeram uma derivação intestinal (71).
A realização destas cirurgias, e os aprendizados obtidos na segunda guerra
mundial permitiram a compreensão da diminuição da absorção intestinal e de seu
impacto no peso e nas alterações metabólicas inerentes.
Na década de 60 foram operadas cerca de 100.000 pessoas, só nos EUA, com
derivações jejunoileais. O tempo e estudos experimentais mostraram que estas operações
causavam esteatose, fibrose hepática, cirrose, litíase renal e outros danos e, por isso,
hoje, elas são desaconselhadas, embora alguns cirurgiões ainda as realizem.
42
As técnicas evoluíram sempre no intuito de obter o melhor controle de peso com
o menor dano aos pacientes. Neste processo evolutivo deve-se destacar Edward E.
Mason, que teve um papel muito importante para a cirurgia bariátrica. Em 1954, logo
após Kremen, realizou algumas cirurgias de derivação intestinal. Em 1966 começou a
usar as derivações gástricas, em 1977 as gastroplastias horizontais, e em 1980 a
gastroplastia vertical com banda (GVB), que até os dias de hoje é realizada. Por esta
trajetória, o Dr. Mason é considerado por muitos, como o pai da cirurgia da obesidade
(72).
Na década de 70, a cirurgia bariátrica teve, talvez, o seu maior avanço. Iniciou-se
ali o conceito da cirurgia restritiva e, daí por diante, as derivações gástricas com restrição
à entrada de alimentos no estômago começaram a ser utilizadas. Hoje, elas predominam
entre as técnicas de cirurgia antiobesidade, tendo sofrido, é claro, vários
aperfeiçoamentos e modificações desde seus primórdios (71).
Na década de 80, nos EUA, o bypass gástrico com derivação em Y de Roux, e
suas variações, começaram a predominar entre as outras técnicas da época. A base desta
cirurgia é a criação de uma pequena bolsa gástrica obtida pela secção da parte mais alta
do estômago, separando-a do restante. Esta bolsa gástrica é anastomosada a uma alça
intestinal de jejuno, trazida do andar infra-mesocólico, a partir de uma secção do jejuno
alguns centímetros adiante (30 a 60) do ângulo de Treitz. Esta porção de jejuno é
anastomosada à outra da qual foi separada a mais ou menos 100 cm da anastomose
gastro-jejunal (90–150 cm ou mais, dependendo da variante técnica utilizada). Dois
cirurgiões americanos, Rafael Capella e Mathias A.L. Fobi se destacaram, entre outros,
nesta técnica. Eles acrescentaram, ao bypass, um anel no pequeno estômago acima da
anastomose gastro-jejunal. Estes cirurgiões exerceram uma grande influência na cirurgia
43
bariátrica brasileira, tanto que muitos cirurgiões no Brasil utilizam estas técnicas ou suas
variações (73-75).
Ainda na década de 80, as cirurgias puramente restritivas ganharam novo espaço,
surgindo opções que não seccionavam nem grampeavam o estômago, mas simplesmente
aplicavam um anel na porção alta (entrada) do mesmo, as chamadas bandas gástricas
(BG) (71).
Também nesta década, no Brasil, Arthur Belarmino Garrido Jr., introduziu
definitivamente a cirurgia bariátrica em nosso meio. Atualmente, o Dr. Garrido é o
cirurgião bariátrico brasileiro que acumula a maior experiência no assunto, e é
autoridade mundial nesta área, sendo o atual presidente da International Federation for
Surgery of Obesity (IFSO). Também, por sua trajetória, é considerado, pela maioria
absoluta dos cirurgiões bariátricos brasileiros, o pai da cirurgia bariátrica no Brasil (76).
Na década de 90, houve uma modificação de método, e não de técnica, com a
introdução da vídeolaparoscopia, cujo pioneiro foi Alan Wittgrove (77). Um relato
expressivo da via laparoscópica foi de Kelvin Higa em 2001. Ele publicou uma
casuística de 1500 casos consecutivos avaliados prospectivamente, concluindo que o
método é seguro e é uma boa alternativa para a RGYR (78). As cirurgias sofreram
algumas modificações, mas os conceitos básicos permaneceram: restringir a entrada de
alimentos, diminuir sua absorção fazendo um desvio intestinal, ou os dois procedimentos
juntos para impedir que o alimento entre e seja absorvido no organismo.
As cirurgias bariátricas ou cirurgias antiobesidade são, hoje, divididas em três
categorias: as predominantemente restritivas, que restringem a entrada de alimentos no
tubo digestivo; as predominantemente desabsortivas, que deixam o alimento entrar, mas
diminuem sua absorção; e as mistas, que fazem as duas funções e, além disto, diminuem
44
a produção de grelina pela exclusão do fundo gástrico. A grelina é um hormônio que
participa no complexo controle entero-hipotalâmico de ingesta alimentar, e se supõe que
aumente a fome (79).
Dentro destas três categorias existem cinco técnicas descritas, com suficiente
literatura baseada em evidências e experiência mundial, para serem consideradas
cirurgias bariátricas efetivamente testadas. Não são consideradas neste grupo, as
cirurgias desaprovadas, como as derivações jejunoileais e outras do gênero. Também não
são consideradas as cirurgias que ainda não apresentam evidências suficientes de sucesso
em longo prazo, sendo, portanto, consideradas experimentais.
As cinco técnicas são: a banda gástrica (BG), a gastroplastia vertical com banda
(GVB), a redução gástrica com derivação em Y de Roux (RGYR), a derivação
bileopancreática (DBP ou Switch Duodenal) e a redução gástrica com Y de Roux com
alça intestinal longa (RGYRAIL), todas podendo ser feitas por via laparoscópica ou
convencional (80).
A cirurgia antiobesidade, como já foi citado, é uma alternativa terapêutica para
obesos mórbidos, tendo um risco-benefício superior aos tratamentos convencionais para
a resolução das patologias associadas (34,81).
As indicações da cirurgia antiobesidade, partem de uma premissa básica: é uma
cirurgia comportamental; cabe ao cirurgião escolher a cirurgia, maximizar a segurança
peri-operatória e otimizar os resultados em longo prazo. Não há uma intenção curativa na
cirurgia bariátrica, e ela requer, diferentemente das outras operações, uma educação e
acompanhamento pré e pós-operatórios para ter bons resultados (82).
Pressupõe-se, para operar um paciente, que ele não consegue controlar a ingesta
alimentar, e que isto o torna um obeso mórbido. Para indicar a cirurgia, deve haver,
45
também, um expresso desejo do paciente de diminuir o peso e, além disto, ele deve ter
uma expectativa realista dos resultados da perda ponderal, ter noção clara dos riscos e
benefícios e, principalmente dos problemas de saúde que poderá ter se permanecer obeso
mórbido.
A indicação formal para operar um paciente obeso se apóia em algumas premissas
estabelecidas. É considerado obeso mórbido com indicação cirúrgica quem tem mais de
45 kg além do peso normal, de acordo com a MHWT, duração da obesidade de pelo
menos dois a cinco anos e história de múltiplas falhas em tratamentos clínicos para
emagrecer com supervisão médica. Deve haver também, uma avaliação psiquiátrica
liberando o paciente para a cirurgia, além de ausência de alcoolismo e de drogadição.
Também é levado em consideração o risco cardio-pulmonar para a indicação da cirurgia
antiobesidade (82).
A conferência do National Institutes of Health de 1991, aprimorou os critérios de
indicação e definiu o que hoje é utilizado, propondo os parâmetros que seguem (83):
- IMC ≥ 35 kg/m2 com co-morbidades ou IMC ≥ 40 kg/m2
- Duração da obesidade por 5 anos ou mais
- Falha de tratamentos clínicos
- Avaliação multidisciplinar liberando para a cirurgia, e definindo um risco
cirúrgico aceitável
- Compreensão e adesão às necessidades de mudança de comportamento, de
hábitos alimentares e controle em longo prazo
Atualmente, alguns critérios foram flexibilizados, e já se fala em indicação
cirúrgica a partir de 32 kg/m2 de IMC, 35 kg/m2 sem co-morbidades, homens com 34
kg/m2, e operações em jovens e adolescentes e cada vez mais precoces (82,84).
46
Em relação ao critério utilizado para avaliar a redução de peso há, recentemente,
uma proposta de padronização para expressar esta perda ponderal, não em quantidade de
quilogramas perdidos, mas sim em percentagem de excesso de peso perdido.
Este padrão foi apresentado em abril de 2003 no editorial do periódico Obesity
Surgery, como recomendação para ser usado em todas as publicações referentes à
cirurgia da obesidade mórbida (85).
O excesso de peso foi calculado partindo do peso ideal, baseado nas tabelas do
MHWT, e foi expresso pela seguinte fórmula:
excesso de peso = peso atual – peso ideal
Do resultado da fórmula do cálculo do excesso, se definiu a perda do mesmo, por
outra fórmula:
PI (peso inicial) – PA (peso atual)
Excesso de PI x 100
Ou também com a aplicação de uma regra de três:
EP (excesso de peso) -------- 100
PP (peso perdido) ----------- X
X = % EPP (excesso de peso perdido)
Todas as formas de calcular o excesso de peso perdido respeitam a padronização
sugerida, e são utilizadas na maioria das publicações atuais.
47
Isto é preconizado para que exista uma linguagem única, o que permite uma
compreensão homogênea do fenômeno, bem como fazer comparações de resultados (86).
Em relação aos resultados da cirurgia bariátrica para o tratamento da obesidade
existem inúmeros relatos na literatura. Num dos vários trabalhos realizados, foram
estudados 232 obesos mórbidos comparando 154 operados com redução do estômago e
78 não-operados. As populações eram semelhantes e o estudo foi retrospectivo. O
objetivo foi ver as diferenças entre a mortalidade e uso de medicamentos na diabete
mélito tipo 2. Foram acompanhados por 9 anos no braço cirúrgico e por 6,2 anos no
braço clínico. A diminuição de medicamentos para diabete foi significativamente maior
(P=0,0001) no braço cirúrgico, e a mortalidade no braço cirúrgico foi menor (9%
incluída a perioperatória) em comparação ao braço clínico (28%). A chance de morte no
grupo operado foi de 1% ao ano e no controle 4,5%; a diminuição da mortalidade nos
operados foi devida primariamente à diminuição de mortes cardiovasculares (34).
Já noutra revisão histórica a obesidade mórbida é citada como grave doença nos
Estados Unidos e nos países industrializados afetando os indivíduos e a sociedade como
um todo. Os riscos da mesma incluem hipertensão, hiperlipidemia, cardiomiopatias,
diabete mélito, doenças ventilatórias como apnéia obstrutiva do sono, aumento do risco
de câncer, colelitíase, artrite degenerativa, infertilidade e conflitos psicológicos, entre
outros. Os tratamentos clínicos raramente apresentaram bons resultados de longo prazo e
houve concordância que a cirurgia antiobesidade é o tratamento de escolha para os
obesos mórbidos motivados e bem informados, que tenham risco cirúrgico aceitável, que
quiserem perder peso e que tenham prejuízo severo pelo excesso de peso. A cirurgia foi
indicada para pacientes com IMC igual ou maior de 40 kg/m2 ou para aqueles que
tenham IMC igual ou maior que 35 kg/m2 com co-morbidades sérias. Três
48
procedimentos neste estudo foram apontados como os de melhor resultado: a banda
gástrica ajustável de silicone (BG), a gastroplastia vertical com banda (GVB) e a redução
de estômago com derivação em Y de Roux (RGYR). Todos eles apresentaram melhores
resultados que os tratamentos clínicos, cada uma com suas vantagens e desvantagens. A
RGYR foi a que produziu os melhores resultados, com a maior perda de peso sustentada
em longo prazo e com um risco pequeno de complicações metabólicas. Todos foram
operados com uma mortalidade operatória surpreendentemente baixa e melhoraram ou
resolveram as co-morbidades tais como diabete e hipertensão (81).
Um dos mais respeitados estudos feitos, mundialmente, até agora, o Swedish
Obese Subjects (SOS), definiu o aumento dramático da obesidade no mundo impondo
sofrimento aos pacientes e altos custos ao sistema de saúde pelas co-morbidades que a
acompanham. A cirurgia gástrica foi apontada como a terapêutica para a redução de peso
com melhores resultados na manutenção desta redução ao longo do tempo, em
comparação a outras alternativas (87).
Este mesmo estudo SOS, numa outra publicação, avalia dois grupos de pacientes.
Um grupo tratado cirurgicamente e outro, clinicamente (845 em cada grupo), seguidos
por dois anos e com população semelhante. Verificou-se que os pacientes tratados com
cirurgia perderam 28 kg (± 15) e os controles 0,5 kg (± 8,9) (P< 0.0001). A incidência de
diabete mélito, hipertensão, hiperinsulinemia e alterações lipídicas foi comparada entre
os dois grupos, havendo significativa melhora no grupo cirúrgico, sugerindo, novamente,
que a obesidade severa deve ser tratada, e que a cirurgia é a melhor opção para estes
pacientes (88).
Ainda dentro do SOS, uma última publicação que envolve 4047 indivíduos com
acompanhamento de dois anos e outros 1703 com acompanhamento de 10 anos,
49
comparando operados e não-operados, aponta, mais uma vez, a cirurgia bariátrica como
opção preferida em relação ao tratamento clínico convencional para a obesidade severa,
resultando em diminuição de peso em longo prazo, melhora do estilo de vida e, exceto
pela hipercolesterolemia, há melhora dos fatores de risco como diabete,
hipertrigliceridemia, hipertensão e hiperuricemia. A redução do estômago com derivação
em Y de Roux também foi sugerida como o melhor procedimento entre todos os
estudados, apresentando os maiores picos de perda de peso em torno de um ano após a
cirurgia (89).
Numa outra publicação, o Adelaid Study, é avaliada a eficácia de três cirurgias
antiobesidade num estudo prospectivo e randomizado com 310 obesos mórbidos. As
populações eram semelhantes, com predomínio feminino, o que reflete a prevalência
usual na obesidade. O sucesso foi definido como uma perda de 50%, ou mais, do excesso
de peso. O seguimento foi de três anos com 91% de adesão e houve perda de excesso de
peso de 17% nas gastrogastrostomias (GG), 48% nas gastroplastias verticais com banda
(GVB) e 67% nas reduções de estômago com derivação em Y de Roux (RGYR) (P<
0,001). Não houve mortes e os pós-operatórios foram semelhantes apesar da RGYR ter
tido um tempo cirúrgico um pouco maior. O trabalho concluiu que RGYR é, mais uma
vez, a operação preferida para o controle da obesidade mórbida (90).
Outro estudo prospectivo randomizado comparou a GVB com a derivação
gástrica com Y de Roux (DGYR), e mostrou falha de 43% na primeira e 23% na segunda.
Para corrigir as falhas das duas foi usada a derivação gástrica isolada (redução) com Y de
Roux (RGYR), o que permitiu comparar as três operações mostrando que a taxa de
sucesso da gastroplastia vertical (GVB) foi de 39%, da derivação gástrica com Y de Roux
50
(DGYR) foi de 58% e da derivação gástrica isolada com Y de Roux (RGYR) foi de 83%,
o que se aplicou para qualquer índice de IMC (91).
A experiência relatada por Mathias Fobi com a RGYR, acrescida de um anel
restritivo de silicone, apresenta um resultado médio semelhante, com 81,3% de
diminuição do excesso de peso em 36 meses de acompanhamento (74).
Rafael Capella obteve resultados semelhantes também com a RGYR acrescida de
um anel restritivo de polipropileno (75).
Um importante e recente estudo sobre o impacto das cirurgias antiobesidade
foi uma revisão sistemática da literatura e meta-análise da mesma, realizado pela
Associação Médica Americana, que mostrou uma prevalência alta de co-morbidades
graves na população obesa mórbida (diabete tipo 2, hiperlipidemia, hipertensão, apnéia
obstrutiva do sono, doença cardíaca, derrame cerebral, asma, degeneração articular,
cânceres e depressão psicológica, entre outras). Mostrou, também, diminuição de 22% da
expectativa de vida devido à obesidade, comparando com indivíduos de peso normal, o
que representa, aproximadamente, 12 anos de vida. Como conclusão final apontou que a
perda de peso efetiva nos pacientes submetidos à cirurgia da obesidade implicou, na
maioria substancial dos pacientes, em completa resolução ou melhora da diabete,
hiperlipidemia, hipertensão e apnéia obstrutiva do sono (28).
Com relação às desvantagens e riscos da cirurgia bariátrica há uma importante
coletânea de dados relatada pelo International Bariatric Surgery Registry (IBSR), órgão
americano que está ligado à American Society of Bariatric Surgery (ASBS). O IBSR
reúne os resultados de muitos cirurgiões dos EUA, dividindo as complicações em
maiores e menores, e apresentando uma mortalidade de 0,3%. O percentual de
complicações maiores foi de 2,04% sendo que as principais foram fístula (0,45%) e
51
embolia pulmonar e falência respiratória (0,3%), responsáveis, respectivamente, por 30%
e 50% das mortes. As complicações menores ocorreram em 4,83% dos pacientes,
distribuídas, principalmente em atelectasia, seroma, infecção de parede, infecção
urinária, dificuldade de passagem na anastomose gastro-entérica, vômitos e desidratação.
Neste relato, a cirurgia mais realizada foi a RGYR, ressaltando que é um registro
selecionado, onde não está presente a experiência de todos os cirurgiões americanos (92).
Já num estudo de análise multivariada de fatores de risco para a RGYR apresentado por
Sugerman e cols. (93) em 2004, a mortalidade é diferente da anterior, variando de 0,5% a
1,5%.
Apesar dos riscos da RGYR, suas vantagens são superiores, por conseguinte, é
uma das cirurgias mais recomendadas atualmente como opção para redução substancial
de peso em pacientes bem informados e motivados, com IMC ≥ 40 ou ≥ 35 que tenham
co-morbidades e risco cirúrgico aceitável.
2.4 BIÓPSIA HEPÁTICA
A primeira biópsia hepática percutânea descrita na literatura, foi realizada por
Paul Ehrlich, em 1883, na Alemanha. Seguiu-se a isto o relato de Menghini em 1958,
após o que, a biópsia tornou-se largamente utilizada (94).
A biópsia hepática é o método de escolha para avaliar a histologia hepática, pois
é o exame mais específico para definir a natureza e a severidade das doenças hepáticas,
bem como monitorar a eficácia dos tratamentos (1).
Tal afirmativa se baseou também, na avaliação feita entre os outros métodos
diagnósticos disponíveis: ultra-sonografia, tomografia computadorizada e ressonância
magnética (95).
52
A ultra-sonografia apresenta, em população de prevalência conhecida, uma
especificidade alta, porém, uma sensibilidade baixa, e, também não distingue as
diferentes alterações histológicas na DHGNA (66,95).
A tomografia computadorizada apresenta uma boa relação entre a atenuação da
passagem dos raios-X pelo parênquima hepático e a presença de esteatose, sendo precisa
e reprodutível, porém, na esteatose severa há dificuldade diagnóstica e na fibrose não há
correlação entre a biópsia e a tomografia computadorizada. Também não há pesquisa
determinando sensibilidade e especificidade da tomografia computadorizada em relação
à histologia quanto à presença de gordura no fígado (95). Devem-se considerar também
os aspectos de exposição à radiação e a impossibilidade de muitos obesos mórbidos
conseguirem realizar a tomografia, devido à incompatibilidade de espaço físico do
aparelho com o seu excessivo volume corporal.
A ressonância magnética apresenta uma boa correlação entre suas medidas e a
gordura histologicamente definida, e tem a vantagem em relação à tomografia
computadorizada, de não expor o paciente à irradiação, porém, é muito mais cara e
pouco tolerada pelos pacientes. Além disto, a maioria dos obesos mórbidos são maiores
que o espaço disponível no aparelho, não podendo ser usado como um exame de rotina
(95).
A análise de 1000 biópsias hepáticas consecutivas em pacientes obesos mórbidos,
realizada pelo grupo italiano de Gênova, coordenado por Nicola Scopinaro, mostrou que
mais de 70% apresentaram esteatose. Foi salientado que os dados bioquímicos realizados
não identificaram pacientes com dano severo no fígado com suficiente sensibilidade para
evitar a biópsia hepática no diagnóstico e estadiamento da DHGNA (96).
53
A indicação da biópsia, por conseguinte, é bem estabelecida na doença hepática
gordurosa não-alcoólica (DHGNA) para diagnóstico, graduação e estadiamento, pois,
mesmo com provas laboratoriais normais e sem evidência clínica da doença, ela poderá
existir (94).
Outro estudo compara biópsias hepáticas realizadas de rotina, com biópsias
hepáticas indicadas pelo aspecto alterado do fígado. Conclui que a biópsia nos fígados
aparentemente alterados foi menos eficaz que as de rotina para detectar as alterações
histológicas. Por isso, sugere que a biópsia hepática, nos pacientes bariátricos, deve ser
feita de rotina para determinar a prevalência das alterações histológicas e direcionar os
cuidados futuros nos pacientes com alterações hepáticas (97).
Para a realização da biópsia hepática existem várias técnicas: biópsia percutânea,
biópsia transjugular, biópsia laparoscópica, biópsia em cunha e a biópsia com agulha
fina, guiada por ultra-sonografia, ou por tomografia computadorizada. Todas elas têm
vantagens e desvantagens, devendo ser avaliado em cada caso, qual a melhor técnica a
ser utilizada (94).
O tamanho do espécime de biópsia varia entre 1 e 3 cm de comprimento e entre
1,2 e 2 mm de diâmetro e representa 1/50.000 do total da massa do fígado. Usualmente,
para avaliação da doença hepática difusa, um espécime de 1,5 cm de comprimento é
considerado adequado para ser feito o diagnóstico. O número de espaços-porta presentes
no espécime é fundamental, e a maioria dos patologistas fica satisfeita com uma biópsia
que contenha 6 a 8 espaços-porta, independente do tamanho.Um espécime adequado
pode ser obtido por agulhas padrão, comumente utilizadas para biópsia hepática. Tais
agulhas medem entre 1,4 a 1,8 mm de diâmetro. As agulhas para biópsia hepática
percutânea são amplamente categorizadas em agulhas de sucção (agulha de Menghini,
54
agulha de Klatskin, agulha de Jamshidi), agulhas cortantes (agulha de Vim-Silverman,
agulha de Trucut) e agulha cortante, tipo Trucut, com mecanismo de pistola (95).
Usualmente, a prática padronizada para biópsia é ambulatorial, observando-se
alguns critérios. O comitê de cuidados de pacientes da Associação Americana de
Gastroenterologia publicou diretrizes práticas para os pacientes que fazem biópsia
hepática ambulatorial. Durante as primeiras 24 horas após o procedimento o paciente
deve estar em local no qual seja possível retornar ao hospital que foi feita a biópsia em
no máximo 30 minutos, ao início de qualquer sintoma adverso. Ele deverá ser
hospitalizado se houver evidência de sangramento, vazamento de bile, pneumotórax,
evidência de perfuração de órgão ou se a dor apresentada requerer mais de uma dose de
analgésicos nas primeiras quatro horas após a biópsia (98).
A biópsia hepática é um procedimento seguro quando feita por médicos
experientes. A biópsia às cegas, sem acompanhamento ecográfico, deve ser realizada
por gastroenterologistas, hepatologistas e cirurgiões de transplante hepático, e não por
médicos generalistas. Esta é a técnica mais freqüentemente realizada com base nos
estudos de prevalência que apontam a biópsia percutânea às cegas como padrão. Dentro
das primeiras 24 horas após a biópsia ocorrem 90% das principais complicações, sendo
que a maioria se manifesta ainda nas primeiras 2 horas. Aproximadamente de 1 a 3%
dos pacientes necessitam hospitalização por complicações após uma biópsia hepática,
especialmente se o procedimento for feito com agulha Trucut. Dor e hipotensão arterial
são as complicações predominantes. As complicações menores são desconforto
transitório no local da biópsia, dor que requer analgésicos e hipotensão pequena e
transitória por reação vagal. Aproximadamente ¼ dos pacientes tem dor no quadrante
superior direito ou ombro direito após a biópsia hepática. A dor geralmente é surda e de
55
pequena intensidade. Dor abdominal severa alerta para complicações como sangramento
e peritonite.
Apesar de muito raro, o sangramento clinicamente significativo, é a complicação
mais séria da biópsia percutânea e ocorre geralmente nas primeiras três horas após o
procedimento. Sangramento intraperitoneal pode resultar da laceração causada pela
aspiração profunda durante a biópsia, ou pode ser ocasionado pelo trauma penetrante de
um ramo da artéria hepática, ou veia porta, conforme o tipo de técnica utilizada (94). Os
fatores de risco para hemorragia depois da biópsia hepática, além dos distúrbios de
coagulação são, idade avançada, mais de três penetrações com a agulha na punção, e
presença de hemangioma, cirrose ou câncer no fígado. Achado de líquido livre
intraperitoneal na ultra-sonografia, ou CT, deve ser correlacionado com a condição
clínica do paciente. Se a suspeita é de hemorragia, devem ser tomadas providências para
ter sangue, plaquetas e plasma para transfusão. O cirurgião e o angiografista devem ser
alertados e estarem disponíveis. Medidas para estabilizar hemodinamicamente o paciente
pela administração de líquidos intravenosos, sangue e derivados, podem ser suficientes.
Se a instabilidade hemodinâmica persistir por algumas horas apesar do uso de medidas
de reposição e ressuscitação, está indicada a realização de angiografia, embolização ou
exploração cirúrgica. Um pequeno hematoma intra-hepático ou subcapsular pode ser
notado após a biópsia hepática mesmo em pacientes assintomáticos, bem como
hematomas maiores com alteração hemodinâmica e diminuição do hematócrito. A
conduta conservadora é geralmente suficiente (94).
Outra complicação é a hemobilia, que usualmente se apresenta com a tríade,
sangramento gastrointestinal, dor em hipocôndrio direito e icterícia, em
aproximadamente 5 dias após a biópsia. Bacteremia passageira tem sido relatada em 5,8
56
a 13,5% dos pacientes após a biópsia hepática. Septicemia e choque podem se
desenvolver em situações raras nos pacientes com obstrução biliar e colangite.
Usualmente, não é recomendado antibiótico profilático de rotina para biópsia hepática,
mesmo nos pacientes com próteses valvulares ou de articulações (94).
A taxa de mortalidade entre os pacientes que são submetidos à biópsia hepática é
aproximadamente de 1 em 10.000 até 1 em 12.000, sendo maior entre pacientes com
lesões malignas e cirrose (94).
Uma análise de 21 anos de experiência, com 9.212 biópsias realizadas dentro de
protocolo prospectivo, evidenciou que a mortalidade estava ligada fundamentalmente ao
sangramento e que este ocorria mais em pacientes com câncer, em idosos, e quando era
realizada mais de uma punção. A taxa de mortalidade nos pacientes sem estes fatores de
risco ficou em 0,04% (99).
A mortalidade pode aumentar para 0,13% até 0,33%, em casuísticas onde o
procedimento é feito por médicos não-especialistas, onde predomina a experiência
menor do que 100 procedimentos realizados (100).
Embora os critérios de contra-indicação sejam considerados absolutos pela
maioria dos hepatologistas, alguns podem ser corrigidos por transfusões de plaquetas ou
plasma e não são totalmente definitivos em casos de extrema necessidade do
procedimento (Tabela 6).
57
TABELA 6 - Contra-indicações para biópsia hepática percutânea
• Absolutas o Paciente não cooperativo o História de sangramento inexplicado o Tendência a sangrar
� Protrombina ≥ 3-5 segundos mais que o controle � Plaquetas < 50.000 mm3 � Tempo de sangria ≥ 10 minutos � Uso de drogas anti-inflamatórias não-esteróides prévias entre 7 a
10 dias o Sangue para transfusão não disponível o Suspeita de hemangioma ou outro tumor vascularizado o Impossibilidade de identificar o ponto de punção adequado o Suspeita de cisto equinocócico
• Relativas o Obesidade Mórbida o Ascite o Hemofilia o Infecção no território de punção
Fonte: N Engl J Med, Bravo AA et al, vol.344, 2001
Salienta-se que o procedimento deve ser precedido por consentimento informado
do paciente, o que é considerado indispensável, independente dos outros procedimentos
éticos e legais para pesquisa (101).
As amostras de fígado com esteatose são analisadas pelos patologistas que
utilizam vários tipos de classificações quanto ao grau de severidade, mas até o momento
não existe um consenso sobre qual a melhor classificação a ser utilizada (45,102,103).
59
3 OBJETIVOS
3.1 OBJETIVO GERAL
Avaliar o comportamento da esteatose hepática nos pacientes obesos mórbidos
após o emagrecimento induzido pela cirurgia bariátrica.
3.2 OBJETIVOS ESPECÍFICOS
1. Definir, por biópsia trans-operatória, a histologia hepática dos pacientes
obesos mórbidos, submetidos à cirurgia bariátrica.
2. Definir, por biópsia percutânea, a histologia hepática dos mesmos pacientes
após o emagrecimento obtido pela intervenção cirúrgica.
3. Comparar, histologicamente, as duas biópsias.
4. Avaliar outras variáveis que possam ter influência no resultado histológico,
tais como: diabete mélito, dislipidemia, hipertensão arterial sistêmica, idade,
sexo, IMC, relação cintura-quadril, e quantidade de peso perdido.
61
4 PACIENTES E MÉTODOS
4.1 DELINEAMENTO
Estudo clínico, coorte histórica.
4.2 PACIENTES
Foram selecionados pacientes obesos mórbidos submetidos à cirurgia bariátrica
por via convencional (cirurgia aberta), realizadas no Centro da Obesidade Mórbida do
Hospital São Lucas da Pontifícia Universidade Católica do Rio Grande do Sul (COM -
HSL/PUCRS).
4.2.1 CRITÉRIOS DE INCLUSÃO
- Ser paciente obeso mórbido.
- Ter indicação cirúrgica formal.
- Ter sido submetido à biópsia trans-operatória e pós-operatória após o
emagrecimento, em torno de um ano após a cirurgia.
- Ter sido submetido à cirurgia pela mesma equipe cirúrgica e com a
técnica cirúrgica básica proposta.
4.2.2 CRITÉRIOS DE EXCLUSÃO
- A amostra da biópsia não ter sido suficiente para adequada análise
anátomo-patológica.
- A biópsia não ter sido avaliada pela mesma equipe de patologistas.
- Marcadores sorológicos positivos para hepatites virais B e C, e auto-
imunes.
62
- Uso de drogas potencialmente causadoras de esteatose hepática.
4.3 PROCEDIMENTOS
Foram analisados todos os pacientes operados, submetidos à biópsia hepática
trans-operatória, no período de julho de 2001 a junho de 2003, pela mesma equipe
cirúrgica. A biópsia faz parte da rotina assistencial do COM para pacientes bariátricos
operados, e é proposta para ser sistematicamente repetida após o emagrecimento, em
torno de um ano de pós-operatório, naqueles pacientes que apresentaram alterações
histológicas na primeira biópsia.
Todas as amostras de biópsia foram analisadas pelo mesmo grupo de patologistas
do Serviço de Patologia do HSL/PUCRS e pelo mesmo método.
Os pacientes foram informados da realização da biópsia e sua importância,
quando do esclarecimento dos procedimentos a serem realizados no trans-operatório.
Utiliza-se um protocolo de rotinas de cuidados e acompanhamento do paciente
bariátrico, que começa já na avaliação do paciente, na preparação pré-operatória e na
educação dos mesmos, quando são candidatos à cirurgia bariátrica (ANEXOS 1 e 2).
Aqueles pacientes que apresentaram histologia alterada no trans-operatório,
foram informados das possíveis implicações e riscos que este achado poderia ocasionar,
e da necessidade de controlar a evolução desta alteração. Eles foram relembrados da
rotina de controle combinada, em torno de um ano de pós-operatório, onde deve ser
repetida a biópsia hepática nos casos que apresentaram alteração histológica. A escolha
de repetir a biópsia no controle de um ano é porque este é o período em que ocorre a
maior perda de peso dos pacientes.
63
Os pacientes que concordaram com a realização do procedimento foram
encaminhados para fazer a biópsia hepática percutânea.
Após o resultado da segunda biópsia, aqueles que ainda permaneceram com
alteração são novamente convidados a realizar uma terceira biópsia, após um ano, ainda
dentro da rotina de controle pós-operatório de evolução e cuidados relativos às co-
morbidades associadas.
Os dados, a partir dos quais o trabalho foi realizado, constam do banco de dados
do COM - HSL/PUCRS que são registrados, na sua maioria, desde o início da sua
atividade em março de 2000. Alguns outros dados foram obtidos dos prontuários do
COM, que são arquivados na sua sede e fazem parte do protocolo de rotinas pré, trans e
pós-operatórias (ANEXOS 3, 4 e 5).
4.3.1 TÉCNICAS UTILIZADAS
4.3.1.1 TÉCNICA CIRÚRGICA
Todos os pacientes foram submetidos à técnica de redução gástrica
com derivação em Y de Roux tipo Fobi-Capella, que secciona o estômago em
duas porções: uma pequena e outra grande. A secção entre as duas é feita a partir
da pequena curvatura, a 10 cm da membrana freno-esofágica, em direção ao
fundo gástrico, próximo ao ângulo de Hiss. A parte grande corresponde ao
estômago que fica excluído do trânsito alimentar. A parte pequena, com volume
inicial de 30 ml, é anastomosada à porção jejunal longa de um Y de Roux. O
alimento entra no pequeno estômago, desce por esta alça intestinal (alça
alimentar) e se encontra com a outra porção do jejuno (alça bileopancreática) que
64
está anastomosada a ela, e de onde vêm as secreções gástricas, biliares e
pancreáticas iniciando, neste ponto, a principal absorção dos alimentos. É
colocado, no pequeno estômago, um anel de sylastic que o envolve, um pouco
acima da anastomose gastrointestinal, a 7 cm da membrana freno-esofágica,
originando, com isto, um neopiloro de diâmetro aproximado de 1,2 cm, o que
mantém o componente restritivo da cirurgia ao longo do tempo.
4.3.1.2 TÉCNICA DAS BIÓPSIAS
A biópsia hepática trans-operatória foi realizada em cunha ou por
agulha, na face anterior do segmento IV do fígado. Dizer por que foi em cunha
ou agulha.
A biópsia pós-operatória foi realizada por punção-biópsia hepática
intercostal às cegas, sob anestesia local. A localização do fígado é feita por
percussão, com inserção da agulha entre o 8º e 9º espaço intercostal, na linha
axilar média, ao final da expiração. Para a inserção da agulha e coleta da amostra
foi utilizada uma “pistola” mecânica, com agulha Bard Magnum. Todos pacientes
ficaram em observação por 5 horas após o procedimento. Todas as biópsias foram
realizadas pelo mesmo profissional, com experiência neste procedimento, já
tendo realizado cerca de 1.000 biópsias nos últimos 10 anos.
4.3.1.3 ANÁLISE DAS AMOSTRAS HEPÁTICAS
Foi utilizado o microscópio óptico para observação das lâminas.
As amostras foram fixadas em parafina e coradas com o método de hematoxilina-
eosina (HE).
65
4.3.2. CRITÉRIO DE CLASSIFICAÇÃO DE ESTEATOSE
A classificação utilizada levou em consideração a quantidade de
parênquima hepático envolvido, classificando a esteatose em 3 graus: leve, com
menos 1/3 de tecido envolvido; moderado, com 1/3 a 2/3 de tecido envolvido; e
severo, com mais de 2/3 comprometidos (45).
4.4 OUTRAS VARIÁVEIS ESTUDADAS
Também foram avaliados nestes pacientes, idade, sexo, IMC, relação cintura-
quadril, e presença de hipertensão arterial sistêmica, diabete mélito e dislipidemia. Não
foi avaliada a resistência à insulina, pois os padrões de sua verificação de que dispomos
ainda não são considerados adequados.
4.5 TAMANHO DA AMOSTRA
Foram escolhidos aqueles pacientes que tinham a biópsia trans-operatória de
rotina e realizaram a segunda biópsia, após o emagrecimento, em torno de um ano da
cirurgia e dentro do prazo viável para serem incluídos neste trabalho.
4.6 ANÁLISE ESTATÍSTICA
As variáveis qualitativas foram comparadas através do cálculo do qui-quadrado
para tabelas de contingência.
Os graus de esteatose observados no trans-operatório e em um ano após a cirurgia
foram categorizados em níveis (leve, moderado e severo), sendo as diferenças
66
observadas, analisadas com o teste de Wilcoxon para verificar a significância entre os
dois momentos.
As variáveis quantitativas foram submetidas à ANOVA.
Em todos os casos foram consideradas significativas as diferenças que
apresentaram P ≤ 0,05.
4.7 ASPECTOS ÉTICOS
O projeto desta pesquisa foi aprovado pelo Comitê de Ética em Pesquisa do
Hospital São Lucas da PUCRS.
Além disto, todos os pacientes participaram das reuniões mensais do COM de
pacientes obesos operados e não operados. Nestes encontros se realizam palestras
esclarecedoras da doença obesidade e suas co-morbidades, dos procedimentos realizados
para seu controle e da necessidade de adesão aos controles e cuidados pós-operatórios
em longo prazo. Esta ocasião é um dos momentos em que os pacientes tem a
oportunidade de trocar experiências e esclarecer dúvidas.
Foi realizado, ao fim do preparo pré-operatório, um questionário respondido pelo
paciente e corrigido por um membro da equipe, junto com o paciente e um familiar. Esta
“sabatina” visa identificar o grau de entendimento do candidato à cirurgia em relação ao
processo de tratamento e controle da obesidade que vai realizar.
Finalmente, foi assinado um termo de consentimento informado para a cirurgia e
para a necessidade de acompanhamento pós-operatório, com fluxograma de rotinas
anexo. Dentro deste termo está incluída uma parte específica para pesquisa, atendendo as
normas da Resolução 196/96 do Conselho Nacional de Saúde / Ministério da Saúde. Para
69
5 RESULTADOS
No período de julho de 2001 até junho 2003, foram selecionados 186 pacientes
obesos mórbidos, que preencheram os critérios de inclusão e exclusão, e foram
submetidos à RGYR convencional tipo Fobi-Capella pelo mesmo grupo cirúrgico.
Na biópsia trans-operatória, 170 pacientes (91,39%) apresentaram alterações
histológicas, e apenas 16 (8,6%) mostraram parênquima hepático normal. Destes 170
pacientes, 163 (87,63%) apresentaram esteatose, 4 (2,15%) esteatohepatite, 2 (1,07%)
cirrose, e um paciente (0,53%) tinha hepatite crônica severa.
Dos 163 pacientes com esteatose, 51 apresentaram esteatose leve (31,29%), 43
tinham esteatose moderada (26,38%) e 69 tinham esteatose severa (42,33%), conforme é
apresentado na Tabela 7.
TABELA 7 - Histologia no trans-operatório
HISTOLOGIA N
TECIDO HEPÁTICO PRESERVADO 16 (8,60%)
TOTAL DE ALTERAÇÕES HEPÁTICAS 170 (91,39%)
Esteatose hepática 163 (87,63%)
Leve 51
Moderada 43
Severa 69
Esteatohepatite 4 (2,15%)
Cirrose 2 (1,07%)
Hepatite crônica severa 1 (0,53%)
TOTAL 186
70
Destes 163 pacientes, 54 fizeram acompanhamento regular com a equipe, mas
recusaram fazer a segunda biópsia, 15 não fizeram acompanhamento adequado, não
permitindo a realização da segunda biópsia e um paciente morreu de complicações
durante o pós-operatório imediato. Assim, dos 163 pacientes com esteatose, 93
realizaram a biópsia percutânea em torno de um ano após a cirurgia bariátrica. Em três
casos a amostra foi considerada inadequada para análise histopatológica, restando então,
90 pacientes que foram incluídos no estudo.
Destes 90 pacientes elegíveis, 64 (71%) eram do sexo feminino e 26 (29%) do
sexo masculino; apresentaram uma média de idade de 35,6 anos (± 10,4), variando de 18
a 58 anos, e um IMC médio de 46,7 kg/m2 (± 8,4), com mínimo de 33,8 e máximo de 82
kg/m2. Sessenta e seis pacientes (73%) apresentavam dislipidemia, 47 (52%) tinham
HAS e 9 (10%) DM, como mostrado na Tabela 8.
TABELA 8 - Perfil dos pacientes no pré-operatório
GÊNERO FEMININO 64 (71%)
GÊNERO MASCULINO 26 (29%)
IDADE 35,5 (± 10,4)
IMC 46,7 (± 8,4)
DISLIPIDEMIA 66 (73%)
HAS 47 (52%)
DM 9 (10%)
Na biópsia trans-operatória os pacientes apresentaram esteatose leve em 27
pacientes (30%), moderada em 24 (26,7%) e severa em 39 (43%). Esta distribuição foi a
71
mesma que a dos 163 pacientes que realizaram somente a 1ª biópsia trans-operatória
(P=0,968) Tabela 9.
TABELA 9 - Distribuição dos graus de esteatose
BIÓPSIA TRANS-OPERATÓRIA LEVE MODERADA SEVERA
N = 163 51 (31,3%) 43 (26,4%) 69 (42,3%)
N = 90 27 (30,0%) 24 (26,7%) 39 (43,3%)
P = 0,968
As biópsias trans-operatórias dos 90 pacientes estudados foram realizadas em
cunha em 49, e por agulha em 41 pacientes. Não houve diferença com relação ao perfil
dos pacientes entre os dois tipos de biópsia trans-operatórias (P>0,05), o que pode ser
observado na Tabela 10.
TABELA 10 - Biópsia em cunha x agulha
CUNHA
N = 49
AGULHA
N = 41
TOTAL
N = 90
P
Idade (anos) 35,86 (±1,44) 35,24 (±1,70) 35,58 (±1,10) 0,782
IMC (kg/m2) 47,31 (±1,19) 45,98 (±1,32) 46,71 (±0,88) 0,457
Cintura / Quadril 0,91 (±0,02) 0,94 (±0,017) 0,93 (±0,0130) 0,347
Gênero masculino 12 (24,5%) 14 (34,1%) 26 (28,9%) 0,220
Gênero feminino 37 (75,5%) 27 (65,9%) 64 (71,1%) 0,220
Diabete 5 (10,2%) 4 (9,8%) 9 (10%) 0,613
HAS 29 (59,2%) 18 (43,9%) 47 (52,2%) 0,109
Dislipidemia 36 (73,5%) 30 (73,2%) 66 (73,3%) 0,581
Emagrecimento 80,61% (±2,41) 82,29% (±3,20) 81,37 (±1,95) 0,671
72
Estes 90 pacientes tiveram uma média de perda do excesso de peso de 81,4%
(±1,95), atingindo assim, um IMC médio de 29,62 (±0,509) após um ano de cirurgia.
A biópsia percutânea obtida um ano após a cirurgia mostrou que 49 pacientes
(54,4%) apresentaram tecido hepático normal, 34 (37,8%) evidenciaram esteatose leve, 4
(4,4%) esteatose moderada, e 3 (3,3%) esteatose severa. Dos 27 pacientes que
apresentavam esteatose leve no trans-operatório 11 (40,7%) permaneceram com o
mesmo grau de esteatose e 16 (59,3%) apresentavam tecido hepático normal após um
ano.
Dos 24 pacientes que apresentavam esteatose moderada no trans-operatório, 2
(8,3%) permaneceram com esteatose moderada após um ano, 7 (29,2%) passaram para
grau leve e 15 (62,5%) passaram para tecido normal.
Dos 39 pacientes com esteatose severa, 3 (7,7%) permaneceram com o mesmo
grau de esteatose, 2 (5,1%) passaram para grau moderado, 16 (41%) passaram para grau
leve e 18 (46,2%) apresentaram parênquima hepático normal após um ano.
Assim, após o emagrecimento, apenas 16 pacientes (17,8%) permaneceram com
o mesmo grau de esteatose, 25 (27,8%) melhoraram o grau de esteatose, e 49 (54,4%)
apresentaram tecido hepático normal na segunda biópsia. Houve diferença estatística
significativa entre a histologia trans-operatória e sua modificação no pós-operatório,
demonstrada pelo teste de Wilcoxon, onde se observou z = - 7.593, P<0.0001.
As modificações histológicas após o emagrecimento são apresentadas nas
Tabelas 11 e 12.
73
TABELA 11 - Esteatose trans-operatória x modificação histológica
Normal Melhorada Inalterada Leve 16 (59,3%) 0 11 (40,7%)
Moderada 15 (62,5%) 7 (29,2%) 2 (8,3%) Severa 18 (46,1%) 18 (46,2%) 3 (7,7%) Total 49 (54,4%) 25 (27,7%) 16 (17,7%)
TABELA 12 - Esteatose hepática antes e após o emagrecimento
ESTEATOSE TRANS-OPERATÓRIO ESTEATOSE PÓS-OPERATÓRIO
Ausente
49 (54,4%)
Leve
34 (37,8%)
Moderada
4 (4,4%)
Severa
3 (3,3%)
Leve 27 (30,0%) 16 (59,3%) 11 (40,7%) - -
Moderada 24 (26,7%) 15 (62,5%) 7 (29,2%) 2 (8,3%) -
Severa 39 (43,3%) 18 (46,2%) 16 (41,0%) 2 (5,1%) 3 (7,7%)
Wilcoxon, z = - 7,593, P<0, 0001
Não houve diferença quanto às modificações histológicas dos pacientes com
esteatose leve, moderada e severa, em relação à idade (P=0,067), IMC (P=0,402),
relação cintura-quadril (P=0,246) e presença de diabete mélito (P=0,249), hipertensão
arterial sistêmica (P=0,373) e dislipidemia (P=0,490). A única diferença observada
estatisticamente significativa foi quanto ao gênero dos pacientes (P=0,04). O perfil dos
pacientes, quanto às variações nos níveis de esteatose é apresentado na Tabela 13.
74
TABELA 13 - Perfil dos pacientes x histologia após emagrecimento
Esteatose
inalterada
N = 16
Esteatose
melhorada
N = 25
Esteatose
ausente
N = 49
Total
N = 90
P
Idade (anos) 37,56 (±2,62) 38,80 (±2,05) 33,29 (±1,44) 35,58 (±1,11) 0,067
IMC (kg/m2) 49,08 (±3,00) 46,92 (±1,56) 45,82 (±1,03) 46,71 (±0,88) 0,402
Cintura / Quadril 0,91 (±0,032) 0,97 (±0,028) 0,91 (±0,016) 0,93 (±0,0130) 0,246
Gênero masculino 3 (18,8%) 12 (48,0%) 11 (22,4%) 26 (28,9%) 0,044
Gênero feminino 13 (81,3%) 13 (52,0%) 38 (77,6%) 64 (71,1%) 0,044
Diabete mélito 0 4 (16,0%) 5 (10,2%) 9 (10%) 0,249
HAS 8 (50,0%) 16 (64,0%) 23 (46,9%) 47 (52,2%) 0,373
Dislipidemia 10 (62,5%) 18 (72,0%) 38 (77,6%) 66 (73,3%) 0,490
Para verificar a possível associação entre o gênero e outras variáveis, os pacientes
foram categorizados e analisados de acordo com o gênero.
Pacientes femininos mostraram média da relação cintura-quadril de 0,89 (±
0,013), significativamente menor que os homens que foi de 1,02 (± 0,020) (P>0,001).
Não houve diferença estatística significativa quanto à idade (P=0,085) ou ao IMC
(P=0,362) entre homens e mulheres. Também não houve diferença estatística
significativa considerando a presença de co-morbidades como DM (P=0,236), HAS
(P=0,485), dislipidemia (P=0,583) ou com relação ao tipo de biópsia realizada (P=220).
As características dos pacientes quanto ao gênero são apresentadas na Tabela 14.
75
TABELA 14 - Características dos pacientes quanto ao gênero.
Masculino
N = 26
Feminino
N = 64
Total
N = 90
P
Idade (anos) 32,62 (±2,11) 36,78 (±1,26) 35.58 (±1.10) 0,085
IMC (kg/m2) 47,98 (±1,43) 46,19 (±1,09) 46.71 (±0.88) 0,362
Cintura / Quadril 1,02 (±0.020) 0,89 (±0.013) 0.93 (±0.0130) <0,001
Diabete mélito 4 (15,4%) 5 (7,8%) 9 (10%) 0,236
HAS 13 (50,0%) 34 (53,1%) 47 (52.2%) 0,485
Dislipidemia 19 (73,1%) 47 (73,4%) 66 (73,3%) 0,583
Emagrecimento 74,65% (±4,45) 84,11% (±1,99) 81,37 (±1.95) 0,027
Como já foi mencionado, a média de excesso de peso perdido nos 90 pacientes
foi de 81,4% (± 1,95). A média de excesso de peso perdido nos pacientes que não
melhoraram da esteatose foi de 72,5% (± 5,89). Entre os pacientes que melhoraram da
esteatose foi de 78% (± 3,37), e foi de 85,9% (± 2,33) nos pacientes que apresentaram
parênquima hepático normal após o emagrecimento. Estes resultados apresentam uma
diferença estatisticamente significativa (P= 0,022). O gráfico da Figura 2 mostra o
emagrecimento, calculado pela % de perda do excesso de peso, relacionado às
modificações histológicas.
76
FIGURA 2 - Emagrecimento (% de perda do excesso de peso) x modificações do
padrão histológico
P=0,022
Não foram identificadas complicações nas biópsias trans-operatórias.
Quanto às biópsias percutâneas, houve dor em hipocôndrio direito, de leve à
moderada intensidade, em cerca de 30% dos pacientes, o que foi resolvido com uso de
analgésicos não-opióides nas primeiras horas pós-biópsia. Foi identificado um hematoma
subcapsular hepático casualmente, por ocasião de uma ecografia de rotina de um ano de
acompanhamento, que se resolveu espontaneamente.
50%
55%
60%
65%
70%
75%
80%
85%
90%
Inalterado Melhorado Normal
Padrão Histológico
78
6 DISCUSSÃO
Os pacientes estudados apresentaram uma prevalência maior do sexo feminino
(71%), um IMC médio de 46,7 kg/m2, e presença das principais co-morbidades como
dislipidemia, DM e HAS, semelhantes à literatura. A idade média de 35,6 anos também é
comparável à literatura, embora este dado possa variar um pouco conforme os cirurgiões,
já que alguns indicam cirurgia mais freqüentemente em pacientes mais jovens. Assim,
este grupo de pacientes estudados não difere de maneira significativa dos demais grupos
de pacientes operados no mundo.
Com relação à DHGNA, sua real prevalência é desconhecida, mas estima-se que
seja de 10% a 39% na população adulta em geral (2), e que venha aumentando, já que
sua prevalência é paralela à da obesidade e da resistência à insulina. Na população obesa
a prevalência sobe para 57% a 74% (3). Na nossa população de obesos mórbidos
operados, encontramos esteatose em 87,63% dos pacientes, que está de acordo com a
literatura, que mostra uma prevalência de 70% a 90% (104,105). A DHGNA já é
considerada a doença hepática mais comum na atualidade (11) sendo crescente a
preocupação com este diagnóstico, inclusive em crianças obesas, principalmente pelas
implicações prognósticas em longo prazo nesta população (1,106)
A obesidade e a diabete mélito são os dois mais importantes fatores de risco para
o desenvolvimento de esteatose e EHNA (44), sendo que ambos os fatores estão
associados com resistência à insulina e são considerados componentes da síndrome
metabólica. A resistência à insulina também está presente nos pacientes com esteatose ou
79
EHNA, mesmo na ausência de DM, o que aumenta o espectro da síndrome metabólica
para incluir estas duas condições (esteatose e EHNA) (46). Ou seja, atualmente a
esteatose e a EHNA já são consideradas como parte da síndrome metabólica, reforçando
a importância clínica deste diagnóstico.
Entre as causas da esteatose e EHNA também estão a derivação jejunoileal e a
gastroplastia, cirurgias realizadas para tratamento da obesidade mórbida (12). A
derivação jejunoileal era uma cirurgia muito realizada na década de 60 e estava
associada com uma incidência de 40% de alteração de função hepática no pós-
operatório, com EHNA severa e insuficiência hepatocelular em 6% dos pacientes (107),
motivo pelo qual esta cirurgia não é mais recomendada (28). Existem alguns artigos
implicando o bypass gastrointestinal como causa de esteatose (1,108), mas outros(109)
relatam melhora. Os nossos resultados mostraram que não houve nenhuma piora da
histologia hepática com a cirurgia realizada, o bypass gastrointestinal.
Alguns trabalhos (12,69) mostram que o grau de obesidade se correlaciona
positivamente com a prevalência e severidade da esteatose, sendo que a prevalência da
EHNA é proporcional à severidade da esteatose.
Nossos resultados mostraram ser realmente alta a prevalência de esteatose
(87,6%) neste grupo de pacientes com um grau maior de obesidade (mórbida) e que,
destes, 43,3% apresentavam esteatose severa, o que está de acordo com um grande
número de trabalhos na literatura (7,8,104,105,110,111).
É esperado que, com a diminuição do peso, haja regressão da esteatose (2,110),
embora alguns autores (112) sugiram que não há evidências suficientes para dar suporte
a esta idéia. Em relação a isto, o achado que consideramos mais importante deste
trabalho foi que 54,4% dos pacientes obesos mórbidos com esteatose no trans-operatório
80
apresentaram histologia hepática normal após o emagrecimento e 27,8% tiveram
melhora do grau de esteatose. Ou seja, após a perda de peso ocasionada pela cirurgia,
apenas 17,8% dos pacientes permaneceram com o mesmo grau de esteatose (histologia
inalterada) e nenhum paciente apresentou piora histológica. Além disto, os pacientes
com maior percentagem de perda do excesso de peso apresentaram uma melhora mais
marcada no grau de esteatose, reforçando a importância do emagrecimento para a
regressão da esteatose.
Como já foi dito, um dos principais fatores relacionando EHNA com fibrose é a
severidade da esteatose (12), e os nossos pacientes mostraram uma melhora importante
na prevalência da esteatose severa após o emagrecimento: 39 pacientes (43,3%) versus 3
pacientes (3,3%), ou seja os pacientes com esteatose severa apresentaram 92,3% de
melhora ou resolução completa e apenas 7,7% continuaram com o mesmo padrão
histológico.
Além da marcada perda de peso, não conseguimos identificar outro fator que
pudesse ter contribuído de maneira significativa na melhora da esteatose, já que não
houve diferença estatística significativa das modificações histológicas em relação à
idade, IMC, relação cintura-quadril, presença de dislipidemia, DM, e HAS.
Foi observada uma diferença no gênero dos pacientes em relação à histologia
após o emagrecimento, mas não encontramos uma razão definida para este achado.
Talvez, uma possibilidade para explicar isto seja o fato de que, na biopsia trans-
operatória, os pacientes do sexo masculino apresentavam uma prevalência maior de
esteatose moderada e severa em relação às mulheres, fazendo com que tivessem mais
chance de apresentar melhora da histologia. As mulheres, como tinham mais esteatose
leve, tinham menos chance de apresentar melhora, já que a esteatose leve, na nossa
81
classificação, não pode “melhorar” (passar para um grau menor de esteatose, sem
contudo normalizar a histologia), apenas apresentar parênquima hepático normal.
Analisando o gênero isoladamente em relação às outras variáveis, observamos
que a relação cintura-quadril se mostra diferente entre homens e mulheres (P<0,001).
Achamos que isto apenas reflete a natural diferença física entre homens e mulheres, já
que estas usualmente apresentam uma menor circunferência de cintura e maior do
quadril em relação aos homens.
Alguns autores (108,109) já descreveram a melhora da esteatose após a cirurgia
antiobesidade, mas nestes estudos a biópsia hepática após o emagrecimento foi feita
sempre pela necessidade de uma segunda cirurgia, em espaços de tempo bem variados, e
não de maneira sistemática, como neste estudo.
Alguns autores (4,5,43) acreditam que a DHGNA tem uma evolução, na maioria
das vezes, benigna e que, não mais do que 10% a 30% dos pacientes, desenvolveriam
cirrose na próxima década, mas consideramos este percentual bastante expressivo
levando em conta uma doença grave, cujo único tratamento atual é o transplante
hepático. Além disto, já existem evidências, embora um pouco escassas, que sugerem
que a EHNA progride para cirrose numa taxa geralmente similar a de outras causas de
hepatite crônica (13).
No trabalho de Clark e Diehl são comentados alguns dados epidemiológicos que
nos parecem de bem importantes. Se fizermos uma extrapolação conservadora de dados
do NHANES III (National Health and Nutricional Examination Survey III), se sugere
que 6,4 milhões de americanos adultos tenham DHGNA e que 640.000 destes possam ter
cirrose (admitindo que apenas 10% dos pacientes com DHGNA desenvolvam cirrose).
Em comparação, estudos populacionais sugerem que menos de 2% da população
82
americana adulta (2 milhões de indivíduos) esteja infectada com hepatite crônica C. Se
20% da população com hepatite crônica C desenvolver cirrose, então a hepatite crônica
C é a causa de aproximadamente 500.000 casos de cirrose, menos do que as 640.000
causadas por DHGNA. Isto reforça a idéia que a DHGNA é tão ou mais importante que a
hepatite crônica por vírus C para o desenvolvimento de cirrose.
As autoras seguem comentando que esta análise é freqüentemente vista com certo
ceticismo, porque até a muito pouco tempo se acreditava que a morbi-mortalidade
relacionada ao fígado fosse muito mais freqüente em pacientes com cirrose por vírus C
do que cirrose devido a DHGNA. Um exemplo disto é a lista de espera para transplante
hepático nos EUA, onde em, pelo menos, 1/3 dos pacientes a causa da cirrose é a
hepatite crônica C, enquanto que a DHGNA é listada em apenas 1% dos casos. Convém
salientar que os pacientes com DHGNA comumente têm associado co-morbidades como
obesidade mórbida e DM tipo 2, geralmente associados com doença cardiovascular,
insuficiência pulmonar e doenças malignas extra-hepáticas que podem, muitas vezes,
impedir o paciente de se candidatar a um transplante hepático, o que pode ocasionar uma
sub-avaliação do efeito adverso hepático nos pacientes com DHGNA. Em contrapartida,
dados recente demonstram que a cirrose criptogênica é a 3a ou 4a causa de indicação para
transplante hepático nos EUA. (121). Além disto, a crescente evidência de que a
DHGNA é a causa mais comum de cirrose criptogênica, pode fazer os clínicos
modificarem sua opinião sobre a suposta benignidade da DHGNA (13).
Vários trabalhos sugerem que a esteatose, sem inflamação, tem um curso bastante
benigno, mas é importante salientar que para o desenvolvimento da EHNA é necessário
que haja esteatose, ou seja, a esteatose é o 1o passo (1º hit), o pré-requisito para o
desenvolvimento da EHNA. E, como não se sabe quais os pacientes que vão evoluir para
83
doença mais avançada, achamos que devemos dar mais importância à presença de
esteatose e tentar eliminá-la.
Até o momento não há tratamento específico e comprovado para a esteatose
hepática, embora existam pesquisas sendo realizadas com vários medicamentos como
Metformina, vitamina E (antioxidante), ácido ursodesoxicólico e agentes anti-
lipemiantes. Por isso, por enquanto, as tentativas de resolução estão restritas ao
tratamento dos seus fatores causais como obesidade, DM, dislipidemia, e outros.
Neste grupo de pacientes estudados, e na população de obesos mórbidos em
geral, a prevalência da esteatose é muito alta e, para tentar eliminá-la, é necessário um
emagrecimento acentuado e, principalmente, sustentado, fato que praticamente só se
obtém atualmente com a cirurgia antiobesidade, reforçando sua importância terapêutica
nos dias atuais.
Os resultados deste trabalho mostram fortemente que há um impacto positivo
significativo do emagrecimento na esteatose hepática, através da intervenção cirúrgica
utilizada, não havendo dano para o paciente em relação ao procedimento cirúrgico.
Com este desfecho, se diminui a chance de aparecimento de doença hepática
avançada e suas graves conseqüências para os pacientes. Isto constitui um grande
estímulo a continuar pesquisando neste campo para desenvolver maior conhecimento
sobre este assunto tão importante e pouco explorado.
Finalmente, consideramos importante que se prossiga com a monitorização do
status do parênquima hepático após a cirurgia antiobesidade para que se possa observar a
evolução dos achados deste trabalho, e orientar mais adequadamente os pacientes.
85
7 CONCLUSÃO
Na maioria dos pacientes deste grupo, houve significativa melhora ou remissão
completa da esteatose hepática após o emagrecimento induzido pela cirurgia utilizada.
A prevalência de alterações histológicas hepáticas foi elevada na biópsia trans-
operatória (91,39%), sendo que a alteração mais prevalente foi esteatose, em 87,63% dos
pacientes, dos quais 2/3 apresentavam esteatose moderada e severa. Encontrou-se
também esteatohepatite em 2,15% dos pacientes, cirrose em 1,07% e hepatite crônica em
1 paciente (0,53%).
Já no pós-operatório, mais de metade dos pacientes apresentaram histologia
hepática normal, e apenas 7,7% tinham esteatose moderada e severa.
Não houve influência das variáveis analisadas, como idade, IMC, presença de
dislipidemia, DM e HAS no comportamento histológico da esteatose após o
emagrecimento, exceto com relação ao gênero, o que não conseguimos esclarecer de
maneira definida, necessitando assim, estudos mais aprofundados para maiores
esclarecimentos.
Concluímos também, que a redução gástrica com derivação intestinal em Y de
Roux (RGYR) não ocasionou piora histológica da esteatose em nenhum caso nesta
amostra de pacientes.
87
REFERÊNCIAS BIBLIOGRÁFICAS
1. 2004 UpToDate®: AGA (American Gastroenterological Association) guideline:
Nonalcoholic fatty liver disease. www.uptodate.com
2. Mulhall BP, Ong JP, Younossi ZM. Non-alcoholic fatty liver disease: An
overview. J Gastroenterol Hepatol 2002; 17: 1136-43.
3. Angulo P and Lindor KD. Non-alcoholic fatty liver disease. J Gastroenterol
Hepatol 2002; 17 (suppl.) S186-S190.
4. Matteoni CA, Younossi ZM, Gramlich T et al. Nonalcoholic fatty liver disease: a
spectrum of clinical and pathological severity. Gastroenterology 1999; 116: 1413-
19.
5. Teli MR, James OFW, Burt AD et al. The natural history of nonalcoholic fatty
liver disease: a follow-up study. Hepatology 1995; 22(6): 1714-19.
6. Spaulding L, Trainer T, Janiec D. Prevalence of non-alcoholic steatohepatitis in
morbidly obese subjects undergoing gastric bypass. Obes Surg 2003; 13: 347-9.
7. Moretto M, Kupski C, Mottin CC et al. Hepatic steatosis in patients undergoing
bariatric surgery and its relationship to body mass index and comorbidities. Obes
Surg 2003; 13: 622-4.
8. Del Gaudio A, Boschi L, Del Gaudio GA et al. Liver damage in obese patients.
Obes Surg 2002; 12:802-4.
9. Falck-Ytter Y, Younossi ZM, Marchesini G, McCullough AJ. Clinical features
and natural history of nonalcoholic steatosis syndromes. Semin Liver Dis 2001;
21(1): 17-26.
88
10. Harrison SA, Torgerson S, Hayashi PH. The natural history of nonalcoholic fatty
liver disease: a clinical histopathological study. Am J Gastroenterol 2003; 98(9):
2042-7.
11. Neuschwander-Tetri BA and Caldwell SH. Nonalcoholic steatohepatitis:
summary of an AASLD single topic conference. Hepatology 2003; 37(5): 1202-
19.
12. Day CP and James OFW. Hepatic steatosis: innocent bystander or guilty party?
Hepatology 1998; 27(6): 1463-6.
13. Clark JM, Diehl AM. Nonalcoholic fatty liver disease: an underrecognized cause
of cryptogenic cirrhosis. JAMA 2003; 289: 3000-3004.
14. Dallal RM, Mattar SG, Lord JL et al. Results of laparoscopic gastric bypass in
patients with cirrhosis. Obes Surg 2004; 14: 47-53.
15. Lindor KD. NASH and NAFL in 2004. World Gastroenterol 2004; 9(1): 17-9.
16. Kral JG, Thung SN, Biron S et al. Effects of surgical treatment of the metabolic
syndrome on liver fibrosis and cirrhosis. Surgery 2004; 135(1): 48-58.
17. Marchesini G, Brizi M, Bianchi G et al. Nonalcoholic fatty liver disease: a feature
of the metabolic syndrome. Diabetes 2001; 50 (8): 1844-50.
18. Repetto G: Histórico da obesidade. In Halpern A, Matos AG, Suplicy HL,
Mancini MC, Zanella MT: Obesidade, 1º ed. Lemos Editorial, 1998, pp. 3-13.
19. Metropolitan Height and Weight Tables, Statistic Bulletin, Metropolitan Life
Foundation, 1983, 64: 2-9.
20. National Institutes of Health Consensus Development Conference Statement.
Health implications of obesity. Ann Int Med 1985; 103: 1073-1077.
89
21. Monteiro JC: Obesidade: diagnóstico, métodos e fundamentos. In Halpern A,
Matos AF de G, Suplicy HL, Mancini MC, Zanella MT: Obesidade, 1º ed. Lemos
Editorial, 1998, pp. 31-54.
22. Expert Panel Detection, Evaluation and Treatment of High Blood Cholesterol in
Adults. JAMA 2001; 285: 2486-2497.
23. American Heart Association – www.americanheart.org
24. WHO reassesses appropriate body mass index for Asian population. Lancet 2002;
July 20, 2002.
25. The World Health Report 2002, Geneva. www.who.int/whr/2002/en
26. WHO Global Strategy on Diet, Physical Activity and Health. Dec, 4, 2003.
www.who.int/hpr/global.strategy.shtml
27. The cost and health effects of obesity. Washington Business Group of Health.
www.wbgh.org/programs/obesity
28. Buchwald H, Avidor Y, Braunwald E et al. Bariatric surgery – a systematic
review and meta-analysis. American Medical Association. JAMA 2004; 292:
1724-1737.
29. Professor Philip James, Chair of London-based International Obesity Task Force,
Monte Carlo, March 17, 2003. www.ioth.org/media
30. World Health Organization. Global Burden of Disease Project, April 25, 2003.
www3.who.int/whosis/menu.cfm?path=evidence, burden
31. Calle EE, Rodriguez C, Walker-Thurmond K et al. Overweight, obesity, and
mortality from cancer in a prospectively studied cohort of U.S. adults. N Engl J
Med 2003; 348: 1625-1638.
32. Deitel M. U.S.A. versus W.H.O. Obes Surg 2004; 14: 297-299.
90
33. IBGE – www.ibge.gov.br
34. MacDonald KG Jr, Long SD, Swanson MS et al. The gastric bypass operation
reduces the progression and mortality of non-insulin- dependent diabetes mellitus.
J Gastrointest Surg 1997; 1(3): 213-220.
35. www.sbcs.org.br
36. www.endocrino.org.br/notic-053.ppp
37. www.obesity-online.com/ifso
38. Doenças hepáticas nutricionais e metabólicas. In Sheila Sherlock and James
Dooley: Doenças do fígado e do sistema biliar, 11ª ed. Guanabara Koogan, 2004,
pp. 363-369.
39. Diehl AM and Poordad F: Nonalcoholic fatty liver disease. In Feldman M,
Friedman LS, Sleisenger MH (eds.): Sleisenger and Fordtran’s Gastrointestinal
and Liver Disease, 7th ed. Philadelphia: WB Saunders, 2002, pp 1393-1401.
40. Reid AE. Nonalcoholic steatohepatitis. Gastroenterology 2001; 121(3): 710-723.
41. Scheen AJ, Luyckx FH. Nonalcoholic steatohepatitis and insulin resistance:
interface between gastroenterologists and endocrinologists. Acta Clin Belg 2003;
58(2): 81-91.
42. Bacon BR, Farahvash MJ, Janney CG et al. Nonalcoholic steatohepatitis: an
expanded clinical entity. Gastroenterology 1994; 107(4): 1103-1109.
43. Powell EE, Cooksley WGE, Hanson R et al. The natural history of nonalcoholic
steatohepatitis: a follow-up study of forty-two patients for up to 21 years.
Hepatology 1990; 11: 74-80.
91
44. Ludwig J, Viggiano TR, McGill DB, Ott BJ. Nonalcoholic steatohepatitis – Mayo
Clinic experiences with a hitherto unnamed disease. Mayo Clinic Proc 1980; 55:
434-438.
45. Burt AD, Mutton A, Day CP. Diagnosis and interpretation of steatosis and
steatohepatitis. Sem Diag Pathol 1998; 15(4): 246-258.
46. Sanyal AJ, Campbell-Sargent, Mirshahi F et al. Nonalcoholic steatohepatitis:
association of insulin resistance and mitochondrial abnormalities.
Gastroenterology 2001; 120(5): 1183-1192.
47. Lieber CS. Biochemical factors in alcoholic liver disease. Sem Liver Dis 1993;
13: 136-153.
48. Cope K, Risby T, Diehl AM. Increased gastrointestinal ethanol production in
obese mice: implications for fatty liver disease pathogenesis. Gastroenterology
2000; 119:1340-1347.
49. Leclercq IA, Farrell GC, Field J et al. CYP2E1 and CYP4A as microsomal
catalysts of lipid peroxides in murine nonalcoholic statohepatitis. J Clin Invest
2000; 105 (8): 1067-1075.
50. Yang SQ, Zhu H, Li Y et al. Mitochondrial adaptations to obesity-related oxidant
stress. Arch Biochem Biophys 2000; 378(2): 259-268.
51. Yin M, Wheeler MD, Kono H et al. Essential role of tumor necrosis factor alpha
in alcohol-induced liver injury in mice. Gastroenterology 1999; 117: 942-952.
52. Kern PA, Saghizadeh M, Ong JM et al. The expression of tumor necrosis factor
in human adipose tissue: regulation by obesity, weight loss, and relationship to
lipoprotein lipase. J Clin Invest 1995; 95(5): 2111-2119.
92
53. Faggioni R, Fantuzzi G, Gabay C et al. Leptin deficiency enhances sensitivity to
endotoxin-induced lethality. Am J Physiol 1999; 276: R136-R142.
54. Guebre-Xabier M, Yang SQ, Lin ZH et al. Altered hepatic lymphocyte
subpopulations in obesity related murine fatty liver: potential mechanism for
sensitization to liver damage. Hepatology 2000; 31:633-640.
55. Leung FW, Drenick EJ, Stanley TM. Intestinal bypass complications involving
the excluded small bowel segment. Am J Gastroenterol 1982; 77: 67-72.
56. Caldwell SH, Swerdlow RH, Khan EM et al. Mitochondrial abnormalities in non-
alcoholic steatohepatitis. J Hepatol 1999; 31: 430-434.
57. Marchesini G, Brizi M, Morselli-Labate AM et al. Association of nonalcoholic
fatty liver disease with insulin resistance. Am J Med 1999; 107: 450-455.
58. DeFronzo RA, Ferrannini E. Insulin resistance: a multifaceted syndrome
responsible for NIDDM, obesity, hypertension, dyslipidemia and atherosclerotic
cardiovascular disease. Diabetes Care 1991; 14: 173-194.
59. Moller DE, Flier JS. Insulin resistance – mechanisms, syndromes, and
implications. N Engl J Med 1991; 325(13): 938-948.
60. Angulo P, Keach JC, Batts KP, Lindor KD. Independent predictors of liver
fibrosis in patients with nonalcoholic steatohepatitis. Hepatology 1999; 30: 1356-
1362.
61. Lin HZ, Yang SQ, Chuckaree C et al. Metformin reverses fatty liver disease in
obese, leptin-deficient mice. Nat Med 2000; 6(8): 998-1003.
62. Day CP, James OFW. Steatohepatitis: a tale of two “hits”? (editorial).
Gastroenterology 1998; 114: 842-845.
93
63. Ratziu V, Giral P, Charlotte F et al. Liver fibrosis in overweight patients.
Gastroenterology 2000; 118: 1117-1123.
64. Czaja AJ, Carpenter HA, Santrach PJ, Moore SB. Host- and disease-specific
factors affecting steatosis in chronic hepatitis C. J Hepatol 1998; 29: 198-206.
65. Poupon RY, Serfaty LD, Amorin M et al. Combination of steatosis and alcohol
intake is the main determinant of fibrosis progression in patients with hepatitis C.
Hepatology 1999; 30: 406A. (abstract)
66. Mottin CC, Moretto M, Padoin AV et al. The role of ultrasound in the diagnosis
of hepatic steatosis in morbidly obese patients. Obes Surg 2004; 14: 635-637.
67. Sheth SG, Gordon FD, Chopar S. Nonalcoholic steatohepatitis. Ann Intern Med
1997; 126: 137-145.
68. Lee RG. Nonalcoholic steatohepatitis: a study of 49 patients. Hum Pathol 1989;
20: 594-598.
69. Wanless IR, Lentz JS. Fatty liver hepatitis (steatohepatitis) and obesity: an
autopsy study with analysis of risk factors. Hepatology 1990; 12: 1106-1110.
70. Novo Aurélio século XX, editora Nova Fronteira, p.267.
71. Cordero RA. La cirurgia de la obesidad 50 años despues. Boletim da Cirurgia da
Obesidade – SBCS, vol.4, nº. 1 maio/2003, pp.4-5.
72. Mason EE: Foreword. In Mervyn Deitel: Update: surgery for the morbidly obese
patient. 2000, pp. I
73. Fobi MAL, Lee H, Igwe D et al. Fobi pouch operation for obesity. In Mervyn
Deitel: Update: Surgery for the morbidly obese patients, 2000, pp. 203-226.
74. Fobi MAL, Lee H. The surgical technique of the Fobi pouch operation for
obesity. Obes Surg 1998; 8: 283-288.
94
75. Capella JF, Capella RF. The weight reduction operation of choice. Am J Surg
1996; 171: 74-79.
76. Garrido Jr AB, Berti LV, Oliveira MR: Gastroplastia vertical com bandagem.
Derivações gastrojejunais. In Garrido Jr AB: Cirurgia da Obesidade. 2002, ed.
Atheneu, pp. 149-161.
77. Wittgrove AC, Clark GW. Laparoscopic gastric bypass, Roux en Y technique and
results in 75 patients with 3-30 months follow-up. Obes Surg 1996; 6: 500-504.
78. Higa KD, Ho T, Boone KB. Laparoscopic Roux en Y gastric bypass: technique
and 3-year follow-up. J Laparoscopic Adv Surg Tech A. 2001; 11(6): 377-382.
79. Frühbeck G, Diez-Caballero A, Jesus Gil M et al. The decrease in plasma ghrelin
concentrations following bariatric surgery depends on the functional integrity of
the fundus. Obes Surg 2004; 14: 606-612.
80. Buchwald H. A bariatric surgery algorithm. Obes Surg 2002; 12: 733-746.
81. Albrecht RJ, Pories WJ. Surgical intervention for the severely obese. Balliers Best
Pract Pas Clin Endocrinol Metabol 1999; 13(1): 149-172.
82. Kral JG. Selection of patients for antiobesity surgery. Intest J Obes 2001;
25(suppl.):1, s107-s112.
83. National Institutes of Health Consensus Development Conference Draft
Statement of Gastrointestinal Surgery for Severe Obesity 25-27 March, 1991.
Obes Surg 1991; 1: 257-265.
84. Bariatric Surgery: American Society for Bariatric Surgery Guidelines 1997.
www.lapsurgery.com/BARIATRIC%20SURGERY/ASBS.htm
85. Deitel M, Greenstein RJ. Recommendations for reporting weight loss. Obes Surg
2003; 13: 159-160.
95
86. International Bariatric Surgery Registry, University of Iowa Hospitals, Iowa City,
IA 52242. USA. www.surgery.uiowa.edu/ibsr
87. Sjöstrom CD. Surgery as an intervention for obesity. Results from Swedish Obese
Subjects Study. Growth Horm IGF Res 2003; 13 suppl. A: 522-526.
88. Sjöstrom CD, Liner L, Nedel TT et al. Reduction in incidence of diabetes,
hypertension and lipid disturbance after intentional weight loss induced bypass
gastric surgery: The SOS Intervention Study. Obes Res 1999; rep; 7(5): 477-484.
89. Sjöstrom CD, Lindons AK, Peltonem M et al. For the Swedish Obese Subjects
Study Scientific Group. Lifestyle, diabetes and cardiovascular risk factors 10
years after bariatric surgery. N Engl J Med 2004; 351(36): 2683-2693.
90. Hall JC, Watts JM, O’Brien PE et al. Gastric surgery for morbidly obesity. The
Adelaid Study. Ann Surg 1990; 211(4): 419-427.
91. MacLeon LD, Rhode BM, Sampalis J et al. Results of the surgical treatment of
obesity. Am J Surg 1993; 165(1): 155-160.
92. American Society for Bariatric Surgery. Rationale for the Surgical Treatment of
Morbid Obesity. Updated 11/29/01. www.asbs.org/htlm/rationale/rationale.html
93. Fernandez AZJr, Demaria EJ, Tichansky DS et al. Multivariate Analysis of Risk
Factors for Death Following Gastric Bypass for Treatment of Morbid Obesity.
Ann Surg 2004; 239(5): 698-703. (abstract).
94. Bravo AA, Sheth SG, Chopra S. Liver biopsy. N Engl J Med 2001; 344(7): 495-
500.
95. Joy D, Thava VR, Scott B. Diagnosis of fatty liver disease: is biopsy necessary?
Eur J Gastroenterol Hepatol 2003; 15: 539-543.
96
96. Papadia FS, Marinari GM, Camerini G et al. Liver damage in severely obese
patients: a clinical-biochemical-morphological study on 1000 liver biopsies. Obes
Surg 2004; 14:952-958.
97. Shalhub S, Parsee A, Gallagher SF et al. The importance of routine liver biopsy
in diagnosing nonalcoholic steatohepatitis in bariatric patients. Obes Surg 2004;
14: 54-59.
98. Jacobs WH, Golberg SB. Statement on out patients percutaneous liver biopsy.
AGA guidelines. Dig Dis Sci 1989; 34: 322-323.
99. MacGill D, Rakela J, Zinsmeister AR et al. A 21-year experience with major
hemorrhage after percutaneous liver biopsy. Gastroenterology 1990; 99:1296-
1400.
100. Gilmore IT, Burroughs A, Murray-Lyon IM et al. Indications, methods, and
outcomes of percutaneous liver biopsy in England and Wales: an audit by
British Society of Gastroenterology and the Royal College of Physicians of
London. Gut 1995; 36: 437-441.
101. Gayotto LC: Biópsia hepática. In Luiz Carlos Gayotto: Doenças do fígado e vias
biliares. ed. Atheneu, pp151-163.
102. Nasrallah SM, Wills Jr CE, Galambos JT. Hepatic morphology in obesity. Dig
Dis Sci 1981; 26(4): 325-327.
103. Brunt EM, Janney CG, Di Bisceglie AM et al. Nonalcoholic steatohepatitis: a
proposal for grading and staging the histological lesions. Am J Gastroenterl
1999; 94(9): 2467-2474.
104. Ramsey-Stewart G. Hepatic steatosis and morbid obesity. Obes Surg 1993; 3:
157-159.
97
105. Gholam PM, Kohler DP, Flancbaun LJ. Liver pathology in morbidly obese
patients undergoing Roux-en-Y gastric bypass surgery. Obes Surg 2002; 12: 49-
51
106. Sathya P, Martin S, Alvarez F. Nonalcoholic fatty liver disease (NAFLD) in
children. Curr Opin Pediatr 2002; 14: 593-600. (abstract)
107. Baddeley R. An epilogue to jejunoileal bypass. World J Surg 1986; 9: 842-894.
108. Luyckx FH, Desaive C, Thiry A et al. Liver abnormalities in severely obese
subjects: effects of drastic weight loss after gastroplasty. Int J Obes Relat Metab
Disord 1998; 22: 222.
109. Silverman EM, Sapala JA, Appelman HD. Regression of hepatic steatosis in
morbidly obese persons after gastric bypass. Am J Clin Pathol 1995; 104: 23-
31.
110. Scheen AJ, Luyckx FH. Obesity and liver disease. Best Pract Research Clin
Endocr Metabol 2002; 16(4): 703-716.
111. Dixon JB, Bathal PS, O’Brien PE. Nonalcoholic fatty liver disease: predictors of
nonalcoholic steatohepatitis and liver fibrosis in the severely obese.
Gastroenterology 2001; 121: 91-100.
112. Wang RT, Koretz RL, Yee Jr HF. Is weight reduction an effective therapy for
nonalcoholic fatty liver? A systematic review. Am J Med 2003; 115: 554-559.
113. Nair S, Mason A, Eason J et al. Is obesity an independent risk factor for
hepatocellular carcinoma in cirrhosis? Hepatology 2002; 36: 150-155.
100
ANEXO 1 – Fluxograma de atendimento
FLUXOGRAMA DE ATENDIMENTO DO C.O.M. HSL – PUCRS FASE A AVALIAÇÃO INICIAL
- Manual de orientações e informações gerais sobre o C.O.M.
- Reunião do Grupo de Apoio (mensais)
FASE B AVALIAÇÃO - Entrevista clínica
(consultas, exames, reconsulta) - Entrevista psicológica
(consulta psiquiatra, questionários) - Entrevista Nutrição
(consulta, orientações, reconsulta) - Entrevista cardiológica
(consulta, exames, reconsulta) - Entrevista endocrinológica
(consulta, exames, reconsulta) - Entrevista fisioterapêutica - Entrevista administrativa
FASE C REUNIÃO CLÍNICA
- Discussão dos dados da FASE B - Parecer com definição da conduta
(tratamento cirúrgico ou alternativo) FASE D PREPARAÇÃO PRÉ – OPERATÓRIA
- Ter participado de, no mínimo, uma reunião do Grupo de Apoio
- Orientação nutricional pré-operatória - Entrevista administrativa - Entrevista cirúrgica - Entrevista anestésica - Entrevista enfermagem - Entrevista fisioterápica - Outros profissionais
FASE E DATA CIRURGIA
- Internação - Visita enfermagem - Visita nutricionista - Visita clínica - Entrevista pré-anestésica - Cirurgia - Pós – operatório internada
- 8 aval./acompanhamento clínico/cardiológico pós-op.
- 3 aval./acompanhamento endocrinologico pós-op.nos diabéticos
- 3 orientações nutricionais - Assessoria psiquiátrica - Acompanhamento enfermagem
101
- Acompanhamento fisioterápico - Acompanhamento cirúrgico diário - Alta hospitalar
FASE F MANUTENÇÃO 1º MÊS 15 dias - Entrevista Nutrição
- Entrevista Cirurgia 30 dias - Entrevista Nutrição
- Entrevista Cirurgia - Entrevista Clínica/ exames
Participar de, no mínimo, 50 % das reuniões do Grupo de Apoio do C.O.M. por ano (6 das 12) 2º MÊS 60 dias - Entrevista Nutrição 3º MÊS 90 dias - Entrevista Nutrição
- Entrevista Cirurgia - Entrevista Clínica c/ exames
6º MÊS 180 dias - Entrevista Nutrição
- Entrevista Cirurgia - Entrevista Clínica/ exames - Entrevista psicológica + questionários
9° MÊS - Entrevista Nutrição
- Entrevista Clínica / exames 12º MÊS 360 dias - Entrevista Nutrição
- Entrevista Cirurgia - Entrevista Clínica/ exames - Entrevista psicológica + questionários
18º MÊS - Entrevista Nutrição
- Entrevista Clínica/ exames 24º MÊS - Entrevista Nutrição
- Entrevista Cirurgia e questionário BAROS - Entrevista Clínica/ exames - Entrevista psicológica + questionários
30º MÊS - Entrevista Nutrição
- Entrevista Clínica/ exames 36º MÊS - Entrevista Nutrição
- Entrevista Cirurgia e questionário BAROS - Entrevista Clínica/ exames - Entrevista psicológica + questionários
102
42º MÊS - Entrevista Nutrição
- Entrevista Clínica/ exames 48º MÊS - Entrevista Nutrição
- Entrevista Cirurgia e questionário BAROS - Entrevista Clínica/ exames - Entrevista psicológica + questionários
54º MÊS - Entrevista Nutrição
- Entrevista Clínica/ exames 60º MÊS - Entrevista Nutrição
- Entrevista Cirurgia e questionário BAROS - Entrevista Clínica/ exames - Entrevista psicológica + questionários
Fluxograma de manutenção pós – operatória de 05 (cinco) anos.
CONTROLE NUTRICIONAL, CLÍNICO E CIRÚRGICO
ANUALMENTE.
103
ANEXO 2 – Fluxograma de Exames
Nome:____________________________________ Data cir: ____/____/_____ Prontuário n°
FLUXOGRAMA INTERNO - pós operatório
Nutrição (verificação cintura/quadril + reposição s/n)
Cirurgia (ver temp., incisão e orientação de at. Física) 15 dias Solicitar exames p/ 30 dias ( Hemograma, Acido fólico, Vit B12, Ferro, Acido úrico,
Albumina, Colesterol, HDL, Triglicerídeos, Glicose, Creatinina, TGO, TGP, GGT, Cálcio) reposição e anotar exames.
Nutrição (verificação cintura/quadril + reposição s/n) Cirurgia (ver temp., incisão e orientação de at. Física)
1° Mês
30 dias Clínica (Solicitar exames p/ 60 dias - Hemograma, Acido fólico, Vit B12, Ferro, Acido úrico, Albumina, Colesterol, HDL, Triglicerídeos, Glicose, Creatinina, TGO, TGP, GGT, Cálcio)- manter protetor gástrico até 1 ano; reposição e anotar exames.
Nutrição (verificação cintura/quadril + reposição s/n) 2° Mês 60 dias
Nutrição
Cirurgia
3° Mês 90 dias Clínica (Solicitar exames p/ 6 meses - Hemograma, Acido fólico, Vit B12, Ferro, Acido úrico, Albumina, Colesterol, HDL, Triglicerídeos, Glicose, Creatinina, TGO, TGP, GGT, Cálcio+ ecografia abdominal para pacientes com vesícula) reposição e anotar exames.
Nutrição (verificação cintura/quadril + reposição s/n)
Cirurgia + questionário BAROS
Clínica (Solicitar exames p/ 9 meses - Hemograma, Acido fólico, Vit B12, Ferro, Acido úrico, Albumina, Colesterol, HDL, Triglicerídeos, Glicose, Creatinina, TGO, TGP, GGT, Cálcio) reposição e anotar exames.
6° Mês
Questionário psicológicos + consulta psiquiátrica/psicológica
Nutrição (verificação cintura/quadril + reposição s/n)
9° Mês Clínico (Solicitar exames p/ 12 meses - Hemograma, Acido fólico, Vit B12, Ferro, Acido úrico, Albumina, Colesterol, HDL, Triglicerídeos, Glicose, Creatinina, TGO, TGP, GGT, Cálcio+ ecografia abdominal para pacientes com vesícula, biópsia hepática e endoscopia c/ Drª Myriam) reposição e anotar exames.
Nutrição (verificação cintura/quadril + reposição s/n)
Cirurgia (suspender protetor gástrico se EDA normal) + questionário BAROS
Clínica (Solicitar exames p/ 18 meses - Hemograma, Acido fólico, Vit B12, Ferro, Acido úrico, Albumina, Colesterol, HDL, Triglicerídeos, Glicose, Creatinina, TGO, TGP, GGT, Cálcio ) reposição e anotar exames.
12° Mês
Questionário psicológicos + consulta psiquiatrica/psicológica
Nutrição (verificação cintura/quadril + reposição s/n)
18° Mês Clínica (Solicitar exames p/ 24 meses - Hemograma, Acido fólico, Vit B12, Ferro, Acido úrico, Albumina, Colesterol, HDL, Triglicerídeos, Glicose, Creatinina, TGO, TGP, GGT, Cálcio + ecografia abdominal para pacientes com vesícula, biópsia hepática se anterior alterada e endoscopia c/ Drª Myriam) reposição e anotar exames.
Nutrição (verificação cintura/quadril + reposição s/n) 24° Mês Cirurgia + questionário BAROS
104
Clínico (Solicitar exames p/ 30 meses - Hemograma, Acido fólico, Vit B12, Ferro, Acido úrico, Albumina, Colesterol, HDL, Triglicerídeos, Glicose, Creatinina, TGO, TGP, GGT, Cálcio) reposição e anotar exames.
Questionário psicológicos + consulta psiquiatrica/psicológica
Nutrição (verificação cintura/quadril + reposição s/n)
30° Mês Clínica (Solicitar exames p/ 36 meses - Hemograma, Acido fólico, Vit B12, Ferro, Acido úrico, Albumina, Colesterol, HDL, Triglicerídeos, Glicose, Creatinina, TGO, TGP, GGT, Cálcio + ecografia abdominal para pacientes com vesícula, biópsia hepática se anterior alterada e endoscopia c/ Drª Myriam) reposição e anotar exames.
Nutrição (verificação cintura/quadril + reposição s/n) Cirurgia + questionário BAROS
Clínica (Solicitar exames p/ 42 meses - Hemograma, Acido fólico, Vit B12, Ferro, Acido úrico, Albumina, Colesterol, HDL, Triglicerídeos, Glicose, Creatinina, TGO, TGP, GGT, Cálcio) reposição e anotar exames.
36° Mês
Questionário psicológicos + consulta psiquiatrica/psicológica
Nutrição (verificação cintura/quadril + reposição s/n)
42° Mês Clínica (Solicitar exames p/ 48 meses - Hemograma, Acido fólico, Vit B12, Ferro, Acido úrico, Albumina, Colesterol, HDL, Triglicerídeos, Glicose, Creatinina, TGO, TGO, GGT, Cálcio + ecografia abdominal para pacientes com vesícula, biópsia hepática se anterior alterada e endoscopia c/ Drª Myriam) reposição e anotar exames.
Nutrição (verificação cintura/quadril + reposição s/n)
Cirurgia + questionário BAROS
Clínica (Solicitar exames p/ 54 meses - Hemograma, Acido fólico, Vit B12, Ferro, Acido úrico, Albumina, Colesterol, HDL, Triglicerídeos, Glicose, Creatinina, TGO, TGP, GGT, Cálcio) reposição e anotar exames.
48° Mês
Questionário psicológicos + consulta psiquiatrica/psicológica
Nutrição (verificação cintura/quadril + reposição s/n)
54° Mês Clínica (Solicitar exames p/ 60 meses - Hemograma, Acido fólico, Vit B12, Ferro, Acido úrico, Albumina, Colesterol, HDL, Triglicerídeos, Glicose, Creatinina + ecografia abdominal para pacientes com vesícula, biópsia hepática se anterior alterada e endoscopia c/ Drª Myriam)
Nutrição (verificação cintura/quadril + reposição s/n)
Cirurgia + questionário BAROS
Clínica (Solicitar exames p/ próximo ano - Hemograma, Acido fólico, Vit B12, Ferro, Acido úrico, Albumina, Colesterol, HDL, Triglicerídeos, Glicose, Creatinina, TGO, TGP, GGT, Cálcio) reposição e anotar exames.
60° Mês
Questionário psicológicos + consulta psiquiatrica/psicológica
Nutrição (verificação cintura/quadril + reposição s/n)
Cirurgia + questionário BAROS
Clínica (Solicitar exames p/ p/ próximo ano - Hemograma, Acido fólico, Vit B12, Ferro, Acido úrico, Albumina, Colesterol, HDL, Triglicerídeos, Glicose, Creatinina, TGO, TGP, GGT, Cálcio) reposição e anotar exames.
APÓS REVISÃO ANUAL
Questionário psicológicos + consulta psiquiatrica/psicológica
105
ANEXO 3 - Amostra do banco de dados do COM Idade Sexo peso 0 IMC cintquad DM HAS Dislip pesot12 emagrec IMC12 esteat0 esteat1 Modesteat tipo biops pré pós
25 2 89 39,56 0 0 1 56 100,76% 24,89 3 0 0 1 1,2 1,6 30 2 113 41,51 0,94 0 0 1 73 89,01% 26,81 3 0 0 1 1,6 1,8 32 2 105 44,85 0,83 0 0 1 63 90,37% 26,91 1 0 0 1 1,9 1,8 24 2 108 39,67 0 0 1 67 102,66% 24,61 2 0 0 1 1,8 1,6 28 2 132 46,77 0,79 0 1 1 84 78,13% 29,76 1 0 0 1 1,2 1,5 58 1 105 38,57 1,11 1 1 0 68 100,17% 24,98 2 0 0 1 1,6 1,3 27 2 226 82,01 0,87 0 0 1 118 68,74% 42,82 1 1 2 1 1,6 0,9 46 2 92 38,29 0,84 1 1 1 61 97,06% 25,39 3 0 0 1 1,5 1,5 36 2 96 39,45 0,90 0 1 1 59 105,23% 24,24 2 0 0 1 1,4 0,2 32 2 136 48,76 0,81 0 0 0 89 70,91% 31,91 1 0 0 1 1,7 1,1 29 1 151 47,13 0 0 1 113 53,60% 35,27 3 1 1 1 1,6 1,0 46 1 125 41,77 0 0 1 77 95,66% 25,73 2 1 1 1 1,1 1,5 48 2 105 41,53 0 1 1 75 71,77% 29,67 3 2 1 1 1,5 1,3 42 1 162 50,00 0,98 0 0 1 107 67,90% 33,02 3 1 1 1 1,3 1,1 37 2 125 45,91 0,90 0 0 1 80 79,03% 29,38 3 0 0 1 1,8 1,5 52 2 178 63,07 1,30 0 1 1 94 78,18% 33,30 1 1 2 1 1,8 1,6 30 2 127 51,52 0 1 1 84 65,77% 34,08 1 0 0 1 1,8 1,6 29 2 100 39,56 0,97 0 1 1 58 114,14% 22,94 3 0 0 1 1,8 1,5 48 2 99 41,21 0,82 0 0 1 68 79,61% 28,30 1 0 0 1 1,3 1,8 37 2 176 64,65 1,22 0 1 0 101 69,48% 37,10 3 0 0 1 2,2 1,2 18 2 135 50,81 0,86 0 0 0 81 78,74% 30,49 3 0 0 1 1,2 1,3 33 2 154 55,22 0 0 0 95 70,01% 34,06 3 0 0 1 1,5 2,1 37 2 130 46,61 0,97 0 1 0 88 69,68% 31,55 2 0 0 1 1,5 1,0 53 2 108 40,15 0,85 0 0 1 70 93,23% 26,03 2 0 0 1 1,7 1,2 21 2 137 47,97 0,73 0 0 1 82 83,84% 28,71 1 1 2 1 1,3 0,9 38 2 123 43,07 0,81 0 1 1 79 85,28% 27,66 1 0 0 1 1,1 1,1 50 1 142 46,90 1 1 1 99 64,85% 32,70 3 1 1 1 2,0 1,7 32 1 184 58,73 1,03 1 1 1 133 48,26% 42,45 3 0 0 1 1,9 0,7
106
Idade Sexo peso 0 IMC cintquad DM HAS Dislip pesot12 emagrec IMC12 esteat0 esteat1 Modesteat tipo biops pré pós 21 1 138 42,59 1,09 0 0 1 81 100,00% 25,00 3 0 0 1 1,1 2,3 44 2 133 55,36 0,82 0 1 1 93 54,84% 38,71 3 1 1 1 1,7 0,9 24 1 174 54,92 0,92 0 1 1 119 58,02% 37,56 2 0 0 1 1,7 1,5 45 2 127 48,39 0,90 0 1 1 80 76,56% 30,48 3 0 0 1 1,7 1,1 40 2 109 43,66 0,98 0 1 1 71 81,56% 28,44 3 0 0 1 1,7 0,8 36 1 165 52,08 0,93 0 1 0 121 51,29% 38,19 3 3 2 1 2,2 2,0 27 2 116 42,61 0,91 0 1 1 78 79,27% 28,65 2 0 0 1 1,8 2,2 42 2 121 44,99 0,80 0 0 1 71 93,01% 26,40 1 1 2 1 1,1 2,0 37 2 142 61,46 0,93 0 1 0 84 68,85% 36,36 3 3 2 1 1,8 1,1 20 2 107 41,80 0 1 1 63 102,33% 24,61 3 1 1 1 1,5 0,4 45 2 120 53,33 0,87 0 1 1 75 70,59% 33,33 3 1 1 1 2,2 1,7 53 2 99 37,26 1 1 0 65 104,37% 24,46 3 1 1 1 2,0 1,0 25 1 124 42,91 1,10 0 0 1 94 57,97% 32,53 3 1 1 1 1,3 1,2 45 2 111 42,82 0,75 0 0 1 71 86,58% 27,39 1 0 0 1 2,0 0,9 22 2 136 44,41 0,81 0 0 0 80 94,22% 26,12 1 1 2 1 1,6 1,2 35 2 140 49,02 0,95 0 1 0 99 59,77% 34,66 3 1 1 1 2,0 0,5 36 2 99 42,29 0,83 0 1 1 51 118,58% 21,79 2 2 2 1 1,5 0,8 42 2 96 39,96 0,82 0 1 0 67 80,70% 27,89 1 1 2 1 1,1 0,5 25 1 141 45,01 0 1 1 83 92,54% 26,49 1 0 0 1 1,2 1,6 31 1 150 51,90 0,99 0 1 1 92 74,60% 31,83 3 1 1 1 1,1 1,2 44 2 99 46,44 0,93 0 1 0 66 72,19% 30,96 1 1 2 1 1,7 0,3 35 2 98 37,81 0,98 1 1 1 67 93,38% 25,85 3 2 1 2 1,8 2,0 36 2 97 41,44 0,78 0 0 0 61 93,56% 26,06 3 1 1 2 1,2 1,5 49 2 138 53,24 0,80 1 1 1 75 86,07% 28,93 3 0 0 2 0,5 1,3 38 2 130 47,75 0,97 0 1 0 81 79,11% 29,75 1 0 0 2 0,3 1,1 40 2 97 41,98 0 0 1 58 99,39% 25,10 3 0 0 2 1,5 1,2 24 1 146 45,06 1,11 0 0 1 91 84,62% 28,09 1 0 0 2 0,3 1,1 32 2 127 44,47 0,81 0 0 1 58 124,11% 20,31 2 0 0 2 0,7 3,0 52 2 133 47,12 0,97 0 0 1 95 60,86% 33,66 1 1 2 2 0,7 1,2 29 2 131 48,12 0,89 0 1 0 84 74,68% 30,85 2 0 0 2 0,3 1,6 32 2 106 41,41 0,94 0 0 1 74 76,19% 28,91 3 0 0 2 0,7 0,8
107
ANEXO 4 - Fluxograma de exames
DATA EXAMES
ERITRÓCITOS HEMATÓCRITO HEMOGLOBINA LEUCÓCITOS Bastonados Segmentados Basófilos Eosinófilos Monócitos Linfócitos Plasmócitos PLAQUETAS
% TP INR
ATTP TGO TGP GAMA GT Fosfatase alcalina BT BDI Glicose HBA1C Uréia Creatinina Albumina Colesterol total HDL LDL Triglicerídeos Ácido úrico Ferro Ferritina Ácido fólico Vit. B12 T4 TSH Insulina Cortisol Cálcio Total Anti-HCV HBsAg Anti-HBc Total FAN Anti musculo liso Anti mitocôndria
108
Gasometria Arterial ph PaCO2 Sat HCO3 Proteínograma Testosterona total Prolactina Estradiol LH FSH HIV
109
ANEXO 5 - Aceitação do artigo para publicação Re: MS #5007 "Histologic outcome of hepatic steatosis in morbidly obese patients after weight loss resulting from bariatric surgery" by Mottin et al. Dear Dr. Mottin:
The above interesting manuscript has been received for consideration for publication in OBESITY SURGERY. This is a very interesting topic, because the outcome in the liver after weight loss has not been studied systematically. I am thus going to accept your paper for publication in OBESITY SURGERY. Could you please inform me whether this was an open gastric bypass, and is it standard or does it use the Fobi technique? Also, were there any complications from the needle biopsy performed 1 year after the gastric bypass? Also, what technique or location was used in obtaining the needle biopsy 1 year after the surgery? Please answer these questions so that I can format your paper. In a few months, you'll receive proofs as PDF email attachment, for checking. Please make sure that the surgeons in your group continue their subscription to OBESITY SURGERY (form attached). Thank you very much for your interest in the Journal. Sincerely, Mervyn Deitel, MD Editor, OBESITY SURGERY ~~~~~~~~~~~~~~~~~~~~~~ FD-Communications Inc. 5863 Leslie Street, Box 1002 Toronto, ON M2H 1J8 Canada www.obesitysurgery.com Tel. (416) 750-9608 Fax. (416) 224-5455
Livros Grátis( http://www.livrosgratis.com.br )
Milhares de Livros para Download: Baixar livros de AdministraçãoBaixar livros de AgronomiaBaixar livros de ArquiteturaBaixar livros de ArtesBaixar livros de AstronomiaBaixar livros de Biologia GeralBaixar livros de Ciência da ComputaçãoBaixar livros de Ciência da InformaçãoBaixar livros de Ciência PolíticaBaixar livros de Ciências da SaúdeBaixar livros de ComunicaçãoBaixar livros do Conselho Nacional de Educação - CNEBaixar livros de Defesa civilBaixar livros de DireitoBaixar livros de Direitos humanosBaixar livros de EconomiaBaixar livros de Economia DomésticaBaixar livros de EducaçãoBaixar livros de Educação - TrânsitoBaixar livros de Educação FísicaBaixar livros de Engenharia AeroespacialBaixar livros de FarmáciaBaixar livros de FilosofiaBaixar livros de FísicaBaixar livros de GeociênciasBaixar livros de GeografiaBaixar livros de HistóriaBaixar livros de Línguas
Baixar livros de LiteraturaBaixar livros de Literatura de CordelBaixar livros de Literatura InfantilBaixar livros de MatemáticaBaixar livros de MedicinaBaixar livros de Medicina VeterináriaBaixar livros de Meio AmbienteBaixar livros de MeteorologiaBaixar Monografias e TCCBaixar livros MultidisciplinarBaixar livros de MúsicaBaixar livros de PsicologiaBaixar livros de QuímicaBaixar livros de Saúde ColetivaBaixar livros de Serviço SocialBaixar livros de SociologiaBaixar livros de TeologiaBaixar livros de TrabalhoBaixar livros de Turismo