COMPOSTOS BIOATIVOS DO ABRICÓ (Mammea americana),...
-
Upload
truongkhanh -
Category
Documents
-
view
230 -
download
0
Transcript of COMPOSTOS BIOATIVOS DO ABRICÓ (Mammea americana),...
i
POLLYANE DA SILVA PORTS MARÇAL DE VASCONCELOS
COMPOSTOS BIOATIVOS DO ABRICÓ (Mammea americana),
FRUTA DA REGIÃO AMAZÔNICA BRASILEIRA.
CAMPINAS,
2015
vii
RESUMO GERAL
Este trabalho objetivou avaliar a fruta Mammea americana, conhecida popularmente como abricó, obtida de dois estados brasileiro (Belém/PA e Manaus/AM) e mais 2 acessos (Kamatá 1 e Kamatá 2) cedidos pela EMBRAPA – Amazônia Oriental quanto a presença de compostos químicos (fenólicos totais e individuais, capacidade antioxidante, ácidos graxos e tocoferóis) presentes na polpa da fruta. Inicialmente foi feito um estudo para otimização da extração dos compostos fenólicos presentes na polpa, utilizando uma metodologia de superfície de resposta (MSR) no intuito de avaliar a melhor condição de extração para obtenção dos fenólicos totais. Após a obtenção do ponto ótimo (52% de metanol/água, 5 extrações consecutivas no tempo de 10 minutos cada uma) esta foi aplicado a todas as amostras e nelas foram realizadas a avaliação da capacidade antioxidante, através dos métodos in vitro do radical livre estável DPPH• (2,2-difenil-1-picrilidrazila), pelo Método de Redução de Ferro (FRAP) e pelo método de ORAC (Oxygen Radical Absorbance Capacity). Os compostos fenólicos majoritários foram separados, identificados e quantificados por cromatografia líquida de alta eficiência acoplada aos detectores de arranjo de diodos e de espectrometria massas (HPLC-PDA-MS/MS). Através do uso da metodologia de superfície de resposta (MSR) para otimização da extração obteve-se resultados para compostos fenólicos totais presentes na polpa em na faixa de 3,53 a 7,12 mgEAG.mL-1, dentre às análises de capacidade antioxidante a de ORAC foi a que mostrou resultados mais expressivos, valores que variaram entre 23,27 e 153,05 μM ET/g, para Kamatá 2 e Manaus respectivamente. Aplicou-se também uma MSR para otimização das condições de hidrólise (liberação das agliconas), onde o composto utilizado como resposta foi o ácido 3,4-dihydroxybenzóico, a concentração deste composto variou de 109,53 a 195,95 mg.g-1, além deste, outros compostos foram detectados com a ajuda de um espectrômetro de massa como a quercetina e o kaempferol. A análise de perfil e composição dos ácidos graxos presentes na polpa foi realizada através de um GC/FID e a confirmação em um GC/MS. Foram encontrados nas maiores porcentagens o ácido palmitoleico com 26%, juntamente com o ácido oleico com 20%, seguido do ácido linoleico com 20% e do ácido linolênico com 17%. Para análise de tocoferóis apenas o alfa-tocoferol foi detectado na concentração de aproximadamente 1,1 µg.g-1 para todas as amostras. Os resultados evidenciam que o abricó possui quantidade significativa de ácidos graxos insaturados e de tocoferóis, contudo demonstra reduzida capacidade antioxidante e baixo teor de compostos fenólicos. Entretanto, em consideração a enorme biodiversidade do Brasil, o conhecimento e divulgação desses resultados é um incentivo para o início de muitos outros trabalhos que podem ser realizados para aumentar a demanda e incentivar a produção e comercialização do abricó, além da possibilidade de inserção das mesmas em outras áreas industriais.
Palavras-chave: Abricó, fenólicos, antioxidante, ácidos graxos e tocoferóis.
ix
ABSTRACT
This study evaluated the Mammea Americana fruit, popularly known as apricot, obtained from two Brazilian states (Belém/PA and Manaus/AM) and 2 accesses (Kamata 1 and Kamata 2) provided by EMBRAPA - Eastern Amazon, for the presence of chemical compounds (total and individual phenolics, antioxidant capacity, fatty acids and tocopherols) in the fruit pulp. Initially a study was performed to optimize the phenolic compounds extraction present in the pulp, using a response surface methodology (RSM) in order to assess the best extraction condition to obtain the total phenolics. After the optimum condition was established (52% methanol/water, 5 consecutive extraction of 10 minutes each), it was applied to all samples. The antioxidant capacity was evaluated by using the in vitro stable free radical •DPPH method (2,2-diphenyl-1-picrilidrazila), the iron reduction method (FRAP) and the method ORAC (Oxygen Radical Absorbance Capacity). The major phenolic compounds were separated, identified and quantified by high-performance liquid chromatography coupled to diode array detectors and mass spectrometry (HPLC-PDA-MS/MS). By using response surface methodology (RSM) for optimization it was ranger obtained 3,53 to 7,12 mgGAE.mL-1 for the extraction of total phenolic compounds present in the pulp. The antioxidant capacity by ORAC analysis was the one that showed better results, values ranging between 23,27 and 153,05 uM ET/g to Kamata 2 and Manaus, respectively. RSM was also applied for hydrolysis conditions (release of the aglycones) optimization. In this analyse, the compound used as was the 3,4-dihydroxybenzóico acid, the concentration of this compound ranged from 109,53 to 195,95 µg.g-1 besides this, others compounds, such as quercetin and kaempferol, were detected with the aid of a mass spectrometer. The fatty acids profile and composition present in the pulp was performed using a GC/FID and confirmed on a GC/MS. The higher amounts were found for palmitoleic acid (26%), followed by oleic acid (20%), linoleic acid (20%) and linolenic acid (17%). At tocopherol analysis only alpha-tocopherol was detected at a concentration around 1,1 μg.g-1 for all tested samples. The results show that apricot has a significant amount of unsaturated fatty acids and tocopherols, on the other hand apricot extracts presented reduced antioxidant capacity and low phenolic compounds content. However, taking into account the enormous biodiversity of Brazil, the knowledge and dissemination of these results is an incentive for the beginning of many other jobs that can be performed to increase demand and encourage the production and marketing of apricot, plus the ability to insert it in other industrial areas.
Keywords: Apricot, phenolics, antioxidant, fatty acids and tocopherols.
xi
SUMÁRIO
RESUMO GERAL....................................................................................................vii
ABSTRACT..............................................................................................................ix
INTRODUÇÃO GERAL.............................................................................................1
REFERÊNCIAS................................................................................................3
CAP I: Revisão bibliográfica
1.1. Diversidade Amazônica....................................................................7
2.2. Abricó (Mammea americana)............................................................8
1.3. Compostos fenólicos.........................................................................9
1.3.1. Extração.......................................................................................11
1.3.2. Métodos de ánálise......................................................................12
1.3.3. Hidrólise.......................................................................................14
4. Capacidade antioxidante...................................................................15
5. Ácidos graxos....................................................................................18
6. Tocoferóis..........................................................................................20
REFERÊNCIAS.....................................................................................23
CAP II: Otimização da extração dos compostos fenólicos assistida por
ultrassom utilizando metodologia de superfície de resposta e determinação
da capacidade antioxidante em abricó (Mammea americana)
1. INTRODUÇÃO..........................................................................................39
2. MATERIAL E MÉTODOS.........................................................................43
2.1. Amostras.......................................................................................43
2.2. Caracterização dos frutos de abricó..............................................43
2.3. Reagentes e solventes..................................................................44
2.4. Extração assistida por ultrassom..................................................44
2.5. Delineamento experimental para otimização da extração usando
um planejamento composto central (PCC) através de uma
metodologia de superfície de resposta (MSR)..............................44
2.6. Determinação dos Compostos Fenólicos Totais...........................46
2.7. Determinação do potencial antioxidante in vitro............................46
xii
2.7.1. Capacidade antioxidante pelo radical livre DPPH...................46
2.7.2. Ferric Reducing Antioxidant Power – FRAP…………………...48
2.7.3. Oxygen Radical Absorbance Capacity – ORAC………………48
2.8. Análise Estatística.............................................................................52
3. RESULTADOS E DISCUSSÃO................................................................49
3.1. Características Físicas dos Frutos de Abricó................................49
3.2. Otimização da extração para análise de fenólicos totais..............51
3.3. Capacidade antioxidante dos extratos de abricó..........................57
3.4. Sequestro do radical DPPH•…………………………………………57
3.5. Ferric Reducing Antioxidant Power – FRAP……………………….58
3.6. Oxygen Radical Absorbance Capacity – ORAC…………….........59
4. CONCLUSÃO...........................................................................................62
REFERÊNCIAS........................................................................................63
CAP. III. Análise dos compostos fenólicos presentes na Mammea americana
por cromatografia líquida (UHPLC/DAD-MS-MS) através da otimização da
hidrólise utilizando uma técnica estatística multivariada
1. INTRODUÇÃO..........................................................................................73
2. MATERIAL E MÉTODOS.........................................................................76
2.1. Amostras.......................................................................................76
2.2. Reagentes e solventes..................................................................76
2.3. Determinação dos compostos fenólicos por UHPLC/DAD-MS-
MS.................................................................................................77
2.3.1. Otimização da hidrólise...........................................................77
2.3.2. Análise cromatográfica ..........................................................78
3. RESULTADOS E DISCUSSÃO................................................................79
3.1. Otimização das condições de hidrólise.........................................78
3.2. Identificação dos compostos fenólicos por UHPLC/DAD-MS-
MS.................................................................................................85
4. CONCLUSÃO...........................................................................................89
REFERÊNCIAS........................................................................................90
Anexos.....................................................................................................93
xiii
CAP. IV. Estudo da composição dos ácidos graxos e tocoferóis presentes na
polpa do abricó (Mammea americana), fruta da região amazônica brasileira
1. INTRODUÇÃO.......................................................................................103
2. MATERIAL E MÉTODOS......................................................................105
2.1. Amostras.......................................................................................105
2.2. Reagentes e solventes..................................................................105
2.3. Extrações......................................................................................106
2.3.1 Lipídios Bligh-Dyer........................................................................106
2.3.2. Ésteres metílicos de ácidos graxos..............................................106
2.3.3. Tocoferóis....................................................................................107
2.4. Determinação dos ácidos graxos CG-FID......................................107
2.5. Confirmação da identidade por CG-MS..........................................108
2.6. Análise de Tocoferóis......................................................................109
2.7. Análise estatística...........................................................................109
3. RESULTADOS E DISCUSSÃO.............................................................109
3.1. Composição de ácidos graxos........................................................109
3.2. Composição de tocoferóis...............................................................114
4. CONCLUSÃO........................................................................................117
REFERÊNCIAS.....................................................................................118
CONCLUSÃO GERAL.........................................................................................123
xv
“Há um tempo em que é preciso abandonar as roupas usadas, que já tem a forma do nosso corpo, e esquecer os nossos caminhos, que nos levam sempre aos
mesmos lugares. É o tempo da travessia: e, se não ousarmos fazê-la, teremos ficado, para sempre, à margem de nós mesmos.”
(Fernando Pessoa)
“A força não provém da capacidade física e sim de uma vontade indomável.” (Mahatma Gandhi)
xvii
Dedico este trabalho aos meus familiares pelo incentivo
em especial aos meus pais Fátima e Rubens, principalmente
a minha mãe por todo o seu amor, dedicação e apoio
incondicional ao longo de toda a minha vida; a minha tia
Alice que sempre me apoiou nos momentos mais difíceis; a
minha Tia Mitze pelo seu enorme carinho mesmo depois de
anos; ao meu irmão Thyago; in memória de minha avó
Noêmia, que nos deixou saudades, e onde quer que esteja sei
que estará sempre torcendo por mim.
xix
AGRADECIMENTOS
Primeiramente a Deus, por não me deixar desistir dos meus objetivos nos momentos
difíceis e de desanimo, pela forca, benção e fé.
À Universidade Estadual de Campinas (UNICAMP), instituição na qual, lutamos para
fazer parte do seu corpo de alunos, onde tive o privilégio de cursar um curso de pós
graduação. Esta que nos ensinou não somente os conteúdos a nível intelectual, mais
também a sermos pessoas melhores; lugar em que no convívio do dia-a-dia aprendemos que
as dificuldades podem ser superadas com esforço, humildade e dedicação.
Agradeço a minha orientadora, Profª. Drª. Helena Teixeira Godoy pela atenção,
ensinamentos e paciência de sempre.
À banca examinadora, Dra. Daniele Rodrigues, Dra. Cláudia Kowalski, Dra.
Merenice Sobrinho e a Dra Juliana Pallone, pelas contribuições, sugestões e atenção
dedicada ao aperfeiçoamento deste trabalho.
A todos do Laboratório de Análise superior e inferior pelos momentos de risadas que
pude compartilhar com todos vocês e é claro a imensa ajuda e conhecimentos transmitidos
durante todo desenvolvimento deste trabalho. Em especial a Maria Rosa (simplesmente
uma pessoa iluminada), o Wellington (companheiro de todas as horas) a Thais (fofinha), a
Dani, a Tayse, ao Marcus, o Mateus, Danilo, Janclei, Alane, Elenice, Léo.
Não podia faltar aqueles amigos que mesmo não estando mais presente no convívio
diário do laboratório, também foram fundamentais para a efetivação deste. Minha querida
amiga Elede e Merê, obrigada pelo carinho, contribuição e auxílio em todos os momentos.
Aos meus grandes amigos (mesmo que não saibam) Renan, que mesmo distante sei
que devo imensamente e sempre estará nos meus agradecimentos, a minha amiga do peito
Fêr Mandelli e é claro a minha Xará do coração (Poli), que sempre vou guardar como
exemplo de pessoa Feliz!
E por fim minhas amigas de longa data, que mesmo tão longe se fazem tão presente
Karlinha, Paulinha, Beta, Rose e Sol.
À CAPES pela concessão da bolsa de doutorado
Em geral, a todos que aqui não citei, mas que de certa forma colaboraram e estiveram
presentes ao longo deste trabalho com os quais vivi momentos maravilhosos durante o
decorrer de todo o tempo que aqui estive em fim a todos o meu sincero, MUITO
OBRIGADA!
1
INTRODUÇÃO GERAL
A América Tropical é considerada centro de origem de muitas árvores
frutíferas, algumas das quais foram domesticadas ao longo do tempo pelos povos
nativos. A sua riqueza se dá também pela situação geográfica, a heterogeneidade
e a mistura de duas floras, a da América do Norte e a da Amazônia, as quais se
estendem até as áreas baixas da América Central (RUFINO et al., 2010).
O consumo de frutas tropicais está aumentando no mercado interno e nos
mercados internacionais, devido ao crescente reconhecimento da sua função
nutricional e funcional, além do seu valor terapêutico (RUFINO et al., 2010).
No Brasil, diversas espécies não-tradicionais vêm sendo utilizadas pelas
populações locais, pelo grande potencial para exploração no mercado de consumo
in natura e/ou industrializado. No entanto, essas espécies necessitam ser
preservadas, cultivadas racionalmente e caracterizadas através do estudo de suas
propriedades, visando sua utilização no mercado de alimentos funcionais. Além
disso, existe uma demanda cada vez maior nos mercados interno e externo por
novos sabores, cores e texturas (LORENZI et al., 2002).
Neste sentido o abricó (Mammea americana L.), pertencente à família do
garcinia (Clusiaceae), uma fruta originalmente das Índias Ocidentais e do norte da
América do Sul, atualmente é encontrada principalmente na Amazônia
(CAVALCANTE, 1991). Torna-se uma fruta interessante por se tratar de uma fruta
ainda silvestre, ou seja, a colheita ainda tem caráter extrativista e dados
relacionados à sua produção e comercialização ainda são escassos.
As frutas, de um modo geral, desempenham um papel de grande destaque
pelos benefícios à saúde que nos proporcionam, traduzindo no aumento da
expectativa de vida, vitalidade, prevenção de inúmeras doenças, como também
pela presença de nutrientes (vitaminas, minerais e fibras) (LORENZI et al., 2006).
Segundo Madhavi et al. (1997), as principais doenças relacionadas a
peroxidação lipídica são: hemocrematose, doença de Keshan, artrose, reumatismo
e outros processos inflamatórios, aterosclerose e doenças cardiovasculares em
geral, carcinogêneses, etc. O saldo dos efeitos negativos causados pela
2
peroxidação lipídica pode ser demonstrado em números populacionais, já que
doenças cardiovasculares matam mais do que todas as formas de câncer juntas.
O aumento significativo, nos últimos anos, das enfermidades crônicas e
degenerativas converteu-se em um dos principais problemas de saúde nos países
desenvolvidos e em desenvolvimento. Isto tem aumentado o interesse da ciência
em descobrir fatores preventivos destes processos. Neste sentido, estudos tem
demonstrado que o consumo de frutas e verduras vem sendo apontado como
fundamental na prevenção de enfermidades, devido à presença de diferentes
compostos bioativos nesses alimentos. (COSTA & ROSA, 2006).
Segundo a Sociedade Brasileira de Cardiologia (2004) os distúrbios
cardiovasculares são responsáveis, no mundo, por um terço do total de mortes.
No Brasil especificamente, estas doenças situam-se como a mais importante na
causa de mortes. Essa alta incidência de doenças cardiovasculares é
frequentemente correlacionada ao alto consumo de alimentos ricos em colesterol
e gorduras saturadas, ao baixo consumo de fibras dietéticas e principalmente de
biocompostos com capacidade antioxidante, tais como os compostos fenólicos
(LIM et al., 2007).
Tendo em vista a importância de se investigar novas fontes de nutrientes e
compostos funcionais, o estudo para caracterização da Mammea americana,
conhecida popularmente como abricó, mostra-se de grande relevância, já que
dados relacionados à sua composição físico-química ainda são bastante
escassos. Este trabalho teve como objetivo avaliar o potencial desta fruta ainda
pouco explorada e proporcionar informações a respeito de substâncias benéficas
à saúde. Para isso o conteúdo total de compostos fenólicos e a capacidade
antioxidante por diferentes métodos, foram avaliados. A identificação e a
quantificação os compostos fenólicos majoritários presentes na polpa e o perfil dos
ácidos graxos e tocoferóis presentes na fruta foram realizadas através de técnicas
cromatográficas. A divulgação desses resultados é um incentivo para o início de
muitos outros trabalhos que podem ser realizados para aumentar a demanda e
incentivar a produção e comercialização desta fruta, além da possibilidade de
inserção da mesma em outras áreas industriais.
3
REFERÊNCIAS
COSTA, N. M. B.; ROSA, C. O. B. (Ed.). Alimentos funcionais. Viçosa: Ed.
Folha de Viçosa, 202p. 2006.
LIM, Y. Y.; LIM,T.T.; Tee, J. J. Antioxidant properties of several tropical
fruits: A comparative study. Food Chemistry 103. 1003–1008. 2007.
LORENZI, H. et al. Frutas brasileiras e exóticasss cultivadas (de
consumo in natura). São Paulo: Instituto Plantarum de Estudos da Flora, 672p.
2006.
LORENZI, H.; MATOS, F.J.A. Plantas medicinais no Brasil: nativas e
exóticas cultivadas. Nova Odessa: Instituto Plantarum, p, 544, 2002.
MADHAVI, D. L.; SINGHAL, R. S.; KULKARNI, P. R. Technological aspects
of food antioxidants. In: MADHAVI, D.L.; DESHPANDE, S.S.; SALUNKHE, D.K.
Food antioxidants – technological, toxicological and health perspectives.
New York: Marcel Dekker, Inc., 1997.
RUFINO, M. S. M.; ALVES, R.; BRITO, E. S.; PÉREZ-JIMÉNEZ, J.;
SAURA-CALIXTO. F.; MANCINI-FILHO. J. Bioactive compounds and antioxidant
capacities of 18 non-traditional tropical fruits from Brazil. Food Chemistry 121
996–1002, 2010.
5
Cap I
Revisão bibliográfica
Pollyane da Silva Port’s1, Helena Teixeira Godoy1
1 Departamento de Ciência de Alimentos, Faculdade de Engenharia de Alimentos, Universidade Estadual de Campinas (UNICAMP), CEP 6121, 13083-862, Campinas, SP, Brasil.
7
1. REVISÃO BIBLIOGRÁFICA
1.1. Diversidade Amazônica
A região Amazônica possui uma grande variedade de frutas com aromas e
sabores diversificados, muitas vezes desconhecidas ou pouco utilizadas, que
podem apresentar potencialidade econômica, trazendo maior perspectiva de
valorização da região.
Quando se buscam informações sobre frutíferas não ou pouco comerciais,
depara-se com um número muito grande de espécies. Somente das Américas são
citadas cerca de mil espécies nativas, distribuídas em 80 famílias, sendo que pelo
menos 400 são de origem ou ocorrem no Brasil. Entre as frutíferas tropicais de
alguma importância, cerca de 300 espécies, das quais apenas 10% são do Brasil
e estas possuem um grande potencial de exploração (DONADIO et al., 2002).
O Brasil possui um grande número de frutas exóticas ainda pouco
exploradas, frutas essas que além do grande potencial para a agroindústria podem
se tornar uma fonte de renda futura para a população local. Esses frutos
representam uma oportunidade para os produtores locais ganharem acesso a
mercados especiais, onde os consumidores enfatizam não só o caráter exótico
também a presença de nutrientes capazes de prevenir doenças degenerativas não
transmissíveis (ALVES, et al., 2008). Nos últimos anos o consumo de frutas já não
é simplesmente um resultado de gosto e preferência pessoal, mas se tornou uma
preocupação de saúde, devido ao vital conteúdo de nutrientes que elas carregam.
Além dos nutrientes essenciais, a maioria dos frutos apresentam quantidades
consideráveis de micronutrientes, como minerais, vitaminas, e compostos
fenólicos secundários (VASCO, et al., 2008)
Das espécies conhecidas como frutas exóticas, poucas apresentam dados
sobre a sua caracterização. Quando apresentam, estes dados contêm geralmente
a porcentagem total de gordura, fibras, proteínas e minerais, carecendo, contudo
de um aprofundamento mais específico de sua composição nutricional e funcional.
Em especial, as frutas e sementes oleaginosas, que além de contribuírem muito
para a alimentação das populações locais, também são utilizadas para fins
8
medicinais sendo que várias partes das plantas são utilizadas (casca, sementes e
polpa) (NASCIMENTO et al., 2008).
A bacia amazônica é rica em recursos genéticos de frutas e plantas
oleaginosas e sua exploração econômica é potencialmente de grande importância
para a região. Entre as frutas e oleaginosas extraídas na Amazônia, muitas são
excepcionalmente ricas em micronutrientes, principalmente em antioxidantes, tais
como carotenoides, antocianinas e outros polifenóis (ROSSO & MERCADANTE,
2007).
1.2. Abricó (Mammea americana)
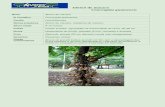
O abricó (Mammea americana L.), como pode ser visualizado na Figura 1,
pertencente à família da garcinia (Clusiaceae) é uma fruta originária das Índias
Ocidentais e do norte da América do Sul, atualmente encontrada principalmente
na Amazônia e algumas outras poucas regiões (CAVALCANTE, 1991). O
abricoteiro foi introduzido na Amazônia Brasileira no início do século XIX, sendo
inicialmente cultivado no então Jardim Botânico da capital da Província do Pará e
utilizado na arborização de ruas. Os primeiros pomares comerciais de abricoteiro
foram estabelecidos em meados da década de 1980, implantados com mudas
oriundas de sementes, advindo desse fato, grande proporção de plantas do sexo
masculino e expressivas variações fenotípicas. O fruto é muito popular no estado,
sendo conhecido em outras regiões do Brasil como abricó-do-pará
(CAVALCANTE, 1996).
Figura 1. Mammea americana, conhecida comumente como abricó
9
Estudos desenvolvidos na Embrapa Amazônia Oriental evidenciaram que
na microrregião de Belém a frutificação do abricoteiro ocorre de junho a dezembro
(NASCIMENTO et al., 2008). Para a cidade de Manaus não foram encontrados, na
literatura, estudos relacionados a época de floração e frutificação do abricó.
Por se tratar de uma fruta ainda silvestre, ou seja, a colheita ainda tem
caráter extrativista, dados relacionados à sua produção e comercialização ainda
são escassos, sabe-se porém que, depois da coleta os frutos são repassados para
intermediários a um baixo custo e revendidos em mercados maiores a um valor
mais elevado. No atual cenário, a demanda é pequena e destinada apenas aos
consumidores locais (BRAGA et al., 2010).
Os frutos de abricó se apresentam na forma de drupas globosas e
volumosas, de 12 – 18cm de diâmetro, contendo de uma a quatro sementes,
podendo o fruto chegar ao peso de até 1kg. Possui casca rugosa, coriáceo-flexível
de cor pardo-alaranjada, mesocarpo (parte comestível) constituído de uma polpa
brilhante, compacta, firme, fibrosa, de coloração alaranjado intenso, de um
agradável sabor e aroma perfumado. O fruto é consumido cru e usado também
para produção de conservas, doces e pastas. Suas sementes são ovaladas,
planoconvexas, com 6 – 8cm de comprimento, imersas na polpa e envolvidas pelo
endocarpo rugoso, em geral são amargas, resinosas e utilizadas como um agente
vermífugo (CAVALCANTE, 1991; MORALES & DUQUE 2002). Contudo, dados
sobre a sua composição ainda são excassos.
1.3. Compostos fenólicos
Atualmente, os compostos fenólicos ganharam bastante destaque em
função de sua capacidade antioxidante trazendo grandes benefícios à saúde
(CAVALCANTE, 1991; BRAGA et al., 2010). Alguns frutos tipicamente amazônicos
apresentam consideráveis concentrações de compostos fenólicos, como é o caso
do açaí, bem como de outros frutas (ROSSO & MERCADANTE, 2007; YANG,
2009).
Os compostos fenólicos são considerados um dos grupos de compostos
bioativos responsáveis pelos efeitos benéficos à saúde. Embora existam outros
10
mecanismos, o modo de ação mais citado é a capacidade antioxidante pela
habilidade de sequestrar espécies reativas de oxigênio e quelar íons metálicos. O
conhecimento do conteúdo de compostos fenólicos presentes nos alimentos a
base de vegetais é uma importante ferramenta para o entendimento do seu papel
na saúde humana, assim como para programas que visam o aumento do seu
consumo. Acredita-se que a atividade biológica destes compostos está
diretamente relacionada com a sua estrutura química (MONTEIRO et al., 2007;
MOLLER & LOFT, 2006).
Os compostos fenólicos são metabólitos secundários presente nas plantas
e são amplamente distribuídos no reino vegetal. Englobam desde moléculas
simples até outras com alto grau de polimerização, e podem estar presentes na
forma livre (aglicona), ligados a açúcares (glicosídeos) e proteínas em diversas
partes das plantas (comestíveis e não comestíveis), como nas sementes, frutos,
folhas, casca do caule e também na raiz. Atualmente são conhecidas mais de
8.000 estruturas, cujas origens orgânicas são ligadas ao caminho metabólico do
ácido chiquímico e ao metabolismo dos fenil propanoides (ANTOLOVICH et al.,
2000; DREOSTI, 2000).
Em sua estrutura básica, possuem um anel aromático com um ou mais
substituintes hidroxílicos, incluindo seus grupos funcionais que os confere poder
antioxidante, podendo ser naturais ou sintéticos. Dentre eles, destacam-se os
flavonoides, os ácidos fenólicos, os taninos e os tocoferóis considerados os
antioxidantes fenólicos mais comuns de fonte natural (ADOLFO LUTZ, 2007).
Tais substâncias ocorrem naturalmente em frutas, vegetais, nos chás e
vinhos (SCALBERT et al., 2005). A importância dos compostos fenólicos está
diretamente relacionada com a atividade fisiológica, a habilidade de capturar
espécies reativas de oxigênio, quelar íons metálicos, inibir a nitrosação, inibir o
potencial de auto-oxidação, além de apresentar a capacidade de modular certas
enzimas celulares ativas (ANTOLOVICH et al., 2000).
Pesquisas indicam uma grande variação na produção de metabólitos
secundários pelas plantas, isto é, plantas pertencentes a mesma espécie podem,
ao longo dos anos, sofrer variações quanto a sua constituição genética e atividade
11
fisiológica, condicionadas pelo processo de seleção ambiental. Esta diversidade
genética ocorre devido ao processo metabólico de cada organismo (HERAS,
1998).
Essas interferências ambientais são os principais precursores no estímulo
para produção desses metabólitos. A concentração desses componentes químicos
nas plantas dependerá do controle genético e dos estímulos proporcionados pelo
meio. Os genes biossintéticos podem ser ativados para estimular a superprodução
de substâncias defensivas, como em casos, por exemplo, de agressão por micro-
organismos e/ou pragas, solo pobre em nutrientes, clima, ferimentos, exposição à
luz UV, etc. Dentre estas substâncias encontram-se os compostos fenólicos, que
também podem atuar nas plantas como antimicrobianos, fotorreceptores, atrativos
visuais e repelentes de predadores (NICHENAMETLA et al., 2006; PIETTA, 2000).
1.3.1. Extração.
O objetivo na extração de compostos fenólicos é liberar estes compostos a
partir das estruturas vacuolares onde eles são encontrados, quer através de
ruptura do tecido da planta ou através de um processo de difusão (COOPER,
2004; KRINSKY E JOHNSON, 2005)
Para isso o preparo da amostra é um fator de grande relevância sobre a
eficiência de extração. A estabilização por meio de congelamento e liofilização são
recursos muito utilizados para a preservação da amostra no período prévio à
análise. A maceração e a redução do tamanho das partículas da amostra são
medidas que aumentam a superfície de contato entre amostra e solvente
facilitando a extração e a reprodução do método (ZHANG et al., 2008).
Assim, vários métodos são referidos na literatura para extração desses
compostos. As técnicas mais utilizadas na literatura são a extração líquido-líquido
(LLE) ou extração sólido-líquido (SLE), para o caso de matrizes sólidas, e a
extração em fase sólida (SPE) (LIMA et al., 2004; TURA & ROBARDS, 2002).
Entretanto, dentre os métodos mais utilizados, a extração assistida por
ultrassom é frequentemente usada para a extração de material vegetal. Este
processo de extração é mais rápido e mais completo em comparação com os
12
métodos tradicionais, tais como maceração/agitação, porque a área de superfície
em contato entre as fases de sólidos e líquidos é muito maior. O tempo de
extração varia e depende da preparação prévia da amostra. Algumas extrações
podem ser realizadas completamente em pouco menos que 30 minutos (KRINSKY
E JOHNSON, 2005). Compostos fenólicos solúveis são geralmente extraídos
utilizando água, metanol, etanol ou acetona. A presença de açúcares anexados
faz com que os compostos fenólicos fiquem mais solúveis em água. Combinações
dos solventes orgânico, como por exemplo, os acima citados com água são,
portanto, solventes melhores para glicosídeos. Em contraste, agliconas menos
polares, tais como isoflavonas, flavanonas e flavonas altamente metoxilados e
flavonóis tendem a ser mais solúvel em solventes não-aquosos (COOPER, 2004;
KRINSKY E JOHNSON, 2005).
O metanol é normalmente o solvente mais empregado. Ele tem sido
utilizado para extrair flavanonas, flavonas, flavonas metoxiflavonas e dímeros de
flavona. O uso de metanol 70-80% apresentou bom rendimento na extração de
hidroxicinâmico e derivados, flavonas, flavonóis e catequinas de frutas,
leguminosas, uva, sementes e bagaço de vinho. A maioria dos flavonoides ocorre
naturalmente como glicosídeos. Os flavo-glicosídeos mostram solubilidade em
água quando comparado com as correspondentes agliconas. O uso de
metanol/água (50:50) é geralmente suficiente para produzir uma boa extração de
glicosídeos em plantas. No entanto, quando o objetivo do trabalho é a avaliação
quantitativa do teor dos compostos fenólicos os solventes de extração são os
orgânicos e não a água somente (MATSUBARA & RODRIGUEZ-AMAYA, 2006).
Para a preservação dos compostos fenólicos a eliminação de água através
de liofilização, que normalmente é empregada nas amostras antes da extração,
geralmente não degrada os compostos fenólicos excessivamente, o que permite
que as amostras sejam mantidas por longos períodos. Congelar a amostra antes
da extração é também aconselhável uma vez que cristais de gelo podem produzir
lesões na estrutura celular e, consequentemente, facilitar a saída dos
componentes celular facilitando, assim o processo de extração (BOCHI et al.,
2015).
13
Por isso diversas pesquisas tem sido realizadas para a otimização do
processo de extração com solventes e com o uso de alternativas mais recentes,
como a utilização de ultrassom e fluído supercrítico e subcrítico. Nesses trabalhos
são utilizados planejamentos experimentais fatoriais, como o delineamento
experimental composto central rotacional (DCCR), a qual possibilita o estudo das
variáveis de extração simultaneamente. Dessa maneira, além da avaliação de
cada variável individualmente, é possível também a determinação de possíveis
efeitos sinérgicos e antagônicos resultantes de interações entre as variáveis
estudadas (FERREIRA et al., 2007).
1.3.2. Métodos de análise
A determinação dos níveis de compostos fenólicos totais em tecidos
vegetais é a etapa inicial de qualquer investigação de funcionalidade fisiológica. A
capacidade redutora desses compostos pode ser uma das propriedades utilizadas
para nortear a quantificação inicial, porém, em tecidos vegetais, a presença de
carboidratos e outros interferentes com as mesmas características requer
metodologias confiáveis para tais avaliações (ANTOLOVICH et al., 2000).
Para realização da análise de compostos fenólicos totais, métodos
colorimétricos e enzimáticos podem ser utilizados. No entanto, grande parte dos
trabalhos determina o teor de fenólicos por métodos colorimétricos com o reagente
Folin-Ciocalteu, utilizando o ácido gálico como padrão de referência, onde os
resultados são expressos em mg de ácido gálico equivalente por grama de peso
seco (mgEAG/mg) (ASSOLINI et al., 2006).
Estudos relacionados à separação, identificação, quantificação e utilização
dos compostos fenólicos em alimentos, enfrenta uma série de dificuldades, devido
à diversidade de substâncias (fenóis simples, ácidos fenólicos, cumárinas,
flavonoides, taninos e ligninas), a grande polaridade e reatividade, e a
susceptibilidade à ação de enzimas (SOARES, 2002).
Vários métodos são utilizados para a determinação dos compostos
fenólicos majoritários em produtos naturais, no entanto, é de significativa
importância que sejam desenvolvidos métodos capazes de determinar,
14
simultaneamente, uma grande gama de compostos, com rapidez, custos
relativamente baixos e com resultados de qualidade. Seguindo esse objetivo,
diversos procedimentos já foram otimizados para identificar e quantificar fenólicos
em alimentos, incluindo Cromatografia Líquida de Alta Eficiência (CLAE),
Cromatografia Gasosa (CG), Eletroforese Capilar (EC) e Eletrocromatografia
Capilar (CEC) (MOLNÁR-PERL & FÜZFAI, 2005). Essas técnicas são de extrema
importância na separação, na identificação e na quantificação dos polifenólicos
(STALIKAS, 2007).
Entre as técnicas cromatográficas para determinação de constituintes
fenólicos biologicamente ativos, a mais utilizada com essa finalidade é o método
por cromatografia líquida de alta eficiência em fase reversa com eluição por
gradiente. Quanto à identificação dos compostos, é muito comum utilizar a
detecção por espectrofotometria de absorção na região UV-visível. (BUIARELLI et
al., 1995; KOO et al., 2000; LOPEZ et al., 2001). Neste caso, a identificação é feita
por comparação dos tempos de retenção e dos perfis de espectros de absorção
obtidos de padrões isolados. No entanto, a forma mais conclusiva de identificação
é a utilização de técnicas como a espectrometria de massas e a ressonância
magnética nuclear. Normalmente, os flavonoides são os compostos de maior
ocorrência em folhas, frutos e outras partes aéreas de vegetais, dentre alguns
estão a quercetina, kaempferol e miricetina (SCHIEBER et al., 2001; HÄKKINEN
et al., 1998; PEREZ-MAGARIÑO et al., 1999).
1.3.3. Hidrólise
A determinação quantitativa de flavonoides glicosilados em materiais
vegetais se torna bastante difícil, devido ao seu grande número impossibilitando
assim, a aquisição de padrões. Portanto, os glicosídeos são normalmente
hidrolisados nas agliconas correspondentes, as quais podem ser identificadas e
quantificadas.
Métodos para a hidrólise ácida de flavonoides a partir de vegetais e frutos
foram publicadas por Hertog et al. (1993) e por Hakkinen et al. (1998).
Normalmente, a hidrólise de glicosídeos flavonoides exige concentrações
15
relativamente elevadas (1-2 mol.L-1) de minerais ácidos em condições de refluxo.
Todavia, as condições para realização da hidrólise desses glicosídeos podem ser
rigorosas para alguns dos outros compostos fenólicos presentes, como no caso
das catequinas, que são miricetinas parcialmente degradadas (MERKEN &
BEECHER, 2000; HAKKINEN et al., 1998; HERTOG et al., 1995).
Dessa forma, estudos devem ser realizados e avaliados de acordo com
cada matéria-prima empregada, a fim de desenvolver os melhores procedimentos
e condições de preparação e hidrólise das amostras para a formação de agliconas
de flavonoides, sem que as mesmas sejam degradadas (NUUTILA et al., 2002).
1.4. Capacidade antioxidante
Os estudos relacionados à capacidade antioxidante são de extrema
necessidade frente ao estresse oxidativo que sempre ocorre em nosso organismo.
Esse estresse oxidativo nada mais é do que o desequilíbrio entre o sistema pró e
antioxidante ocorre devido a uma produção descontrolada de radicais livres ou
uma deficiência nos mecanismos de defesa, o que acarreta prejuízo à célula
como, oxidação de lipídios de membrana, proteínas, enzimas, carboidratos e DNA,
que se acumulam com o passar dos anos contribuindo para a degeneração das
células somáticas e indução de doenças crônico-degenerativas, especialmente
associadas com o avanço da idade (HALLIWELL, 1994; FINKEL & HOLBROOK,
2000; LANGSETH, 2000; PIETTA, 2000; SCALBERT et al., 2005; VALKON et al.,
2007).
Os compostos fenólicos, incluindo flavonoides e xantonas, são conhecidos
por inibir a peroxidação lipídica e as lipoxigenases in vitro, através da capacidade
em sequestrar radicais livres, tais como hidroxílicos, superóxidos e peroxílicos, os
quais reconhecidamente promovem o estresse oxidativo celular (LEONG & SHUI,
2002; MOONGKARNDI et al., 2004; OKONOGI, et al., 2007;
TACHAKITTIRUNGROD et al., 2007; LEONTOWICZ et al., 2007). Numerosos
estudos mostram que tais compostos, presentes nos alimentos, estão associados
com ações anticarcinogênica (inibição do câncer de cólon, esôfago, pulmão,
fígado, mama e pele), anti-inflamatória, anti-hepatotóxica, antiviral, antialérgica e
16
antitrombótica (MAZZA & GIRARD, 1998). Além disso podem prevenir a oxidação
de lipoproteínas de baixa densidade (LDL), diminuindo os riscos da aterosclerose,
atuando na prevenção de doenças cardiovasculares e na absorção de produtos
tóxicos oriundos da peroxidação lipídica (GORELIK et al., 2008; MATSUMOTO et
al., 2003; CHIANG et al., 2004; DUBICK & OMAYE, 2001). Ação antibacteriana
(CHANARAT et al., 1997), antifúngica, anti-inflamatória, antitumoral e atividade
antileucêmica também já foram atribuídas às xantonas (HO et al., 2002).
A maioria dos organismos teve seus sistemas de defesa (antioxidantes)
evoluído para protegê-los contra danos oxidativos, no entanto, estes sistemas são
insuficientes para impedir totalmente o dano (SIMIC, 1988). Por tais motivos,
devido a alta capacidade antioxidante e importância nutricional, os compostos
fenólicos e carotenoides têm se destacado dentre os compostos bioativos
presentes na natureza, fazendo com que a procura por esses antioxidantes
aumentassem significativamente nesta última década (BECKER, 2004; LEE, 2004;
TURA & ROBARDS, 2002; YANG, 2009).
Os compostos fenólicos presentes nos materiais vegetais estão
intimamente associados a sua capacidade antioxidante, efeito este que está
principalmente ligado à sua propriedade de redução-oxidação, atuando por meio
de vários mecanismos: atividade sequestradora de radicais livres, atividade de
transição metal-quelante, e/ou capacidade de desativar o oxigênio singlete. Além
disso, são conhecidos por desempenharem um papel importante na estabilização
da peroxidação lipídica e inibir vários tipos de enzimas responsáveis pela oxidação
no organismo. Estes mecanismos múltiplos do potencial antioxidante tornam o
grupo dos compostos fenólicos um alvo interessante na busca de fitoquímicos
benéficos à saúde (SHAN et al., 2005; SRINIVASAN, 2005; ZHENG et al., 2001).
Para a determinação da capacidade antioxidante, ou da capacidade de
moléculas impedirem reações radiculares e oxidativas, muitos métodos têm sido
aplicados, porém como a informação gerada por cada método varia, torna-se
necessária à aplicação de mais de um método para esta determinação (SILVA et
al, 2007). Para os diversos métodos espectrofotométricos in vitro, alguns são
baseados na captura de radicais livres (ORAC - Oxygen Radical Absorbance
17
Capacity, captura do radical ABTS•, captura do radical DPPH•), outros no Poder
de Redução do Ferro (FRAP) ou na quantificação de produtos formados durante a
peroxidação de lipídios (TBARS, oxidação do LDL) (PAIXÃO et al., 2007;
ANTOLOVICH et al., 2002).
Frente à diversidade da estrutura química dos compostos antioxidantes e
de seus mecanismos de ação, vários ensaios têm sido desenvolvidos para avaliar
a capacidade antioxidante de diferentes amostras. Baseado nas reações químicas
envolvidas, a maior parte dos métodos usados para avaliar a capacidade
antioxidante pode ser dividida em duas categorias: (1) baseados na reação de
transferência de elétrons, representados pelo método de Folin-Ciocalteu e
sequestro de radicais livres, que simulam as espécies reativas de oxigênio, tais
como o DPPH• (1,1 difenil- 2-picrilhidrazil) e o ABTS+• [2,2’-azino-bis(3-etil-
benzolina-6-sulfonado)] e (2) baseados na reação de transferência de átomos de
hidrogênio, representado pelo ORAC (Oxygen Radical Absorbance Capacity) e
sistema β-caroteno/ácido linoléico (ARNAO, 2000; HUANG et al., 2005).
Muitos destes métodos avaliam a eficácia de moléculas em impedir as
reações radiculares e oxidativas. Como a informação gerada por cada método
varia, torna-se necessária a aplicação de mais de um método para avaliar de
modo mais completo, a capacidade de antioxidante (BRAGA et al., 2010; PRIOR
et al., 2005).)
Antioxidantes naturais, especialmente em frutas e legumes, têm ganhado
interesse crescente entre os consumidores e a comunidade científica, visto que os
estudos epidemiológicos indicam que o consumo frequente de antioxidantes
naturais está associado com um menor risco de doença cardiovascular e câncer
(LANGSETH, 2000). Os efeitos de defesa de antioxidantes naturais em frutas e
vegetais estão relacionados a três grandes grupos: vitaminas, compostos fenólicos
e carotenoides. O ácido ascórbico e os compostos fenólicos pertencem a classe
de antioxidantes hidrofílicos, enquanto carotenoides pertencem a classe de
antioxidantes lipofílicos (HALLIWELL, 1994).
É importante salientar que apenas a identificação e a quantificação destes
compostos não são parâmetros suficientes para avaliar o quanto um alimento ou
18
um determinado composto é benéfico à saúde, uma vez que tais compostos nunca
estão sozinhos e pode haver reações sinérgicas ou antagônicas entre eles. Assim,
a verificação destas interações também é importante, bem como a verificação da
capacidade antioxidante do alimento como um todo (IACOPINI et al., 2008).
1.5. Ácidos graxos
Cada vez mais tem aumentado a procura por óleos vegetais com
composição especial, tais como óleos de oliva, de girassol, de palma e de linhaça,
que demonstraram um elevado valor comercial devido à presença dos
componentes funcionais (FOSTER & WILLIAMSON, 2009; AQUINO et al., 2012).
As propriedades funcionais dos óleos vegetais também têm sido
amplamente estudadas devido aos seus benefícios a saúde e à sua utilização na
indústria de alimentos. A estabilidade oxidativa de um óleo vegetal pode ser
influenciada pela quantidade de antioxidantes naturalmente presentes ou
adicionados a este produto (ARAIN et al., 2009).
Por definição, ácidos graxos são compostos alifáticos monocarboxílicos
derivados ou contidos na forma esterificada proveniente de uma gordura, óleo ou
cera vegetal ou animal, os quais, comumente, apresentam uma cadeia de 4 a 28
carbonos, saturados ou insaturados (IUPAC, 1997)
Os ácidos graxos (AGs) são os componentes básicos naturalmente
presentes em plantas e animais. A diversidade do comprimento da cadeia, grau de
insaturação, geometria e posição das ligações duplas determinam as
características destes lípidos e a sua origem (LIMA, et al., 2002). As propriedades
dos óleos são muito dependentes do perfi AGs, que fornecem informações sobre o
comprimento da cadeia, porcentagem de saturação, monoinsaturação e poli-
insaturação. Com base nestas informações a determinação do perfil AGs
insaturados presente nos alimentos é de extrema importância, já que sua ingestão
possui impactos benéficos a saúde como, por exemplo, na prevenção de doenças
cardiovasculares (ATTAR-BASHI, et al., 2004; GROOTVELD, et al., 2001).
O método mais utilizado para a análise de AGs envolve a determinação dos
ésteres metílicos correspondentes (FAMEs), utilizando cromatografia gasosa (CG)
acoplado com detector de ionização de chama (FID) (FIRESTONE, 1987). Para
19
lipídios, gorduras e óleos muitas vezes um procedimento de transesterificação
envolvendo a conversão direta dos AGs, para ésteres de alquilo (especificamente
metil ésteres) por álcool na presença de um catalisador é realizada. O
procedimento de derivatização (especialmente para os AGs de cadeia longa) é
obrigatório para aumentar a volatilidade e superar adsorção dos grupos polares
funcionais para a coluna CG (LACAZE et al., 2007). Os AGs termicamente lábeis
também pode ser separada através da cromatografia líquida de alta eficiência
(HPLC), eletroforese capilar (CE) e cromatografia com fluido supercrítico
(BRONDZ, 2002). Antes da determinação analítica, os FAS ou os FAMEs
precisam ser isolados a partir da amostra. Isto é comumente realizado usando
extração líquido-líquido (LLE), procedimento este, utilizado nos métodos oficiais
recomendados pelos órgãos reguladores, como por exemplo, a American Oil
Chemists Society (AOCS) e o Malaysian Palm Oil Board (MPOB) (SIANG, et al.,
2010).
Os principais problemas da técnica LLE são o consumo bruto de solvente
orgânico, a falta de seletividade, tempo longo de análise, além da etapa de
evaporação, que se faz necessário antes da análise para remover o excesso de
solvente. Isto pode conduzir a problemas de contaminação e possível perda de
analítos (BERRUETA, et al., 1993; WU & LEE, 2006). Para superar estes
problemas e para atender à crescente demanda de determinações analíticas, um
esforço considerável tem sido direcionado para abordar estas questões. No início
dos anos 1970, a técnica de extração em fase sólida (SPE) foi introduzida
(BERRUETA, et al., 1993) e muitos trabalhos utilizando esta técnica para a análise
de AGs, foram publicados por exemplo, a determinação da composição de FAs de
cadeia longa no azeite de dendê transesterificado (PUAH, et al., 2006), a
determinação de metil linolenate e metil linoleato na soja derivada de biodiesel (LI,
et al, 2009) e a determinação de AG livre na cerveja (HORÁK, et al., 2009). Mais
recentemente, a microextração trouxe a minimização do uso de vários solventes
utilizados na extração, tais como a microextração em fase sólida (SPME) e
microextração em fase líquida (LPME) que foram introduzidas por Bjergaard e
Rasmussen, (1999).
20
Assim, a análise de ácidos graxos é considerada de rotina em muitos
laboratórios de química de alimentos e controle de qualidade. Após a extração
com solventes orgânicos, a composição em ácidos graxos é determinada
realizando-se a derivatização da amostra, produzindo ésteres metílicos de ácidos
graxos. Os ésteres são separados por cromatografia em fase gasosa, geralmente
utilizando-se detecção por ionização em chama (VENKATACHALAM & SATHE,
2006; VISENTAINER & FRANCO, 2006; FARKAS et al., 2008).
1.6. Tocoferóis
Grãos, vegetais, óleos vegetais e frutas contêm um amplo espectro de
antioxidantes lipofílicos incluindo os tocoferóis. Estudos epidemiológicos e clínicos
indicam que um aumento da ingestão de cereais, vegetais e frutas pode resultar
em uma concentração plasmática mais elevada desses antioxidantes, os quais
têm sido associados com o risco reduzido de doenças degenerativas crônicas, tais
como o cancro, doenças cardiovasculares, leucoplasia oral, danos da pele, e
também estão associadas a diminuição envelhecimento ocular (HAO et al., 2005).
A vitamina E, termo genérico utilizado para designar diferentes compostos
ocorrem em uma variedade de isômeros que se diferem na estrutura de acordo
com o número e a localização de grupos substituintes no anel cromanol. Possui
oito isômeros: α-, β-, γ-, δ-tocoferol (T) e α-, β-, γ-, δ-tocotrienol (T3) (GUINAZI et
al., 2009). E dentre os tocoferóis, especialmente α- e γ-tocoferol, são
particularmente os mais abundantes (BRAUNRATH et al., 2010).
Estes compostos têm sido extensivamente estudados em diversas áreas do
conhecimento, assim com os ácidos graxos, uma vez que desempenham papeis
especialmente importantes na reprodução e em mecanismos antioxidantes de
tecidos animais e vegetais. A ingestão de vitamina E tem despertado interesse e
preocupação principalmente nesta última década, uma vez que compõe
juntamente com a vitamina C, carotenoides, selênio, enzimas (catalase,
peroxidase de glutationa e superóxido dismutase) e flavonoides, o grupo
denominado antioxidantes alimentares (DO et al., 2015; GUINAZI et al., 2009).
Os tocoferóis fazem parte dos micronutrientes lipofílicos que desempenham
um papel importante na saúde humana. Entre os compostos do tocoferol, o α-
21
tocoferol é apontado como sendo o mais potente em sua ação antioxidante. No
entanto, alguns trabalhos indicam que outros isômeros como γ- e δ-tocoferol são
melhores antioxidantes que o α-tocoferol (CHAUVEAU-DURIOT et al., 2010;
GUINAZI et al., 2009)
Essas controvérsias, em relação a qual isômero possui maior ação
antioxidante, podem ocorrer devido a diferenças entre os métodos testados, os
substratos utilizados, o nível de oxidação empregado e as metodologias
empregadas para monitoramento da oxidação. Por isso, métodos confiáveis e
sensíveis são essenciais para a determinação da ação antioxidante dos tocoferóis
presentes em alimentos (CHAUVEAU-DURIOT et al., 2010; GUINAZI et al., 2009;
MEHMOOD, 2015). Por isso, se faz importante realizar estudos para avaliar a
presença desses isômeros uma vez que estes podem possuir além de
características químicas diversas podem também atuar de diferentes formas
(LIMA, 1997).
Diversas técnicas têm sido aplicadas para separação, purificação e
quantificação de tocoferóis nas mais variadas matrizes orgânicas e podem ser
utilizadas de acordo com os objetivos da análise e da natureza da amostra. De um
modo geral, um bom método analítico e prático deve ter uma combinação ideal de
extração, separação por cromatografia e funcionalidade do detector. Com base
nas suas propriedades químicas, os tocoferóis podem ser extraídos com solventes
hidrofóbicos tais como clorofórmio ou hexano, separados por coluna usando fase
normal ou fase reversa e quantificado por detectores acoplados a cromatógrafo
como UV, fluorescência, espectrometria de massas (MS) e Ressonância
Magnética Nuclear (RMN). Entre outras técnicas empregadas, podem-se citar as
colorimétricas, cromatografia em camada delgada, a cromatografia gasosa, além
de algumas ainda em desenvolvimento, como a eletroforese capilar (HAO et al.,
2005; GUINAZI et al., 2009).
Porém, desde que foi utilizada para a análise de antioxidantes lipídicos, a
cromatografia líquida de alta eficiência (HPLC) tem sido extensivamente aplicada
e é a técnica preferida pela grande maioria dos pesquisadores da área para a
22
análise de compostos presentes em pequenas quantidades em matrizes
complexas (PINHEIRO-SANT’ANA et al., 2011; GUINAZI et al., 2009).
A fluorescência é a técnica de detecção cromatográfica utilizada para a
análise de tocoferóis e tocotrienóis na maioria dos estudos realizados com HPLC.
Esta preferência para a detecção por fluorescência é atribuída à sua seletividade
mais elevada, a sensibilidade e especificidade em comparação com a detecção
por absorbância (PINHEIRO-SANT’ANA et al., 2011).
Poucos trabalhos têm pesquisado a composição completa dos isômeros da
vitamina E em alimentos, sendo que a maioria tem relatado apenas o conteúdo do
α-tocoferol. Além disso, as tabelas brasileiras de composição de Alimentos ainda
não contemplam os diferentes isômeros da vitamina E, o que torna importante
pesquisas envolvendo a composição completa em alimentos brasileiros (GUINAZI
et al., 2009).
Desta forma, considerando a enorme biodiversidade encontrada no Brasil e
o apelo comercial cada vez maior de ingredientes naturais e funcionais, o objetivo
deste trabalho foi obter extratos caracterizados quanto à composição de fenólicos
totais, capacidade antioxidante, ácidos graxos e tocoferóis dos frutos de Mammea
americana de dois diferentes estados brasileiros (Pará e Amazônia), além de 2
acessos cedidos pela EMBRAPA – Amazônia Oriental.
23
REFERÊNCIAS
AGOSTINI, T.S. GODOY, H.T. Simultaneous determination of nicotinic acid,
nicotinamide, riboflavin, thiamin and pyridoxine in enriched Brazilian foods, by
HPLC. Journal High resolution Chromatography, 20, 3081-3086, 1997.
ANTOLOVICH, M.; PRENZLER, P. D.; PATSALIDES, E.; MCDONALD, S.;
ROBARDS, K. Methods for testing antioxidant activity. Analyst, v. 127, p. 183–
198, 2002.
ANTOLOVICH, M.; PRENZLER, P.; ROBARDS, K. & RYAN, D. Sample
preparation in the determination of phenolic compounds in fruits - Review. Analyst,
125, 989-1009. 2000.
AQUINO, J. D. E.; PESSOA, D. C. N. D. P.; ARAÚJO, K. D. L. G. V. ;
EPAMINONDAS, P. S.; SCHULER, A. R. P.; SOUZA, A. G. D.; STAMFORD, T. L.
M. Refining of Buriti Oil (Mauritia flexuosa) Originated from the Brazilian Cerrado:
Physicochemical, Thermal-Oxidative and Nutritional Implications. Journal Of The
Brazilian Chemical Society, Vol. 23, No. 2, 212-219, 2012.
ARAIN, S.; SHERAZI, S. T. H.; BHANGER, M. I.; TALPUR, F. N.;
MAHESAR, S. A. Oxidative stability assessment of Bauhinia purpurea seed oil in
comparison to two conventional vegetable oils by differential scanning calorimetry
and Rancimat methods Thermochimica Acta. 484, 1. 2009.
ARIAS, R.; LEE, T.C.; LOGENDRA L.; JANES, H. Correlation of lycopene
measured by HPLC with the L*, a*, b* color readings of a hidroponic tomato and
the relationship of maturity with color and lycopene content. Journal of
Agricultural and Food Chemistry, v.48, p.1697-1702, 2000.
ARNAO, M. B. Some methodological problems in the determination of
antioxidant activity using chromogen radicals: a practical case. Trends in Food
Science & Technology, v.11, p. 419-421, 2000.
ARTHUR, C. L.; PAWLISZYN, J. Solid phase microextraction with thermal
desorption using fused silica optical fibers. Analytical Chemistry, 62, 2145–2148.
1990
24
ASOLINI, F. C.; TEDESCO, A. M.; CARPES S. T. Atividade Antioxidante e
Antibacteriana dos Compostos Fenólicos dos Extratos de Plantas Usadas como
Chás. Brazilian Journal of Food Technology, v.9, n.3, p. 209-215, jul./set. 2006.
ASSOCIATION OF OFFICIAL ANALYTICAL CHEMISTS. Official methods
of analysis. 16th ed. Washington, DC, 1997. v. 2. 1190. Capítulo 3
ASSUNÇÃO, R. B., MERCADANTE, A. Z. Carotenoids and ascorbic acid
from cashew apple (Anacardium occidentale L.): Variety and geographic effects.
Food Chemistry, 81, 495–502. 2003.
ATTAR-BASHI, N.M.; FRAUMAN A.G.; SINCLAIR, A.J., Alpha-linolenic acid
and the risk of prostate cancer. What is the evidence? The Journal of Urology.
171, 2004.
BALL, G. F. M. Vitamins in foods: Analysis, bioavailability and stability. In G.
F. M. Ball (Ed.), Vitamins in foods: Analysis, bioavailability and stability. Boca
Raton, USA: CRC Press LLC. 2006.
BECKER, E. M.; NISSEN, L. R.; SKIBSTED, L. H. Antioxidant evaluation
protocols: food qualitor health effects. European Food Research and
Technology, Berlin, v. 219, n. 6, p. 561-571, Nov. 2004.
BENZIE, I. F. F. & STRAIN, J. J. The Ferric Reducing Ability of Plasma
(FRAP) as a Measure of “Antioxidant Power”: The FRAP Assay. Analytical
Biochemistry, v. 239, n. 292, p. 70-76, 1996.
BERNSTEIN, M., NELSON, M., TUCKER, K., LAYNE, J., JOHNSON, E.,
NUERNBERGER, A. A home-based nutrition intervention to increase consumption
of fruits, vegetables and Calcium-rich foods in community dwelling elders. Journal
of the American Dietetic Association, 102, 1421–1422. 2002.
BERRUETA, L.A., GALLO, B., VICENTE, F.. Analysis of oxazepam in urine
using solid-phase extraction and high-performance liquid chromatography with
fluorescence detection by post-column derivatization. Journal Chromatography,
1993.
BLIGH, E. G.; DYER, W. J. A rapid method of total lipid extraction and
purification. Canadian Journal of Biochemistry and Physiology, v..37, n.8,
p.911-917, 1959.
25
BRAGA, A. C. C.; SILVA, A. E.; PELAIS, A. C. A.; BICHARA, C. M. G.
POMPEU, D. R. Atividade antioxidante e quantificação de compostos bioativos
dos frutos de abricó (Mammea americana). Alimentos e Nutrição, Araraquara
v.21, n.1, p. 31-36, 2010
BRAUNRATH, R.; ISNARDY, B.; SOLAR S.; ELMADFA, I. Impact of α-, γ-,
and δ -tocopherol on the radiation induced oxidation of rapeseed oil
triacylglycerols. Radiation Physics and Chemistry. 79, 764–769, 2010.
BRONDZ, I. Development of fatty acid analysis by high-performance liquid
chromatography, gas chromatography, and related techniques. Analytica Chimica
Acta 465, 2002.
BUIARELLI, F.; CARTONI, G.; COCCIOLI, F.; LEVETSOVITOU, Z.
Determination of phenolic acids in wine by high-performance liquid
chromatographic with a microbore column. Journal of Chromatography A; v.695,
p. 229-235, 1995.
CARVALHO, J. E. U. de; MÜLLER, C. H. Biometria e rendimento
percentual de polpa de frutas nativas da Amazônia. Belém, PA: Embrapa
Amazônia Oriental. 4 p. (Embrapa Amazônia Oriental. Comunicado Técnico, 139).
2005.
CAVALCANTE, P. B. Frutas comestíveis da Amazônia. 5.ed. Belém:
CEJUP, 279 p, 1991.
CAVALCANTE, P. B. Frutas comestíveis da Amazônia. 6. ed. Belém, PA:
CEJUP, 279 p. 1996.
CHANARAT, P., CHANARAT, N., FUJIHARA, M., NAGUMO, T.; Immuno
pharmacological activity of polysaccharide from the pericarp of mangosteen
garcinia: phagocytic intracellular killing activities. Journal of the Medical
Association of Thailand 80, S149-154, 1997.
CHAUVEAU-DURIOT, B.; DOREAU, M.; NOZIÈRE, P.; GRAULET, B.
Simultaneous quantification of carotenoids, retinol, and tocopherols in forages,
bovine plasma, and milk: validation of a novel UPLC method. Analytical and
Bioanalytical Chemistry. 397:777–790, 2010.
26
CHIANG, L.C.; CHENG, H.Y.; LIU, M.C.; CHIANG, W.; LIN, C.C; In vitro
evaluation ofantileukemic activity of 17 commonly used fruits and vegetables in
Taiwan. LWT- Food Science and Technology37, 539–544, 2004.
COOPER, D. A. Carotenoids in health and disease: recent scientific
evaluations, research recommendations and the consumer. Journal of Nutrition,
134(1), 221S–224S. 2004.
DIAS, M. G.; CAMÕES, M. F. G.F.C.; OLIVEIRA, L. Carotenoids in
traditional Portuguese fruits and vegetables. Food Chemistry 113, 808–815,
2009.
DONADIO, L. C.; MORO, F.V.; SERVIDONE, A. A., Pitanga. In: Frutas
Brasileiras. Novos Talentos, Jaboticabal, p.240-243, 2002.
DREOSTI, J. E. Antioxidant polyphenols in tea, cocoa, and wine. Nutrition.
v.16, p. 692-694, 2000.
DUBICK, M.A.; OMAYE, S.T.; Modification of atherogenesis and heart
disease by grape wine and tea polyphenols. In: Wildman, R.E.C. (org). Handbook
of Nutraceuticals and Functional Food. Boca Raton: CRC Press, p.235-261,
2001.
FARKAS, O.; ZENKEVICH, I. G.; STOUT, F.; KALIVAS, J. H.; HÉBERGER,
K. Prediction of retention indices for identification of fatty acid methyl esters.
Journal of Chromatography A, v. 1198-1199, p. 188-195, 2008.
FERREIRA, S. L. C.; BRUNS, R. E; SILVA, E. G. P.; SANTOS, W. N. L.;
QUINTELLA; C. M.; DAVID, J. M.; ANDRADE, J. B.; BREITKREITZ, M. C.;
JARDIM, I. C. S. F.; NETO, B. B. Statistical designs and response surface
techniques for the optimization of chromatographic systems. Journal of
Chromatogr A 1158(1-2): 2-14, 2007.
FINKEL, T. & HOLBROOK, N.J. Oxidants, oxidative stress and the biology
of ageing. Nature, v. 408, n. 9, p. 239–247, 2000.
FIRESTONE, D. Official Methods and Recommended Practices (4th ed.),
American Oil Chemists’ Society, Champaign, IL. 1987.
FOSTER, R.; WILLIAMSON, C. S.; LUNN, J.; Culinary oils and their health
effects. Food and nutrition bulletin. 34, 4. 2009.
27
GORELIK, S.; LIGUMSKY, M.; KOHEN, R.; KANNER, J.; A novel function of
red wine polyphenols in humans: prevention of absorption of cytotoxic lipid
peroxidation products. The FASEB Journal. Com., 22, 41-46, 2008.
GROOTVELD, M.; C.J.L. SILWOOD, P. ADDIS, A. CLAXSON, B.B.
SERRA, M. VIANA. Health effects of oxidized heated oils. Foodservice Research
International. 13, 2001.
GUINAZI, M.; MILAGRES, R. C. R. M. PINHEIRO-SANT’ANA, H. M.
CHAVES, J. B. P.. Tocoferois e tocotrienois em óleos vegetais e ovos. Quimica
Nova, Vol. 32, No. 8, 2098-2103, 2009.
HAKKINEN, S.H.; KÄRENLAMPI, S.O.; HEINONEN, I.M.; MYKKÄNEN,
H.M.; TÖRRÖNEN, A.R. HPLC method for screening of flavonoids and phenolic
acids in berries. Journal of the Science of Food and Agriculture. v. 77, p. 543–
551, 1998.
HALLIWELL, B. Free radical and antioxidants: a personal view. Nutrition
Reviews, v. 52, n. 8, p. 253-265, 1994.
HAOA, Z.; PARKERA, B.; KNAPPA, M.; YU, L. Simultaneous quantification
of α-tocopherol and four major carotenoids in botanical materials by normal phase
liquid chromatography–atmospheric pressure chemical ionization-tandem mass
spectrometry. Journal of Chromatography A. v 1094, 1–2, 11, Pages 83–90,
2005.
HERAS, D. L.; SLOWING, K.; BENEDÍ, J.; CARRETO, E.; ORTEGA, T.;
TOLEDO, C. BERMEJO, P.; IGLESIAS, I.; ABAD, M. J.; GÓMEZ-SERRANILLOS,
P.; LISO, P. A.; VILLAR, A. Antiinflamatory and antioxidant activity of plants used
in traditional medicine in Ecuador. Journal of Ethnopharmacology. v.61: p. 161-
166, 1998.
HERTOG, M. G. L.; HOLLMAN, P. C. H.; VAN DE PUTTE, B. Content of
potentially anticancerogenic flavonoids of tea infusions, wines and fruit juices.
Journal of Agricultural and Food Chemistry, 41, p. 1242–1246, 1993.
HERTOG, M. G. L.; KROMHOUT, D.; ARAVANIS, C.; BLACKBURN, H.;
BUZINA, R.; FIDANZA, F. Flavonoid intake and longterm isk of coronary heart
28
disease and cancer in the seven countries study. Archives of Internal Medicine,
155, p. 381–386, 1995.
HO, C.K.; HUANG, Y.L.; CHEN, C.C. Garcinone E, a xanthone derivative,
has potent cytotoxic effect against hepatocellular carcinoma cell lines. Planta
Medica. 68, p. 975-979, 2002.
HORNERO-MÉNDEZ, D.; GOMÉZ-LADRÓN-de-GUEVARA, R.; MÍNGUEZ-
MOSQUERA, M. I. Carotenoid biosynthesis changes in five red pepper (Capsicum
annuum L.) cultivars during ripening. Cultivar selection for breeding. Journal of
Agricultural and Food Chemistry, 48:3857-3864, 2000.
HUANG, D., OU, B., PRIOR, R. L. The chemistry behind antioxidant
capacity assays. Journal of Agricultural and Food Chemistry, v. 53, p. 1841-
1856, 2005.
IACOPINI, P.; BALDI, M.; STORCHI, P. & SEBASTIANI, L. Catechin,
epicatechin, quercetin, rutin and resveratrol in red grape: Content, in vitro
antioxidant activity and interactions. Journal of Food Composition Analysis, 21,
p. 589-598, 2008.
IUPAC. Compendiun of chemical terminology. 2ª ed. 1997.
WU, J.; LEE, H.K. Ion-pair dynamic liquid-phase microextraction combined
with injection-port derivatization for the determination of long-chain fatty acids in
water samples. Journal Chromatogry A 1133, 2006.
KOO, H.; ROSALEN, P. L.; CURY, J. A.; AMBROSANO, G. M. B.;
MURATA, R. M.; YATSUDA, R.; IKEGAKI, M.; ALENCAR, S. M.; PARK, Y. K.
Effect of a new variety of Apis mellifera propolis on mutants Streptococci. Current
Microbiology, New York, v. 41, n. 3, p. 192-196, Sept. 2000.
KRINSKY, N. I., & JOHNSON, E. J. Carotenoid actions and their relation to
health and disease. Molecular Aspects of Medicine, 26, 459–516. 2005.
KURZ, C., CARLE, R.; SCHIEBER, A. HPLC–DAD–MS characterization of
carotenoids from apricots and pumpkins for the evaluation of fruit product
authenticity. Food Chemistry, 110, 522–530. 2008.
LACAZE, J.-P.C.L., L.A. STOBO, E.A. TURRELL, M.A. QUILLIAM, Journal
Chromatogry A 1145 (2007) 51.
29
LANGSETH, L. Antioxidants and their effects on health. In: SCHMIDL,
M. K., LABUZA, T. P. Essential of foods. Maryland: Aspen Publication, p. 303-
317, 2000.
LEAKEY, R. Potential for novel food products from agroforestry trees: a
review. Food Chemistry, 66, 1–14. 1999.
LEE, J.; KOO, N.; MIN, D. B. Reactive oxygen species, aging, and
antioxidative nutraceuticals. Comprehensive Reviews in food Science and Food
Safety, Chicago, v. 3, n. 1, p. 21-33, Jan. 2004.
LEONG, L. P.; SHUI, G. An investigation of antioxidant capacity of fruits in
Singapore markets. Food Chem. 76, 69-75, 2002.
LEONTOWICZ, M.; LEONTOWICZ, H.; DRZEWIECKI, J.; JASTRZEBSKI,
Z.; HARUENKIT, R.; POOVARODOM, S.; PARK, Y.S.; JUNG, S.T.; KANG, S.G.;
TRAKHTENBERG, S.; GORINSTEIN, S.; Two exotic fruits positively affect rat’s
plasma composition. Food Chem. 102, 192–200, 2007.
LI, M., P.J. PHAM, T. WANG, C.U. PITTMAN JR., T. LI, Solid phase
extraction and enrichment of essential fatty acid methyl esters from soy-derived
biodiesel by novel pi-complexing sorbents. Bioresource Technology 100, 2009.
LIM, Y. Y.; LIM,T.T.; Tee, J. J. Antioxidant properties of several tropical
fruits: A comparative study. Food Chemistry 103. 1003–1008. 2007.
LIMA, E.S.; ABDALLA D.S.P. HPLC of fatty acids in biological samples.
Analytica Chimica Acta, 465, 2002.
LIMA, V. L. A. G.; MELO, E. A.; LIMA, D. E. S. Teor de compostos fenólicos
totais em chás brasileiros. Brazilian Journal of Food Technology, Campinas, v.
7, n. 2, p. 187-190, Oct. 2004.
LIMA, V. L. E. Os fármacos e a quiralidade: uma breve abordagem.
Química Nova. 20, 6. 1997.
LOPEZ, M.; MARTÝNEZ, F.; DEL VALLE, C.; ORTE, C.; MIRO, M. Analysis
of phenolic constituents of biological interest in red wines by high-performance
liquid chromatography. Journal of Chromatography A; v. 922, p. 359-363, 2001.
30
MATSUBARA, S. RODRIGUEZ-AMAYA, D, B. Conteúdo de miricetina,
quercetina e kaempferol em chás comercializados no brasil. Ciência e Tecnoogia
del Alimentos, Campinas, 26(2): 380-385, abr.-jun. 2006.
MATSUMOTO, K.; AKAO, Y.; KOBAYASHI, E.; OHGUCHI, K.; ITO, T.;
TANAKA, T.; IINUMA, M.; NOZAWA, Y.; Induction of apoptosis by xanthones from
mangosteen in human leukemia cell lines. Journal of Natural Products, 66,1124-
1127. 2003.
MAZZA, G.; GIRARD, B.; Functional grape and citrus products. In:
Functional Foods Biochemical and Processing Aspects. Lancaster: Technomic
Publishing Company, p. 139-159, 1998.
MEHMOOD, T. Optimization of the canola oil based vitamin E
nanoemulsions stabilized by food grade mixed surfactants using response surface
methodology. Food Chemistry. 183, 1–7, 2015.
MERKEN, H. M.; BEECHER, G. R. Measurement of food flavonoids by high-
performance liquid chromatography: A review, Journal of Agricultural and Food
Chemistry, v. 48, p. 577–599, 2000.
MERTZ, C., CHEYNIER, V., GÜNATA, Z., BRAT, P. Analysis of phenolic
compounds in two blackberry species (rubus glaucus and rubus adenotrichus) by
high-performance liquid chromatography with diode array detection and
electrospray ion trap mass spectrometry. Journal of Agricultural and Food
Chemistry. 55:8616–8624, 2007, .
MOLLER, P.; LOFT, S. Dietary antioxidants and beneficial effects on
oxidatively damaged DNA. Free Radical Biology & Medicine v. 41, p. 388-415,
2006.
MOLNÁR-PERL, I.; FÜZFAI, Z. Chromatographic, capillary electrophoretic
and capillary electrochromatographic tecchniques in the analysis of flavonoids.
Journal of Chromatography A, v. 1073, p. 201-227. 2005.
MONTEIRO, M.; FARAH, A.; PERRONE, D.; TRUGO, L. C.; DONANGELO,
C. Chlorogenic acid compounds from coffe are differentially absorbed metabolized
in humans. Nutrition. v.37, p. 2196-2201, 2007.
31
MOONGKARNDI, P.; KOSEM, N.; KASLUNGKA, S.; LUANRATANA, O.;
PONGPAN, N.; NEUNGTON, N.; Antiproliferation, antioxidation and induction of
apoptosis by Garcinia mangostana (mangosteen) on SKBR3 human breast cancer
cell line. Journal of Ethnopharmacology, 90,161-166. 2004.
MORALES, A. L.; ARGUELLO, W.; GARCIA, G.; HERRERA, I.
Componentes volátiles de mamey. Rev Col Química 22:9. 1993.
MORALES, A. L.; DUQUE, C.; Free and glycosidically bound volatiles in the
mammee apple (Mammea americana) fruit. European Food Research and
Technology, 215:221–226, 2002.
NASCIMENTO, W. M. O.; CARVALHO, J. E. U.; MÜLLER, C. H.
Propagação do Abricoteiro. Comunicado técnico. ISSN 1517-2201, 2008
NICHENAMETLA, S. N.; TARUSCIO, T. G.; BARNEY, D. L.; EXON, J. H. A
Review of the Effects and Mechanisms of Polyphenolics in Cancer. Critical
Reviews in Food Science and Nutrition, v. 46, p. 161-183, 2006.
NONGONIERMA, A.; CAYOT, P. LE QUEACUTEREACUTE, J. L.;
SPRINGETT, M.; VOILLEY, A. Mechanisms of Extraction of Aroma Compounds
from Foods, Using Adsorbents. Effect of Various Parameters Food Reviews
International, 22, 51-94 2006.
NUUTILA, A. M.; KAMMIOVIRTA, K.; OKSMAN-CALDENTEY, K. –M.
Comparison of methods for the hydrolysis of flavonoids and phenolic acids from
onion and spinach for HPLC analysis. Food Chemistry. v. 76, p. 4519-525, 2002.
OKONOGI, S.; DUANGRAT, C.; ANUCHPREEDA, S.;
TACHAKITTIRUNGROD, S.; CHOWWANAPOONPOHN, S. Comparison of
antioxidant capacities and cytotoxicities of certain fruit peels. Food Chemistry,
103, 839-846, 2007.
PAIXÃO, N.; PERESTRELO, R.; MARQUES, J. C.; CÂMARA, J. S.
Relationship between antioxidant capacity and total phenolic content of red, rosé
and white wines. Food Chemistry, v. 105, p. 204–214, 2007.
PEREZ-MAGARIÑO, S.; REVILLA, I.; GONZALEZ-SANJOSE, M.L.;
BELTRAN, S. Various applications of liquid chromatography–mass spectrometry to
32
the analysis of phenolic compounds. Journal of Chromatography A; 847, p. 75–
81, 1999.
PIETTA, P. G. Flavonoids as antioxidants. Journal of Natural Products, v.
63, p. 1035-1042, 2000.
PINHEIRO-SANT’ANA, H. M.; GUINAZIA, M.; OLIVEIRA, D. DA S.; LUCIA,
C. M. D. REISA, B. L.; BRANDÃO, S. C. C. Method for simultaneous analysis of
eight vitamin E isomers in various foods by high performance liquid
chromatography and fluorescence detection. Journal of Chromatography A. v
1218, 47, 25, 8496–8502, 2011.
PROVESI, J. G.; DIAS, C. O.; AMANTE, E. R. Changes in carotenoids
during processing and storage of pumpkin puree. Food Chemistry 128, 195–202.
2011.
PUAH, C.W., CHOO Y.M., MA, A.N., CHUAH, C.H.. Very Long Chain Fatty
Acid Methyl Esters in Transesterified Palm Oil. Lipids 41, 2006.
REID, W. J. Instrumental methods in detecting taint and off-flavours in
food. In: Taints and off-flavours in food. Brian Baingrie. Boca Raton: Boston: New
York: Washington, cap. 3, p. 1-33. 2003.
REINECCIUS, GARY. Flavor chemistry and technology. In. Flavor
formation in fruits and vegetables, 2nd ed, Boa Roton; London; New York:
Taylor & Francis group, cap. 4, p. 73-98. 2006.
ROSSO, V. V. De.; MERCADANTE. A. Z. Identification and Quantification of
Carotenoids, By HPLC-PDA-MS/MS, from Amazonian Fruits J. Agricultural Food.
Chemistry, 55, 5062-5072. . 2007
SAGRERO-NIEVES, L.; DE POOTER H. L.; VAN WASSENHOVE, F. A.
Major volatile constituints from the fruit of Mammea Apple (Mammea americana L.)
Journal of Food Composition and Analysis 2:382. 1989.
SCALBERT, A., MANACH, C., MORAND, C., RÉMÉSY, C. Dietary
polyphenols and the prevention of diseases. Critical Review in Food Science
and Nutrition, v. 45, p. 287-306, 2005.
SCHERER, R.; GODOY, H. T. Antioxidant activity index (AAI) by the 2,2-
diphenyl-1-picrylhydrazyl method. Food Chemistry, 112, p. 654-658, 2009.
33
SCHIEBER, A.; KELLER, P.; CARLE, R. Determination of phenolic acids
and flavonoids of apple and pear by high-performance liquid chromatography.
Journal of Chromatography A; 910, p. 265–273, 2001.
SHAN, B.; CAI, Y. Z.; SUN, M.; CORKE, H. Antioxidant Capacity of 26 Spice
Extracts and Characterization of Their Phenolic Constituents. Journal Agricultural
and Food Chemistry, 53 (20), p. 7749–7759. 2005.
SIANG, G. H.; MAKAHLEH, A.; SAAD, B.; LIM, L. P. Hollow fiber liquid-
phase microextraction coupled with gas chromatography-flame ionization detection
for the profiling of fatty acids in vegetable oils. Journal of Chromatography A,
1217 8073–8078. 2010.
SILVA, E. M. et al. Antioxidant activities and polyphenolic contents of fi fteen
selected plant species from the Amazonian region. Food. Chemistry v. 101, p.
1012-1018, 2007.
SIMIC, M. G. Mechanisms of inhibition of free-radical processed in
mutagensis and carcinogenesis. Mutation Research, v.202, p. 377–386, 1988.
SINGLETON, V. L.; ORTHOFER, R.; LAMUELA-RAVENTÓS, R. M. JR.
Analysis of total phenols and other oxidation substrates and antioxidants by means
of Folin-Ciocalteu reagent. Methods in Enzymology. 830, p. 152-178, 1999.
SMIDT, C. R.; BURKE, D. S. Nutritional significance and measurement of
carotenoids. Current Topics in Nutraceutical Research, 2:79-91, 2004.
SOARES, S. E. Ácidos fenólicos como antioxidants. Revista de Nutrição,
Campinas, v. 15, n. 1, p. 71-81, jan./abr., 2002.
SRINIVASAN, K. Role of spices beyond food flavoring: Nutraceuticals with
multiple health effects. Food Reviews International., 21, p. 167−188. 2005.
STALIKAS, C. D. Review Extraction, separation, and detection methods for
phenolic acids and flavonoids. Journal of separation science, v. 30, p. 3268 –
3295, 2007.
TACHAKITTIRUNGROD, S.; OKONOGI, S.; CHOWWANAPOONPOHN, S.;
Study on antioxidant activity of certain plants in Thailand: Mechanism of antioxidant
action of guava leaf extract. Food. Chemistry., 2006.
34
TURA, D.; ROBARDS, K. Sample handling strategies for the determination
of biophenols in food and plants. Journal of Chromatography A, v. 975, p. 71-93,
2002.
VALKON, M., LEIBFRITZ, D., MONCOL, J., CRONIN, M. T. D., MAZUR, M.,
TELSER, J. Free radicals and antioxidants in normal physiological functions and
human disease. The International Journal of Biochemistry and Cell Biology, v.
39, p. 44-84, 2007.
VASCO, C.; RUALES, J.; KAMAL-ELDIN, A. Total phenolic compounds and
antioxidant capacities of major fruits from Ecuador. Food. Chemistry. 111, 816-
823, 2008.
VENDRAMINI, A. L.; TRUGO, L. C. Chemical composition of acerola fruit
(Malpighia punicifolia L.) at three stages of maturity. Food Chemistry, 71, 195–
198. 2000.
VENKATACHALAM, M.; SATHE, S. K. Chemical Composition of Selected
Edible Nut Seeds. Journal of Agricultural and Food Chemistry, v. 54, p. 4705-
4714, 2006.
VISENTAINER, J. V.; FRANCO, M. R. B. Ácidos Graxos em Óleos e
Gorduras: Identificação e Quantificação. São Paulo: Varela, 2006.
YANG, J. Brazil nuts and associated health benefits: a review. LWT - Food
Sci. Technol., v. 42, p. 1573-1580, 2009.
ZHANG, Y.; SEERAM, N. P.; LEE R, FENG, L.; HEBER, D. Isolation and
identification of strawberry phenolics with antioxidant and human cancer cell
antiproliferative properties. Journal of Agricultural and Food Chemistry.13;56
(3):670-5. 2008.
ZHENG, W.; WANG, S. Y. Antioxidant activity and phenolic compounds in
selected herbs. . Journal of Agricultural and Food Chemistry, 49, 5165−5170.
2001.
ZHISHEN, J.; MENGCHENG, T.; JIANMING, W. The determination of
flavonoid contents in mulberry and their scavenging effects on superoxide radicals.
Food Chemistry. v 64, p. 555–559, 1999.
35
Cap II
Otimização da extração dos compostos fenólicos
assistida por ultrassom utilizando metodologia de
superfície de resposta e determinação da capacidade
antioxidante em abricó (Mammea americana)
Pollyane da Silva Port’s1, Helena Teixeira Godoy1
Artigo em preparação para ser publicado no periódico Food Reserch International
1 Departamento de Ciência de Alimentos, Faculdade de Engenharia de Alimentos, Universidade Estadual de Campinas (UNICAMP), CEP 6121, 13083-862, Campinas, SP, Brasil
37
RESUMO
O Brasil é um país com grande diversidade em espécies de frutas tropicais, no
entanto ainda pouco exploradas, mas com um enorme potencial agroindustrial.
Neste contexto a Mammea americana, conhecida popularmente como abricó,
torna-se interessante, por apresentar dados escassos quanto a sua capacidade
antioxidante bem como o seu conteúdo de fenólicos totais. Este estudo visou
avaliar a fruta M. americana, obtida de dois estados brasileiro (Belém/PA e
Manaus/AM) e de 2 acessos fornecidos pela EMBRAPA – Amazônia Oriental,
quanto a presença de substâncias antioxidantes. Foi realizada inicialmente uma
caracterização física dos frutos para obtenção de maiores dados relacionados a
esta fruta. Também foi realizado uma otimização , utilizando metodologia de
superfície de resposta, para avaliar a melhor condição de extração, onde as
variáveis estudadas foram % de solvente (metanol), tempo de extração e número
de extrações . A resposta para o planejamento foi o teor de compostos fenólicos
totais (CFT). A melhor condição encontrada para extração destes compostos foi
com porcentagem de metanol igual a 52%, com 5 extrações consecutivas, no
tempo de 10 minutos cada. Nestes extratos também foi avaliada a capacidade
antioxidante, através dos métodos in vitro do radical livre estável DPPH• (2,2-
difenil-1-picrilidrazila), pelo Método de Redução de Ferro (FRAP), e pelo método
de ORAC (Oxygen Radical Absorbance Capacity) que mede a capacidade
sequestradora de um antioxidante frente à formação de um radical peroxila. A
faixa dos resultados obtidos para a análise de CFT foi de 3,53 a 7,12 EAG µg.g-1,
para DPPH não se obteve resultados nas concentrações estudadas, para FRAP a
faixa dos resultados ficou entre 18,05 EAG e 39,05 µg.g-1 e ORAC de 19,74 e
164,92 μM equivalente em trolox/g, sendo que estes resultados variaram de
acordo com cada lote e com cada localidade de onde foram obtidos. Os resultados
demonstraram que o abricó apresentou uma significativa capacidade antioxidante
para o método de ORAC, entretanto apresentou baixo teor para fenólicos totais e
reduzida capacidade antioxidante quando foram utilizados os métodos DPPH e
FRAP.
Palavras-chave: Abricó, antioxidantes, compostos fenólicos.
38
ABSTRACT
Brazil is a country with great diversity in tropical fruit species, which are still largely
unexplored, but with enormous agroindustrial potential. In this context the
Mammea ammericana, popularly known as apricot is interesting, since it has
sparse data as its antioxidant capacity and its contents of total phenolics. This
study aimed to evaluate the presence of antioxidants in the American M. fruit,
obtained from two Brazilian states (Belém/PA and Manaus/AM) and 2 accesses
provided by EMBRAPA - Eastern Amazon. It was initially performed a physical
characterization of fruits to obtain more data related to this fruit. It was also
conducted an optimization, using the response surface methodology, to evaluate
the best extraction condition where the variables studied were% solvent
(methanol), extraction time and number of extractions. The answer to experimental
design was the content of phenolic compounds (CFT). The best condition found for
these compounds extraction was 5 consecutive extractions of 10 minutes each
with a solution of 52% methanol. In these extracts was also evaluated the
antioxidant capacity by in vitro methods of the stable free radical DPPH• (2,2-
diphenyl-1-picrilidrazila), the iron reduction method (FRAP), and the method ORAC
(Oxygen Radical Absorbance Capacity) which measures the ability of a scavenging
antioxidant opposite the formation of a peroxyl radical. The results range obtained
from CFT analysis was 3,53 to 7,12 mgGAE.mL-1 to DPPH was not obtained
results at the concentrations studied, to FRAP the range of results was between
18,05 and 39,05 EAG mg.g-1 and to ORAC 19,74 and 164,92 uM Trolox
equivalent/g, and those results varied with each batch and each location from
which they were obtained. The results demonstrated that the apricot has a
significant antioxidant ability to ORAC method, however has a low level of total
phenolics and a small antioxidant capacity when it was measured by DPPH and
FRAP.
Keywords: Apricot, antioxidants, phenolic compounds
39
1. INTRODUÇÃO
A América Tropical é considerada como centro de origem de muitas árvores
frutíferas, algumas das quais foram domesticadas ao longo do tempo pelos povos
nativos. A sua riqueza se dá também pela situação geográfica, pela
heterogeneidade e pela mistura de duas floras, a da América do Norte e a da
Amazônia, as quais vão até as áreas baixas da América Central (RUFINO et al.,
2010).
O abricó é uma fruta pertencente à família da garcinia (Clusiaceae) e é uma
fruta originalmente das Índias Ocidentais e do norte da América do Sul,
atualmente encontrada principalmente na Amazônia e em algumas outras poucas
regiões (CAVALCANTE, 1991).
É um fruto grande com 7-15 cm (3-6 polegadas) de diâmetro, coberto com
uma casca espessa e resistente, contém uma polpa amarela e brilhante de um
agradável sabor e aroma perfumado que é comido cru e também usado para
conservas. Suas sementes (1-4) em bruto são grandes amargas e resinosas e são
utilizadas como um agente vermífugo (MORALES & DUQUE, 2010).
Levando em consideração o fato do abricó (Mammea americana) se tratar
de uma fruta ainda silvestre, ou seja, a colheita ainda tem caráter extrativista,
dados relacionados à sua produção e comercialização ainda são escassos. No
atual cenário, a demanda é pequena e destinada apenas aos consumidores locais
(BRAGA et al., 2010).
ALVES, et al. (2008), definem as frutas oriundas das espécies consideradas
não-tradicionais como um conjunto de produtos agrícolas nativos ou exóticos de
uma determinada região, pouco conhecidas no mercado pelos consumidores. Nos
países desenvolvidos são conhecidas simplesmente por sua origem como
produtos exóticos, tropicais ou especialidades. A maior parte dos produtos
agrícolas não-tradicionais que são conhecidos, resultam de esforços, inovação e
criatividade na diversificação de produtos mais rentáveis, agregando valor as
matérias-primas locais.
No Brasil, diversas dessas espécies não-tradicionais vêm sendo utilizadas
pelas populações locais, pelo grande potencial para exploração no mercado de
40
consumo in natura e/ou industrializado. No entanto, necessitam serem
preservadas, cultivadas racionalmente e caracterizadas através do estudo de suas
propriedades, visando sua utilização no mercado de alimentos funcionais. Além
disso, existe uma demanda cada vez maior nos mercados interno e externo por
novos sabores, cores e texturas (LORENZI et al., 2006).
Contudo o consumo dessas frutas tropicais está aumentando no mercado
interno e mercados internacionais, devido ao crescente reconhecimento da sua
função nutricional e funcional, além do seu valor terapêutico (RUFINO et al.,
2010).
Assim as frutas desempenham papel de grande destaque, seja pelo simples
prazer de consumi-las; seja pelo benefício à saúde que nos proporcionam,
traduzida no aumento da expectativa de vida, vitalidade, prevenção de inúmeras
doenças, como também pela presença de nutrientes (vitaminas, minerais e fibras).
Tudo isso as tornam um alimento essencial, salutar e sem precedentes em nossas
vidas (LORENZI et al., 2006).
Por isso, dados relacionados tanto a suas funcionalidade como as suas
características físicas (como massa, comprimento, textura, diâmetro transversal e
coloração) também se fazem importante pois influenciam na aceitabilidade dos
frutos pelo consumidor bem como no seu rendimento industrial. Esses atributos
fazem-se importante para a qualidade dos frutos de maneira geral, já que estão na
dependência de suas características físicas e químicas e são peculiares a cada
espécie e cultivar, variando também com o clima, solo e época de maturação
(CHITARRA & CHITARRA, 1994; ALVARENGA & FORTES, 1985).
Em relação aos benefícios a saúde, dados científicos mostram que a
ingestão de frutas e outros vegetais estão associados a efeitos anti-
carcinogênicos. Alguns flavonoides têm demonstrado suprimir a carcinogênese em
vários modelos animais (YANG et al., 2001). A propriedade antioxidante dos
flavonoides foi o primeiro mecanismo de ação estudado, em especial no que diz
respeito ao seu efeito protetor contra as doenças cardiovasculares. Os mesmos
têm se mostrado eficientes captadores da maioria dos tipos de moléculas
oxidantes, incluindo o oxigênio singlete e vários radicais livres, envolvidos em
41
diversas doenças crônico-degenerativas. Dessa forma, o mecanismo de ação
antioxidante pode agir suprimindo a formação de espécies reativas de oxigênio,
seja por inibição de enzimas ou por quelação oligoelementos envolvidos na
produção de radicais livres, assim como no combate de espécies reativas e/ou
aumentando os mecanismos de defesas (MONTORO et al., 2005; BRACA et al.,
2003).
Geralmente, esses fitoquímicos presentes nas frutas são extraídos usando
diferentes técnicas de extração bem como diferentes tipos de solvente sob
diferentes condições de interações com as matrizes. Métodos como prensagem a
frio, aquecimento sob refluxo (soxhlet) e extração com solventes tem sido
amplamente utilizados para extrair compostos bioativos a partir de produtos
naturais (CONTINI et al., 2008; Du et al., 2007; MANDAL et al., 2007; WANG et
al., 2008). No entanto, as desvantagens, incluindo riscos de segurança, baixa
qualidade do produto, riscos ambientais e os efeitos toxicológicos foram sempre
encontradoa durante a extração (CONTINI et al., 2008; MANDAL et al., 2007).
Portanto, melhorar os métodos de extração é necessário. Recentemente, novos
métodos de extração, tais como, assistida por ultrassom, assistida por micro-
ondas, fluido supercrítico e a extração assistida por enzimas têm sido
desenvolvidos para a extração destes compostos (SPORRING et al., 2005;
VILKHU et al., 2008). Entre eles, a extração assistida por ultrassom é conhecida
como sendo um dos mais econômicos e eficientes meios de extração. Portanto, a
extração ultrassônica pode ser um potencial meio para extrair os compostos com
bioatividade tanto quanto outras técnicas de extração modernas (CHEN, 2015).
A determinação destes compostos fenólicos totais em tecidos vegetais é a
etapa inicial de qualquer investigação de funcionalidade, avaliação biológica e
estímulo ao consumo e sua quantificação em diferentes extratos normalmente é
feita empregando o reagente de Folin-Ciocalteau, que apesar de abundante na
literatura em alimentos, poucos são os trabalhos que descrevem adaptações do
procedimento para extração em matrizes específicas e/ou condições críticas de
preparo de amostra para a quantificação. Cabe ressaltar que o processo de
42
extração para distintas matrizes e analitos é fundamental para a estimativa mais
exata de compostos fenólicos para diferentes fins (SAIKIA, 2015; CHEN, 2015).
A otimização de metodologia de extração de um analito em especial é
fundamental, visto que pequenos detalhes podem resultar em efeitos que
comprometem a confiabilidade dos resultados. Para atingir esta meta com o
mínimo de experimentos, uma ferramenta matemática e estatística, que é a
metodologia de superfície de resposta (MSR), comumente usado para otimizar os
parâmetros do processo durante a extração de fitoquímicos das fontes vegetais
como as frutas, pode ser aplicada. A MSR geralmente aplicada é o delineamento
composto central rotacional, que vem sendo utilizada largamente nas indústrias
alimentares para desenvolvimento de novos produtos, bem como otimizar os
processos que têm dois ou mais fatores que influenciam nas respostas do produto
final, já que através dele pode-se avaliar o impacto de diferentes parâmetros,
avaliar as variáveis críticas, observando seus respectivos efeitos e possíveis
interações de fatores nas respostas desejadas e simultaneamente otimizar as
condições experimentais. Este meio de otimização também vêm sendo largamente
empregado na otimização de metodologias analíticas (SAIKIA, et al., 2015; PENA
et al., 2014; JORGE et al., 2013; ELLENDERSEN et al., 2012; LI et al., 2012; YIM
et al., 2012; CHEN, et al., 2015; SOUZA et al., 2009).
Sabendo que os compostos fenólicos são metabólitos secundários e estão
envolvidos em, praticamente, qualquer interação da planta com o ambiente
abiótico (irradiação solar, luz UV, períodos de seca, excesso ou escassez de
nutrientes, índices pluviométricos, estações do ano e poluição), o que pode
ocasionar alterações no metabolismo da planta, modificando a produção destes
compostos e adicionalmente, considerando o fato de que a região amazônica
apresenta grandes variações nos mais diferentes fatores abióticos, a presente
pesquisa teve como objetivo, determinar as condições ideais para a extração dos
compostos fenólicos, a partir da polpa liofilizada de abricó, utilizando uma
metodologia de superfície de resposta e determinar a capacidade antioxidante por
vários métodos in vitro, no extrato otimizado, o que proporcionará informações a
respeito dessa fruta ainda pouco estudada. Além disso, foi observado, se há
43
diferença na concentração destes compostos em função dos diferentes locais de
origem das frutas, já que para este estudo obteve-se amostras de dois Estados
brasileiros (Belém e Manaus),além de dois acessos fornecidos pela EMBRAPA no
intuito de investigar a influência da variação genética, sobre a composição da
mesma.
2. MATERIAL E MÉTODOS
2.1. Amostras
As frutas provenientes de acessos (Kamatá 1 e Kamatá 2), utilizadas neste
trabalho foram fornecidas pela Embrapa Amazônia Oriental, Belém/ Pará, in
natura em um único lote para cada um dos acessos, as demais foram obtidas no
comércio local de Belém/PA e em Manaus/AM, em três lotes, para cada um dos
anos, 2011-2012-2013 especificamente no mês de julho. Sendo que cada lote foi
formado por 3 a 4 frutos.
Os frutos dos acessos obtidos juntamente com os frutos dos lotes dos dois
Estados foram descascados, cortados, congelados e liofilizados. As amostras
após serem liofilizadas foram então moídas e acondicionadas em sacos metálicos
(ao abrigo de luz) e seladas a vácuo (livre de O2) e posteriormente guardadas em
freezer (-18 ºC) até o momento das análises.
2.2. Caracterização dos frutos de abricó
A massa dos frutos foi determinada utilizando uma balança eletrônica Marca
Bel M2202 (mark 2200) de precisão (0,01g). Os diâmetros longitudinal e
transversal foram medidos utilizando um paquímetro de 150 mm (MEB 6,
STARRETT). Tais medições foram realizadas em cada fruto, individualmente,
obtendo-se, posteriormente, o valor médio. Os teores de umidade foram
determinados de acordo com o método nº 7.003 da AOAC (1984). Os sólidos
solúveis foram determinados em refratômetro digital à temperatura ambiente,
sendo os valores expressos em graus Brix (ºBrix). O pH dos frutos de abricó foi
medido com um potenciômetro (Bel, modelo W3B), previamente calibrado.
44
2.3. Reagentes e solventes
O reagente Folin Ciocalteu foi fornecido pela Dinâmica (Brasil); o padrão
ácido gálico, o padrão Trolox (Ác. 6-idroxi-2,5,7,8-Tetrametilcromano-2-
Carboxílico), o AAPH (Dicloridrato de 2,2-Azobis (2-Metilpropionamidina), o TPTZ
2,4,6-Tri (2-pyridil)-5-triazine) e o radical DPPH (2,2-difenil-1-picrilidrazina, D-9132)
foram fornecidos pela Sigma (St Louis, MO, USA); o carbonato de sódio anidro, o
perssulfato de potássio, acetato de sódio, o fosfato de potássio bibásico, o fosfato
de potássio monobásico, a fluoresceína sódica e o solvente metanol (grau
analítico) foram fornecidos pela Synth (Brasil).
2.4. Extração assistida por ultrassom
Extração assistida por ultrassom foi realizada em um equipamento
ultrassônico (Microsonic SX-20, Arruda Ultra-sons LTDA, Brasil). As polpas
liofilizadas e moídas do abricó foram pesadas (0,5 g) e colocadas em tubos Falcon
(50 ml), as quais foram acrescidas inicialmente de 10 mL de uma solução
metanol/água em seguida foram levadas para o ultrassom, onde permaneceram
por tempo específico. A porcentagem de solvente e o tempo de extração bem
como o número de extrações foram determinados de acordo com cada ponto do
planejamento. Após cada etapa de sonicação os tubos foram levados à centrífuga
por um período de 5 minutos a 5000 g-1, este processo se deu por vezes
consecutivas de acordo com o número de vezes de re-extração especificadas no
planejamento que pode ser visualizado da Tabela 3. Por fim todos os extratos, de
cada ensaio, foram combinados e filtrados em papel filtro (Whatman) e
posteriormente armazenados em frascos de vidro âmbar com tampa selante, sob
refrigeração até o momento das análises.
2.5. Delineamento experimental para otimização da extração usando um
planejamento composto central (PCC) pela metodologia de superfície de
resposta (MSR)
Inicialmente foram realizados testes para determinar a melhor proporção
entre sólido-líquido, ou seja, volume de extrato suficiente para realização das
45
análises. Depois de fixada a melhor proporção entre sólido e líquido, a
porcentagem de solvente, o número de extrações e o tempo necessário de
extração foram otimizados através de um planejamento experimental, onde os
níveis estudados podem ser visualizados na Tabela 1. No intuito de se agilizar as
etapas seguintes à otimização, foi realizada apenas com a mistura dos primeiros
lotes, adquiridos em 2011, dos frutos obtidos de Manaus e Belém.
Tabela 1. Níveis e variáveis estudadas.
Variáveis Cód. Níveis
-1,68 -1 0 +1 +1,68
Solvente (%) X1 20 28,09 40 51,90 60
Extrações (nº) X2 1 2 3 4 5
Tempo (min) X3 10 14,05 20 25,95 30
Para obter a máxima extração dos compostos fenólicos totais (Y1) foi
realizado um Planejamento Composto Central em 5 níveis diferentes (-, -1, 0, +1,
+). Um fatorial completo 23 incluindo 6 ponto axiais (±a = (2k)1/4,onde k = número
número de variáveis independentes) e 3 repetições no ponto central (para avaliar
a repetibilidade da análise e determinar o erro puro do modelo), totalizando assim
17 ensaios independentes (BOX et al, 1978; RODRIGUES & IEMMA, 2012). Após
o desenvolvimento do planejamento um modelo de segunda ordem foi obtido (Eq.
1), para prever a extração máxima destes compostos, com as variáveis
estatisticamente significativas em seguida, este modelo foi utilizado para otimizar o
extração dos CFT para todos os lotes.
A equação quadrática para o referido sistema é:
(Eq. 1)
Onde у é a resposta prevista (para CFT em mg EAG / g), β0 é a média global, βJ é o
coeficiente linear, βij é o coeficiente de interação, βjj é o coeficiente quadrático, ε é o erro do modelo, Xi e XJ são os valores codificados das variáveis independentes.
46
2.6. Determinação dos Compostos Fenólicos Totais
A determinação dos compostos fenólicos totais dos extratos foi realizada
espectrofotometricamente, utilizando um espectrofotômetro da marca Pró-
análise/Modelo–UV-1600, de acordo com o método colorimétrico de Folin-
Ciocalteau, utilizando ácido gálico como padrão (SINGLETON et al., 1999). Em
ambiente escuro foram adicionados em tubos de ensaio 0,5 mL de extrato de
abricó obtidos a partir do planejamento. Em seguida, foram adicionados 2,5 mL da
solução de Folin-Ciocalteau 10% e após 5 minutos 2,0 mL e uma solução de
Na2CO3 7,5%. Os tubos foram agitados e incubados por 2 horas no escuro.
Depois deste tempo foi feita a leitura de absorbância em comprimento de onda
760 nm. Um branco foi conduzido sob as mesmas condições, substituindo o
extrato pela mesma quantidade de uma solução com a porcentagem de metanol
específica de cada ponto. Uma curva padrão com ácido gálico (concentração de
10 µg.mL-1) foi elaborada da mesma maneira como foi descrito para as amostras,
sendo os resultados obtidos expressos em mg equivalente de ácido gálico por
grama de amostra em base seca. Cada amostra foi analisada em triplicata.
2.7. Determinação da capacidade antioxidante in vitro.
O ponto otimizado da extração para análise de fenólicos totais foi utilizado
para as análises de capacidade antioxidante. Todas as análises foram realizadas
em triplicata. Não foram encontrados dados na literatura para nenhum dos ensaios
realizados, fato este que impossibilitou qualquer análise comparativa.
2.7.1. Capacidade antioxidante pelo radical livre DPPH•
A capacidade antioxidante foi determinada nos extratos metanólicos obtidos
através da redução do radical DPPH• (2,2-difenil-1-picril-hidrazila), de acordo com
metodologia descrita por Scherer & Godoy (2009) e Brand-williams et al., (1995).
Este é um método bastante utilizado e tecnicamente rápido que se baseia na
capacidade de antioxidantes sequestrarem radicais livres, no caso o radical 2,2-
difenil-1-picril-hidrazida (DPPH•), de cor púrpura e com banda de absorção
máxima em solução metanólica centrada em 517 nm. Este radical, após receber
47
um átomo de hidrogênio dos compostos antioxidantes é reduzido adquirindo
coloração amarela. Desta forma, é possível medir a descoloração do radical
espectrofotometricamente e estimar o poder antioxidante de uma amostra
(SCHERER & GODOY, 2009; MOLYNEUX, 2004; BRAND-WILLIAMS et al.,
1995).
Em tubos de ensaio foram adicionados 0,1 mL dos extratos em diferentes
concentrações que variaram para cada amostra e 3,9 mL de uma solução
metanólica de DPPH (31,6 μg.mL-1). Os tubos foram agitados e incubados por 90
minutos. Depois desse tempo foi realizada a leitura de aborbância à 517 nm.
Como composto de referência utilizou-se o ácido gálico que foi substituido pelo
extrato para realização da curva (concentração de 100 µg.mL-1). Para o cálculo da
capacidade antioxidante cada absorbância foi transformada em % Inibição através
da Equação 2:
% Inibição Extrato/Padrão = [(Ab0 - Absi.)/ Abs0] x 100 (Eq. 2)
Onde Abs0 é a absorbância do branco (0,1 mL de água substituindo a amostra) e Absi é a
absorbância da solução reativa contendo a amostra.
Depois de se obter para cada amostra a curva de I DPPH % (que foi
construída a partir de dez concentrações distintas) versus a concentração de
amostra dentro do tubo com DPPH•, utilizou-se a equação do modelo gerado para
encontrar o IC50 (mg.mL-1), ou seja, a concentração necessária de amostra para
neutralizar 50% dos radicais livres de DPPH• presentes no meio reativo. Com esse
valor calculou-se o IAA (índice de atividade antioxidante), que é o parâmetro
utilizado para classificar uma amostra em relação ao seu potencial antioxidante. O
cálculo pode ser visualizado na Equação 3 (SCHERER & GODOY, 2009).
IAA = Concentração de DPPH• (µg.mL-1) (Eq. 3)
IC50 (µg.mL-1)
48
2.7.2. Ferric Reducing Antioxidant Power - FRAP
Este método baseia-se na habilidade dos antioxidantes presentes na
amostra reduzirem, em pH baixo, o complexo Fe3+ /tripiridiltriazina (TPTZ), para
Fe2+, de intensa cor azul e absorção máxima a 593 nm. O ensaio foi realizado
conforme método proposto por Benzie e Strain (1996), com pequenas modificações. Em
tubos de ensaio foram adicionados 90 μL do extrato. Em seguida, foram adicionados 270
μL de H2O destilada e 2700 μL do reagente FRAP. Os tubos foram agitados e logo depois
deixados a 37 °C por 15 minutos. Passado esse tempo os tubos foram retirados e
deixados a temperatura ambiente e após 5 minutos a leitura de absorbância foi feita a 593
nm no escuro. Uma curva padrão com ácido gálico foi elaborada, a partir da concentração
de 63 µg.mL-1, da mesma maneira como foi descrito para as amostras, sendo os
resultados obtidos expressos em mg equivalente de ácido gálico por grama de amostra
em base seca (mg EAG/g).
2.7.3. Oxygen Radical Absorbance Capacity – ORAC
Os ensaios foram realizados conforme o método descrito por Dávalos et al.
(2004) com algumas modificações. Este método verifica a capacidade
sequestradora de um antioxidante frente à formação de um radical peroxila que é
formado após o 2,2‟-azobis (2-amidinopropano) dihidrocloreto (AAPH) sofrer
decomposição térmica a 37 ºC. Os radicais peroxila formados degradam a
estrutura química da fluoresceína sódica, levando a perda da conformação inicial
com o consequente decréscimo da emissão de fluorescência (OU et al., 2001).
Todos os reagentes foram preparados em tampão fosfato 75 mM, pH 7,4.
Neste ensaio 20 µL de amostra foram misturados a 120 µL de uma solução de
fluoresceína (Sigma Chemical Co.,St Louiz, EUA) a 70 nM e incubados a uma
temperatura constante de 37 ºC por 15 minutos, em seguida foi adicionado 60 µL
da solução de AAPH - 2,2´-azobis (2-methylpropionamidine dihydrochloride), a 24
mM, que dá início à reação.
O experimento foi realizado no leitor de fluorescência (FLUOstar Omega,
BMG Labtechnologies) em microplacas de 96 poços de cor preta. A leitura foi
realizada a cada 1 minuto, durante 80 minutos, com emissão a 520 nm e excitação
à 485 nm e temperatura controlada à 37°C.
49
O cálculo da perda de fluoresceína foi efetuado com o auxílio da seguinte
fórmula.
AUC = 1 + f2/f1 + f3/f1 + f4/f1 +…+ fn/f1 (Eq. 4)
Onde: AUC = Área sob a curva, f1 = leitura da fluorescência no tempo 1 minuto, f2 = leitura da
fluorescência no tempo 2 minutos e fn = leitura da fluorescência no tempo de 80 minutos.
O AUC foi calculado para todas as amostras, diferentes concentrações do
Trolox, composto usado como referência (concentração de 100 µM), e para o
branco. O AUC do branco foi subtraído do AUC de todas as amostras em
diferentes concentrações de Trolox (PRIOR & CAO, 1999; CAO & PRIOR, 1998).
2.8. Análise Estatística
O tratamento estatístico dos dados foi realizado através da Análise de
Variância (ANOVA), e as médias foram comparadas pelo teste de Tukey ao nível
de 95% de confiança. O Software Statistica 7.0 (Statsoft Inc., Tulsa, OK, EUA)
também foi utilizado para analisar os dados e gerar as superfícies de resposta. O
valor de ajuste da equação do modelo estatístico foi expresso pelo coeficiente de
determinação (R2) e a sua significância estatística foi determinada por um teste F
(análise de variância)
3. RESULTADOS E DISCUSSÃO
3.1. Características físico-química inicial dos Frutos de Abricó
De acordo com a Tabela 2, pode-se observar os valores para a
caracterização inicial obtidas para a fruta de abricó.
50
Tabela 2. Caracterização dos frutos de abricó.
Lotes Diâmetro (mm)
Peso (g) Rendimento (g) Brixº pH Umidade (%) Transv. Long.
BELÉM (médias de cada lote)
1º lote (2011) 94,50 ± 2,38b 96,50 ± 4,20a 544,09 ± 42,87a 464,92 ± 118,12a 14,40 ± 0,06a 3,15 ± 0,13a 85,96 ± 1,27a
2º lote (2012) 96,5 ± 5,45ab 96,01 ± 4,90a 569,94 ± 23,41a 528,48 ± 15,51a 13,10 ± 0,10b 3,33 ± 0,15a 87,28 ± 1,05a
3º lote (2012) 108,50 ± 9,15a 105,75 ± 6,70a 597,31 ± 110,50a 470,92 ± 10,12a 14,40 ± 0,04a 3,22 ± 0,17a 86,87 ± 1,10a
MÉDIA 99,83 ± 7,57A 99,42 ± 5,49A 570,45 ± 26,61A 486,11 ± 36,70A 13,97 ± 0,75A 3,23 ± 0,09A 86,70 ± 0,68A
MANAUS (médias de cada lote)
1º lote (2011) 85,02 ± 6,58a 89,75 ± 5,56a 456,65 ± 22,91ab 403,82 ± 15,04a 14,40 ± 0,08b 3,18 ± 0,26b 85,24 ± 1,57a
2º lote (2012) 84,25 ± 6,75a 84,5 ± 7,14ab 467,33 ± 37,94a 406,62 ± 29,87a 12,57 ± 0,52c 3,60 ± 0,08a 84,13 ± 1,28a
3º lote (2012) 78,25 ± 6,13a 75,5 ± 3,87b 398,29 ± 27,88b 335,40 ± 37,06b 16,62 ± 0,15a 3,51 ± 0,21ab 87,17 ± 1,34a
MÉDIA 82,51 ± 3,71B 83,25 ± 7,21A 440,76 ± 37,16B 381,95 ± 40,33B 14,53 ± 2,03A 3,43 ± 0,22A 85,51 ± 1,54A
EMBRAPA (médias de cada lote)
Lote 1* (K1) (2012) 75,75 ± 14,93a 76,75 ± 11,41a 365,71 ± 17,20a 351,48 ± 72,60a 15,00 ± 0,72a 3,62± 0,14a 85,90 ± 1,11a
Lote 1* (K2) (2012) 85,00 ± 6,58a 89,75 ± 5,56a 456,65 ± 22,91a 403,82 ± 15,04a 13,86 ± 1,05a 3,45 ± 0,13a 86,14 ± 0,59a
MÉDIA 80,38 ± 6,54B 83,25 ± 9,19A 411,18 ± 64,30B 377,65 ± 37,01B 14,43 ± 0,81A 3,54 ± 0,12A 86,02 ± 0,17A
MÉDIA GERAL 88,47 ± 10,76 89,31 ± 10,27 482,00 ± 81,87 419,93 ± 63,65 14,29 ± 1,23 3,38 ± 0,19 86,09 ± 1,06
*Valores representam a média de triplicata e/ou quadruplicata ± o desvio padrão, seguidas de letras diferentes, minúsculas nas colunas e maiúsculas nas colunas em relação às MÉDIAS obtidas de cada localidade, diferem estatisticamente entre si pelo teste de Tukey a 5% de probabilidade.
51
Nota-se que os valores referentes ao Brixº, não se diferenciaram
estatísticamente (p<0,05), os frutos apresentaram valores em torno de 14 ºBrix,
independente da localidade e época de colheita, o que mostra que os frutos
encontravam-se maduros, já que os frutos são coletados ao caírem quando
atingem o ápice da maturação. Para os valores de umidade os mesmos
mostraram-se também homogêneos para os diferentes lotes dos diferentes
lugares de obtenção do fruto.
Os dados de caracterização dos frutos encontrados neste trabalho estão de
acordo com os fornecidos por Braga et al. (2010), que encontraram para polpa do
abricó, resultados semelhantes de pH (3,47), ºBrix (12,20) e umidade (85%) aos
obtidos neste trabalho. Aguiar et al. (1980), também encontrou teor de umidade no
abricó de 85%.
Alguns resultados se diferenciaram estatisticamente como, por exemplo, os
obtidos para o 3º lote proveniente de Manaus que foram os menores, para
diâmetro longitudinal, peso e rendimento, quando comparados aos demais obtidos
da mesma localidade nos outros anos. Essas diferenças ocorrem devido às frutas
terem sido coletadas em anos diferentes e, além disso, sofrerem ação de fatores
abióticos naturais como a radiação solar, raios UV, períodos de seca ou chuva,
nutrientes e estações do ano o que pode influenciar em diversas características
das frutas (DEGÁSPARI & WASZCZYNSKYJ, 2004).
3.2. Otimização da extração, assistida por ultrassom para análise de
fenólicos totais
Para otimização da extração dos compostos fenólicos presentes na polpa de
abricó, foi realizado um planejamento experimental com três variáveis (23),
totalizando 17 ensaios, onde se avaliou a porcentagem de solvente em solução
aquosa (% de metanol), o número de extrações e o tempo (em minutos) no
ultrassom. Os ensaios foram realizados em triplicata e em ordem aleatória e a
resposta considerada foi o teor total de fenólicos (Folin-Ciocalteau). A tabela com
as variáveis estudadas bem como os valores de cada nível estão descritas na
52
Tabela 1 (material e métodos). Testes univariados realizados anteriormente
mostraram serem essas as melhores faixas a serem estudadas.
A partir dos níveis estudados obteve-se a matriz (Tabela 3), e os resultados
obtidos foram dados em mg por grama de equivalente em ácido gálico (mg EAG/g)
de amostra liofilizada.
Tabela 3. Matriz do planejamento fatorial 23 com pontos axiais e pontos centrais.
Ensaios Valores codificados Valores reais Resposta*
CFT mg EAG/g**
X1 X2 X3 Sol. (%) Ext. (n°) Tempo
1 -1 -1 -1 28 2 14 1,78 ± 0,03
2 +1 -1 -1 52 2 14 3,06 ± 0,04
3 -1 +1 -1 28 4 14 2,07 ± 0,08
4 +1 +1 -1 52 4 14 3,41 ± 0,05
5 -1 -1 +1 28 2 26 1,70 ± 0,03
6 +1 -1 +1 52 2 26 2,94 ± 0,03
7 -1 +1 +1 28 4 26 2,05 ± 0,05
8 +1 +1 +1 52 4 26 3,43 ± 0,08
9 -1,68 0 0 20 3 20 2,12 ± 0,05
10 +1,68 0 0 60 3 20 3,11 ± 0,07
11 0 -1,68 0 40 1 20 2,18 ± 0,02
12 0 +1,68 0 40 5 20 3,72 ± 0,15
13 0 0 -1,68 40 3 10 3,18 ± 0,05
14 0 0 +1,68 40 3 30 3,27 ± 0,03
15 0 0 0 40 3 20 3,15 ± 0,05
16 0 0 0 40 3 20 3,16 ± 0,04
17 0 0 0 40 3 20 3,33 ± 0,03
*Média de triplicata/ **CFT = fenólicos totais/ EAG = Equivalente em ácido gálico
Os valores de CFT variaram entre 1,7 a 3,7 mg EAG/g, de acordo com a
faixa avaliada (Tabela 3). Dentre os ensaios realizados, o ensaio 12 (com
concentração de metanol de 40% v/v, com 5 extrações no tempo de 20 minutos)
53
foi o que proporcionou a maior extração de fenólicos (3,72 mgEAG/g). A
concentração de metanol (%) e o número de extrações realizadas foram as
variáveis mais relevantes para a extração. Uma maior extração dos compostos
fenólicos foi conseguida quando ocorreu uma combinação entre um maior número
de vezes de re-extrações e o aumento da porcentagem de metanol utilizado.
A partir dos resultados obtidos (FT), foi realizada uma análise de regressão
(Tabela 4) nos dados experimentais e os coeficientes do modelo foram avaliados
em relação às suas significâncias. Assim, ao obter-se os coeficientes de
regressão as variáveis estatisticamente não significativas foram retiradas para
obtenção do modelo reparametrizado. Nota-se que os resultados obtidos para
regressão mostram um modelo de 2º ordem para as variáveis codificadas. O nível
de significância utilizado para avaliar os efeitos foi ajustado para 5%.
Tabela 4 Coeficientes de regressão para o modelo matemático, já
reparametrizados.
Fatores Coeficiente de
regressão t (13) p*
Média 2,990301 0,110930 0,000000
% Solvente (L) 0,505804 0,091190 0,000094
% Solvente (Q) -0,233161 0,093361 0,026719
N° de extrações (L) 0,297817 0,091190 0,006137
*p = nível de significância a 5%
Os resultados da ANOVA encontram-se apresentados na Tabela 5. No
presente estudo, o valor de R2 foi de 0,83, o que segundo Joglekar & Maio (1987)
implica na adequação do modelo aplicado. A falta de ajuste foi considerada não
significativa (p ≥ 0,05). Portanto, o comportamento verificado permitiu construir
modelo preditivo para extração dos compostos fenólicos, e também pode ser
utilizado para a otimização da extração dos compostos fenólicos presentes no
abricó.
54
Tabela 5. Valores da ANOVA
Soma
Quadrátic
a
Graus de
liberdade
Média
quadrática
F
calculado P
(1)Solvente(L) 3,493934 1 3,493934 339,5894 0,002932
Solvente(Q) 0,708304 1 0,708304 68,8428 0,014217
(2)nº extrações(L) 1,211292 1 1,211292 117,7303 0,008387
Falta de ajuste 1,455754 11 0,132341 12,8628 0,074295
Erro puro 0,020577 2 0,010289
Total 6,889862 16
*p = nível de significância a 5%
A partir dos resultados obtidos foi possível gerar a curva de contorno e a
superfície de resposta para o rendimento de compostos fenólicos totais (Figura 1
e 2).
Figura 1. Curva de contorno mostrando os efeitos dos parâmetros, número de extrações e porcentagem de metanol, em relação ao conteúdo do teor de fenólicos totais.
55
Figura 2. Superfície de resposta mostrando os efeitos dos parâmetro,s número de extrações e porcentagem de metanol, em relação ao conteúdo do teor de fenólicos totais
Ao analisar as 2 figuras pode-se observar que o conteúdo de FT extraídos do
abricó aumentou com o aumento da porcentagem de metanol, até 52%. O número
de extrações apresentou um efeito positivo em relação à extração dos FT. Como a
variável tempo não foi estatisticamente significativa (p ≤ 0,05), optou-se pelo
menor tempo (10 minutos)
A confirmação experimental do modelo foi realizada sob as condições ótimas
de 52% de metanol, com 5 extrações consecutivas, no tempo de 10 minutos cada,
resultando em uma concentração de fenólico totais de 3,7 mgEAG/g-1.
As condições ótimas obtidas através do planejamento experimental foram
aplicadas para a extração de todas as amostras de abricó. Os resultados dos
compostos fenólicos totais podem ser visualizados na Tabela 6
56
Tabela 6. Análise de fenólicos totais das amostras de abricó para diferentes lotes.
Amostras
CFT (mg EAG/g)**
1° lote (2011) 2° lote (2012) 3º lote (2013)
Abricó Belém 3,53 ± 0,07cB 4,45 ± 0,05bB 7,12 ± 0,06aA
6,03 ± 0,30aB
-
-
Abricó Manaus 4,05 ± 0,36aA 5,82 ± 0,35aA
Kamatá 1* 5,60 ± 0,23A -
Kamatá 2* 5,17 ± 0,12B -
*Lote único, adquirido em 2012 **Resultados expressos em base seca/ Valores representam a média de triplicata ± o desvio padrão, seguidas de letras diferentes, minúsculas nas linhas e maiúsculas nas colunas, diferem estatisticamente entre si pelo teste de Tukey a 5% de probabilidade.
Através dos resultados obtidos para os 1ºs lotes (Belém e Manaus), pode-se
observar que os dados encontram-se dentro dos valores preditos pelo modelo
para otimização da extração. Ao realizar-se a comparação, através do teste de
Tukey, entre as médias, observou-se que houve diferença estatística entre os
lotes obtidos de Belém, o que não aconteceu para os lotes provenientes de
Manaus.
Poucos são os dados na literatura para análise de FT em abricó. Braga et al.
(2010) foi de 0,25 mg EAG/g de amostra fresca, valor este inferior ao encontrado
no presente estudo que foi de 1,32 mg EAG/g de amostra fresca, quando
colocados na mesma base, tal valor pode ser explicado devido os autores terem
utilizado condições de extração fixa, onde foi utilizado uma mistura de diferentes
solventes (acetona:água:ácido acético - 70:29,5:0,5; v:v), enquanto que neste
trabalho foi realizado um planejamento, onde uma ferramenta estatística foi
utilizada para encontrar as melhores condições para extração dos compostos
fenólicos presentes na polpa do abricó.
Naczk & Shahidi, (2006) ressaltam a importância em se realizar estudos da
melhor condição de extração de fenólicos em frutas, já que este depende de
vários fatores como a polaridade do solvente utilizado, a solubilidade dos fenólicos
presentes, a interação destes fenólicos com outros compostos presentes na matriz
que podem ser solúveis ou insolúveis em um determinado solvente. Portanto, é
57
muito difícil desenvolver um método de extração padrão que seria adequado para
todos os compostos fenólicos em matrizes alimentares. Por isso, o conteúdo de
fenólico de uma amostra pode variar com a utilização de diferentes condições de
solvente e de extração (SAIKIA, 2015).
Rufino e colaboradores (2010) juntamente com Chirinos et al. (2010) e
Pompeu et al. (2009) encontraram para frutas tropicais não-tradicionais como o
açaí, camu-camu, murici, acerola, caju, bacuri, muruci e o ingá valores de 32,68
mg EAG/g; 0,12 mg EAG/g; 23,80 mg EAG/ g; 0,10 mg EAG/g; 8,30 mg EAG/g;
13,65 mg EAG/g; 2,90 mg EAG/g e 2,40 mg EAG/g de amostra seca
respectivamente. Estes valores são superiores aos encontrados no presente
estudo, para a polpa de abricó liofilizada, com exceção do camu-camu, acerola,
murucí e ingá que foram inferiores.
Pode-se observar através dos dados obtidos que a extração assistida por
ultrassom foi eficaz para a extração dos compostos fenólicos (GHAFOOR et al.,
2009). De acordo com a literatura (CHEN, 2015; VILKHU et al., 2008;TOMA et al.,
2001), a explicação para a eficiência da extração assistida por ultrassom é que a
sonicação pode facilitar a transferência de massa dos componentes solúveis para
o solvente de extração. Assim, pode-se afirmar que a extração por ultrassom pode
proporcionar resultados interessantes.
3.3. Capacidade antioxidante dos extratos de abricó.
3.3.1. Sequestro do radical DPPH•
Para partir de um parâmetro de comparação a capacidade antioxidante, o
padrão de ácido gálico foi testado pelo método de sequestro do radical DPPH•. O
valor IC 50 encontrado foi 1,09 μg/mL e o índice de capacidade antioxidante foi 27,
semelhante ao relatado na literatura por Scherer & Godoy (2009). Entretanto, para
as amostras estudadas nenhuma apresentou atividade perante a este radical
mesmo quando mais concentrados, o que impossibilitou a realização desta
análise. Resultado este que pode ser explicado pela quantidade reduzida de
compostos fenólicos presente na amostra como pode ser visto na Tabela 6,
compostos estes capazes de diminuir a ação do radical DPPH•.
58
3.3.2. Ferric Reducing Antioxidant Power - FRAP
Os resultados obtidos nesta análise são apresentados na Tabela 7. Assim
como para a análise de FT, os valores encontrados são estimativas do poder
antioxidante de redução do ferro em equivalente de ácido gálico. Não foram
encontrados dados na literatura sobre capacidade antioxidante em abricó
utilizando essa metodologia
Tabela 7. Capacidade redutora do complexo Fe3+ -TPTZ à Fe2+ -TPTZ para as
diferentes amostras.
Amostras
FRAP (EAG µg.g-1)**
1° lote (2011) 2° lote (2012) 3º lote (2013)
Belém 18,05 ± 1,47cB 27,52 ± 2,00bA 39,05 ± 1,40aB
Manaus 32,92 ± 2,03aA 28,42±1,96bA 34,63 ± 0,83aA
Kamatá 1* - 24,03 ± 1,39B -
Kamatá 2* - 29,00 ± 2,21A -
*Lote único, adquirido em 2012 **Resultados expressos em base seca/ Valores representam a média de triplicata ± o desvio padrão, seguidas de letras diferentes, minúsculas nas linhas e maiúsculas nas colunas, diferem estatisticamente entre si pelo teste de Tukey a 5% de probabilidade.
Observa-se que houve uma variação entre os resultados, sendo que o 3º
lote, proveniente de Belém, foi o que obteve o maior resposta para este método,
valor este de 39,05 EAG µg.G-1. Os lotes provenientes de cada Estado bem como
os do mesmo Estado foram submetidos ao teste de tukey ao nível de 95% de
confiança e este mostrou que entre os lotes de Belém todos os lotes
diferenciaram-se estatisticamente. Para os lotes provenientes de Belém e Manaus,
o 1º e o 3º se diferenciaram estatisticamente, resultado já esperado, já que as
frutas foram obtidas de locais diferentes e em anos diferentes, além disso, efeitos
edafoclimáticos também podem influenciar nos compostos responsáveis pela ação
antioxidante presentes nas frutas.
59
3.3.3. . Oxygen Radical Absorbance Capacity – ORAC
Neste ensaio a presença de antioxidantes nas amostras resulta na inibição
dos danos causados pelos radicais livres ao composto fluorescente. Os resultados
obtidos nesta análise estão apresentados na Tabela 8.
Tabela 8. Capacidade antioxidante pelo método ORAC para as diferentes
amostras.
Amostras
ORAC (μM equivalente em trolox/g)**
1° lote (2011) 2° lote (2012) 3º lote (2013)
Belém. 19,74 ± 0,93cB 65,16 ± 2,57bB 138,03 ± 8,19aB
164,92 ± 5,94aA
-
-
Manaus 152,11 ± 5,51abA 142,14 ± 4,90bA
Kamatá 1* - 139,58 ±10,59A
Kamatá 2* - 23,27 ± 1,73C
*Lote único, obtido em 2012 **Resultados expressos em base seca/ Valores representam a média de triplicata ± o desvio padrão, seguidas de letras diferentes, minúsculas nas linhas e maiúsculas nas colunas, diferem estatisticamente entre si pelo teste de Tukey a 5% de probabilidade.
Observa-se através dos resultados apresentados na Tabela 8 que houve
diferenças significativas para as amostras e mesmo entre os lotes, provavelmente
devido à diferentes épocas e localidades de colheita que influenciam na
constituição química das frutas.
Braga et al. (2010), encontraram para frutos de abricó (30,97 µMol ET/g)
valor este inferior aos encontrados na presente pesquisa, com exceção do 1º lote
de Belém, valores estes que podem estar relacionados ao equivalente químico
utilizado pelos autores, já que estes utilizaram como padrão de referência o trolox
(ET), o que impossibilita a comparação. Além disso, os autores utilizaram
diferentes tipos de solventes para extração (solução de acetona:água:ácido
acético -70:29,5:0,5; v/v).
Para análise de ORAC os resultados foram bem superiores quando
comparados às demais, o que mostra uma possível ação antioxidante por parte de
algum outro composto, que não os fenólicos, que podem ter sido extraídos
60
juntamente com os fenólicos. Um provável composto para tal ação seria a
presença de carotenoides na amostra, que são conhecidos devido as suas
propriedades antioxidantes e estão associadas à capacidade de capturar radicais
(El-Agamey, 2004). Estes resultados também mostram a importância do uso de
diferentes tipos de metodologias para análise da capacidade antioxidante, já que
cada uma deles possui diferentes mecanismos de reação o que
consequentemente acaba dificultando a comparação entre elas.
Foi aplicado um teste de correlação para determinar se havia alguma
correlação entre os compostos fenólicos e as análises de capacidade antioxidante.
Através deste teste, observou-se haver uma correlação significativa entre os CFT
e a análise de FRAP (r = 0,83). Contudo, quando a correlação foi feita entre os
CFT e a metodologia de ORAC uma baixa correlação foi observada (r = 0,61),
corroborando com ideia de que além dos fenólicos presentes outros compostos
podem estar atuando como antioxidantes.
Um gráfico ilustrativo (figura 3) com as médias das respostas obtidas para
todos os lotes de cada Estado mais os acessos, obtidos da Embrapa, foi
construído no intuito de se observar visualmente os resultados obtidos para cada
análise realizada. Cheung et al. (2003) relatam que a capacidade antioxidante de
materiais vegetais normalmente é bem correlacionada com seus compostos
fenólicos, entretanto no caso do presente estudo tal fato não foi observado. Por
isso, é sempre importante considerar o efeito do conteúdo total de fenólicos na
capacidade antioxidante dos extratos.
61
Figura 3. Gráfico ilustrativo comparativo das análises realizadas na polpa liofilizada de
abricó.
Pode-se visualizar que para todas as amostras obtidas dos diferentes
Estados e os acessos obtiveram valores baixos de CFT. Para a análise de FRAP
todas as amostras obtiveram resultados semelhantes como podem ser destacado
na Fig. 3, já para a análise de DPPH, como foi relatado anteriormente os extratos
da polpa liofilizada de abricó não obteve resposta nas concentrações estudadas, e
para as análises de ORAC as amostras obtiveram resultados bastante
significativos quando comparado as outras análises com destaque principalmente
para as amostras obtidas de Manaus e o acesso Kamata 1. Resultados estes que
mostram que possivelmente a atividade exercida neste método não provém
apenas dos fenólicos existentes na polpa, já que para esta análise os resultados
foram relativamente baixos, mas sim de outros compostos presentes na polpa,
possivelmente os carotenoides. É extremamente difícil comparar ensaios
diferentes que medem a capacidade antioxidante de uma amostra, uma vez que
eles diferem entre si em termos de substrato, condições de reação e método de
quantificação (HUANG et al., 2005). Além disso, um levantamento na literatura
revelou que não há muitos estudos sobre o potencial antioxidante do abricó, o que
dificultou a comparação com outros trabalhos.
0,00
20,00
40,00
60,00
80,00
100,00
120,00
140,00
160,00
180,00
Belém Manaus Kamata 1 Kamata 2
Fenólicos totais e capacidade antioxidante
CFT
FRAP
ORAC
62
4. CONCLUSÃO
Obteve-se através do planejamento realizado para otimizar a etapa de
extração um resultado satisfatório, já que permitiu construir o modelo preditivo
dentro da faixa ótima para a extração de compostos fenólicos a partir da
combinação das variáveis (número de extração, tempo de extração e a
porcentagem de solvente utilizado). As condições otimizadas deu-se com 5
extrações e a porcentagem de solvente igual a 52%, porém a variável tempo não
foi estatisticamente significativa, (p ≤ 0,05), sendo assim utilizou-se o menor tempo
dentro da faixa no planejamento que foi de 10 minutos. Os resultados mostraram
que a polpa de abricó não possui grandes quantidades de fenólicos quando
comparadas a outras frutas tropicais, entretanto para uma das análises realizadas
para avaliação do potencial antioxidante (ORAC), o mesmo obteve resultados
bastante promissores quando comparado aos demais métodos. Os resultados
obtidos na presente pesquisa podem incentivar maiores investigações, no intuito,
de caracterizar os compostos antioxidantes presentes na polpa de abricó, fruta
comumente consumida na região norte, bem como os seus modos de ação.
63
REFERÊNCIAS
AGRUIAR, J. P. L.; MARINHO, H. A.; REBÊLO, Y. S; SHRIMPTON, R.
Aspectos nutritivos de alguns frutos da Amazônia. Acta Amazonica. 10 (4), 755-
758, 1980.
ALVARENGA, L. R.; FORTES, J. M. Cultivares de frutíferas de clima
temperado, Informe agropecuário, Belo horizonte, v. 11, n. 124. 1985.
AOAC, ASSOCIATION OF OFFICIAL ANALYTICAL CHEMISTS. Official
methods of analysis. 14. ed. Arlington, VA, USA, 1984.
BENZIE, I. F. F. & STRAIN, J. J. The Ferric Reducing Ability of Plasma
(FRAP) as a Measure of “Antioxidant Power”: The FRAP Assay. Analytical
Biochemistry, v. 239, n. 292, p. 70-76, 1996.
BOCHI, V. C.; GODOY, H. T.; GIUSTI, M. M. Anthocyanin and other
phenolic compounds in Ceylon gooseberry (Dovyalis hebecarpa) fruits. Food
Chemistry. 176, 234–243. 2015.
BOX, G. E. P., HUNTER, W. G., & HUNTER, J. S. (1978). Statistics for
experimenters: An introduction to design, data analysis, and model building. New
York: Wiley.
BRACA, A.; BILIA, A. R.; MENDEZ,J.; PIZZA, C.; MORELLI. I.; DE
TOMMASI, N. Chemical and biological studies on Licania genus. In: A.U. Rahman,
Editor, Studies in natural products chemistry, v. 28, Elsevier, Amsterdam, p.
35–67, 2003.
BRAGA, A. C. C.; SILVA, A. E.; PELAIS, A. C. A.; BICHARA, C. M. G.
POMPEU, D. R. Atividade antioxidante e quantificação de compostos bioativos
dos frutos de abricó (Mammea americana). Alimentos e Nutrição, Araraquara
v.21, n.1, p. 31-36, jan./mar. 2010
BRAND-WILLIAMS, W., CUVELIER, M. E., BERSET, C. Use of a free
radical method to evaluate antioxidant activity. LWT – Food Science and
Technology, 28(1), 25–30, 1995.
CAO, G.; PRIOR, R. L. Comparison of different analytical methods for
assessing total antioxidant capacity of human serum. Clinical Chemistry.
44:1309–1315. 1998.
64
CAVALCANTE, P. B. Frutas comestíveis na Amazônia. Belém: Museu
Emílio Goeldi. 7 Ed. Revista atual. 2006.
CHEN, M.; YI ZHAO, SHUJUAN YU. Optimisation of ultrasonic-assisted
extraction of phenolic compounds, antioxidants, and anthocyanins from sugar beet
molasses. Food Chemistry. Volume 172, 1, Pages 543–550. 2015.
CHEUNG, L. M., CHEUNG, P. C. K., OOI, V. E. C. Antioxidant activity and
ttal phenolics of edible mushroom extracts. Food Chemistry, v. 81, p. 249-255,
2003.
CHIRINOS, R. et al. Antioxidant compounds and antioxidant capacity of
Peruvian camu-camu (Myrciaria dubia (H.B.K.) McVaugh) fruit at different maturity
stages. Food Chemistry v. 120, p. 1019-1024, 2010.
CHITARRA, M. I. F.; CHITARRA, A. D. Pós colheita de frutas e hortaliças,
fisiologia e manuseio. Lavras: ESAL/FAEPE. 1994
CONTINI, M., BACCELLONI, S., MASSANTINI, R., ANELLI, G. (2008).
Extraction of natural antioxidants from hazelnut (Corylus avellana L.) shell and skin
wastes by long maceration at room temperature. Food Chemistry, 110(3), 659–
669.
DÁVALOS, A., GÓMEZ-CORDOVÉS, C., BARTOLOMÉ, B. Extending
applicability of the oxygen radical absorbance capacity (ORAC-Fluoresein) assay.
Journal of Agricultural and Food Chemistry, v. 52, p. 48-54, 2004.
DU, F.-Y., XIAO, X.-H., & LI, G.-K. Application of ionic liquids in the
microwave-assisted extraction of trans-resveratrol from Rhizma Polygoni
Cuspidati. Journal of Chromatography A, 1140(1), 56–62, 2007
EL-AGAMEY, A.; LOWE, G.M.; MCGARVEY, D.J.; MORTENSEN, A.;
PHILLIP, D.M.; TRUSCOTT, T.G.; YOUNG, A.J. Carotenoid radical chemistry and
antioxidant/pro-oxidant properties. Archives Biochemistry Biophysics., 430, 37-
48. 2004
ELLENDERSEN, L. S. N., GRANATO, D., GUERGOLETTO, K. B.,
WOSIACKI, G. Development and sensory profile of a probiotic beverage from
apple fermented with Lactobacillus casei. Engineering in Life Sciences, 12, 475–
485. 2012.
65
GHAFOOR, K., CHOI, Y. H., JEON, J. Y., & JO, I. H. Optimization of
ultrasound assisted extraction of phenolic compounds, antioxidants, and
anthocyanins from grape (Vitis vinifera) seeds. Journal of Agricultural and Food
Chemistry, 57(11), 4988–4994, 2009.
HUANG, D., OU, B., PRIOR, R. L. The chemistry behind antioxidant
capacity assays. Journal of Agricultural and Food Chemistry, v. 53, p. 1841-
1856, 2005.
JOGLEKAR, A. M.; MAY, A. T. Product excellence through design of
experiments. Cereal Foods World 32: 857-868, 1987.
JORGE, A. J., HELIODORO, D. L. G. T., ALEJANDRO, Z. C., RUTH, B. C.,
AGUILAR CRISTÓBAL NOE, A. C. The optimization of phenolic compounds
extraction from cactus pear (Opuntia ficus-indica) skin in a reflux system using
response surface methodology. Asian Pacific Journal of Tropical Biomedicine,
3(6), 436–442. 2013.
LI, F., YANG, L., ZHAO, T., ZHAO, J., ZOU, Y., ZOU, Y. Optimization of
enzymatic pretreatment for n-hexane extraction of oil from Silybum marianum
seeds using response surface methodology. Food and Byproducts Processing,
90, 87–94. 2012
LIMA, V. L. A. G.; MELO, E. A.; LIMA, D. E. S. Teor de compostos fenólicos
totais em chás brasileiros. Brazilian Journal of Food Technology, Campinas, v.
7, n. 2, p. 187-190, Oct. 2004.
LORENZI, H.; MATOS, F.J.A. Plantas medicinais no Brasil: nativas e
exóticas cultivadas. Nova Odessa: Instituto Plantarum, p, 544, 2002.
MANDAL, V., MOHAN, Y., & HEMALATHA, S. Microwave assisted
extraction—an innovative and promising extraction tool for medicinal plant
research. Pharmacognosy Reviews, 1(1), 7–18, 2007.
MOLYNEUX, P. The use of the stable free radical diphenylpicrylhidrazyl
(DPPH) for estimating antioxidant activity. Journal Science Technologie, v. 26, n.
2, p. 211-219, 2004.
66
MONTORO, P.; BRACA, A.; PIZZA, C.; TOMMASI, N. D. Structure–
antioxidant activity relationships of flavonoids isolated from different plant species.
Food Chemistry, v. 92, p. 349–355, 2005.
NACZK, M., & SHAHIDI, F. Phenolics in cereals, fruits and vegetables:
Occurrence, extraction and analysis. Journal of Pharmaceutical and Biomedical
Analysis, 41(5), 1523–1542, 2006.
NASCIMENTO, W. M. O; CARVALHO, J. E. U; MÜLLER, C. H. Propagação
do Abricoteiro. Comunicado técnico. ISSN 1517-2201, 2008
OU, B., HAMPSCH-WOODILL, M., PRIOR, R. L. Development and
validation of an improved oxygen radical absorbance capacity assay using
fluorescein as the fluorescent probe. Journal Agricultural Food Chemistry, v.49,
p. 4619-4626, 2001.
PENA, W. E. L., ANDRADE, N. J., SOARES, N. F. F., ALVARENGA, V. O.,
RODRIGUES, J. S., ZUNIGA, A. D. G. Modelling Bacillus cereus adhesion on
stainless steel surface as affected by temperature, pH and time. International
Dairy Journal, 34, 153–158. 2014.
POMPEU, D. R.; SILVA, E. M.; ROGEZ, H. Optimisation of the solvent
extraction of phenolic antioxidants from fruits of Euterpe oleracea using response
surface methodology. Bioresource Technology v. 100, p. 6076-6082, 2009.
PRIOR, R. L. CAO, G. In vivo total antioxidant capacity: comparison of
different analytical methods. Free Radical Biology & Medicine, v. 27, n.11/12, p.
1173-1181, 1999.
PRIOR, R.L.; WU, X.; SCHAICH, K. Standardized methods for the
determination of antioxidant capacity and phenolics in foods and dietary
supplements. Journal of Agricultural and Food Chemistry, Washington, v.53, p.
4290-4303, 2005.
RODRIGUES, M. I.; IEMMA, A. F. (2012). Experimental design and process
optimization. Campinas: Cárita Editora.
RUFINO, M. S. M.; ALVES, R.; BRITO, E. S.; PÉREZ-JIMÉNEZ, J.;
SAURA-CALIXTO. F.; MANCINI-FILHO. J. Bioactive compounds and antioxidant
67
capacities of 18 non-traditional tropical fruits from Brazil. Food Chemistry 121
996–1002, 2010.
SAIKIA, S; NIKHIL KUMAR MAHNOT, CHARU LATA MAHANTA.
Optimisation of phenolic extraction from Averrhoa carambola pomace by response
surface methodology and its microencapsulation by spray and freeze drying. Food
Chemistry 171, 144–152, 2015.
SCHERER, R.; GODOY, H. T. Antioxidant activity index (AAI) by the 2,2-
diphenyl-1-picrylhydrazyl method. Food Chemistry, 112, p. 654-658, 2009.
SILVA, B. A.; GORDON, A.; JUNGFER, E.; MARX, F.; MAIA, J. G. S.
Antioxidant capacity and phenolics of Pouteria macrophylla, an under-utilized fruit
from Brazilian Amazon. Eur Food Res Technol 234:761–768, 2012.
SINGLETON, V. L.; ORTHOFER, R.; LAMUELA-RAVENTÓS, R. M. JR.
Analysis of total phenols and other oxidation substrates and antioxidants by means
of Folin-Ciocalteu reagent. Methods in Enzymology. 830, p. 152-178, 1999.
SOUZA, M. M.; RECART, V. M.; ROCHA, M..; CIPOLATTI, E. P.; BADIALE-
FURLONG, E. Estudo das condições de extração de compostos fenólicos de
cebola (Allium cepa L.). Instituto Adolfo Lutz, 68, 192-200, 2009.
SPORRING, S., BOWADT, S., SVENSMARK, B., BJÖRKLUND, E.
Comprehensive comparison of classic Soxhlet extraction with Soxtec extraction,
ultrasonication extraction, supercritical fluid extraction, microwave assisted
extraction and accelerated solvent extraction for the determination of
polychlorinated biphenyls in soil. Journal of Chromatography A, 1090(1), 1–9.
2005.
TOMA, M., VINATORU, M., PANIWNYK, L.; MASON, T. Investigation of the
effects of ultrasound on vegetal tissues during solvent extraction. Ultrasonics
Sonochemistry, 8(2), 137–142, 2001.
VASCO, C.; RUALES, J.; KAMAL-ELDIN, A. Total phenolic compounds and
antioxidant capacities of major fruits from Ecuador. Food Chemistry. 111, 816-
823, 2008.
68
VILKHU, K., MAWSON, R., SIMONS, L., BATES, D. Applications and
opportunities for ultrasound assisted extraction in the food industry—A review.
Innovative Food Science & Emerging Technologies, 9(2), 161–169, 2008.
WANG, J., SUN, B., CAO, Y., TIAN, Y., & LI, X. Optimisation of ultrasound-
assisted extraction of phenolic compounds from wheat bran. Food Chemistry,
106(2), 804–810, 2008.
YAHIA, E. M. The Contribution of Fruit and Vegetable Consumption to
Human Health. In: ROSA, L.A.; ALVAREZ-PARRILLA, E.; GONZALEZ-
AGUILARA; G.A. Fruit and vegetable phytochemicals: chemistry, nutritional
value and stability. Hoboken: Wiley-Blackwell. p. 3-51. 2010.
YANG, J. Brazil nuts and associated health benefits: a review. LWT – Food
Science Technology., v. 42, p. 1573-1580, 2009.
YANG, J. M. L.; M.; HUANG, M. T.; H.; NEWMARK, H. L. Inhibition of
carcinogenesis by dietary polyphenolic compounds, Annual Review of Nutrition,
v.21, p. 381–406, 2001.
YIM, H. S., CHYE, F. Y., KOO, S. M., MATANJUN, P., HOW, S. E., HO, C.
W. Optimization of extraction time and temperature for antioxidant activity of edible
wild mushroom, Pleurotus porrigens. Food and Bioproducts Processing, 2, 235–
242. 2012.
69
Cap III
Análise dos compostos fenólicos presentes na Mammea
americana por cromatografia líquida (UHPLC/DAD-MS-MS)
através da otimização da hidrólise utilizando uma técnica
estatística multivariada
Pollyane da Silva Port’s1, Helena Teixeira Godoy1
Artigo em preparação para ser publicado no periódico Food Reserch International
1 Departamento de Ciência de Alimentos, Faculdade de Engenharia de
Alimentos, Universidade Estadual de Campinas (UNICAMP), CEP 6121, 13083-862, Campinas, SP, Brasil.
71
RESUMO
O Brasil é um país com grande diversidade em espécies de frutas tropicais, no
entanto ainda pouco exploradas, mas com um enorme potencial agroindustrial.
Neste contexto a Mammea americana, conhecida popularmente como abricó,
torna-se interessante para o estudo proposto, por apresentar dados escassos
quanto ao perfil desses bioativos presentes na polpa. Essas informações tornam-
se relevantes para o conhecimento dos seus constituintes e suas propriedades
funcionais. Então, este trabalho visou avaliar a polpa da fruta M. americana, obtida
de dois estados brasileiro (Belém/Pa e Manaus/AM) e de 2 acessos (Kamatá 1 e
Kamatá 2) fornecidos pela EMBRAPA – Amazônia Oriental quanto a presença de
compostos fenólicos. Foi realizada, uma otimização da etapa de hidrólise para
posterior determinação dos compostos presentes na polpa, utilizando a
metodologia de superfície de resposta (0,5M de ácido clorídrico, temperatura de
95 ºC por 30 minutos). Os fenólicos presentes na polpa foram avaliados através
da técnica de cromatografia líquida de ultra alta eficiência (UHPLC) acoplada a um
detector de arranjo de diodos (DAD) e de massas (MS) Ion Trap, operando no
modo negativo e equipado com uma fonte de ionização ESI (electron spray
ionization) e analisador de massas Ion-Trap. Foi utilizada uma coluna do tipo fase
reversa, C18 (150 x 2.1 mm) e tamanho de partícula de 1,9 µm, na qual foi aplicado
um gradiente utilizando como fase móvel uma solução aquosa 0,1% ácido fórmico
e acetonitrila. Foram identificados, ácido gálico, ácido caféico, ácido 3,4
dihidroxibenzoico, p-coumárico, quercetina e o kaepmferol. O ácido 3,4
dihidroxibenzoico foi o único composto fenólico quantificado, apresentando
resultados na faixa de 109,53 à 195,95 µg/g de amostra liofilizada. Os resultados
mostraram que a fruta do abricó apresentou baixo teor para os compostos
fenólicos estudados, o que demonstra que esta fruta possui poucos constituintes
desta natureza.
Palavras-chave: Abricó, antioxidantes, compostos fenólicos.
72
ABSTRACT
Brazil is a country with great diversity in tropical fruit species, which are still largely
unexplored, but with enormous potential agroindustrial. In this context the a
Mammea ammericana, popularly known as apricot, becomes interesting for the
proposed study, due to its scarce data on the profile of these bioactive in the pulp.
This information is relevant to the knowledge of their constituents and their
functional properties. So, this work aimed to evaluate the pulp of the fruit, obtained
from two Brazilian states (Belém/PA and Manaus/AM) and 2 accesses (Kamata 1
and Kamata 2) provided by EMBRAPA - Eastern Amazon for the presence of
compounds phenolic. It was carried out an optimization for the hydrolysis stage for
subsequent determination of the compounds present in the pulp using the
response surface methodology (0.5 mol.L-1 hydrochloric acid, temperature of 95 °C
for 30 minutes). The phenolics present in the pulp were analyzed by the liquid
chromatography technique for ultra high efficiency (UHPLC) coupled with a diode
array detector (DAD) and mass (MS) Ion Trap operating in negative and fitted with
an ionization source ESI mode (electron spray ionization), and analyzer Ion-Trap
mass. It was used a reverse phase column of type C18 (150 x 2.1 mm) and 1,9 uM
particle size, in which was applied a gradients with a aqueous solution 0,1% formic
acid and acetonitrile as the mobile phase. It was identified, gallic acid, caffeic acid,
3,4 dihydroxybenzoic acid, p-coumaric, quercetin and kaepmferol. The 3,4
dihydroxybenzoic acid was the only phenolic compound measured, with results in
the range of 109,53 to 195,95 mg.g-1 of freeze-dried sample. The results showed
that the fruit apricot has low level of studied phenolic compounds, which indicates
that this fruit has few components of this nature.
Keywords: Apricot, antioxidants, phenolic compounds
73
1. Introdução
Frutas são fontes potencialmente ricas em muitos compostos bioativos e
estudos científicos mostram que estes compostos desempenham um papel
importante na prevenção de muitas doenças inflamatórias e oxidativas, entre
outras, devido sua ação antioxidante, anti-cancro, antimicrobianos, antimaláricos,
e propriedades hipoglicemiantes (CAVALCANTI et al., 2011).
A bacia amazônica é rica em recursos genéticos de frutas e oleaginosas, e
sua exploração econômica é de grande importância para a região. Entre os frutos
e oleaginosas extraídos na Amazônia, muitos são excepcionalmente ricos em
micronutrientes, em particular antioxidantes, tais como carotenoides, antocianinas
e outros polifenóis (ROSSO & MERCADANTE 2007).
Assim, muitas dessas frutas, em especial, as que possuem sementes
oleaginosas contribuem consideravelmente para a alimentação das populações
locais, além disso, também são utilizadas devido as suas propriedades medicinais,
sendo que várias partes dessas plantas são utilizadas para este fim como a casca,
polpa e sementes (NASCIMENTO et al., 2008). Existem poucos estudos sobre a
maioria das frutas exóticas que, além de apresentarem grande potencial para a
agroindústria, podem se tornar uma fonte de renda futura para a população local.
Esses frutos representam uma oportunidade para os produtores locais ganharem
acesso a mercados especiais, onde os consumidores enfatizam não só o caráter
exótico, mas também a presença de nutrientes capazes de prevenir doenças
degenerativas não transmissíveis (ALVES, et al., 2008).
Neste sentido o abricó (Mammea americana L.), pertencente à família do
garcinia (Clusiaceae) e originalmente proveniente das Índias Ocidentais e do norte
da América do Sul, atualmente encontrada principalmente na Amazônia e algumas
outras poucas regiões (CAVALCANTE, 1991). Pode medir entre 7-15 cm (3-6
polegadas) de diâmetro, é coberto com uma casca espessa e resistente, contém
uma polpa amarela e brilhante de um agradável sabor e aroma perfumado que é
comido cru e também usado para conservas. Suas sementes (1-4) em bruto são
grandes amargas e resinosas e são utilizadas como um agente vermífugo
(MORALES & DUQUE, 2010), o que torna uma fruta interessante como fonte de
74
estudos, já que pesquisas relacionadas à sua composição são escassas na
literatura.
Entre os vários grupos de compostos bioativos presentes nessas frutas, os
compostos fenólicos se destacam em função de sua capacidade antioxidante. Os
fenólicos são produtos secundários do metabolismo vegetal, constituem um amplo
e complexo grupo de fitoquímicos, de natureza hidrofílica, com mais de 10.000
estruturas conhecidas e estão distribuídos fisicamente entre os seus vários
compartimentos: frutas, folhas, cascas, sementes e raízes. Em geral, uma menor
fração dos ácidos fenólicos permanece de forma não associada, ao passo que
uma quantidade maior está ligada à celulose, lignina, proteínas, ou conjugada com
açúcares, flavonoides e terpenos, entre outras substâncias. Por isso a
determinação quantitativa de flavonoides glicosídicos é difícil, devido ao seu
grande número. Neste sentido, estes compostos glicosilados são normalmente
hidrolisados e as agliconas resultantes são identificadas e quantificadas. Os
métodos para a hidrólise ácida de flavonoides a partir de vegetais e frutas foram
publicados inicialmente por Hertog et al. (1992a) e por Häkkinen (1998).
Geralmente, a hidrólise de glicosidos de flavonoides requer concentrações
relativamente elevadas de ácidos (1-2 M) sob condições de refluxo (HERTOG et
al., 1992b; MERKEN & BEECHER, 2000). Contudo, as condições ótimas para sua
obtenção acabam sendo muito drásticas para alguns dos outros compostos
fenólicos presentes no mesmo material da planta. (BRAGA et al., 2010; NUUTILA
et al., 2002). Por esta razão, a extração e as condições de hidrólise têm sido
sistematicamente otimizadas para cada amostra de alimento, principalmente em
relação à concentração de ácido utilizado e o período de reação, e o efeitos
dessas variáveis sob as agliconas obtidas na hidrólise normalmente é investigada
(HERTOG et al., 1992b).
A grande diversidade estrutural, as interações com outros componentes da
amostra, a susceptibilidade a ação de enzimas assim como, as características
físicas do fruto são alguns dos fatores responsáveis pela complexidade da
extração e análise (separação, identificação e quantificação) de compostos
fenólicos, não existindo uma metodologia universal de análise.
75
Consequentemente, diferentes métodos de extração de compostos fenólicos são
relatados na literatura, assim como, trabalhos de otimização da extração para uma
amostra em específico (FUKUJI et al., 2010; NACZK & SHAHID, 2006).
A metodologia de superfície de resposta (MSR) é uma técnica estatística e
matemática que vem sendo bastante utilizada para a melhoria e otimização de
processos, podendo ser aplicada quando uma resposta ou conjunto de respostas
são afetados por múltiplas variáveis, como é o caso da extração de compostos
fenólico e da hidrólise (MEHMOOD, 2015).
A cromatografia líquida de alta eficiência (HPLC) em fase reversa, acoplado
a um detector de arranjo de diodos (DAD) e a um espectrômetro de massas (MS),
através de ionização por electrospray (ESI) tem sido uma ferramenta importante
na caracterização de compostos fenólicos em frutas e produtos naturais. Além
disso, outras técnicas também vem sendo bastante utilizadas como a eletroforese
capilar de zona (Capillary Zones Electrophoresis, CZE) e em alguns casos
ressonância magnética nuclear (Nuclear Magnetic Ressonance, NMR) (FUKUJI et
al., 2010).
Recentemente, a cromatografia líquida de ultra alta eficiência (UHPLC)
tornou-se uma técnica amplamente difundida por apresentar uma maior eficiência
de separação, devido ao tamanho menor das partículas permitindo trabalhar com
colunas menores, e tempo de análises reduzido. Sistemas UHPLC tem
demonstrado serem benéficos no desenvolvimento de produtos farmacêuticos
(WREN & TCHELITCHEFF, 2006), no monitoramento de drogas (YUAN et al.,
2008), no perfil de metabolitos (WONG et al., 2008), em proteômica (EVERLEY &
CROLEY, 2008), em química ambiental (GERVAIS et al., 2008) e química de
alimentos (HUNG et al., 2011). Neste sentido novos métodos em UHPLC vêm
sendo desenvolvidos nos últimos anos para a determinação de flavonoides e
ácidos fenólicos em diversas matrizes alimentícias (NOVAKOVA et al., 2010).
Tendo em vista a importância de se investigar novas fontes de compostos
fenólicos, a caracterização da Mammea americana. é de grande relevância, já que
estudos no que diz respeito a sua composição fenólica ainda não existem. Assim,
o objetivo deste trabalho foi otimizar as condições de hidrólise ácida (para
76
liberação das agliconas), utilizando o método de superfície de resposta e
identificar os compostos fenólicos presentes na polpa através da técnica
cromatográfica líquida de ultra eficiência acoplada a detectores de DAD e
espectrometria de massas.
2. MATERIAL E MÉTODOS
2.1. Amostras
As frutas provenientes de acessos (Kamatá 1 e Kamatá 2), utilizadas neste
trabalho foram fornecidas pela Embrapa Amazônia Oriental, Belém/ Pará, in
natura em um único lote para cada um dos acessos, as demais foram obtidas no
comércio local de Belém/PA e em Manaus/AM, em três lotes, para cada um dos
anos, 2011-2012-2013 especificamente no mês de julho. Sendo que cada lote foi
formado por 3 a 4 frutos.
Os frutos dos acessos obtidos juntamente com os frutos dos lotes dos dois
Estados foram descascados, cortados, congelados e liofilizados. As amostras
após serem liofilizadas foram então moídas e acondicionadas em sacos metálicos
(ao abrigo de luz) e seladas a vácuo (livre de O2) e posteriormente guardadas em
freezer (-18 ºC) até o momento das análises.
2.2. Reagentes e solventes
Metanol, grau cromatográfico, foi adquirido da J.T.Baker (Phillipsburg, USA).
Para análises cromatográficas foram utilizadas acetonitrila de grau cromatográfico
da JT Baker (Phillipsburg, USA), o ácido fórmico, da marca MERCK, o ácido
clorídrico foi adquirido da Synth. A água utilizada para o preparo das fases móveis
foi purificada em sistema Milli-Q (Millipore Corporation). As fases móveis foram
filtradas em filtros politetrafluoroetileno (PTFE) da Millipore, com poros de 0,22 μm
de diâmetro. Os padrões de ácido gálico, ácido 3,4 dihidroxibenzoico, (+)-
catequina, (-)-epicatequina, ácido caféico, rutina, ácido p-coumárico, miricetina,
quercetina e kaempferol, foram adquiridos da Sigma Chemicals Co. (St. Louis,
EUA).
77
2.3. Determinação dos compostos fenólicos por UHPLC/DAD-MS-MS
Para obtenção do perfil dos compostos fenólicos por UHPLC, foi
selecionada, inicialmente, a melhor condição apresentada no Capítulo II,
composta por 5 extrações consecutivas, metanol 52%, no tempo de 10 minutos
cada. Na tentativa de otimizar a etapa de hidrólise. Entretanto, para a identificação
dos compostos agliconas foi necessário realizar uma nova otimização da etapa de
hidrólise dos fenólicos glicosídicos.
2.3.1. Otimização da hidrólise
A otimização da hidrólise foi feita através de um Planejamento Composto
Central (PCC) em 5 níveis diferentes (-, -1, 0, +1, +). Um fatorial completo 22
incluindo 4 ponto axiais (± α = (2k)1/4,onde k = número de variáveis independentes)
e 3 repetições no ponto central (para avaliar a repetibilidade da análise e
determinar o erro puro do modelo), totalizando 11 ensaios independentes
(RODRIGUES & IEMMA, 2012). As variáveis estudadas foram a concentração em
mol.L-1 do ácido clorídrico (HCl) e a temperatura para realização da hidrólise. Os
níveis podem ser visualizados na Tabela 1. As faixas estudadas foram baseadas
naquelas mais encontradas na literatura para hidrólise (NUUTILA et al., 2002;
TOYODA et al., 1997; HERTOG et al., 1993).
Tabela 1. Variáveis independentes e seus respectivos níveis.
Variáveis Código Níveis
-1,41 -1 0 +1 +1,41
Conc. de HCl (mol.L-1) X1 0,5 0,9 2,0 3,0 3,5
Temperatura (°C) X2 65 69 80 91 95
A concentração do ácido 3,4-dihidroxibenzoico foi à resposta avaliada, em
três tempos diferentes (Y1 – 30 min, Y2 – 120 min e Y3 – 180 min), devido este
ser o único composto encontrado acima do limite de quantificação. A faixa de
tempo estudado também foi selecionada de acordo com a literatura. A equação
78
quadrática para o referido sistema é: Y= 0 + 1A + 2B + 11A2 + 22B
2 + 12AB +
ε, onde Y é a resposta prevista, 0 a intersecção; 1 e 2 coeficientes lineares; 11
e 22 coeficientes quadráticos; 12, interação entre os coeficientes; e A, B, A2, B2,
AB variáveis independentes.
Foi utilizado o Software Statistica 7.0 (Statsoft Inc., Tulsa, OK, EUA) para
analisar os dados e gerar a superfície de resposta. O valor de ajuste da equação
do modelo estatístico foi expresso pelo coeficiente de determinação (R2) e a sua
significância estatística foi determinada por um teste F (análise de variância)
Para a realização dessa etapa utilizou-se a metodologia descrita por Hertog
(1992b). Em um balão de fundo redondo onde foram adicionados 0,5 g de amostra
de abricó liofilizada, 25 mL de solução extratora metanol-água (1:1 v/v) e ácido
clorídrico, com a molaridade de acordo com cada ponto do planejamento. O
sistema foi mantido sob refluxo em banho-maria em diferentes tempos (30, 120 e
180 minutos) e temperatura controlados para a hidrólise dos compostos fenólicos
de acordo com cada ponto do planejamento. Após a etapa de hidrólise, os extratos
foram resfriados em banho de gelo e neutralizados com NaOH (40%) e filtrados, e
em seguida foram acondicionados em frascos âmbar e armazenados sob
refrigeração -18 ºC até o momento da análise.
2.3.2. Análise cromatográfica
A análise dos compostos fenólicos, dos extratos hidrolisados, foi realizada
empregando-se um cromatógrafo líquido de ultra eficiência, da marca Thermo,
com injetor automático, alça de amostragem de 20 µL e bomba quaternária,
acoplado a um detector de arranjo de diodos (DAD) e um espectrômetro de
massas equipado com fonte de ionização por electrospray (ESI) e analisador de
massas Ion-Trap. O equipamento foi operado à temperatura ambiente (25 ± 2°C) e
os dados cromatográficos foram obtidos e processados pelo software Xcalibur. A
coluna cromatográfica utilizada foi do tipo fase reversa, C18 (150 x 2.1 mm) e
tamanho de partícula de 1,9 µm (Thermo, hypersil gold). O método cromatográfico
foi baseado em Novakova et al. (2010), com pequenas modificações. A fase móvel
constituiu de solução aquosa ácido fórmico a 0,1% em água (A) e acetonitrila (B).
79
O gradiente de eluição iniciou-se na proporção 95:5 em um fluxo de 0,32 mL.min-1.
A concentração de “A” decresceu até chegar aos 5 minutos na condição de 50:50,
e a partir dos 6 minutos voltou gradativamente para a condição inicial 95:5 em 20
minutos e permaneceu nesta condição por mais 2 minutos p ara que as condições
iniciais fossem restabelecida. A detecção dos compostos foi realizada com ajuda
do DAD (operando a 210, 260, 300 e 325 nm) e um espectrômetro de massas com
uma fonte de electrospray operando no modo negativo (temperatura do capilar
350 ºC, voltagem capilar de 2,5 kV, tensão do cone de 5 kv). Gás hélio (He) foi
utilizado como gás de colisão e o nitrogênio (N2) foi usado como gás nebulizador
70 (unidade arbitraria)
Para a identificação dos compostos presentes nas amostras foram
utilizados o tempo de retenção, os espectros de absorção e a co-cromatografia
comparando com os dos padrões e espectro de massas, que auxiliou na
confirmação da estrutura química dos compostos, através da comparação das m/z
e os fragmentos de cada composto com os dos seus respectivos padrões. A
quantificação dos fenólicos foi feita por padronização externa.
Para avaliar a faixa linear de trabalho, foi construída uma curva de
calibração para o composto 3,4 diidroxibenzóico. A concentração empregada para
o preparo da curva, partiu de uma solução de 5 µg.g-1. A repetitividade do método
foi avaliada, utilizando padrão, em três níveis de concentração (nos pontos baixo,
médio e alto da curva) em 10 injeções cada nível (mesmo dia). A precisão
intermediária foi avaliada nos mesmos níveis utilizados para avaliar a
repetibilidade, porém em três dias diferentes. Os limites de detecção (LD) e de
quantificação (LQ) foram calculados a partir da relação sinal-ruído que foi de 3:1 e
10:1, respectivamente (BRASIL 2003).
3. RESULTADOS E DISCUSSÃO
3.1. Otimização das condições de hidrólise
Dos compostos investigados nas amostras na etapa de hidrólise, apenas o
3,4 diidroxibenzoico quantificado, por isso foi selecionado como resposta do
80
planejamento. A matriz com as especificações de cada ensaio bem como suas
respectivas respostas pode ser visualizada na Tabela 2
Tabela 2. Matriz do planejamento fatorial 22, com pontos axiais e pontos centrais.
Ensaios
Valores
codificados
Valores
decodificados Resposta µg.g-1*
X1 X2 Molaridade
(mol/L) T (°C)
Y1
30
(min)
Y2
120
(min)
Y3
180
(min)
1 -1 -1 0,9 69 24,89 70,86 53,66
2 +1 -1 3,0 69 67,97 48,12 44,38
3 -1 +1 0,9 91 108,61 35,86 49,78
4 +1 +1 3,0 91 49,82 69,15 74,78
5 -1,41 0 0,5 80 44,17 128,09 40,36
6 +1,41 0 3,5 80 48,35 21,25 46,05
7 0 -1,41 2 65 53,74 69,25 57,33
8 0 +1,41 2 95 54,32 39,99 43,97
9 0 0 2 80 53,42 31,54 52,23
10 0 0 2 80 55,41 35,62 60,54
11 0 0 2 80 39,17 47,81 52,09
* Resposta do ácido 3,4 diihroxibenzóico em µg.g-1
Ao analisar as concentrações obtidas para cada ensaio nos diferentes
tempos observou-se que o estudo do tempo como resposta é de extrema
importância garantindo que não haja degradação dos compostos. Hertog et al.
(1992b) já mencionava a importancia de se investigar o efeito desse parâmetro.
Com o intuito de avaliar a integridade dos compostos durante a etapa de hidrólise
para cada matriz.
Para avaliar melhor o efeito da hidrólise, para o 3,4 dihidroxibenzóico, nos
respectivos tempos estudados, um gráfico (Figura 1) foi construído com as
resposta obtidas, para cada tempo. A partir dele pode-se observar que no ensaio
5, no tempo de 120 minutos, obteve-se a maior resposta (139,62 µg.g-1),
81
possivelmente devido a baixa concentração de ácido utilizada, porém em seguida
houve uma queda brusca em sua concentração, fato este que pode estar
relacionado a exposição deste ácido fenólico a elevada temperatura por um longo
período. Já no ensaio 7 o valor da área encontrado manteve-se praticamente
constante no decorrer de todo o tempo, isto ocorreu mesmo em temperatura
elevadas, devido ao fato deste ensaio conter concentração mais baixa de ácido, o
que permitiu a hidrólise sem uma degradação significativa deste composto.
Figura 1. Gráfico das respostas (em µg.g-1
) para o composto 3,4 dihidroxibenzóico para cada um dos tempos estudado 30, 120 e 180 minutos.
No gráfico também nota-se que o ensaio 6, onde a concentração de ácido é
máxima (axial = + 1,41), juntamente com uma temperatura mais elevada foi a que
obteve a menor concentração para o composto estudado, o que pode ser atribuído
a degradação do composto no decorrer do tempo.
Os resultados indicaram que é necessário um equilíbrio entre a concentração
de ácido (HCl) utilizado e a temperatura (ºC), para obtenção das agliconas, sem
que haja degradação da mesma. Segundo Toyoda et al. (1997), as condições
destas variáveis dependerá principalmente do tipo ou grupo de composto que se
pretende hidrolisar ou seja do grau de complexidade relacionados a sua estrutura
molecular.
A partir das concentrações obtidas dos picos cromatográficos referentes ao
ácido 3,4 dihidroxibenzóico, calculou-se o efeito das 2 variáveis estudadas para
cada um dos tempos, e a partir dos resultados obtidos, verificou-se que de acordo
0,00
20,00
40,00
60,00
80,00
100,00
120,00
140,00
30 (min) 120 (min) 180 (min)
Res
po
sta
em µ
g/g
Ensaio 1
Ensaio 2
Ensaio 3
Ensaio 4
Ensaio 5
Ensaio 6
Ensaio 7
Ensaio 8
Ensaio 9
Ensaio 10
82
com os tempos estudados algumas das variáveis (Tabela 3) foram significativas (p
≤ 0,10). A partir dos efeitos obteve-se os coeficientes de regressão para cada
tempo 30, 120 e 180 minutos e as variáveis estatisticamente não significativas
foram retiradas para obtenção do modelo reparametrizado. O nível de significância
utilizado para avaliar o efeito de cada variável sobre a hidrólise na amostra do
composto 3,4 dihidroxibenzoico foi ajustado para 10%, com objetivo de minimizar
o risco de se excluir qualquer variável importante (Rodrigues & Iemma, 2012).
Tabela 3. Coeficientes de regressão para os modelos matemáticos, já
reparametrizados.
Fatores
Coeficiente de
Regressão t (9) p*
30
Min
Média 54,5334 15,03866 0,000000
Molaridade (L) 8,9369 2,10176 0,068749
X1 (L) e X2 (L) -25,4673 -4,23510 0,002856
12
0
Min
Média 54,3209 6,82106 0,000077
Molaridade (L) -17,5676 -1,88124 0,092622
18
0
Min
Média 52,28850 20,78638 0,000001
X1 (L) e X2 (L) 8,56963 2,05432 0,070122
*p = nível de significância a 10%
Nos tempos de 30 e 120 minutos ocorreu a inclusão no modelo de uma
variável (molaridade linear), e no tempo de 180 minutos da interação X1 (L) e X2
(L), todas não foram estatisticamente significativas, porém, devido as mesmas
encontrarem-se com valores muito próximo ao p-valor (0,1), estas foram inclusas.
Isto foi realizado no intuito de não se excluir nenhuma variável considerada
importante. A partir dos resultados para o coeficiente de regressão nos respectivos
tempos estudado os modelos ajustados foram submetidos ao teste de significância
(ANOVA).
83
Os resultados da ANOVA obtidos para as respostas nos diferentes tempos
(30, 120 e 180 min), encontram-se apresentados na Tabela 4.
Tabela 4. Valores da ANOVA nos respectivos tempos.
Fatores Soma
Quadrática G.L
Média
quadrática F calculado p
30
min
Molaridade(L) 638,950 1 638,950 8,14433 0,103984
X1 (L) e X2 (L) 2594,336 1 2594,336 33,06852 0,028934
Falta de ajuste 1000,242 6 166,707 2,12492 0,354126
Erro puro 156,907 2 78,453
Total 4390,435 10
120
min
Molaridade(L) 2468,960 1 2468,960 34,48041 0,027798
Falta de ajuste 6135,434 7 876,491 12,24068 0,077581
Erro puro 143,209 2 71,605
Total 8747,604 10
180
min
X1 (L) e X2 (L) 293,7540 1 293,7540 12,56577 0,071188
Falta de ajuste 579,7003 7 82,8143 3,54251 0,237749
Erro puro 46,7546 2 23,3773
Total 920,2089 10
*p = nível de significância a 10%
As análises de variância (ANOVA) mostraram que de todos os modelos,
apenas o de 120 minutos não foi adequado para representar os dados
experimentais. Já que a adequação do modelo proposto foi verificada através de
análise estatística que revelou que houve falta de ajuste para este modelo neste
tempo. Myers e Montgomery (2002) afirmam que a falta de ajuste mede a falha do
modelo para representar dados no domínio experimental que não estão incluídas
na regressão. Portanto, apenas os modelos de 30 e 180 minutos puderam ser
utilizados para realizar a previsão do ponto ótimo das condições de hidrólise e
liberação do ácido 3,4-dihidroxibenzóico presente na polpa do abricó.
84
Os modelos reparametrizados estão apresentados nas equações 1 e 2.
MODELO CODIFICADO (30 MINUTOS)
y = 54,53 + 8,94X1 – 25,47X1.X2 Eq. 1
MODELO CODIFICADO (180 MINUTOS)
y = 52,29 + 8,57X1.X2 Eq. 2
Onde, y é a área do pico cromatográfico do composto fenólico avaliado (ácido 3,4 dihidroxibenzóico), X1 é a molaridade do ácido clorídrico, e X2 é a temperatura.
A partir dos resultados obtidos para a análise de variância foi possível
construir as superfícies de resposta e suas respectivas curvas de contorno para
cada um dos tempos (30 e 180 minutos), que encontram-se representados na
Figura 2.
Figura 2. Superfícies de resposta e curvas de contorno para a concentração do ácido 3,4
dihidroxibenzóico em função da molaridade do HCl e a temperatura de hidrólise para os tempos de 30 e 180 minutos, (A) e (B) respectivamente.
(A)
(B)
85
Nota-se através da Figura 2A que foi obtido um efeito antagônico, ou seja,
as melhores condições de hidrólise no tempo de 30 minutos se davam ou quando
uma alta temperatura era combinada com uma concentração de ácido mais baixa
ou quando uma temperatura mais baixa era combinada com uma concentração de
ácido mais elevada. Já que, temperaturas muito elevadas e altas concentrações
de ácido (HCl) possivelmente levam a degradação dos compostos, assim como
baixas temperaturas e concentração de ácido (HCL) elevada há uma hidrólise
ineficiente
Para o tempo de 180 minutos (Figura 2B), observou-se que com o emprego
de ácido clorídrico na concentração de 0,5 mol.L-1 e temperaturas menores (entre
65 ºC e 69 ºC), resultaram nas maiores concentrações do ácido 3,4
dihidroxibenzóico, este resultado mostra que por longos períodos expostos a
condições mais drásticas a temperatura e a molaridade precisam ser as menores
possíveis do contrário ocorre à degradação do composto.
A partir dos modelos obtidos e suas respectivas superfícies verificou-se que
o modelo que apresentou um maior valor previsto, para a determinação do 3,4-
dihidroxibenzoico na amostra, foi o modelo obtido nas condições de 30 minutos.
Assim, para a realização das análises do perfil cromatográfico dos fenólicos as
condições ótimas de hidrólise foram temperatura de 95 °C, concentração de HCl
de 0,5 mol/L e tempo de 30 minutos. Tais condições foram aplicadas a partir de
então para todas as amostras para posterior detecção e identificação por
UHPLC/DAD-MS-MS
3.2. Identificação dos compostos fenólicos por UHPLC/DAD-MS-MS
A Tabela 5 apresenta os compostos detectados e confirmados pelo
espectrômetro de massas (UHPLC/DAD-MS-MS), a partir dos extratos obtidos nas
melhores condições. Antes, porém o método foi submetido ao processo de
validação, onde apenas o composto, ácido 3,4 dihidroxibenzóico, foi validado uma
vez que foi o único a se apresentar acima dos limites de quantificação. O método
mostrou boa linearidade (r2 = 0,99) e repetitividade dentro dos limites aceitáveis
86
(<10%). Os limites de detecção e de quantificação ficaram em 0,02 µg.g-1.e 0,06
µg.g-1 respectivamente.
Tabela 5. Compostos fenólicos encontrados na polpa de abricó em seus
respectivos lotes e localidades.
Amostras Compostos [M-H]- m/z M2
B1
Ácido gálico Ácido 3,4 dihidroxibenzóico
Ácido caféico Ácido p-coumárico
Quercetina Kaempferol
[169] [153] [179] [163] [289] [285]
[169] 125 [153] 109
[179] 161, 135 [163] 119
[289] 245, 205, 179 [285] 217, 151
B2
Ácido.gálico Ácido 3,4 dihidroxibenzoico
Quercetina Kaempferol
[169] [153] [289] [285]
[169] 125 [153] 109
[289] 245, 205, 179 [285] 217, 151
B3
Ácido.gálico Ácido 3,4 dihidroxibenzoico
Quercetina Kaempferol
[169] [153] [289] [285]
[169] 125 [153] 109
[289] 245, 205, 179 [285] 217, 151
M1 Ácido 3,4 dihidroxibenzoico
Quercetina Kaempferol
[153] [289] [285]
[153] 109 [289] 245, 205, 179
[285] 217, 151
M2 Ácido 3,4 dihidroxibenzoico
Quercetina Kaempferol
[153] [289] [285]
[153] 109 [289] 245, 205, 179
[285] 217, 151
M3 Ácido 3,4 dihidroxibenzoico
Quercetina Kaempferol
[153] [289] [285]
[153] 109 [289] 245, 205, 179
[285] 217, 151
K1 Ácido 3,4 dihidroxibenzoico
Quercetina Kaempferol
[153] [289] [285]
[153] 109 [289] 245, 205, 179
[285] 217, 151
K2 Ácido 3,4 dihidroxibenzoico
Quercetina Kaempferol
[153] [289] [285]
[153] 109 [289] 245, 205, 179
[285] 217, 151
B1 = Belém 1 lote; B2= Belém 2 lote; B3= Belém 3 lote; M1= Manaus 1 lote; M2= Manaus 2 lote; M3= Manaus 3 lote; K1= Kamatá 1 lote único; K2= Kamatá 2 lote único.
87
O ácido 3,4-dihidroxibenzóico foi o único composto a ser quantificado, e foi
encontrado nas concentrações de: Belém (1, 2 e 3), 109,53; 160,28; 165,18
Manaus (1, 2 e 3), 150,26; 175,33; 195,95 e Kamatá-1 e Kamatá-2 175,33; 185,78
respectivamente em µg.g-1. Os compostos que apresentaram-se abaixo do limite
de quantificação foram apenas identificados com o auxílio de um espectrômetro de
massas.
Como pode ser visualizada na Tabela 5, em todas as amostras encontrou-se
os mesmos compostos (ácido 3,4 dihidroxibenzoico, quercetina e kaempferol).
Porém, apenas nos lotes obtidos de Belém encontrou-se, além destes, os ácidos
gálico, caféico e o p-coumárico. Esta diferença na composição pode estar
relacionada a fatores abióticos naturais como a radiação solar, raios UV, períodos
de seca ou chuva, nutrientes e estações do ano também influenciam no
metabolismo e na produção destes compostos e ainda, fatores artificiais, como
poluentes (DEGÁSPARI & WASZCZYNSKYJ, 2004), fatores estes característicos
de cada região. Dados do Instituto Nacional de Meteorologia (INMET) mostram
que no período de coleta das frutas para a presente pesquisa a temperatura e a
umidade nos meses de julho nos 3 anos de coleta nos dois Estados foram bem
próximos. Em Belém os valores para temperatura (ºC) e umidade (%), variaram na
faixa de 22 – 35 e 45 – 95, respectivamente. Para Manaus estes valores ficaram
na faixa de 21 – 34 ºC de temperatura e de 33 – 99 % de umidade. Contudo, os
índices de radiação nos dois Estados, sofreu uma variação considerável como, por
exemplo, em Belém nos meses de julho de cada ano, teve uma variação de 1005
a 3227 Kj/m2, enquanto que para Manaus essa variação foi de 596 a 3153 Kj/m2, a
altitude também pode estar relacionada a estas variações já que Belém localiza-se
a 10,8 metros acima do nível do mar, enquanto que Manaus está quase 10 vezes
a mais, acima do nível do mar, (92,9 metros). Essas diferenças podem influenciar
de diferentes formas na síntese de diversos compostos, além dos fenólicos,
presentes na planta, fazendo com que a mesma fruta sofra diferentes variações
em sua composição.
Com relação aos compostos encontrados na polpa da fruta do abricó, Park et
al. (2015) analisaram fenólicos em diversas frutas, adquiridas frescas e em
88
seguida liofilizadas, como a maçã, banana, uva verde, morango, durião, toranja,
caqui, mangostão, pomelo e kiwi e em todas elas encontraram os ácidos
protocatecuico (também conhecido como 3,4 dihidroxibenzóico), cafeico e p-
cumárico. Dentre os flavonoides estudados encontraram na maioria delas a
quercetina e o kaempferol, corroborando com os resultados aqui obtidos para
todos os lotes. Dentre as frutas estudadas pelos autores, o mangostão é uma das
frutas pertencentes à mesma família do abricó e nela também foram encontrados
entre outros compostos o ácido 3,4 dihidroxibenzóico.
Hertog (1993) e colaboradores, também encontraram quercetina em todos os
sucos de frutas frescas e comerciais analisados, como o suco de uva, laranja,
maçã e limão. As frutas segundo Hertog (1992b) contêm quase exclusivamente
glicosídeos de quercetina, kaempferol e miricetina, por isso normalmente são
encontrados apenas em quantidades muito pequenas.
89
CONCLUSÃO
O planejamento composto central aplicado para otimização da etapa de hidrólise
permitiu extrair e identificar o ácido 3, 4 dihidroxibenzoico. A condição ótima
estabelecida para a hidrólise foi uma concentração de 0,5 mol.L-1 de ácido
clorídrico, temperatura de 95 ºC e tempo de 30 minutos. Dos compostos
estudados apenas o ácido 3,4-dihidroxibenzoico, quercetina e o kaempferol foram
os encontrados em todas as amostras. Os baixos valores encontrados para
análise de fenólicos, através do uso da técnica de cromatografia líquida,
demonstraram que a fruta de abricó não é rica nestes compostos.
90
REFERENCIAS
BRAGA, A. C. C.; SILVA, A. E.; PELAIS, A. C. A.; BICHARA, C. M. G.; POMPEU,
D. R. Atividade antioxidante e quantificação de compostos bioativos dos
frutos de abricó (Mammea americana). Alimentos e Nutrição, Araraquara
v.21, n.1, p. 31-36, 2010.
BRASIL. Resolução nº 899, de 29 de maio de 2003. Guia para validação de
métodos analíticos e bioanáliticos. Agência Nacional de vigilância Sanitária
(ANVISA). Disponível em <http://portal.anvisa.gov.br/>. Acessado em 14 de
setembro de 2013.
CAVALCANTI, R. N.; VEGGI, P. C.; MEIRELES, M. A. A.. Supercritical fluid
extraction with a modifier of antioxidant compounds from jabuticaba
(Myrciaria cauliflora) byproducts: economic viability. Procedia Food Science
1, 1672 – 1678, 2011.
EVERLEY, R. A.; CROLEY, T. R. Ultra-performance liquid chromatography mass
spectrometry of intact proteins. Journal Chromatogr A. 30; 1192(2): 2, 2008.
FUKUJI, T.; TONIN, F. G.; Tavares, M. F.M. Optimization of a method for
determination of phenolic acids in exotic fruits by capillary electrophoresis.
Journal of Pharmaceutical and Biomedical Analysis 51. 430–438. 2010.
GERVAIS, G.; BROSILLON, S.; LAPLANCHE, A. .Ultra-pressure liquid
chromatography–electrospray tandem mass spectrometry for multiresidue
determination of pesticides in water. Journal Chromatograph A 1202 (2008)
163.
HÄKKINEN, S.H.; KÄRENLAMPI, S.O.; HEINONEN, I.M.; MYKKÄNEN, H.M.;
TÖRRÖNEN, A.R. HPLC method for screening of flavonoids and phenolic
acids in berries. Journal of the Science of Food and Agriculture, 77, pp.
543–551.1988.
HERRMANN, K. On the occurrence of flavonol and flavones glycosides in
vegetables. Z Lebemm. Unters. Forsch. 186 1-5, 1988.
HERTOG, M. G. L.; HOLLMAN, P. C. H.; PUTTE, B. V. Content of Potentially
Anticarcinogenic Flavonoids of Tea Infusions, Wines, and Fruit Juices. J.
Agrlcultural Food Chemistry 4 1, 1242-1246. 1993.
91
HERTOG, M. G. L.; KROMHOUT, D.; ARAVANIS, C.; BLACKBURN, H.; BUZINA,
R.; Fidanza, F. Flavonoid intake and long-term risk of coronary-heart-disease
and cancer in the 7 countries study, Archives of Internal Medicine, v.155, p.
381–386. 1992.a
HERTOG, M.G.L.; HOLLMAN, P.C.H.; VENEMA, D.P. Optimization of a
quantitative HPLC determination of potentially anticarcinogenic flavonoids in
vegetables and fruits. Journal of Agricultural and Food Chemistry, 40 pp.
1591–1598. 1992.b
HUNG, P. V.; HATCHER, D. W.; BARKER, W. Phenolic acid composition of
sprouted wheats by ultra-performance liquid chromatography (UPLC) and
their antioxidant activities. Food Chemistry 126, 1896–1901. (2011).
INMET. Instituto Nacional de Meteorologia. Disponível em
<http://www.inmet.gov.br/>. Acessado dia 25/08/2015.
JOGLEKAR, A. M.; MAY, A. T. Product excellence through design of experiments.
Cereal Food World, 32, pp. 857–868, 1987
MEHMOOD, TAHIR. Optimization of the canola oil based vitamin E nanoemulsions
stabilized by food grade mixed surfactants using response surface
methodology Food Chemistry, v 183, 15, 1–7, 2015.
MERKEN, H.M.; BEECHER. G.R. Measurement of food flavonoids by high-
performance liquid chromatography: a review. Journal of Agricultural and
Food Chemistry, 48, pp. 577–599, 2000
NACZK, M.; SHAHIDI, F. Phenolics in cereals, fruits and vegetables: Occurrence,
extraction and analysis – Review. Journal of Pharmaceutical and
Biomedical Analysis. v 41, 1523. 2006.
NASCIMENTO, W. M. O.; CARVALHO, J. E. U.; MÜLLER, C. H. Propagação do
Abricoteiro. Comunicado técnico - EMBRAPA. ISSN 1517-2201. 2008.
NOVÁKOVÁ, L.; SPACIL, Z.; SEIFRTOVA, M.; OPLETAL, L.; SOLICHA, P. Rapid
qualitative and quantitative ultra high performance liquid chromatography
method for simultaneous analysis of twenty nine common phenolic
compounds of various structures. Talanta 80, 1970–1979. 2010.
92
NUUTILA, A. M.; KAMMIOVIRTA, K.; OKSMAN-CALDENTEY, K. –M. Comparison
of methods for the hydrolysis of flavonoids and phenolic acids from onion and
spinach for HPLC analysis. Food Chemistry. v. 76, p. 4519-525, 2002.
PARK, YONG-SEO.; CVIKROVÁ, M.; MARTINCOVÁ, O.; HAM, K.; KANG, S.;
PARK, Y. K.; NAMIESNIK, J.; ROMBOLÀ, A. D.; JASTRZEBSKI, Z. In vitro
antioxidative and binding properties of phenolics in traditional, citrus and
exotic fruits. Food Research International. 74, 37–47, 2015.
PETRARCA, M. H.; RODRIGUES, M. I.; ROSSI, E. A.; SYLOS, C.M. Optimisation
of a sample preparation method for the determination of fumonisin B1 in rice.
Food Chemistry 158 (2014) 270–277.
RODRIGUES, M. I., & IEMMA, A. F. Experimental design and process
optimization. Campinas: Cárita Editora. 2012.
ROSSO, V. V. De.; MERCADANTE. A. Z. Identification and Quantification of
Carotenoids, By HPLC-PDA-MS/MS, from Amazonian Fruits Journal
Agricultural Food Chemistry 55, 5062-5072. 2007.
TOYODA, M.; TANAKA, K.; HOSHINO, K.; AKIYAMA, H.; TANIMURA, A.; SAITO,
Y. Profile of potentially antillergic flavoids in 27 kinds of health tea and green
tea infusions. Journal of Agricultural Food Chemistry, Easton, v. 45, n. 7,
p. 2561-2564, Jul. 1997.
WONG MCY, LEE WTK, WONG JSY, FROST G, LODGE. An approach towards
method development for untargeted urinary metabolite profiling in
metabonomic research using UPLC/QTOF-MS. Journal of
Chromatography, v. 871, p: 341-348, 1570-0232, 2008.
YUAN, H.; WANG, F.; TU, J.; PENG, W.; LI, H. Determination of lovastatin in
human plasma by ultra-performance liquid chromatography-electrospray
ionization tandem mass spectrometry and its application in a pharmacokinetic
study. Journal of Pharmaceutical and Biomedical Analysis 13;46(4):808-
13, 2008.
95
Espectros obtidos dos compostos estudados na identificação dos fenólicos
em abricó utilizando um LC/MS-MS.
Fig 1. Espectro MS representativo do composto ácido gálico e seus respectivos fragmentos.
Fig 2. Espectro MS representativo do composto quercetina e seus respectivos
fragmentos.
96
Fig 3. Espectro MS representativo do composto kaempferol o e seus respectivos fragmentos.
Fig 4. Espectro MS representativo do composto ácido 3,4 dihidroxibenzoico o e
seus respectivos fragmentos.
97
Fig 5. Espectro MS representativo do composto ácido caféico o e seus respectivos
fragmentos.
Fig 6. Espectro MS representativo do composto ácido p-coumárico o e seus respectivos fragmentos.
98
Fig. 7. Perfil cromatográfico obtido no DAD para a polpa do abricó liofilizada, para
um dos lotes obtidos de Belém.
:
0 2 4 6 8 10 12 14 16 18 Time (min)
0
100000
200000
300000
400000
500000
600000
700000
800000
900000
1000000
1100000
1200000
uAU
3,4 dihidroxibenzóico
kkkkkk
99
Cap IV
Estudo da composição dos ácidos graxos e tocoferóis
presentes na polpa do abricó (Mammea americana), fruta
da região amazônica brasileira
Pollyane da Silva Port’s1, Wellington Oliveira1, Helena Teixeira Godoy1
Artigo em preparação para ser publicado no periódico food Reserch International
1 Departamento de Ciência de Alimentos, Faculdade de Engenharia de Alimentos,
Universidade Estadual de Campinas (UNICAMP), CEP 6121, 13083-862, Campinas,
SP, Brasil.
101
RESUMO
O Brasil é um país com grande diversidade em espécies de frutas tropicais, no
entanto ainda pouco exploradas, mas com um enorme potencial agroindustrial.
Neste contexto a Mammea americana, conhecida popularmente como abricó,
torna-se interessante para o estudo proposto, por apresentar dados escassos
quanto a composição de ácidos graxos e os tocoferóis presentes na polpa. Por
isso este estudo visou avaliar a fruta M. americana, obtida de dois estados
brasileiros (Belém/PA e Manaus/AM) e de 2 acessos (Kamatá 1 e 2) fornecidos
pela EMBRAPA – Amazônia. O perfil dos ácidos graxos foi obtido através de
cromatografia gasosa acoplada a um detector de ionização de chama (GC-FID) e
a confirmação dos mesmos foi realizado por meio de cromatografia gasosa
acoplada a espectrômetria de massas, tipo quadrupolo, (CG-MS). Foram
analisados quatro dos isômeros da vitamina E (tocoferol) através da técnica de
cromatografia líquida de alta eficiência (HPLC) com fase normal e um detector de
fluorescência. Os resultados obtidos para a polpa de abricó mostraram que a
polpa apresenta os ácidos láurico, mirístico, palmítico, esteárico, lignocerico,
palmitoleico, oleico, linoleico e linonênico. Do total aproximadamente 60% são
insaturados. Dentre os ácidos graxos encontrados as maiores parcelas foram
atribuídos ao ácido palmitoleico com 26%, juntamente com o ácido oleico 20%, o
ácido linoleico com 20% e o ácido linolênico com 17%. Para análise dos
homólogos do tocoferol apenas o alfa-tocoferol foi detectado na concentração de
aproximadamente 1,1 µg.g-1 para todas as amostras. Os resultados obtidos são
importantes para o levantamento de dados de frutas pouco conhecidas,
provenientes da região amazônica brasileira. Além disso, os resultados mostraram
que o abricó possui quantidade significativa de ácidos graxos e tocoferóis,
compostos estes importantes na dieta.
Palavras-chave: Abricó, Vitamina E, ácidos graxos.
102
ABSTRACT
Brazil is a country with great diversity in tropical fruit species, which are still largely
unexplored, but with enormous potential agroindustrial. In this context the
Mammea americana, popularly known as apricot, becomes interesting for the
proposed study, due to its scarce data on the composition of fatty acids and
tocopherols present in the pulp. Therefore this study aimed to evaluate the
M.ammericana fruit, obtained from two Brazilian states (Belém/PA and
Manaus/AM) and 2 accesses (Kamatá 1 e 2) provided by EMBRAPA - Eastern
Amazon. The identification and quantification of fatty acids using a gas
chromatograph coupled to a flame ionization detector (GC-FID) and confirmation of
these compounds was performed by a gas chromatograph coupled to a
quadrupole mass spectrometer (GC-MS). Four isomers of vitamin E (tocopherol)
were analyzed using the technique of high-performance liquid chromatography
(HPLC) on normal phase coupled with a fluorescence detector. The results showed
that the pulp has lauric, myristic, palmitic, stearic, lignoceric, palmitoleic, oleic,
linoleic and linonênico. Among the compounds found the larger portion were
attributed to palmitoleic acid with 26% along with 20% oleic acid, 20% linoleic acid,
and 17% linolenic acid. For analysis of the tocopherol homologues only alpha-
tocopherol was detected at a concentration of approximately 1,1 μg.g-1 for all
samples. These results are important for the data base collection of fruits that are
not well known from the Brazilian Amazon region. The results showed that apricot
has significant quantities of fatty acids and tocopherols that are important
compounds for our diet.
Keywords: Apricot, Vitamin E, fatty acids
103
1. Introdução
No Brasil, diversas espécies não-tradicionais vêm sendo utilizadas pelas
populações locais, pelo grande potencial para exploração no mercado de consumo
in natura e/ou industrializado. No entanto, são espécies que necessitam ser
preservadas, cultivadas racionalmente e caracterizadas através do estudo de suas
propriedades, visando sua utilização no mercado de alimentos funcionais. Além
disso, existe uma demanda cada vez maior nos mercados interno e externo por
novos sabores, cores e texturas (LORENZI et al., 2002).
A bacia amazônica é rica em recursos genéticos de frutas e oleaginosas e
sua exploração econômica é de grande importância para a região. Entre as frutas
e oleaginosas extraídas na Amazônia, há espécies excepcionalmente ricas em
micronutrientes, em particular antioxidantes, tais como carotenoides (tocoferóis),
antocianinas e outros polifenóis (ROSSO & MERCADANTE, 2007)
Neste sentido o abricó (Mammea americana L.), torna-se uma fruta
interessante para estudos uma vez que é uma fruta ainda silvestre pertencente à
família da garcinia (Clusiaceae), originária das Índias Ocidentais e do norte da
América do Sul (CAVALCANTE, 1991) sua colheita ainda tem caráter extrativista e
dados relacionados à sua produção, comercialização e aos seus constituintes
químicos ainda são escassos, sabe-se, porém que no atual cenário, a demanda é
pequena e destinada apenas aos consumidores locais (BRAGA et al., 2010).
O abricó é um fruto grande com 7-15 cm de diâmetro, coberto com uma
casca espessa e resistente, contém uma polpa amarela e brilhante de um
agradável sabor e aroma perfumado que é consumido cru e também usado para
conservas. Suas sementes (1-4) são grandes amargas e resinosas e são
utilizadas como um agente vermífugo (MORALES & DUQUE, 2010).
Tanto os ácidos graxos monoinsaturados e poli-insaturados, quanto aos
componentes lipídicos menores, tais como tocoferóis e fitosteróis, desempenham
um papel importante na nutrição humana e saúde. Dietas ricas nestes compostos
tendem a diminuir a pressão arterial e níveis de colesterol total no sangue dos
seres humanos (TURAN et al., 2007).
104
Com base nestas informações a determinação do perfil dos ácidos graxos
insaturados presente nos alimentos é de extrema importância, já que estudos
relacionados a sua ingestão mostram que estes compostos possuem impactos
benéficos à saúde como, por exemplo, na prevenção de doenças cardiovasculares
(ATTAR-BASHI, et al., 2004; GROOTVELD, et al., 2001)
A vitamina E, termo genérico utilizado para designar diferentes compostos,
nomeados α-, β-, γ- e δ- (alfa, beta, gama e delta) tocoferóis, tem sido
extensivamente estudada em diversas áreas do conhecimento, assim como os
ácidos graxos, uma vez que desempenham papéis especialmente importantes na
reprodução e em mecanismos antioxidantes de tecidos animais e vegetais. Esse
composto tem despertado interesse e preocupação, principalmente nesta última
década, uma vez que compõe juntamente com a vitamina C, β-caroteno, selênio e
flavonoides, o grupo denominado antioxidantes alimentares. Este grupo também
tem sido frequentemente associado à prevenção de doenças neurodegenerativas,
aterosclerose, inflamação crônica, câncer e envelhecimento precoce (GUINAZI et
al., 2009).
Poucos trabalhos têm pesquisado a composição completa dos isômeros da
vitamina E em alimentos, sendo que a maioria tem relatado apenas o conteúdo do
α-tocoferol. Além disso, as tabelas brasileiras de composição de Alimentos ainda
não contemplam os diferentes isômeros da vitamina E, o que torna importante as
pesquisas envolvendo a composição completa em alimentos brasileiros (GUINAZI
et al., 2009).
Diversas técnicas têm sido aplicadas para separação e quantificação destes
compostos nas mais variadas matrizes orgânicas e podem ser utilizadas de
acordo com os objetivos da análise e da natureza da amostra. Entretanto, a
cromatografia líquida com detecção por fluorescência para tocoferóis e a gasosa
acoplada ao detector de ionização de chama para os ácidos graxos tem sido
extensivamente aplicadas e são preferidas pela grande maioria dos pesquisadores
da área (PINHEIRO-SANT’ANA et al., 2011).
Por isso se faz importante investigar a composição lipídica de novas fontes
de nutrientes e compostos bioativos para a dieta, já que estudos no que diz
105
respeito à composição química lipídica do abricó ainda não existem. Assim, este
trabalho teve como objetivo avaliar a composição dos isômeros de tocoferol assim
com obter a composição dos ácidos graxos presentes na polpa do abricó (dos
diferentes Estados) que é uma fruta ainda pouco explorada, o que proporcionará
informações a respeito de substâncias benéficas à saúde.
2. MATERIAL E MÉTODOS
2.1. Amostras
As frutas provenientes de acessos (Kamatá 1 e Kamatá 2), utilizadas neste
trabalho foram fornecidas pela Embrapa Amazônia Oriental, Belém/ Pará, in
natura em um único lote para cada um dos acessos. As demais foram obtidas no
comércio local de Belém/PA e em Manaus/AM, em três lotes, para cada lote foram
adquiridos 3 a 4 frutos (2011-2012-2013), especificamente no mês de julho de
cada ano.
Os frutos obtidos foram descascados, cortados e levados para liofilização. As
amostras após serem liofilizadas foram então moídas e acondicionadas em sacos
metálicos (ao abrigo de luz) e seladas a vácuo (livres de O2) e posteriormente
armazenadas em freezer (-18 ºC) até o momento das análises.
2.2. Reagentes e solventes
Para a preparação das amostras, foram utilizados os seguintes reagentes de
qualidade analítica: acetato de etila, hexano e isopropanol (Synth, Brasil), sulfato
de sódio (Vetec, Brasil), e butil-hidroxitolueno (BHT) (Synth, Brasil). Os padrões
utilizados (α-, β-, γ- e δ-tocoferóis) foram adquiridos a partir de Calbiochem®, EMD
Biosciences, Inc. (EUA) e armazenados a -18 ° C até a utilização. Os padrões de
ésteres metílicos do C4 ao C24 (FAME Mix), foram adquiridos da Supelco (EUA).
As fases móveis foram preparadas utilizando reagentes de grau HPLC:
hexano e isopropanol (Mallinckrodt, EUA) e ácido acético (Merck, Brasil). As
soluções de estoque padrão de tocoferol foram preparadas por dissolução em
hexano de grau HPLC contendo 0,01% de BHT nas concentrações de 100 mg.L -1.
A solução-mãe padrão de ésteres metílicos de ácidos graxos foi preparada em
106
hexano grau HPLC. Soluções de reserva dos padrões foram filtrados em filtro
Millipore de 0,45 µm (PVDF - Millipore, EUA), armazenada a -18 °C e protegidas
da luz. Os frascos contendo as soluções de trabalho foram colocados em
ultrassons durante 5 min antes da injeção.
A filtração das amostras incluiu o uso de papel de filtro Whatman n°1 (J.
Prolab, Brasil), seringas de 3 ml estéreis (Rymco, Colômbia), e unidades de filtro
de polietileno Millex HV (Millipore, 0,22 µm, Brasil).
2.3. Extrações
2.3.1 Lipídios Bligh-Dyer
Um dos procedimentos de extração mais versáteis e efetivos, é a
metodologia de Bligh & Dyer 1959, uma versão simplificada do procedimento
clássico usando clorofórmio-metanol proposto por Folch et al. (1957). Para
extração foram pesadas aproximadamente 1g de amostra em tubos de ensaio
com tampa. Em seguida foram adicionados 5 mL de clorofórmio, 10 mL de
metanol e 4mL de água, tornando a proporção 1:2:0,8, respectivamente. Os tubos
foram agitados por 15 minutos e logo em seguida, foram adicionados mais 5 mL
de clorofórmio e 5 mL sulfato de sódio (1,5%). Os tubos foram então agitados
novamente por mais 2 minutos e centrifugados a 3000 g-1 por 5 minutos. O
sobrenadante foi descartado e a fase inferior foi filtrada em papel Whatman nº 1,
com aproximadamente 1 g de Na2SO4 anidro. O filtrado foi evaporado até a secura
com N2 e armazenado a -18 ºC até o momento da análise.
2.3.2. Ésteres metílicos de ácidos graxos
Para a análise dos ésteres metílicos foi utilizado o método proposto por
Joseph & Ackman (1992) com pequenas modificações, onde o extrato obtido por
Bligh-Dyer, foi pesado em tubos com tampa e resuspendidos em 4 mL de NaOH
0,5 mol L-1 em solução com metanol. Os tubos foram levados para aquecimento
em banho a uma temperatura de aproximadamente 100 ºC por 10 minutos.
Posteriormente, foram adicionados aos tubos, 3 mL de trifluoreto de boro (BF3 -
12% em solução com metanol) e levados novamente para serem aquecidos por
107
mais 5 minutos. Depois de resfriados à temperatura ambiente, 4 mL de uma
solução saturada de NaCl foi adicionada no tubo sob agitação. Logo em seguida,
4 mL de hexano foi adicionado e toda a mistura foi submetida a agitação vigorosa
em vórtex. Os tubos ficaram em repouso até a separação das fases. A fase
superior foi recolhida e o resíduo foi lavado com 2 mL de hexano por 3 vezes. As
fases recolhidas foram então combinadas e concentradas até a secura em
evaporador rotativo e ressuspendida novamente em 2 mL de hexano. O extrato foi
armazenado a -18 ºC até o momento da análise. Todo o experimento foi
preparado em triplicata (n = 3).
2.3.3. Tocoferóis
Para a análise de tocoferóis, utilizou-se a metodologia empregada por
Pinheiro-Sant’anna et al. (2009). Os extratos obtidos por Bligh-Dyer, foram diluídos
em hexano na concentração de 10mg/mL (hexano contendo 0,01% de BHT),
filtrados através de uma membrana de PVDF de 0,22µm (Millipore, USA), e
imediatamente injetados no sistema de cromatografia líquida de alta eficiência.
2.4. Determinação dos ácidos graxos CG-FID
Para as análises cromatográficas utilizou-se o método de Ballus et al.
(2014). Foi utilizado um cromatógrafo de gás modelo 7890 (Agilent, Alemanha)
equipado com uma coluna capilar de sílica fundida com 50% de cianopropil metil
polisiloxano modificado (60 m de comprimento, 0,25 mm de diâmetro interno, 0,25
mm de espessura de filme) (Part number: 122-2362, Agilent, Alemanha), um
detector de ionização de chama (FID) e um injetor tipo spli/splitless, com razão de
split 1:25. Os parâmetros utilizados para determinação foram temperatura do
injetor (250 ºC), temperatura do detector (280 ºC), H2 como gás de arraste com
taxa de fluxo de 1,0 mL min-1, e no detector (H2: N2: ar sintético – 30: 30: 300
mL.min -1). A rampa de temperatura foi iniciada com 50 ºC passando para 175 ºC
com taxa de ajuste de 25 °C/min, posteriormente aumentada para 230 ºC a uma
taxa de ajuste de 4 ºC/min, totalizando assim 35,5 minutos de corrida A
identificação dos picos foi feita por comparação dos tempos de retenção dos
108
padrões, obtidos nas mesmas condições, e os tempos de retenção dos picos
observados para as amostras. Os resultados da área são expressos em
porcentagem de área total, ou seja, área do pico de um determinado ácido graxo
em relação à área total (somatório da área de todos os picos de ácidos graxos).
As amostras foram injetadas todas em triplicata.
2.5. Confirmação da identidade dos ésteres metílicos por CG/MS
A identificação dos ésteres metílicos de ácidos graxos foi realizada em
cromatógrafo gasoso (CG) 7890A (Agilent, Alemanaha) acoplado a um detector de
massas (MS) tipo quadrupolo. Para separação dos ésteres, utilizou-se uma coluna
HP-5 (Aginet, Alemanha) de 30 metros de comprimento x 0,32 mm de diâmetro e
fase estacionária de 0,50 µm de revestimento. Os ésteres (1µL) foram injetados
em modo split (1:25). O fluxo do gás de arraste (He) foi ajustado para 0,5 mL/min,
a temperatura do injetor foi de 250ºC, a temperatura inicial do forno foi de 50 ºC
aquecendo a uma taxa de 1 °C/ min até atingir a temperatura de 110 ºC em
seguida aumentou-se a taxa para 3 ºC/ min até atingir uma temperatura de 310 ºC
onde permaneceu por mais 3 minutos, totalizando uma corrida de 129,67 minutos.
O fluxo de saída da coluna do CG para o espectrômetro de massas foi
ajustada para uma temperatura de 250 ºC. A fonte de ionização por impacto de
elétrons (EI) do MS foi ajustado para 70 eV a uma temperatura de 200 ºC. O
quadrupolo foi operado a uma temperatura de 150 ºC no modo scan, com intervalo
de monitoramento entre 50 e 500 m/z. Os dados foram obtidos através de um
software ChemStation® (USA) utilizado para aquisição e processamento de dados.
A identificação dos ésteres metílicos de ácidos graxos foi realizada por tentativa
em comparação com os espectros da biblioteca virtual NIST® (versão 2011) e de
forma positiva por comparação de espectros das amostras com os dos padrões
analíticos injetados.
109
2.6. Tocoferóis
As análises dos tocoferóis foram realizadas utilizando um cromatógrafo à
líquido de alta eficiência (HPLC) Agilent 1100 (Agilent Technologies, Alemanha)
acoplado a um detector de fluorescência, sistema de bomba quaternária, injetor
automático e forno para controlar a temperatura da coluna. As condições do
método foram realizadas de acordo com os trabalhos de Souza et al. (2015),
Ballus et al. (2014) e Pinheiro-Sant'ana et al. (2011). Foi utilizada uma coluna com
dimensões de 150 mm x 4,6 mm x 3,0 µm de fase normal (sílica Hypersil, Thermo,
Alemanha) foi utilizada. A fase móvel consistiu de um sistema isocrático composto
de hexano: isopropanol: ácido acético (98,9: 0,6: 0,5) com um fluxo de 1,0 mL min -
1 A temperatura foi mantida a 30 °C, e o volume de injeção foi de 100 µL. A
detecção da fluorescência foi realizada em λEx 290 nm e λEm 330 nm. Os
compostos foram identificados por comparação dos tempos de retenção dos
compostos encontrados nas amostras com o padrão dos homólogos do tocoferol
separados sob as mesmas condições bem como por co-cromatografia e a
quantificação foi realizada através de uma curva padrão (padronização externa)
contendo 10 pontos com concentração entre 10 e 55 ng.µL-1. Todas as amostras
foram injetadas em triplicata.
2.7. Análise Estatística
O tratamento estatístico dos dados foi realizado através da Análise de
Variância (ANOVA), e as médias foram comparadas pelo teste de Tukey ao nível
de 95% de confiança. Todas as análises estatísticas foram realizadas no software
Statistica 7.0 (Statsoft, USA).
3. RESULTADOS E DISCUSSÃO
3.1. Composição de ácidos graxos
Na Figura 1 tem-se o perfil cromatográfico obtido para uma das amostras de
abricó proveniente de Belém. As amostras da polpa de abricó não apresentaram
diferenças representativas quanto perfil cromatográfico dos principais ésteres
metílicos.
110
O perfil dos ácidos graxos, presentes nas polpas do abricó, identificados pelo
método do CG-FID, estão apresentados na Tabela 2.
Figura 1. Cromatograma da composição de ácidos graxos por CG-FID para uma das amostras de Belém (B1). As condições cromatográficas estão descritas no texto. Os números identificam os ácidos graxos correspondentes à Tabela 1.
111
Tabela 1. Teores de ácidos graxos obtidos da polpa de abricó (média ± desvio padrão, n = 3)
Ácidos
Graxos*
Teores de ácidos graxos (% da área relativa) por ano de coleta
Belém
1º Lote
Belém
2º Lote
Belém
3º Lote
Manaus
1º Lote
Manaus
2º Lote
Manaus
3º Lote
Kamatá
1
Kamatá
2
1 12:0 4,27±0,08ª 3,99±0,40ª 5,69±0,59ª 4,91±1,53ª 4,53±0,07ª 5,59±0,14ª 4,18±0,73ª 2,97±0,35ª
2 14:0 4,29±0,05ª 3,83±0,16ª 5,98±0,72ª 4,88±1,15ª 4,96±0,25ª 5,24±0,09ª 3,96±0,62ª 2,69±0,22ª
3 16:0 28,66±2,10ª 25,31±1,08ª 29,75±2,34ª 27,91±3,20ª 28,40±1,28ª 28,88±0,88ª 22,70±2,32ª 27,55±0,59ª
4 16:1 1,13±0,25ª 0,92±0,02ª 0,96±0,20ª 1,27±0,16 ª 1,20±0,27ª 1,11±0,16 ª 0,71±0,09b nd***
5 18:1 n9c 21,05±7,23ª 30,46±2,96a 19,35±4,78b 17,77±3,79b 17,60±4,54b 13,84±3,05b 35,98±6,37 a 19,70±0,38b
6 18:2 n6c 22,95±0,40b 17,35±1,20b 16,74±3,38b 22,28±3,69b 19,61±0,84b 23,19±0,86b 12,85±0,64c 29,49±2,52ª
7 18:3 n3 17,83±2,01ª 16,95±0,41ª 20,15±2,02ª 17,64±6,46ª 21,50±2,18ª 19,79±0,03ª 18,34±2,23ª 15,82±0,30ª
8 24:0 4,57±1,44ª 1,82±0,28b 2,57±0,89 b 3,21±0,20b 2,20±0,19b 2,37±0,07b 1,98±0,37b 3,14±0,43b
Sat. 38,70%B 35,92%B 39,85%B 40,98B 40,09B 43,41B 50,35 A 35,35B
Ins. 61,30%A 64,08%A 60,15%A 57,84 A 59,91A 56,59A 49,65A 64,65A
*nomenclatura de ácidos graxos: 12:0, ácido láurico 14:0, ácido mirístico 16:0, ácido palmítico; 16:1, ácido palmitoléico; 18:1n-9, ácido oleico;
18:2n-6, ácido linoleico; 18:3n-3, ácido α-linolênico; 24:0, ácido lignocérico. **Diferenças significativas na mesma coluna são indicadas com letras maiúscula diferentes. Diferenças significativas na mesma linha são indicadas com letras minúsculas diferentes (A - B)
***nd = não detectado.
112
Dentre os compostos encontrados na polpa do abricó (Tabela 1) estão o
ácido láurico (C12:0), ácido mirístico (C14:0), ácido palmítico (C16:0), ácido
palmitoléico (C16:1), ácido oléico (C18:1n9cis), ácido linoléico (C18:2-cis),
ácido linolênico (C18:3n-6cis) e o ácido lignocérico (C24:0). Apenas para o lote
K2 não foi detectado o C16:1, provavelmente pela baixa concentração deste
composto.
O perfil dos ésteres metílicos do abricó avaliado neste trabalho
apresentou os ácidos graxos insaturados oleico, linoleico e linolênico (C18:1 –
20%, C18:2 – 20% e C18:3 – 18,5%), seguido pelo ácido palmítico (C16:0 –
26%). Para todos os lotes das diferentes localidades apresentaram prevalência
de ácidos graxos insaturados, sendo a porcentagem encontrada no 3º lote de
Belém juntamente com o Kamatá 2 (64%), o que é considerado uma
característica positiva do ponto de vista nutricional. Os óleos da polpa
apresentaram elevados teores de ácido linolênico ou ômega-3 (C18:3) (18,5%),
considerado ácido graxo essencial à alimentação humana. Este ácido graxo
possui efeito hipocolesterolêmico, considerado útil na redução do risco de
várias doenças e poderá ser consumido na forma in natura, o que é uma
vantagem nutricional, posto que este ácido graxo é altamente insaturado e
suscetível à oxidação pelo aquecimento.
O ácido esteárico (C18:0) também foi encontrado para algumas das
amostras, entretanto, como a resolução não foi adequada, na maioria dos
casos não foi quantificado, em termos de porcentagem, como pode visto no
cromatograma da amostra B1 (Fig. 1) no tempo de 19 min aproximadamente
(composto X).
As amostras, como mostra a tabela 1, não apresentaram diferença
significativa para os ésteres metílicos de ácidos graxos, e as poucas variações
ocorridas, podem ser consideradas resultantes de variabilidade natural para a
espécie, principalmente por se tratar de uma espécie nativa.
Também pode ser observado dos resultados obtidos na Tabela 1 que não
houve variações significativas (p<0,05) entre as proporções de ácidos graxos
saturados e insaturados na polpa de abricó, em relação ao local e lotes. Nota-
se que a fração insaturada foi significativamente maior que a quantidade de
ácidos graxos insaturados que ficaram em torno dos 60 %. Em comparação
com a parcela saturada.
113
Dados relacionados à composição de ácidos graxos presentes no óleo da
polpa de abricó não foram encontrados. Porém, outros trabalhos, como o de
Wycoff et al. (2015), que encontraram nas polpas de outras frutas regionais tais
como açaí roxo e branco, valores de 12,7%; 7,8%; 4,1% para açaí roxo e para
o açaí branco valores de 26,7%; 6,6%; 4,6% para os C16:1+C18:1, C18:2 e
C18:3 respectivamente. Valores estes próximos aos encontrados para a polpa
de abricó. Lopes et al. (2012), também encontraram em polpas de frutas do
nordeste (araticum e pequi) além de outros compostos o C12:0, C14:0, C16:0,
C16:1, C18:1, C18:2, C18:3, assim como neste presente trabalho. Coimbra
(2012) analisou o óleo de polpa de guariroba, jerivá e macaúba e encontrou o
C12:0, C14:0, C16:0, nas mesmas proporções, entre si, aos encontrados no
respectivo trabalho.
Lutterod et al. (2011), afirmam que a qualidade do óleo está diretamente
relacionado à predominância de ácidos graxos insaturados, uma vez que o
grau de saturação está relacionado à depreciação do produto e o consumo de
óleo com alto grau de saturação está diretamente ligado ao aparecimento de
doenças no ser humano. O ácido linolênico, principalmente, é um dos ácidos
graxos polinsaturados mais importantes na dieta alimentar. Os estudos
realizados para se determinar a importância do metabolismo deste ácido graxo
no corpo humano sugere que ele tem impôrtancia vital na prevenção de
doenças como formação de prostaglandinas e eicosanoides, necessários na
liberação hormonal das glândulas do hipotálamo e da tireóide, principalmente
(BROUWER, et al., 2006).
Foi realizado em seguida a análise de GC-MS dos ésteres metílicos dos
ácidos graxos, presentes na polpa de abricó anteriormente detectados e
quantificados no GC-FID. Verificou-se que o composto que encontrava-se em
baixa concentração não pode ser confirmado, isto ocorreu devido o GC-MS ter
sido operado no modo scan fazendo com que a sensibilidade do equipamento
tenha diminuído sensivelmente. Por isso apenas o 16:1 não foi confirmado.
Notou-se que dos compostos encontrados na polpa apenas o lignocérico,
não foi encontrado em alguns lotes (B2, M2 e K1), isto se deu, talvez devido a
baixa concentração deste composto. Para os demais compostos todos foram
confirmados. Na análise por CG-MS também pode ser confirmado à presença
114
do esteárico, composto este que não pode ser quantificado pelo FID devido o
mesmo estar co-eluido com um interferente.
3.2. Composição de Tocoferóis
Dados relacionados à composição dos homólogos da vitamina E, na
polpa de abricó, não foram encontrados na literatura. A Figura 2 apresenta um
perfil cromatográfico obtido para a mistura da solução-padrão dos quatro
isômeros da vitamina E estudados. A eluição dos compostos seguiu a ordem
característica e já bem estabelecida pela literatura para análises utilizando
sistema de fase normal: α-tocoferol, β- tocoferol, γ- tocoferol e δ- tocoferol.
Figura 2. Cromatogramas da mistura de padrões de tocoferóis (A) e uma das amostra
da polpa de abricó B1. As condições cromatográficas estão descritas no texto.
De todos os isômeros estudados da vitamina E, apenas o α-tocoferol foi
encontrado na polpa. A concentração do α-tocoferol nas amostras de abricó
analisados, estão apresentada na Tabela 3.
Relevante para essa observação em relação a presença do α-tocoferol é
o fato de ele também ser conhecido por estar concentrado principalmente em
min3 4 5 6 7 8 9
LU
15
20
25
30
35
40
FLD1 A, Ex=290, Em=330 (POLLY\TOCO000117.D)
min3 4 5 6 7 8 9
LU
15
20
25
30
35
40
FLD1 A, Ex=290, Em=330 (POLLY\TOCO000089.D)
alfa
(B)
(A) beta
gama
delta
alfa
115
tecidos que metabolizam ativamente (por exemplo, nas célula cloroplastos), ao
passo que os outros tocoferóis são mais encontrados em tecidos dormentes,
como em óleos de sementes (KAMAL-ELDIN & ANDERSSON 1997).
Tabela 2. Concentração de α-tocoferol presente na polpa liofilizada do abricó
Amostras Teor de alfa tocoferol
(µg.g-1 de óleo)*
Teor de alfa tocoferol
(µg/100g de fruta)**
B1 (2011) 0,76±0,11ª 1,52±0,33ª
B2 (2012) 1,05±0,05ª 2,11±0,10ª
B3 (2013) 1,18±0,10ª 2,37±0,20ª
M1 (2011) 1,04±0,13ª 2,09±0,25ª
M2 (2012) 0,86±0,08ª 1,73±0,16ª
M3 (2013) 1,23±0,11ª 2,47±0,23ª
K1 (2012) 0,84±0,05ª 1,67±0,10ª
K2 (2012) 1,23±0,11ª 2,47±0,23ª
*Valores representam a média de triplicata ± o desvio padrão, seguidas de letras
diferentes, minúsculas na coluna, diferem estatisticamente entre si pelo teste de Tukey a 5% de probabilidade. **Valores dados em fruta liofilizada
Nota-se, através dos dados, que concentração do α-tocoferol da vitamina
E presente na polpa de abricó não diferiu estatisticamente (p > 0,05) em
relação ao local de procedência dos frutos bem como entre os lotes da mesma
localidade, variando de 1,52 até 2,47 µg/100g de fruta liofilizada. Esses
resultados mostraram que tanto a concentração bem como a composição não
mudaram em relação à localidade e épocas de colheita dos frutos.
Vilela et al. 2013, estudaram em 12 cultivares de manga (polpa) a
presença dos isômeros da vitamina E, e o α-tocoferol também foi o único
detectado em todas as amostras de manga estudadas.
Charoensiri et al. (2009), encontraram em uma grande variedades de
frutas frescas, totalizando 37 tipos, resultados de alfa tocoferol que variaram
desde não detectável até 1,43 mg/100g, sendo que os maiores valores foram
encontrados no durião (variedade ''chanee") e na manga verde (variedade
‘kheosawoei’).
116
Kamal-Eldin & Andersson (1997), realizaram um estudo estatístico
utilizando uma técnica multivariada de análise de componentes principais
(PCA) tentando estabelecer se havia qualquer correlação bioquímica entre
conteúdo de tocoferol e percentuais de ácidos graxos em 14 óleos vegetais e
viu que existia uma alta correlação entre os ácidos graxos insaturados,
especificamente 18:1 e 18:2, com a presença do α-tocoferol. Entretanto, os
autores afirmam que outros fatores além do grau de insaturação, também
podem influenciar nos níveis de tocoferol, tais como a natureza dos lipídios, a
estrutura dos lipídios na presença de anti e/ou pró oxidantes, além de outros
fatores como a quantidade de clorofila e/ou outros pigmentos,
fotossensibilizadores que podem está presentes no óleo.
117
CONCLUSÃO
A análise de ácidos graxos no abricó mostrou que existem quantidades
significativas de ácidos graxos insaturados (cerca de 60%). Com relação aos
resultados obtidos para os tocoferóis presentes na polpa do abricó, estes
mostraram-se importantes, já que os valores encontrados na polpa mostraram
quantidades interessantes de α-tocoferol, quando comparadas a outras frutas
exóticas, contribuindo para o consumo da vitamina E, levando em consideração
o índice de ingestão diária que é de 10 mg de α-tocoferol/dia. Os resultados
deste estudo representam uma grande contribuição para a caracterização do
abricó, uma vez que trabalhos desta natureza são escassos para a respectiva
fruta e outras ainda pouco conhecidas da região amazônica, resultados estes
que permitem refletir com maior veracidade os nutrientes consumidos por essa
população.
118
REFERENCIAS
ARAIN, S.; SHERAZI, S. T. H.; BHANGER, M. I.; TALPUR, F. N.;
MAHESAR, S. A. Oxidative stability assessment of Bauhinia purpurea seed oil
in comparison to two conventional vegetable oils by differential scanning
calorimetry and Rancimat methods Thermochim. Acta. 484, 2009.
BALLUS, C. A.; MEINHART, A. D. CAMPOS JR., F. A. de S.; SILVA, L. F.
de O. da; OLIVEIRA, A. F. GODOY, H. T. A quantitative study on the phenolic
compound, tocopherol and fatty acid contents of monovarietal virgin olive oils
produced in the southeast region of Brazil. Food Research International 62
74–83, 2014.
BLIGH, E.G.; DYER,W.J. A rapid method for total lipid extraction and
purification. Canadian Journal of Biochemistry and Physiology. 37:911-917.
1959.
BRAGA, A. C. C.; SILVA, A. E.; PELAIS, A. C. A.; BICHARA, C. M. G.
POMPEU, D. R. Atividade antioxidante e quantificação de compostos bioativos
dos frutos de abricó (Mammea americana). Alimentos e Nutrição, Araraquara
v.21, n.1, p. 31-36. 2010.
BRAUNRATH, R.; ISNARDY, B.; SOLAR, B.; ELMADFA, I. Impact of α-,
γ-, and δ-tocopherol on the radiation induced oxidation of rapeseed oil
triacylglycerols.. Radiation Physics and Chemistry. v 79, 7, p. 764–769, 2010.
BROUWER, I. A.; GEELEN, A.; KATAN, B. M. n-3 Fatty acids, cardiac
arrhythmia and fatal coronary disease. Progress in Lipid Research, v. 45, p.
357-367, 2006.
CAVALCANTE, P. B. Frutas comestíveis da Amazônia. 5.ed. Belém:
CEJUP, 279pag, 1991.
CHAROENSIRI, R.; KONGKACHUICHAI, R.; SUKNICOM, S.;
SUNGPUAG P. Beta-carotene, lycopene, and alpha-tocopherol contents of
selected Thai fruits. Food Chemistry. 113, 202–207, 2009.
COIMBRA, M. C.; JORGE, N. Fatty acids and bioactive compounds of the
pulps and kernels of Brazilian palm species, guariroba (Syagrus oleraces),
jerivá (Syagrus romanzoffiana) and macaúba (Acrocomia aculenta). Journal of
the Science of Food and Agriculture, 92: 679-684, 2012.
119
DO, T. D. T.; COZZOLINO, D.; MUHLHAUSLER, B.; BOX, A.; ABLE, A. J.
Antioxidant capacity and vitamin E in barley: Effect of genotype and storage.
Food Chemistry 187 (2015) 65–74.
FOLCH, J.; LEES, M.; SLOANE S. G. H. A simple method for the isolation
and purification of total lipides from animal tissues. The Journal of Biological
Chemistry, 226:497-509, 1957.
FOSTER, R.; WILLIAMSON, C. S.; LUNN, J.; Culinary oils and their
health effects. Food and Nutrition Bulletin. 34, 4. 2009.
GÓRNAŚ, P. Unique variability of tocopherol composition in various seed
oils recovered from by-products of apple industry: Rapid and simple
determination of all four homologues (α, β, γ and δ) by RP-HPLC/FLD. Food
Chemistry. v. 172, 129–134, 2015.
GUINAZI, M.; MILAGRES, R. C. R. M. PINHEIRO-SANT’ANA, H. M.
CHAVES, J. B. P.. Tocoferois e tocotrienois em óleos vegetais e ovos. Química
Nova, v. 32, n. 8, 2098-2103, 2009.
JOGLEKAR, A. M.; MAY, A. T. Product excellence through design of
experiments. Cereal Food World, 32 (1987), pp. 857–868.
KAMAL-ELDIN, A.; ANDERSSON, R. A Multivariate Study of the
Correlation Between Tocopherol Content and Fatty Acid Composition in
Vegetable Oils. Journal of the American Oil Chemists Society, v. 74, n. 4
1997.
LOPES, R. M.; SILVA, J. P. VIEIRA, R. F.; SILVA, D. B.; GOMES, I. S.;
AGOSTINI-COSTA, T. S. Composição de ácidos graxos em polpa de frutas
nativas do cerrado. Revista Brasileira de Fruticultura, Jaboticabal - SP, v. 34,
n. 2, p. 635-640, 2012.
LORENZI, H. et al. Frutas brasileiras e exóticasss cultivadas (de
consumo in natura). São Paulo: Instituto Plantarum de Estudos da Flora,
672p. 2006.
LUTTERODT, H., SLAVIN, M., WHENT, M., TURNER, E., YU, L. Fatty
acid composition, oxidative stability, antioxidant and antiproliferative properties
of selected cold-pressed grape seed oils and flours. Food Chemistry. v. 128:
391-399, 2011.
120
MEHMOOD, TAHIR. Optimization of the canola oil based vitamin E
nanoemulsions stabilized by food grade mixed surfactants using response
surface methodology. Food Chemistry, v. 183, p 1–7, 2015
MORALES, A. L.; DUQUE, C. Free and glycosidically bound volatiles in the
mammee apple (Mammea americana) fruit. European Food Research and
Technology. 215:221–226, 2002.
PINHEIRO-SANT’ANA, H. M.; GUINAZIA, M.; OLIVEIRA, D. DA S.;
LUCIA, C. M. D. REISA, B. L.; BRANDÃO, S. C. C. Method for simultaneous
analysis of eight vitamin E isomers in various foods by high performance liquid
chromatography and fluorescence detection. Journal of Chromatography A. v
1218, 47, 25, 8496–8502, 2011.
ROSSO, V V. DE.; MERCADANTE, A. Z. Identification and Quantification
of Carotenoids, By HPLC-PDA-MS/MS, from Amazonian Fruits. Journal of
Agricultural and Food Chemistry, 55, 5062-5072, 2007.
SOUZA, D. S.; BALLUS, C. A.; OLIVEIRA, W. S.; GODOY, H. T. Cap IV -
Perfil quantitativo de tocoferóis e ésteres metílicos de ácidos graxos da
semente de tamarindo (Tamarindus indica L.) provenientes de três
Estados brasileiro. In: Caracterização e avaliação da capacidade antioxidante
da polpa liofilizada enriquecida com compostos bioativos da semente de
Tamarindo (Tamarindus indica L.). 2015, 149f. Tese (Doutorado em Ciências
de Alimentos) – Faculdade de Engenharia de Alimentos, Universidade Estadual
de Campinas, São Paulo. 2015.
TURAN, S.; TOPCU, A.; KARABULUT, I.; VURAL, H.; HAYALOGLU, A. A.
Fatty acid, triacylglycerol, phytosterol, and tocopherol variations in kernel oil of
malatya apricots from turkey. Journal of Agricultural and Food Chemistry,
55, 10787–10794, 2007.
VILELA, C.; SANTOSA, S. A. O.; OLIVEIRA, L.; CAMACHO, J. F.;
CORDEIRO, N.; FREIREA, C. S. R.; SILVESTRE, A. J. D.;. The ripe pulp of
Mangifera indica L.: A rich source of phytosterols and other lipophilic
phytochemicals. Food Research International. v 54, Issue 2, 1535–1540,
2013.
WAGNER, K.-H., ELMADFA, I. Effects of tocopherols and their mixtures
on the oxidative stability of olive oil and linseed oil under heating. European
Journal of Lipid Science and Technology 102, 624–629. 2000.
121
WYCOFF, W.; LUO, R.; SCHAUSS, A. G.; NEAL-KABABICK, J.; SABAA-
SRUR, A. U. O.; MAIA, J. G. S.; TRANG, K.; RICHARDS, K. M. E. SMITH, R.
E. Chemical and nutritional analysis of seeds from purple and white açaí
(Euterpe oleracea Mart.). Journal of Food Composition and Analysis. v. 41,
181–187, 2015.
123
CONCLUSÃO GERAL
Neste trabalho, o conteúdo dos compostos fenólicos, da capacidade
antioxidante, de tocoferóis e ácidos graxos utilizando diferentes técnicas
analíticas foram analisadas. Este estudo é o primeiro sobre a composição
química desta fruta da região amazônica. Levando em consideração que
sempre há necessidade de adaptação das metodologias, por isso o
planejamento composto central, se mostrou uma ferramenta estatística
bastante importante, tanto para a aplicação da extração como também para
obtenção das melhores condições para a etapa de hidrólise.
O abricó apresentou uma significativa capacidade antioxidante para o
método de ORAC (CAP II), o que mostra uma ação antioxidante por parte de
outros compostos, além dos fenólicos, já que para está análise os resultados
obtidos foram relativamente baixos, resultados estes corroborados no CAP III,
na qual mostra os baixos teores encontrados para estes compostos que foram
obtidos através da técnica de cromatografia líquida.
Para as análises de ácidos graxos (CAP IV) observou-se que a polpa de
abricó apresentou um perfil com um alto índice de ácidos graxos insaturados,
aproximadamente 60%, o que a torna interessante, já que a ingestão de
alimentos com este perfil possui impactos benéficos a saúde como, por
exemplo, na prevenção de doenças cardiovasculares. Com relação aos
homólogos da vitamina E, esta fruta apresentou quantidades relevantes de
alfa-tocoferol, que foi detectado na concentração de aproximadamente 1,1
µg.g-1 para todas as amostras, quantidade está significativa quando
comparadas a outras frutas da região. Assim, estes resultados além de
proporcionar maiores dados sobre essa fruta mostra também que o abricó é
uma fruta interessante como fonte de compostos bioativos.