ECOLOGIA ALIMENTAR DE AVES INSET VORAS DE UM … · os períodos de chuva e seca na Mata do Olho...
Transcript of ECOLOGIA ALIMENTAR DE AVES INSET VORAS DE UM … · os períodos de chuva e seca na Mata do Olho...
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE BIOCIÊNCIA
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS BIOLÓGICAS MESTRADO EM CIÊNCIAS BIOLÓGICAS
ECOLOGIA ALIMENTAR DE AVES INSETÍVORAS DE UM FRAGMENTO DE MATA DECÍDUA DO EXTREMO NORTE
DA MATA ATLÂNTICA
GLAUBER H. B. O. SOUTO
NATAL / RN
2010
GLAUBER H.B.O. SOUTO
ECOLOGIA ALIMENTAR DE AVES INSETÍVORAS DE UM FRAGMENTO DE MATA DECÍDUA DO EXTREMO NORTE
DA MATA ATLÂNTICA
Orientador: Profº Dr. Mauro Pichorim
Departamento de Botânica, Ecologia e Zoologia – DEBZ / CB / UFRN
Dissertação de Mestrado apresentada para
defesa pública ao Programa de Pós-graduação
em Ciências Biológicas do Centro de
Biociências, da Universidade Federal do Rio
Grande do Norte.
NATAL / RN
2010
Dedico esta dissertação a minha
mãe Maria das Graças Borges de
Oliveira Souto, meu pai
Theogenes de Amorim Souto,
sem os quais não teria sido
possível ter alcançado este
objetivo em minha vida.
AGRADECIMENTOS
Quero expressar meus sinceros agradecimentos àqueles cuja colaboração
tornou possível a realização deste trabalho:
Ao Prof. Dr. Mauro Pichorim, pela orientação e empréstimo dos
equipamentos;
Ao Prof. Miguel Rocha Neto, amigo e incentivador, pela ajuda na identificação
dos fragmentos de insetos e por disponibilizar o Laboratório de Zoologia da
Universidade Potiguar (UnP);
Aos professores Alexandre Vasconcellos, Márcio Zikán e Adrian Garda pelas
críticas e sugestões durante várias etapas desse trabalho;
Ao Biólogo Marcelo da Silva, Tonny e Bruno França pela pelas companhias e
ajudas durante as atividades de campo;
À direção da Escola Agrícola de Jundiaí (EAJ), pela permissão para o
desenvolvimento do projeto e pela ampla colaboração durante a realização do
trabalho;
À minha esposa, Flaviana Macedo pela paciência e incentivo ao longo do
trabalho;
Por fim, agradeço a todos que contribuíram direta ou indiretamente para a
realização desse trabalho.
SUMÁRIO
RESUMO............................................................................................................. 08
ABSTRACT......................................................................................................... 10
INTRODUÇÃO .................................................................................................... 12
OBJETIVOS ........................................................................................................ 16
MATERIAIS E MÉTODOS .................................................................................. 17
RESULTADOS.................................................................................................... 29
DISCUSSÃO ....................................................................................................... 62
CONCLUSÃO ..................................................................................................... 71
REFERÊNCIAS................................................................................................... 72
ANEXO................................................................................................................ 82
LISTA DE FIGURAS
Figura 1. Mapa do Rio Grande do Norte mostrando a localização da Mata do
Olho D’água, Macaiba, delimitada pela circunferência ....................................... 18
Figura 2. Vista parcial da Mata do Olho D’água, Macaiba, RN. A: Vista geral da
mata..................................................................................................................... 19
Figura 3. Alguns fragmentos de presas encontrados nas amostras estomacais
de aves insetívoras da Mata do Olho D’água, Macaiba, RN ............................... 23
Figura 4. Curva cumulativa de riqueza alimentar de algumas aves insetívoras
da Mata do Olho D’água, Macaiba, RN ............................................................... 30
Figura 5. Abundância de itens-presa capturados pelos métodos de
amostragem “pitfall traps” e “shake cloths” durante o período chuvoso e seco
na Mata do Olho D’água, Macaíba, RN............................................................... 45
Figura 6. Índice de eletividade de presas por aves insetívoras, durante os
períodos de chuva e seca na Mata do Olho D’água, Macaíba, RN ..................... 49
Figura 7. Índice de eletividade de presas por Thamnophilus pelzelni, durante
os períodos de chuva e seca na Mata do Olho D’água, Macaiba, RN ............... 51
Figura 8. Índice de eletividade de presas por Formicivora grisea, durante os
períodos de chuva e seca na Mata do Olho D’água, Macaiba, RN .................... 53
Figura 9. Índice de eletividade de presas por Cnemotriccus fuscatus, durante
os períodos de chuva e seca na Mata do Olho D’água, Macaiba, RN ............... 55
Figura 10. Índice de eletividade de presas por Tolmomyias flaviventris, durante
os períodos de chuva e seca na Mata do Olho D’água, Macaiba, RN ............... 57
Figura 11. Índice de eletividade de presas por Vireo olivaceus, durante os
períodos de chuva e seca na Mata do Olho D’água, Macaiba, RN .................... 59
Figura 12. Índice de eletividade de presas por Basileuterus flaveolus, durante
os períodos de chuva e seca na Mata do Olho D’água, Macaiba, RN ............... 61
LISTA DE TABELAS
Tabela 1. Índice de importância alimentar (IA), freqüência de ocorrência
(FO) e freqüência absoluta (FA) dos itens capturados por aves insetívoras
da Mata do Olho D’água, Macaiba, RN, durante o período de chuva ................ 32
Tabela 2. Índice de importância alimentar (IA), frequência de ocorrência
(FO) e frequência absoluta (FA) dos itens capturados por aves insetívoras
da Mata do Olho D’água, Macaíba, RN durante o período de seca .................... 33
Tabela 3. Índices de importância alimentar (IA%) dos três itens alimentares
mais importantes durante os períodos chuvoso e seco de algumas aves
insetívoras da Mata do Olho D’água, Macaiba, RN............................................. 34
Tabela 4. Valores de sobreposição alimentar entre aves insetívoras da
Mata do Olho D’água, Macaíba, RN durante o período chuvoso ....................... 36
Tabela 5. Valores de sobreposição alimentar entre aves insetívoras da
Mata do Olho D’água, Macaíba, RN durante o período seco .............................. 38
Tabela 6. Valores de sobreposição de nicho de Pinka (1973) observado e
estimado por modelo nulo entre os períodos chuvoso e seco para cada
espécie de ave insetívora da Mata do Olho D’água, Macaíba, RN ..................... 40
Tabela 7. Medidas morfológicas e Amplitude de nicho de algumas aves
insetívoras capturadas na mata do Olho D’água durante os períodos
chuvoso e seco.................................................................................................... 43
Tabela 8. Freqüência e porcentagem dos itens-presas coletados, na Mata
do Olho D’água, Macaiba/RN, através das armadilhas Shake Cloths
(folhagem) e Pitfall (solo) nos períodos chuvoso e seco ..................................... 46
8
ECOLOGIA ALIMENTAR DE AVES INSETÍVORAS DE UM FRAGMENTO DE
MATA DECÍDUA DO EXTREMO NORTE DA MATA ATLÂNTICA
Glauber H.B.O. Souto¹ & Mauro Pichorim²
¹ Programa de Pós-graduação em Ciências Biológicas, Universidade Federal do Rio
Grande do Norte . 59072-970, Natal, Brasil. E-mail: [email protected]
² Departamento de Botânica, Ecologia e Zoologia, Centro de Biociências,
Universidade Federal do Rio Grande do Norte . 59072-970, Natal, Brasil.
RESUMO
O estudo da dieta de aves tem contribuído, historicamente, como modelo de uso
para o entendimento de padrões e estratégias ecológicas utilizados por vários outros
grupos de vertebrados, nos quais são observados padrões sazonais e temporais na
disponibilidade de recursos e outros. O presente trabalho objetivou gerar
informações referentes à dieta de aves insetívoras durante os períodos chuvoso e
seco, bem como analisar importância alimentar, valores de sobreposição alimentar,
amplitude de nicho, eletividade e disponibilidade de presas durantes as estações
chuvosa e seca. O estudo foi realizado em um fragmento com cerca de 270 ha
(coordenadas centrais 5º53’S e 35º23’W). O período de amostragem das aves
ocorreu entre março de 2008 a dezembro de 2009, em três trilhas pré-estabelecidas.
As capturas das aves foram realizadas por meio de 10 redes ornitológicas dispostas
em linha, onde cada linha de rede foi colocada em uma das trilhas, sendo uma
amostragem de aves realizadas em uma única trilha por mês. As amostras de
regurgitos foram obtidas por meio do tártaro emético. As amostragens de
disponibilidade de presas ocorreram entre fevereiro de 2009 a dezembro de 2009,
sendo utilizados amostragens no solo (pitfall traps) e na folhagem (shake cloths).
Capturamos 269 indivíduos de 21 espécies de aves insetívoras. Foram coletados
4.116 invertebrados, dos quais 3.259 no período chuvoso e 857 no período seco.
Obtivemos 174 amostras estomacais, onde 10 espécies tiveram dieta
exclusivamente insetívora, 9 alimentaram-se de inseto/material vegetal, 1 de
inseto/material vegetal/vertebrado e 1 por inseto/vertebrado. Durante o período
chuvoso foi observada diferença entre o consumo dos itens com maior Importância
9
Alimentar, sendo Coleoptera o item com maior Importância Alimentar (73%), seguido
por Formicidae (7%) e Araneae (6%). Durante o período seco, não foi encontrada
diferença entre o consumo dos itens com maior importância Alimentar, Sendo
Coleoptera o item com maior Importância Alimentar (34%), seguido por sementes
(29%) e Formicidae (18%). Os maiores índices de sobreposição de nicho ocorreram
durante o período chuvoso, enquanto o período seco foi caracterizado pelos maiores
valores de segregação de nicho. Isto indica que a comunidade de aves insetívoras
local esteve estruturada de forma diferenciada entre os períodos. Não foi encontrada
correlação entre os valores de Amplitude de nicho com os pesos médios das aves,
mostrando que o tamanho do nicho ocupado pelas aves não tem relação com o seu
tamanho corporal. Foram observados padrões sazonais na disponibilidade de
presas, sendo o pico da disponibilidade de invertebrados observado durante o
período chuvoso. As aves insetívoras selecionaram a mesma riqueza de espécies
durante os dois períodos, mostrando uma dieta especializada. Thamnophilus
pelzelni foi a única espécie que teve a sua dieta influenciada pela sazonalidade. No
que diz respeito a dieta global das aves insetívoras, observamos um elevado
consumo de presas, cuja grande disponibilidade de alimento fez com que as aves
pudessem investir e aumentar os seus recursos alimentares.
Palavras-chave: dieta de aves; sazonalidade; disponibilidade de presas; aves
insetívoras.
10
ABSTRACT
The diet study of birds has contributed historically as a model for use to
understanding ecological patterns and strategies used by several other groups of
vertebrates, which are observed in season patterns and temporal availability of
resources, and other. This study has as objective generate information concerning
the diet of insectivorous birds during rainy season and dry season, as well as analyze
Index food importance, niche overlap, niche breadth, electivity, and seasonal
availability of prey. The study was conducted in a fragment of about 270 ha (center
coordinates and 5 º 53'S 35 ° 23'W). The sampling of birds occurred between March
2008 and December 2009 in three pre-established trails. Catches of birds were
performed using 10 mist nets placed in line, where each trails was sampled once a
month. Samples of pellets were obtained by means of tartar emetic. Sampling of
availability of prey occurred between February 2009 to December 2009. We used two
methods of sampling (pitfall traps and Shake cloths). We captured 269 individuals of
21 species of insectivorous birds. We collected 4116 invertebrates of which 3259 in
the rainy season and 857 in the dry season. We obtained 174 samples stomach,
where 10 species were exclusively insectivorous diet, nine fed on insect/plant
material, an insect/plant material/vertebrate and one for insect/vertebrate. During the
rainy season was observing difference between the consumption of items with higher
food importance. The Coleoptera was item with higher food importance (73%),
followed by Formicidae (7%) and Araneae (6%). During the dry season, no difference
was found difference between the consumption of items with higher food importance.
The Coleoptera was item with higher food importance (34%), followed by seeds
(29%) and Formicidae (18%). The highest levels of niche overlap occurred during the
rainy season, while the dry season was characterized by high levels of niche
11
segregation. This indicates that the local insectivorous birds community was
structured differently between periods. No was found correlation between the values
of niche breadth to the mean weight of the body size. We observed seasonal
patterns in prey availability, with the peak availability of invertebrates observed
seasonal patterns in rainy season. The insectivorous birds selected the same species
richness during both periods, showing a specialized diet. Thamnophilus pelzelni was
the only species that had their diet influenced by seasonality. Regarding the overall
diet of insectivorous birds, observed a high consumption of prey, whose food
availability caused the birds could invest and increase their food resources.
Keywords: Diet of birds; seasonality; availability of prey; insectivorous birds.
12
1. INTRODUÇÃO GERAL
O estudo da dieta de aves constitui um amplo campo de pesquisa
historicamente explorado como modelo para entendimento de padrões e estratégias
ecológicas utilizados por vários grupos de vertebrados (Kear 1985). Teorias como a
do forrageamento ótimo, ilustram a complexidade que existe nas estratégias de
seleção de alimento entre as aves, revelando que o ato de procurar comida envolve
tomada de decisões sobre o custo/benefício de se obter um item (Krebs 1978, 1980).
Além disso, as aves apresentam diversidade alimentar variadas, em especial nos
sub-bosques florestais brasileiros onde podemos encontrar espécies onívoras,
granívoras, frugívoras e insetívoras num mesmo ambiente (Sick 1997). Tais estudos
são importantes, pois fornecem dados sobre a estrutura trófica da comunidade de
aves e condições ambientais (Piratelli e Pereira 2002), colaborando para
estabelecimento de estratégias de conservação (Bartholomew 1986). Visto que
algumas guildas de aves são bastante sensíveis ao processo de fragmentação e que
podem se deslocar de um fragmento para outro. Estes deslocamentos estão
relacionados com abundância de recursos, estrutura do habitat, padrões climáticos e
componentes da comunidade (Malizia 2001). Estudos realizados por Stouffer e
Bierregaard (1995) em fragmentos florestais amazônicos, apresentaram redução no
número de indivíduos e número de espécies de aves insetívoras logo nos primeiros
anos de isolamentos, mostrando que esta guilda é bastante vulnerável à
fragmentação (Stouffer e Bierregaard 1995).
De uma forma geral a diversidade alimentar é resultado de várias adaptações
morfológicas que possibilitam as aves explorar novos habitats (Sick 1997; Prince et
al. 1997; Podulka et al. 2004) e ocupar nichos variados (Loiselle e Blake 1990). As
13
adaptações morfológicas estão, na maioria das vezes, associadas com as técnicas
de forrageio (Podulka et al. 2004). Neste caso, as diferenças morfológicas presentes
em algumas aves, podem limitar ou não, o tipo de recurso a ser explorado,
influenciando na estratégia alimentar (Morse 1971; Sherry 1990; Podulka et al.
2004). Em algumas situações, a influência morfológica sobre a utilização dos
recursos entre espécies simpátricas é tão forte que possibilita o deslocamento de
caractere (Brown e Wilson 1956).
Dentre as medidas morfológicas, as que mais influenciam o regime alimentar,
são: as medidas de bico (e.g. Schoener 1974; Price 1991) e o tamanho corporal
(peso) (e.g. Morse 1974; Brooke 1983; Sherry 1990), cuja influência está relacionada
com a acessibilidade dos recursos mais compensadores, sendo as espécies maiores
possuidoras de nichos tróficos menores, consequentemente, sendo mais
especialistas (Morse 1974).
Porém, alguns estudos, que correlacionam dieta com morfologia das aves,
têm utilizados outras características morfológicas que podem influenciar na dieta.
Tais características são: medida do tarso, cuja influência está relacionada com a
dieta de insetívoros de solo (Fretwell 1969, Gaston 1974) e tamanho das asas, que
influencia no comportamento de forrageio (Fitzpatrick 1985; Marchetti et al. 1995).
Cabe destacar que padrões sazonais influenciam na abundância de frutos e
artrópodes, que são as principais fontes de alimentos de aves no sub-bosque
(Manhães 2003a; 2003b; Moorman et al. 2007; Riehl e Adelson 2008). À medida que
a disponibilidade de itens alimentares aumenta dentro de um fragmento, ocorre uma
seletividade por parte das aves através da detectabilidade, proximidade, aceitação e
habilidade para capturar o alimento com sucesso (Wolda 1990; Podulka et al. 2004).
Esta sazonalidade é marcante nos trópicos, onde o clima é bimodal, apresentando
14
estações chuvosa e seca bem definidas, sendo elementos importantes para
determinar picos de abundância de presas, principalmente no caso dos artrópodes
(Wolda 1978; Wolda e Fisk 1981). Segundo Develey e Peres (2000), os picos
sazonais observados na distribuição espacial de artrópodes estão relacionados com
o período reprodutivo da maioria dos passeriformes. Este fato é corroborado pelo
trabalho realizado por Riehl e Adelson (2008), ao observar a dieta de frugívoro
durante seu período reprodutivo, verificando consumo de artrópodes por adulto e
filhote.
A disponibilidade sazonal de alimentos também influencia a composição,
riqueza e abundância da comunidade de aves (Martin e Karr 1986; Naranjo e Ulloa
1997; Tebbich et al. 2004). Em seu trabalho realizado em florestas altas na Bolívia,
Herzog et al. (2003) observou alta sazonalidade na comunidade de aves,
principalmente nos frugívoros, granívoros e nectarívoros, cujos padrões na floração
e produção de frutos e sementes por árvores da região coincidiram com flutuações
de aves especializadas nestes alimentos. Flutuações sazonais de insetívoros dentro
de comunidades de aves foram observadas no Panamá (Karr 1976) e no Chaco
paraguaio (Brooks 1997), mostrando que a presença de insetívoros esteve
relacionada com abundância de artrópodes.
Padrões sazonais na disponibilidade de presas exercem influência direta nos
padrões comportamentais de aves dentro do sub-bosque (Podulka et al. 2004), isto
pode ser observado nos estudos realizados por Unno (2002) e Murakami (2002)
numa Floresta Decídua no Japão. Nestes estudos, os padrões comportamentais na
exploração de recursos sofreram mudanças ao longo das estações. Isso mostra que
aves com técnicas de forrageio mais diversas respondem melhor à distribuição
espacial e às mudanças sazonais na disponibilidade de presas do que aves mais
15
especializadas (Unno 2002). As espécies que apresentaram preferência por um
determinado tipo de presa modificam a altura de forrageio de acordo com a variação
na distribuição sazonal das presas (Murakami 2002).
Estudos com alimentação de passeriformes de sub-bosque vêm sendo
realizados em regiões temperadas, tropicais e subtropicais (e.g. Develey e Peres
2000; Malizia 2001; Unno 2002; Murakami 2002). Estes estudos dão ênfase à
descrição qualitativa do alimento (e.g. Argel-de-Oliveira et al. 1996; Motta-júnior e
Talamoni 1996; Francisco e Galetti 2001), caracterização do comportamento de
forrageio (e.g. Alves 1991; Alves e Duarte 1996) e a disponibilidade de recurso
alimentar (Hutto 1990; Rosenberg e Cooper 1990). Na região neotropical, a maioria
dos trabalhos com dieta, seja análise do conteúdo estomacal ou observação direta
do comportamento de forrageio, é realizada com frugívoros (e.g. Marini 1992; Galetti
e Pizo 1996; Malizia 2001; Manhães 2003a; Manhães 2003b), sendo poucos os
trabalhos com insetívoros (Willis e Oniki 1992; Durães 2001; Mestre 2002; Manhães
2007). Essa ausência de trabalhos é oposta à abundância de indivíduos nesta guilda
que é predominante nos sub-bosques brasileiros (Devely e Peres 2000; Manhães
2007; Lima e Manhães 2009).
No Brasil, estudos relacionados com alimentação de aves tiveram início com
Moojen et al. (1941) e Hempel (1949), tendo o seu ápice na década de 60 com o
trabalho de Schubart et al. (1965), onde foi analisado o conteúdo estomacal de 600
espécies de diferentes regiões do Brasil. Atualmente, estudos com dieta no Brasil
tem se concentrado na Floresta Amazônica, Cerrado e no extremo sul da Floresta
Atlântica. (e.g. Alves 1991; Pinheiro et al. 2003; Lopes 2005; Krügel et al. 2006),
tendo como objetivos principais determinar o consumo de frutos e inferir quais aves
podem ser dispersores destas sementes (Pinheiro et al. 2003) e determinar a dieta
16
através de estudos das táticas de forrageamento (Alves 1991; Lopes 2005; Krügel et
al. 2006).
Com base em informações presentes na literatura sobre ecologia alimentar de aves
insetívoras, observa-se uma carência de estudos em florestas estacionais decíduas,
quando comparadas com trabalhos realizados em florestas semidecíduas e,
principalmente, nas áreas localizadas no extremo nordeste brasileiro, onde trabalhos
com dieta priorizam espécies nectarívoras (Machado et al. 2007; Machado 2009),
frugívoras (Faustino e Machado 2006) e carnívoras (Roda 2006; Pereira et al. 2006).
2. OBJETIVOS
1) Caracterizar quali-quantitativamente a dieta de aves insetívoras do sub-bosque de
um fragmento de floresta estacional decídua do extremo nordeste brasileiro, bem
como a disponibilidade de presas durantes as estações chuvosa e seca.
2) Avaliar parâmetros tróficos tais como amplitude de nicho e sobreposição alimentar
entre as espécies de aves durante as estações chuvosa e seca.
3) Avaliar padrões de eletividade de presas durante as estações chuvosa e seca.
4) Testar a segurança do emético nas aves insetívoras.
17
3. MATERIAIS E MÉTODOS
3.1 Área de estudo
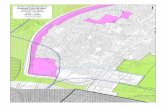
O presente trabalho foi realizado na Mata do Olho D’água, localizada no
município de Macaíba distante 25 km de Natal, RN (coordenada central 5°53’S e
35°23’W), pertencente à Escola Agrícola de Jundiaí/UFRN (Figuras 1 e 2). Neste
fragmento de aproximadamente 270 ha ocorre a criação de gado e extração seletiva
de madeira. A altitude é de aproximadamente 40 metros e o clima local transita entre
os tipos As’ e BSw’ da classificação de Köppen, com temperaturas média de 26ºC,
apresentando estação seca de setembro a dezembro e chuvosa entre janeiro e
agosto (Cestaro 2004).
A área de estudo é classificada como Floresta Estacional Decídua de terras
baixas com deciduidade ao final do período desfavorável atingindo mais de 80% de
um dossel não muito compacto (IBGE 1992). A composição florística é caracterizada
pela predominância de Leguminosae, Myrtaceae e Rubiaceae, destacando o gênero
Eugenia como o mais rico, seguido por Casearia, Alibertia, Caesalpinia,
Campomanesia, Capparis, Mimosa, Myrcia, Piptadenia e Tabebuia (Cestaro 2004).
18
Figura 1. Mapa do Rio Grande do Norte e em detalhe, a localização da Mata do
Olho D’água, Macaiba,
19
Figura 2. Vista parcial da Mata do Olho D’água, Macaiba, RN. A: Vista geral da
mata; B: Vista interna da trilha principal durante a época de seca; C: Vista interna da
trilha principal durante a época de chuva (foto: Glauber Souto).
20
3.2 Procedimentos de campo
As atividades em campo ocorreram entre março de 2008 e dezembro de
2009. As capturas das aves foram realizadas com o auxílio de redes de neblina de
12x3 m com de 15 mm em três pontos pré-estabelecidos, sendo que as amostras
foram realizadas em um ponto por mês. Em cada ponto foram colocadas 10 redes
em linha permanecendo abertas por aproximadamente nove horas, iniciando as
capturas por voltas de uma hora depois do crepúsculo matutino. As redes foram
monitoradas a cada 60 minutos e as aves capturadas foram marcadas com anilhas
metálicas numeradas do CEMAVE/ICMBio. Os espécimes capturados foram
pesados e medidos (asa flat, cauda, tarso culmen, base do bico e altura do bico).
O conteúdo estomacal das aves foi obtido por meio da administração de
solução de tártaro de antimônio e potássio na concentração de 1,2% na dosagem de
0,8 ml por 100 g do peso corporal (seguindo Durães e Marini 2003). A solução foi
administrada lentamente por meio de tubo fino e flexível de silicone ligado a seringa
de 1 ml. Logo em seguida a ave era acondicionada dentro de caixa escura, ventilada
e forrada com papel absorvente, onde era mantida por 30 minutos para depois ser
liberada, tendo regurgitado ou não. Nos casos de óbito pela administração do
tártaro, as aves eram levadas para o laboratório para a retirada do seu estômago
para análise. O material regurgitado foi coletado com o auxílio de espátula e pincel e
conservado em álcool a 70% com a devida identificação.
O material foi identificado até o menor nível taxonômico possível com o auxílio
de literatura pertinente (Borror et al. 1976; Ralph et al. 1985; Chapman et al. 1991;
Buzzi 2002; Costa et al. 2006) e por meio de coleção de referência de espécimes
21
coletados em campo. Os fragmentos não identificados foram descartados da mesma
forma como é feito em estudos desta natureza (Burger et al. 1999, Manhães 2007).
Devido à fragmentação das presas a contagem foi realizada de acordo com a
proposta de Durães (2001) e Manhães (2007), cujos itens são estimados por meio
da associação entre as partes do corpo, agrupando-os por tamanho, cor e forma,
sendo a frequência arredondada para cima (e.g. dois élitros esquerdo = dois
coleopteras). A partir destas associações, foram definidos os morfotipos de
coleopteras (Figura 3).
Simultaneamente às amostragens de dieta, foram feitas amostragens
mensais da disponibilidade de presas no local de estudo. As amostragens foram
iniciadas em fevereiro de 2009 e terminaram em dezembro de 2009. Foram
utilizados dois métodos de coletas de invertebrados – pitfall traps, para amostragens
de possíveis presas capturadas no solo, e shake cloths, para amostragens de
possíveis presas capturadas na vegetação (Cooper e Whitmore 1990). A escolha do
método shake cloths foi devida às características deciduais da vegetação, que
impossibilitam métodos tal como o branch clipping (Cooper e Whitmore 1990). As
armadilhas pitfall (n = 25), com volume de 500 ml. As armadilhas foram dispostas
paralelas às trilhas onde foram colocadas as redes de capturas de aves, à distância
média de 1 m entre elas por um período de 24 h em cada fase de coleta. Foram
utilizados 200 ml de formol a 10% em cada pitfall para conservar os invertebrados
coletados. Para proteger as armadilhas contra chuva e queda de folhas e galhos, foi
utilizada uma cobertura plástica sobre cada pitfall, sem impedir a entrada de insetos.
O método de shake cloths consistiu na utilização de um anteparo (tecido)
abaixo da vegetação ao nível do solo, a qual foi sacudida vigorosamente por duas
vezes para a queda dos invertebrados. Esse método foi empregado nas mesmas
22
linhas de rede de captura de aves no dia anterior ao das capturas. Estas coletas
ocorreram a cada 5 m, totalizando 18 amostras em cada trilha com um esforço
amostral de 3 horas/mês. Em seguida os espécimes foram coletados, fixados em
álcool 70% e transportados para o laboratório onde foram identificados ao menor
nível taxonômico possível.
23
Figura 3. Alguns fragmentos de presas encontrados nas amostras estomacais de
aves insetívoras da Mata do Olho D’água, Macaiba/RN. A = coleoptera tipo 3; B =
Coleoptera tipo 5; C = Coleoptera tipo 6; D = Coleoptera tipo 10; E = Curculionidae;
F = Antribidae, G = Coleoptera tipo 8; H = Formicidae.
24
3.3 Análises dos dados
Testou-se a eficiência do tártaro por meio do Qui-quadrado, utilizando como
valor esperado, os 10% de morte encontrados por Durães (2001). Curvas
cumulativas de riqueza da dieta foram feitas para as espécies que tiveram, pelo
menos, dez amostras analisadas. Para tal, foi utilizado o estimador de riqueza Mao
Tau com aleatorização de 500 pseudo-réplicas. As espécies que apresentaram as
curvas com tendência a estabilizar foram utilizadas nas análises de Importância
alimentar (IA%) e no Índice de eletividade (IEI). Os cálculos referentes ao Índice de
sobreposição de nicho e Amplitude de nicho foram empregados individualmente em
cada espécie que teve ao menos quatro amostras de dieta por período chuvoso e
seco. Foi utilizado o teste de Kolmogorov-smirnov para verificar a normalidade dos
dados. Foi utilizado o teste t com amostras pareadas para avaliar diferenças de
média das presas capturadas durante o período chuvoso e seco.
Índice de importância alimentar (IA)
O índice de importância alimentar de Kawkami-Vazzoler (1980) foi empregado
para determinar quais itens foram importantes na dieta global das aves insetívoras
durante os períodos chuvoso e seco. A fórmula utilizada foi:
25
Sendo:
IA é o índice de importância alimentar; Foi é o número total de amostras onde
ocorre a categoria i, dividido pelo número total de amostras. Fai é o número de itens
contidos na categoria i, dividido pelo número total de itens contidos na amostra.
Uma ANOVA foi utilizada para verificar possíveis diferenças sazonais entre os
itens, cujas freqüências apresentaram valores ≥ 80% das presas mais importantes
(IA) na dieta global das aves insetívoras e nas espécies onde foram calculados os
Índices de importância alimentar.
Sobreposição de Nicho:
O índice de sobreposição de nicho foi calculado, usando a índice de Pianka
(1973), cuja formula é:
Sendo:
O é o índice de sobreposição entre as espécies 1 e 2; P1i é a proporção da
presa i em relação ao total de presas usadas pela espécie 1; P2i é a proporção da
presa i em relação ao total de presas usadas pela espécie 2. Os valores de O
podem variar entre 0 e 1, correspondendo a ausência e total sobreposição,
respectivamente.
Para verificar a existência de estruturação de nicho da comunidade de aves
insetívoras locais nos períodos seco e chuvoso, o valor médio observado de
26
sobreposição em cada período foi comparado com o valor médio de um modelo nulo
gerado a partir de 1000 aleatorizações da matriz de dados original. Também
analisamos a sobreposição de nicho entre os períodos seco e chuvoso
individualmente em cada espécie que teve ao menos quatro amostras de dieta por
período. Neste caso, o valor de sobreposição observado foi comparado com o valor
médio de um modelo nulo gerado a partir de 1000 aleatorizações da matriz de dados
original da espécie em questão. Os cálculos de sobreposição de nicho de Pianka e
as análises de modelo nulo foram realizados no programa EcoSim 7.72 (Acquired
Intelligence, Inc. 2009) na opções “Niche Overlap”, “Niche Breadth – Relaxed” and
“Zero States - Retained”.
Para verificar possíveis correlações entre a morfologia das aves e os seus
valores de sobreposição, foram empregadas duas medidas, foram elas: o peso (g) e
o tamanho do bico (mm).
Com relação ao peso, foi calculada à diferença entre o peso médio das aves e
correlacionado com os seus respectivos valores de sobreposição durante os
períodos chuvoso e seco. Neste caso, foi empregado o teste não-paramétrico de
Sperman. Quanto ao tamanho do bico, foi empregado o índice de espessura do bico
(altura do bico / comprimento do bico), em seguida foi calculada à diferença entre a
espessura média do bico das aves e correlacionados com os seus respectivos
valores de sobreposição durante os períodos chuvoso e seco. Neste caso, também
foi empregado o teste não-paramétrico de Sperman.
27
Amplitude de Nicho:
A amplitude de nicho foi medida através do índice inverso de Simpson, onde:
Sendo:
Pi representa a proporção da categoria da presa i na dieta das espécies
estudadas. Este índice foi calculado para a dieta das aves insetívoras durante o
período chuvoso e seco. Em seguida foi utilizado o teste não-paramétrico de
Sperman para verificar possíveis correlações entre a amplitude de nicho e o peso
médio das aves capturadas durante os períodos chuvoso e seco.
Eletividade
O índice de eletividade de Ivlev (1961) foi utilizado na dieta global das aves
insetívoras durante os períodos chuvoso e seco. Em seguida, foi utilizado o índice
para as espécies de aves insetívoras durante os períodos chuvoso e seco. Cuja
fórmula:
Sendo:
IEI = é o índice de eletividade, r = é a porcentagem das presas na dieta; p = é
a porcentagem das presas no ambiente. Na utilização do índice de eletividade foram
desconsiderados os itens alimentares presentes nos regurgitos/estômagos e cuja
28
presença não foi verificada nas amostragens de disponibilidade de presas. O índice
de eletividade pode variar de -1 a 1, correspondendo a rejeição e preferência de
presas, respectivamente.
Para as análises estatísticas foram utilizados os programas BioEstat 5.0,
Statistica 7.0 e EstimateS Win800.
29
4. Resultados
4.1. Dados gerais:
Capturamos 269 espécimes de aves insetívoras pertencentes a 21 espécies e
10 Famílias (Anexo 1). Destes, 241 receberam solução emética e 28 espécimes
foram mortos. Dos indivíduos tratados com solução, 18 morreram (7,4%), sendo que
a frequência de mortes não foi superior à encontrada por Durães (2001) (x² = 13,26;
g.l. = 1; p<0,05). Dos indivíduos mortos, nove apresentaram itens alimentares. Dos
indivíduos que sobreviveram, 31% (n = 70) não regurgitaram e 69% (n = 153)
regurgitaram. Destes, 90% (n = 137) regurgitaram amostras identificáveis e 10% (n =
16) não regurgitaram. No geral, obtivemos amostras analisáveis de conteúdo
estomacal de 174 indivíduos de 21 espécies (Anexo 1). A análise destas amostras
resultou em 1.170 itens alimentares de 28 táxons de invertebrados (sendo, 12
morfotipos de Coleoptera), dois tipos de materiais de origem vegetal (fruto e
semente) e um tipo de vertebrado. Dez espécies tiveram dietas constituídas por
insetos, nove espécies por insetos/material vegetal, uma espécie por
insetos/material vegetal/vertebrado e uma espécie por inseto/vertebrado (Anexo 1).
As curvas cumulativas de riqueza da dieta apresentaram tendência a estabilizar
nas espécies, cuja riqueza de morfotipos de coleoptera consumidos foram iguais ou
maiores que 8 morfotipos. As espécies que apresentaram estes dados foram: B.
flaveolus (11 morfotipos), T. pelzelni (11 morfotipos), T. flaviventris (11 morfotipos),
C. fuscatus (9 morfotipos), F. grisea (9 morfotipos),V. olivaceus (8 morfotipos)
(Figuras 4).
30
Figura 4. Curva cumulativa de riqueza alimentar de algumas aves insetívoras da
Mata do Olho D’água, Macaiba, RN.
31
4.2. Índice de importância Alimentar (I.A):
Durante o período chuvoso, a dieta global das aves insetívoras apresentou
diferença entre o consumo dos itens alimentares mais importantes (F2, 5 = 66,74;
p<0,05), mostrando Coleoptera como o item de maior importância alimentar (IA =
73%), seguido por Formicidae (IA = 7%) e Araneae (IA = 6%) (Tabela 1). Na estação
seca, a dieta global das aves insetívoras não apresentou diferença entre o consumo
dos itens alimentares mais importantes (F2, 1= 0,7; p>0,05), mostrando Coleoptera
(IA =34%) como o item alimentar de maior importância alimentar, seguido por
Sementes (IA = 29%) e Formicidae (IA = 18%) (Tabela 2). Não foi encontrada
diferença sazonal entre o consumo dos itens de maior importância alimentar pelas
aves insetívoras (F1, 1= 0,18; p>0,05).
Durante o período chuvoso, Basileuterus flaveolus (F2, 4 = 4,89; p<0,05),
Cnemotriccus fuscatus (F2, 1 = 10,49; p<0,05) e Formicivora grisea (F2, 2 = 4,61;
p<0,05) apresentaram diferenças no consumo dos itens com maior importância
alimentar. No período seco, também foi observada diferença no consumo dos itens
com maior importância na dieta de B. flaveolus (F2 = 10,99; p<0,05) e F. grisea (F2 =
48,04; p<0,05).
Thamnophilus pelzelni não apresentou diferenças na importância dos itens na
sua dieta durante o período chuvoso (F2, 2 = 1,36; p>0,05) e seco (F2 = 0,74; p>0,05).
Tolmomyias flaviventris, também não apresentou diferenças na importância dos itens
alimentares na sua dieta durante o período chuvoso (F2, 3 = 3,52; p>0,05) e seco (F2,
1 = 2,87; p>0,05) (Tabela 3).
32
Tabela 1. Índice de importância alimentar (IA), frequência de ocorrência (FO) e
frequência absoluta (FA) dos itens capturados por aves insetívoras da Mata do Olho
D’água, Macaíba, RN durante o período de chuva.
Chuva Itens da dieta
FOi FAi IA%
Coleoptera 0,84 0,38 73,45
Formicidae 0,27 0,12 7,16
Araneae 0,35 0,07 5,63
Hemiptera não Heteroptera 0,30 0,07 4,85
Semente 0,13 0,12 3,65
Hymenoptera 0,16 0,04 1,62
Ovo de inseto 0,07 0,07 1,2
Orthoptera 0,14 0,03 1,06
Larva de coleoptera 0,11 0,03 0,85
Isoptera 0,07 0,01 0,22
Larva de lepidoptera 0,06 0,01 0,13
Blattodea 0,04 0,01 0,06
Odonata 0,04 0,01 0,06
Hemiptera Heteroptera 0,02 0,00 0,02
Acari 0,01 0,00 0,01
Phasmida 0,01 0,00 0,01
Amphibia 0,02 0,00 0,01
Fruto 0,02 0,00 0,01
Scolopendromorpha 0,00 0,00 0,00
Mantodea 0,00 0,00 0,00
33
Tabela 2. Índice de importância alimentar (IA), frequência de ocorrência (FO) e
frequência absoluta (FA) dos itens capturados por aves insetívoras da Mata do Olho
D’água, Macaíba, RN durante o período de seca.
Seca Itens da dieta
FOi FAi IA%
Coleoptera 0,65 0,18 33,66
Semente 0,29 0,36 29,17
Formicidae 0,44 0,15 18,29
Hemiptera não Heteroptera 0,65 0,07 8,37
Araneae 0,29 0,04 3,18
Orthoptera 0,24 0,04 2,66
Hymenoptera 0,18 0,04 2,1
Ovo de inseto 0,11 0,04 1,06
Hemiptera Heteroptera 0,11 0,02 0,59
Fruto 0,06 0,02 0,3
Larva de coleoptera 0,03 0,03 0,26
Larva de lepidoptera 0,06 0,01 0,18
Isoptera 0,03 0,01 0,08
Blattodea 0,05 0,01 0,07
Mantodea 0,02 0,00 0,02
Scolopendromorpha 0,02 0,00 0,01
Odonata 0,00 0,00 0,00
Acari 0,00 0,00 0,00
Phasmida 0,00 0,00 0,00
Amphibia 0,00 0,00 0,00
34
Tab
ela
3. Í
ndic
es d
e im
port
ânc
ia a
lime
ntar
(IA
%)
dos
três
itens
alim
enta
res
mai
s im
port
ante
s du
rant
e o
s p
erí
odo
s ch
uvoso
e s
eco
de
alg
umas
ave
s in
setí
vora
s d
a M
ata
do
Olh
o D
’ág
ua,
Maca
iba,
RN
.
T. pelzelni
F. grisea
C. fuscatus
T. flaviventris
B. flaveolus
Iten
s da
die
ta
Chuva
S
eca
chuva
S
eca
chuva
se
ca
chuva
se
ca
chuva
S
eca
Col
eopte
ra
40,2
20
,3
54,
7 81,
8 70
,3
24,3
78
,7
20
67,
5 46
Ara
nea
e -
- 14,
1 2,3
-
- -
- -
-
Hem
ipte
ra n
ão H
eter
opte
ra
9,8
-
9,4
-
- -
- 15
7,7
8,7
Form
icid
ae
- 39
,4
- 9,1
12
,2
11,3
13
,1
47,3
14,
2 -
Ort
hopte
ra
- -
- -
- -
- -
- -
Larv
a d
e C
oleopte
ra
- -
- -
10.8
-
- -
- -
Sem
ente
43
,5
24,8
-
- -
53,4
-
- -
-
Hym
eno
ptera
-
- -
- -
- 3,3
-
- 27
Fru
to
- -
- -
- -
- -
- -
35
4.3. Sobreposição de nicho:
Durante o período chuvoso foi calculada a sobreposição de nicho entre 12
espécies de aves insetívoras, gerando 66 pares. Dentre estes, 15 pares
apresentaram valores de sobreposição entre 0% – 10%, 47 pares entre 11% - 50%,
e 4 pares entre 51% - 90% (Tabela 4).
Dentre os 15 pares formados, cujos valores de sobreposição foram pequenos
(0% - 10%), destacam-se: Furnarius leucopus, cujos pares formados foram 7, sendo
seguidos por: Hylophilus amaurocephalus (5 pares) Galbula ruficauda, Canthorchilus
longirostris e Cnemotriccus fuscatus ambas com 3 pares, Hemitriccus striaticollis,
Vireo olivaceus e Formicivora grisea, ambas com 2 pares, e Thamnophilus pelzelni,
Hemitriccus margaritaceiventer e Basileuterus flaveolus, ambas com 1 par formado.
Dentre os 47 pares formados, os que apresentaram valores intermediários de
sobreposição (11% - 50%), destacam: T. pelzelni e H. margaritaceiventer, cujos
pares formados foram 10, seguidos por: F. grisea, V. olivaceus e Tolmomyias
flaviventris, ambas com 9 pares, H. striaticollis e B. flaveolus, ambas com 8 pares, C.
longirostris, C. fuscatus e G. ruficauda, ambas com 7 pares, H. amaurocephalus com
6 pares e F. leucopus com 4 pares formados.
E, dentre os 4 pares formados, cujos valores de sobreposição foram os mais
altos (51% - 90%) destacam: B. flaveolus e T. flaviventris, ambas com 2 pares, e C.
longirostris, H. striaticollis, G. ruficauda e C. fuscatus, ambas com 1 par formado
(Tabela 4).
O maior valor de sobreposição de nicho foi formado pelo par T. flaviventris e B.
flaveolus (74%) e o menor valor foi formado pelos pares: H. striaticollis e F.
leucopus, T. flaviventris e B. flaveolus, H. amaurocephalus e C. longirostris, H.
36
amaurocephalus e F. leucopus, V. olivaceus e G. ruficauda, ambas com 5% de
sobreposição (Tabela 4).
Tabela 4. Valores de sobreposição de nicho entre aves insetívoras da Mata do Olho
D’água, Macaíba, RN durante o período chuvoso. BF = Basileuterus flaveolus, CF =
Cnemotriccus fuscatus, CL = Cantorchilus longirostris, FG = Formicivora grisea, FL =
Furnarius leucopus, GR = Galbula ruficauda, HA = Hylophilus amaurocephalus, HM
= Hemitriccus margaritaceiventer, HS = Hemitriccus striaticollis, TF = Tolmomyias
flaviventris, TP = Thamnophilus pelzelni, VO = Vireo olivaceus.
Espécies BF CF CL FG FL GR HA HM HS TF TP VO
BF 0,51 0,28 0,42 0,22 0,27 0,09 0,37 0,42 0,74 0,49 0,41
CF 0,08 0,36 0,17 0,07 0,07 0,35 0,49 0,28 0,34 0,19
CL 0,34 0,07 0,55 0,05 0,18 0,12 0,23 0,19 0,21
FG 0,23 0,50 0,10 0,40 0,08 0,32 0,28 0,50
FL 0,07 0,05 0,08 0,05 0,18 0,08 0,07
GR 0,15 0,12 0,13 0,32 0,27 0,05
HÁ 0,25 0,12 0,15 0,20 0,16
HM 0,22 0,36 0,47 0,49
HS 0,51 0,35 0,38
TF 0,27 0,47
TP 0,43
37
Durante o período seco foi calculada a sobreposição de nicho entre 06
espécies de aves insetívoras, gerando 21 pares. Dentre estes, 1 par apresentou
valores de sobreposição entre 0% - 10%, 18 pares entre 11% - 50%, e 2 pares entre
51% - 90% (Tabela 5).
As espécies que apresentaram os menores valores de sobreposição (0% -
10%) foram: Tolmomyias flaviventris e Vireo olivaceus, formando um único par.
Estas espécies, também foram as que apresentaram os menores valores de
sobreposição (10%) (Tabela 5).
Dentre os 18 pares formados, os que apresentaram valores intermediários de
sobreposição (11% - 50%), destacam-se: Thamnophilus pelzelni, Formicivora grisea
e Cnemotriccus fuscatus, ambas com 6 pares formados, sendo seguidos por: V.
olivaceus e Basileuterus culicivorus, ambas com 5 pares, e Basileuterus flaveolus e
T. Flaviventris com 4 pares formados.
E, dentre os 2 pares formados, cujos valores de sobreposição foram os mais
altos (51% - 90%), destacam: B. flaveolus, cujos pares formados foram 2, T.
flaviventris e B. culicivorus, ambas com 1 par formado (Tabela 5).
O maior valor de sobreposição de nicho foi formado pelo par B. flaveolus e B.
culicivorus (57%) (Tabela 5).
38
Tabela 5. Valores de sobreposição de nicho entre aves insetívoras da Mata do Olho
D’água, Macaíba, RN durante o período seco. BC = Basileuterus culicivorus, BF =
Basileuterus flaveolus, CF = Cnemotriccus fuscatus, FG = Formicivora grisea, TF =
Tolmomyias flaviventris, TP = Thamnophilus pelzelni, VO = Vireo olivaceus.
Espécies BC BF CF FG TF TP VO
BC 0,57 0,22 0,18 0,47 0,42 0,15
BF 0,33 0,43 0,53 0,27 0,11
CF 0,27 0,24 0,23 0,15
FG 0,23 0,48 0,11
TF 0,35 0,10
TP 0,16
39
A sobreposição de nicho média entre as aves insetívoras durante os períodos
chuvoso e seco foi de 0,26 e 0,29 respectivamente. Já os valores médios de
sobreposição nos mesmos períodos gerados pelo modelo nulo foram de 0,37 (p <
0,01) e 0,42 (p < 0,01). Estes valores mostram que a comunidade de aves
apresentou diferenças sazonais em relação à sobreposição de nicho.
A análise individual de sobreposição para as espécies mostrou que
Thamnophilus pelzelni, Formicivora grisea, Cnemotriccus fuscatus, Tolmomyias
flaviventris, Vireo olivaceus e Basileuterus flaveolus apresentaram índices de
sobreposição alimentar observado e estimado pelo modelo nulo diferentes entre os
períodos seco e chuvoso (Tabela 6). Isto mostra que as espécies analisadas
apresentaram diferenças sazonais em relação à sobreposição de nicho.
40
Tabela 6. Valores de sobreposição de nicho de Pinka (1973) observado e estimado
por modelo nulo entre os períodos chuvoso e seco para cada espécie de ave
insetívora da Mata do Olho D’água, Macaíba, RN.
Sobreposição de nicho Espécie
Observada Modelo nulo**
Probabilidade
T. pelzelni 0,27 0,53 P = 0,004*
F. grisea 0,20 0,41 P = 0,039*
C. fuscatus 0,37 0,58 P = 0,019*
T. flaviventris 0,18 0,43 P = 0,010*
V. olivaceus 0,15 0,38 P = 0,021*
B. flaveolus 0,46 0,63 P = 0,029*
* Valores significativos para um nível de significância de 0,05.
** Valores médios de sobreposição de nicho do modelo nulo gerado a partir de 1000
aleatorizações da matriz de dados original da espécie em questão (cálculos
realizados no programa EcoSim 7.72 - Acquired Intelligence, Inc. 2009).
41
4.4. Morfologia versus Sobreposição de nicho e Amplitude de nicho
O peso corporal das aves insetívoras analisadas foi agrupado da seguinte
forma: Aves pequenas (≤10.9 g), Aves médias (11 g – 20. 9 g) e Aves grandes (≥ 21
g). Com relação à espessura do bico, as aves apresentaram bicos pouco espesso
(0.10 mm – 0.21 mm), bicos com espessura intermediária (0.22 mm – 0.40 mm) e
bicos grossos (≥ 0.41 mm).
Durante o período chuvoso, 4 espécies de aves apresentaram pesos leves
(Hemitriccus striaticollis, Hemitriccus margaritaceiventer, Hylophilus amaurocephalus
e Formicivora grisea), 6 espécies apresentaram pesos intermediários (Basileuterus
flaveolus, Cnemotriccus fuscatus, Tolmomyias flaviventris, Vireo olivaceus,
Thamnophilus pelzelni e Canthorchilus longirostris) e, 2 espécies apresentaram os
maiores pesos (Galbula ruficauda e Furnarius leucopus) (Tabela 7). Quanto à
espessura do bico, 2 espécies apresentaram o bico pouco espesso (G. ruficauda e
C. longirostris), 5 espécies apresentaram o bico com espessura média (F. grisea, F.
leucopus, H. margaritaceiventer, H. striaticollis e B. flaveolus) e, 5 espécies
apresentaram bicos grossos (T. pelzelni, C. fuscatus, T. flaviventris, H.
amaurocephalus e V. olivaceus) (Tabela 7).
Durante o período seco, 2 espécies apresentaram pesos leves (F. grisea e B.
culicivorus) e 5 espécies apresentaram pesos médios (T. pelzelni, C. fuscatus, T.
flaviventris, V. olivaceus e B. flaveolus) (Tabela 7). Quanto à espessura do bico, 2
espécies apresentaram bicos com espessura média (F. grisea e B. flaveolus) e 5
espécies apresentaram bicos grossos (T. pelzelni, C. fuscatus, T. flaviventris, V.
olivaceus e B. culicivorus) (Tabela 7).
42
Durante o período chuvoso, a diferença entre o peso médio das aves foi
negativamente correlacionada com os valores de sobreposição de nicho (rs = - 0,42
p < 0,05), enquanto que, no período seco não foi encontrada correlação entre a
diferença do peso médio das aves com os valores de sobreposição (r = 0,21 p >
0,05).
Durante o período chuvoso (rs = 0,12 p > 0,05) e seco (r = - 0,11 p > 0,05) não
foi encontrada correlação entre o peso médio das aves e amplitude de nicho. O
mesmo pôde ser observado ao correlacionar a espessura do bico e amplitude de
nicho, cujos valores para o período chuvoso e seco foram, respectivamente, r = -
0,31 p > 0,05 e rs = 0,48 p > 0,05.
43
Tabela 7. Medidas morfológicas e amplitude de nicho de algumas aves insetívoras
capturadas na mata do Olho D’água durante os períodos chuvoso e seco.
Peso (g) Índice de espessura do bico Amplitude (B) Espécies
Chuva Seca chuva Seca Chuva seca
G. ruficauda 21.3 - 0.15 - 2.83 -
T. pelzelni 18.8 17.86 0.53 0.53 3.25 3.86
F. grisea 10.4 10.13 0.3 0.36 5.31 2.53
F. leucopus 37.9 - 0.32 - 3.4 -
C. fuscatus 12.4 12.42 0.42 0.42 3.11 3.55
T. flaviventris 12.5 11.41 0.51 0.53 2.67 4.43
H. margaritaceiventer 9 - 0.36 - 4.9 -
H. striaticollis 8.8 - 0.39 - 1.94 -
H. amaurocephalus 9.5 - 0.47 - 2.99 -
V. olivaceus 13.6 13.75 0.5 0.48 4.45 1.36
C. longirostris 19.1 - 0.21 - 5.56 -
B. flaveolus 12.2 12.25 0.39 0.4 4.06 4.17
B. culicivorus - 9.28 - 0.44 - 4.25
4.5. Disponibilidade de recursos:
As amostragens de disponibilidade total de presas resultaram na coleta de
4.116 espécimes distribuídos em 19 táxons de invertebrados e um táxon de
vertebrado (Amphibia) (Figura 5). No período chuvoso foram amostrados 3.259
espécimes (2.531 espécimes amostrados no solo mais 728 amostrados nas
folhagens) e durante o período seco obtivemos 857 espécimes amostrados (436
espécimes amostrados no solo mais 421 amostrados nas folhagens). A
disponibilidade de presas foi maior no período chuvoso (Média chuva= 543,16
±153,9; Média Seca= 214 ±29,61; t = 4,14; g.l. = 8; p< 0,05).
44
Foram coletados 2.967 espécimes nas armadilhas de solo, sendo 18 táxons de
invertebrados e um táxon de vertebrado (Amphibia). Os grupos mais abundantes
Formicidae (68,5%), Araneae (8,8%) e Coleoptera (8,6%), compreendendo, os
demais grupos menos de 15% do total (Tabela 8). Foram observadas pequenas
variações na proporção dos grupos capturados nas diferentes estações (Tabela 8).
Nas amostragens realizadas nas folhagens foram capturados 17 táxons de
invertebrados, totalizando 1.149 espécimes coletados, sendo os grupos mais
abundantes Araneae (37,9%), Formicidae (28,6%), Coleoptera (11,1%) e Orthoptera
(6,2%) (Tabela 8). As proporções de cada grupo sofreram pequenas variações entre
as estações (Tabela 8).
45
Abun dância de itens-pres as
0 200 400 600 800 1000 1200 1400 1600 1800 2000
Form icidae
Coleoptera
Diptera
Hym enoptera
Thysanura
Anfíbio
Larva de coleoptera
Larva de lepidoptera
Mantodea
Scutigerom orpha Chuva Seca
Araneae
Orthoptera
Isoptera
Acari
Hem i ñ Heteroptera
Blattodea
Scorpiones
Phasm ida
Scolopendromorpha
Hem i Heteropte ra
Figura 5. Abundância de itens-presa capturados pelos métodos de amostragem
“pitfall traps” e “shake cloths” durante o período chuvoso e seco na Mata do Olho
D’água, Macaíba, RN. Hemi ñ Heteroptera = Hemiptera não Heteroptera; Hemi
Heteroptera = Hemiptera Hetroptera.
46
Tab
ela
8. F
req
üênci
a e
porc
enta
gem
dos
ite
ns-
pre
sas
cole
tados,
na M
ata
do O
lho D
’águ
a,
Maca
iba,
RN
, atr
avé
s das
arm
adi
lhas
Shake
Clo
ths
(folh
ag
em
) e P
itfal
l (so
lo)
nos
per
íod
os
chuv
oso
e s
eco
.
Folh
agem
so
lo
ch
uva
%
seca
%
Tota
l %
ch
uva
%
se
ca
%
Tota
l %
Aca
ri 1
0.14
6 1.4
3 7
0.61
29
1.1
5
1
0.2
3
30
1.01
Sco
rpio
nes
0 0.
00
0 0.0
0 0
0.00
5
0.2
0
2
0.4
6
7
0.24
Ara
nea
e 269
36.9
5 167
39.6
7
436
37.9
5 23
8
9.4
0
25
5.7
3
263
8.86
Scu
tiger
om
orp
ha
0 0.
00
0 0.0
0 0
0.00
1
0.0
4
2
0.4
6
3
0.10
Sco
lope
ndr
om
orp
ha
0 0.
00
1 0.2
3 1
0.09
0
0.0
0
0
0.0
0
0
0.00
Th
ysan
ura
20
2.75
6 1.4
3 26
2.26
9
0.3
6
1
0.2
3
10
0.34
Ort
hopte
ra
36
4.95
36
8.5
5 72
6.27
112
4.4
3
15
3.4
4
127
4.28
Ma
ntode
a 2
0.27
6 1.4
3 8
0.70
1
0.0
4
0
0.0
0
1
0.03
Phas
mid
a 2
0.27
1 0.2
3 3
0.25
0
0.0
0
0
0.0
0
0
0.00
Bla
ttod
ea
7 0.
96
8 1.9
0 15
1.31
5
0.2
0
5
1.1
5
10
0.34
47
Tab
ela
8. C
ontin
uaçã
o.
Isopte
ra
37
5.0
8
5
1.1
9 42
3.66
0
0.0
0 4
0.9
2 4
0.1
4
Hem
ipte
ra H
ete
ropte
ra
7 0.9
6
24
5.7
0 31
2.70
1
0.0
4 0
0.0
0 1
0.0
3
Hem
ipte
ra n
ão
Hete
ropte
ra
12
1.6
5
6
1.4
3 18
1.57
13
0.5
0 2
0.4
6 15
0.5
1
Cole
opte
ra
11
6 15.
93
12
2.8
5 128
11.1
4 22
4
8.8
5 32
7.3
4 256
8.6
3
Dip
tera
4
0.5
5
0
0.0
0 4
0.34
133
5.2
5 3
0.6
9 136
4.5
8
Hym
eno
pte
ra
0 0.0
0
4
0.9
5 4
0.34
32
1.2
6 2
0.4
6 34
1.1
5
Form
icid
ae
20
2 27.
75
12
7 30
.17
329
28.6
3 17
00
67.1
7
334
76.6
0
2034
68.5
5
Larv
a d
e co
leopte
ra
7 0.9
6
1
0.2
3 8
0.70
4
0.1
6 0
0.0
0 4
0.1
4
Larv
a d
e le
pid
opte
ra
6 0.8
3
11
2.6
1 17
1.48
0
0.0
0 1
0.2
3 1
0.0
3
Anf
íbio
0
0.0
0
0
0.0
0 0
0.00
24
0.9
5 7
1.6
0 31
1.0
4
TO
TA
L
728
100
421
100
1149
10
0 25
31
100
436
100
2967
10
0
48
4.6. Eletividade:
O índice de Eletividade sugere que as aves insetívoras selecionam o mesmo
número de espécies durante os períodos chuvoso e seco (Figura 6). Sendo, Larva
de Coleoptera, Hemiptera não Heteroptera, Hymenoptera e Coleoptera os itens-
presa mais selecionados durante os dois períodos (Figura 6).
Foram observadas diferenças sazonais no consumo de alguns itens-presas,
tais como: Phasmida, Blattodea, Hemiptera Heteroptera e Larva de Lepidoptera,
sendo itens-presas selecionados, em sua maioria, durante o período chuvoso. E,
durante o período seco, também foram observadas diferenças no consumo de
Scolopendromorpha e Orthoptera (Figura 6).
49
Fig
ura
6.
Índ
ice d
e e
letiv
ida
de d
e p
resa
s p
or
ave
s in
setí
vora
s, d
urante
os
perí
od
os d
e c
huva
e s
eca n
a M
ata
do
Olh
o D
’águ
a,
Maca
iba,
RN
. A
ca =
Aca
ri;
Sco
r =
Sco
rpio
nes
; A
ra =
Ara
neae;
Scu
t =
Scu
tigero
mor
pha;
Sco
l =
Sco
lope
ndro
mor
ph
a; T
hy
=
Thys
an
ura;
Ort
h =
Ort
ho
pte
ra;
Man
= M
ant
ode
a; P
ha
= P
hasm
ida;
Bla
= B
latt
odea;
Iso
p =
Iso
ptera
; H
Het
= H
em
ipte
ra H
ete
ropte
ra;
HñH
et
= H
em
ipte
ra n
ão H
ete
ropte
ra;
Col
= C
oleopte
ra;
Dip
= D
ipte
ra;
Hym
= H
ymen
opte
ra;
Form
= F
orm
icid
ae;
Lco
l =
Lar
va d
e
Cole
opt
era
; Lle
p =
Larv
a de L
epid
opte
ra; A
mp =
Am
phi
bia
.
50
Durante o período chuvoso, Thamnophilus pelzelni selecionou, em ordem de
importância, Hemiptera não Heteroptera, Larva de Coleoptera, Larva de lepidoptera,
Blattodea, Coleoptera e Hymenoptera (Figura 7). Orthoptera, Araneae e Formicidae
foram itens-presa pouco selecionados durante o período chuvoso. Durante o período
seco, T. pelzelni selecionou uma quantidade de presas menor, cujos itens-presa
mais selecionados foram: Hemiptera não Heteroptera, Coleoptera e Blattodea
(Figura 7). Formicidae e Araneae foram pouco selecionados durante a seca.
O índice de Ivlev sugere que a dieta de T. pelzelni apresenta diferenças
sazonais quanto à seleção de presas, apresentando itens-presa eleitos durante um
único período. Neste caso, temos: Larva de Coleoptera, Larva de Lepidoptera e
Hymenoptera, que foram selecionadas durante o período chuvoso.
51
Fig
ura
7.
Índ
ice d
e e
letiv
idad
e d
e pr
esa
s po
r T
ha
mn
op
hilu
s p
elz
eln
i, d
ura
nte
os
perí
odos
de c
huva
e s
eca
na M
ata
do
Olh
o
D’á
gu
a, M
acaib
a,
RN
. A
ca =
Aca
ri;
Sco
r =
Sco
rpio
nes;
Ara
= A
rane
ae;
Scu
t =
Scu
tigero
morp
ha;
Sco
l = S
colo
pendro
morp
ha;
Thy
=
Thys
an
ura;
Ort
h =
Ort
ho
pte
ra;
Man
= M
ant
ode
a; P
ha
= P
hasm
ida;
Bla
= B
latt
odea;
Iso
p =
Iso
ptera
; H
Het
= H
em
ipte
ra H
ete
ropte
ra;
HñH
et
= H
em
ipte
ra n
ão H
ete
ropte
ra;
Col
= C
oleopte
ra;
Dip
= D
ipte
ra;
Hym
= H
ymen
opte
ra;
Form
= F
orm
icid
ae;
Lco
l =
Lar
va d
e
Cole
opt
era
; Lle
p =
Larv
a de L
epid
opte
ra; A
mp =
Am
phi
bia
.
52
Durante o período chuvoso, Formicivora grisea selecionou, em ordem de
importância, Hemiptera Heteroptera, Isoptera, Coleoptera e Orthoptera (Figura 8).
Formicidae foi o item-presa pouco selecionado durante o período chuvoso. Durante
o período seco, F. grisea selecionou, em ordem de importância, Coleoptera, Larva
de Lepidoptera, Hemiptera Heteroptera e Orthoptera (Figura 8). Formicidae e
Araneae foram poucos selecionados durante a seca.
O índice de Ivlev indica diferença sazonal entre a seletividade dos itens-presa, Larva
de lepidoptera e Isoptera, cujos consumos destes itens-presa ocorreram, apenas,
durante o período seco e chuvoso, respectivamente (Figura 8).
53
Fig
ura
8.
Índi
ce d
e e
letiv
ida
de d
e pre
sas
por
Form
iciv
ora
grisea,
dura
nte
os
per
íod
os
de c
huva
e s
eca
na M
ata
do O
lho D
’água,
Maca
iba,
RN
. A
ca =
Aca
ri;
Sco
r =
Sco
rpio
nes
; A
ra =
Ara
neae;
Scu
t =
Scu
tigero
mor
pha;
Sco
l =
Sco
lope
ndro
mor
ph
a; T
hy
=
Thys
an
ura;
Ort
h =
Ort
ho
pte
ra;
Man
= M
ant
ode
a; P
ha
= P
hasm
ida;
Bla
= B
latt
odea;
Iso
p =
Iso
ptera
; H
Het
= H
em
ipte
ra H
ete
ropte
ra;
HñH
et
= H
em
ipte
ra n
ão H
ete
ropte
ra;
Col
= C
oleopte
ra;
Dip
= D
ipte
ra;
Hym
= H
ymen
opte
ra;
Form
= F
orm
icid
ae;
Lco
l =
Lar
va d
e
Cole
opt
era
; Lle
p =
Larv
a de L
epid
opte
ra; A
mp =
Am
phi
bia
.
54
Durante o período chuvoso, Cnemotriccus fuscatus selecionou, em ordem de
importância, larva de Coleoptera, Hymenoptera, Coleoptera, Hemiptera não
Heteroptera e Isoptera (Figura 9). Formicidae e Araneae foram itens-presas pouco
selecionados durante o período chuvoso. Durante o período de seca, C. fuscatus
selecionou, em ordem de importância, larva de Coleoptera, Hymenoptera,
Coleoptera, Hemíptera não Heteroptera e Hemíptera Heteroptera (Figura 9).
Araneae e Formicidae foram itens-presa pouco selecionados.
O consumo de itens-presas por C. fuscatus durante as estações, diferiu
apenas em dois itens, que foram: Isoptera e Hemiptera Heteroptea, sendo o primeiro
consumido apenas durante o período chuvoso, e o segundo consumido apenas
durante o período seco (Figura 9).
55
Fig
ura
9.
Índi
ce d
e e
letiv
idade
de p
resa
s p
or C
ne
motr
iccus f
uscatu
s,
dura
nte o
s perí
odos
de c
huva
e s
eca
na M
ata
do
Olh
o
D’á
gu
a, M
acaib
a,
RN
. A
ca =
Aca
ri;
Sco
r =
Sco
rpio
nes;
Ara
= A
rane
ae;
Scu
t =
Scu
tigero
morp
ha;
Sco
l = S
colo
pendro
morp
ha;
Thy
=
Thys
an
ura;
Ort
h =
Ort
ho
pte
ra;
Man
= M
ant
ode
a; P
ha
= P
hasm
ida;
Bla
= B
latt
odea;
Iso
p =
Iso
ptera
; H
Het
= H
em
ipte
ra H
ete
ropte
ra;
HñH
et
= H
em
ipte
ra n
ão H
ete
ropte
ra;
Col
= C
oleopte
ra;
Dip
= D
ipte
ra;
Hym
= H
ymen
opte
ra;
Form
= F
orm
icid
ae;
Lco
l =
Lar
va d
e
Cole
opt
era
; Lle
p =
Larv
a de L
epid
opte
ra; A
mp =
Am
phi
bia
.
56
Durante o período chuvoso, Tolmomyias flaviventris selecionou, em ordem de
importância, Hemiptera não Heteroptera, Hymenoptera e Coleoptera (Figura 10).
Orthoptera, Araneae e Formicidae foram itens-presa pouco selecionados durante
este período. Durante o período seco, a seleção de presas eleitas foi igual ao
período chuvoso, sendo em grau de importância, Hemíptera não Heteroptera,
Coleoptera e Hymenoptera (Figura 10). Orthoptera, Formicidae, Hemíptera
Heteroptera e Araneae foram itens-presa pouco selecionados durante este período
(Figura 10).
57
Fig
ura
10.
Índi
ce d
e e
letiv
ida
de d
e pre
sas
por
To
lmo
myia
s f
laviv
entr
is,
dura
nte
os
perí
od
os d
e c
huv
a e
sec
a n
a M
ata
do O
lho
D’á
gu
a, M
acaib
a,
RN
. A
ca =
Aca
ri;
Sco
r =
Sco
rpio
nes;
Ara
= A
rane
ae;
Scu
t =
Scu
tigero
morp
ha;
Sco
l = S
colo
pendro
morp
ha;
Thy
=
Thys
an
ura;
Ort
h =
Ort
ho
pte
ra;
Man
= M
ant
ode
a; P
ha
= P
hasm
ida;
Bla
= B
latt
odea;
Iso
p =
Iso
ptera
; H
Het
= H
em
ipte
ra H
ete
ropte
ra;
HñH
et
= H
em
ipte
ra n
ão H
ete
ropte
ra;
Col
= C
oleopte
ra;
Dip
= D
ipte
ra;
Hym
= H
ymen
opte
ra;
Form
= F
orm
icid
ae;
Lco
l =
Lar
va d
e
Cole
opt
era
; Lle
p =
Larv
a de L
epid
opte
ra; A
mp =
Am
phi
bia
.
58
Durante o período chuvoso, Vireo olivaceus selecionou, em ordem de
importância, Hemiptera não Heteroptera, Coleoptera, Orthoptera e Araneae (Figura
11). Formicidae foi o item-presa pouco selecionado durante este período. Durante o
período seco, V. olivaceus selecionou uma quantidade de itens-presa menor, sendo
os mais selecionados: Hemiptera não Heteroptera, Coleoptera e Orthoptera (Figura
11). Araneae foi o item-presa pouco selecionado neste período.
O índice de Ivlev indica diferença sazonal entre a seletividade do item Araneae,
cujo consumo deste item-presa ocorreu com maior importância durante o período
chuvoso (Figura 11).
59
Fig
ura
11.
Ín
dic
e d
e e
letiv
idade d
e p
resa
s por
Vireo o
livaceus,
dura
nte
os
perí
odos
de
chu
va e
sec
a n
a M
ata
do O
lho D
’água,
Maca
iba,
RN
. A
ca =
Aca
ri;
Sco
r =
Sco
rpio
nes
; A
ra =
Ara
neae;
Scu
t =
Scu
tigero
mor
pha;
Sco
l =
Sco
lope
ndro
mor
ph
a; T
hy
=
Thys
an
ura;
Ort
h =
Ort
ho
pte
ra;
Man
= M
ant
ode
a; P
ha
= P
hasm
ida;
Bla
= B
latt
odea;
Iso
p =
Iso
ptera
; H
Het
= H
em
ipte
ra H
ete
ropte
ra;
HñH
et
= H
em
ipte
ra n
ão H
ete
ropte
ra;
Col
= C
oleopte
ra;
Dip
= D
ipte
ra;
Hym
= H
ymen
opte
ra;
Form
= F
orm
icid
ae;
Lco
l =
Lar
va d
e
Cole
opt
era
; Lle
p =
Larv
a de L
epid
opte
ra; A
mp =
Am
phi
bia
60
Durante o período chuvoso, Basileuterus flaveolus selecionou, em ordem de
importância, Hemiptera não Heteroptera, Hymenoptera, Larva de Coleoptera,
Coleoptera e Blattodea (Figura 12). Isoptera, Araneae e Formicidae foram itens-
presa pouco selecionados durante o período chuvoso. Durante o período seco, B.
flaveolus selecionou uma menor quantidade de itens-presa, cujos mais selecionados
foram: Hymenoptera, Coleoptera e Hemiptera não Heteroptera (Figura 12).
Hemiptera Heteroptera, Orthoptera, Araneae e Formicidae foram poucos
selecionados durante a seca.
O índice de Ivlev indica diferenças sazonais entre a seletividade dos itens-
presa, podendo ser observado uma preferência por Blattodea e Larva de Coleoptera,
apenas, durante um período (Figura 12).
61
Fig
ura
12.
Índic
e de
ele
tivid
ade d
e pre
sas
po
r B
asile
ute
rus f
lave
olu
s,
dura
nte
os
perí
odo
s d
e c
huv
a e
sec
a n
a M
ata
do
Olh
o
D’á
gu
a, M
acaib
a,
RN
. A
ca =
Aca
ri;
Sco
r =
Sco
rpio
nes;
Ara
= A
rane
ae;
Scu
t =
Scu
tigero
morp
ha;
Sco
l = S
colo
pendro
morp
ha;
Thy
=
Thys
an
ura;
Ort
h =
Ort
ho
pte
ra;
Man
= M
ant
ode
a; P
ha
= P
hasm
ida;
Bla
= B
latt
odea;
Iso
p =
Iso
ptera
; H
Het
= H
em
ipte
ra H
ete
ropte
ra;
HñH
et
= H
em
ipte
ra n
ão H
ete
ropte
ra;
Col
= C
oleopte
ra;
Dip
= D
ipte
ra;
Hym
= H
ymen
opte
ra;
Form
= F
orm
icid
ae;
Lco
l =
Lar
va d
e
Cole
opt
era
; Lle
p =
Larv
a de L
epid
opte
ra; A
mp =
Am
phi
bia
.
62
5. Discussão
5.1. Composição da dieta e importância dos diferentes itens alimentares:
A dieta das aves insetívoras da comunidade estudada foi diversificada,
apresentando, em algumas espécies, a presença de material vegetal e de
vertebrado. Assim como no trabalhado realizado por Poulin et al. (1994), a baixa
abundância de artrópodes durante o período seco foi caracterizada pelo alto
consumo de material vegetal. A investida em outros tipos de alimento tem a função
de complementar a dieta durante respostas sazonais na disponibilidade de recursos
(Wiens 1989; Murakami 2002), sendo comum, encontrar sementes ou frutos na dieta
de insetívoros (Zotta 1936; Schubart et al. 1965; Pineschi 1990; Poulin et al. 1994;
Durães e Marini 2005).
O consumo de vertebrados por Passeriformes, que na sua maioria são anuros
e lagartos, é algo raro e reflete uma dieta oportunista a um alimento em potencial
(Lopes et al. 2005a). Estes itens foram encontrados por Poulin et al. (1994, 2001) e
Mestre (2002) na dieta de insetívoros de solo. Manhães (2007) encontrou Amphibia
na dieta de Xiphocolaptes albicolis, Sittasomus griseicapilus, Pyriglena leucoptera e
Turdus albicolis. No presente trabalho foi registrado pela primeira vez o consumo de
vertebrado (Amphibia) nas dietas de Thamnophilus capistratus e Furnarius leucopus.
Coleoptera foi um dos itens alimentares mais abundantes entre as espécies de
aves insetívoras e o mais importante na dieta global das aves, durante o período
chuvoso e seco, mostrando que seu consumo não caracteriza uma dieta oportunista,
o que difere do encontrado por Poulin et al. (1994). Outro fato que contribui para o
consumo de Coleoptera não ser oportunista foi sua seletividade, em ambos os
63
períodos, por T. pelzelni, F. grisea, V. olivaceus, B. flaveolus e T. Flaviventris, e a
sua baixa abundância no ambiente.
A predominância de Coleoptera na dieta das aves da Mata do Olho D’água já
era prevista, pois esse é o item mais comum na dieta das aves tropicais (Champman
e Rosenberg 1991; Poulin et al. 1992; Chesser 1995; Mestre 2002; Durães e Marini
2005). Esta predominância é corroborada pela sua difícil digestão (Levey e Karasov
1989, Major 1990) e fácil identificação.
Formicidae também foi um item importante na dieta global das aves insetívoras,
principalmente durante o período seco. O seu consumo, assim como o de
Coleoptera, era de se esperar, pois já foi relatado em outros trabalhos (Poulin et al.
1992; Lopes et al. 2005b). De acordo com Poulin e Lefebvre (1995) e Durães e
Marini (2005) a abundância deste táxon no ambiente, bem como seus hábitos
sociais, contribuem para o seu elevado consumo, mostrando que sua presença na
dieta reflete uma dieta oportunista (Poulin et al. 1994). Este item alimentar não
apresentou seletividade positiva na dieta global das aves insetívoras e, muito
menos, quando analisado para algumas espécies, tais como: T. pelzelni, B. flaveolus
e T. flaviventris.
A presença de sementes na dieta foi contabilizada em dez espécies de aves.
Pressupõe-se que o consumo deste item foi feito juntamente com o fruto, pois foi
observada a presença de polpa ou pedaços de frutos junto ao material coletado,
corroborando com que foi proposto por Durães (2001). Outro fator que pode
confirmar o consumo das sementes junto com frutos deve-se ao fato das espécies
amostradas serem insetívoras e não granívoras e, também, pelas sementes não
apresentarem nenhum tipo de mandibulação.
64
A dificuldade em determinar a quantidade de sementes e frutos nas amostras
favoreceu a superestimação de sementes, onde sua presença, indiferente de estar
com polpa ou pedaços de frutos, acabou por ser identificada apenas como
sementes. Nas amostras que foram identificadas frutos, este foi devido a sua
presença intacta.
A família Thamnophilidae apresenta espécies exclusivamente insetívoras (Sick
1997), podendo, em algumas situações, ocorrer o consumo de frutos/sementes
(Zotta 1936, 1940; Piratelli e Pereira 2002) e vertebrados (Lopes et al. 2005a). De
acordo com os autores citados acima, este consumo é realizado, em sua maioria,
por espécies do gênero Thamnophilus. O que pode ser confirmado neste trabalho,
onde T. pelzelni apresentou elevado consumo de sementes, concentrado em sua
maioria durante a estação seca. Este consumo de material vegetal pode ser
corroborado pela baixa abundância de artrópodes na folhagem dos arbustos e
árvores da mata do Olho D’água durante o período seco, cujo estrato é utilizado
para o forrageio da ave. Neste caso, T. pelzelni buscou fontes alternativas de
energia durante a escassez de itens-presas. Além disso, T. capistratus apresentou
consumo de Amphibia durante a estação chuvosa, período em que ocorreram todas
as capturas de Amphibia pelas pitfall traps.
Os tiranídeos podem utilizar vários recursos alimentares, apresentando
espécies dentro das diversas guildas, tais como onívoros (e.g. Pitangus
sulphuratus), insetívoros (e.g. Tyrannus melancholicus) e frugívoros (e.g. Elaenia
chiriquensis) (Sick 1997). Neste estudo, observamos a presença de sementes/frutos
na dieta de todos os tiranídeos insetívoros analisados. O consumo de
sementes/frutos pelos tiranídeos ocorreu durante o período de seca. Este consumo
de material vegetal, também, está relacionado com o estrato ocupado pelos
65
tiranídeos para o forrageio. Em estudos realizados por Schubart et al. (1965), Poulin
et al. (1994) e Durães (2001) foram observados o consumo de fruto/sementes por C.
fuscatus, M. viridicata e T. flaviventris.
A dieta de C. fuscatus apresentou sementes como o item mais abundante, o
que difere do encontrado por Poulin et al. (1994), onde foi observada uma dieta
exclusivamente insetívora, com pequeno consumo de frutos e sementes. Este
consumo por sementes ocorreu durante o período seco, o que também foi
observado por Poulin et al. (1994) para outros tiranídeos. Cnemotriccus fuscatus
apresentou uma grande seletividade de presas durante os dois períodos.
T. flaviventris apresentou dieta exclusivamente insetívora, tendo consumido
pequenas quantidades de sementes durante o período seco, semelhante ao
encontrado por Poulin et al. (1994).
Para H. amaurocephalus a proporção de insetos foi maior do que o consumo de
sementes, mostrando uma dieta insetívora, o que foi contrário ao trabalho de
Schubart et al. (1965) e Durães (2001). Vireo olivaceus apresentou grande
quantidade de sementes e frutos, tendo seu maior consumo durante o período seco.
Em estudos realizados por Poulin et al. (1994), V. olivaceus alimentou-se de
artrópodes, semente e frutos. Entretanto, Robinson e Holmes (1982) encontraram na
dieta desta espécie amostras com insetos, enquanto que Leck (1972) em seus
estudos no Panamá presenciou o consumo de frutos. Neste caso, podemos
classificá-lo como uma espécie onívora, corroborando com Schubart et al. (1965) e
Durães e Marini (2003).
Nas amostras individuais, B. flaveolus apresentou preferência alimentar por
Hymenoptera, durante o período seco, e por Hemiptera não Heteroptera, no período
chuvoso. A sua dieta foi caracterizada como exclusivamente insetívora, o mesmo foi
66
observado por Marini e Cavalcanti (1993) e por Piratelli e Pereira (2002).
Basileuterus culicivorus, também apresentou dieta exclusivamente insetívora, com
Coleoptera como o item alimentar mais abundante, semelhante ao encontrado por
Chatellenaz (2002) e, por Lima e Manhães (2009). No estudo realizado por Lima e
Manhães (2009), além de Coleoptera, foi observado Araneae e Larvas de insetos
como itens alimentares mais representativos. Em seus estudos, Lima e Manhães
(2009), observaram na dieta de B. culicivorus preferência alimentar por larva de
insetos. No presente estudo Araneae e larva de insetos não estiveram presentes na
dieta de B. culicivorus, isto deve ao fato das amostragens terem sido poucas e
durante o período seco, onde foi observada pequena abundância de artrópodes no
ambiente.
Galbula ruficauda apresentou na sua dieta elevada quantidade de Coleoptera,
seguido por Hymenoptera. Em estudos realizados por Fry (1970) e por Pinheiro et al.
(2003), Hymenoptera foi o item mais consumido por esta espécie. O consumo de
Odonata, também, foi observado por Pinheiro et al. (2003). A principal diferença
encontrada entre nosso estudo e o realizado por Pinheiro et al. (2003), diz respeito
ao consumo de Coleoptera. Em seus estudos, G. ruficauda não foi observada
consumindo Coleoptera, isto pode estar relacionado com o método utilizado pelo
autor, onde as observações são menos precisas do que as amostras estomacais
para determinar a dieta da espécie.
67
5.2. Disponibilidade de presas, sobreposição e amplitude de nicho:
Estudos com abundância de invertebrados nas regiões tropicais apresentam
variações sazonais com aumento na abundância durante o período chuvoso e
declínio durante o período seco (Wolda 1978; Wolda e Fisk 1981; Develey e Peres
2001). De acordo com Orians (1980), este aumento está relacionado com as
atividades reprodutivas dos invertebrados, resultando num aumento das populações
neste período. Durante o período seco a diminuição das populações de
invertebrados por ser explicada pela escassez de alimentos e pela dificuldade de
repor as suas necessidades hídricas (Janzen e Schoener 1968). A Mata do Olho
D’água é marcada por período chuvoso longo e um período seco curto e marcante.
Esta característica contribuiu para que ocorresse pico na abundância de
invertebrados durante o período chuvoso.
Esta maior abundância de presas durante o período chuvoso faz com que
ocorra uma maior sobreposição alimentar (Smith et al. 1978), enquanto que no
período seco, a menor abundância de presas possibilita maior especialização na
dieta das aves locais aumentando a segregação de nicho trófico (Durães 2001).
Estas diferenças sazonais na composição de presas influenciaram os valores de
sobreposição de nicho da comunidade de aves insetívoras da Mata do Olho D’água,
cujos valores de sobreposição de nicho foram maiores durante o período chuvoso,
indicando que a comunidade esteve estruturada de forma diferenciada entre os
períodos. Estes valores de sobreposição elevados durante o período chuvoso,
também foi observado em estudos tróficos de aves insetívoras realizados em áreas
com fitofissionomias diferentes da Mata do Olho D’água (Durães 2001; Mestre
2002). Isto vem a confirmar que a composição da dieta das aves do sub-bosque e o
68
grau de sobreposição sofrem influência de padrões sazonais (Smith et al. 1978;
Loiselle e Blake 1990) e que as diferenças observadas na estruturação da
comunidade de aves da Mata do Olho D’água não foram ao acaso.
Os elevados graus de sobreposição observados durante o período chuvoso na
comunidade de aves insetívoras local sugerem que esteja ocorrendo competição por
recurso alimentar dentro da comunidade. Porém, esta afirmação é totalmente
refutada. Por dois motivos: (1), a grande disponibilidade de presas durante o período
chuvoso faz com que as aves se alimentem de foram oportunista, fazendo com que
os valores de sobreposição sejam elevados durante o período chuvoso. Este fato
pode ser corroborado com os estudos realizados com aves seguidoras de formigas
de correição. Durante o período de abundância do inseto, as aves alimentaram-se
demasiadamente, de forma oportunista, possibilitando elevado grau de sobreposição
(Chesser 1995) e (2), os valores de amplitude de nicho não mostraram diferenças
entre o tamanho do nicho ocupado pelas espécies estudadas com o peso médio das
aves durante o período chuvoso. De acordo com Durães (2001), a falta de
correlação entre o peso médio das aves e o tamanho do nicho é um indício de que
as espécies não estejam competindo por alimento.
Durante o período seco, observamos maior segregação entre os nichos tróficos
da comunidade de aves local. Esta segregação está fundamentada pela escassez
de recurso alimentar, que é comum durante o período de estiagem (Janzen e
Schoener 1968) fazendo com que ocorra especialização na dieta das aves insetívora
local. Também, podemos verificar a falta de correlação entre o peso médio das aves
e o tamanho do nicho ocupado durante o período seco.
69
5.3. Eletividade:
Apesar da grande diversidade de itens alimentares presente na dieta das aves
insetívoras da mata do Olho D’água, os resultados da eletividade mostraram que a
dieta apresenta-se especializada, tendo em vista que a maioria dos itens alimentares
mais selecionados pelas aves foram os menos abundantes no ambiente durante os
dois períodos.
Na Mata do Olho D’água, podemos observar que T. pelzelni forrageava apenas
sobre um estrato (folhagem), esta especialização no comportamento de forrageio fez
com que a seletividade positiva de itens-presas fosse maior durante o período
chuvoso e menor durante o período seco, tendo em vista que durante o período
seco, a vegetação da mata do Olho D’água apresenta característica decidual de até
80%, o que favorece a redução da fauna de artrópodes nas folhagens das árvores e
arbustos, influenciando sazonalmente na dieta das aves insetívoras que utilizam
apenas as folhagens como substrato de forrageio. Para F. grisea, cuja espécie
forrageia utilizando dois estratos (folhagem e solo), a seletividade positiva de presas
sofreu pouca influência sazonal, tendo em vista que a oferta de recursos para a
espécie tornou-se maior pelo fato de poder utilizar os recursos alimentares presentes
nos dois estratos, porém a sua dieta também foi especializada.
Nas demais espécies, a seletividade positiva de presas foi praticamente
semelhante entre o período chuvoso e seco, mostrando que as espécies
apresentaram dieta especialista sem influência sazonal. Isto pode ser observado
para C. fuscatus, T. flaviventris, V, olivaceus e B. flaveolus.
70
5.4. Utilização do emético:
O uso do tártaro foi eficiente na obtenção de conteúdo estomacal. A taxa de
morte presente neste trabalho aponta o método como sendo seguro em estudos de
dieta de ave de florestas decíduas. Isto pode ser confirmado com os dados
presentes em trabalhos anteriores, onde a taxa de morte foi igual ou inferior a 10 %
das aves administradas pela solução (Prys-Jones et al. 1974; Tomback 1975; Poulin
et al. 1994; Poulin e Lefebvre 1995; Mallet-Rodrigues et al. 1994; Durães e Marini
2003; Lopes et al. 2005).
71
6. CONCLUSÃO:
A comunidade de aves insetívoras da Mata do Olho D’água apresentou uma
dieta diversificada;
O pico na disponibilidade de presas ocorreu durante o período chuvoso, o que
proporcionou maior sobreposição de nicho, enquanto que no período seco ocorreu
maior segregação de nicho;
O tamanho corporal das aves capturadas durante o período chuvoso e seco
não apresentou correlação com o tamanho do nicho, mostrando ausência de
competição durante os períodos chuvoso e seco;
O índice de eletividade apontou para dieta especializada, tendo em vista que a
maioria dos itens alimentares mais selecionados pelas aves foram os menos
abundantes no ambiente durante os dois períodos;
O índice de eletividade calculado sugere que a dieta das espécies T. pelzelni e
F. grisea sofreram influência sazonal;
O tártaro emético mostrou-se seguro em estudos de dieta de aves de florestas
decíduas.
72
6. REFERÊNCIAS
Alves, M. A. S. 1991. Dieta e tática de forrageamento de Neothraupis fasciata em
Cerrado no Distrito Federal, Brasil (Passeriforme: Emberizidae). Ararajuba 2: 25-
29.
Alves, M. A. S.; Duarte, M. F. 1996. Tática de forrageamento de Conopophaga
melanops (Passeriformes: Formicariidae) na área de Mata Atlântica da Ilha
Grande, Estado do Rio de Janeiro. Ararajuba 4: 110-112.
Argel-de-Oliveira, M. M.; Castiglioni, G. D. A.; Souza, S. B. 1996. Comportamento
alimentar de aves frugívoras em Trema micratha (Ulmaceae) em duas áreas
alteradas do sudeste brasileiro. Ararajuba 4: 51-55.
Bartholomew, G. A. 1986. The role of natural history in contemporary biology.
Bioscience 36: 324-329.
Borror, D. J.; De Long, D. M.; Triplehornm, C. A. 1976. An Introduction to the study of
insects. Fourth edition. Holt, Rinehart and Winston. New York..
Buger, J. C.; Patten, M. A.; Rotenberry, J. T.; Redak, R. A. 1999. Foraging ecology of
the California gnatcatcher deduced from fecal samples. Oecologia 120: 304-310.
Buzzi, Z. J. 2002.Entomologia Didática. Curitiba: Editora UFPR.
Brooke, M. L. 1983. Ecological segregation of woodcreepers (Dendrocolaptidae) in
the State of Rio de Janeiro, Brasil. Ibis 125: 562-567.
Brooks, D. M. 1997. Avian seasonality at a locality in the central Paraguayan Chaco.
El Hornero 14: 193-203.
Brown Jr., W. L.; Wilson, E. O. 1956. Character displacement. Systematic Zoology 5:
49-64.
73
Cestaro, L. A.; Soares, J. J. 2004. Variações florísticas e estrutural e relação
fitogeográficas de um fragmento de floresta decídua no Rio Grande do Norte,
Brasil. Acta Botânica Brasilica 18: 203-218.
Chapman, A.; Rosenberg, K. V. 1991. Of Four Sympatric Amazonian Woodcreepers
(Dendrocolaptidae). The Condor 93: 904-915.
Chatellenaz, M. L. 2002. Análisis de la dieta de dois espécies del gênero
Basileuterus (Aves: Parulidae) del nordeste argentino. Comunicaciones Científicas
Y Tecnológicas/Universidad Nacional del Nordeste, Resistência. http:
//www.unne.edu.ar/Web/cyt/cyt/2002/06-Biologicas/B-046.pdf (último acesso em
17/05/2010).
Chesser, R. T. 1995. Comparative diets of obligate ant-following birds at a site in
northern Bolívia. Biotropica 27: 382-390.
Cooper, R. J.; Whitmore, R. C. 1990. Arthropod sampling methods in ornithology, p.
29-37.in: Morrison, M. L.; Ralph, C. J.; Verner, J.; Jehl, jr, J.R. (eds.) in: Avian
Foraging: theory, methodology, and applications. Lawrence: Cooper
Ornithological Society (Studies in Avian Biology 13).
Costa, C.; Ide, S.; Simonka, C. E. 2006. Insetos Imaturos. Metamorfose e
identificação. Ribeirão Preto: Editora Holos.
Develey, P. F.; Peres, C. A. 2000. Resource seasonality and the structure of mixed
species birds flocks in a coastal Atlantic Forest of southeastern Brazil. Journal of
Tropical Ecology 16: 33 – 53.
Durães, R. 2001. Ecologia alimentar de aves de sub-bosque de Mata Atlântica em
Minas Gerais. Dissertação de Mestrado. UFMG.
74
Durães, R.; Marini, M. A. 2003. An evalution of the use of Tatar Emetic in the study of
bird diets in the Atlantic Forest of southeastern Brazil. Journal Field Ornithology
74: 207-280.
Durães, R.; Marini, M. A. 2005. A quantitive assessment of bird diets in the brazilian
Atlantic Forest, with recommendations for future diet studies. Ornitologia
neotropical 16: 65-83.
Faustino, T. C.; Machado, C. G. 2006. Frugivoria por aves em uma área de campo
rupestre na Chapada Diamantina, BA. Revista Brasileira de Ornitologia 14: 137-
143.
Fitzpatrick, J. W. 1985. Form, foraging behavior, and adaptative radiation in the
Tyrannidae. Ornith. Monogr. 36: 447-470.
Francisco, M. F.; Galetti, M. 2001. Frugivoria e dispersão de sementes de Rapanea
lancifolia (Myrsinaceae) por aves numa área de cerrado do Estado de São Paulo,
sudeste do Brasil. Ararajuba 9: 13 – 19.
Fretwell, S. D. 1969. Ecotypic variation in the non-breeding season in migratory
populations: a study on tarsal length in some Fringillidae. Evolution 23: 406-420.
Fry, C. H. 1970. Convergence between jacamars and bee-eaters. Ibis 112: 257-259.
Galetti, M; Pizo, M. A. 1996. Fruit eating by birds in a forest fragment in southeastern
Brazil. Ararajuba 4: 71-79.
Gaston, A. J. 1974. Adaptation in the genus Phylloscopus. Ibis 116: 432-450.
Hempel, A. 1949. Estudo da alimentação natural de aves silvestres do Brasil.
Arquivos do Instituto de Biologia São Paulo 19: 237-268.
Herzog, S. K.; Soria, R. A.; Matthysen, E. 2003. Seasonal variation in avian
community composition in a high-andean Polulepis (Rosaceae) forest fragment.
Willson Bulletin 115: 438-447.
75
Hutto, R. L. 1990. Measuring the Availability of Food Resources. Studies in Avian
Biology 13: 20-28.
IBGE. 1992. Manual Técnico da Vegetação Brasileira. CDDI-IBGE, Rio de Janeiro.
(série Manuais Técnicos de Geociências, n.1).
Ivlev, V. S. 1961. Experimental ecology of the feeding of fishes. New Haven: Yale
University Press.
Janzen, D. H.; Schoener, T. W. 1968. Differences in insect abundance and diversity
between wetter and drier sites during a tropical seanson. Ecology 49: 96-110.
Karr, J. R. 1976. Seasonality, resource availability, and community diversity in
tropical bird communities. American Nature 110: 973-994.
Kawakami, E.; Vazzoler, G. 1980. Método gráfico e estimativa de índice alimentar
aplicado no estudo de alimentação de peixes. Instituto Oceanográfico de São
Paulo 205 – 207.
Kear, J. 1985. Food selection. Pp. 234 – 235. Em Campbell, B.; Lack, E. (eds.). A
dictionary of birds. Poyser, Calton, UK.
Krebs, J. R. 1978. Optimal foraging: decision rules for predators. Ch. 2 in: Krebs, J.
R.; Davies, N. B. (eds.). Behavioural Ecology: and evolutionary approach.
Blackwell Scientific Publications, Oxford.
Krebs, J. R. 1980. Optimal Foraging: Predation Risk and Territory Defence. Ardea
68: 83-90.
Krügel, M. M.; Burger, M. I.; Alves, M. A. 2006. Frugivoria por aves em Nectandra
megapotamica (Lauraceae) em uma área de Floresta Estacional Decidual no Rio
Grande do Sul, Brasil. Iheringia 96: 17-24.
Levey, D. J.; Karasov, W .H. 1989. Digestive responses of temperate birds switched
to fruit or insect diet. The Auk 106: 675-686.
76
Leck, C. F. 1972. Seasonal changes in feeding pressures of fruit – and nectar –
eating birds in Panamá. The Condor 74: 54-60.
Lima, A. L. C.; Manhães, M. A. 2009. Hábitos Alimentares de Basileuterus culicivorus
(Aves: Parulidae) em uma Área de Mata Atlântica secundária, Sudeste do Brasil.
Biotaneotropica 9: 00-00.
Loiselle, B. A.; Blake, J. G. 1990. Diets of understory fruit-eating birds in Costa Rica:
Seasonality and Resource abudance. Studies in Avian Biology 13: 91-103.
Lopes, L. E. 2005. Dieta e comportamento de forrageamento de Suiriri affinis e S.
islerorum (Aves, Tyrannidae) em um cerrado do Brasil central. Iheringia 95: 341-
345.
Lopes, L. E.; Fernandes, A. M.; Marini, M. A. 2005a. Predation on vertebrates by
neotropical passerine birds. Lundiana 6: 57-66.
Lopes, L. E.; Fernades, A. M.; Marini, M. A. 2005b. Diet of some Atlantic Forest birds.
Ararajuba 13: 95-103.
Machado, C. G. 2009. Beija-flores (Aves: Trochilidae) e seus recursos florais em
uma área de caatinga de Chapada Diamantina, Bahia, Brasil. Zoologia 26: 255-
265.
Machado, C. G.; Coelho, A. G.; Santana, C. S.; Rodrigues, M. 2007. Beija-flores e
seus recursos florais em uma área de campo rupestre da Chapada Diamantina,
Bahia. Revista Brasileira de Ornitologia 15: 267-279.
Major, R. E. 1990. Stomach flushing of an insectivorous bird: An assessment of
differential digestibility of prey and the risk to the birds. Australian. Wildlife.
Research 17: 647-657.
Malizia, L. R. 2001. Seasonal fluctuations of birds, fruits, and flowers in a subtropical
forest of Argentina. The Condor 103: 45 – 61.
77
Mallet-Rodrigues, F.; Alves, V. S.; Noronha, M. L. M. 1997. O uso do tártaro emético
no estudo da alimentação de aves silvestres no estado do Rio de Janeiro.
Ararajuba 5: 219-228.
Manhães, M. A. 2003a. Variação Sazonal da Dieta e do Comportamento de
Traupíneos (Passeriformes: Emberezidae) em Ibitipoca, Mias Gerais, Brasil.
Ararajuba 11: 45 – 55.
Manhães, M. A. 2003b. Dieta de Traupíneos (Passeriformes: Emberezidae) no
Parque Estadual do Ibitipoca, Minas Gerais, Brasil. Iheringia 93: 59 – 73.
Manhães, M. A. 2007. Ecologia Trófica de aves de sub-bosque em duas áreas de
Mata Atlântica no sudeste do Brasil. Tese de Doutorado. UFSCar-SP.
Marchetti, K.; Price, T.; Richman, A. 1995. Correlates of wing morphology with
foraging behaviour and migration distance in the genus Phylloscopus. Journal of
Avian Biology 26: 177-181.
Marini, M. A. 1992. Foranging behaviour and diet of the Helmented manakin. The
Condor 94: 151-158.
Marini, M. A.; Cavalcanti, R. B. 1993. Habitat and foraging substrate use of three
Basileuterus warblers from central Brazil. Ornitologa Neotropical 4: 69-76.
Martin, T. E.; Karr, J. R. 1986. Temporal dynamics of neotropical birds with special
reference to frugivores in second-growth woods. Wilson Bulletin 98: 38-60.
Mestre, L. A. M. 2002. Dieta de aves insetívoras terrestres e a disponibilidade de
presas em fragmentos florestais amazônicos. Dissertação de Mestrado. UFSCar-
SP.
Moojen, J.; Carvalho, J. C. M.; Lopes, H. S. 1941. Observações sobre o conteúdo
gástrico das aves brasileiras. Memórias do Instituto Oswaldo Cruz 36: 405-444.
78
Moorman, C. E.; Bowen, L. T.; Kilgo, J. C.; Sorenson, C. E.; Hanula, J. L.; Horn, S;
Ulyshen, M. D. 2007. Seasonal diets of insectivorous birds using canopy gaps in
a bottomland forest. Journal Field Ornithology 78: 11 – 20.
Motta-Júnior, J. C.; Talamoni, S. A. 1996. Biomassa de presas consumidas por Tyto
alba (Strigiformes: Tytonidae) durante a estação reprodutiva no Distrito Federal.
Ararajuba 4: 38 – 41.
Morse, D. H. 1971. The insectivorous bird as an adaptative strategy. Ann. Rev. Ecol.
Syst. 2: 177-200.
Morse, D. H. 1974. Niche breadth as a function of social dominance. American
Naturalist. 108: 818-830.
Murakami, M. 2002. Foraging mode shifts of four insectivorous birds species under
temporally varying resource distribution in a Japanese Deciduous Forest.
Ornithological science 1: 63-69.
Naranjo, L. G.; Ulloa, P. C. 1997. Diversidad de insectos y aves insectivoras de
sotobosque em habitats pertubados de selva lluvosa tropical. Caldesia 19: 507-
520.
Orians, G. H. 1980. Some adaptations of marsh-nesting blackbirds. Monographs in
Population Biology 14: 295pp.
Pereira, G. A.; Coelho, G.; Dantas, S. M.; Roda, S. A.; Farias, G. B.; Periquito, M. C.;
Brito, M. T.; Pacheco, G. L. 2006. Ocorrência e hábitos alimentares do falcão-
peregrino Falco peregrinus no Estado de Pernambuco, Brasil. Revista Brasileira
de Ornitologia 14: 435-439.
Pianka, E. R. 1973. The structure of lizard communities. Annual Review of Ecology
and Systematics 4: 53-74.
79
Pineschi, R. B. 1990. Aves como dispersoras de sete espécies de Rapanea
(Myrsinaceae) no maciço do Itatiaia, estado do Rio de Janeiro e Minas Gerais.
Ararajuba 1: 73-78.
Pinheiro, C. E. G.; Bagno, M. A.; Brandão, R. A. 2003. Diet and foraging behavior of
the rufous-tailed jacamar (Galbula ruficauda, Galbulidae) in central Brazil.
Ararajuba 11: 241-243.
Piratelli, A.; Pereira, M. R. 2002. Dieta das aves na região leste de Mato Grosso do
Sul, Brasil. Ararajuba 10: 131-139.
Podulka, S.; Rohrbaugh Jr, W.; Bonney, R, Eds. 2004. Handbook of Birds Biology, 2ª
ed. Cornell Lab of Ornithology , Ithaca, New York.
Poulin, B.; Lefebvre, G.; McNeil, R. 1992. Tropical avian phenology in relation to
abundance and exploitation of food resources. Ecology 73: 2295-2309.
Poulin, B.; Lefebvre, G. 1995. Additional information on the use of tatar emetic in
determining the diet of tropical birds. The Condor 97: 897-902.
Poulin, B.; Lefebvre, G.; McNeil, R. 1994. Diets of land birds from northeastern
Venezuela. The Condor 96: 354-367.
Poulin, B.; Lefebvre, G.; Ibáñez, R.; Jaramillo, C.; Hernández, C.; Randa, A. S. 2001.
Avian predation upon lizards and frogs in Neotropical forest understorey. Journal
of Tropical Ecology 17: 21-40.
Price, T. 1991. Morphology and ecology of breeding warblers along an altitudinal
gradient in Kashmir, India. Journal Animal Ecology 60: 643-664.
Price, T. D.; Helbig, A. J.; Richman, A. D. 1997. Evolution of breeding distribution of
old world leaf warblers (genus Phylloscopus). Evolution 51: 552-561.
Prys-Jones, R. P.; Schifferli, L.; MacDonald, D. W. 1974. The use of an emetic in
obtaining food samples from passerines. Íbis 116: 90-94.
80
Ralph, C. P.; Nagata, S. E.; Ralph, J. 1985. Analysis of Droppings to Describe Diets
of Small Birds. Journal Field Ornithology 56: 165-174.
Riehl, C.; Adelson, G. S. 2008. Seasonal insectivory by Black-headed Trogons, a
tropical dry forest frugivore. Journal Field Ornithology 79: 371 – 380.
Robinson, S. K.; Holmes, R. T. 1982. Foranging behavior of forest birds: the
relationships among search tactics, diet, and habitat structure. Ecology 63: 1918-
1931.
Roda, S. A. 2006. Dieta de Tyto alba na Estação Ecológica do Tapacurá,
Pernambuco, Brasil. Revista Brasileira de Ornitologia 14: 449-452.
Rosenberg, K. V.; Cooper, R. J. 1990. Approach to Avian Diet Analysis, p. 80-90. in:
Morrison, M. L; Ralph, C. J; Verner, J; Jehl, jr, J. R. (eds.) in: Avian Foraging:
theory, methodology, and applications. Lawrence: Cooper Ornithological Society
(Studies in Avian Biology 13).
Schoener, T. W. 1974. Resource partitioning in ecological communities. Science 185:
27-39.
Schubart, O.; Aguirre, A. C.; Sick, H. 1965. Contribuição para o conhecimento da
alimentação das aves brasileiras. Arquivos de Zoologia de São Paulo 12:95-249.
Sherry, T. W. 1990. when are birds dietarily specialized? Distinguishing ecological
from evolutionary approaches. Studies in Avian Biology 13: 337-352.
Sick, H. 1997. Ornitologia brasileira, uma introdução. Rio de Janeiro: Editora Nova
Fronteira.
Smith, J. N. M.; Grant, P. R.; Grant, B. R.; Abbolt, I. J.; Abbot, L. K. 1978. Seasonal
variation in feeding habitas of Darwin’s ground finches. Ecology 59: 1137-1150.
Stouffer, P. C.; Bierregaard, R. O. 1995. Use of Amazonian forest fragments by
understory insectivorous birds. Ecology 76: 2429-2445.
81
Tebbich, S.; Tabordky, M.; Fessl, B.; Dvorak, M.; Windler, H. 2004. Feeding behavior
of four arboreal Darwin’s finches: adaptations to spatial and seasonal variability.
The Condor 106: 95-105.
Tomback, D. F. 1975. An emetic technique to investigate food preferences. The Auk
92: 581-583.
Unno, A. 2002. Tree species preferences of insectivorous birds in a japanese
deciduous forest: the effect of different foraging techniques and seasonal change
of food resources. Ornithological science 1: 113-142.
Wiens, J. A. 1989. The ecology of bird communities, v.1. New York: University Press.
Willis, E. O.; Oniki, Y. 1992. As aves e as formigas de correição. Boletim do Museu
Paraense Emilio Goeldi, série Zoologia 8: 123-150.
Wolda, H. 1978. Fluctuations in Abundance of Tropical Insects. The American
Naturalist 988: 1017 – 1045.
Wolda, H. 1990. Food Availability for an Insectivore and how to Measure it. Studies in
Avian Biology 13: 38 – 43.
Wolda, H.; Fisk, F. W. 1981. Seasonality of Tropical Insects. II Blattaria in Panamá.
Journal of Animal Ecology 50: 827 – 838.
Zotta, A. 1936. Sobre el contenido estomacal de aves argentinas. El Hornero 6: 261-
270.
Zotta, A. 1940. Lista sobre el contenido estomacal de aves argentinas. El Hornero 7:
402-411.
82
Anexo 1
. F
req
uênci
a d
e p
resa
s co
nsu
mid
as
entr
e m
arç
o d
e 200
8 e d
eze
mb
ro d
e 20
09
por
aves
inse
tívo
ras
da
Mata
do
Olh
o
D’á
gu
a, M
aca
íba,
RN
. A
C =
Aca
ri, A
R =
Ara
neae,
SC
= S
colo
pen
dro
morp
ha,
OD
= O
donat
a, O
R =
Ort
hopt
era
, M
A =
Manto
de
a,
PH
= P
hasm
ida,
BL =
Bla
todea,
IS =
Iso
pte
ra,
HH
= H
em
ipte
ra H
ete
ropt
era
, H
ñH
= H
emip
tera
não H
ete
ropt
era
, C
O =
Col
eop
tera
,
HY
= H
yme
nop
tera
, F
O =
Form
icid
ae,
LC
= L
arv
a de
Col
eop
tera
, LL =
Larv
a d
e L
epid
opte
ra,
OI
= O
vo d
e I
nse
tos,
FR
= F
ruto
, S
E
= S
em
ente
, A
M =
Am
phib
ia,
Ver
t =
Ver
tebra
do.
Art
rópo
des
ve
geta
l V
ert
A
ves
inse
tívo
ras
AC
A
R
SC
O
D
OR
M
A
PH
B
L
IS
HH
H
ñH
C
O
HY
F
O
LC
LL
OI
FR
S
E
AM
Gal
bulidae
Galb
ula
ruficaud
a
(nch
uva =
7;
n sec
a =
2)
3
3
1
2
22
12
2
1
Bucco
nid
ae
Nysta
lus m
acula
tus
(nse
ca =
1)
1
3
2
Pic
idae
Pic
um
nus f
ulv
escens
(nse
ca =
1)
1
12
83
Anexo 1
. C
ontin
uaçã
o
Tham
nophili
dae
AC
A
R
SC
O
D
OR
M
A
PH
B
L
IS
HH
H
ñH
C
O
HY
F
O
LC
LL
OI
FR
S
E
AM
Tara
ba m
ajo
r
(nch
uva =
3;
n sec
a =
2)
2
6
1
8
5
1
19
Tha
mn
op
hilu
s c
apis
tra
tus
(nch
uva =
1)
3
10
1
Tha
mn
op
hilu
s p
elz
eln
i
(nch
uva =
12; n s
eca
= 7
)
5
1
5
3
17
37
2
33
2
1
11
89
Myrm
orc
hilu
s s
trig
ilatu
s
(nch
uva =
1)
6
4
2
Form
iciv
ora
grisea
(nch
uva =
7;
n sec
a =
4)
4
3
2
4
16
4
1
2
84
Anexo 1
. C
ontin
uaçã
o
Den
dro
cola
ptidae
Dendro
ple
x p
icus
(nch
uva =
2)
AC
2
V
SC
O
D
OR
M
A
PH
B
L IS
H
H
HñH
4
C v
HY
2
FF
2 C
LL
O
I F
R
SE
A
M
Furn
ariidae
Furn
arius le
uco
pus
(nch
uva =
6;
n sec
a =
1)
2
3
4 3
2
30
18
1
6
1
Synalla
xis
scuta
ta
(nch
uva =
3;
n sec
a =
3)
3
4
1
4
5
2
3
Tyr
annid
ae
Cnem
otr
iccus f
uscatu
s
(nch
uva =
4;
n sec
a =
6)
5
1
1
3
3
25
4
10
9
33
Tolm
om
yia
s f
laviv
entr
is
(nch
uva =
9;
n sec
a =
8)
6
3
1
12
28
5
22
9
85
Anexo 1
. C
ontin
uaçã
o
Myio
pa
gis
virid
icata
(nch
uva =
3;
n sec
a =
2)
AC
1
R
SC
O
D
OR
M
A
PH
B
L
IS
HH
H
ñH
8
C
HY
F
O
6 L
1
L
OI
1
F
4
S
AM
He
mitriccus
marg
arita
ceiv
ente
r
(nch
uva =
6;
n sec
a =
2)
1
1
4
12
2
2 2
1
14
7
He
mitriccus s
tria
ticolli
s
(nch
uva =
5;
n sec
a =
1)
1
5
15
2
Vir
eonid
ae
Hylo
ph
ilus
am
auro
ceph
alu
s
(nch
uva =
10)
4
1
22
1
4
1
10
Vireo o
livaceus
(nch
uva =
10; n s
eca
= 4
)
6
3
3
10
1
6
10
11
3
86
Anexo 1
. C
ontin
uaçã
o
Tro
glo
dyt
idae
A
C
AR
S
C
OD
O
R
MA
P
H
BL
IS
HH
H
ñH
C
O
HY
F
O
LC
LL
OI
FR
S
E
AM
Canto
rchilu
s lo
ngir
ostr
is
(nch
uva =
6;
n sec
a =
3)
8
6
1
4
6
7
1
2
2
1
Par
ulidae
Basile
ute
rus f
lave
olu
s
(nch
uva =
20; n s
eca
= 6
)
10
7
1
1 1
18
65
21
30
2
4
Basile
ute
rus c
ulic
ivoru
s
(nse
ca =
6)
1
1
4
12
3
4
5