Modelos Atômicos – Sequência Histórica Modelos Atômicos devem: -Explicar observações...
Transcript of Modelos Atômicos – Sequência Histórica Modelos Atômicos devem: -Explicar observações...

Modelos Atômicos – Sequência Histórica
Modelos Atômicos devem:-Explicar observações experimentais;-Predizer novas observações;-Ser passível de novas modificações quando novos fatos forem descobertos.
Gregos Antigos:-Quatro elementos (fogo, ar, terra e água) se combinariam para formar tudo na natureza;- Obs: atualmente: mais de 100 elementos (111, em 2003), sendo 90 naturais.
Leucipo e Demócrito (idéia filosófica):- toda matéria era constituída por partículas indivisíveis denominadas átomos.

Modelos Atômicos – Sequência Histórica
Quanto à natureza elementar da matéria (gregos antigos):-Dois pontos de discussão:
-Questão da partícula contínua: átomo indivisível;-Termo hyler para descrever a natureza contínua da matéria
-Hoje:-Concepção atômica da matéria (descontínua);-Mas:
-algumas áreas da ciência:-natureza têm um comportamento contínuo;-Campos elétrico, gravitacional e magnético.


Modelos Atômicos – Sequência Histórica
Relembrando, Modelos Atômicos devem:-Explicar observações experimentais;-Predizer novas observações;-Ser passível de novas modificações quando novos fatos forem descobertos.
Sendo assim:Características do modelo atômico pressupõem que o mesmo possa evoluir ao
longo do tempo

Modelos Atômicos – Sequência Histórica
Fim do Século XVIII: Leis Ponderais (Leis das Combinações Químicas)
-Lei da Conservação de Massa (Lavoisier):‘Num sistema fechado, a massa total dos reagentes é igual a dos produtos”
-Lei da Composição Definida (Lei de Proust):-Lei das proporções constantes (múltiplas):“Toda substância apresenta uma proporção em massa constante em sua composição”

Modelos Atômicos – Sequência Histórica
Neste momento, cabe um parênteses:
-Lei:-Generalização que resume similaridades, regularidades e coerências reveladas a partir da análise cuidadosa dos dados científicos
-Teoria:-Respostas oferecidas para elucidar o porquê das leis;-Seu sucesso está na habilidade em sugerir novas propriedades ou comportamentos não observados anteriormente;-Usada para previsões que podem ser testadas posteriormente, por meio de novas experiências:
-Novos experimentos:-Concordam teoria tornam-na mais confiável;-Não concordam teoria modifica-se ou abandona-se a teoria

Modelos Atômicos – Sequência Histórica
Dessa Maneira: Leis Ponderais Teoria para explicá-las
1808: Teoria Atômica de Dalton (Modelo Atômico de Dalton):- Toda matéria é constituída de partículas fundamentais, os átomos;- Os átomos são permanentes e indivisíveis, eles não podem ser criados nem destruídos;- Todos os átomos de um elemento específico são iguais, têm o mesmo peso;- Átomos de elementos diferentes têm pesos diferentes;- As reações químicas consistem em uma combinação, separação ou rearranjo de átomos;- Compostos químicos são formados por átomos de dois ou mais elementos em uma razão fixa.

Modelos Atômicos – Sequência HistóricaLeis Ponderais à luz do modelo atômico de Dalton:Lei da Conservação das Massas:
-Teoria Atômica de Dalton:- cada átomo tem a sua própria característica;- átomos são rearranjados durante uma reação química.
-Consequência::- massa total dos átomos dos reagentes deve ser a mesma que a dos átomos dos produtos (Lei de Conservação das massas).
-Lei da Composição definida:-Teoria Atômica de Dalton:
-Compostos químicos são formados por átomos de dois ou mais elementos em uma razão fixa;-Todos os átomos de um elemento específico têm o mesmo peso;
-Consequência::- Toda substância apresenta uma proporção em massa constante em sua composição

Modelos Atômicos – Sequência Histórica
Modelo Atômico de Dalton:
Elementos Químicos e Massas Atômicas
-Época de Dalton: conhecidos aproximadamente 30 elementos;
-50 anos seguintes: 25 novos elementos;
-Hoje: mais de 100 elementos, dos quais 90 ocorrem naturalmente.
-Teoria Atômica de Dalton:
-Essencialmente adequada para acomodar todas essas novas descobertas;
-Exceção: existência dos isótopos

Modelos Atômicos – Sequência Histórica
Modelo Atômico de Dalton:
Elementos Químicos e Massas Atômicas
Teoria Atômica de Dalton:-Átomos de um dado elemento têm uma massa que é característica do elemento e que não
é afetada por transformações químicas;
-Elemento A reage com elemento B, formando composto AB:
-massas de A e B consumidas estão na proporção fixa 2:1;
-então, um átomo de A pesa o dobro do átomo de B;
-Elemento A reage com elemento B, formando composto A2B:
-massas de A e B consumidas estão na proporção fixa 2:1;
-então, um átomo de A pesa o mesmo que um átomo de B;
-Para ter confiança neste sistema:
-necessário conhecer as fórmulas corretas de muitos compostos;
-1805 a 1860: discordância considerável entre os cientistas quanto às fórmulas corretas de muitos
compostos;
-Culpa: Dalton e outros, que não consideravam as moléculas poliatômicas, tais como:
-O2, H2, N2

Modelos Atômicos – Sequência Histórica
Modelo Atômico de Dalton:
Elementos Químicos e Massas Atômicas- Tabela de massas atômicas elaborada:
-base: massa relativa dos átomos;
-estabeleceu-se um padrão arbitrário:
-massa de todos os átomos comparadas em relação a ele;
-Hoje: utiliza-se o isótopo do carbono-12.

Modelos Atômicos – Sequência Histórica
A Descoberta do elétronExperimentos em Tubos de Crookes:
-eletrodos do tubo são ligados a uma fonte de alta voltagem;
-tubo é conectado a uma bomba de vácuo;
-tubo é evacuado gradualmente por um pequeno tubo lateral;
- amostra de gás colocada em seu interior.
De acordo com a variação da pressão dentro do tubo, vários fenômenos são observados:
- pressões próximas à atmosférica: nada parece acontecer;
-pressões intermediárias: gás residual no tubo começa a emitir uma leve incandescência;
-baixas pressões:
-interior incandescente desaparece gradualmente;
-vidro na extremidade ânodo começa a emitir uma incandescência esverdeada;


Modelos Atômicos – Sequência Histórica
A Descoberta do elétronTubos de Crookes (baixas pressões):
-contendo uma amostra de sulfeto de zinco;
- lado da amostra voltado para o cátodo:
- emite uma incandescência fosforescente;
- sombra da amostra pode ser vista no ânodo no final do tubo;
- exame da superfície incandescente do sulfeto de zinco:
- incandescência composta de incontáveis e minúsculos flashes de luz brilhante
- todos os resultados podem ser obtidos:
- usando qualquer metal como eletrodo
- usando qualquer gás no tubo





Modelos Atômicos – Sequência HistóricaA Descoberta do elétron
Interpretação dos experimentos do Tubo de Crookes:
-é evidente que alguma coisa deixa o cátodo e viaja para o ânodo:
- denominado originalmente raio catódico;
-incandescência observada no sulfeto de zinco, indica que:
- raio catódico seja composto de um fluxo de minúsculas partículas;
- cada vez que uma partícula individual bate na superfície do sulfeto de zinco:
- um flash de luz é emitido
- partículas emitidas do cátodo viajam em linha reta:
- se pudessem percorrer vários caminhos em torno do sulfeto de zinco:
- a sombra no ânodo na extremidade do tubo seria indefinida

Modelos Atômicos – Sequência HistóricaA Descoberta do elétron
- pressões intermediárias:
- incandescência emitida pelo gás resulta da colisão das partículas em movimento com
moléculas do gás;
- baixas pressões:
- concentração de moléculas do gás muito baixas para produzir luz visível;
- sob estas condições, muitas partículas atingem o vidro no ânodo na extremidade do
tubo, causando incandescência

Modelos Atômicos – Sequência Histórica
A Descoberta do elétron1887 (Físico Inglês J.J. Thomson):
- mostrou que as partículas em raios catódicos são carregadas negativamente:
- raios podem ser desviados se passar entre placas de metais carregados opostamente
em um tubo de Crookes;
- direção do desvio (para a placa carregada positivamente):
- mostra que as partículas do raio catódico carregam uma carga elétrica negativa.
-Hoje:
- prova-se a existência desta carga negativa, mostrando o desvio destas cargas em um
campo magnético;
- Determinou também a razão e/m (carga por massa do elétron)



Modelos Atômicos – Sequência Histórica
A Descoberta do elétron-Partículas que emergem do cátodo em um tubo de Crookes:
-Possuem sempre as mesmas propriedades;
- independentes do material do cátodo;
- conclui-se: as partículas estão presentes em toda a matéria;
- Atualmente: estas partículas são chamadas elétrons

Modelos Atômicos – Sequência Histórica1909 (Físico Robert Millikan):
- experiência da gota de óleo:
- determinou a magnitude da carga negativa no elétron;
- vaporizou gotas de óleo entre duas placas metálicas carregadas opostamente;
- observou que tais gotículas caíam pelo ar sob influência da gravidade;

Modelos Atômicos – Sequência Histórica1909 (Físico Robert Millikan):
- irradiou o espaço entre as placas com raio X:
- que, chocando com as moléculas do ar:
-refletiam elétrons destas moléculas;
-alguns elétrons eram capturados pelas gotículas de óleo.
- carregando a placa superior positivamente e a inferior negativamente:
- poderia parar a queda de uma gota de óleo:
- ajuste da quantidade de carga elétrica nas placas;
- determinaria a carga;
- calcularia a dimensão da carga em uma única gotícula;
- cada gotícula poderia captar apenas um número inteiro de elétrons


Modelos Atômicos – Sequência Histórica1909 (Físico Robert Millikan):
- repetiu o experimento várias vezes:
- cada gotícula poderia captar apenas um número inteiro de elétrons
- cada gotícula era carregada por um múltiplo inteiro de -1,6 x 10 -19 C
- concluindo, dessa forma, que cada elétron possuía carga igual a -1,6 x 10 -19 C
- Thomson:
- tinha determinado razão carga-massa = 1,76 x 1011 C/kg
- de posse dessa informação:
- Millikan:
- massa do elétron = 9,1 x 10-28 gramas
- Millikan mostrou:
- todos os elétrons são idênticos (mesma massa e mesma carga)
- Elétrons:
- presentes em toda matéria;
- são idênticos

Modelos Atômicos – Sequência Histórica
A Descoberta do próton e do Neutrôn-Eugene Goldstein (1888):
-Tubo de Crookes modificado:
- colocado um cátodo perfurado;
- do cátodo perfurado:
- partem os elétrons ou raios catódicos (representados em vermelho);
- que se chocam com as moléculas do gás (em azul claro) contido no interior do tubo;

Modelos Atômicos – Sequência Histórica
A Descoberta do próton e do Neutrôn-Eugene Goldstein (1888):
-Com o choque, as moléculas do gás perdem um ou mais elétrons:
- originando íons positivos (em azul escuro):
-que repelidos pelo ânodo;
-são atraídos pelo cátodo;
-atravessam os furos e colidem com a parede do tubo de vidro,
- enquanto os elétrons:
-são atraídos pelo ânodo e;
- ao colidirem com a parede de vidro do tubo produzem fluorescência.


Modelos Atômicos – Sequência HistóricaA Descoberta do Próton e do Neutrôn
-Goldstein:
-Chamou este fluxo de íons positivos de raio canal;
- pela observação da direção da deflexão do raio canal (campo magnético ou elétrico):
-Provou que os raios eram carregados positivamente
-Diferente dos elétrons de um raio catódico:
-Partículas de um raio canal não são todas semelhantes:
-Mesmo que apenas um gás puro esteja presente no tubo;
-Elas detêm diferentes cargas (todas múltiplas de 1,6 x 10-19 C);
-Massas muito maiores que as de um elétron

Modelos Atômicos – Sequência HistóricaA Descoberta do Próton e do Neutrôn
-Para todos os outros elementos, excetuando o hidrogênio:
-massa dos seus átomos maior que a soma das massas dos seus elétrons e prótons;
-Durante alguns anos da década de 20:
-Diferença atribuída a uma outra partícula fundamental:
-O nêutron
-Mas ninguém a havia identificado
-1933 (J. Chadwick):
-Descobriu o nêutron;
-Desde então: reconhecemos o nêutron como uma partícula fundamental na estrutura atômica

Modelos Atômicos – Sequência HistóricaA Descoberta do Próton e do Neutrôn
-1933 (Descoberta do nêutron (Chadwick)):
- Num acelerador de partículas subatômicas:
- partícula alfa (núcleo átomo de hélio):
- lançada contra o núcleo do átomo de berílio;
-Na colisão:
-átomo de berílio adiciona a partícula alfa e transmuta-se:
- no elemento químico carbono-13, que por ser instável:
-elimina um nêutron e transmuta-se no carbono estável C-12
-O nêutron eliminado, ao atravessar um campo elétrico, não sofre desvio;
-Conclusão:
-o nêutron é uma partícula que não possui carga elétrica;
-mas que possui massa praticamente igual a do próton.

Modelos Atômicos – Sequência Histórica

Modelos Atômicos – Sequência HistóricaEspectrógrafo de Massa
-1898 (Wein):
- observou que os raios positivos também podiam ser desviados por um campo magnético;
-1913 (Thomson):
- aperfeiçoou o instrumento que media a carga e a massa dos raios positivos:
- Método dos desvios parabólicos dos raios canais submetidos a campos elétricos e magnéticos;
- espectrógrafo de massas:
-Feixe de partículas positivas (os raios canais):
-Era defeltido por um campo eletromagnético;
-Formando curvas visíveis;
-Cada uma delas associada a um certo valor e/m da partícula

Modelos Atômicos – Sequência HistóricaEspectrógrafo de Massa
-1913 (Thomson):
- primeiras comparações feitas por Thomson com o seu aparelho de desvios parabólicos:
-Muitos dos elementos pareciam obedecer ao segundo postulado de Dalton (inexistência de isótopos)
- produziu-se parábolas:
- que pareciam provir de grupos de átomos com diferentes velocidades;
- mas com as mesmas massas;
- apenas os inconclusivos resultados com o Neônio pareciam alimentar a crença na existência dos
isótopos não-radioativos;

Modelos Atômicos – Sequência HistóricaEspectrômetro de Massa
-Passos a serem seguidos:
-Preciso bombear o ar para fora do instrumento;
-Deixamos entrar na câmara:
-Um elemento:
- na forma de gás (Neônio, por exemplo);
- ou na forma de vapor de um elemento líquido ou sólido (mercúrio ou zinco, por exemplo);
-Átomos de gás ou vapor expostos a um feixe de elétrons muito rápidos:
-Elétron acelerado colide com um átomo:
-Choca-se com outro elétron, expelindo-o, deixando o átomo com carga positiva;
-Íons positivos:
-São acelerados para fora da câmara:
- forte campo elétrico aplicado entre as duas grades metálicas;
-Velocidades atingidas pelos íons:
-Dependem de suas massas

Modelos Atômicos – Sequência HistóricaEspectrômetro de Massa
-Íons positivos se movendo rapidamente:
-Passam entre os pólos de um eletroimã;
-Campo Magnético:
-Encurva a trajetória dos íons, conforme:
-Velocidade;
-Intensidade do campo;
-Cada íon que chega a um detector produz um sinal;
-O instrumento combina os sinais em um espectro de massas:
-Gráfico do sinal detectado contra a intensidade do campo magnético;
-Posições dos picos: fornecem a massa dos íons;

Modelos Atômicos – Sequência Histórica

Modelos Atômicos – Sequência HistóricaRadioatividade e Partículas subatômicas
-Conceito de Radioatividade:
-Ajuda a discernir a estrutura atômica;
-Serve de instrumento para o estudo experimental da estrutura do átomo;
-Primeira observação da Radioatividade (1896):
-Exemplar clássico da descoberta acidental em Química;
-Henry Becquerel
-Dava continuidade às pesquisas sobre as propriedades dos Raios X:
-Descobertos recentemente por Wil¨helm Röentgen;
-Observou que tanto os raio-x quanto a luz solar induziam certos minerais à fluorescência;
-Descobriu que o filme fotográfico, mesmo quando acondicionado numa caixa à prova de luz:
-Era afetado pelos raio-X;
-Objetivo da pesquisa:
-verificar se o mineral, depois de exposto à luz, continuava a emitir algum tipo de radiação:
-Igual aos raios-X que sensibilizavam o material fotográfico

Modelos Atômicos – Sequência HistóricaRadioatividade e Partículas subatômicas
-Henry Becquerel
-Num dia nublado: suspendeu as suas experiências;
-Guardou a amostra de óxido de urânio em uma gaveta que continha algumas placas fotográficas;
-Composto de urânio: escureceu as placas;
-Apesar de as placas estarem cobertas com um material opaco
-Percebeu que o composto de urânio devia estar emitindo algum tipo de radiação.
-Marie Slodowska Curie:
-Mostrou que a radiação, que ela chamava de radioatividade:
-Era emitida pelo Urânio, independentemente do composto em que ele estava;
-Concluiu: que os átomos de Urânio eram a fonte da radiação;
-Juntamente com Pierre, seu marido, concluiu ainda:
- tório, rádio e polônio também eram radioativos

Modelos Atômicos – Sequência HistóricaRadioatividade e Partículas subatômicas
-Apesar das descobertas de Curie e Becquerel:
-A origem da radiação foi inicialmente um mistério;
-Existência dos núcleos atômicos desconhecida até o momento;
-1898 (Ernest Rutheford):
-Deu o primeiro passo para a descoberta da origem da radiação:
-Ao observar o efeito do campo elétrico sobre emissões radioativas:
-Identificou três tipos de radiação:
(alfa):
- constituída de partículas contendo, cada uma:
- duas unidades de carga positiva;
- massa quatro vezes a massa do átomo de hidrogênio
(beta):
- simplesmente uma corrente de elétrons;
(gama):
- radiações eletromagnéticas extremamente penetrantes;
- de comprimento de onda muito curto.

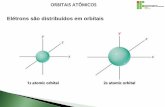
Modelos Atômicos – Sequência HistóricaModelo Atõmico de Thomson
-A partir de 1890:
-Ficou evidente para a maioria dos cientistas:
-Átomos consistem uma parte carregada positivamente e alguns elétrons;
-Mas isto não estava plenamente claro.
-Persistia a pergunta: De que os átomos são constituídos?
-1898 (Thomson)
-Sugeriu:
-átomo poderia ser uma esfera carregada positivamente;
-Na qual alguns elétrons estão incrustados
- o que facilitaria a fácil remoção de elétrons dos átomos.
-A partir de 1890:
-Modelo “pudim de ameixas”

Modelos Atômicos – Sequência HistóricaO Átomo Nuclear de Rutherford
-Período de 1909 a 1911:
-Rutherford, H. Geiger e EMarsden:
-Desenvolveram engenhosa experiência para estudar o interior do átomo:
-Focalizando um raio de partículas alfa numa folha fina de metal:
-Observaram o efeito deste projéteis de alta velocidade:
-À medida que eram projetados na folha de metal;
-Resultado:
- maioria das partículas alfa:
-Passava direto pela folha de metal;
-podendo ser detectadas, conforme atingiam uma tela fluorescente
- ocasionalmente:
- esses projéteis de alta velocidade eram desviados;
- voltando, algumas vezes, diretamente à fonte

Modelos Atômicos – Sequência Histórica

Modelos Atômicos – Sequência Histórica

Modelos Atômicos – Sequência HistóricaO Átomo Nuclear de Rutherford
-Análise da Experiência de Rutherford, Geiger e marsden (À Luz do modelo de Thomson):
-Não causou espanto
-Maioria das partículas alfa atravessarem em linha reta a folha metálica:
-Com pouca ou nenhuma deflexão;
-Raciocínio:
- massas e cargas elétricas positiva e negativa:
- espalhadas ao acaso através de cada átomo na folha
-Essa distribuição difusa poderia significar:
-Nada seria muito sólido que impedisse uma partícula alfa de passar;
-Carga positiva carregada pela partícula alfa:
-não seria influenciada por nenhuma concentração alta de:
- carga positiva ou negativa localizada na folha
-Problema: como os maiores desvios experimentados pelas partículas alfa poderiam ser explicados?

Modelos Atômicos – Sequência Histórica

Modelos Atômicos – Sequência HistóricaO Átomo Nuclear de Rutherford
-Grande Questão:
-Como os maiores desvios experimentados pelas partículas alfa poderiam ser explicados?
-Rutherford, buscando a resposta:
-Retomou idéia proposta em 1904 pelo físico Japonês H. Nagaoka;
-Átomo poderia ser composto por um pequeníssimo núcleo carregado positivamente (no centro do átomo);
-Rodeado por uma região comparativamente maior: contendo os elétrons
-Argumentou que só ocorreria o desvio de uma partícula alfa:
-Se ela se aproximasse do núcleo maciço, compacto e positivamente carregado;
-E, aproximando bastante, experimentariam grandes desvios;

Modelos Atômicos – Sequência HistóricaO Átomo Nuclear de Rutherford
-Rutherford, buscando a resposta:
-Reconheceu:
-Resultados de Geiger-Marsden:
- não serviriam para distinguir entre um núcleo carregado positivamente e um carregado
negativamente;
-Núcleo negativo pesado: poderia também provocar deflexões grandes;
-Admitiu que o núcleo era positivo:
-Por saber que os elétrons têm massas relativamente baixas;
-Se um núcleo fosse constituído por elétrons:
-Uma partícula alfa mais provavelmente removeria o núcleo do átomo ao invés de se desviar

Modelos Atômicos – Sequência Histórica

Modelos Atômicos – Sequência HistóricaO Átomo Nuclear de Rutherford
-Mis do que admitir que o núcleo era positivo:
-Resultados de Geiger-Marsden:
- serviu para estimar que:
-Maior parte da massa do átomo responsável pelos desvios:
- estaria dentro de uma região 1/10000 do diâmetro do átomo todo.

Modelos Atômicos – Sequência Histórica