UFRRJ Marques dos Santos.pdf · In the last experiment, genes in the tips of rice roots were...
Transcript of UFRRJ Marques dos Santos.pdf · In the last experiment, genes in the tips of rice roots were...
UFRRJ INSTITUTO DE AGRONOMIA
CURSO DE PÓS-GRADUAÇÃO EM AGRONOMIA
CIÊNCIA DO SOLO
TESE
Absorção, Assimilação e Remobilização de
Nitrogênio em Arroz, sob Nutrição Nítrica.
Avaliação da Expressão Gênica Diferencial.
André Marques dos Santos
2007
UNIVERSIDADE FEDERAL RURAL DO RIO DE JANEIRO INSTITUTO DE AGRONOMIA
CURSO DE PÓS-GRADUAÇÃO EM AGRONOMIA CIÊNCIA DO SOLO
ABSORÇÃO, ASSIMILAÇÃO E REMOBILIZAÇÃO DE NITROGÊNIO EM ARROZ, SOB NUTRIÇÃO NÍTRICA. AVALIAÇÃO DA
EXPRESSÃO GÊNICA DIFERENCIAL.
ANDRÉ MARQUES DOS SANTOS
Sob a Orientação da Professora Sonia Regina de Souza
e Co-orientação do Professor Manlio Silvestre Fernandes
Tese submetida como requisito parcial para obtenção do grau de Doutor em Ciências no Curso de Pós-Graduação em Agronomia, Área de Concentração em Ciência do Solo.
Seropédica, RJ
Fevereiro de 2007
631.417 P654f T
Santos, André Marques, 1977-
Absorção, Assimilação e Remobilização de Nitrogênio em Arroz, sob Nutrição Nítrica. Avaliação da Expressão Gênica Diferencial.
93f. : il. Orientador: Sonia Regina de Souza. Tese(doutorado) – Universidade Federal Rural do Rio de Janeiro, Instituto de Agronomia. Bibliografia: f. 78-93. 1. Variedades tradicionais de arroz – Teses. 2. Enzimas de assimilação de N – Genes diferencialmente expressos – Teses. 3. Solos – Oryza sativa L – Teses. 4. Húmus – Teses. I. Souza, Sonia Regina de Souza, 1962- II. Universidade Federal Rural do Rio de Janeiro. Instituto de Agronomia. III. Título.
É permitida a cópia parcial ou total desta tese, desde que seja citada a fonte.
UNIVERSIDADE FEDERAL RURAL DO RIO DE JANEIRO INSTITUTO DE AGRONOMIA CURSO DE PÓS-GRADUAÇÃO EM AGRONOMIA – CIÊNCIA DO SOLO
ANDRÉ MARQUES DOS SANTOS
Tese submetida como requisito parcial para obtenção do grau de Doutor em Ciências, no Curso de Pós-Graduação em Agronomia, área de Concentração em Ciência do Solo.
TESE APROVADA EM 27/02/2007.
____________________________________________
Drª Sonia Regina de Souza (Orientadora)
____________________________________________ Drº Manlio Silvestre Fernandes
(Co-orientador)
____________________________________________ Drº Marcio Alves Ferreira
____________________________________________ Drª Lilia Bender Machado
____________________________________________ Drº Eduardo de Matos Nogueira
AGRADECIMENTOS
A DEUS, fonte de tudo, por ter me acompanhado em toda a caminhada; À minha família, pelo carinho, apoio, incentivo nas horas de dificuldade, meu
obrigado por estarem sempre presentes mesmo a quase 2500 km de distância; À Carol, Minha Branca, “Todo azul do mar”, do meu mar, pelo simples fato de existir; Aos professores que compartilharam comigo seu conhecimento, seja nas disciplinas
ministradas ou simplesmente nas palavras trocadas nos bate-papos; À Profª Sonia, pelas valiosas discussões, por acreditar no trabalho e aceitar as
sugestões, pela amizade e incentivo; Ao Profº Manlio pelo incentivo e pela oportunidade de trabalho no grupo de pesquisa; À Mariam e aos estudantes do Laboratório de Nutrição de Plantas e de Bioquímica de
Plantas, que aqui prefiro omitir os nomes para evitar a injustiça de esquecer algum. Obrigado pela amizade, convívio, companheirismo, ajuda nas coletas, pelas boas risadas, pelas palavras de incentivo, vocês contribuíram muito nessa história;
A CAPES pela concessão da bolsa e ao CNPq e FAPERJ pelo apoio financeiro que suportou as análises desse projeto, propiciando ainda a realização de cooperações com outros grupos de pesquisa;
A UFRuralRJ pela acolhida e pela formação; Ao Drº Antonio Álvaro Corsetti Purcino, pela orientação e apoio durante a realização
das análises no Centro Nacional de Pesquisa de Milho e Sorgo da EMBRAPA; Ao Drº Eduardo de Matos Nogueira, por ter me recebido no Laboratório de Biologia
Molecular de Plantas do Instituto de Pesquisas do Jardim Botânico do Rio de Janeiro. Obrigado pela orientação, assistência, disposição e total dedicação às análises realizadas;
Aos funcionários do Departamento de Solos e do Curso de Pós-Graduação em Agronomia – Ciência do Solo, em especial Luciene, Roberto, Marcos e Moraes, pela cordialidade, presteza e amizade, sempre prontos a nos atender.
A todos que cruzaram meu caminho, obrigado pela chance de ter aprendido algo!
BIOGRAFIA André Marques dos Santos nasceu na cidade de Ituiutaba – MG, em 12 de setembro de
1977. Aos seis anos de idade mudou-se para Pontes e Lacerda – MT, neste mesmo estado, terminou o curso Técnico em Agropecuária na Escola Agrotécnica Federal de Cáceres no ano de 1996. Iniciou o curso de graduação em Agronomia na Universidade Federal Rural do Rio de Janeiro em 1997, diplomando-se em 2002. Durante a graduação foi bolsista de Iniciação Científica no Centro Nacional de Pesquisa de Agrobiologia (Embrapa Agrobiologia) utilizando técnicas de biologia molecular no estudo da diversidade genética de microrganismos diazotróficos, sob a orientação do Drº José Ivo Baldani. Também foi bolsista no CPDA – Curso de Pós-Graduação em Desenvolvimento, Agricultura e Sociedade, na área de Sociologia Rural, sob a orientação do Drº John Wilkinson. Ao final da graduação foi monitor da disciplina de Tecnologia de Sementes, sob orientação da Profª Cláudia Rossetto. Em março de 2002 iniciou o mestrado no Curso de Pós-Graduação em Agronomia – Ciência do Solo sob a orientação da Profª Sonia Regina de Souza. Em julho de 2003, após aprovação da CAPES, obteve a mudança direta de nível do mestrado para o doutorado. Em 2005 concluiu curso de Especialização em Biotecnologia pela Universidade Federal de Lavras e no ano de 2007, concluiu seu doutoramento na Universidade Federal Rural do Rio de Janeiro.
RESUMO GERAL
SANTOS, André Marques dos. Absorção, assimilação e remobilização de nitrogênio em arroz, sob nutrição nítrica. Avaliação da expressão gênica diferencial. 2007. 93f. Tese (Doutorado em Agronomia, Ciência do Solo). Instituto de Agronomia, Departamento de Solos, Universidade Federal Rural do Rio de Janeiro, Seropédica, RJ, 2007. O arroz é um dos mais importantes cereais para o homem, porque é fonte primária na alimentação de mais da metade da população do mundo. As plantas necessitam de nitrogênio para seu desenvolvimento, sendo este presente em solos aerados, na forma de nitrato. Em função do desgaste das áreas cultivadas, tem sido intensificada a utilização de fertilizantes nitrogenados, o que contribui para o aumento da poluição, visto que, esse composto possui grande mobilidade no solo. Objetivando-se avaliar os mecanismos fisiológicos, bioquímicos e moleculares responsáveis pela eficiência no uso de nitrogênio em arroz foram conduzidos três experimentos no Departamento de Solos da Universidade Federal Rural do Rio de Janeiro, com duas variedades de arroz, uma tradicional (Piauí) e outra melhorada (IAC-47). Primeiramente, ambas as variedades foram cultivadas em solução nutritiva e submetidas a tratamentos simulando o fluxo sazonal de nitrato, característico das regiões tropicais. Nessa condição, foram avaliados os teores de açúcares solúveis, frações nitrogenadas e a atividade das enzimas Nitrato Redutase (ANR) e Glutamina Sintetase. A variedade Piauí foi mais eficiente na aquisição e uso do N quando comparada a IAC-47, acumulando nitrato em seus tecidos durante as fases iniciais de crescimento. Depois, essas mesmas variedades foram cultivadas em câmara de crescimento para estudar o efeito de concentrações crescentes de nitrato sobre os teores das frações nitrogenadas, ANR e sobre o perfil de expressão relativa dos genes dos transportadores de nitrato (NRT1 e NRT2) e da Nitrato Redutase (Nia2). Dos resultados obtidos, foi observado que a variedade tradicional possui menor ANR, maiores teores de nitrato e N-amino livre. Além disso, esta apresentou maior expressão relativa dos genes que codificam os transportadores de nitrato de baixa (NRT1) e os de alta (NRT2) afinidade, sendo esse na parte aérea. Estas plantas pareceram adotar um controle diferenciado da ANR, pois mesmo tendo maior expressão relativa desse gene, a atividade desta enzima se mantém praticamente sem sofrer influência das concentrações de nitrato na solução. No último experimento, foram identificados os genes induzidos por duas concentrações de nitrato (0,1 e 10 mM) em ápices radiculares de arroz. Diversos genes foram seqüenciados, dentre eles, destacou-se a subunidade E1 do complexo piruvato desidrogenase e fosfofrutoquinase, indicando a necessidade de se melhor entender a complexidade da interação entre o metabolismo de carbono e nitrogênio. Foram encontradas também seqüências homólogas aos genes da alfa actina, miosina, tropomiosina 1, creatina cinase e glioxalase I. Palavras chave: Variedades tradicionais de arroz. Enzimas de assimilação de N. Genes diferencialmente expressos. Oryza sativa L.
GENERAL ABSTRACT
SANTOS, André Marques dos. Nitrogen uptake, assimilation and remobilization in rice under supply of nitrate. Evaluation of differential genic expression. 2007. 93p. Thesis (Doctor Science in Agronomy, Soil Science) Instituto de Agronomia, Departamento de Solos, Universidade Federal Rural do Rio de Janeiro, Seropédica, RJ, 2007. Rice is one of the most important cereals for the humanity, because it is primary source of nutrition for more than half of the world’s population. Nitrogen is the most important element for plants and is predominantly present in aerated soils in the nitrate form. As a result of the poor quality of the cultivated areas, the usage of nitrogen fertilizers intensified, contributing to the increase of pollution, since this nutrient has high mobility in the soil. With the objective of evaluating physiologic, biochemical and molecular mechanisms responsible for the efficiency of the application of nitrogen in rice, experiments were conducted at the Soils Department of Federal Rural University of Rio de Janeiro. Two rice varieties were used, Piaui (traditional rice) and IAC-47 (improved rice). In the beginning, both varieties were cultivated in nutrition solutions and submitted to treatments simulating the seasonal fluctuation of nitrate, characteristic of the tropical region. Under this condition an evaluation was done in order to define the soluble sugar levels, nitrogen fractions, and the Nitrate Reductase Activity (NRA) as well as Glutamine Synthetase Activity. Piaui rice was more efficient in the acquisition and usage of nitrogen compared to IAC-47, accumulating nitrate in its tissue during the initial phase of growth for future consumption. Later, these same rice varieties were cultivated in a growth chamber with the objective of studying the effect of increased nitrate concentrations over nitrogen fraction levels, NRA, relative expression of genes for nitrate transporters (NRT1 and NRT2) as well as a nitrate reductase (Nia2). From the results obtained it was observed that the traditional rice variety contained less NRA, higher levels of nitrogen and free amino-N. Further, traditional variety presented higher relative expression of the genes which codify nitrate transporters of low affinity (NRT1) and those of high affinity (NRT2). These plants seemed to adopt a differentiated control of NRA, because even having a higher relative expression of the genes, the NRA maintained practically without influence from the different concentrations of nitrate in the solution. In the last experiment, genes in the tips of rice roots were identified, induced by different concentrations of nitrate (0.1 and 10 mM). Several genes were sequenced, were the most important data was the subunit E1 of the dehydrogenase pyruvate complex, and phosphofructokinase, suggesting the need for a better understanding of the complexity of the interaction between carbon and nitrogen metabolism. There were also found sequences homologous to the alpha actin, myosin, tropomyosin 1, creatin kinase, and glyoxalase I genes. Key words: Traditional rice varieties. Nitrogen assimilation enzymes. Genes expressed differentially. Oryza sativa L.
LISTA DE ABREVIAÇÕES, SIGLAS E SÍMBOLOS
ATA Ácido aurintricarboxílico ATP Adenosina trifosfato cDNA DNA complementar, obtido a partir de RNA por meio de transcrição
reversa DAG Dias após a germinação DEPC “dyethylpyrocarbonate” – dietilpirocarbonato dNTP “2'-deoxynucleoside 5'-triphosphate” – 2’-deoxinucleosídeo 5’-trifosfato ds-cDNA “double strand-cDNA” – cDNA dupla fita EDTA “EthyleneD iamineTetrAcetic acid” - ácido etilenodiamino tetra-acético EtOH Etanol GDH “Glutamate Dehydrogenase” - Glutamato Desidrogenase GOGAT “Glutamate Sinthase” - Glutamato Sintetase GS “Glutamine Sinthase” - Glutamina Sintetase GS1 Glutamina Sintetase citossólica, isoforma da GS GS2 Glutamina Sintetase plastidial, isoforma da GS HATS “High-affinity transport systems” – Sistema de transporte de alta
afinidade LATS “Low-affinity transport systems” – Sistema de transporte de baixa
afinidade mM Milimolar N Nitrogênio NH3 Amônia NH4
+ Amônio NiR Nitrato Redutase nm Nanômetro – Equivale a 1,0×10- 9 metros ou um milionésimo de
milímetro nmoles Nanomeles NO3
- Nitrato NR “N itrate Reducatse” – N itrato Redutase NR-NADH Nitrato Redutase dependente de NADH, isoforma da NR NR-NADPH Nitrato Redutase dependente de NADPH, isoforma de NR PCR “Polymerase Chain Reaction” – Reação em Cadeia da Polimerase Primer Oligonucleotídeo iniciador rpm Rotações por minuto SDS “Sodium lauryl sulfate” - Dodecil sulfato de sódio, detergente aniônico ss-cDNA “Single strand-cDNA” – cDNA fita simples SSH “Suppression Subtractive Hybridization” - Hibrid ização Subtrativa
Supressiva U Unidades de enzima x g Aceleração da gravidade ßMe β-MercaptoEtanol µg Micrograma µL Microlitro µM Micromolar
SUMÁRIO
1 INTRODUÇÃO GERAL ......................................................................................... 1
2 REVISÃO DE LITERATURA ................................................................................ 4
2.1 A Absorção do Nitrato e as Enzimas de Assimilação de Nitrogênio em Plantas ..... 4 2.1.1 Absorção de nitrato............................................................................................. 4 2.1.2 Enzimas de assimilação de nitrogênio................................................................ 5
2.2 NO3-: Nutriente e Sinal.............................................................................................. 6
2.2.1 Efeito do nitrato no desenvolvimento de raízes ................................................. 7 2.2.2 Influência do NO3
- e seus produtos de redução .................................................. 7 2.3 Transportadores de Nitrato ........................................................................................ 8
2.3.1 Sistema de transporte de baixa afinidade (LATS).............................................. 9 2.3.2 Sistema de transporte de alta afinidade (HATS) ................................................ 9 2.3.3 AtNRT1.1, inicialmente chamado CHL1: um transportador de dupla afinidade.........................................................................................................................9
2.4 Regulação da Absorção de Nitrato .......................................................................... 10 2.4.1 Regulação exercida por nitrato e seus metabólitos........................................... 10 2.4.2 Regulação temporal e espacial ......................................................................... 12
2.5 Técnicas para o Estudo da Expressão Diferencial de Genes................................... 12 2.5.1 A técnica de PCR em tempo real...................................................................... 13 2.5.2 A técnica de Hibridização Subtrativa Supressiva............................................. 15
3 CAPÍTULO I – EFEITO DO FLUXO SAZONAL DE NITRATO SOBRE O METABOLISMO DE NITROGÊNIO E O ACÚMULO DAS FRAÇÕES NITROGENADAS SOLÚVEIS EM DUAS VARIEDADES DE ARROZ ........................ 20
3.1 INTRODUÇÃO ...................................................................................................... 22 3.2 MATERIAL E MÉTODOS .................................................................................... 23
3.2.1 Condições experimentais .................................................................................. 23 3.2.2 Extração alcoólica no material fresco............................................................... 24 3.2.3 Determinação dos teores de N-amino livre ...................................................... 24 3.2.4 Determinação dos teores de açúcares solúveis ................................................. 24 3.2.5 Determinação dos teores de N-NO3
-................................................................. 24 3.2.6 Determinação dos teores de N-NH4
+ ................................................................ 25 3.2.7 Determinação da atividade da nitrato redutase................................................. 25 3.2.8 Determinação da atividade da glutamina sintetase........................................... 25 3.2.9 Análises estatísticas .......................................................................................... 26
3.3 RESULTADOS E DISCUSSÃO ............................................................................ 26 3.4 CONCLUSÕES....................................................................................................... 34
4 CAPÍTULO II – EFEITO DE DIFERENTES CONCENTRAÇÕES DE NITRATO EM SOLUÇÃO NUTRITIVA SOBRE O PERFIL DE EXPRESSÃO DA NITRATO REDUTASE E TRANSPORTADORES DE NITRATO POR RT-PCR SEMI-QUANTITATIVA EM TEMPO REAL E ATIVIDADE DA NITRATO REDUTASE E FRAÇÕES NITROGENADAS EM DUAS VARIEDADES DE ARROZ ......................... 35
4.1 INTRODUÇÃO ...................................................................................................... 37 4.2 MATERIAL E MÉTODOS .................................................................................... 39
4.2.1 Condições experimentais .................................................................................. 39 4.2.2 Análise da atividade enzimática e frações solúveis.......................................... 40 4.2.3 Análise estatística ............................................................................................. 40 4.2.4 Avaliação da expressão gênica ......................................................................... 40
4.3 RESULTADOS E DISCUSSÃO ............................................................................ 43 4.3.1 Massa fresca, frações solúveis e atividade da NR ............................................ 43 4.3.2 Extração do RNA total ..................................................................................... 47 4.3.3 Análise de similaridade genética das seqüências utilizadas na construção dos primers.. ......................................................................................................................... 48 4.3.4 Expressão dos genes da nitrato redutase e dos transportadores de nitrato baixa afinidade em arroz ......................................................................................................... 52 4.3.5 Expressão dos genes dos transportadores de alta afinidade em arroz .............. 55
4.4 CONCLUSÕES....................................................................................................... 56
5 CAPÍTULO III – PROSPECÇÃO E ANÁLISE DE GENES INDUZIDOS POR NITRATO EM ÁPICES RADICULARES DE ARROZ POR MEIO DE HIBRIDIZAÇÃO SUBTRATIVA SUPRESSIVA - SSH ................................................................................. 57
5.1 INTRODUÇÃO ...................................................................................................... 59 5.2 MATERIAL E MÉTODOS .................................................................................... 60
5.2.1 Crescimento das variedades em câmara de crescimento .................................. 60 5.2.2 Avaliação da expressão gênica diferencial ....................................................... 61
5.3 RESULTADOS E DISCUSSÃO ............................................................................ 68 5.3.1 Genes induzidos por nitrato .............................................................................. 68 5.3.2 Interação entre o metabolismo de carbono (C) e nitrogênio (N) ...................... 73 5.3.3 Categorização dos clones ................................................................................. 73
5.4 CONCLUSÕES....................................................................................................... 76
6 CONCLUSÕES GERAIS ...................................................................................... 77
7 REFERÊNCIAS BIBLIOGRÁFICAS ................................................................... 78
1 INTRODUÇÃO GERAL
A importância do arroz é evidenciada pelo seu amplo consumo na alimentação humana em diversas partes do mundo. São plantados, anualmente, cerca de 150 milhões de hectares ou aproximadamente 11% das terras cultivadas no mundo. Em 2002, o consumo médio de arroz de 67 kg habitante-1 ano-1, sendo a população asiática a maior consumidora, com cerca de 353 milhões de toneladas anuais, representando cerca de 90% da produção global do cereal.
Aproximadamente 45% da proteína total consumida no mundo é oriunda de cereais (FAO, 1998). O arroz responde por 35-75% das calorias consumidas por mais de 3 bilhões de asiáticos. Segundo as últimas estimativas da FAO, a produção mundial em 2005 progrediu 2,7%, alcançando 628 milhões de toneladas de arroz em casca. Em 2006 houve novo aumento de 1%, representando 634 milhões de toneladas. Os responsáveis por esses números tem sido a abundância das safras nos principais produtores asiáticos (China, Índia, Bangladesch, Vietnã) (dell Villar, 2006). No Brasil, o arroz é utilizado por uma ampla parcela da população, principalmente a menos favorecida, que utiliza este cereal como alimentação básica e diária, devido a seu custo acessível. A área cultivada na safra 2005/06 foi de 47,1 milhões de hectares, que é inferior à safra anterior em 4,1%, ou 2 milhões de hectares. Da área total estimada, o arroz ocupa 6,7% (3,1 milhões de hectares), o que corresponde à 4ª colocação, perdendo apenas para a soja (47,2%), o milho (26,7%) e o feijão (8,9%) (CONAB, 2006).
Na produção mundial de arroz, o Brasil se destaca como principal produtor entre os países ocidentais. Apesar das reduções de produção em algumas safras nos últimos anos, a produção de arroz vem apresentando uma tendência de crescimento, em função, principalmente, do constante incremento de produtividade. Por outro lado, o consumo brasileiro de arroz vem aumentando em ritmo bem inferior ao crescimento da produção. Nos últimos anos, o aumento da população brasileira vem sendo compensado por uma redução no consumo per capta do cereal, conseqüência de uma série de modificações nos padrões e hábitos de consumo que vem sendo observados na população (Barata, 2005).
Além da importância econômica, este cereal vem se destacando na área molecular, devido ao término do seqüenciamento de seu genoma, esta espécie foi proposta como a representante das monocotiledôneas em estudos de genômica.
A intensificação no uso de fertilizantes, principalmente nitrogenados, objetivando-se o aumento na produtividade das espécies agrícolas vem ocasionando problemas de poluição, principalmente do lençol freático por nitrato. O nitrogênio é um dos elementos minerais requeridos pelas plantas em maiores quantidades e sua falta limita seu crescimento. Em função disso, na última década, seu uso tem sido intensificado e isso vem ocasionando problemas de poluição. Deste modo, o alto custo destes fertilizantes tem levado a busca por variedades que possam absorver e utilizar esse nutriente de forma mais eficiente.
Os dados agrícolas dos últimos anos indicam que incrementos de ganho em produtividade vão depender cada vez mais de modificações genéticas das plantas, devido à crescente preocupação quanto à utilização sustentável dos recursos naturais. As pressões advindas do uso racional de energia, água, químicos e fertilizantes, por exemplo, requerem o desenvolvimento de novas cultivares, adaptadas a estas limitações e capazes de manter e aumentar a produtividade da cultura.
No Brasil, o arroz é cultivado em dois sistemas distintos, o irrigado, praticado na região sul (Rio Grande do Sul e Santa Catarina) caracterizado pelo manejo altamente tecnológico; e o sistema de sequeiro, no ecossistema de terras altas, caracterizadas pelo baixo nível tecnológico e rusticidade. Devido a ocupação do Cerrado como nova fronteira agrícola,
2
o sistema de cultivo de sequeiro sofreu desenvolvimento e ganho tecnológico devido a criação de cultivares modernas e mais adaptadas à região.
No entanto, há ainda a necessidade de desenvolvimento de plantas adaptadas, por exemplo, à melhor aquisição de nutrientes nestas regiões tropicais. Segundo Greenland (1958) e Wetselaar (1961a, 1961b), o clima tropical é caracterizado por duas estações bem definidas (um período de chuvas e um período seco), que ocasiona fluxos sazonais de nutriente no solo. O mesmo fenômeno parece acontecer nas regiões do cerrado brasileiro, onde o acúmulo de N na forma de nitrato (N-NO3
-) no solo ocorre somente na estação chuvosa (Nardoto & Bustamante, 2003). Desta forma, o N está sujeito à lixiviação intensa durante a estação das chuvas, tornando-se disponível para as plantas apenas no início do período úmido, portanto, devendo ser absorvido rapidamente.
Em trabalho com milho, Hirel et al. (2001) sugerem que o teor de nitrato acumulado nas folhas, nos estágios iniciais de crescimento é um bom indicador da capacidade das plantas para produzir e acumular N nos grãos. Durante esta fase, os tecidos deveriam manter a atividade da NT, de maneira que o nitrato acumulado nos vacúolos possa ser remobilizado, posteriormente, para a produção de grãos. Estes autores também sugerem que a formação de reserva de NO3
- é um fenômeno controlado geneticamente, e que pode ser de fundamental importância nas etapas posteriores de assimilação de N e produção de grãos.
Portanto, se supõe que no processo de seleção de plantas que visa maior eficiência de uso de N, deve-se optar por variedades que apresentem alta capacidade de acumular nitrato nos estágios iniciais de crescimento.
Em experimento comparando duas variedades de arroz, a IAC-47 (melhorada) e a Piauí (tradicional), observou-se que a variedade tradicional foi mais eficiente na remobilização de N acumulado e menos dependente do N proveniente de fontes externas durante o período reprodutivo. Isto sugere que esta variedade possui um processo de adaptação ao fluxo instável de N que ocorre na região do trópico úmido (Souza et al., 1998). Nas fases iniciais de crescimento, provavelmente esta variedade tem capacidade de absorver e acumular NO3
- e possui menor atividade da NR até a antese, tais mecanismos permitem a esta variedade uma elevada produção de N nos grãos.
A capacidade de rápido acúmulo de NO3-, na fase inicial de crescimento, pode
propiciar um maior estoque de N disponível para o metabolismo das plantas nas fases posteriores de seu ciclo de vida, principalmente, quando no enchimento dos grãos. Esta pode ser a razão do alto acúmulo de N nos grãos. A maior eficiência de aquisição de NO3
-, a partir de baixas concentrações na solução externa pode ser uma indicação de adaptação às condições de estresse nutricional (fluxos instáveis de N), como o decorrente da disponibilidade sazonal de NO3
- em regiões tropicais. Durante o período reprodutivo se espera que o NO3
- acumulado nos vacúolos e o N remobilizado de outras partes da planta sejam direcionados para o desenvolvimento dos grãos, o que torna necessário o estudo das modificações metabólicas que ocorrem nestas circunstâncias, relacionados principalmente às enzimas de assimilação de N e carbono, envolvidas nestes processos.
Nos últimos anos, o grupo de pesquisa em Nutrição de Plantas do CPGA-
CS/UFRuralRJ, vem acumulando conhecimento quanto à eficiência no uso de N por variedades de arroz tradicionalmente cultivadas no estado do Maranhão. Da mesma forma, esse trabalho de tese está inserido nessa mesma linha de pesquisa, propondo uma nova ótica nesse processo, buscando integrar a abordagem fisiológica aos mecanismos moleculares relacionados ao metabolismo de N em variedades de arroz.
3
Desta forma, a abordagem fisiológica é demonstrada por meio de análises das frações solúveis, nitrogenadas e atividade das enzimas de assimilação de N, apresentadas nos Capítulos I, II e III. No Capítulo II pretendeu-se unir a abordagem bioquímica e fisiológica do processo de absorção e assimilação de NO3
- por plantas de arroz a análise da expressão dos genes que codificam os transportadores de NO3
- e a enzima Nitrato Redutase. O Capítulo III consiste numa tentativa de identificar os mecanismos moleculares envolvidos no processo de absorção e assimilação de NO3
-, por meio da técnica de Hibridização Subtrativa Supressiva – SSH que permite uma análise do conjunto de genes que estão sendo expressos em determinada condição experimental.
4
2 REVISÃO DE LITERATURA
2.1 A Absorção do Nitrato e as Enzimas de Assimilação de Nitrogênio em Plantas
O arroz é um dos cereais mais importantes para o homem, e se constitui na alimentação básica para mais de três bilhões de pessoas. Ao contrário de outros cereais, o arroz é consumido quase que exclusivamente por humanos. São plantados anualmente acima de 150 milhões de hectares de arroz e a produção mundial chega a 600 milhões de toneladas (Fischer et al., 2000).
Além da sua importância econômica, estudos com arroz evoluíram de tal maneira que esta espécie foi indicada como representante das monocotiledôneas em pesquisas genômicas (Izawa & Shimamoto, 1996). Isto ocorre porque o genoma de arroz é um dos menores (440 milhões de pares de bases - Mbp) entre as gramíneas e por sua íntima relação com os principais cereais (Sandhu & Gill, 2002; Bennetzen & Ma, 2003), apresentando grande sintenia com eles (aveia, milho, sorgo, trigo e cevada), isto é, conservação de ordem, de seqüência e, em grande parte, de função gênica (Feuillet & Keller, 2002).
De todos os elementos minerais requeridos pelas plantas, o nitrogênio (N) é necessário em maiores quantidades e mais freqüentemente limita o crescimento quando este se torna escasso. Este elemento é constituinte de proteínas, ácidos nucléicos, diversos hormônios vegetais e outros metabólitos. Sua deficiência resulta em redução de crescimento da planta, clorose gradual das folhas mais velhas, seguida por abscisão (Williams & Miller, 2001).
2.1.1 Absorção de nitrato
O nitrogênio (N) está disponível no solo em diversas formas, incluindo amônio, nitrato, aminoácidos, peptídeos solúveis e formas complexas insolúveis. As espécies de plantas diferem na sua preferência por fontes de N, absorvendo-o primariamente em formas inorgânicas como nitrato ou amônio, via sistema radicular (Williams & Miller, 2001).
O nitrato (NO3-) pode ser absorvido nas raízes ou ser translocado para a parte aérea,
para depois ser reduzido a amônio. A utilização de uma forma ou de outra dependendo da espécie vegetal e das condições do ambiente. O transporte para as folhas ocorre via xilema, embora a redistribuição das folhas para outros órgãos ocorra predominantemente na forma de aminoácidos, via floema. Essa redistribuição é essencial para suprir os tecidos que não participam na assimilação de N.
Quando ocorre a assimilação do N nas raízes, aminoácidos são transportados para as folhas maduras via fluxo transpiratório, pelo xilema (Marschner et al., 1997). O N também pode ser transportado através da membrana plasmática de certas células, em outras formas tais como peptídeos menores (Steiner et al., 1994), bases purinas e pirimidinas e seus derivados (Gillissen et al., 2000).
Quando NO3- e NH4
+ são oferecidos às plantas em quantidades equivalentes, o amônio é geralmente absorvido mais rapidamente do que o nitrato (Macduff & Jackson, 1991). A preferência pelo amônio sobre o nitrato é explicada, pelo menos em parte, pela energia extra que a planta deveria gastar para reduzir o nitrato a amônio antes dele poder ser incorporado em componentes orgânicos (Bloom et al., 1992).
No entanto, na natureza, as concentrações de amônio e nitrato raramente são iguais, podendo variar grandemente em função de inúmeros fatores inerentes a características físicas,
5
químicas e biológicas do solo. Desta forma, ao longo de sua história evolutiva, as plantas desenvolveram em suas membranas celulares proteínas transportadoras que permitem a aquisição de nutrientes a partir de concentrações bastante variáveis.
O NO3- é considerado a mais importante fonte de N mineral para o crescimento de
plantas em solos aeróbicos. As plantas adquirem NO3- da solução do solo, absorvendo-o
através de transportadores específicos localizados na membrana plasmática das células da epiderme e do córtex da raiz. Uma vez no interior da célula, o NO3
- pode ser reduzido ou estocado no vacúolo. O primeiro passo na redução é realizado no citossol pela NR produzindo nitrito, que entra nos plastídios (cloroplasto na parte aérea) e é reduzido a NH4
+ pela NiR. O amônio é fixado pelo sistema GS/GOGAT em aminoácidos (glutamina/glutamato) os quais servem como substrato para reações de transaminação para produzir todos os outros aminoácidos protéicos (Tischner, 2000).
2.1.2 Enzimas de assimilação de nitrogênio
Os processos de absorção, remobilização e partição de N em plantas de arroz influenciam na produtividade, no acúmulo de proteínas e consequentemente na qualidade dos grãos, entre outros eventos. Tais processos estão diretamente relacionados à atividade das enzimas de assimilação de N.
O nitrato que for absorvido pelas plantas pode ser transportado para a parte aérea, onde será reduzido a nitrito no citossol e transportado para os plastídios, sendo então assimilado. Esse elemento também pode acumular no vacúolo e quando necessário remobilizado para o citossol, reduzido a nitrito através da enzima Nitrato Redutase (NR) sendo então assimilado pelo sistema GS-GOGAT e/ou GDH (Lea & Ireland, 1999).
A NR é uma enzima passível de ativação e indução pelo substrato (nitrato) e possui meia-vida curta (em torno de três horas). Existem três isoenzimas da NR em plantas, as quais diferenciam pela coenzima utilizada, NADH, NADPH, ou ambas. A NR dependente de NADH (EC 1.6.6.1) está presente em plantas superiores e algas, a NR dependente de NADPH (EC 1.6.6.2) é encontrada em plantas superiores, algas e fungos. A forma mais comum encontrada em Arabidopsis é a NR-NADH (Wilkinson and Crawford, 1993). Raízes contêm as duas isoformas de NR (NADH e NADPH). Stöhr e Ullrich (2002) também descreveram uma forma de NR ligada a plasmalema, que seria responsável pela geração de óxido nítrico (NO), mas a significância dessa atividade ainda é incerta.
Em raízes existem duas formas de Glutamina Sintetase (GS), uma encontrada nos plastídios (GS2), e outra no citossol (GS1), sendo essa usualmente detectada, existindo poucos trabalhos com a forma plastídica (Brugière et al., 2001). A GS1 constitui uma família com diversos genes, alguns dos quais são especificamente expressos em raízes (Gebhardt et al., 1986). Esta enzima assimila NH4
+ derivado diretamente do solo ou dos produtos da redução de NO3
- (Ireland and Lea, 1999). Existem 2 isoformas de GOGAT (glutamato sintase) que catalisa a reação de
assimilação de do NH4+, utilizando NADPH ou Fd reduzida como doadores de elétrons. A
presença delas varia com o desenvolvimento do tecido, no entanto ambas estão localizadas no plastídio. Em raízes, especialmente nas pontas, a Fd-GOGAT é a principal forma presente (Brugière et al., 2001).
A diminuição no influxo e quantidade de NO3-, no citossol, pode resultar na queda da
atividade da NR. Deste modo, o NO3- armazenado nos vacúolos constitui-se em uma
importante reserva, que pode ser posteriormente remobilizada e utilizada para o metabolismo nitrogenado da planta. De fato, Hirel et al. (2001) demonstraram em trabalho com milho que o nitrato acumulado no estágio inicial de crescimento das plantas poderia ser utilizado em fases
6
posteriores do ciclo. Os autores concluem ainda que a formação desse estoque de nitrato estaria relacionada à baixa atividade da NR no início do ciclo da cultura.
Durante o período reprodutivo se espera que o NO3- acumulado nos vacúolos e o N
remobilizado de outras partes da planta seja direcionado para o desenvolvimento dos grãos, o que torna necessário o estudo das modificações metabólicas que ocorrem nestas circunstâncias, relacionados principalmente às enzimas de assimilação de N e carbono, envolvidas nestes processos. Segundo Masclaux et al. (2000), tanto os transcritos gênicos como a atividade das enzimas GS1, GDH e Proteases aumentam durante o período reprodutivo. Estes autores também observaram que durante a senescência houve diminuição das enzimas cloroplásticas GS2, GOGAT e RUBISCO, resultado provavelmente da hidrólise das proteínas nesta organela, que ocorre nesta ocasião.
A suplementação com N pode aumentar o conteúdo de proteína nos grãos de arroz. Entretanto, a produção de grãos e o seu conteúdo de proteína geralmente se correlacionam negativamente. A relação inversa entre a produção de grãos e o teor de proteína ocorre devido à estratégia aplicada pelos melhoristas, que aumentaram a produtividade dos cereais em detrimento do acúmulo de N nos grãos (Kramer, 1979). Isto pode ser evitado escolhendo-se a época apropriada para a aplicação de N, especialmente na fase pós-antese (Souza et al., 1999a).
Aplicações suplementares de N após a antese conduziram a um aumento significativo no teor de proteína nos grãos de arroz, sem correspondente decréscimo na produção. A época da aplicação e a dose aplicada afetaram o conteúdo de proteína e o acúmulo de diversas frações protéicas, sendo a glutelina a fração que mais contribuiu para o aumento na proteína dos grãos, melhorando a qualidade destes (Souza et al., 1999b).
2.2 NO3-: Nutriente e Sinal
Tanto as plantas como outros organismos desenvolveram mecanismos que os permitem sentir e responder as mudanças nos níveis de metabólitos de carbono (C) e nitrogênio. Esses mecanismos regulam a expressão de genes e controlam a atividade de enzimas envolvidas no transporte e metabolismo de C e N, permitindo a otimização e eficiência de seus recursos energéticos (Coruzzi & Zhou, 2001).
É de se esperar que o NO3-, a principal fonte de N para a maioria das plantas, não atue
apenas com um nutriente, mas também como um sinal para a iniciação de diversos processos importantes no metabolismo das plantas (Crawford, 1995), a indução das enzimas de sua assimilação. Além destas, tem sido mostrado que o metabolismo dos carboidratos também é afetado pela presença desse íon, que altera a relação entre a síntese de amido e a síntese de sacarose em favor da última (Tischner, 2000).
A “sensibilidade” das plantas ao NO3- se dá tanto devido a disponibilidade de N no
ambiente, como também seu próprio estado interno. Na célula isto leva a uma reprogramação do metabolismo para permitir que o NO3
- seja assimilado e incorporado em compostos orgânicos (Stitt, 1999).
Deste modo, o NO3- influencia decisivamente no metabolismo vegetal, levando a uma
rápida mudança nos níveis de um amplo espectro de transcritos que codificam enzimas do metabolismo de C e N, permitindo sua reprogramação para facilitar a assimilação de NO3
- e sua incorporação em aminoácidos. Sinais derivados do conteúdo de nitrato interno e externo interagem para modular o crescimento e a arquitetura das raízes e permite o fornecimento eficiente de nutrientes (Stitt, 1999).
7
2.2.1 Efeito do nitrato no desenvolvimento de raízes
O N no solo é extremamente heterogêneo tanto em escala espacial quanto temporal. As raízes tendem a proliferar em áreas localizadas no solo onde houver maiores concentrações desse nutriente (Granato & Raper, 1989). Porções específicas das raízes podem ser expostas a altas concentrações de N enquanto outras são ineficazes em absorvê- lo. As plantas possuem sensibilidade a concentração de N no solo, além disso, conseguem monitorar e responder ao seu “status” interno de N (Malamy & Ryan, 2001).
A aquisição de N também depende da distribuição de raízes ativas na absorção desse nutriente no solo. A profundidade do enraizamento, que varia grandemente entre espécies, determina a habilidade da cultura em interceptar o N, particularmente o NO3
-, durante os períodos de lixiviação (Gastal & Lemaire, 2002). Os custos exigidos para a formação de raízes é uma importante consideração, raízes finas têm uma área superficial mais elevada que o volume das raízes grossas, e assim requerem menos carbono para sua construção por unidade de comprimento de raiz, mas sua manutenção pode ser mais cara (por unidade de peso de raiz). Os atributos mais importantes são: o número, o tamanho e a localização dos pêlos radiculares, os quais têm um enorme impacto na área superficial de absorção da raiz (Miller & Cramer, 2004).
Muitas espécies respondem a fontes localizadas de NO3- através da proliferação
preferencial de raízes laterais dentro da zona rica em nutrientes (Drew & Saker, 1975), ou seja, a disponibilidade desse íon afeta tanto o número quanto a localização dos sítios de iniciação das raízes laterais (Malamy & Ryan, 2001). No entanto, o efeito estimulatório do NO3
- na proliferação de raízes, pode ser contraditório, havendo dois modos de ação: Inibição de desenvolvimento de raízes por um sinal inibitório sistêmico que resulta do acúmulo de NO3
- na parte aérea, e um efeito estimulatório localizado que depende da concentração local de NO3
- nas raízes (Zhang & Forde, 2000). Quando raízes de Arabidopsis foram expostas a aplicações localizadas de NO3
- houve estímulo na alongamento de raízes laterais o qual foi causado pelo aumento de produção de células nos meristemas e quando foi adicionado outra fonte de N não houve estímulo. Por outro lado, altas doses de NO3
- causaram efeito inibitório sistêmico no desenvolvimento dessas. Estas evidências demonstram que o íon NO3
- atua preferencialmente como sinal desencadeador destes efeitos, ao invés de atuar apenas como nutriente (Zhang et al., 1998).
2.2.2 Influência do NO3
- e seus produtos de redução
O NO3- e seus metabólitos reduzidos (NH4
+, glutamina) exercem considerável influência sobre diversos mecanismos do metabolismo de carbono e nitrogênio das plantas. Foram realizados estudos com milho para verificar o acúmulo e a redução de NO3
- na presença de asparagina e glutamina (metabólitos de N) e sacarose (metabólito de C). Os resultados mostraram que, embora asparagina possa inibir a absorção e redução de NO3
-, a glutamina inibe somente a sua redução. A inibição da expressão da NR e NiR por asparagina e glutamina, foi o resultado de mecanismos que devem afetar diretamente a expressão desses genes, e não um efeito indireto ocorrido através da redução dos níveis de NO3
- no tecido, resultante da inibição da absorção de nitrato (Sivasankar et al., 1997).
Qualquer fator regulatório que influencie o sistema de absorção de NO3- pode afetar a
expressão da NR e NiR, assim como a presença desse íon dentro dos tecidos é crítica para a expressão dessas enzimas (Sivasankar et al., 1997). O influxo de NO3
- e a atividade da Nitrato Redutase (ANR) são processos induzidos pelo substrato. Plantas crescendo na ausênc ia de NO3
- apresentam baixas taxas de absorção de NO3- e ANR. A exposição ao nitrato aumenta as
8
taxas desses processos (indução), seguido por um declínio gradual (repressão) até atingir um valor constante. Este padrão geral é comum entre as plantas, as espécies se diferenciam apenas na escala de tempo sobre o qual esses eventos ocorrem bem como na magnitude desses processos (Min et al., 1998).
Entretanto, foi demonstrado em experimentos com Arabidopsis que a regulação dos genes de assimilação de NO3
- pelo produto final (“feedback”), não se baseia apenas na repressão exercida pelos metabólitos reduzidos de N (NH4
+ e aminoácidos), mas pode envolver também a ação de NO2
- como um sinal regulatório. Assim, a repressão dos genes dos transportadores de nitrato do sistema de baixa afinidade (NRT1.1) e da Nitrato Redutase (NIA), depende da capacidade da planta de reduzir NO3
-, já que altos níveis de nitrato promovem repressão desses dois genes por meio do mecanismo dependente da redução desse íon (Loqué et al., 2003).
Estudos com Arabidopsis identificaram mais de 15 novos genes induzidos por nitrato sendo predominante a expressão dos que estão relacionados aos processos de absorção e assimilação desse nutriente (Wang et al., 2000). Mais tarde, esse mesmo grupo estudou a resposta genômica a baixos níveis de NO3
- (20 minutos de exposição a 250 µM), com o auxílio um “chip” ATH1 da empresa Affymetrix contendo mais de 22.500 sondas. A resposta ao NO3
- foi muito superior nas raízes quando comparada a parte aérea. Foram encont rados genes conhecidamente responsivos a este íon (Ex.: aqueles que codificam transportadores de NO3
-, NR, NiR, etc.), muitos dos quais estão envolvidos no metabolismo de C e nutrientes (Wang et al., 2003). Os resultados apresentados aqui ressaltam a importância e influência do nitrato no metabolismo das plantas superiores.
Aplicações de N podem aumentar significativamente o conteúdo de proteína dos grãos de arroz (Souza et al., 1999a) e também estimular a produção de biomassa em Quercus robus (Thomas & Hilker, 2000). Deste modo, a identificação das proteínas e genes que são responsáveis pelo deslocamento de NO3
- dentro da planta é um pré-requisito para o melhor entendimento dos mecanismos que controlam sua absorção, assimilação e distribuição em toda a planta (Orsel et al., 2002a).
2.3 Transportadores de Nitrato
A absorção de NO3- é um processo ativo que ocorre contra um gradiente de potencial
eletroquímico, dependente da atividade de uma bomba de prótons existente na plasmalema (denominada P-H+-ATPase) (McClure et al., 1990; Glass et al., 1992). O transporte de NO3
- do meio externo para o interior das células vegetais é mediado por proteínas transportadoras. Os transportadores de NO3
- pertencem a duas classes de proteínas (PTR – “Peptide transporter” e NNP – “Nitrate-nitrite porter”), com diferentes propriedades regulatórias e cinéticas, codificadas por múltiplos genes que são diferencialmente regulados (Forde, 2000).
Em plantas superiores, os genes que codificam estas proteínas transportadoras são classificados, de acordo com a afinidade dos transportadores pelo substrato, em duas famílias: NRT1 (pertencente a uma ampla família de proteínas chamadas PTR) que codificam os genes pertencentes ao sistema de transporte de baixa afinidade (LATS – “low-affinity transport systems”) e NRT2 (pertencente a uma segunda e também ampla família de proteínas chamadas NNP) que codificam os genes pertencentes ao sistema de transporte de alta afinidade (HATS – “high-affinity transport systems”).
Para padronizar a nomenclatura dos genes que tem sido clonados em diversas espécies de plantas superiores e outros organismos, adotou-se como regra utilizar para nomeá- los duas letras iniciais correspondentes à espécie e gênero da planta de origem seguidas da família a
9
que ele pertence e um número correspondente à seqüência de isolamento. Ex.: AtNRT2.1 – primeiro gene de Arabidopsis thaliana que codifica um transportador de nitrato pertencente ao sistema de alta afinidade (família NRT2).
2.3.1 Sistema de transporte de baixa afinidade (LATS)
O sistema de transporte de baixa afinidade está envolvido na absorção de NO3- a altas
concentrações externas. Quando identificado em cevada (Siddiqi et al., 1990), acreditava-se que esse sistema não era passível de saturação. Entretanto, a clonagem e caracterização de genes que codificam CHL1 (primeira denominação do gene AtNRT1.1) em Arabidopsis, um transportador de baixa afinidade (NRT1.1), e seu homólogo NRT1.2, levou à conclusão de que, pelo menos nesta espécie, a absorção de NO3
- pelo sistema de baixa afinidade é realizada por componentes tanto induzíveis quanto constitutivos. Cada transportador parece ter uma função distinta que contribui para uma elaborada rede que atua na absorção de nitrato (Huang et al., 1990).
A família dos transportadores de baixa afinidade é reconhecida pela capacidade de seus membros transportarem uma variedade de substratos (oligopeptídeos, aminoácidos, NO3
-
, ClO3-) e pela capacidade de transportadores individuais lidarem com substratos de diferentes
tamanhos e cargas (Forde, 2000). Esta capacidade foi comprovada em experimento com Brassica napus onde um transportador do sistema de baixa afinidade foi capaz de transportar histidina além de nitrato (Zhou et al., 1998).
2.3.2 Sistema de transporte de alta afinidade (HATS)
O sistema de transporte de alta afinidade é constituído por um componente induzido (iHATS) e outro constitutivo (cHATS). O sistema constitutivo de alta afinidade opera a concentrações externas de NO3
- em torno de 0,2 mM e são complementados por outro sistema de alta afinidade (iHATS), o qual é induzido por concentrações de NO3
- muito reduzidas (Aslam et al., 1992). Quando a concentração externa de NO3
- alcança concentrações superiores a 1 mM, um sistema de baixa afinidade começa a atuar (Siddiqi et al 1990; Glass et al 1992).
Em plantas superiores, genes que codificam proteínas pertencentes ao iHATS têm sido clonados em Hordeum vulgare (cevada) (Trueman et al., 1996; Vidmar et al., 2000a), Arabidopsis (Filleur & Daniel-Vedele, 1999; Zhuo et al., 1999), N. plumbaginifolia (Quesada et al., 1997) e Glicine max (soja) (Amarashinghe et al., 1998).
Estima-se que existam mais de dez genes pertencentes à família NRT2 no genoma de cevada, porém, até o momento, apenas a seqüência de quatro destes está disponível: HvNRT2.1, HvNRT2.2 (Trueman et al., 1996) e HvNRT2.3 e HvNRT2.4 (Vidmar et al., 2000a). Da mesma forma, em Arabidopsis, quatro genes foram primeiramente identificados: AtNRT2.1, AtNRT2.2, AtNRT2.3 e AtNRT2.4 (Filleur & Daniel-Vedele, 1999; Zhuo et al., 1999). Atualmente, porém, com o seqüenciamento sistemático de todo o genoma de Arabidopsis, mais três genes desta família foram disponibilizados, AtNRT2.5, AtNRT2.6 e AtNRT2.7 (Orsel et al., 2002a).
2.3.3 AtNRT1.1, inicialmente chamado CHL1: um transportador de dupla afinidade
Investigações realizadas em mutantes do gene CHL1 sugerem que CHL1 é um componente importante de ambos os sistemas de absorção de NO3
- (LATS e HATS). Assim,
10
este transportador tem sido referido como pertencente a um “sistema de dupla afinidade”. Entretanto, deve ser enfatizado que as plantas submetidas a este estudo foram supridas com altas concentrações de nitrogênio. Isto, inevitavelmente, leva a repressão dos transportadores do sistema de alta afinidade e também a uma super estimativa do papel dos transportadores do sistema de baixa afinidade em pequenas concentrações externas de NO3
- (Wang et al., 1998). O perfil de expressão do gene NRT1.1 em Arabidopsis indica que o fornecimento de NO3
- inicialmente causa indução, que é seguida por repressão (Glass, 2003).
O gene AtNRT1.1 é preferencialmente expresso em órgãos nascentes e áreas de crescimento tanto em raízes como em parte aérea. Sua regulação parece ser mais complexa que o previsto. Múltiplos sinais afetam sua expressão, incluindo auxina que endereçaria sua expressão para áreas de crescimento e divisão celular (Guo et al., 2002).
Descobertas recentes apontam AtNRT1.1 como um transportador com diversas funções, porque além de ser um sistema não específico de transporte de NO3
-, possivelmente com dupla afinidade, induzido por NO3
- e regulado por auxina, parece também desempenhar um importante papel no controle da abertura e fechamento estomático (Forde & Cole, 2003).
2.4 Regulação da Absorção de Nitrato
2.4.1 Regulação exercida por nitrato e seus metabólitos
O NO3- atua na regulação de sua assimilação como sinal primário, junto com luz,
citocinina, níveis de CO2, ritmo circadiano, carbono e metabólitos de nitrogênio, tais como sacarose e glutamina. Uma cascata de eventos bastante complexa envolvendo mecanismos de regulação em nível transcripcional e pós-transcripcional integram a assimilação de NO3
- (a qual consome energia e esqueletos de carbono) com a fotossíntese e o metabolismo de carbono (Crawford, 1995).
A absorção de nitrato é também regulada por mecanismos relacionados principalmente aos transportadores, regulando a entrada do NO3
- na célula das raízes por meio do controle no nível de expressão dos seus genes. Os membros das famílias NRT1 e NRT2 são induzidos em resposta ao NO3
- no ambiente e são regulados por sinais internos, incluindo metabólitos de nitrogênio e demanda da planta por este nutriente (Crawford & Glass, 1998).
Em Arabidopsis thaliana, quatro genes dos transportadores de baixa afinidade (NRT1) e sete de alta afinidade (NRT2) foram investigados de acordo com a abundância de seus transcritos nos tecidos de parte aérea e raízes, em resposta ao fornecimento de 1 mM de NO3
-. Baseado neste critério, os genes foram classificados como nitrato-induzíveis (AtNRT1.1, 2.1, 2.2; e AtNRT2.4 que foi modestamente induzido), nitrato-reprimidos (AtNRT2.5) e nitrato-constitutivos (AtNRT1.2; 1.4; 2.3; 2.6; 2.7) (Okamoto et al., 2003).
Em geral, o sistema de alta afinidade em plantas é regulado de acordo com a demanda de N que é expressa via metabólitos resultantes da assimilação de NO3
-, um mecanismo conhecido como regulação negativa por “feedback” (Forde, 2000). O modelo foi desenvolvido em fungos e envolve uma combinação de reguladores específicos que respondem ao NO3
-, e reguladores globais que também controlam a assimilação de NO3- de
acordo com o estado geral de N na célula (Forde & Cole, 2003). (a) Repressão O alto grau de heterogeneidade em relação à disponibilidade de N no solo e a variação
sazonal e diurna no N requerido pelas plantas impõem a necessidade de regular os fluxos de N através da plasmalema nas raízes das plantas. A necessidade de integrar a absorção de N a
11
partir de diversas fontes (NO3-, NH4
+ e aminoácidos) sugere que a regulação deste processo poderia ser mais efetiva se um produto final comum à assimilação de NO3
-, como a glutamina, fosse fonte de “feedback” negativo (Glass et al., 2002).
Experimentos usando raízes de cevada indicaram que a glutamina (sem excluir a contribuição de outros aminoácidos) e NH4
+ são os principais reguladores na repressão do gene HvNRT2 (Vidmar et al., 2000b). A glutamina opera a nível de abundância de transcritos, embora o amônio tenha pequeno efeito nos transcritos e provavelmente atua a nível de proteína. Igualmente, em Arabidopsis, o gene AtNRT2.1 sofre tanto influência positiva quanto negativa em resposta ao nitrogênio. A indução depende da presença de nitrato. O efeito negativo está relacionado ao estado nutricional de N da planta e resulta do acúmulo de produtos da assimilação de NO3
-, principalmente, glutamina (Nazoa et al., 2003). Estudos realizados em Brassica napus L. indicam que a regulação da atividade de
influxo de NO3- envolve diversos componentes atuando diferencialmente e ao mesmo tempo.
Esses componentes incluem uma regulação negativa por “feedback” (repressão) por aminoácidos em nível transcripcional e/ou pós-transcripcional (Faure-Rabasse et al., 2002).
Comparando aminoácidos quanto aos níveis de expressão do gene NpNRT2, observou-se que a glutamina foi mais eficiente (90% de repressão após 48h), comparado a asparagina (75%), alanina (60%) e glutamato (33%) (Krapp et al., 1998). Já em Arabidopsis, foi observada repressão do gene NRT2.1 em resposta a exposição à asparagina, aspartato, glutamina, glutamato e alanina. Entretanto, esta foi especificamente relacionada com o aumento interno de glutamina, resultante da interconversão desses aminoácidos (Nazoa et al., 2003). Resultados similares também foram evidenciados em plantas de cevada (Vidmar et al., 2000a & 2000b).
O nitrato serve tanto como fonte de indução (efeito positivo) como o precursor para a regulação da glutamina (efeito negativo) na absorção de nitrato.
(b) Indução É bem conhecido que o nível de mRNA dos genes que codificam as proteínas do
sistema iHATS (NRT2.1 e/ou NRT2.2) aumenta rapidamente após a retirada de NO3- das
plantas (Trueman et al., 1996; Quesada et al., 1997; Amarashinghe et al., 1998; Filleur & Daniel-Vedele, 1999; Zhuo et al., 1999). Também se sabe que o sistema de alta afinidade em plantas superiores é rapidamente induzido em resposta a concentrações externas de nitrato (Daniel-Vedele et al., 1998; Crawford & Glass, 1998). Entretanto, estudos realizados por Orsel et al. (2002a) e por Okamoto et al. (2003) indicaram que alguns membros da família NRT2 não são ativados por nitrato e podem apresentar declínio quando nitrato é fornecido, ou ainda, não ter efeito algum. Esta resposta ao substrato é conhecida em espécies tais como cevada (Vidmar et al., 2000b), N. plumbaginifolia (Krapp et al., 1998), Arabidopsis (Filleur & Daniel-Vedele, 1999; Lejay et al., 1999, Zhuo et al., 1999) e tomate (Wang et al., 2001). Portanto, NO3
- é um indutor natural dos transportadores de nitrato de alta afinidade, mostrando a mesma dependência exibida pela enzima NR que é induzida por este íon (Glass, 2003). Este tipo de indução acontece também em alguns sistemas de baixa afinidade (Kronzucker et al., 1995; Wang et al., 2001).
Interessantemente, até onde é conhecido, NO3- atua como um indutor de sua própria
absorção, uma propriedade que não é compartilhada com outros sistemas de transporte de íons tais como sulfato e fosfato (Smith et al., 2000), os quais são provavelmente dereprimidos pela deficiência do íon correspondente.
12
2.4.2 Regulação temporal e espacial
Estudos realizados em Arabidopsis têm demonstrado que a taxa de absorção de NO3-
pelos HATS geralmente atinge maiores patamares durante o período de luz. A expressão aumentou durante o período de luz e diminuiu nas primeiras horas de escuro (Lejay et al., 1999), sugerindo a existência de uma conexão entre a expressão dos genes destes transportadores e o suprimento de metabólitos de carbono para a fotossíntese, pois a expressão de ambos os genes (NRT2.1 e NRT1) é diurnamente regulada em plantas fotossinteticamente ativas (Lejay et al., 1999).
Em Arabidopsis, o gene NRT2.1 sofre controle espacial e transcripcional, sendo regulado de acordo com a disponibilidade de NO3
- e aminoácidos. Adicionalmente, NRT2.1 é o principal componente do sistema iHATS nas partes mais velhas das raízes, havendo indícios da existência de outro transportador de alta afinidade que opera nas pontas das raízes (Nazoa et al., 2003). O gene do transportador de nitrato de baixa afinidade (NRT1.1) é particularmente ativo nas pontas das raízes, este transportador pode atuar na absorção de nitrato nesta região.
Resultados de hibridização in situ com mRNAs de genes da família NRT2 em raízes de Nicotiana plumbaginifolia demonstraram acúmulo destes transcritos em células de raízes em desenvolvimento (Krapp et al., 1998). Próximo às pontas das raízes, houve o acúmulo de altos níveis de mRNA de NpNRT2 tanto em células da epiderme como da endoderme, embora a expressão desse gene em partes de raízes mais maduras seja detectada apenas na epiderme (Krapp et al., 1998).
O fato do NO3- poder ser adquirido no apoplasto com o fluxo de água ou
simplasticamente pelas células da epiderme, e difundir através do córtex em direção a endoderme onde apenas a rota simplástica é possível, pode explicar o alto nível de expressão do gene NpNRT2 tanto na epiderme quanto na endoderme das pontas das raízes (Krapp et al., 1998). Adicionalmente, transcritos do gene AtNRT1.2 foram encontrados em “pêlos radiculares” e epiderme, tanto em regiões jovens (pontas de raízes) quanto em regiões maduras de raízes (Huang et al., 1999). Estudos realizados em plantas de Arabidopsis mutantes para os genes AtNRT2.1 e AtNRT2.2, demonstraram que estes genes desempenham papel crítico na absorção de NO3
- pelo sistema radicular (Cerezo et al., 2001). Em análises de “Northern blot”, mRNAs do gene NRT2.1 acumularam
preferencialmente em raízes de N. plumbaginifolia (Quesada et al., 1997) e Arabidopsis (Zhuo et al., 1999). Os genes NRT2.4, NRT2.5 e NRT2.6 são preferencialmente expressos em raízes de Arabidopsis, enquanto NRT2.3 é expresso tanto em raízes quanto em parte aérea e NRT2.7 é expresso apenas em parte aérea (Orsel et al., 2002a).
Estudos do gene AtNRT1.1, originalmente chamado CHL1, revelaram que seu mRNA é encontrado predominantemente em raízes, mostrando regulação dependente de pH e NO3
- (Tsay et al., 1993).
2.5 Técnicas para o Estudo da Expressão Diferencial de Genes
O fenótipo exibido por determinado tecido é o resultado da ação combinada das proteínas codificadas pelos genes que estão sendo expressos em determinada circunstância, dependendo ainda de como a expressão desses genes está sendo modulada, seja transcripcional ou pós-transcripcionalmente. Muitos eventos regulatórios que ocorrem em processos, tais como, diferenciação celular, desenvolvimento embrionário ou transformações malignas que resultam em câncer, dependem da ativação e/ou supressão de genes específicos.
13
Em eucariotos superiores, processos biológicos, tais como, o crescimento celular e a organogênese são regulados por genes que são diferencialmente expressos (Diatchenko et al., 1996). Técnicas satisfatórias para o isolamento de genes diferencialmente expressos são necessárias para entender em maior profundidade os mecanismos que regulam estes processos (Gurskaya et al., 1996).
O genoma de plantas superiores é composto por milhares de genes que controlam o crescimento, a fisiologia, a reprodução, a interação planta/patógenos, etc. O completo seqüenciamento do genoma do arroz (Yu et al., 2002; Goff et al., 2002) disponibilizou uma enorme quantidade de informação genética dessa espécie a qual será muito útil em programas de melhoramento genético. Além disso, técnicas de expressão gênica diferencial têm possibilitado a identificação de genes expressos em determinadas condições, permitindo avaliar os mecanismos moleculares responsáveis por características específicas.
Várias técnicas de análise da expressão gênica têm sido aplicadas a fim de melhor entender os mais variados processos, dentre elas, Hibridização subtrativa de bibliotecas de cDNA (Lee et al., 1991), Differential Display - DD/RT-PCR (Liang & Pardee, 1992), RNA fingerprinting por “primers” arbitrátrios- RAP-PCR (Welsh et al., 1992). Entretanto, estas técnicas possuem limitações metodológicas intrínsecas, pois as que se baseiam em “screening” diferencial em bibliotecas de cDNA demandam muito trabalho além de produzirem clones oriundos de genes abundantemente expressos. A utilização de bibliotecas subtrativas de cDNA necessita de grande quantidade de mRNA e é de difícil realização e por fim, aquelas baseadas em impressão digital (“fingerprinting”) de RNA e DD/RT-PCR são dependentes da amplificação de cDNA sob baixa estringência e conseqüentemente tendem a produzir falsos positivos (Hartings, 1999).
Outras técnicas também foram desenvolvidas visando superar os problemas anteriormente discutidos, as mais recentes incluem: SAGE (“Serial Analysis of Gene Expression” – Análise Serial da Expressão Gênica) (Velculescu et al., 1995), Hibridização de DNA em arranjos de diversos formatos (Chee et al., 1996; Chu et al., 1998), cDNA-AFLP (Bachem et al., 1996 e 1998) e Hibridização Subtrativa Supressiva (“Suppression Subtractive Hybridization – SSH”) (Diatchenko et al., 1996; Gurskaya et al., 1996).
Várias técnicas foram desenvolvidas para medir a expressão de genes em tecidos e células. Estas incluem “Northern blots”, transcrição reversa acoplada a amplificação por PCR (RT-PCR), ensaios protegidos de RNase, dentre outros. Dentre esses métodos, a RT-PCR é o mais sensível e versátil. Por exemplo, esta técnica pode ser usada para determinar a presença ou a ausência de um transcrito, para estimar os níveis de expressão de determinado gene e para clonar produtos de cDNA sem a necessidade da construção e seleção de bibliotecas de cDNA.
2.5.1 A técnica de PCR em tempo real
Como já foi dito anteriormente, a técnica de RT-PCR é uma técnica extremamente sensível e versátil que pode ser utilizada em muitas aplicações. Nesta técnica, o RNA é isolado e transcrito reversamente a cDNA que é subsequentemente amplificado por PCR. RT-PCR tem sido utilizada numa variedade de pesquisas e metodologias de diagnóstico para detecção de transcritos específicos, para estimar o nível de expressão relativa de um gene de interesse ou para amplificar produtos de cDNA para uso em clonagem ou tradução “in vitro”.
A PCR em tempo real (“real-time PCR”), uma variação da técnica de RT-PCR, revolucionou o campo da análise da expressão gênica em organismos vivos. Em comparação a RT-PCR clássica, a principal vantagem da PCR em tempo real é sua alta sensibilidade, especificidade e sua ampla magnitude de quantificação (Bustin, 2002; Gachon et al., 2004). A
14
técnica de PCR em tempo real tornou-se o método mais comum para a validação de dados obtidos com análises de “microarray” em genomas inteiros ou em um grupo menor de genes, e também em diagnósticos moleculares (Giulietti et al., 2001; Chuaqui et al., 2002; Mladek et al., 2003; Czechowski et al., 2004; Jain et al., 2006a & b).
(a) O princípio da técnica de PCR em tempo real O princípio de quantificação da técnica de PCR em tempo real é definido pelo “Ct”
(Ct – “threshold cycle number” ou número de ciclos do limiar) que é fixado quando a amplificação por PCR está ainda na fase exponencial e os componentes da reação não limitam a amplificação do gene (Orlando et al., 1998). A quantificação absoluta requer a construção de uma curva padrão absoluta para cada amplicon individual para calcular o número preciso de cópias de transcritos de mRNAs por célula ou por unidade de peso do tecido (Orlando et al., 1998).
(b) Eficácia da técnica de PCR em tempo real Comparada a outros métodos quantitativos, a técnica de RT-PCR oferece ensaios
extremamente ágeis e resultados reproduzíveis. A técnica de RT-PCR elimina a necessidade de padrões competitivos no tubo com grupo de “primers” idênticos ao alvo. Assim, o processo de criação de um ensaio quantitativo é bastante ágil porque a construção e caracterização de tais padrões não são requeridos mais. Agora, a técnica de RT-PCR faz a quantificação de DNA e RNA muito mais precisa e reproduzível porque ela se baseia no valor do “Ct” determinado durante a fase exponencial do PCR ao invés do ponto final da reação. Além disso, o uso do valor de “Ct” permite maior dinâmica na quantificação. Isto incrementa o processamento porque não é mais necessário analisar as diluições de cada amostra a fim de obter resultados precisos (Zhao et al., 2006).
Em contraste a técnicas rotineiras, tais como “Northern blot” e ensaios protegidos de RNase, as quais requerem grandes quantidades de RNa total, ensaios de RT-PCR são capazes de quantificar níveis de mRNA oriundos de amostras tão pequenas quanto uma única célula (Brady et al., 1990; Brady et al., 1993; Al-Taher et al., 2000; Steuerwald et al;. 1999).
(c) Normalização da técnica de PCR em tempo real Para investigar mudanças fisiológicas na expressão de genes, a expressão relativa de
um gene alvo versus um gene de referência é adequada para a maioria dos propósitos. Para o objetivo de uniformizar a amostra de RNA carregada e equalizar a eficiência das enzimas da reação, é recomendado o uso de genes não regulados conhecidos como “housekeeping”, tais como gliceraldeido-3-fosfato desidrogenase, albumina, actinas, tubulinas, ciclofilinas, 18S rRNA e 28S rRNA como genes de referência. No entanto, vários estudos têm mostrado que esses genes variam sob condições experimentais (Schmittgen & Zakrajsek, 2000; Zhong & Simons, 1999).
Apesar de ser uma técnica extremamente poderosa, PCR em tempo real sofre certas “armadilhas”, sendo que a mais importante diz respeito à normalização (Bustin & Nolan, 2004). A expressão do gene de referência usado para a normalização na análise de PCR em tempo real deveria permanecer constante entre as células de diferentes tecidos e sob as diferentes condições experimentais; caso contrário, ele poderia levar a um resultado errôneo (Jain et al., 2006).
15
2.5.2 A técnica de hibridização subtrativa supressiva
A hibridização subtrativa é uma técnica que permite a obtenção de pequenas bibliotecas de cDNA enriquecidas com transcritos que estão presentes em apenas uma das amostras comparadas. Todos os métodos de subtração desenvolvidos até o momento têm uma significativa limitação, pois são falhos em obterem transcritos que são expressos raramente. Entretanto, os transcritos raros são de particular interesse, pois muitas proteínas reguladoras pertencem a esta categoria (Gurskaya et al., 1996).
Em geral, os métodos de subtração de cDNA envolvem a hibridização de cDNA oriundo de uma população em excesso denominada tester, com outra população chamada driver, seguida da separação da fração não hibridada (alvo) a partir das seqüências comuns hibridadas (Diatchenko et al., 1996).
Apesar do sucesso na identificação de genes importantes, esses métodos normalmente são ineficientes para a obtenção de transcritos pouco abundantes, pois requerem quantidades de RNA poli(A) superiores a 20 µg, envolvendo múltiplos e repetidos passos de subtração, além de serem muito laboriosos (Diatchenko et al., 1996).
Para superar os problemas apresentados pelas técnicas de hibrid ização subtrativa existentes até o momento, foi desenvolvido por Diatchenko et al. (1996) e Gurskaya et al. (1996) e patenteado pela Clontech (PCR-Selet®) um novo método de hibridização subtrativa de populações de cDNA, seguida de amplificação por PCR dos genes diferencialmente expressos, chamada Hibrid ização Subtrativa Supressiva (“Suppression Subtractive Hybridization” – SSH).
A técnica de SSH que combina uma normalização e uma subtração num único passo é baseada numa reação de PCR supressiva. O passo de normalização iguala a abundância de cDNAs com a população tester e o passo de subtração exclui as moléculas comuns entre as populações tester e driver, realizando um enriquecimento dos cDNAs diferencialmente expressos superior a 1000 vezes (Diatchenko et al., 1996).
(d) O princípio da técnica de SSH O método de subtração descrito por Diatchenko et al. (1996) e Gurskaya et al. (1996)
supera o problema de diferenciação na abundância de mRNA pela incorporação de um passo de hibrid ização que normaliza (equaliza) a abundância de seqüências durante a subtração, baseado no padrão de cinética de hibrid ização. Isso elimina qualquer passo intermediário para separação física de ss (“single strand”) e ds (“double strand”) cDNAs, requerendo apenas uma rodada de hibridização subtrativa, podendo alcançar mais de 1.000 vezes de enriquecimento para os cDNAs expressos diferencialmente.
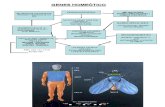
O princípio da Hibridização Subtrativa Supressiva é descrito a seguir, segundo Diatchenko et al. (1996) e representado na Figura 1.
Os cDNAs expressos diferencialmente (alvo) estão presentes no cDNA tester e ausentes (ou apresenta níveis muito baixos) no cDNA driver. Os ds-cDNAs tester e o driver são primeiro digeridos com uma enzima de restrição que corta na 4ª base, produzindo “pontas cegas” (não coesivas). Os fragmentos de cDNA tester são então divididos em duas amostras (1 e 2) e ligados a dois adaptadores diferentes (adaptador 1 e 2), resultando em duas populações de tester, (1) e (2). Os finais dos adaptadores são projetados sem o grupo fosfato, de forma que apenas a fita maior de cada adaptador pode ligar covalentemente a extremidade 5’ do cDNA.
São realizadas duas hibridações na técnica de SSH. Primeiro, um excesso do driver é adicionado a cada amostra do tester. As amostras são então aquecidas (desnaturadas) e colocadas para anelar. A fração de ss-cDNA (“single strand” cDNA - cDNA fita simples)
16
tester (a) é normalizada, significando que concentrações de alta e baixa abundância tornam-se aproximadamente iguais. A normalização ocorre porque o processo de reanelamento que gera os cDNAs homo-híbridos (b) é mais rápido para as moléculas mais abundantes, devido à cinética de segunda ordem da hibrid ização (Britten & Davidson, 1985). Além disso, os ss-cDNAs na fração do tester (a) são significativamente enriquecidos em cDNAs de genes diferencialmente expressos, como é comum, cDNAs não alvos formam hetero-híbridos (e) com o driver.
Na segunda hibrid ização, as duas amostras oriundas da primeira hibridização são misturadas. Apenas o restante de ss-cDNAs normalizados e subtraídos está apto a reassociar e formar híbridos do tipo (b), (c) e novos (e). A adição de uma segunda porção de driver desnaturado a este estágio posterior enriquece a fração (e) para genes diferencialmente expressos. Os híbridos recentemente formados (e) têm uma importante característica que os distingue dos híbridos (b) e (c) formados durante a segunda hibrid ização. Eles possuem seqüências diferentes de adaptadores em sua extremidade 5’. Uma extremidade é proveniente da amostra 1 e a outra da amostra 2. As duas seqüências permitem a amplificação preferencial da fração normalizada e subtraída (e) usando PCR e um par de “primers” (iniciadores), P1 e P2, os quais correspondem à parte externa do adaptador 1 e 2, respectivamente.
Para realizar esta amplificação seletiva, uma reação de extensão é realizada para preencher as pontas desencontradas (coesivas) das moléculas para o anelamento do “primer” antes da iniciação do procedimento de PCR (Reação em Cadeia da Polimerase – “Polimerase Chain Reaction”).
Em todos os ciclos da reação de PCR, a amplificação exponencial pode ocorrer em moléculas do tipo (e). As moléculas do tipo (b) contêm longas repetições invertidas nas extremidades que formam estruturas estáveis “panhandle- like” após cada passo de anelamento/desnaturação na PCR.
A estrutura “panhandle- like” não pode servir como molde na PCR exponencial, porque o anelamento intramolecular de sucessões de adaptadores mais longos é altamente favorecida e mais estável que o anelamento intramolecular de “primers” de PCR muito mais curtos. Este é o efeito supressivo da PCR. Além disso, as moléculas do tipo (a) e (d) não possuem sítios de ligação para o “primer”, assim as moléculas do tipo (c) podem ser amplificadas apenas linearmente. Somente as moléculas do tipo (e) têm seqüências de adaptadores diferentes nas suas extremidades as quais permitem que eles sejam exponencialmente amplificados por meio da reação de PCR. O modelo matemático e os cálculos que descrevem o processo de formação da fração (e), bem como a taxa de enriquecimento, são descritas, detalhadamente, por Gurskaya et al. (1996).
17
Figura 1. Esquema representativo ilustrando passo-a-passo a técnica de SSH. Fonte: Pinto (2004).
(e) Aplicações da técnica de SSH Apesar de ter sido inicialmente desenvolvida para identificar genes relacionados a
doenças humanas, a técnica de Hibrid ização Subtrativa Supressiva - SSH possui outras aplicações e permite a identificação de genes diferencialmente expressos nos mais diversos organismos.
A técnica de SSH ainda continua sendo utilizada na área da saúde, por exemplo, na investigação da expressão de genes relacionados ao câncer (Sers et al., 2002), mas também tem sido utilizada com sucesso em estudos de expressão gênica em diversas espécies vegetais. Por exemplo, SSH foi usada para identificar genes induzidos em resposta à infecção de
cDNA “Tester” com adaptador 1 R cDNA “Tester”com adaptador 2 RcDNA“Driver”(em excesso)
1ªHibridização
a
RNA mensageiro
Subtração
Ligação dosadaptadores
cDNA
Digestão com RSA I
a, b, c, d + e
2ª Hibridização: mistura de amostras,
adição de “Driver” desnaturado e anelamento
Preenchimento dos terminais
d
b
c
a
d
b
c
eAdição de “primers”
Amplificação por PCR
a e d - nenhuma amplificação b- b’ - nenhuma amplificaçãoc - amplificação lineare - e
5’
5’
3’
3’ amplificação exponencial
18
plantas por patógenos, como demonstrado em um estudo onde foram identificados genes induzidos após duas horas de infecção de Arabidopsis thaliana por Orobanche ramosa (Santos et al., 2003) e para identificar genes através de ESTs que tiveram sua abundância alterada em raízes de soja devido à inoculação de Fusarium solani f.sp. glycines (Iqbal et al., 2002). Esta técnica, além de ser utilizada para identificar genes induzidos em resposta à infecção por patógenos, também é utilizada para identificar genes induzido por estresse, como demonstrado em estudo onde foram identificados genes de Arabidopsis que foram diferencialmente expressos em resposta a aplicações de ozônio, patógenos (como bactérias e oomicetos), e moléculas sinalizadoras como ácido salicílico e jasmônico (Mahalingam et al., 2003).
Outra aplicação da técnica de SSH é a detecção de diferenças no conteúdo gênico entre membros da uma espécie bacteriana. SSH foi utilizada para detectar diferenças no conteúdo de genes entre estirpes de Helicobacter pylori. Neste caso, o método anteriormente desenvolvido para estudar a expressão gênica em eucariotos foi adaptado para identificação de diferenças gênicas em procariotos. O conjunto de fragmentos de DNA genômico da estirpe da bactéria de interesse (tester) é removido das seqüências que estão também na estirpe de referência, por hibridização e PCR. Os fragmentos de DNA restantes, altamente enriquecidos para as seqüências tester específicas, são então clonadas para posterior análise (Akopyants et al., 1998). A técnica de SSH também foi utilizada na identificação de diferenças genéticas entre duas estirpes de Xylella fastidiosa que diferem em patogenicidade e em sua gama de hospedeiros (Harakava & Gabriel, 2003) e diferenças genéticas entre bacillus (Radnedge et al., 2003).
A versatilidade da técnica de SSH também é confirmada nos diversos estudos que a utilizam para as mais variadas aplicações, como por exemplo, para o isolamento de genes diferencialmente expressos envolvidos na tolerância de frutos de citrus a condições de variação de temperatura (Sanchez-Ballesta et al., 2003), na identificação de genes que codificam proteínas nos passos anteriores e posteriores da biossíntese de antocianina, bem como genes envolvidos na glicosilação e transporte de antocianinas para o interior do vacúolo em frutos de tomate (Mathews et al., 2003), para identificar genes induzidos por nitrato em raízes de arroz (Wang et al., 2002), e genes induzidos por espécies fitotóxicas de alumínio em raízes de cana-de-açúcar (Watt, 2003). Também no estudo dos mecanismos moleculares envolvidos no processo de senescência em Arabidopsis (Gepstein et al., 2003), e no isolamento de genes diferencialmente expressos em dois diferentes estágios de desenvolvimento floral em Dianthus caryophyllus (Ok et al., 2003).
(f) Eficácia da técnica de SSH As metodologias que empregam a hibridização subtrativa originalmente descrita são
de uso limitado devido à necessidade de uma grande quantidade de mRNA para a realização da hibridização, bem como, devido à dificuldade em clonar as diminutas quantidades de cDNA restantes após a hibrid ização. Entretanto, esta metodologia foi incrementada pela incorporação da técnica de Hibridização Subtrativa Supressiva seguida de PCR (SSH PCR), na qual genes diferencialmente expressos podem ser normalizados e enriquecidos mais de 1000 vezes em uma única rodada de hibrid ização (Diatchenko et al., 1996).
Para determinar que fatores influenciam a eficácia da técnica de SSH, um modelo teórico foi proposto, sob a suposição de que a hibridização de cDNA segue a cinética de segunda ordem. O modelo teórico sugere que um fator crítico que influencia a eficácia da técnica é a relação de concentração (R) do gene alvo entre duas preparações de cDNA. São preferencialmente enriquecidos genes diferencialmente expressos, nos quais o valor do R tende ao infinito. Os experimentos também revelaram algumas limitações práticas do método
19
que não são óbvios a partir do modelo teórico. Para o enriquecimento efetivo dos genes diferencialmente expressos, são requeridas concentrações fracionárias do gene alvo superiores a 0,01% e relação de concentração superior a cinco vezes entre as duas preparações de cDNA (Ji et al., 2002).
Portanto, em experimentos onde pequenas mudanças na expressão gênica são fisiologicamente relevantes, a técnica de SSH seria altamente ineficaz para detectar as mudanças no perfil da expressão gênica. Para superar essa limitação, o “screening” diferenc ial de uma grande quantidade de bibliotecas subtrativas poderia potencialmente compensar esta deficiência, no entanto, o alto custo e grande tempo de trabalho necessário devem ser considerados. Além disso, para o enriquecimento efetivo dos mRNAs alvos, este deve corresponder a pelo menos 0,1% do mRNA total, assim, a baixa abundância de genes, tais como, fatores de transcrição, citocininas e receptores que são reguladores chave de muitos processos patológicos não seriam detectados por este método. A presença de muitos transcritos, não diferencialmente expressos em relação aos transcritos alvos influenciará no tamanho da biblioteca. Desta forma, uma biblioteca de cDNA muito pequena pode não conter os genes diferencialmente expressos, uma vez que sua proporção em relação aos transcritos não alvos foi mínima em função da escolha do tester e do driver (Ji et al., 2002).
Em estudo realizado para identificar genes relacionados ao processo de senescência em plantas de Arabidopsis, a técnica de SSH foi capaz de identificar genes especificamente induzidos pelo processo de senescência, além de identificar genes abundantes com função conhecida neste processo. A proporção dos genes abundantes não foi superior aos outros genes. Estes resultados comprovam a capacidade de enr iquecimento de transcritos raros que a técnica de SSH possui, pois caso contrário estes genes não teriam sido descobertos (Gepstein et al., 2003).
Genes induzidos pela presença de Al+3 em raízes de cana-de-açúcar foram identificados usando a técnica de SSH devido a sua capacidade de enriquecer especificamente os transcritos raros. Neste estudo, mais da metade (28 de 50) dos cDNAs seqüenciados foram de função não conhecida, não havendo similaridade com seqüências gênicas depositadas nos banco de dados ou sendo homólogos a genes que codificam proteínas hipotéticas ou não conhecidas. Entretanto, análises da identidade provável das 22 seqüências restantes forneceram evidências adicionais do potencial da técnica de SSH para enriquecer os transcritos raros. A normalização entre os transcritos abundantes e raros também ocorreu de forma eficiente durante a subtração neste estudo, uma vez que apenas um limitado grau de redundância (2 entre 50 clones) foi aparente nos fragmentos isolados (Watt, 2003).
Foi avaliada em experimento com Arabidopsis, por meio da amplificação por PCR do gene que codifica a enzima gliceraldeido-3fosfato desidrogenase (gene “housekeeping”) e de diversos genes diferencialmente expressos, a eficiência do passo de subtração na técnica de SSH. Se a subtração fosse eficiente, os transcritos do gene “housekeeping” deveriam ser reduzidos, enquanto os transcritos dos genes diferencialmente expressos deveriam ser substancialmente enriquecidos na população de cDNAs usada na construção da biblioteca. Com base no número de ciclos de PCR requeridos para uma eqüitativa amplificação dos produtos de PCR correspondentes às amostras de cDNA subtraídas e não subtraídas, estimou-se que as bibliotecas subtraídas foram enriquecidas de 32-64 vezes para os genes diferencialmente expressos. A mais uniforme distribuição da intensidade de hibrid ização obtida usando sondas de cDNA subtraído refletiu a equalização na concentração de espécies individuais presentes em concentrações notavelmente diferentes na população inicial de cDNA não subtraído. A habilidade desta técnica em identificar genes raros diferencialmente expressos é comprovada neste estudo. Quase 17% dos genes identificados foram depositados no banco de dados de ESTs de Arabidopsis pela primeira vez (Mahalingam et al., 2003).
20
3 CAPÍTULO I
EFEITO DO FLUXO SAZONAL DE NITRATO SOBRE O METABOLISMO DE NITROGÊNIO E O ACÚMULO DAS FRAÇÕES NITROGENADAS SOLÚVEIS EM DUAS VARIEDADES DE ARROZ.
21
RESUMO
Duas variedades de arroz, Piauí (tradicional) e IAC-47 (melhorada) foram cultivadas em casa de vegetação em solução nutritiva recebendo 1,4 mM de N, na forma de nitrato, até os 32 dias após a germinação (DAG). Após esse período, um grupo de plantas passou a receber 14 mM de N-NO3
- e o outro continuou recebendo 1,4 mM N-NO3- por mais 10 dias (42 DAG). Dos
42 até os 56 DAG, todas as plantas passaram a receber 0,35 mM de N-NO3- até 56 DAG. Aos
42 e 56 DAG, as plantas foram coletadas e pesadas. Em paralelo determinaram-se os teores de açúcares solúveis, N-Amino livre, N-NO3
-, N-NH4+ e a atividade das enzimas NR e GS. Os
resultados obtidos indicam que o histórico nutricional das plantas afetou, significativamente, a absorção e uso de N, devendo ser considerado nos estudo de eficiência no uso de N. A variedade Piauí foi mais eficiente na aquisição e uso do N quando comparada com a IAC-47, visto que acumulou NO3
- em seus tecidos durante as fases iniciais de crescimento, para posterior utilização. Palavras chave: Oryza sativa L. Variedades tradicionais. N-amino. Açúcares solúveis. Absorção de nitrato. Eficiência no uso de N. Enzimas de assimilação de nitrogênio.
ABSTRACT
Two rice varieties: Piaui, traditional rice, and IAC-47, an improved variety, were grown in nutrient solution containing 1.4 mM NO3
--N up to 32 days after germination (DAG). After this, a group of plants received 14 mM NO3
--N while the other was kept at 1.4 mM NO3--N up
to 42 DAG. From 42 until 56 DAG, all plants received 0.35 mM NO3--N. Plants were
collected at 42 and 56 DAG, soluble fractions, NR and GS enzyme activities were determinate. The nutritional history of the plants affected significantly the uptake and use of N, and should be taken into consideration in the studies of N-use efficiency. The variety Piaui was more efficient than IAC-47 in N-uptake use, accumulating more NO3
- in its tissues at the initial phases of its cycle for subsequent utilization. Key words: Oryza sativa L. Traditional varieties. Amino-N. Soluble sugars. Nitrate uptake. Nitrogen use efficiency. Nitrogen assimilation enzymes.
22
3.1 INTRODUÇÃO
O arroz é um dos cereais mais importantes para o homem, e se constitui na alimentação básica para mais de três bilhões de pessoas. Ao contrário de outros cereais, o arroz é consumido quase que exclusivamente por humanos. São plantados anualmente acima de 150 milhões de hectares de arroz e a produção mundial chega a 600 milhões de toneladas (Fischer et al., 2000).
Segundo Greenland (1958) e Wetselaar (1961a, 1961b), o clima tropical, caracterizado por duas estações bem definidas (um período de chuvas e um período seco), ocasiona fluxos sazonais de nitrato no solo. O mesmo fenômeno parece acontecer nas regiões do cerrado brasileiro, onde o acúmulo de nitrato no solo ocorreu somente em curto período de tempo na estação chuvosa (Nardoto & Bustamante, 2003). Desta forma, devido à lixiviação intensa durante a estação das chuvas, o N estaria disponível para as plantas apenas no início do período úmido, quando deveria, portanto, ser absorvido rapidamente.
O nitrato absorvido pelas raízes pode ser reduzido a amônio ou estocado nos vacúolos, ou ainda, pode ser translocado para a parte aérea para ser reduzido ou armazenado nos vacúolos. O primeiro passo na redução do nitrato é realizado no citossol pela enzima Nitrato Redutase (NR) e produz nitrito, que entra nos plastídios (cloroplastos na parte aérea) e é reduzido a amônio (NH4
+) pela Nitrito Redutase (NiR). O NH4+ é fixado pela GS/GOGAT em
aminoácidos (glutamina/glutamato) (Tischner, 2000). O nitrato acumulado nos vacúolos pode ser utilizado nas etapas posteriores de
assimilação de N e produção de grãos. As plantas que apresentarem esta característica seriam mais eficientes na utilização do N absorvido. Hirel et al. (2001), estudando milho, comprovaram esta hipótese e propuseram que durante a fase vegetativa a planta deveria manter uma baixa atividade da NR, de maneira que o NO3
- acumulado nos vacúolos possa ser apenas remobilizado, posteriormente, para a produção de grãos. Souza et al. (1998) também chegaram a resultados semelhantes quando compararam duas variedades de arroz, sendo uma melhorada (IAC-47) e outra tradicional (Piauí). Segundo estes autores, a variedade tradicional foi mais eficiente na utilização do N acumulado nas fases iniciais de crescimento, sendo portanto, menos dependente de fontes externas.
Para que o nitrato acumulado nos vacúolos seja direcionado para o desenvolvimento dos grãos é necessário que ocorra modificações metabólicas que estão relacionadas principalmente com as enzimas de assimilação de N e carbono, dentre elas a Glutamina Sintetase (GS) ocupa papel importante. Segundo Andrews et al. (2004), para os cereais, a GS1 é uma enzima chave no processo de mobilização do N a partir das folhas senescentes e sua atividade nestas folhas está positivamente correlacionada com a produção. Para arroz (Oryza sativa L.), a enzima GOGAT dependente de NADH, é importante na utilização do N, no enchimento dos grãos, e sua atividade nessa fase está também relacionada positivamente com a produção.
Este trabalho teve como objetivo avaliar as frações nitrogenadas solúveis, enzimas do
metabolismo de N e sua relação com a eficiência do uso de N em duas variedades de arroz, sendo uma melhorada (IAC-47) e outra tradicional (Piaui), cultivadas sob disponibilidade sazonal de nitrato.
23
3.2 MATERIAL E MÉTODOS
3.2.1 Condições experimentais
O experimento foi conduzido em casa de vegetação no Departamento de Solos da Universidade Federal Rural do Rio de Janeiro.
Duas variedades de arroz, uma tradicional (Piauí) e uma melhorada (IAC-47), foram cultivadas em vasos com solução nutritiva de Hoagland modificada, pH 5,5 (Hoagland & Arnon, 1950). As plantas foram germinadas sobre gaze em vasos com água. Após a germinação as plântulas (duas por vaso) receberam solução nutritiva contendo 1,4 mM de N-NO3
-. Nos sete primeiros dias, a solução nutritiva foi fornecida a ¼ da força iônica, a seguir, as plantas foram transferidas para solução nutritiva a ½ da força iônica, onde ficaram por mais sete dias, a partir dos quais passaram para solução nutritiva com força iônica total, completando 32 dias após a germinação (DAG). Após esse período, um grupo de plantas passou a receber 14 mM de N-NO3
-, e o outro grupo permaneceu com 1,4 mM de N-NO3-, até
completarem 42 DAG, a partir desse tempo, todas as plantas passaram a receber 0,35 mM de N-NO3
-, até completarem 56 DAG (Figura 2). As coletas do material vegetal foram realizadas aos 42 e 56 DAG. A solução nutritiva foi trocada a cada três dias e o pH foi corrigido diariamente.
Figura 2. Esquema do experimento em Casa de Vegetação com variedades de arroz, IAC-47 e Piauí, submetidas a diferentes concentrações de N na forma de nitrato em solução nutritiva.
Nas coletas (42 e 56 DAG) as plantas foram separadas em parte aérea e raízes,
também foram coletadas as amostras para a determinação da atividade da Nitrato Redutase (Jaworski, 1971) e Glutamina Sintetase (Farnden & Robertson, 1980) no mesmo dia da coleta. Amostras de um grama de material coletado foram homogeneizadas em etanol (80%) e após partição com clorofórmio (Fernandes, 1984) a fração solúvel obtida, foi armazenada e utilizada posteriormente para a determinação do teor de N-amino livre (Yemm & Cocking, 1955), Açúcares solúveis (Yemm & Willis, 1957), N-NH4
+ (Mitchell, 1972; Felker, 1977) e N-NO3
- (Cataldo et al., 1975). Os procedimentos para realização das análises mencionadas são descritos a seguir.
1,4 mM N-NO3-1
1,4 mM N-NO3-1 14 mM N-NO3
-1 0,35 mM N-NO3-1
0,35 mM N-NO3-1 A
B
Dias 0 32 42 56
A – tratamento B - controle coletas
24
3.2.2 Extração alcoólica no material fresco
A extração alcoólica e partição com clorofórmio foram realizadas segundo Fernandes (1984), como descritas a seguir.
Após a determinação da massa fresca, um grama de material vegetal foi colocado em 20 mL de etanol (80%) e armazenados em frascos de vidro, para posterior extração das frações solúveis.
Cada amostra armazenada em etanol foi triturada com politron, e filtrada em 4 camadas de gaze e papel de filtro. Posteriormente, foi transferido para funil de separação onde se adicionou igual volume de clorofórmio. Após agitação suave, foi deixado em repouso por 40 minutos, quando se descartou a fração apolar. A fração polar (sobrenadante) foi recolhida e elevada a um volume final de 25 mL com etanol (80%), sendo em seguida armazenada para a determinação dos teores de N-amino livre, N-NH4
+, N-NO3- e açúcares solúveis.
3.2.3 Determinação dos teores de N-amino livre
A determinação foi realizada de acordo com Yemm & Cocking (1955), em tubo “pyrex” com 0,5 mL de tampão citrato (0,2 M; pH 5,0), 1 mL da solução obtida do extrato alcoólico (diluída quando necessário), 1,2 mL do reagente metil celossolve (100%) + KCN (0,01M) + ninidrina (5%). A mistura foi agitada e todos os tubos foram fechados com papel alumínio e colocados para aquecer em banho-maria a 100°C por 15 minutos. Após esse período, os tubos com as amostras foram resfriados em água corrente por 5 minutos, quando então foram acrescentados 3 mL de etanol (60%). A mistura foi homogeneizada e levada para a leitura espectrofotométrica em 570 nm. A leucina (0,00; 0,05; 0,10; 0,20; 0,25 e 0,30 mM) foi utilizada como padrão.
3.2.4 Determinação dos teores de açúcares solúveis
A determinação dos teores de Açúcares Solúveis foi realizada segundo Yemm & Willis (1954). Foram adicionados em tubos “pyrex” de 2,5 cm de diâmetro imersos em banho de gelo, 5 mL do reagente de antrona (2% em H2SO4 5:2), e após 5 minutos de repouso, foi adicionado lentamente 1 mL da solução obtida do extrato alcoólico (diluída quando necessário), deixando-se em repouso por 5 minutos a 0°C. Em seguida, as amostras foram colocadas em banho-maria a 100ºC por 10 minutos para o desenvolvimento da cor verde característica. Após resfriamento em água corrente, as leituras espectrofotométricas foram realizadas em 620 nm. A glicose (0, 20, 40, 50, 80 e 100 µg mL-1) foi utilizada como padrão.
3.2.5 Determinação dos teores de N-NO3-
A determinação dos teores de N na forma de nitrato foi realizada segundo Cataldo et al. (1975). Uma alíquota de 0,1 mL da solução obtida do extrato alcoólico (diluída quando necessária) foi colocada em tubo de ensaio, adicionando-se vagarosamente, 0,4 mL da solução de ácido salicílico (5%) em H2SO4 concentrado. A mistura foi deixada em repouso por 20 minutos em temperatura ambiente, acrescentando lentamente 9,5 mL de NaOH (2N). Após o resfriamento da amostra, foi realizada a leitura espectrofotométrica em 410 nm utilizando o KNO3 (0, 5, 10, 20, 25 e 40 µg de NO3
-.0,1 mL-1) como padrão.
25
3.2.6 Determinação dos teores de N-NH4+
A determinação de N na forma de amônio foi realizada pelo método de Mitchell (1972), sendo a solução de hipoclorito de sódio substituída por dicloroisocianurato de sódio (Felker, 1977), pois em clima tropical, a solução de hipoclorito perde rapidamente seu poder oxidante. A determinação foi realizada utilizando-se duas soluções. A “solução A” constituída de 5 g de fenol e 0,025 g de nitroprussiato de sódio em 500 mL de água deionizada, e a “solução B”, composta de 15 g de NaOH e 0,31 g de dicloroisocianurato de sódio em 500 mL de água deionizada. Uma alíquota de 0,5 mL da solução obtida do extrato alcoólico (diluída quando necessária) foi acrescentada a 2,5 mL de cada solução, após homogeneização e descanso por 30 minutos, as amostras foram lidas em espectrofotômetro a 630 nm. O NH4Cl (5 mM) foi utilizado para a confecção da curva padrão nas seguintes concentrações: 0, 50, 100 e 200 nmoles de NH4
+.0,5 mL-1.
3.2.7 Determinação da atividade da nitrato redutase
A determinação da atividade da Nitrato Redutase foi realizada de acordo com a metodologia de Jaworski (1971). Para a determinação da atividade da NR, 200 mg de tecido vegetal foram colocados em tubo de ensaio, onde se acrescentou 5 mL da solução incubadora (Tampão Fosfato 0,1 M pH 7,5 + n-propanol (2%) + KNO3 0,02 M). Os tubos foram cobertos com papel alumínio e incubados em banho-maria a 30ºC por 30 minutos. O NO3
- foi utilizado no meio de incubação para se medir a “atividade potencial” da enzima. Após a incubação, retirou-se para o ensaio, 0,4 mL de amostra, acrescentando-se 0,3 mL de sulfanilamida (1%), 0,3 mL de n-nafitil-etileno-diamino (0,02%), deixando-se em repouso por 20 minutos. Em seguida, foram adicionados 4 mL de água destilada , após homogeneização, a leitura espectrofotométrica foi realizada em 540 nm . O NaNO2 (0, 5, 10, 20, 25, 40 e 50 µM) foi utilizado como padrão. Os resultados foram expressos em nmoles de NO2 g-1 de massa fresca-1 hora-1.
3.2.8 Determinação da atividade da glutamina sintetase
A determinação da atividade da Glutamina Sintetase foi realizada de acordo com a metodologia de Farnden & Robertson (1980). Para a extração da enzima, pesou-se 1g do terço médio das folhas que foi macerado em N líquido. Após a maceração com N líquido, foram acrescentados 8 mL de tampão imidazol-HCl 0,5 M pH 5,0. A mistura foi filtrada em gaze e papel de filtro e recolhida em tubos de ensaio no banho de gelo, sendo centrifugadas em seguida por 15 minutos a 0ºC e 15.000 x g. O sobrenadante fo i recolhido e conservado em gelo. Para a reação enzimática, 0,3 mL do sobrenadante obtido foi incubado com 0,5 mL de coquetel de incubação (0,2 mL de tampão imidazol-HCl 0,5 M pH 5,0; 0,1 mL de ß-mercaptoetanol; 0,1 mL de MgSO4.5H20 (0,4 M); 0,1 mL de hidroxilamina; 0,1 mL de ATP (0,1 M); 0,1 mL de glutamato (0,5 M, pH 7,5) e 1,0 mL de água). Foram feitos controles sem acréscimo de ATP. O meio de incubação permaneceu em banho-maria a 30ºC por 30 minutos. No final do período, as amostras foram retiradas e acrescentou-se 1,5 mL de solução de cloreto férrico (FeCl3 – 10 g de ácido tricloroacético + 13,33 g de cloreto férrico dissolvidos em 250 mL de HCl 0,5 N)para interromper a reação. A mistura foi filtrada e a leitura foi realizada em espectrofotômetro em 540 nm, utilizando-se como padrão ?-glutamilmono-hidroxamato (0,0; 0,5; 1,0; 1,5; 2,0; 3,0; 4,0; 5,0 e 6,0 mM).
26
3.2.9 Análises estatísticas
O delineamento experimental utilizado foi inteiramente casualizado em um fatorial (duas variedades, dois níveis de N) com três repetições. Os dados obtidos foram avaliados estatisticamente através do programa Sisvar para Windows versão 4.0 (Ferreira, 2000) e as médias comparadas pelo Teste de Tukey ou pelo erro padrão.
3.3 RESULTADOS E DISCUSSÃO
As plantas de ambas as variedades, que receberam 14 mM de N-NO3- apresentaram
redução significativa na massa fresca da parte aérea na coleta aos 42 DAG. No entanto, as raízes de IAC-47 apresentaram redução significativa (Tabela 1). Entretanto, quando as plantas que receberam 14 mM de N-NO3
- foram coletadas após permanecerem por 14 dias em solução com 0,35 mM de N-NO3
- (coleta aos 56 DAG), houve maior acúmulo de massa fresca da parte aérea para a variedade IAC-47, enquanto que nessa mesma coleta (56 DAG) a variedade Piauí acumulou mais massa fresca na parte aérea e raízes apenas quando havia recebido 1,4 mM de N-NO3
- (Tabela 1). Tanto a variedade melhorada (IAC-47) quanto a tradicional (Piauí) mostraram maiores
teores de N-NH4+ nas raízes, aos 42 DAG, quando haviam recebido 14 mM de N-NO3
-. Na parte aérea não houve variação significativa nos teores de N-NH4
+ (Tabela 1). Aos 42 DAG, as plantas que receberam 14 mM de N-NO3
- acumularam N-NO3- tanto
nas raízes quanto na parte aérea (Figura 3). Na coleta aos 56 DAG, quando essas plantas já estavam em solução nutritiva com 0,35 mM de N-NO3
- a resposta foi diferente. A variedade tradicional (Piauí) acumulou maiores teores de NO3
- quando tinha recebido anteriormente 1,4 mM de N-NO3
- (Figura 3). Embora os teores totais de NO3- sejam bem menores do que os
observados na coleta aos 42 DAG, estes resultados indicam que a variedade Piauí possui uma estratégia diferente da IAC-47 no que diz respeito ao acúmulo de nitrato nos tecidos, pois quando recebeu menor dose de NO3
-, manteve maior acúmulo de NO3-, tanto na parte aérea
como na raiz. Em um estudo com duas variedades tradicionais de arroz (Manteiga e Lageado), com
apenas 20% de similaridade genética entre si (Araújo, 2002), cultivadas em dois níveis de N-NO3
- (1,4 e 14 mM) em solução nutritiva, Santos et al. (2003) sugeriram que a variedade Manteiga estava mais bem adaptada a baixos níveis de NO3
-, e que a variedade Lageado, acumulou elevados teores deste nutriente em seus tecidos quando submetida a altas doses de N-NO3
- em solução. Estes dados reforçam os indícios que apontam a maior capacidade destas variedades tradicionais para se adaptarem à disponibilidade sazonal de NO3
- utilizando diferentes mecanismos.
27
Tabela 1. Massa Fresca aos 42 e 56 dias após a germinação (DAG) da parte aérea e raízes de duas variedades de arroz submetidas a duas doses de N-NO3
-.
N-NO3
- (mM)
Parte Aérea Raízes
42 DAG *56 DAG 42 DAG *56 DAG
Piauí IAC-47 Piaui IAC-47 Piaui IAC-47 Piaui IAC-47
Massa Fresca (g vaso-1)
1,4 7,75 aA 6,97 aA 18,69 aA 14,33 bB 2,38 aA 2,32 aA 14,13 aA 7,84 bA 14 5,00 aB 5,65 aB 21,79 aA 20,91 aA 1,61 aA 1,36 aB 13,31 aA 8,38 bA
Média 6,37 a 6,31 a 20,24 a 17,62 a 1,99 a 1,84 a 13,72 a 8,11 b
N-NH4+ (µmoles gpf-1)
1,4 1,74 aA 2,00 aA 1,65 aA 1,57 aA 2,60 aB 2,68 aB 1,18 aA 1,24 aA 14 1,88 aA 2,21 aA 1,73 aA 1,67 aA 5,75 aA 4,96 aA 1,26 aA 1,36 aA
Média 1,81 a 2,10 a 1,69 a 1,62 a 4,18 a 3,82 a 1,22 a 1,30 a
Açúcares solúveis (mg gpf-1)
1,4 5,21 bA 9,77 aA 12,45 bB 17,14 aA 9,33 aA 7,33 bA 5,53 aB 5,88 aA 14 3,53 bB 8,20 aB 19,57 aA 16,97 bA 4,96 aB 5,58 aB 7,05 aA 4,75 bB
Média 4,37 b 8,98 a 16,01 a 17,05 a 7,14 a 6,46 a 6,29 a 5,32 b
Médias seguidas de mesma letra minúscula na linha e mesma letra maiúscula na coluna para cada época de coleta (42 e 56 DAG) não diferem significativamente (Teste de Tukey, p<0,05). *Aos 56 DAG, as plantas estavam submetidas a 0,35 mM N-NO3
-, entretanto, no início do experimento um grupo foi submetido a doses diferenciais de N-NO3
- representadas na primeira coluna da tabela.
28
Levando em consideração que muitas plantas acumulam durante o estágio vegetativo de crescimento grandes quantidades de N que podem ser remobilizadas em estágios posteriores do desenvolvimento (von Wirén et al., 1997), e que essa remobilização de N ocorre quando sua absorção é reduzida ou mesmo interrompida por estresses bióticos ou abióticos, incluindo estresse hídrico ou durante o processo de senescência natural (Gallais & Hirel, 2004), a capacidade de “armazenamento” do N-NO3
- pela variedade Piauí, mesmo quando este íon se encontra em baixos níveis no solo, pode ser considerada como uma vantagem adaptativa desta variedade já que este N, absorvido no início do seu ciclo pode ser utilizado posteriormente de acordo com a demanda nos estágios finais do ciclo da planta.
56 diasParte Aérea
0
20
40
60
80
PiauiIAC-47
42 diasParte Aérea
PiauiIAC-47
Raízes
Doses de N-NO3- (mg N L-1)
20 200
N-N
O3-
( µm
oles
gpf
-1)
0
20
40
60
80
PiauiIAC-47
42 dias Raízes
20 200
PiauiIAC-47
56 dias
56 dias
20 2000
2
4
6
8
20 2000
1
2
3
4
Figura 3. Teores de nitrato na parte aérea e raízes em duas épocas de coleta de duas variedades de arroz submetidas a duas doses de N-NO3
-, 20 e 200 mg N-NO3- L-1 (1,4 e
14 mM de N-NO3- respectivamente). Cada valor corresponde a uma média de 3
repetições + erro padrão (barras verticais). Os gráficos menores (56 dias, parte aérea e raízes) correspondem à ampliação dos resultados para facilitar a visualização das diferenças.
Aos 42 DAG, plantas de ambas as variedades que receberam 14 mM de N-NO3
-
acumularam maiores teores de N-amino livre na parte aérea. Nas raízes, entretanto, ocorreu acúmulo apenas na variedade Piauí (Figura 4). É interessante observar que aos 42 DAG, os acúmulos de NO3
- e N-amino livre na parte aérea e raízes estão relacionados inversamente, indicando que a remobilização do NO3
- e sua redução, leva à produção de N-amino livre. Aos
29
56 DAG, este acúmulo só foi observado na parte aérea da variedade Piauí que havia sido anteriormente cultivada em 14 mM de N-NO3
- (Figura 4). Elevados teores de N-amino livre podem ter contribuído para o acúmulo de NO3
- nos tecidos, uma vez que estudos têm demonstrado que o NO3
- e os produtos da sua redução influenciam na sua aquisição e redução. Diante da necessidade de uma aquisição coordenada de N a partir de diversas fontes (NO3
-, NH4+ e aminoácidos), espera-se que essa regulação seja
mais efetiva se um produto interno da assimilação de NO3-, como a glutamina, exerça
“feedback” negativo (Glass et al., 2002). O efeito inibitório da glutamina foi demonstrado em plântulas de milho, onde este aminoácido inibiu a expressão da NR e NiR. Houve 80% de inibição em tecidos de raízes que foram mais sensíveis a este efeito inibitório que a parte aérea (Sivasankar et al., 1997).
O aumento nos teores de NO3- nos tecidos leva também a um aumento nos teores de
N-amino livre como demonstrado neste trabalho e em outros, onde a aplicação de doses crescentes de N na forma de URAN (fertilizante líquido contendo uréia, amônio e nitrato) levou a um aumento no teor de N-amino livre em arroz (Souza et al., 1999). Também foram encontrados os maiores teores de N-amino livre nas raízes de uma variedade tradicional de arroz (Lageado) quando submetida a maior dose de N-NO3
- (Santos et al., 2003).
56 diasParte Aérea
0
2
4
6
8
10
12
14
PiauiIAC-47
42 diasParte Aérea
PiauiIAC-47
Raízes
Doses de N-NO3- (mg N L-1)
20 200
N-a
min
o liv
re (
µmol
es g
pf-1
)
0
2
4
6
8
10
12
14
PiauiIAC-47
42 dias Raízes
20 200
PiauiIAC-47
56 dias
56 dias
20 2000
1
2
3
4
Figura 4. Teores de N-amino livre na parte aérea e raízes em duas épocas de coleta de duas
variedades de arroz submetidas a duas doses de N-NO3-, 20 e 200 mg N-NO3
- L-1 (1,4 e 14 mM de N-NO3
- respectivamente). Cada valor corresponde a uma média de 3 repetições + erro padrão (barras verticais). O gráfico menor (56 dias, raízes) corresponde à ampliação dos resultados para facilitar a visualização das diferenças.
30
A grande disponibilidade de N provoca maior acúmulo de N-amino livre, mas para que esse nitrogênio seja assimilado é necessário haver gasto de energia na sua redução e assimilação pelas enzimas do metabolismo de N. Além disso, experimentos têm revelado que o “status” de carboidratos afeta o metabolismo de N, havendo uma inibição geral da biossíntese de aminoácidos quando os níveis de açúcares solúveis são baixos, ocorrendo também uma inibição dos transcritos da NR e a assimilação de NO3
-, além da diminuição nos níveis de metabólitos secundários que são sintetizados a partir dos aminoácidos (Stitt et al., 2002).
Aos 42 DAG, em ambas as variedades no tratamento com 14 mM de N-NO3- houve
redução nos teores de açúcares solúveis, tanto na parte aérea quanto nas raízes (Tabela 1), esta redução é simétrica com o que ocorre com a massa fresca, comprovando ter havido gasto de energia para redução e assimilação do N-NO3
- absorvido. O mesmo foi observado também em arroz, onde a aplicação de doses crescentes de URAN levou a diminuição dos níveis de açúcares solúveis quando da aplicação da maior dose de N (Souza et al., 1999). Aos 56 DAG, quando as plantas já estavam sendo cultivadas com 0,35 mM de N-NO3
- as variedades diferiram quanto ao acúmulo de açúcares solúveis na parte aérea, havendo aumento para a Piauí e redução para a IAC-47, quando haviam recebido anteriormente 14 mM de N-NO3
-. Nesta coleta, as plantas não mostraram simetria entre acúmulo de massa fresca e os teores de açúcares solúveis. Este comportamento se repete nas raízes (Tabela 1). O mesmo ocorreu com uma variedade tradicional de arroz (Manteiga) que apresentou os maiores teores médios de açúcares solúveis quando submetida a maior dose de N-NO3
- em solução nutritiva (14 mM), sugerindo que esta variedade apresenta maior adaptação a menores níveis de NO3
- (Santos et al., 2003).
Estes resultados parecem indicar a existência de um mecanismo de uso eficiente para o N disponível, já que sob alta disponibilidade de N-NO3
- pouca energia parece ter sido gasta na redução do N-NO3
- absorvido. Desta forma, se o NO3- não for reduzido ele pode acumular no
vacúolo e servir como reserva de N para utilização nas fases posteriores do ciclo da planta como comentado anteriormente.
O NO3- é um dos compostos que a planta utiliza como “sensor” para fazer o ajuste do
metabolismo e do crescimento de acordo com as mudanças na disponibilidade de N, desta forma, genes requeridos para a absorção e redução de NO3
- são induzidos por este nutriente (Scheible et al., 1997). É bem conhecido que tanto o influxo de NO3
- quanto a atividade da NR são processos induzidos pelo substrato. Plantas crescidas na ausência de NO3
- tem baixas taxas de absorção de NO3
- e baixa atividade da NR. A exposição ao nitrato aumenta as taxas desses processos (indução), seguido por um declínio gradual (repressão) até atingir um valor constante. Este padrão geral é comum entre as plantas, as espécies se diferenciam apenas na escala de tempo sobre o qual esses eventos ocorrem bem como na magnitude desses processos (Min et al., 1998).
O processo de indução pelo substrato também foi comprovado em duas variedades de arroz, IAC-47 (melhorada) e Piauí (tradicional), pois após a aplicação foliar de N na forma de URAN houve um aumento na atividade da NR nas folhas bandeira e folha 2 (Souza et al., 2002).
É conhecido que o metabolismo de carboidrato é afetado pela presença de NO3- que
altera a relação entre a síntese de amido e sacarose em favor do último (Tischner, 2000). Isto foi demonstrado em um experimento onde a sacarose aumentou a expressão tanto da NR quanto da NiR sem afetar significativamente a absorção de NO3
- (Sivasankar et al., 1997). Nas raízes de ambas as variedades estudadas, aos 42 DAG, ocorreu redução na
atividade da NR quando as plantas receberam 14 mM de N-NO3- (Figura 5), verificando-se
que não existe correlação entre o acúmulo de NO3- e a atividade da NR. Entretanto aos 56
31
DAG, quando as plantas já estavam sendo cultivadas com 0,35 mM de N-NO3- a variedade
Piauí apresentou maior atividade da NR na parte aérea apenas quando tinha recebido anteriormente 14 mM de N-NO3
- (Figura 5). Em condições de baixa disponibilidade de N-NO3
-, o acúmulo de NO3- na fase inicial
de crescimento pode ser favorável para o metabolismo da planta em suas fases posteriores. Nestas circunstâncias, a menor atividade da NR apresentada pela variedade Piauí indica que o nitrato absorvido não foi reduzido, sendo, portanto, estocado para uso posterior. Esta é uma característica importante, pois demonstra a capacidade da variedade tradicional usar de maneira mais eficiente o N disponível.
56 diasParte Aérea
0
500
1000
1500
2000
2500
3000
PiauiIAC-4742 dias
Parte Aérea
PiauiIAC-47
Raízes
Doses de N-NO3- (mg N L-1)
20 200
Ativ
idad
e da
Nitr
ato
Red
utas
e (n
mol
es g
pf-1
h-1
)
0
500
1000
1500
2000
2500
3000
PiauiIAC-4742 dias
Raízes
20 200
PiauiIAC-47
56 dias
56 dias
20 2000
200
400
600
800
20 2000
50
100
150
200
250
Figura 5. Atividade da Nitrato Redutase na parte aérea e raízes de duas variedades de arroz
submetidas a duas dose de N-NO3-, 20 e 200 mg N-NO3
- L-1 (1,4 e 14 mM de N-NO3-
respectivamente). Cada valor corresponde a uma média de 3 repetições + erro padrão (barras verticais). Os gráficos menores (56 dias, parte aérea e raízes) correspondem à ampliação dos resultados para facilitar a visualização das diferenças.
Esta capacidade foi comprovada em trabalho onde a variedade Piauí foi mais eficiente
na utilização de N acumulado e menos dependente de fontes externas, indicando um processo de adaptação ao fluxo instável de N que ocorre na região do trópico úmido (Souza et al., 1998). Nestas circunstâncias, aparentemente, a capacidade da variedade Piauí para absorver e acumular NO3
- e sua menor atividade da NR nas fases iniciais de crescimento, podem ser os mecanismos que permitem a esta variedade uma elevada produção de N nos grãos (Rodrigues et al., 2004).
32
Aos 42 DAG, quando as variedades são comparadas, a variedade Piauí apresentou maior atividade da GS em ambos os tratamentos nas raízes. Na parte aérea houve maior atividade da GS apenas quando a va riedade Piauí foi cultivada com 14 mM de N-NO3
- (Figura 6). No conjunto, esses resultados parecem indicar uma maior eficiência na economia de N pela variedade tradicional, em relação à melhorada. Aos 42 DAG, a variedade Piauí apresentou maior atividade da GS nas raízes, tanto no tratamento com 1,4 mM como com 14 mM de N-NO3
- (Figura 6). Este comportamento da GS é o inverso do que se observa para a NR.
Aparentemente, Piauí é uma planta que quando sob fluxo elevado de N-NO3-, acumula
NO3- nas raízes, diminui a atividade da NR e aumenta a da GS. Não foi observada variação
nos teores de N-NH4+ na parte aérea das variedades analisadas, indicando ter havido pronta
assimilação do amônio oriundo da redução. Provave lmente, ocorreu assimilação deste N que se reverteu no acúmulo de N-amino livre na parte aérea e raízes da variedade tradicional (Figura 4).
Aos 56 DAG, foi observado nas raízes da variedade Piauí, maior atividade da GS quando comparada à variedade IAC-47, tanto quando submetidas anteriormente a 1,4 mM quanto a 14 mM de N-NO3
-. No entanto, na parte aérea, a atividade da GS da variedade melhorada foi significativamente maior que a variedade tradicional quando estas tinham recebido 1,4 mM de N-NO3
-. A atividade da GS nas raízes foi o dobro da observada na parte aérea em ambas as variedades, demonstrando que o NO3
- absorvido e reduzido pelas plantas está sendo assimilado preferencialmente nas raízes (Figura 6).
O nitrato induz genes que codificam proteínas que são requeridas na redução de NO3-
e NH4+. Em experimento comparando plantas de tabaco normais e mutantes (nas quais a
atividade da NR era muito baixa), os níveis dos transcritos de GS1 e Fd-GOGAT foram baixos nas folhas e raízes das plantas normais crescidas em baixas concentrações de NO3
-, e altos, quando as plantas transformadas foram crescidas em altas concentrações de NO3
- (Scheible et al., 1997).
Tanto em milho (Hirel et al., 2001) quanto em arroz (Obara et al., 2001), estudos têm revelado que há coincidência na localização de genes da GS e QTLs para a produtividade. Esses resultados sugerem que, possivelmente, a GS representa um componente chave da eficiência no uso de N bem como na produtividade. Em experimento com folhas senescentes de Brassica napus, foi encontrado um alto conteúdo de glutamina e este aminoácido foi mais abundante no floema. Juntamente com o fato de que a GS1 foi a única isoenzima da GS encontrada neste estágio, isto sugere que a GS1 desempenha um importante papel na remobilização de N (Finnemann & Schjoerring, 2000). Limami et al. (2002) demonstraram a presença de dois QTLs para a atividade da GS que foram mapeados coincidentemente com genes da GS citossólica. Assim, há fortes evidências de que a GS1 é uma enzima chave na mobilização de N a partir de folhas senescentes e sua atividade está relacionada à produção (Andrews et al., 2004).
33
56 diasParte Aérea
0
50
100
150
200
250
300
PiauiIAC-47
42 diasParte Aérea
PiauiIAC-47
Raízes
Doses de N-NO3- (mg N L-1)
20 200
Ativ
idad
e da
Glu
tam
ina
Sin
teta
se (
nmol
es g
pf-1
min
-1)
0
50
100
150
200
250
300
PiauiIAC-47
42 diasRaízes
20 200
PiauiIAC-47
56 dias
56 dias
20 2000
20
40
60
80
Figura 6. Atividade da Glutamina Sintetase na parte aérea e raízes de duas variedades de
arroz submetidas a duas doses de N-NO3-, 20 e 200 mg N-NO3
- L-1 (1,4 e 14 mM de N-NO3
- respectivamente). Cada valor corresponde a uma média de 3 repetições + erro padrão (barras verticais). O gráfico menor (56 dias, parte aérea) corresponde à ampliação dos resultados para facilitar a visualização das diferenças.
De maneira geral, os dados indicam que o histórico nutricional das plantas deve ser considerado, isto é, mesmo cultivadas por um determinado período com a mesma dose de N, deve ser levado em consideração que a quantidade de N a que as plantas foram submetidas anteriormente (dos 32 aos 42 DAG), influencia significativamente os mecanismos de absorção e uso desse N. Neste contexto, há evidências de que a variedade tradicional (Piauí) é mais eficiente na aquisição e uso deste nutriente, pois parece estar havendo acúmulo de NO3
- nas fases iniciais do desenvolvimento vegetal permitindo sua posterior remobilização. Os dados apresentados aqui reforçam a hipótese apresentada por Hirel et al. (2001), na qual o acúmulo de NO3
- nas folhas e as reações catalisadas pela NR e GS são co-reguladas e representam elementos chave no controle da eficiência no uso de N em milho.
34
3.4 CONCLUSÕES
O aumento na disponibilidade de NO3-, entre 32 e 42 DAG afetou o metabolismo de N
nas variedades IAC-47 e Piaui em etapas posteriores do crescimento, quando os teores de N-NO3
- na solução externa voltaram a níveis mais baixos. Estes resultados simulam o provável comportamento destas plantas nas áreas tropicais onde ocorrem fluxos estacionais de NO3
-. A variedade tradicional (Piauí) teve comportamento diferente da variedade melhorada
(IAC-47) tendo sido capaz de acumular NO3- nos tecidos, mesmo quando sob baixos níveis de
N na solução nutritiva. A variedade Piauí na fase exponencial de crescimento acumulou mais NO3
- nos tecidos e mostrou menor atividade da Nitrato Redutase do que a IAC-47. Isso sugere que essa planta (Piauí) sofreu adaptação às condições dominantes nos trópicos úmidos com “flush” de NO3
-, que alternam o acúmulo e a depleção de N da solução do solo.
35
4 CAPÍTULO II
EFEITO DE DIFERENTES CONCENTRAÇÕES DE NITRATO EM SOLUÇÃO NUTRITIVA SOBRE O PERFIL DE EXPRESSÃO DA
NITRATO REDUTASE E TRANSPORTADORES DE NITRATO POR RT-PCR SEMI-QUANTITATIVA EM TEMPO REAL E ATIVIDADE
DA NITRATO REDUTASE E FRAÇÕES NITROGENADAS EM DUAS VARIEDADES DE ARROZ.
36
RESUMO
Duas variedades de arroz, Piauí (tradicionalmente cultivada no estado do Maranhão e eficiente na aquisição e uso de N) e IAC-47 (uma variedade melhorada) foram utilizadas em experimento de RT-PCR quantitativo em tempo real, visando avaliar o perfil de expressão relativa dos genes que codificam os transportadores de nitrato (NRT1 e NRT2) e da NR (Nia2), além das frações nitrogenadas e atividade da Nitrato Redutase (ANR). As plantas foram cultivadas em solução nutritiva enriquecida com 1,4 mM de nitrogênio (N) até 31 dias após a germinação (DAG), sendo em seguida transferidas para solução sem N por 48 horas. Depois disso, as plantas forma divididas em três tratamentos: cultivo se adição de N na solução, cultivo com 0,1 mM e 10 mM de N-NO3
-. Seis horas após, a parte aérea e raízes foram coletados e armazenados em N líquido para futuras análises. A variedade tradicional acumulou maiores teores de nitrato e N-amino livre, apresentou menor ANR, este resultado se deve a um possível controle dos teores de aminoácidos, levando ao acúmulo do nitrato. A variedade Piauí pareceu adotar um controle diferenciado da ANR, pois mesmo apresentando maior expressão relativa desse gene, manteve a ANR sem sofrer influência da concentração de nitrato na solução. Os dados apontaram a variedade tradicional como potencial acumuladora de nitrato, pois também induziu a expressão dos genes dos transportadores de baixa afinidade (NRT1), aproveitando a grande disponibilidade desse nutriente em solução. Ocorreu também indução dos transportadores de alta afinidade (NRT2) na parte aérea da variedade tradicional. Palavras chave: RT-PCR quantitativa em tempo real. NRT1. NRT2. Nitrogênio.
ABSTRACT
Two rice varieties, Piaui (traditionally cultivated at Maranhão State and efficient in the acquisition and use of N) and IAC-47 (an improved variety) were used in quantitative real-time PCR, with objective of to evaluate expression profile of nitrate transporter genes (NRT1 and NRT2) and NR genes (Nia2), nitrogenate fractions and Nitrate Reductase activity (NRA). Plants were grown in nutrient solution (1.4 mM) until 31 days after germination (DAG), after this, they were transferred to nutrient solution without N by 48h. So, one group of plants received 0.1 and the other 10 mM of NO3
--N, and another group remained in the nutrient solution without N. Six hours after, roots and shoots were collected and stored in liquid nitrogen to be analyzed later. Traditional variety accumulated higher nitrate and free amino-N content, showing less NRA, which can be due to a possible control of amino acids leading to the accumulation of nitrate. Piaui variety seemed to adopt a differentiate control of NRA, because even showing higher relative expression of this gene, it maintained the NRA without influence of nitrate concentration in solution. These data pointed out the traditional variety as an accumulator potential of nitrate, because it also induced the expression of low affinity nitrate transporter gene (NRT1), taking advantage of the high availability of this nutrient in solution. Also, high affinity nitrate transporter were induced (NRT2) in shoots of the traditional variety. Key words: Quantitative real- time PCR. NRT1. NRT2. Nitrogen.
37
4.1 INTRODUÇÃO
Os cereais são fontes de carboidratos e de proteína, contribuindo direta e indiretamente na dieta humana. Aproximadamente 45% proteína total dos alimentos consumidos pela população humana provém diretamente dos grãos (FAO, 1998). Além disso, estes são fonte de rações para animais que pertencem a nossa cadeia alimentar, logo, participam indiretamanente da dieta humana (Feil, 1997).
Dentre os cereais, o arroz é fonte primária de alimento para mais da metade da população mundial, correspondendo a 35-75% das calorias consumidas por mais de 3 bilhões de asiáticos sendo plantado em aproximadamente 154 milhões de hectares anualmente, correspondendo a cerca de 11% das terras cultivadas no mundo (Khush, 2005). Entre 1966 e 2000, a produção de arroz aumentou 130%, de 257 milhões de toneladas em 1966 para 600 milhões de toneladas em 2000 (Khush, 2005).
As plantas requerem nitrogênio (N) durante todo o seu desenvolvimento, representando cerca de 2% da matéria seca total das plantas. É componente de proteínas, ácidos nucléicos, coenzimas e numerosos produtos secundários de plantas. Esse mineral está disponível como nitrato (NO3
-) ou amônio (NH4+) (Miller & Cramer, 2004).
As plantas superiores precisaram se adaptar à mudanças temporais e espaciais na disponibilidade das fontes de N no solo (Robinson, 1994). Para superar tais limitações, as plantas desenvolveram mecanismos adaptativos que permitiram a melhoria na eficiência de captura do N em situações de limitação desse nutriente (Clarkson, 1985).
Para que o nitrato possa atravessar a membrana plasmática, é necessário um sistema de transporte ativo, que é acoplado a um fluxo de prótons e dependente de uma força próton motriz gerada pela H+-ATPase (McClure et al., 1990; Glass et al., 1992). O influxo de NO3
- nas raízes das plantas foi definido cineticamente como sendo composto por pelo menos quatro sistemas que se complementam; sistema constitutivo de alta afinidade (cHATS – “constitutive high-affinity influx”), sistema de alta afinidade induzido por nitrato (iHATS – “nitrate-inducible high-affinity influx”), sistema constitutivo de baixa afinidade (cLATS – “constitutive low-affinity influx”), e sistema de baixa afinidade induzido por nitrato (iLATS – “inducible low-affinity influx”) (Crawford & Glass, 1998).
O sistema de alta afinidade (HATS) é responsável pela absorção em baixas concentrações externas (0,5 – 1 mM) e o de baixa afinidade (LATS) atua quando as concentrações externas forem superiores a 1 mM (Clarkson, 1986; Crawford & Glass, 1998; Daniel-Vedele et al., 1998; Glass & Siddiqi, 1995). A absorção de NO3
- envolve proteínas transportadoras classificadas em duas famílias gênicas, NRT1 e NRT2, que codificam os transportadores de baixa (LATS) e alta (HATS) afinidade, respectivamente (Crawford & Glass, 1998; Daniel-Vedele et al., 1998; Forde, 2000; Huang et al., 1999).
O nitrato entra no citoplasma das células epidérmicas da raiz, pode ser translocado para a parte aérea ou armazenado no vacúolo, ou pode ainda ser excretado de volta para o apoplasma (Orsel et al., 2002b). Quando no citossol, pode ser reduzido a nitrito (NO2
-) pela enzima Redutase (NR) e depois a NH4
+ através da Nitrito Redutase (NiR). A redução do nitrato a nitrito e depois a amônio gera N numa forma que pode ser assimilado em aminoácidos através do ciclo GS/GOGAT (Stitt, 1999). O movimento do NO3
- do citossol para os vacúolos é feito através de canais, portanto, a alta velocidade, o que resulta numa depleção de nitrato no citossol, até mesmo quando o conteúdo total de NO3
- na célula for alto. Desta forma, os vacúolos são considerados como um importante local de armazenamento de
38
nitrato, sendo chamado de “pool substrato”. O NO3- nos vacúolos pode ser transportado de
volta para o citossol através de um simporte (NO3-/H+) (Vidmar et al., 2000b).
A NR é uma enzima passível de ativação e indução pelo substrato e sua expressão é controlada tanto por nitrato, como pela luz e açúcares. Essa regulação ocorre a nível transcricional, embora a regulação por luz ocorra tanto a nível transcricional quanto postranscricional (Vincentz et al., 1993; Melzer et al., 1989). Para a maioria das espécies de plantas, a principal isoforma da NR é a dependente de NADH e está localizada no citoplasma de células de raízes e parte aérea (Andrews et al., 2004).
Fertilizantes nitrogenados e seus contaminantes associados acumulam-se em algumas situações, resultando na eutrofização de mananciais, águas litorâneas (Raven & Taylor, 2003), superficiais e subsuperficiais, além do enriquecimento da atmosfera com NH3 e N2O. O manejo inadequado de fertilizantes nitrogenados representa risco ambiental, por exemplo, as aplicações excessivas que buscam o rendimento máximo das culturas agrícolas podem causar lixiviação de NO3
- (Miller & Cramer, 2004; Beman et al., 2005). Assim, os fertilizantes são a fonte primária da poluição por N, e infelizmente a previsão é de que seu uso poderá dobrar ou triplicar nos próximos 50 anos (Tilman et al., 2001).
Devido ao alto custo dos fertilizantes e problemas de poluição ambiental, tem-se desenvolvido estratégias para reduzir a utilização de nitrogênio nos cultivos agrícolas sem afetar a produtividade (Wang et al., 2001). Estudos abordando as correlações entre o conteúdo de NO3
- nas folhas jovens e sua remobilização, têm possibilitado a identificação de genótipos de milho mais eficientes na aquisição e uso de N (Gallais & Hirel, 2004). Resultados obtidos com variedades tradicionais de arroz (Santos et al., 2003a; Rodrigues et al., 2004; Souza & Fernandes, 2006) indicam a necessidade de melhor entendimento dos mecanismos relacionados à absorção e remobilização do N, para o desenvolvimento de novas variedades mais eficientes na aquisição e uso de nitrogênio.
O NO3- além de nutriente, também é um sinal, atua na reprogramação do metabolismo
e influencia no desenvolvimento de raízes e no metabolismo de carbono e nitrogênio (Crawford, 1995; Sitt, 1999). A exposição de raízes ao NO3
- tem mostrado a indução de genes importantes para a assimilação de N, incluindo aqueles que codificam os transportadores de nitrato de alta (NRT2) e baixa (NRT1) afinidade e também aqueles que codificam as enzimas NR, NiR, GS e GOGAT (Wang et al., 2000). No entanto, não está bem evidenciado os eventos envolvidos nessas mudanças. O completo entendimento dos mecanismos fisiológicos, bioquímicos e moleculares que controlam a absorção de NO3
-, sua partição entre a parte aérea e raízes, sua redução e subseqüente assimilação em aminoácidos pode fornecer respostas que contribuam para o uso eficiente desse nutriente.
Dessa forma, esse trabalho teve como objetivo estudar o efeito de quatro
concentrações de NO3- em solução nutritiva sobre os teores de N-NO3
-, N-NH4+ e N-amino
livre, e sobre a atividade da Nitrato Redutase na parte aérea e raízes de duas variedades de arroz: Paiui (tradicionalmente cultivadas no estado do Maranhão) e IAC-47 (melhorada). Além disso, buscou-se investigar o perfil de expressão de diferentes membros dos genes que codificam os transportadores de nitrato (NRT1 e NRT2) e Nitrato Redutase (Nia2 – NR-NADH) por meio de RT-PCR quantitativo em tempo real (“quantitative real-time PCR”).
39
4.2 MATERIAL E MÉTODOS
4.2.1 Condições experimentais
O experimento foi conduzido em câmara de crescimento do Departamento de Solos na Universidade Federal Rural do Rio de Janeiro (UFRuralRJ) sob condições controladas: fotoperíodo de 12h/12h (luz/escuro) com radiação de 280 µmol m-2 s-1 (fluxo de fótons fotossintéticos), umidade relativa do ar de 70% e temperatura 28ºC/24ºC (diurna/noturna).
Duas variedades de arroz, IAC-47 (melhorada) e Piauí (tradicional), foram cultivadas em solução nutritiva de Hoagland modificada, pH 5,5 (Hoagland & Arnon, 1950). As plantas foram submetidas nos primeiros 31 dias a uma solução basal de crescimento (solução de Hoagland com NO3
-/NH4+ a 1,4 mM). Após 31 dias, permaneceram em solução sem N por
48 h. Passado esse período, as plantas passaram a receber as doses diferenciais de N-NO3- (0;
0,1; 1 e 10 mM) e outro grupo (controle) permaneceu em solução sem N por 6 horas (Figura 7). A solução nutritiva foi trocada a cada três dias e o pH foi corrigido diariamente.
Figura 7. Esquema do experimento em Câmara de Crescimento com variedades de arroz,
IAC-47 e Piauí, submetidas a diferentes concentrações de N na forma de nitrato em solução nutritiva.
As plantas receberam o tratamento com N-NO3- três horas após o início do período de
luz (Wang et al., 2001), visando a minimização da influência do ritmo circadiano e da alternância luz/escuro sobre a expressão gênica.
A coleta foi realizada seis horas após a aplicação dos tratamentos, pois até onde se sabe, a indução dos genes que codificam os transportadores nitrato é bastante rápida, pelo
Solução basal Solução sem N
0,1 mM NO3-
1 mM NO3-
10 mM NO3-
31 dias 48h 6h
Piaui
Solução basal Solução sem N
0,1 mM NO3-
1 mM NO3-
10 mM NO3-
31 dias 48h 6h
IAC-47
(A)
(B)
(C)
(Controle)
(A)
(B)
(C)
(Controle)
40
menos para o sistema de alta afinidade. Alguns estudos demonstraram indução já a partir da primeira hora de exposição permanecendo até 48 h após a indução inicial. Em tomate, a indução máxima dos genes que codificam os transportadores de nitrato ocorreu 6 h após a aplicação do tratamento (Wang et al., 2001). Em Brassica napus L. (canola), foi detectada a expressão dos genes BnNRT1 e BnNRT2 depois de 24 horas de aplicação do pulso de NO3
- e permanecendo até 96 horas após essa indução (Faure-Rabasse et al., 2002). Em milho, foi detectado acúmulo de transcritos do gene ZmNRT2.1 após 0,5 horas após transferência das plantas para solução contendo 1 mM de NO3
-. Nas raízes a máxima indução foi observada 48 horas e nas folhas 6 horas após a indução (Quaggiotti et al., 2003). O gene OsNRT1 é constitut ivamente expresso (apresentando indução de 0 a 24 horas – tempo final de análise) na maioria das camadas da raiz, epiderme e pêlos radiculares (Lin et al., 2000).
4.2.2 Análise da atividade enzimática e frações solúveis
Amostras de folhas e raízes foram coletadas no mesmo dia, foi determinada a atividade da Nitrato Redutase (Jaworski, 1971 e amostras de um grama de material coletado da parte aérea ou raízes foram homogeneizadas em etanol (80%) e após partição com clorofórmio (Fernandes, 1984), a fração solúvel obtida foi armazenada e utilizada posteriormente para a determinação do teor de N-amino livre (Yemm & Cocking, 1955), N-NH4
+ (Mitchell, 1972; Felker, 1977) e N-NO3- (Cataldo et al., 1975). Para maior detalhamento
das metodologias aqui utilizadas, consultar os itens 3.2.2, 3.2.3, 3.2.5, 3.2.6 e 3.2.7 no Capítulo I.
4.2.3 Análise estatística
O delineamento experimental utilizado foi o inteiramente casualizado em um fatorial (duas variedades x quatro níveis de N-NO3
-) com três repetições. Os dados obtidos foram avaliados estatisticamente através do programa Sisvar para Windows versão 4.0 (Ferreira, 2000) e as médias comparadas pelo Teste de Tukey (5%). Para as análises de Correlação, foi utilizado o programa SigmaStat 2.03, empregando-se a Correlação de Pearson.
4.2.4 Avaliação da expressão gênica
A análise do perfil de expressão dos genes dos transportadores de nitrato de alta e baixa afinidade (NRT2 e NRT1), e da enzima Nitrato Redutase (Nia2), foram coletadas amostras da parte aérea e raízes, seis horas após a indução conforme descrito no item 4.2.1 e Fig. 7. Foi utilizada nas análises a técnica de RT-PCR semi-quantitativa em tempo real (“Quantitative real-time PCR Analysis”).
As análises relativas ao perfil de expressão dos genes estudados foram realizadas no Instituto de Pesquisas do Jardim Botânico do Rio de Janeiro, no Laboratório de Biologia Molecular de Plantas, pertencente ao Instituto de Bioquímica Médica da Universidade Federal do Rio de Janeiro, em colaboração com os pesquisadores Drª Adriana Silva Hemerly e Drº Eduardo de Matos Nogueira.
(a) RT-PCR Semi-Quantitativa em tempo real
A técnica de RT-PCR quantitativa em tempo real foi utilizada para investigar o perfil de expressão dos genes que codificam os transportadores de NO3
- e da NR-NADH em duas variedades de arroz, submetidas a concentrações contrastantes de N-NO3
-.
41
(b) Extração de RNA total
Com o auxílio de gral e pistilo, na presença constante de nitrogênio líquido, foi macerado aproximadamente 1,0 grama de tecido de raiz e parte aérea das variedades de arroz estudadas. O macerado foi transferido para tubos de centrífuga de 15 mL, novos e estéreis, contendo 1,5 mL de fenol, 1,5 mL de clorofórmio:álcool isoamílico e 4,5 mL de Tampão NTES (0,2 mL Tris-ClDEPC pH 8,0; 25 mM EDTADEPC; 0,3 M NaClDEPC; 2% SDSDEPC). A mistura foi homogeneizada em vortex por 10 minutos, sendo centrifugada a 8.014 x g, por 10 minutos, a 4ºC. O sobrenadante foi transferido para um tubo novo e o precipitado descartado em recipiente próprio para descarte de fenol. Foi adicionado ao sobrenadante 1/10 volume de NaOAcDEPC (2 M, pH 4,8) e 1 volume de isopropanol. Essa mistura foi submetida a -20ºC por 2 horas para a precipitação. Após a incubação as amostras foram centrifugadas a 8.014 x g por 10 minutos e o precipitado (“pellet”) foi lavado com 2,0 mL de EtOHDEPC 70% gelado, sendo centrifugado novamente a 8.014 x g por 10 minutos. O “pellet” foi ressuspenso em 2,5 mL de H2ODEPC, adicionando-se em seguida 2,5 mL de LiAcDEPC (4 M, pH 4,8). A mistura foi deixada em gelo, dentro da geladeira, por uma no ite.
No dia seguinte, as amostras foram centrifugadas a 8.014 x g por 10 minutos e o precipitado foi redissolvido em 0,9 mL de H2ODEPC e 0,1 mL de NaOAcDEPC (2 M, pH 4,8). Após a ressuspensão, foi adicionado 2 mL de EtOH absoluto a 4ºC e a mistura foi colocada a -20ºC por 2 horas para a precipitação. Após a incubação, as amostras foram centrifugadas a 12.522 x g por 20 minutos e o precipitado foi lavado com 500 µL de EtOHDEPC 70% gelado e centrifugadas a 8.014 x g por 10 minutos. O EtOH que restou no tubo foi retirado com o auxílio da pipeta sem desfazer o precipitado e os recipientes foram deixados no gelo com as tampas abertas por cerca de 10 minutos para a secagem das amostras, que em seguida foram dissolvidas em 200-500 µL de H2ODEPC e transferidas para microtubos novos de 1,5 mL.
Após a extração, o RNA total foi quantificado espectrofotometricamente, assumindo que 1 D.O a 260 nm corresponde a 40 µg de RNA por mL de solução. A qualidade do RNA extraído foi verificada espectrofotometricamente por meio das relações A260/A230 e A260/A280 capazes de detectar polissacarídeos/polifenóis (Loulakakis et al., 1996; Shultz et al., 1994) e contaminação por proteínas, respectivamente (Winfrey et al., 1997). Além desta técnica, também foi visualizada a viabilidade do RNA em gel de agarose (1%) corado com brometo de etídio.
(c) Tratamento com DNase e precipitação do RNA tratado
A fim de garantir a qualidade do RNA total a ser utilizado na reação de síntese do cDNA, as amostras extraídas foram submetidas a digestão com DNase I. Cada reação de 30 µg de RNA total foi composta por 3 µL de DNase I (10 U µL-1), 52 µL de tampão para DNase (4 X) completando-se o volume final para 210 µL com H2ODEPC. A mistura foi incubada em termociclador a 37ºC por 15 minutos.
Terminada a reação de digestão, foi realizada a precipitação do RNA tratado com DNase cono descrito a seguir. Após o tratamento com DNAse, a reação foi avolumada para 700 µL com H2ODEPC, adicionando-se em seguida 700 µL de fenol. A mistura foi homogeneizada em vortex por 5 minutos e centrifugada a 8.014 x g, por 5 minutos. Após a centrifugação, 600 µL da fase aquosa (superior) foram retirados e transferidos para um novo tubo, sendo em seguida adicionados 600 µL de fenol:clorofórmio:álcool isoamílico (24:1). A solução foi homogeneizada em vortex por 3 minutos e novamente centrifugada por 2 minutos. Após a centrifugação (8.014 x g), 500 µL da fase aquosa (superior) foi retirada e adicionada a um novo tubo, foi colocado em seguida 50 µL (1/10 do volume) de NaOAcDEPC (2 M) e 1100 µL (2 volumes de etanol absoluto). A mistura foi homogeneizada em vortex e incubada a -
42
20ºC. Após a incubação, a mistura foi centrifugada a 13.023 x g, por 20 minutos a 4ºC. O sobrenadante foi descartado e o precipitado lavado com 200 µL de EtOHDEPC (70%), centrifugando-se a 13.023 x g, por 5 minutos a 4ºC. Após a centrifugação, o sobrenadante foi retirado e transferido para microtubos novos, acondicionados em gelo com a tampa aberta por 10 minutos para a total eliminação de resíduos de etanol. Em seguida, as amostras foram ressuspendidas em 100 µL de H2ODEPC. Após a precipitação, as amostras foram quantificadas novamente no espectrofotômetro para o conhecimento da quantidade de RNA restante após a digestão. Essa leitura é importante para o passo de síntese de cDNA, pois é necessário o conhecimento exato da quantidade de RNA a ser utilizado na reação de síntese da 1ª fita de cDNA.
(d) Síntese de cDNA
A síntese do cDNA a partir do RNA total, é o primeiro passo na quantificação da expressão de genes por meio da RT-PCR em tempo real. A 1ª fita de cDNA foi sintetizada usando “TaqMan Reverse Transcription Reagents” (Applied Biosystems), usando primers randômicos (“random hexamers”) de acordo com as recomendações do fabricante, com pequenas modificações: 0,5 µg de RNA total; 3 µL de 10 X TaqMan RT Buffer; 6,6 µL de 25 mM MgCl2; 6 µL de deoxyNTPs mixture; 1,5 µL de Random Hexamers; 0,6 µL de RNase Inhibitor; 0,75 µL de MultiScribe™ Reverse Transcriptase (50 U µL-1) e “RNase-free water” suficiente para completar 30 µL. A reação foi realizada em termociclador, iniciando com 10 minutos de incubação a 25ºC, seguida de 30 minutos de transcrição reversa a 48ºC e terminando com 5 minutos a 95ºC para inativação da transcriptase reversa.
(e) RT-PCR quantitativo em tempo real
As análises de RT-PCR quantitativo em tempo real foram realizadas usando “primers” específicos (Tabela 2) para os genes estudados. Devido a grande similaridade existente entre os membros da família gênica dos transportadores de nitrato em arroz, os “primers” foram desenhados com base nas seqüências da região 3’ não transcrita (3’-UTR) utilizando o programa “Primer Express version 2.0” (Applied Biosystems). O gene 28S de arroz foi utilizado como controle constitutivo do experimento (Kim et al., 2003). Os produtos de PCR foram detectados com “SYBR® Green PCR Master Mix” (Applied Biosystems).
A reação de “real- time” foi realizada em duplicata, de acordo com as recomendações do fabricante: 6,25 µL da mistura de “primers” “forward” + “reverse” (totalizando 3,6 µM = 50 µL de cada um dos primers que foram ressuspendidos a 7,2 µM); 12,5 µL de “mix UMM” e 6,25 µL da reação de síntese da 1ª fita de cDNA. A mistura foi centrifugada na placa a 4023 x g, por 3 minutos e levada para o aparelho de PCR em tempo real (“7500 Real Time PCR System” da Applied Biosystems), as condições da reação de PCR foram as seguintes: 50°C por 2 minutos, 95°C por 10 minutos, 95°C por 15 segundos e 60°C por 1 minuto (40 ciclos), a curva de dissociação foi realizada a 95°C por 15 segundos, 60°C por 1 minuto, 95°C por 15 segundos.
43
Tabela 2. Primers específicos usados nas análises de RT-PCR semi-quantitativo em tempo real para a amplificação dos genes OsNia2 e dos transportadores de nitrato (OsNRT1, OsNRT1.1, OsNRT1.2 e OsNRT2.5).
Número de
acesso Proteína Forward primer Reverse primer
11978.m076371 OsNia 2 NR2 fwr 5’-GCG TAT GCA AGA TGA GAG AAA AAA -3’
NR2 rev 5’-TCA TGG CCT ATG TAT GCA GTA TGT AC -3’
11972.m087921
OsNRT1 TN1 fwr 5’-GAG GTT TGG GTT
TTT GAG GTA GTG-3’ TN1 rev 5’-CAG GAG ATT GAA
GCT AGC ATC ATA TC-3’ 11981m.054661
OsNRT1 TN2 fwr 5’-AAT GAT CCC TGA
TTA GGT CAA GTC A-3’ TN2 rev 5’-CCA AAT ACC ACT ACT
CTT GCA TCC T-3’ BAD68604.12 OsNRT1.2 TN4 fwr 5’-CAA TCT GTA ATG
CAG GGT TAA CTG TT -3’ TN4 rev 5’-AGC ATC CTC AAG ACC
ACC AAA -3’ NP_917125.12 OsNRT2.5 TN5 fwr 5’-GGT GGC CTT GGG
ATT GG-3’ TN5 rev 5’-GCC GAT CCA CAG
AAG TAA ATC AA-3’ XP_480163.12 OsNRT1.1 TN6 fwr 5’-CGA GGT TGG TGC
ATT TTG TG-3’ TN6 rev 5’-GCC GTG GTG TTC TCT
TTT TTT T-3’ 1TIGR Rice Genome Annotation. 2NCBI – National Center for Biotechnology Information.
4.3 RESULTADOS E DISCUSSÃO
4.3.1 Massa fresca, frações solúveis e atividade da NR
As concentrações de N-NO3- influenciaram na produção de massa fresca das
variedades estudadas. Em alguns tratamentos (0,1 e 10 mM de N-NO3- na parte aérea e 1 e 10
mM de N-NO3- nas raízes) a variedade IAC-47 apresentou maior produção de massa fresca
quando comparada com a Piauí. Entretanto, a variedade IAC-47 apresentou maior média de produção de massa fresca, tanto na parte aérea como nas raízes, quando comparada a Piauí. O mesmo foi observado para os teores de N-NH4
+ (Tabela 3). A redução na produção de massa fresca pela variedade Piauí poderia ser explicada por
sua habilidade de acumular NO3- em seus tecidos, como demonstrado em experimento com
plantas de tabaco que possuíam baixa atividade da NR, segundo Scheible et al. (1997), o acúmulo de altas concentrações de NO3
- nas parte aérea dessas plantas foi correlacionado a uma inibição do crescimento radicular e aumento da relação parte aérea:raiz.
A variedade Piauí acumulou maiores teores de N-NO3- na parte aérea e raízes do que a
variedade IAC-47. A variedade Piauí apresentou maior capacidade de acúmulo de nitrato em seus tecidos, essa capacidade foi mais aparente na parte aérea, acumulando cerca de 15 µmoles gpf-1 de N-NO3
- na maior dose de nitrato aplicado em solução (10 mM). O acúmulo de nitrato nos tecidos da parte aérea da variedade Piauí representou praticamente o dobro do acúmulo ocorrido na IAC-47 (Figura 8), possuindo, portanto, uma reserva maior de N quando comparada a IAC-47, apontando para uma possibilidade de remobilização do N armazenado em seus tecidos.
44
Tabela 3. Massa Fresca e teores de N-NH4+ na parte aérea e raízes de duas variedades de
arroz submetidas a diferentes concentrações de N-NO3-.
N-NO3-
(mM)
Parte Aérea Raízes
Massa Fresca (g)
Piauí IAC-47 Piauí IAC-47
0 21,80 Aa 24,43 Aa 10,22 Aa 8,86 Aa 0,1 19,09 Ab 26,40 Aa 8,03 ABb 10,57 Aa 1,0 21,53 Aa 24,62 Aa 8,88 Aa 10,58 Aa 10,0 19,56 Ab 25,89 Aa 6,32 Bb 11,07 Aa
Média 20,49 B 25,33 a 8,36 b 10,27 a
N-NH4+ (µmoles gpf-1)
0 0,98 Ba 0,93 Aa 0,93 Ba 0,83 Aa 0,1 1,20 Aa 0,93 Ab 0,84 ABa 0,78 Aa 1,0 1,27 Aa 1,13 Aa 1,05 Aa 0,89 Ab 10,0 1,30 Aa 1,09 Ab 1,11 Aa 0,92 Ab
Média 1,19 A 1,02 b 0,98 a 0,86 b
Médias seguidas de mesma letra minúscula na linha e mesma letra maiúscula na coluna em cada parte da planta, não diferem significativamente (Teste de Tukey, p<0,05).
Estes dados estão de acordo com os resultados apresentados por Hirel et al. (2001)
onde o aumento na produtividade de genótipos de milho foi devido a sua habilidade em acumular NO3
-, em suas folhas, no crescimento vegetativo e eficiente remobilização durante o enchimento dos grãos. Em plântulas de cevada, a atuação do NO3
- estocado no vacúolo como reserva de N foi comprovada, pois mesmo quando o NO3
- externo foi removido, o crescimento e assimilação de N pelas plântulas continuaram por meio da remobilização do NO3
- (van der Leij et al., 1998). A variedade IAC-47 apresentou maior atividade da NR quando comparada com a
variedade Piauí. Isto pode ter se dado por influencia das concentrações de N-NO3-, ou seja, o
aumento nas concentrações de nitrato levou ao aumento na atividade da NR, o mesmo não foi observado para a variedade Piauí (Figura 8). O aumento nas concentrações de NO3
- em solução nutritiva também provocou incremento na atividade da NR em Quarcus robur (Thomas & Hilker, 2000).
A variedade IAC-47 não acumulou N-NO3- em seus tecidos, ao contrário, prontamente
reduziu o NO3- absorvido. Isto é evidenciado pela inexistência de correlação significativa (r =
0,42, P = 0,174ns) entre as doses de N aplicadas em solução e os teores de N-NO3- nos tecidos
da parte aérea desta variedade. Os menores teores de N-NO3- encontrados na parte aérea da
variedade IAC-47 estão relacionados com a maior atividade da NR, demonstrando mais uma vez que o NO3
- absorvido foi prontamente reduzido mantendo-se seus teores constantes nos tecidos.
45
Parte Aérea
AN
R (n
mol
es g
pf-1 h
-1)
0
400
800
1200
1600
Raízes
IAC-47Piaui
Parte Aérea
N-N
O3- (
µmol
es g
pf-1
)
0
5
10
15 Raízes
IAC-47Piaui
Parte Aérea
mM N-NO3-
0 0,1 1 10
N-a
min
o (µ
mol
es g
pf-1
)
0
5
10
15 Raízes
0 0,1 1 10
IAC-47Piaui
Figura 8. Atividade da Nitrato Redutase (ANR), teores de N-NO3
- e N-amino na parte aérea e raízes de duas variedades de arroz, IAC-47 (melhorada) e Piauí (tradicional) submetidas a 4 concentrações de N-NO3
- em solução nutritiva (0; 0,1; 1 e 10 mM).
46
A atividade da NR é governada por múltiplos fatores, como luz, nitrato, glutamina e açúcares (Campbell, 1999; Stitt et al., 2002). Os genes Nia, que codificam a NR, são induzidos por NO3
- e açúcares e inibidos por glutamina exógena (Hoff et al., 1994), e a atividade da NR é regulada pelo NO3
- do “pool metabólico” (Ferrari et al., 1973; Aslam et al., 1976). O efeito inibitório da glutamina foi demonstrado em plântulas de milho onde este aminoácido inibiu a expressão da NR e Nitrito Redutase (NiR). Foram observados níveis de 80% de inibição em tecidos de raízes que foram mais sensíveis a este efeito inibitório que a parte aérea (Sivasankar et al., 1997).
Hirel et al. (2001) sugerem que durante a fase vegetativa de crescimento, plantas de milho deveriam manter uma baixa atividade da NR, de maneira que o NO3
- acumulado nos vacúolos possa ser posteriormente remobilizado para a produção de grãos. Segundo Gallais & Hirel (2004), alta atividade da NR indicam genótipos menos eficientes no uso de N.
Não houve diferença significativa no acúmulo de N-amino livre nas raízes das variedades estudadas. No entanto, na parte aérea, a variedade Piauí apresentou maiores teores de N-amino livre em todas as concentrações de N-NO3
- comparada a variedade IAC-47 (Figura 8). Os teores de N-amino livre na parte aérea da variedade Piauí refletem sua eficiência em absorver e assimilar o N disponível, pois mesmo quando submetida a solução sem N, apresentou maiores teores de N-amino livre que a variedade melhorada (Figura 8).
Elevados teores de N-amino livre podem ter contribuído para o acúmulo de NO3- nos
tecidos, uma vez que estudos têm demonstrado que o NO3- e os produtos da sua redução
influenciam sua aquisição e redução. O conteúdo de aminoácido nas folhas geralmente correlaciona-se com o fornecimento de N (Scheible et al. 1997). O aumento nos teores de NO3
- nos tecidos está relacionado também aos maiores teores de N-amino livre, como demonstrado por Souza et al. (1999), onde a aplicação de doses crescentes de N na forma de URAN (fertilizante líquido contendo uréia, amônio e nitrato) levou a um aumento no teor de N-amino livre. Também foram encontrados maiores teores de N-amino livre nas raízes de uma variedade tradicional de arroz (Lageado) quando submetida a maior dose de N-NO3
- (Santos et al., 2003a).
Os resultados obtidos com a variedade Piauí sugerem que esta adota uma estratégia de maior eficiência no uso de N-NO3
-, pois acumulou elevados teores de N-NO3- na parte aérea e
teve menor atividade da NR, levando a crer que o NO3- absorvido não está sendo todo
reduzido, sendo grande parte estocado no vacúolo para posterior utilização. Rodrigues et al. (2004), estudando a variedade Piaui sob fluxos estacionais de nitrato também chegaram a estes resultados. Segundo esses autores, a variedade Piauí mostrou baixa atividade de NR nos estágios iniciais do desenvolvimento acumulando NO3
-. A maior concentração de N-amino livre na variedade Piauí pode ter contribuído para o controle do nível de atividade da NR, e conseqüente acúmulo de N-NO3
- (Figura 8). Em cevada foi demonstrada a existência de correlação da atividade da NR com o
conteúdo de NO3- das folhas, ocorrendo diminuição da atividade da enzima com a redução do
conteúdo de NO3- nos tecidos foliares. Por outro lado, plantas submetidas a altas
concentrações de NO3- mostraram alta atividade da NR e níveis elevados de glutamina quando
comparadas às plantas submetidas a baixas concentrações de NO3- (Man et al., 1999).
A eficiência da variedade Piauí já foi demonstrada anteriormente em um experimento onde esta variedade apresentou o mesmo nível de atividade da NR na parte aérea independentemente da disponibilidade de seu substrato (Santos et al., 2003b).
47
4.3.2 Extração do RNA total
Para o estudo da expressão relativa dos genes dos transportadores de nitrato de alta e baixa afinidade e da Nitrato Redutase, foram escolhidas apenas as amostras das plantas que foram submetidas a 0,1 e 10 mM de NO3
-, além daquelas utilizadas como controle (sem N). Essa medida foi adotada por medidas de economia, uma vez que tais análises apresentaram custo elevado.
A extração de RNA total de folhas e raízes das variedades de arroz submetidas a concentrações contrastantes de N-NO3
- apresentou bons resultados, como demonstrado pelas relações obtidas nas leituras espectrofotométricas (Tabela 4). O resultado da extração também foi confirmado pela visualização de alíquotas das amostras extraídas em gel de agarose corado com brometo de etídio (Figura 9).
Houve grande diferença nas quantidades de RNA extraído nas diferentes amostras (3,30 – 24,90 µg mL-1), no entanto, o rendimento obtido com a extração foi suficiente para a realização das análises da expressão gênica. A relação A260/A280 indica o nível de contaminação com proteínas, baseado no princípio de que ácidos nucléicos apresentam uma absorvância ótima de 260 nm e proteínas de 280 nm (Winfrey et al., 1997). Sendo assim, a relação A260/A280 reflete a pureza do RNA total, sendo que as amostras com RNA mais puros apresentam valores entre 1,8 – 2,1 (Longeman et al., 1987). Os valores da relação A260/A280 variaram de 1,73 – 1,89 (Tabela 4) indicando que o RNA foi extraído livre de contaminação por proteínas.
Tabela 4. Relações espectrofotométricas de amostras de RNA total extraído de folhas e raízes de duas variedades de arroz submetidas a diferentes concentrações de N-NO3
-.
Variedade Parte da planta N-NO3-
(mM) A260/A230 A260/A280 Quantidade
(µg mL-1)
Piaui
Folha 0 2,32 1,79 24,90 Folha 0,1 2,32 1,82 23,70 Folha 10 2,16 1,77 16,00 Raiz 0 1,90 1,73 14,50 Raiz 0,1 2,13 1,77 20,90 Raiz 10 1,44 1,73 5,60
IAC-47
Folha 0 1,91 1,89 9,80 Folha 0,1 2,19 1,85 23,60 Folha 10 1,93 1,75 15,80 Raiz 0 1,67 1,84 8,40 Raiz 0,1 1,65 1,80 9,70 Raiz 10 1,52 1,78 3,30
48
Figura 9. RNA total extraído de folhas e raízes de duas variedades de arroz (Piauí e IAC-47) submetidas a diferentes concentrações de N-NO3
-: cont – controle (sem N), 0,1 e 10 mM de N-NO3
-.
A relação A260/A230 detecta contaminação com polissacarídeos/polifenóis (Loulakakis
et al., 1996; Shultz et al., 1994), valores superiores a 2,5 são considerados livres de contaminação (Tattersall et al., 2005). As relações A260/A230 obtidas nesse experimento variaram de 1,44 – 2,32 (Tabela 4), no entanto, mesmo as amostras com valores próximos a 1,44 não representaram problema na reação de RT-PCR.
A integridade do RNA total extraído foi verificada em gel de agarose corado com brometo de etídio (Figura 9). Os resultados mostraram a clara presença das bandas ribossomais, sem aparente degradação de RNA, sugerindo que a extração ocorreu relativamente livre de RNases. A qualidade do RNA foi confirmada pela presença no gel das duas bandas de RNA ribossomal (25S e 18S) (Figura 9).
4.3.3 Análise de similaridade genética das seqüências utilizadas na construção dos primers
Os primers usados na análise da expressão dos genes dos transportadores de nitrato de alta e baixa afinidade e da enzima NR-NADH, foram desenhados com base nas seqüências gênicas encontradas nos bancos de dados do NCBI (“National Center for Biotechnology Information, USA) e TIGR Rice Genome Annotation (http://www.tigr.org/tdb/e2k1/osa1/ overview.shtml). Foram comparadas as seqüências gênicas de arroz (Oryza sativa L.) e de Arabidopsis thaliana em função do sequenciamento do genoma dessa espécie. As seqüências obtidas foram alinhadas usando o programa CLUSTAL X (Pérez-Garcia, et al., 1998) e as análises de similaridade com o programa MEGA Versão 2.1 (Kumar et al., 1993).
A análise de similaridade realizada com o programa MEGA possibilitou a separação das seqüências da NR entre espécies. Ocorreu a formação de dois grupos, tanto nas seqüências provenientes de Arabidopsis thaliana quanto de arroz, correspondentes aos genes Nia1 e Nia2 (Figura 10). Em Arabidopsis, existem dois genes que codificam as duas isoformas da NR, Nia1 e Nia2, com seqüências divergentes, no entanto, com estrutura similar (Wilkinson & Crawford, 1993). Estes mesmos estudos demonstraram que as isoformas não contribuem igualmente na atividade da NR em plantas (Wilkinson & Crawford, 1993). Para a
Piauí IAC-47 Folha Raiz Folha Raiz --------------------- -------------------- ----------------- ------------------- cont 0,1 10 cont 0,1 10 cont 0,1 10 cont 0,1 10 25 S
18 S
49
análise da expressão gênica, foi escolhida a seqüência de arroz correspondente ao gene da NR-NADH, por ser a isoforma da NR mais abundante nas células das plantas superiores (Andrews et al., 2004).
Figura 10. Análise de similaridade entre seqüências da NR de Arabidopsis thaliana e arroz
(Oryza sativa L.) utilizando o programa MEGA. Todas as seqüências que possuem sua identificação iniciadas por “at” correspondem a seqüências de Arabidopsis thaliana, as demais são de arroz. A seqüência escolhida para o desenho do primer é marcada com um círculo tracejado e o nome dado ao primer é indicado após o sinal de igual.
atAAN41389 atNP177899 atP11832 atCAA79494 atAAG51627 at1916406A atAAM13997 atCAA31786 atAAN13137 atAAK64018 atCAA31787 atAAF19225 atAAA32830 atNP174901 atP11035 atAAK59616
11972m10342 XP468007 BAD16843
P16081 11978m07637 = NR2
CAA33817 11978m07639 BAD09562 XP482867 BAD09558 XP482863
100
100
46
100
98
100
0.2
OsNia
50
A análise de similaridade das seqüências gênicas de arroz correspondentes aos transportadores de nitrato de alta e baixa afinidade, possibilitou a separação das seqüências em dois grandes grupos, o primeiro compreendendo os transportadores de baixa afinidade (LATS) e o segundo os transportadores de alta afinidade (HATS) (Figura 11). Com base na análise de similaridade foram escolhidas seqüências representativas dos dois grupos para o desenho dos primers utilizados na análise de RT-PCR quantitativa em tempo real.
A inclusão das seqüências dos genes dos transportadores de Arabidopsis thaliana possibilitou uma análise comparativa que consistiu na tentativa de caracterização dos genes de arroz. Essa caracterização teve como base a similaridade genética existente entre as seqüências das duas espécies. Dessa forma, foi possível fazer uma caracterização aproximada das seqüências utilizadas para o desenho dos primers utilizados no estudo de arroz (TN1 – OsNRT1; TN2 – OsNRT1; TN4 – OsNRT1.2; TN5 – OsNRT2.5; TN6 – OsNRT1.1).
51
Figura 11. Análise de similaridade entre seqüências dos transportadores de baixa (NRT1) e
alta (NRT2) afinidade de Arabidopsis thaliana e arroz (Oryza sativa L.), utilizando o programa MEGA. Todas as seqüências que possuem sua identificação iniciadas por “at” correspondem a seqüências de Arabidopsis thaliana, as demais são de arroz. A seqüência escolhida para o desenho do primer é marcada com um círculo tracejado e o nome dado ao primer é indicado após o sinal de igual.
xp4801631 = TN6
11978.m26584 aak154411
11973m5678 atntr11
AT2G26690 11971.m43056 11971.m10048
11972.m08792 = TN1
11974.m08892 atntr12
bad686041 = TN4 11981m05466 = TN2
bad869721 aar017151
aar017231 xp4627201
11971.m09967 atntr27 atnrt27sp2 atnrt27sp1
atntr25 np9171251 = TN5
atntr23 atntr26
bad078531 atntr24 atntr21
atntr2295
100
99
54
99
67
100
84
98
66
100
100
100
100
100
100
55
38
77
100
10080
92
89
47
94
0.2
LATS
HATS
52
4.3.4 Expressão dos genes da nitrato redutase e dos transportadores de nitrato baixa afinidade em arroz
A aplicação de nitrato leva a indução direta na expressão de genes envolvidos na sua rota de redução e assimilação. Esse mecanismo é mostrado pelo rápido aumento na concentração de mRNA de diversos genes envolvidos na rota de assimilação de nitrato e amônio em resposta a tratamentos com baixas concentrações desse elemento. Um dos genes estudados é o da NR, o primeiro gene que mostrou ser induzido por NO3
- (Crawford et al., 1986). O mRNA de NR acumula em plantas dentro de minutos após a aplicação do tratamento com nitrato a concentrações de 10 µM a 50 mM (Aslam et al., 1993; Tischner et al., 1993).
Plantas de arroz foram crescidas em concentrações contrastantes de N-NO3- (0,1 e 10
mM) e uma condição controle (sem N). A expressão relativa dos genes da NR na parte aérea e raízes é mostrada na Figura 12. O padrão de expressão do gene da NR foi completamente diferente nas duas variedades quando submetidas a altas concentrações de N-NO3
-. Enquanto que na parte aérea a variedade Piauí apresentou maior nível de expressão relativa para este gene, nas raízes essa situação se inverte. Em estudo com Arabidopsis, ambos os genes da NR, Nia1 e Nia2, foram induzidos por nitrato tanto nas raízes quanto na parte aérea (Wang et al., 2003). Porém, Cheng et al. (1991) demonstraram em seu estudo com raízes de Arabidopsis, que a indução de Nia1 foi superior quando comparada a Nia2, essa indução diferencial já havia sido descrita previamente.
Por outro lado, a atividade da NR na parte aérea apresentada pela variedade Piauí (Figura 8) não acompanha o nível de expressão relativa desse gene (Figura 12), se mantendo praticamente constante, levando ao acúmulo de NO3
- na parte aérea (Figura 8). Esses dados demonstram que a variedade tradicional (Piauí) parece adotar um sistema de controle diferenciado da atividade da NR, pois mesmo apresentando maior expressão relativa desse gene, mantém a atividade da NR sem sofrer influência do aumento da concentração de N-NO3
- em solução. Estudos realizados em mutantes de Arabidopsis indicam haver uma relação entre a
expressão de uma das isoformas da NR e um transportador de nitrato do sistema de baixa afinidade. As análises realizadas por Loqué et al. (2003) demonstraram que Nia2 desempenha papel predominante na regulação do gene NRT1.
53
Parte Aérea
(mM) N-NO3-
0 0,1 10
N
R2
expr
essã
o re
lativ
a
0
10
20
30
40
50
60
70
Piaui IAC-47 Raízes
0 0,1 10
Figura 12. Efeitos da concentração de nitrato em solução nutritiva na expressão relativa dos
genes da NR-NADH em duas variedades de arroz.
Os genes que codificam os transportadores de nitrato pertencem a duas famílias
gênicas (NRT1 e NRT2). Cada família é representada por múltiplos genes que são diferencialmente regulados e podem codificar transportadores com diferentes propriedades regulatórios e cinéticas (Forde et al., 2000; Orsel et l., 2002; Glass et al., 2000). Em Arabidopsis, a família NRT2 possui sete membros e a NRT1, 52 genes. Pelo menos três tipos principais de regulação foram identificados até o momento: (i) indução por nitrato, (ii) coordenação com a fotossíntese através do estímulo na aquisição de nitrato e no metabolismo de açúcares e (iii) controle do “status” de N na planta por meio de “feedback” exercido por metabólitos provenientes da assimilação de nitrato, como amônio e aminoácidos (Loque et al., 2003). Dessa forma, torna-se importante analisar o perfil de expressão dos transportadores de nitrato por meio de sua indução por concentrações contrastantes (0,1 e 10 mM) de nitrato em solução nutritiva.
O padrão de expressão relativa dos genes dos transportadores de nitrato de baixa afinidade (NRT1) sob a influência de concentrações contrastantes de NO3
- em solução nutritiva é apresentado na Figura 13. Os genes OsNRT1 (TN1), OsNRT1 (TN2), OsNRT1.2 (TN4) e OsNRT1.1 (TN6) apresentaram perfil de expressão relativa similar, houve indução da expressão desses genes na parte aérea da variedade Piauí, não havendo resposta nas raízes com exceção do gene OsNRT1.1 (TN6) que foi induzido também nas raízes dessa variedade.
A indução na expressão relativa dos genes dos transportadores de baixa afinidade foi maior na maior concentração de N-NO3
- (Figura 13), contrastando com resultados apresentados por Loqué et al. (2003), que demonstraram que o aumento da concentração de nitrato em solução nutritiva (0,25; 0,5; 2 e 5 mM) resultou em forte diminuição no acúmulo dos transcritos de NRT1.1 em raízes de plantas normais de Arabidopsis, indicando que altos níveis de nitrato promovem repressão na expressão desse gene.
54
Parte Aérea
TN
1ex
pres
são
rela
tiva
0
1
2
3
4
Piaui IAC-47
Raízes
Parte Aérea
T
N2
expr
essã
o re
lativ
a
0
2
4
6
8
10
12
14
Piaui IAC-47
Raízes
Parte Aérea
T
N4
expr
essã
o re
lativ
a
0
2
4
6
8
10
12
14
16
18
20
22
24
Piaui IAC-47
Raízes
Parte Aérea
mM N-NO3-0 0,1 10
T
N6
expe
ssão
rel
ativ
a
0
1
2
3
4
5
6
7
Piaui IAC-47
Raizes
0 0,1 10
Figura 13. Efeitos da concentração de nitrato em solução nutritiva na expressão relativa dos
genes dos transportadores de baixa afinidade (NRT1) em duas variedades de arroz.
55
Os resultados apresentados aqui reforçam a idéia de que a variedade tradicional possui potencial acumulador de nitrato na parte aérea, pois induz a expressão dos seus transportadores do sistema de baixa afinidade para aproveitar a grande disponibilidade desse nutriente em solução nutritiva, que de fato acumula nos tecidos da parte aérea (Figura 8).
Por outro lado, houve indução na expressão relativa dos genes OsNRT1 (TN2), OsNRT1.2 (TN4) e OsNRT1.1 (TN6) nas raízes da variedade IAC-47 quando esta foi submetida a 0,1 mM de N-NO3
- em solução (Figura 13). Em Arabidopsis, dos 11 genes NRT, apenas quatro mostraram indução significativa nas raízes (NRT1.1; NRT2.1; NRT2.2 e NRT2.4), desses quatro genes, NRT2.1 e NRT2.2 foram os mais induzidos e NRT2.6 não apresentou indução (Wang et al., 2003).
O sistema de transporte de baixa afinidade está envolvido na absorção de NO3- a altas
concentrações externas e estudos em Arabidopsis têm demonstrado que a família dos transportadores do sistema de baixa afinidade (LATS) possuem membros tanto constitutivos como induzidos por nitrato (Huang et al.,1999; Lejay et al., 1999). Estudos confirmaram o envolvimento de dois membros da família NRT1 (NRT1.1 e NRT1.2) na alta capacidade de transporte de nitrato no sistema de baixa afinidade (Tsay et al., 1993; Huang et al., 1996).
4.3.5 Expressão dos genes dos transportadores de alta afinidade em arroz
Estudos no genoma de Arabidopsis demonstraram a presença de sete homólogos do gene NRT2 (Glass et al., 2002) e, em cevada, foi sugerida a existência de 8-10 homólogos desse gene (Trueman et al., 1996). Utilizando RT-PCR e baseando-se no número de ciclos de PCR necessários para amplificar os homólogos do gene NRT2 em Arabidopsis e a quantidade de RNA molde utilizada na reação, Okamoto et al. (2003) concluíram que AtNRT2.1 e AtNRT2.2 foram os genes mais abundantemente expressos em cultivo hidropônico de Arabidopsis. NRT1.1 é induzido por NO3
- (Filleur & Daniel-Vedele, 1999; Lejay et al., 1999; Zhuo et al.,1999), já NRT2.1 não depende de NO3
- para sua expressão (Huang et al., 1999). Estudos posteriores demonstraram que o gene NRT1.1 está envolvido também na absorção de NO3
- no sistema de alta afinidade, tornando-se assim um transportador de dupla afinidade (Wang et al., 1998; Liu et al., 1999). ). Esses dados mostram que NRT2.1 codifica a maioria do mRNA de NRT2 em raízes de Arabidopsis na presença de nitrato, embora a parte aérea mostre um perfil de expressão diferente dependendo da idade da planta e das suas condições de cultivo (Wang et al., 2003).
Quanto ao perfil de expressão relativa do gene dos transportador de alta afinidade (OsNRT2.5 –TN5) em nosso estudo, ocorreu uma indução desse gene na parte aérea da variedade Piaui, não havendo resposta nas raízes de ambas as variedades (Figura 14). Por outro lado, análises de “Northern blot” mostraram que os mRNAs NRT2.1 acumularam principalmente nas raízes de N. plumbaginifolia (Quesada et al., 1997) e Arabidopsis (Zhuo et al., 1999). Nessa última espécie, os genes NRT2.4, NRT2.5 e NRT2.6 são preferencialmente expressos nas raízes, enquanto NRT2.3 foi expresso tanto nas raízes quanto na parte aérea e NRT2.7 apenas na parte aérea (Orsel et al., 2002).
Outros estudos de expressão gênica realizados em cevada (Trueman et al., 1996; Vidmar et al., 2000a), N. plumbaginifolia (Quesada et al., 1997; Krapp et al., 1998), soja (Amarasinghe et al., 1998) e Arabidopsis (Filleur & Daniel-Vedele, 1999; Zhuo et al., 1999) mostraram que o mRNA do gene NRT2 aumentou rapidamente nas raízes dessas plantas após a indução por nitrato, confirmando a raiz como principal local de expressão dos transportadores do sistema de alta afinidade.
56
Parte Aérea
(mM) N-NO3-
0 0,1 10
TN
5ex
pres
são
rela
tiva
0
1
2
3
4
5
6
7
8
Piaui IAC-47
Raízes
0 0,1 10
Figura 14. Efeitos da concentração de nitrato em solução nutritiva na expressão relativa dos genes dos transportadores de alta afinidade (NRT2) em duas variedades de arroz.
4.4 CONCLUSÕES
A variedade tradicional de arroz (Piauí) acumulou mais de nitrato e N-amino livre, e apresentou menor atividade da NR, o que pode ter ocorrido devido ao controle da atividade da enzima pelos aminoácidos, levando ao acúmulo do nitrato. A variedade Piauí parece adotar um controle diferenciado da NR, pois mesmo apresentando maior expressão relativa desse gene, mantém a atividade da enzima sem sofrer influência da concentração de nitrato na solução. Os dados apontam a variedade tradicional como potencial acumuladora de nitrato, pois também induz a expressão dos genes dos transportadores de baixa afinidade (NRT1) para aproveitar a grande disponibilidade desse nutriente em solução. Houve também indução dos transportadores de alta afinidade (NRT2) na parte aérea da variedade tradicional.
57
5 CAPÍTULO III
PROSPECÇÃO E ANÁLISE DE GENES INDUZIDOS POR NITRATO
EM ÁPICES RADICULARES DE ARROZ POR MEIO DE HIBRIDIZAÇÃO SUBTRATIVA SUPRESSIVA – SSH.
58
RESUMO
O uso intensivo de fertilizantes nitrogenados onera o sistema de produção, seja pelo alto custo do N ou pela sua facilidade de lixiviação, tornando necessária a avaliação dos mecanismos responsáveis pela eficiência no uso desse nutriente pelas plantas. Objetivando-se identificar os genes induzidos por nitrogênio, duas variedades de arroz, Piauí (tradicionalmente cultivada no estado do Maranhão e eficiente na aquisição e uso de N) e IAC-47 (uma variedade melhorada), foram utilizadas na construção de bibliotecas de cDNA por meio da técnica de Hibridização Subtrativa Supressiva. As plantas foram cultivadas em solução nutritiva (1,4 mM de N) até os 31 dias após a germinação (DAG), sendo em seguida transferidas para solução sem N por 48h. Depois disso, as plantas foram divididas em três grupos: um grupo de plantas recebeu 0,1 mM e outro grupo 10 mM de N-NO3
- e o outro permaneceu na solução sem N. Seis horas depois os ápices radiculares foram coletados e armazenados em N líquido para posterior extração do RNA total. Foram obtidas quatro bibliotecas subtrativas, duas da variedade Piauí e duas da variedade IAC-47, contendo, cada uma, genes induzidos por baixas (0,1 mM) e altas (10 mM) concentrações de NO3
-. Dentre os clones seqüenciados, destacam-se aqueles que apresentaram homologia com a subunidade E1 do complexo piruvato desidrogenase, enzima chave para a produção de acetil-CoA para o ciclo de Krebs, que pode assim fornecer cetoácidos para a assimilação de N inorgânico. Os resultados obtidos nesse trabalho indicam a necessidade de se melhor compreender a complexidade da interação entre o metabolismo de N e o de carbono. Palavras chave: Hibrid ização subtrativa supressiva. Genes diferencialmente expressos. Expressão Gênica. Arroz.
ABSTRACT
The intensive usage of nitrogen fertilizers makes onerous the production system, so much for the high cost of N as for being easily lost. Thus, it is necessary an evaluation of mechanisms responsible for the nitrogen usage efficiency by plants. With the objective of identifying the genes induced by nitrogen, two rice varieties, Piaui (traditionally cultivated at Maranhão State and efficient in the N acquisition and use) and IAC-47 (an improved variety) were used to construct cDNA libraries by means of Suppression Subtractive Hybridization. Plants were grown in nutrient solution (1.4 mM) until 31 days after germination (DAG), after this, they were transferred to nutrient solution without N by 48h. Them the plants were divided in three groups: one group of plants received 0.1 and the other 10 mM of NO3
--N, and another group remained in the nutrient solution without N. After six hours, the root tips were collected and stored in liquid N for subsequent RNA extraction. Four subtractive libraries were obtained; two of Piaui variety and two of IAC-47 variety, containing, each one, genes induced by low (0.1 mM) and high (10 mM) nitrate concentrations. Among the sequenced clones, stood out those homologues to E1 subunit of pyruvate dehydrogenase complexe. It is a key enzyme for acetyl-CoA production in the Krebs cycle, which supply ketoacids to N inorganic assimilation. The results obtained in this study suggest the need of better understand ing the complexity of N and C metabolism interaction. Key words: Suppression Subtractive Hybridization. Genes expressed differentially. Genic expression. Rice.
59
5.1 INTRODUÇÃO
O uso de fertilizantes nitrogenados vem se tornando cada vez mais intenso buscando o aumento na produtividade de espécies agrícolas. No entanto, essa prática tem representado altos custos no sistema produção, tanto pelo alto custo dos fertilizantes quanto pela facilidade das perdas ocorridas por lixiviação que levam a poluição por nitrato (NO3
-). Esse novo panorama tem levado à seleção de variedades que absorvam e metabolizem o nitrogênio (N) do solo mais eficientemente.
Em experimento comparando duas variedades de arroz, IAC-47 (melhorada) e Piauí (tradicional), quanto a remobilização de N durante o período reprodutivo, observou-se que a variedade tradicional foi mais eficiente na utilização de N acumulado e menos dependente do N proveniente de fontes externas, indicando um processo de adaptação ao fluxo instável de N que ocorre na região do trópico úmido (Souza et al., 1998).
A capacidade de rápido acúmulo de NO3- na fase inicial de crescimento pode propiciar
um maior estoque de N disponível para o metabolismo das plantas nas fases posteriores de seu ciclo de vida, principalmente quando do enchimento dos grãos, e podem ser a razão do alto acúmulo de N nos grãos. A maior eficiência de aquisição de NO3
-, a partir de baixas concentrações na solução externa pode ser uma indicação de adaptação às condições de estresse nutricional (fluxos instáveis de N), como o decorrente da disponibilidade sazonal de NO3
- em regiões tropicais. Tanto as plantas, como outros organismos, desenvolveram mecanismos que os
permitem sentir e responder as mudanças nos níveis de metabólitos de carbono (C) e nitrogênio (N). Esses mecanismos regulam a expressão de genes e atividade de enzimas envolvidas no transporte e metabolismo de C e N, permitindo às plantas otimizar e usar eficientemente seus recursos energéticos (Coruzzi & Zhou, 2001).
O NO3-, principal fonte de N, para a maioria das plantas, não atua apenas com um
nutriente, mas também como um sinal para a iniciação de diversos processos importantes para o metabolismo de C e N das plantas (Crawford, 1995). Deste modo, o NO3
- influencia decisivamente no metabolismo vegetal, levando a uma rápida mudança nos níveis de um amplo espectro de transcritos que codificam enzimas do metabolismo de C e N, permitindo sua reprogramação para facilitar a assimilação de NO3
- e sua incorporação em aminoácidos. Sinais derivados do conteúdo de nitrato interno e externo interagem para modular o crescimento e a arquitetura das raízes e permite o fornecimento eficiente de nutrientes (Stitt, 1999). A indução das enzimas assimiladoras de NO3
-, as quais são arranjadas em um agrupamento de genes, é apenas um dos eventos desencadeados pelo nitrato (Tischner, 2000). A identificação das proteínas e genes que são responsáveis pelo deslocamento de NO3
- dentro da planta é um pré-requisito para o melhor entendimento dos mecanismos que controlam sua absorção, assimilação e distribuição em toda a planta (Orsel et al., 2002a).
O genoma de plantas superiores é composto por milhares de genes que controlam o crescimento, a fisiologia, a reprodução, a interação planta/patógenos, etc. Entretanto, o completo seqüenciamento do genoma do arroz (Yu et al., 2002; Goff et al., 2002) disponibilizou uma enorme quantidade de informação genética dessa espécie. Além disso, técnicas de expressão gênica diferencial têm possibilitado a identificação de genes expressos em determinadas condições, permitindo avaliar os mecanismos moleculares responsáveis por características específicas.
Várias técnicas de análise da expressão gênica têm sido aplicadas a fim de melhor entender estes processos, dentre elas, Hibrid ização Subtrativa Supressiva (“Suppression
60
Subtractive Hybridization – SSH”) (Diatchenko et al., 1996; Gurskaya et al., 1996). A hibridização subtrativa é uma técnica que permite comparar duas populações de mRNA e obter clones de genes que são expressos em uma população e ausentes na outra. Embora existam vários métodos semelhantes, a teoria básica da subtração é simples. Primeiro, ambas as populações de mRNA são convertidas em cDNA: refere-se ao cDNA que contém a cópia específica (expresso diferencialmente), como tester e o cDNA de referênc ia como driver. Os cDNAs tester e driver são hibridizados, e as seqüências que encontram homologia são então removidas por PCR supressivo. Conseqüentemente, as seqüências não hibridizadas de cDNAs representam os genes que são expressos na população tester, mas são ausentes na população driver.
Deste modo, a técnica de SSH foi utilizada objetivando-se identificar os mecanismos moleculares responsáveis pela eficiência no uso de N em duas variedades de arroz, sendo uma tradicionalmente cultivada no estado do Maranhão (Piauí), sabidamente eficiente na aquisição e uso de N, e outra melhorada (IAC-47).
5.2 MATERIAL E MÉTODOS
5.2.1 Crescimento das variedades em câmara de crescimento
Duas variedades de arroz, IAC-47 (melhorada) e Piauí (tradicional) foram cultivadas, em solução nutritiva na câmara de crescimento do Departamento de Solos na Universidade Federal Rural do Rio de Janeiro (UFRuralRJ), objetivando-se construir bibliotecas subtrativas para serem comparadas. As variedades foram submetidas a fotoperíodo de 12h/12h (luz/escuro) com luminosidade de 280 µmol m-2 s-1 (fluxo de fótons fotossintéticos), umidade relativa do ar de 70% e temperatura 28ºC/24ºC (diurna/noturna).
As plantas foram submetidas nos primeiros 31 dias a uma solução basal de crescimento (solução de Hoagland com NO3
-/NH4+ a 1,4 mM). Após, estas permaneceram
durante 48h numa solução sem nitrogênio (solução controle). Depois disso, as plantas foram divididas em três grupos: um grupo recebeu 10 mM de N-NO3
- (grupo A), o outro recebeu 0,1 mM (grupo B) e outro grupo permaneceu em solução sem N (substituído por KCl) (Figura 15).
Para minimizar o efeito do ritmo circadiano e da alternância luz/escuro sobre a expressão dos genes que codificam os transportadores de NO3
- e NH4+, as plantas foram
submetidas ao tratamento com N-NO3- três horas após o início do período de luz (Wang et al.,
2001). Portanto, como o período de luz se iniciou às 5 horas, o fornecimento diferencial de NO3
- ocorreu às 8 horas. Para garantir que os genes de interesse fossem induzidos, a coleta foi realizada seis
horas após a aplicação dos tratamentos, sendo coletados os ápices radiculares e armazenados em nitrogênio líquido para posterior análise. Portanto, a coleta foi realizada às 14 horas.
61
Figura 15. Esquema do experimento em Câmara de Crescimento com variedades de arroz, IAC-47 e Piauí, submetidas a diferentes concentrações de N na forma de nitrato em solução nutritiva.
5.2.2 Avaliação da expressão gênica diferencial
Para a construção das bibliotecas subtrativas foram coletadas amostras de pontas de raízes que foram submetidas à técnica de SSH (Diatchenko et al., 1996; Gurskaya et al., 1996).
(a) Hibridização Subtrativa Supressiva (SSH) As bibliotecas subtrativas foram construídas utilizando-se o kit da Clontech
denominado “PCR SelectTM cDNA subtraction kit” de acordo com as recomendações do fabricante. As análises foram realizadas em parceria com a Embrapa Milho e Sorgo, sediada em Sete Lagoas – MG, em colaboração com o pesquisador Drº Antonio Álvaro Corsetti Purcino.
(b) Extração de RNA total Foi triturado 1,0 grama de ápices de raízes das duas variedades de arroz, em almofariz
com nitrogênio líquido, o macerado foi transferido para tubo de centrífuga tratado com DEPC. Em seguida, foram adicionados 10 mL do tampão de extração (100mM Tris HCl, pH 7,5; 10mM EDTA; 1M NaCl; 0,1% SDS; 1% βMe; 1mM ATA) e 10 mL de fenol. A mistura foi homogeneizada em vortex por 5 minutos, mantendo em gelo, sendo centrifugada a 12.062 x g, por 15 minutos a 4ºC. O sobrenadante foi transferido para outro tubo (tratado com DEPC), o precipitado foi então descartado. Foram adicionados 1,87 µL de cloreto de lítio-DEPC (12M) a cada tubo com o sobrenadante. Após homogeneização, as amostras foram deixadas em gelo por uma noite.
Solução basal Solução sem N
0,1 mM NO3-
10 mM NO3-
31 dias 48h 6h
Piaui
Solução basal Solução sem N
0,1 mM NO3-
10 mM NO3-
31 dias 48h 6h
IAC-47
(A)
(B)
(Controle)
(A)
(B)
(Controle)
62
No dia seguinte, as amostras foram homogeneizadas em vortex por 2 minutos e mantidas em gelo, sendo em seguida centrifugadas a 20.384 x g, por 30 minutos a 4oC. O sobrenadante foi retirado e descartado e o precipitado ressuspenso em 200 µL de H2O-DEPC e transferido para um microtubo estéril, adicionando-se 25 µL de NaCl–DEPC (5 M). Em seguida, foram adicionados 4 volumes (900 µL) de etanol 95% (gelado), deixando-se as amostras em freezer –80ºC por 30 minutos. Passado o tempo no freeze r -80ºC, as amostras foram centrifugadas a 20.384 x g, por 30 minutos à 4oC, retirando-se em seguida o sobrenadante. O precipitado (RNA total) foi ressuspenso em 30 µL de H2O-DEPC. O RNA total extraído foi quantificado espectrofotometricamente em 260-280 nm (5µL do RNA total + 995 µL de tampão TE) assumindo que a D.O.=1 a 260 nm corresponde a 40 µg de RNA mL-1. Para a confirmação dos valores encontrados e verificação da qualidade do RNA, uma alíquota do RNA total foi diluída para 1 µg µL-1, 1 µL deste RNA total foi submetido à eletroforese em gel de agarose (1,5%) com brometo de etídio (1 µg mL-1) a 200 V por cerca de 15 minutos, visualizando sob luz ultravioleta e digitalizado em um sistema processador de imagens.
(c) Isolamento do RNA mensageiro (mRNA) Para o isolamento do mRNA foi utilizado o kit para purificação de mRNA
“NucleoTrap® mRNA mini purification kit” (Clontech, Cat.#K3072-1). Antes de começar o isolamento do mRNA, a água livre de RNAse para o procedimento de eluição e o “NucleoTrap mRNA suspension” foram colocados a 68oC, o restante das soluções usadas na purificação foram colocadas a 37ºC. Foram pipetados 25 µL de cada amostra (em torno de 100 µg de RNA total) e foi adicionado o mesmo volume (25 µL) de tampão 2X RM1. O “NucleoTrap mRNA suspension” foi ressuspendido em vortex e foram adicionado 15 µL da suspensão em cada amostra, misturando-se bem, aquecendo-se em seguida a 68ºC por 5 minutos. Depois do aquecimento, a mistura foi incubada a temperatura ambiente por 10 minutos, invertendo-se o tubo a cada 2 minutos. Em seguida, foi centrifugado a 5.010 x g, por 15 segundos e depois a 14.025 x g, por 5 minutos, descartando-se o sobrenadante e dissolvendo-se o “pellet” em 600 µL de tampão RM2 a 37ºC, transferindo-se em seguida a suspensão para o “nucleoSpin microfilter” e centrifugando-se a 5.010 x g, por 15 segundos. Em seguida, foi realizada uma centrifugação a 14.025 x g, por 2 minutos, descartando-se o sobrenadante. Foram adicionados novamente 600 L de tampão RM2 a 37ºC, centrifugando-se a 14.025 x g, por 5 minutos, descartando-se o sobrenadante. Foram adicionados 500 µL do tampão RM3 a 37ºC ao microfiltro, ressuspendendo-se por pipetagem várias vezes, cuidadosamente para não perfurar a membrana. Depois da ressuspensão, foi realizada uma centrifugação a 14.025 x g, por 2 minutos, descartando-se o sobrenadante. Novamente, o sobrenadante foi descartado e o “pellet” dissolvido em 600 µL de tampão RM2 a 37ºC, transferindo-se a suspensão para o “NucleoSpin microfilter” e centrifugando-se a 5.010 x g, por 15 segundos. Depois, foi centrifugado a 14.025 x g, por 2 minutos e o sobrenadante descartado, transferindo-se a “spin-column” para um microtubo de 1,5 mL novo para solubilizar o RNA, adicionando-se 30 µL de água livre de RNAse (do Kit). O conteúdo do tubo foi re-suspendido completamente, sendo então incubado a 68ºC por 10 minutos. Após, foi realizada uma centrifugação a 14.025 x g, por 2 minutos coletando-se o sobrenadante.
Para verificação da pureza do mRNA, uma alíquota de 5 µL de mRNA foi visualizada em gel de agarose (1%) corado com brometo de etídio (1 µg mL-1) submetido a 180 V por cerca de 15 minutos. O restante do mRNA foi armazenado em freezer -80OC.
63
(d) Identificação dos genes diferencialmente expressos Para identificação dos genes induzidos por N-NO3
- no ápice de raízes de duas variedades de arroz (Piauí e IAC-47), cultivadas sob diferentes níveis de N-NO3
- (0; 0,1 e 10 mM) em solução nutritiva, foi utilizado o processo de Hibrid ização Subtrativa Supressiva (Diatchenko et al., 1996; Gurskaya et al., 1996).
A obtenção das bibliotecas subtraídas que devem conter os genes diferencialmente induzidos pelos tratamentos impostos durante a indução por N-NO3
-, foi utilizado o PCR-Select™ cDNA Subtraction Kit (Clontech Laboratories, Palo Alto, EUA) conforme instruções do fabricante.
A primeira biblioteca subtrativa foi construída considerando-se as plantas submetidas ao tratamento A (10 mM) como tester e as plantas controle (0 mM) como driver. A segunda biblioteca subtrativa foi construída considerando as plantas submetidas ao tratamento B (0,1 mM) como tester e as plantas controle como driver. Para permitir a comparação, essas bibliotecas foram construídas tanto para a variedade IAC-47 quanto para a variedade Piauí, totalizando, portanto, 4 bibliotecas que correspondem aos genes induzidos por altas e baixas concentrações de NO3
-.
• Síntese dos cDNAs tester e driver Para produção das bibliotecas de cDNAs que foram utilizadas nas reações de
subtração, foi utilizado o protocolo descrito para o PCR SelectTM cDNA Subtraction Kit produzido pela Clontech Laboratories INC, EUA. O kit utilizado para a obtenção das bibliotecas subtraídas requer que duas bibliotecas sejam construídas, uma denominada tester e outra denominada driver. As bibliotecas tester foram preparadas a partir das populações de mRNAs obtidos dos ápices das raízes das variedades de arroz submetidas a 0,1 e 10 mM de N-NO3
-. As bibliotecas denominadas driver foram preparadas a partir da população de mRNA oriunda dos ápices de raízes das plantas que foram submetidas ao tratamento controle, isto é, sem a presença de N-NO3
-. Desta forma, foram construídas 4 bibliotecas subtraídas, as quais foram denominadas
de: Piauí 0,1 mM (tester = variedade Piauí submetida a 0,1 mM de N-NO3- e driver =
variedade Piauí submetida à solução controle, sem N-NO3-), Piauí 10 mM (tester = variedade
Piauí submetida a 10 mM de N-NO3- e driver = variedade Piauí submetida à solução controle,
sem N-NO3-), IAC-47 0,1 mM (tester = variedade IAC-47 submetida a 0,1 mM de N-NO3
- e driver = variedade IAC-47 submetida à solução controle, sem N- NO3
-) e IAC-47 10 mM (tester = variedade IAC-47 submetida a 10 mM de N-NO3
- e driver = variedade IAC-47 submetida à solução controle, sem N-NO3
-). Para a síntese da 1ª fita de cDNA foi colocado em um microtubo de 4 µL de mRNA e
1 µL do primer (10 µM) para a síntese de cDNA, incubando-se a 70ºC em termociclador por 2 minutos, resfriando-se em seguida em gelo por mais 2 minutos, centrifugando-se rapidamente. Foram adicionados 2 µL do tampão da 1ª fita (5X), 1µL do mix dNTP (10 mM cada), 1µL de água estéril e 1 µL da enzima AMV transcriptase reversa (20 U µL-1), homogeneizando-se, gentilmente, e incubando por 1h e 30min a 42ºC em termociclador. Logo após, os microtubos foram colocados em gelo para finalização da síntese da 1ª fita de cDNA.
Para a síntese da 2a fita de cDNA, foram adicionados aos microtubos de reação da síntese da 1ª fita dos cDNAs tester e driver, 48,4 µL de água estéril, 16 µL de tampão da 2a fita de cDNA, 1,6 µL do mix dNTP (10 Mm) e 4 µL do coquetel da enzima da 2ª Fita (20x), homogeneizando-se gentilmente e centrifugando-se rapidamente, incubando-se em seguida por 2 h a 16ºC no termociclador. Foram adicionados 6 U de T4 DNA Polimerase, homogeneizando-se bem, incubando-se a seguir por 30 minutos a 16ºC no termociclador.
64
Depois da incubação, foram adicionados 4 µL da mistura EDTA/Glicogênio (20x) para finalizar a síntese da 2ª fita. Para a limpeza dos cDNAs sintetizados, foram adicionados 100 µL de Fenol:Clorofórmio:Álcool Isoamílico (25:24:1), misturando-se bem. Depois, foi centrifugado por 10 minutos a 14.000 rpm à temperatura ambiente. Cuidadosamente, a camada aquosa (superior) foi removida e transferida para outro microtubo estéril, descartando-se a interfase e fase inferior. Foram adicionados 100 µL de Clorofórmio:Álcool Isoamílico (24:1), misturando-se e centrifugando-se por 10 minutos a 14.000 rpm à temperatura ambiente. A camada aquosa foi removida e transferida para um microtubo, descartando-se a interfase e a fase inferior. Foram adicionados 40 µL de acetato de amônio (4M) fornecido juntamente com o kit, e 300 µL de Etanol Gelado (95%). O microtubo foi agitado no vortex rapidamente e centrifugado por 20 minutos a 14.000 rpm à temperatura ambiente. O sobrenadante foi removido cuidadosamente e o precipitado foi ressuspendido em 500 µL de Etanol Gelado (80%) e centrifugado por 10 minutos a 14.000 rpm. O sobrenadante foi removido e o precipitado secado na centrífuga a vácuo por aproximadamente 5 minutos. O precipitado foi ressuspenso em 50 µL de água estéril e armazenado a -20ºC.
Para avaliação do rendimento e tamanho dos cDNAs sintetizados, foram transferidos 6 µL para um microtubo para posterior eletroforese em gel de agarose.
• Digestão dos cDNAs com a enzima de restrição RsaI
Em microtubos estéreis, foram adicionados 43,5 µL do cDNA fita dupla, 5 µl do tampão de RsaI (10x) e 1,5 µL da enzima RsaI (10 U µL-1), misturando-se, centrifugando-se rapidamente e incubando-se por 2 h a 37ºC em banho-maria. Foram separados 5 µL da digestão para analisar sua eficiência em gel de agarose (1%). Foram adicionados 2,5 µL da mistura EDTA/glicogênio para terminar a digestão.
Para recuperação dos cDNAs e limpeza de contaminantes, foram adicionados 50 µL de fenol:clorofórmio:álcool isoamílico (25:24:1) misturando-se rapidamente, centrifugando-se em seguida a 14.025 x g, por 4 minutos à temperatura ambiente, removendo-se cuidadosamente a camada aquosa superior e transferindo-se para um novo microtubo estéril. Foram adicionados 50 µL de clorofórmio:álcool isoamílico (24:1), misturando-se e centrifugando-se por 4 minutos a 14.025 x g. A camada aquosa superior foi removida cuidadosamente e transferida para outro microtubo. Foram adicionados 25 µL de NH4Oac (4M) fornecido juntamente com o kit e 187,5 µL de etanol gelado (95%), misturando-se rapidamente e centrifugando-se por 20 minutos a 14.025 x g, à temperatura ambiente. O sobrenadante foi removido cuidadosamente e desprezado. O precipitado foi ressuspendido em 200 µL de etanol gelado (80%) e centrifugado por 5 minutos a 14.025 x g, removendo-se o sobrenadante e descartando-o. O precipitado foi seco a vácuo em centrífuga por 5 minutos, ressuspendendo-se o precipitado em 5,5 µL de água estéril, e armazenando-se a –20ºC. A avaliação da eficiência da digestão com RsaI foi feita por eletroforese em gel de agarose, comparando-se as amostras dos cDNAs sintetizados, antes e depois da digestão. Os cDNAs digeridos e não digeridos foram visualizados em gel de agarose (1%).
• Ligação dos adaptadores ao cDNA tester digerido com RsaI
A população tester foi subdividida em duas alíquotas, sendo que uma recebeu o adaptador 1 e a outra o adaptador 2R. Os cDNAs driver não foram ligados aos adaptadores. Para a ligação, foi diluído 1 µL de cada cDNA tester digerido com RsaI em 5 µL de água estéril. Um mix de ligação foi preparado combinando-se 3 µL de água estéril, 2 µL de tampão de ligação (5X) e 1 µL de T4 DNA ligase (400 U µL-1). Um microtubo foi identificado para
65
cada cDNA tester, em cada tubo foram combinados os seguintes componentes: 2 µL do cDNA tester diluído, 2 µL de adaptador 1 (10 µM) e 2µL de adaptador 2R (10 µM) e 6 µL do mix em todos os microtubos perfazendo um volume de 10 µL. Após rápida centrifugação a mistura foi incubada em termociclador a 16ºC por uma noite. A reação de ligação foi interrompida adicionando-se 1 µL da mistura EDTA/Glicogênio, sendo em seguida aquecidas por 5 minutos a 72ºC para inativar a DNA ligase.
• Hibridações
Foram realizadas duas hibridizações, a primeira com objetivo de equalizar e enriquecer as seqüências expressas diferencialmente e a segunda hibridização a fim de gerar moldes para amplificação por PCR a partir das seqüências expressas diferencialmente. As reações foram preparadas em microtubos, contendo 1,5 µL de cDNA driver digerido com RsaI, 1,5 µL da população tester ligada ao adaptador, 1,5 µL da população teste ligada ao adaptador 2R e 1 µL do tampão de hibrid ização (4X). Foi realizada uma incubação por 90 segundos a 98ºC em termociclador e após este tempo, as amostras foram incubadas novamente por 8h a 68ºC. Na segunda hibridização, inicialmente, o cDNA driver de todas as amostras foi desnaturado, adicionando-se nos microtubos, 1µL de cada cDNA driver, 1 µL de tampão de hibridização (4X) e 2 µL de água estéril. Em seguida, 1 µL desta mistura foi coberta com óleo mineral e incubada por 90 segundos a 98ºC em termociclador. Os microtubos contendo os cDNAs drivers desnaturado recentemente foram retirados do termociclador. Cada um dos cDNAs drivers foram misturados simultaneamente aos cDNAs tester ligados ao adaptador 1 e 2R. Este passo foi feito rapidamente e os microtubos da primeira hibridização permaneceram no termociclador durante todo tempo. A reação foi incubada por uma noite a 68ºC. Para finalizar a segunda hibridização, foram adicionados 200 µL do tampão de diluição, homogeneizando-se e aquecendo-se por 7 minutos a 68ºC e os produtos obtidos foram armazenados a –20ºC.
• Amplificações por PCR
Foram realizadas duas amplificações por PCR (reação em cadeia da polimerase), a primeira sendo um PCR supressivo com o objetivo de se obter somente as seqüências diferencialmente expressas amplificadas exponencialmente. A segunda amplificação foi realizada com o objetivo de reduzir o “background” e enriquecer ainda mais as seqüências diferencialmente expressas. Na primeira amplificação por PCR, foi preparada uma mistura contendo os seguintes reagentes para cada reação de amplificação: 19,5 µL de água estéril, 2,5 µL de tampão de reação de PCR (10X), 0,5 µL do mix dNTP (10 mM), 1,0 µL de oligonucleotídeo iniciador 1 (10 mM) e 0,5 µL do mix cDNA polimerase Advantage (50X). Foram transferidos 24 µL do mix para cada microtubo e foi adicionado 2 µL de cada um dos cDNAs provenientes da segunda hibridização, em outro microtubo foi preparada a reação de PCR controle, de cDNA subtraído, proveniente do kit. As reações foram inicialmente incubadas em um termociclador por 5 minutos a 75ºC, para estender o adaptador. Imediatamente foram iniciados os 27 ciclos de amplificação, sendo 94ºC por 25 segundos, seguido de 27 ciclos de 94ºC por 10 segundos, 66ºC por 30 segundos e 72ºC por 90 segundos. Antes de iniciar a segunda amplificação com “primers nested” a eficiência da primeira reação de PCR foi avaliada em gel de agarose 2%, corado com brometo de etídio (1 µg mL-1), visualizado sob luz ultravioleta e digitalizado em um sistema processador de imagens.
Para realizar a segunda PCR, cada reação proveniente da primeira PCR foi diluída em 27 µL de água estéril. Após foi preparado um mix do segundo PCR contendo os seguintes reagentes, para cada reação de amplificação: 18,5 µL de água estéril, 2,5 µL de tampão de
66
reação de PCR (10X), 1,0 µL de oligonucleotídeo iniciador 1 “nested” (10 µM), 3,0 µL oligonucleotídeo iniciador 2R “nested” (10 µM), 0,5 µL de mix dNTP (10 µM), 1,0 do mix cDNA polimerase Advantage (50X). Foram transferidos 24 µL do mix para cada microtubo de PCR, adicionando-se em seguida 2 µL do produto da primeira amplificação diluído referente ao cDNA de cada amostra. Foram realizados 18 ciclos de 94ºC por 10 segundos, 66ºC por 30 segundos, 72ºC por 30 segundos. Após os 18 ciclos, as amostras foram incubadas a 72ºC por 7 minutos. Para avaliação e visualização dos produtos gerados, foram aplicados 8 µL de cada reação em gel de agarose 2%, corando-se com brometo de etídio (1 µg mL-1), visualizando-se sob luz ultravioleta e digitalizando-se em um sistema processador de imagens (Eagle Eye-Stratagene). O restante da segunda reação de PCR foi armazenado a –20ºC.
• Clonagem dos produtos da segunda amplificação por PCR
Os produtos da segunda amplificação por PCR, obtidos das reações de subtração direta, foram clonados no vetor TOPO TA pCR4, utilizando-se o Kit TOPO TA Cloning for Sequencing (Invitrogen, Cat. 45-0030). Primeiramente, foi preparada a reação de ligação: 2 µL de água estéril, 1 µL de solução salina, 2 µL do produto do segundo PCR, 1 µL do vetor Topo TA. A reação de ligação foi incubada por 10 minutos à temperatura ambiente e, após este tempo, as amostras foram colocadas no gelo. Para a transformação, células competentes fornecidas juntamente com o kit foram descongeladas em gelo por 15 minutos transferindo-se em seguida 2 µL da ligação para o tubo contendo as células competentes sem homogeneizar. O restante da ligação foi armazenado a –20ºC. A reação de ligação foi incubada por 30 minutos no gelo, após este tempo, os tubos foram colocados por 30 segundos a 42ºC em banho-maria e imediatamente colocados no gelo por 2 minutos. Foram adicionados 250 µL de meio SOC proveniente do Kit, agitando-se em incubadora-shaker por 1 hora a 200 rpm a 37ºC. Foram plaqueados 100 e 150 µL de cada ligação em placas de Petri contendo meio LB sólido com 10 ng µL-1 de ampicilina, incubando-se as placas por uma noite a 37ºC.
• Preparação dos plasmídeos
As colônias que cresceram no meio LB sólido com antibiótico (ampicilina) teoricamente receberam o inserto, isto é, estavam transformadas. As colônias foram inoculadas em microplacas de 96 “well” para preparação do plasmídio. Para tal, foi adicionado 1 mL de meio Circle Grow (fabricante) contendo 100 µL de ampicilina (100 mg mL-1) em cada poço das microplacas. As colônias isoladas foram inoculadas com auxílio de palitos de dente esterilizados e as placas foram seladas com adesivo. Foram feitos nos adesivos, dois furos pequenos por poço, com auxílio de uma agulha aquecida no fogo, para permitir a aeração. As placas foram agitadas em incubadora-shaker por 23 horas a 220 rpm a 37ºC. A cultura permanente foi preparada em placas estéreis, contendo 100 µL do plasmídeo, 100 µL de glicerol 20 % estéril estocando-se em freezer a – 80ºC. As placas foram identificadas com o nome do experimento, data e número dos clones.
Para a extração dos plasmídeos, as placas com as bactérias crescidas foram centrifugadas por 4 minutos a 5.008 x g, para sedimentar as células. O adesivo foi removido, do sobrenadante descartado e as placas invertidas sobre papel absorvente por 4 minutos. Foram adicionados 200 µL de GET (1 % de Glicose; 0,01M EDTA; 0,026 M Tris-HCl pH 7,4) em cada poço e as células foram ressuspendidas manualmente por 2 minutos, sendo em seguida centrifugadas por 4 minutos a 5.008 x g, para sedimentar as células. O adesivo foi retirado, o sobrenadante descartado e as placas foram invertidas sobre papel absorvente por 4 minutos. Foi preparada uma solução contendo 20 mL de GET e 600 µL de RNase (10 mg mL-
1). Foram adicionados 80 µL desta solução GET/RNase em cada poço, selando-se a placa com
67
adesivo e agitando-se manualmente por 2 minutos para ressuspender as células. Foram transferidos 60 µL da suspensão de células para uma nova microplaca polipropileno de fundo redondo (tipo placa Elisa). Foram adicionados 80 µL de NaOH 0,2 N / SDS 1 % a cada poço, selando-se e homogeneizando-se por inversão cada placa 30 vezes, as quais foram incubadas por 10 minutos à temperatura ambiente, centrifugando-se rapidamente para retirar toda a solução do adesivo. Em seguida, foram adicionados 80 µL de Acetato de Potássio (3 M) a cada poço. As placas foram seladas e homogeneizadas 30 vezes por inversão, sendo incubadas em seguida por 10 minutos à temperatura ambiente e centrifugadas rapidamente. O adesivo foi removido e as placas incubadas abertas, em estufa a 90ºC por 30 minutos. Após a incubação em estufa, as placas foram seladas novamente e colocadas em gelo por 10 minutos. Após a incubação em gelo, as placas foram centrifugadas por 9 minutos a 5.008 x g. Todo o volume do sobrenadante foi transferido para uma placa de Millipore (MAGV N22) fixada sobre uma microplaca de fundo “U” de 250 µL de polipropileno, centrifugando-se a placa aberta, por 4 minutos a 5.008 x g. A placa Millipore foi removida e 100 µL de isopropanol foi adicionado ao filtrado que ficou na microplaca de fundo “U”, em seguida, a placa foi selada com adesivo e centrifugada por 45 minutos a 5.008 x g. O sobrenadante foi descartado sendo adicionados em seguida 100 µL de etanol (70%) gelado, centrifugando-se em seguida por 5 minutos a 5.008 x g. O sobrenadante foi removido e as placas centrifugadas invertidas sobre papel absorvente rapidamente. As placas foram deixadas à temperatura ambiente por 60 minutos para secagem, cobertas com papel toalha. O DNA plasmidial foi ressuspendido em 30 µL de água MilliQ, as placas foram seladas, misturadas e armazenadas em freezer -20ºC.
• Reação de seqüenciamento dos clones
As seqüências de DNA foram determinadas pelo método de terminação de cadeia por dideoxinucleotídeos (Sanger, 1977). O seqüenciamento foi realizado no seqüenciador automático ABI 3.100 Genetic Analyser (Applied Biosystems) pela Dra Eliane Aparecida Gomes (CNPMS-Sete Lagoas, MG).
Cada reação de seqüenciamento foi composta por 2 µL do Mix Big Dye Terminator, 1 µL de Primer M13 (Forward) (3,5 µM), 2 µL de Tampão Save Money, 2 µL (~200 ng) de cada DNA e 3 µL de água milliQ estéril. A reação de seqüenciamento foi colocada em termociclador, programado para 30 ciclos a 96ºC por 20 segundos, 50ºC por 15 segundos, 60ºC por 4 minutos. Para a precipitação da reação de seqüenciamento, foram adicionados 40 µL de isopropanol 75% (Sigma) para cada pocinho, selando a placa com adesivo resistente a álcool, misturando-se 30 vezes por inversão, deixando-se em seguida a temperatura ambiente por 15 minutos. Depois, a mistura foi centrifugada a 5.008 x g, por 45 minutos, o adesivo foi retirado e o sobrenadante descartado. Em seguida, foram adicionados 100 µL de etanol 70% (Sigma), centrifugando-se em seguida a 5.008 x g, por 10 minutos, descartando-se o sobrenadante. A placa foi então centrifugada invertida a 760 x g, por 10 segundos e incubada por 10 minutos no escuro. O precipitado foi ressuspenso em 10 µL de formamida Hi-Di e desnaturado a 95ºC por 5 minutos, incubando-se em gelo antes de injetar as amostras no seqüenciador.
• Análise dos clones
Após a retirada do vetor, as seqüências dos clones obtidas foram utilizadas na busca por similaridade em bancos de dados, para tal, foram utilizados os programas blastN e blastX (Altschul et al., 1997) no site do NCBI (National Center for Biotechnology Information, USA) e WU-BLAST versão 2.0 (Altschul et al., 1990) no site do TIGR (The Institute for Genomic Research - http://tigrblast.tigr.org/euk-blast/index.cgi?project=osa1).
68
5.3 RESULTADOS E DISCUSSÃO
Para identificar genes induzidos por alta (10 mM) e baixa (0,1 mM) concentração de nitrato em ápices radiculares de duas variedades de arroz, sendo uma tradicional (Piauí) e outra melhorada (IAC-47), foram construídas quatro bibliotecas subtrativas utilizando a técnica de Hibridização Subtrativa Supressiva - SSH. Um total de 365 clones foram obtidos, sendo 156 da biblioteca denominada Piauí 0,1 mM; 56 da Piauí 10 mM; 57 da Piauí IAC-47 0,1 mM e 56 da IAC-47 10 mM. Os clones mais importantes foram selecionados e são apresentados na Tabela 5 e Figura 16. A similaridade entre as seqüências obtidas a partir dos clones das bibliotecas estudadas e aquelas encontradas nos bancos de dados foi considerada significativa quando o E-value foi menor que 10-5. A Tabela 5 apresenta os principais parâmetros utilizados na busca de similaridade (E-value e Identidade) e a Figura 16 apresenta o alinhamento da seqüência pesquisada com o melhor alinhamento no banco de dados.
5.3.1 Genes induzidos por nitrato
Foi identificado na biblioteca Piauí 0,1 mM, três clones com seqüências similares as que codificam para proteína da subunidade ribossomal 60S. As proteínas ribossomais são primordiais para a montagem do ribossomo e consequentemente para a síntese de proteínas. Resultado similar também foi encontrado em tomate (Wang et al., 2001) e arroz, indicando que a síntese de proteínas foi rapidamente aumentada nas raízes em resposta ao fornecimento de nitrato (Wang et al., 2002).
Tabela 5. Clones representativos da biblioteca de cDNA de duas variedades de arroz submetidas a duas concentrações de N-NO3
-.
Similaridade no banco de dados E-value Identidade da seqüência Proteína ribossomal 60S Alfa actina Miosina Tropomiosina I Creatina cinase Hormônio da tireóide humana Basigin Humanin Glioxalase I Fosfofrutoquinase Subunidade E1 da Piruvato desidrogenase
2e-85 3e-08 1e-146 5e-78 1e-118 8e-49 3e-69 1e-102 1e-105 1e-123 1e-147
260/290 (86%) 136/139 (97%) 313/329 (95%) 155/157 (98%) 221/222 (99%) 126/133 (94%) 135/135 (100%) 191/191 (100%) 196/196 (100%) 232/234 (99%) 267/267 (100%)
Proteína ribossomal 60S Query: 99 tgctntgacagataacgctttgattgctcgatctcttggtaantacngtatcntctgcat 158 |||| ||||||||||||||||||||||||||||||||||||| ||| | ||| ||||||| Sbjct: 522 tgctttgacagataacgctttgattgctcgatctcttggtaaatacggcatcatctgcat 581
69
Query: 159 ggangattngnttcatgagatctatactgtnggaaaacgcttcatagaggcaaataacnt 218 ||| |||| | ||||||||||||||||||| ||||||||||||| ||||||||||||| | Sbjct: 582 ggaggatttgattcatgagatctatactgttggaaaacgcttcaaagaggcaaataactt 641 Query: 219 cctgtggnccttcnaattgtcttctccacgangtgtnntgaanaanaanaccacccatnt 278 ||||||| ||||| ||||||||||||||||| ||| |||| || || ||||||||| | Sbjct: 642 cctgtggcccttcaaattgtcttctccacgaggtggaatgaagaaaaagaccacccattt 701 Query: 279 tgtaganggtggncatgctggngacagggcaggancanatccacaggcttattataagaa 338 |||||| ||||| ||||||| |||||| |||| || ||| |||||||||||| ||||| Sbjct: 702 tgtagaaggtggagatgctggcaacaggg-aggaccagatcaacaggcttattagaagaa 760 Query: 339 ngaactaaggtgccaaccatgatnatttttctaagctgnntggtgnaataaacagtacc 397 ||||||||||| | |||||||| |||||||||||||| |||| ||||||||||||| Sbjct: 761 tgaactaaggtgtctaccatgattatttttctaagctggttggt-taataaacagtacc 818
Alfa actina Query: 33 ctgccctnagacgcncttccagcccnccttctatcattatggagtcgtgtagggcattca 92 |||||| |||||| |||||||||| ||||| ||| ||||||||| | ||||||||| Sbjct: 877 ctgcccggagacgctcttccagccctccttc-atcggtatggagtc--ggcgggcattca 933 Query: 93 cgagaccacctatna-agcatcatgaanggtgacatcgacatca 135 |||||||||||| | ||||||||||| ||||||||||||||| Sbjct: 934 cgagaccacctacaacagcatcatgaagtgtgacatcgacatca 977 Miosina Query: 20 ggtacagccccaccacagtctcattcagggggtccttgttcttgtcaagccagccggcaa 79 |||||||||||||||||||||||||||||||||||||||| ||||| ||||||||||| | Sbjct: 1948 ggtacagccccaccacagtctcattcagggggtccttgtttttgtccagccagccggcga 1889 Query: 80 tgttgtagtccacggtgccagcatagtgaatcaaagagaagtgggcctcaggcttgcctt 139 ||||||||||||||||||| |||||||| | || |||||||| |||||||||||||||| Sbjct: 1888 tgttgtagtccacggtgccggcatagtgcaccagtgagaagtgagcctcaggcttgcctt 1829 Query: 140 tggcaggcttgggcttctggaagttattggattttccaagatgttgttcatacagcttgt 199 ||||||||||||||||||||||||| |||||||||||||||||||||||||||||||||| Sbjct: 1828 tggcaggcttgggcttctggaagttgttggattttccaagatgttgttcatacagcttgt 1769 Query: 200 tcttgaaggaggtgtctgtcgccttggggaacatgcactcctcttccaggatggagaaga 259 ||||||||||||||||||| |||||||||||||||||||||||||| ||||||||||||| Sbjct: 1768 tcttgaaggaggtgtctgttgccttggggaacatgcactcctcttctaggatggagaaga 1709 Query: 260 tgcccataggcttctcgatgagctcgatgcaggcagccaggtccatcccaaagtcaatga 319 ||||||||||||||||||||||||||||||||||||||||||||||||| |||||||||| Sbjct: 1708 tgcccataggcttctcgatgagctcgatgcaggcagccaggtccatcccgaagtcaatga 1649 Query: 320 acgtccactcaatgccttccttcttgtac 348 || |||||| |||||||||||||||||| Sbjct: 1648 actcccactcgatgccttccttcttgtac 1620
70
Tropomiosina I Query: 21 gtacaatagaaagcacagtgtgtgcctggctctaaggcaggatgctaagagagagaacca 80 |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| Sbjct: 1195 gtacaatagaaagcacagtgtgtgcctggctctaaggcaggatgctaagagagagaacca 1136 Query: 81 gggtcagctggagaatanacaaatgcagagctcagagaggtgggacatccagctcgacga 140 ||||||||||||||||| |||||||||||||||||||||||||||||||||||||||||| Sbjct: 1135 gggtcagctggagaatagacaaatgcagagctcagagaggtgggacatccagctcgacga 1076 Query: 141 gggagtcttgggagaagtgcagcaaagaaacttatat 177 ||||||||||||||||||| ||||||||||||||||| Sbjct: 1075 gggagtcttgggagaagtgaagcaaagaaacttatat 1039
Creatina cinase Query: 19 gtacccctcttctgcagactcaggcgggtgaggatctcctcgaacttggggtgcttgctc 78 ||||||||||||||||||| |||||||||||||||||||||||||||||||||||||||| Sbjct: 965 gtacccctcttctgcagacgcaggcgggtgaggatctcctcgaacttggggtgcttgctc 906 Query: 79 aggtgcgccagcttcacatgcacgcctccacgcagcccagtgcccaggttggatgggcag 138 |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| Sbjct: 905 aggtgcgccagcttcacatgcacgcctccacgcagcccagtgcccaggttggatgggcag 846 Query: 139 gtgagcacgtagcccaggtgctggttccacatgaaggggtggccagctttcttaaagatc 198 |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| Sbjct: 845 gtgagcacgtagcccaggtgctggttccacatgaaggggtggccagctttcttaaagatc 786 Query: 199 tcctcaatcttctgcagccctacgcagaagcggcggaaaacc 240 |||||||||||||||||||||||||||||||||||||||||| Sbjct: 785 tcctcaatcttctgcagccctacgcagaagcggcggaaaacc 744
Hormônio da tireóide humana Query: 66 gcctttttaaagcattagatggctaattgaagtattttatgactcctcattcctggccca 125 ||||||||||||||||| |||||||||||||||||||||||||||||||||||||||||| Sbjct: 4588 gcctttttaaagcatta-atggctaattgaagtattttatgactcctcattcctggccca 4646 Query: 126 gagggtcgntctttgaaaccctgtttctaacccttgtgnngtgtgtttctgtctgangac 185 |||||| | ||||||||||||||||||||||||||||| |||||||||||||||| ||| Sbjct: 4647 gagggttg-tctttgaaaccctgtttctaacccttgtgttgtgtgtttctgtctgaggac 4705 Query: 186 agtgngtgtgtac 198 |||| |||||||| Sbjct: 4706 agtgggtgtgtac 4718
Basigin Query: 20 ggtactggccggggtcggcctccatgttcaggttctcaatgtgtagctctgaccggccct 79 |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| Sbjct: 594 ggtactggccggggtcggcctccatgttcaggttctcaatgtgtagctctgaccggccct 535
71
Query: 80 gcgaggaactcacgaagaacctgctctcggagccgttcatgagggccttgtcctcagagt 139 |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| Sbjct: 534 gcgaggaactcacgaagaacctgctctcggagccgttcatgagggccttgtcctcagagt 475 Query: 140 cagtgatcttgtacc 154 ||||||||||||||| Sbjct: 474 cagtgatcttgtacc 460
Humanin Query: 20 ggtaccctaaccgtgcaaaggtagcataatcacttgttccttaattagggacctgtatga 79 |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| Sbjct: 891 ggtaccctaaccgtgcaaaggtagcataatcacttgttccttaattagggacctgtatga 950 Query: 80 atggctccacgagggttcagctgtctcttacttttaaccagtgaaattgacctgcccgtg 139 |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| Sbjct: 951 atggctccacgagggttcagctgtctcttacttttaaccagtgaaattgacctgcccgtg 1010 Query: 140 aagaggcgggcataacacagcaagacgagaagaccctatggagctttaatttattaatgc 199 |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| Sbjct: 1011 aagaggcgggcataacacagcaagacgagaagaccctatggagctttaatttattaatgc 1070 Query: 200 aaacagtacct 210 ||||||||||| Sbjct: 1071 aaacagtacct 1081 Glioxalase I Query: 18 aggtactacaactttgaggcacaatctaaatactaaaaatgattatgaaatcttgagttg 77 |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| Sbjct: 1447 aggtactacaactttgaggcacaatctaaatactaaaaatgattatgaaatcttgagttg 1388 Query: 78 agctgattgatgccctcttaaatccattaataatccatgaaagtgatttcacatgcctag 137 |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| Sbjct: 1387 agctgattgatgccctcttaaatccattaataatccatgaaagtgatttcacatgcctag 1328 Query: 138 cctgctttctttctcacatgacagctgggagtattaaatgagataaagttgcagcctagc 197 |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| Sbjct: 1327 cctgctttctttctcacatgacagctgggagtattaaatgagataaagttgcagcctagc 1268 Query: 198 ccagtgtctgggtacc 213 |||||||||||||||| Sbjct: 1267 ccagtgtctgggtacc 1252
Fosfofrutoquinase Query: 23 ccgtttgaatgttgacgggatgaacataataagcaatgacggcagcaataaactcaacag 82 |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| Sbjct: 669 ccgtttgaatgttgacgggatgaacataataagcaatgacggcagcaataaactcaacag 610 Query: 83 gagcaggaaagcgagggtatcctacaaagtccagcgtaccataaacgcaagcctcaacgc 142 |||||||||||||||||||||| ||||||||||||||||||||||||||||||||||||| Sbjct: 609 gagcaggaaagcgagggtatcccacaaagtccagcgtaccataaacgcaagcctcaacgc 550
72
Query: 143 agcgacgagcacgagagcggtcagtagcaatccaaactttgttactcgtcagaaaatcga 202 |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| Sbjct: 549 agcgacgagcacgagagcggtcagtagcaatccaaactttgttactcgtcagaaaatcga 490 Query: 203 aatcatcttcggttaaatccaaagcggcagaagcctgaatgagcttaatagagg 256 ||||||||||||||||||||||| |||||||||||||||||||||||||||||| Sbjct: 489 aatcatcttcggttaaatccaaaacggcagaagcctgaatgagcttaatagagg 436
Subunidade E1 da Piruvato desidrogenase Query: 21 gtcgtgcctcctgggttgtgaggagtcgccgctgccgccactgcctgtgcttcatgagga 80 |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| Sbjct: 53 gtcgtgcctcctgggttgtgaggagtcgccgctgccgccactgcctgtgcttcatgagga 112 Query: 81 agatgctcgccgccgtctcccgcgtgctgtctggcgcttctcagaagccggcaagcagag 140 |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| Sbjct: 113 agatgctcgccgccgtctcccgcgtgctgtctggcgcttctcagaagccggcaagcagag 172 Query: 141 tgctggtagcatcccgtaattttgcaaatgatgctacatttgaaattaagaaatgtgacc 200 |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| Sbjct: 173 tgctggtagcatcccgtaattttgcaaatgatgctacatttgaaattaagaaatgtgacc 232 Query: 201 ttcaccggctggaagaaggccctcctgtcacaacagtgctcaccagggaggatgggctca 260 |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| Sbjct: 233 ttcaccggctggaagaaggccctcctgtcacaacagtgctcaccagggaggatgggctca 292 Query: 261 aatactacaggatgatgcagactgtac 287 ||||||||||||||||||||||||||| Sbjct: 293 aatactacaggatgatgcagactgtac 319 Figura 16. Alinhamento dos clones representativos da biblioteca de cDNA de duas
variedades de arroz submetidas a duas concentrações de N-NO3-. Foi utilizado o
programa BLASTN 2.2.8 no site do NCBI (“Query” identifica a seqüência utilizada para a busca de similaridade no banco de dados e “Sbjct” identifica a seqüência do banco de dados que apresentou o melhor alinhamento com a seqüência utilizada na busca).
O gene que codifica a alfa actina foi identificado em todas as bibliotecas, com exceção
da IAC-47 10 mM. A actina faz parte de 10 a 20% da proteína celular e desempenha papel vital na integridade e estrutura da célula. Desempenhando basicamente as mesmas funções, os genes da miosina e da tropomiosina I também foram identificados na biblioteca Piauí 0,1 mM.
Foram ident ificados na biblioteca IAC-47 0,1 mM três clones similares a creatina cinase, enzima envolvida na manutenção dos níveis de ATP intracelulares.
Interessantemente, foram encontrados 32 clones similares ao hormônio da tireóide humana, distribuídos nas bibliotecas IAC-47 0,1 mM, Piauí 0,1 mM e Piauí 10 mM. Da mesma forma, outro gene expresso em humanos, “basigin”, foi identificado na biblioteca IAC-47 10 mM e Piauí 0,1 mM. “Basigin” é um membro da superfamília das imunoglobulinas, envolvido em vários fenômenos imunológicos, de diferenciação e desenvolvimento, atuando no reconhecimento intercelular. Na biblioteca Piauí 0,1 mM, foram identificados cinco clones similares ao gene conhecido como “Humanin” (HN), que codifica
73
um pequeno polipeptídio que previne a morte de células neuronais ajudando na prevenção da doença de Alzheimer, também em humanos.
Nesta mesma biblioteca, foi identificado um clone similar ao gene da glioxalase I (GLO1). Glioxalase I catalisa a condensação do metilglioxal e glutationa reduzida para formar S-lactoil-glutationa que é convertida pela Glioxalase II para D-ácido lático e glutationa reduzida. A glutationa é uma substância bastante importante para algumas plantas resistirem a ambientes contaminados por metais pesados, atuando também num sistema de captura de moléculas de herbicidas.
O gene da enzima fosfofrutoquinase foi identificado na biblioteca Piauí 0,1 mM. Esta enzima catalisa a conversão irreversível da frutose 6-fosfato a frutose 1,6-bisfosfato. Também nesta biblioteca, foram encontrados sete clones similares a subunidade E1 (piruvato descarboxilase) do complexo piruvato desidrogenase, enzima chave para a produção de acetil-CoA para o ciclo de Krebs.
5.3.2 Interação entre o metabolismo de carbono (C) e nitrogênio (N)
O nitrato regula uma grande quantidade de genes envolvidos no metabolismo de nitrogênio, incluindo genes do sistema de transporte de nitrato (NRT1 e NRT2), nitrato redutase (Nia), nitrito redutase (Nii) e as enzimas que atuam na incorporação de amônio a aminoácidos, tais como glutamina sintetase (GS) e glutamato sintase (GOGAT) (Crawford & Glass, 1998; Stitt, 1999). Muitos genes envolvidos no metabolismo dos ácidos orgânicos também sofrem alterações em seu nível transcripcional em resposta ao fornecimento de nitrato (Stitt, 1999). Análises genômicas têm identificado outros genes induzidos por nitrato, tais como canais de entrada de água, transportadores de fósforo e potássio em raízes, genes de resposta a estresse, proteínas ribossomais (Wang et al., 2001), transportadores de nit rato do sistema de baixa afinidade (OsNRT1), nitrito redutase (OsNiR), transportadores de açúcar (SUT), piruvatoquinase (PK) e fosfoenolpiruvato carboxilase (PEPC) (Wang et al., 2002).
Os dois principais pontos de controle no metabolismo de C e N são a NR, que controla o fluxo de entrada de N no processo de assimilação, e a PEPC, que regula a produção de ácidos orgânicos (Foyer et al., 2003). A assimilação de nitrato está intimamente relacionada com mudanças no metabolismo de carbono e o fato de encontrarmos clones similares a enzima piruvato descarboxilase reforça essa idéia.
Resultados obtidos em outros estudos apontam também para a existência de interação entre o metabolismo de N e C. Segundo Stitt et al. (2002), o metabolismo de ácidos orgânicos possui duas funções distintas durante a assimilação de nitrato. (i) PEPC opera em conjunto com a malato desidrogenase para fornecer malato que é exportado para as raízes onde é descarboxilado. (ii) PEPC opera em conjunto com a piruvato quinase, a citrato sintase mitocondrial, a piruvato desidrogenase e a isocitrato desidrogenase citossólica para fornecer alfa-cetoglutarato (2-oxoglutarato), que é o aceptor primário para o amônio.
5.3.3 Categorização dos clones
As análises dos dados obtidos a partir do seqüenciamento dos clones das bibliotecas de cDNA consistiu no agrupamento dos clones de acordo com sua função no metabolismo (Figura 17).
Dos 156 clones seqüenciados da biblioteca denominada Piauí 0,1 mM, 10,2% corresponderam a seqüências com função desconhecida; 10,3% a genes relacionados à estrutura celular; 1,3% estão relacionados a mecanismos de defesa; 1,3% ao metabolismo de
74
aminoácidos; 5,8% ao metabolismo de carboidratos, 1,3% ao metabolismo de lipídeos; 9,6% ao processamento da informação gênica; 5,8% relacionadas a mecanismos de regulação e 5,1% a mecanismos de transporte. Cinco por cento das seqüências não mostraram homologia com nenhuma seqüência depositada no GenBank.
Na biblioteca denominada Piauí 10 mM, foram analisados 56 clones, dos quais 18,3%
corresponderam a seqüências com função desconhecida; 1,8% a genes relacionados ao metabolismo de aminoácidos; 3,6% relacionados a estrutura celular; 3,6% com função relacionada ao processamento da informação genética; 43,6% das seqüências relacionadas a mecanismos de regulação e 1,8% das seqüências não tiveram homologia com nenhuma seqüência depositada no banco de dados até o momento da busca por similaridade.
Foram seqüenciados 57 clones da biblioteca denominada IAC-47 0,1 mM, 3,5% destes
clones corresponderam a seqüências com função desconhecida; 10,5% estão relacionados a estrutura celular; 10,5% ao metabolismo de aminoácidos; 14% possuem função relacionada ao processamento de informações ambientais; 1,8% relacionados a regulação e 15,8% das seqüências não tiveram homologia com nenhuma seqüência depositada no GenBank.
Dos 56 clones seqüenciados da biblioteca denominada IAC-47 10 mM, 7,1% são
correspondentes a seqüências com função desconhecida; 28,6% estão relacionados ao processamento de informações ambientais; 5,4% ao metabolismo de aminoácidos; 12,5% com função relacionada à estrutura celular; 1,8% ao metabolismo de lipídeos e 1,8% das seqüências não possuem homologia com nenhuma seqüência depositada no banco de dados.
75
Piaui 0,1 mM
Func. DesconhecidaEst. CelularMec. DefesaMet. AminoácidosMet. CarboidratosMet. LipídeosProc. Informação GênicaMec. RegulaçãoMec. TransporteSem homologiaProc. Informações Ambientais
Piaui 10 mM
IAC-47 0,1 mM
IAC-47 10 mM
Figura 17. Categorização dos clones seqüenciados em cada biblioteca.
76
Foi encontrada uma grande proporção (24,4%) de clones sem homologia com nenhuma seqüência depositada no banco de dados. Da mesma forma, Foucart et al. (2006) encontraram em seus estudos grande proporção de clones sem homologia (31,2% dos clones seqüenciados) com seqüências do banco de dados. Estes autores justificaram esse resultado devido ao pequeno tamanho médio dos fragmentos obtidos no seqüenciamento, além da grande proporção de fragmentos correspondentes a região 3’ não transcrita (UTR), que geralmente é a região menos conservada nos genes, reduzindo a probabilidade de detecção de homologia durante a busca por similaridade. No entanto, Foucart et al. (2006) alertaram para a possibilidade de algumas dessas seqüências corresponderem a genes ainda não identificados, porque a técnica de SSH, é reconhecidamente capaz de identificar novos genes a partir de bibliotecas de cDNA, devido à sua capacidade de enriquecimento de transcritos raros (Diatchenko et al., 1996; Vilaine et al., 2003).
Assim, no presente estudo, os clones que possuem seqüência desconhecida e aqueles que não apresentaram homologia com nenhuma seqüência depositada no banco de dados, representam uma fonte valiosa de informação genética, pois podem representar novos genes que atuariam conferindo maior eficiência no uso de N pela variedade tradicional (Piauí). Estas seqüências precisam ser mais bem estudadas a fim de chegar a este tipo de resultado.
5.4 CONCLUSÕES
Dentre os clones seqüenciados da biblioteca Piauí 0,1 mM, destacam-se aqueles que apresentaram homologia com a subunidade E1 (piruvato descarboxilase) do complexo piruvato desidrogenase, enzima chave para a produção de acetil-CoA para o ciclo de Krebs, que pode assim fornecer cetoácidos para a assimilação de N inorgânico. Nesta mesma biblioteca, foram encontrados clones homólogos à enzima fosfofrutoquinase que catalisa a conversão irreversível de frutose 6-fosfato em frutose 1,6-bisfosfato e também clones que possuem homologia com a proteína SEC 14, codificada por um gene pertencente a uma família de fatores citossólicos relacionados ao sistema de transporte intracelular.
Nas bibliotecas IAC-47 0,1 mM; Piauí 0,1 mM e 10 mM, foram encontrados clones com seqüências homólogas ao gene do hormônio da tireóide humano. Até onde se sabe, esta é a primeira vez que a seqüência correspondente ao gene que codifica este hormônio foi encontrada em plantas. Nestas mesmas bibliotecas também foram encontradas seqüências correspondentes aos clones que fazem parte do projeto de mapeamento do genoma de arroz (Seqüências depositadas no GenBank). Estes clones ainda não possuem função conhecida.
Nas bibliotecas IAC-47 0,1 mM e 10 MM e na biblioteca Piauí 10 mM, também foram encontradas seqüências correspondentes aos clones pertencentes ao projeto de mapeamento do genoma de milho, realizado pela empresa DuPont. Estes clones também não possuem função conhecida.
Os resultados indicam a necessidade de se melhor compreender a complexidade da interação entre o metabolismo de N e de carbono sugerindo também que controles ainda desconhecidos estão implicados na regulação da rota de assimilação de nitrogênio em arroz.
77
6 CONCLUSÕES GERAIS
O aumento na disponibilidade de NO3
-, entre 32 e 42 DAG afetou o metabolismo de N nas variedades IAC-47 e Piaui em etapas posteriores do crescimento, quando os teores de N-NO3
- na solução externa voltaram a níveis mais baixos. A variedade Piauí foi mais eficiente na aquisição e uso do N quando comparada a IAC-47, acumulando NO3
- em seus tecidos durante as fases iniciais de crescimento, para posterior utilização.
Quando submetidas a concentrações crescentes de nitrato, a variedade tradicional acumulou maiores teores de nitrato e também N-amino livre, apresentando menor atividade da Nitrato Redutase (ANR), que pode ter sofrido controle dos teores de aminoácidos, levando ao acúmulo do nitrato. A variedade Piauí parece adotar um controle diferenciado da ANR, pois mesmo apresentando maior expressão relativa desse gene, mantém a ANR sem sofrer influência da concentração de nitrato na solução.
O perfil de expressão dos genes dos transportadores de baixa afinidade (NRT1) mostra indução dos genes NRT1 que atuam no aproveitamento da grande disponibilidade desse nutriente em solução. Ocorreu também indução dos transportadores de alta afinidade (NRT2) na parte aérea da variedade tradicional.
Dentre os clones seqüenciados, destacam-se aqueles que tiveram homologia com a subunidade E1 do complexo piruvato desidrogenase que reforça a idéia da íntima relação existente entre o metabolismo de Carbono e Nitrogênio, já relatada em outros estudos. Os resultados obtidos nesse trabalho indicam a necessidade de se melhor compreender a complexidade da interação entre o metabolismo de N e de carbono. A seqüência correspondente a enzima fosfrotucinase também foi identificada, ela está relacionada a manutenção dos níveis intracelulares de ATP, desta forma, o N estaria ativando uma importante enzima antioxidante que estaria relacionada ao metabolismo responsável pela manutenção dos níveis energéticos da célula.
Foram identificadas também seqüências homólogas aos genes da fosfofrutocinase, proteína SEC 14, hormônio da tireóide humana além de seqüências que não apresentaram homologia com nenhuma seqüência depositada no banco de dados, podendo representar genes ainda não identificados.
78
7 REFERÊNCIAS BIBLIOGRÁFICAS
AKOPYANTS, N.; FRADKOV, A.; DIATCHENKO, L.; HILL, J.E.; SIEBERT, P.D.; LUKYANOV, S.A.; SVERDLOV, E.D. & BERG, D.E. PCR-based subtractive hybridization and differences in gene content among strains of Helicobacter pylori. Proceedings of the National Academy of Sciences of the United States of America, v.95, p.13108-13113, 1998. AL-TAHER, A.; BASHEIN, A.; NOLAN, T.; Hollingsworth, M.; BRADY, G. Global cDNA Amplification Combined with Real-Time RT-PCR: Accurate Quantification of Multiple Human Potassium Channel Genes at the Single Cell Level. Yeast, v.17, p.201-210, 2000. ALTSCHUL, S.F.; GISH, W.; MILLER, W.; MYERS, E.W. & LIPMAN, D.J. Basic local alignment search tool. J. of Mol. Biol., v.215, p.403-410, 1990. ALTSCHUL, S.F.; MADDEN, T.L.; SCHÄFFER, A.A.; ZHANG, J.; ZHANG, Z.; MILLER, W. & LIPMAN, D.J. Gapped BLAST and PSI-BLAST: a new generation of protein database search programs. Nucleic Acids Res., v.25, p.3389-3402, 1997. AMARASHINGHE, B. H. R. R.; DE BRUXELLES, G.; BRADDON, M.; ONYEOCHO, I.; FORDE, B. G. & UDVARDI, M. K. Regulation of GmNRT2 expression and nitrate transport activity in roots of soybean (Glycine max). Planta, v.206, p.44-52, 1998. ANDREWS, M.; LEA, P.J.; RAVEN, J.A.; LINDSEY, K. Can genetic manipulation of plant nitrogen assimilation enzymes result in increased crop yield and greater N-use efficiency? An assessment. Annual Applied Biology, v.141, n.1, p.25-40, 2004. ARAÚJO, E.S. Diversidade Genética e Acúmulo de Proteína de Reserva em Arroz da Baixada Maranhense – MA. 2002. 79p. Dissertação (Mestrado em Agronomia – Ciência do Solo) - Departamento de Solos, Universidade Federal Rural do Rio de Janeiro, Seropédica – RJ. ASLAM, M.; OAKS, A.; HUFFAKER, R.C. Effect of light and glucose on the induction of nitrate reductase and on the distribution of nitrate in etiolated barley leaves. Plant Physiology, v.58, p.588-591, 1976. ASLAM, M.; TRAVIS R. & HUFFAKER, R. Comparative kinetics and reciprocal inhibition of nitrate and nitrite uptake in roots uninduced and induced barley (Hordeum vulgare L.) seedlings. Plant Physiology, Rockville, v.99, p.1124-1133, 1992. ASLAM, M.; TRAVIS, R. L. & HUFFAKER, R. C. Comparative induction of nitrate and nitrite uptake and reduction systems by ambient nitrate and nitrite in intacts roots of barley (Hordeum vulgare L.) seedlings. Plant Physiology, v.102, p.811-819, 1993. BACHEM, C. W. B.; OOMEN, R. J. F. J. & VISSER, R. G. F. Transcript Imaging with cDNA-AFLP: A Step-by-Step Protocol. Plant Molecular Biology Reporter, v.16, p.157-173, 1998.
79
BACHEM, C. W. B.; VAND DER HOEVEN, R. S.; DE BRUIJN, S. M.; VREUGDENHIL, D.; ZABEAU, M. & VISSER, R. G. F. Visualization of differential gene expression using a novel method of RNA fingerprinting based on AFLP: Analysis of gene expression during potato tuber development. The Plant Journal, v.9, n.5, p.745-753, 1996. BARATA, T.S. Caracterização do consumo de arroz no Brasil. In.: Congresso Brasileiro de economia e sociologia rural XLIII, Ribeirão Preto, 2005. Anais do XLIII Congresso Brasileiro de Economia e Sociologia Rural. CD-ROM. BASSLER, H.A.; FLOOD, S.J.; LIVAK, K.J.; MARMARO, J.; KNORR, R.; BATT, C.A. Use of a fluorogenic probe in PCR-based assay for the detection of Listeria monocytogenes. Appl. Environ. Microbiol., v.61, p.3724-3728, 1995. BEMAN, J.M.; KEVIN R. ARRIGO, K.R. & MATSON, P.A. Agricultural runoff fuels large phytoplankton blooms in vulnerable areas of the ocean. Nature , v.434, p.211-214, 2005. BENNETZEN, J. AND MA, J. The genetic colinearity of rice and other cereals on the basis of genomic sequence analysis. Current Opinion in Plant Biology, v.6, p.128-133, 2003. BLOOM, A. J.; SUKRAPANNA, S. S. & WARNER, R. L. Root respiration associated with ammonium and nitrate absorption and assimilation by barley. Plant Physiology, Rockville, v.99, n.4, p.1294-1301, 1992. BRADY, G.; BARBARA, M.; SCOVE, N.N. Representative In Vitro cDNA Amplification from Individual Hemopoietic Cells and Colonies. Methods Mol. Cell Biol., v.2, p.17-25, 1990. BRADY, G.; ISCOVE, N.N. Construction of cDNA Libraries from Single Cells. Methods Enzymol., v.225, p.611-623, 1993. BRUGIÈRE, N.; SUZUKI, A. & HIREL, B. Ammonium assimilation. In: Nitrogen assimilation by plants: Physiological, biochemical and molecular aspects. Ed. J-F Morot-Gaudry. pp. 71–94. Science Publishers Inc., New Hampshire, USA. 2001. BUSTIN, S.A. Quantication of mRNA using real-time reverse transcription PCR RT-PCR: trends and problems. J. Mol. Endocrinol., v.29, p.23-29, 2002. BUSTIN, S.A. & NOLAN, T. Pitfalls of quantitative real-time reversetranscrip tion polymerase chain reaction. J. Biomol. Tech., v.15, p.155-166, 2004. CAMPBELL, W.H. Nitrate reductase structure, function and regulation: bridging the gap between biochemistry and physiology. Annual Review of Plant Physiology and Plant Molecular Biology. v.50, p.277-303, 1999. CATALDO, D.; HARRON, M.; SCHARADER, L. E. & YOUNGS, V. L. Rapid colorimetric determination of nitrate in plant tissue by nitration of salicylic acid. Communication in Soil Science and Plant Analysis, New York, US., v.6, p.853-855, 1975.
80
CEREZO, M.; TILLARD, P.; FILLEUR, S.; MUÑOS, S.; DANIEL-VEDELE, F. & GOJON, A. Major Alterations of the Regulation of Root NO3
- Uptake Are Associated with Mutation of Nrt2.1 and Nrt2.2 Genes in Arabidopsis. Plant Physiology, v. 127, p. 262-271, 2001. CHEE, M.; YANG, R.; HUBBELL, E.; BERNO, A.; HUANG, X.C.; STERNO, D.; WINKLER, J.; LOCKHART, D.J.; MORRIS, M.S. & FODOR, S.P. Accessing genetic information with high-density DNA arrays. Science, v.274, p.610-614, 1996. CHENG, C.L.; ACEDO, G.N.; DEWDNEY, J.; GOODMAN, H.M.; CANKLING, M.A. Differential expression of the two Arabidopsis nitrate reductase genes. Plant Physiology, v.96, p.275-279, 1991. CHU, S.; DERISI, J.; EISEN, M.; MULHOLLAND, J.; BOTSTEIN, D.; BROWN, P.O. & HERSKOWITZ, I. The transcriptional program of sporulation in buding yeast. Science, v.282, p.699-705, 1998. CHUAQUI, R.F.; BONNER, R.F.; BEST, C.J.; GILLESPIE, J.W.; FLAIG, M.J.; HEWITT, S.M.; PHILLIPS, J.L.; KRIZMAN, D.B.; TANGRE, M.A.; AHRAM, M.; LINEHAN, W.M.; KNEZEVIC, V.; EMMERT-BUCK, M.R. Post-analysis follow-up and validation of microarray experiments. Nat. Genet., v.32 (Suppl.), p.509-514, 2002. CLARKSON, D.T. Factors affecting mineral nutrient acquisition by plants. Annual Review of Plant Physiology, v.36, p.77-115, 1985. CONAB – Companhia Nacional de Abastecimento. Avaliação da Safra Agrícola 2005/06 – Sexto Levantamento. Maio/2006. www.conab.gov.br (Acessado em 05 de junho de 2006). CORUZZI, G.M. & ZHOU, L. Carbon and nitrogen sensing and signaling in plants: emerging “matrix effects”. Current Opinion in Plant Biology, London, v.4, p.247-253, 2001. CRAWFORD, N. M. & GLASS, A. D. M. Molecular and physiological aspects of nitrate uptake in plants. Trends in Plant Science, v.3, n.10, p.389-395, 1998. CRAWFORD, N. M. Nitrate: Nutrient and Signal for Plant Growth. The Plant Cell, v.7, p.859-868, 1995. CZECHOWSKI, T.; BARI, R.P.; STITT, M.; SCHEIBLE, W.R.; UDIVARDI, M.K. Real-time RT-PCR profiling of over 1400 Arabidopsis transcription factors: unprecedented sensitivity reveals novel root- and shoot specific genes. Plant Journal, v.38, p.366-379, 2004. DANIEL-VEDELE, F.; FILLEUR, S. & CABOCHE, M. Nitrate transport: a key step in nitrate assimilation. Current Opinion in Plant Biology, London, v.1, n.3, p.235-239, 1998. del VILLAR, P.M. Inter Arroz – Informativo mensal do mercado mundial de arroz. Abril 2006, n.26, 2006.
81
DIATCHENKO, L.; LAU, Y.C.; CAMPBELL, A.P.; CHENCHIK, A.; MOQADAM, F.;HUANG, B.; LUKYANOV, S.; LUKYANOV, K.; GURSKAYA, N.; SVERDOLOV, E.D. & SIBERT, P.D. Suppression subtractive hybridization: A method for generating differentially regulated or tissue-specific cDNA probes and libraries. Proceedings of the National Academy of Sciences of the United States of America, v.93, p.6025-6030, 1996. DREW, M.C. & SAKER, L.R. Nutrient supply and the growth of the seminal root system of barley. Part II. Localized, compensatory increases in lateral root growth and rates of nitrate uptake when nitrate supply is restricted to only part of the root system. Journal of Experimental Botany, v.26, p.79–90, 1975. FAO. Food Balances Sheets for 1995, http://apps.fao.org/lim500/nph-wrap.pl?FoodBalanceSheet&Domain=FoodBalanceSheet. 1998. FARNDEN, K. J. S. AND ROBERTSON, J. G. Methods for studying enzyme envolved in metabolism related to nitrogen. In: Bergsen, F.J. (ed.). Methods for Evaluating Biological Nitrogen Fixation, 1980. FAURE-RABASSE, S.; DEUNFF, E. L.; LAINÉ, P.; MACDUFF, J. H. & OURRY, A. Effects of nitrate pulses on BnNRT1 and BnNRT2 genes: mRNA levels and nitrate influx rates in relation to the duration of N deprivation in Brassica napus L. Journal of Experimental Botany, v.53, n.375, p.1711-1721, 2002. FEIL. B. The inverse yield-protein relationship in cereals: possibilities and limitations for genetically improving the grain protein yield. Trends in Agronomy, v.1, p.103-119, 1997. FELKER, P. Microdetermination of nitrogen in seed protein extracts. Anal.Chem., v.49, p.1980, 1977. FERNANDES, M. S. N-carriers, light and temperature influences on uptake and assimilation of nitrogen by rice. Turrialba, San Jose, CR, v.34, p.9-18, 1984. FERRARI, T.E.; YODER, O.C.; FILNER, P. Anaerobic nitrite production by plant cells and tissues: evidence for two nitrate pools. Plant Physiology, v.51, p.423-431, 1973. FERREIRA, D.F. Análises estatísticas por meio do Sisvar para Windows versão 4.0. In.: 45a Reunião Anual da Região Brasileira da Sociedade internacional de Biometria, UFSCar, São Carlos – SP, pp. 255-258, 2000. FEUILLET, K.; KELLER, B. Comparative genomics in the grass familiy: molecular characterization of grass genome structure and evolution. Annuals of Botany, London, v.89, n.1, p.3-10, 2002. FILLEUR, S. & DANIEL-VEDELE, F. Expression analysis of a high-affinity nitrate transporter isolated from Arabidopsis thaliana by differential display. Planta, v.207, p.461-469, 1999. FINNEMANN, J. AND SCHJOERRING, J.K. Post-translational regulation of cytossolic glutamine synthetase by reversible phosphorylation and 14-3-3 protein interaction. The Plant Journal, v.24, n.2, p.171-181, 2000.
82
FISCHER, K. S.; BARTON, J.; KHUSH, G. S.; LEUNG, H. & CANTRELL, R. Genomics and Agriculture: Collaborations in Rice. Science, Washington, US, v.290, n.13, p.279-280, 2000. FORDE, B. G. & COLE, J. A. Nitrate Finds a Place in the Sun. Plant Physiology, v.131, p.395-400, 2003. FORDE, B. G. Nitrate transporters in plants: structure, function and regulation. Biochimica et Biophysica Acta, v.1465, p.219-235, 2000. FOUCART, C.; PAUX, E.; LADOUCE, N.; SAN-CLEMENTE, H.; GRIMA-PATTENATI, J.; SIVADON, P. Transcripts profiling of xylem vs phloem cDNA subtractive library identifies new genes expressed during xulogenesis in Eucalyptus. New Phytologist, v.170, p.739-752, 2006. FOYER, C.H.; PARRY, M.; NOCTOR, G. Markers and signals associated with nitrogen assimilation in higher plants. Journal of Experimental Botany, v.54, p.585-593, 2003. GACHON, A.; MINGAM, A.; CHARRIER, B. Real- time PCR: what relevance to plant studies? Journal of Experimental Botany, v.55, p.1445-1454, 2004. GALLAIS, A. & HIREL, B. An approach to the genetics of nitrogen use efficiency in maize. Journal of Experimental Botany, v.55, n.396, p.295-306, 2004. GASTAL, F. & LEMAIRE, G. N uptake and distribution in crops: An agronomical and ecophysiological perspective. Journal of Experimental Botany, v.53, p.789–799, 2002. GEBHARDT, C.; OLIVER, J.E.; FORDE, B.G.; SAARELAINEN, R. & MIFLIN, B.J. Primary structure and differential expression of glutamine synthetase genes in nodules, roots and leaves of Phaseolus vulgaris. EMBO J., v.5, p.1429–1435. 1986. GEPSTEIN, S.; SABEHI, G.; CARP, M.; HAJOUJ, T.; NESHER, M.F.O.; YARIV, I.; DOR, C. & BASSANI, M. Large-scale identification of leaf senescence-associated genes. The Plant Journal, v.36, p.629-642, 2003. GIBSON, U.E.; HEID, C.A. & WILLIMAS, P.M. A novel method for real time quantitative RT-PCR. Genome Res., v.995-1001, 1996. GILLISSEN, B.; BÜRKLE, L.; ANDRÉ, B.; KÜHN, C.; RENTSCH, D.; BRANDL, B. & FROMMER, W. B. A New Family of High-Affinity Transporters for Adenine, Cytosine, and Purine Derivatives in Arabidopsis. The Plant Cell, v.12, p.291-300, 2000. GIULIETTI, A.; OVERBERGH, L.; VALCKX, D.; DECALLONNE, B.; BOUILLON, R.; MATHIEU, R. An overview of real-time quantitative PCR: applications to quantify cytokine gene expression. Methods , v.25, p.386-401, 2001. GLASS, A. D. M.; SHAFF, J. E. & KOCHIAN, L. V. Studies of the uptake of nitrate in barley. 4.Electrophysiology. Plant Physiology, Rockville, v.99, n.2, p.456-463, 1992.
83
GLASS, A.D.M. Nitrogen Use Efficiency of Crop Plants: Physiological Constraints upon Nitrogen Absorption. Critical Reviews in Plant Sciences, v.22, n.5, p.453-470, 2003. GLASS, A.D.M.; BRITTO, D.T.; KAISER, B.N.; KINGHORN, J.R.; KRONZUCKER, H.J.; KUMAR, A.; OKAMOTO, M.; RAWAT, S.; SIDDIQI, M.Y.; UNKLES, S.E. & VIDMAR, J.J. The regulation of nitrate and ammonium transport systems in plants. Journal of Experimental Botany, v.53, n.370, p.855-864, 2002. GOFF, S. A.; RICKE, D.; LAN, T.; PRESTING, G.; WANG, R.; DUNN, M.; GLAZEBROOK, J.; SESSIONS, A.; OELLER, P.; VARMA, H.; HADLEY, D.; HUTCHISON, D.; MARTIN, C.; KATAGIRI, F.; LANGE, B. M.; MOUGHAMER, T.; XIA, Y.; BUDWORTH, P.; ZHONG, J.; MIGUEL, T.; PASZKOWSKI, U.; ZHANG, S.; COLBERT, M.; SUN, W.; CHEN, L.; COOPER, B.; PARK, S.; WOOD, T. C.; MAO, L.; QUAIL, P.; WING, R.; DEAN, R.; YU, Y.; ZHARKIKH, A.; SHEN, R.; SAHASRABUDHE, S.; THOMAS, A.; CANNINGS, R.; GUTIN, A.; PRUSS, D.; REID, J.; TAVTIGIAN, S.; MITCHELL, J.; ELDREDGE, G.; SCHOTT, T.; MILLER, R. M.; BHATNAGAR, S.; ADEY, N.; RUBANO, T.; TUSNEEM, N.; ROBINSON, R.; FELDHAUS, J.; MACALMA, T.; OLIPHANT, A. & BRIGGS, S. A Draft Sequence of the Rice Genome (Oryza sativa L. ssp. japonica). Science, v.296, p.92-100, 2002. GRANATO, T.C. & RAPER Jr, C.D. Proliferation of maize (Zea maize L.) roots in response to localized supply of nitrate. Journal of Experimental Botany, v.40, p.263–275, 1989. GRANSLEDT, R.C. & HUFFAKER, R.C. Identification of the leaf vacuole as a major nitrate storage pool. Plant Physiology, v.70, p.410-413, 1982. GREENLAND, D.J. Nitrate fluctuations in tropical soils. Journal Agricultural Science, v.50, p.82-91, 1958. GUO, F.; WANG, R. & CRAWFORD, N. M. The Arabidopsis dual-affinity nitrate transporter gene AtNRT1.1 (CHL1) is regulated by auxin in both shoots and roots. Journal of Experimental Botany, v.53, n.370, p.835-844, 2002. GURSKAYA, N.G.; DIATCHENKO, L.; CHENCHIK, A.; SIEBERT, P.D.; KHASPEKOV, G.L.; LUKYANOV, K.A.; VAGNER, L.L.; ERMOLAEVA, O.D.; LUKYANOV, S.A. & SVERDLOV, E.D. Equalizing cDNA Subtraction Based on Selective Suppression of Polymerase Chain Reaction: Cloning of Jurkat Cell Transcripts Induced by Phytohemaglutinin and Phorbol 12-Myristate 13-Acetate. Analytical Biochemistry, v.240, p.90-97, 1996. HARADA, H.; KUROMORI, T.; HIRAYAMA, T.; SHINOZAKI, K.; LEIGH, R.A. Quantitative trait loci analysis of nitrate storage in Arabidopsis leading to an investigation of the contribution of the anion chanel gene, AtCLC-c, to variation in nirate levels. Journal of Experimental Botany, v.55, n.405, p.2005-2014, 2004. HARAKAVA, R. & GABRIEL, D.W. Genetic Difference between Two Strains of Xylella fastidiosa Revealed by Suppression Subtractive Hybrid ization. Applied and Environmental Microbiology, v.69, n.2, p.1315-1319, 2003.
84
HARTINGS, H. High resolution fingerprinting of transcribed genes by means of a modified cDNA-AFLP method. Maydica, v.44, n.2, p.179-181, 1999. HEID, C.A.; STEVENS, J.; LIVAK, K.J. & WILLIAMS, P.M. Real time quantitative PCR. Genome Res., v.6, p.986-994, 1996. HIREL, B.; BERTIN, P.; QUILLERÉ, I.; BOURDONCLE, W.; ATTAGNANT, C.; DELLAY, C.; GOUY, A.; CADIOU, S.; RETAILLIAU, C.; FALQUE, M. & GALLAIS, A. Towards a Better Understand ing of the Genetic and Physiological Basis for Nitrogen Use Efficiency in Maize. Plant Physiology, v.125, p.1258-1270, 2001. HOAGLAND, D. R. & ARNON, D. I. The water-culture method for growing plants without soil. California Agricultural Experiment Station, Berkeley, Calif., US., 347P, 1950. HOFF, T.; TRUONG, H.N.; CABOCHE, M. The use of mutants and transgenic plants to study nitrate assimilation. Plant Cell and Environment, v.17, p.489-506, 1994. HUANG, N.; LIU, K.; LO, H. & TSAY, Y. Cloning and Functional Characterization of an Arabidopsis Nitrate Transporter Gene That Encodes a Constitutive Component of Low-Affinity Uptake. The Plant Cell, v.11, p.1381-1392, 1999. INOKUCHI, R.; KUMA, K.; MIYATA, T.; OKADA, M. Nitrogen-assimilating enzymes in land plants and algae: phylogenic and physiological perspectives. Physiologia Plantarum, v.116, p.1-11, 2002. IQBAL, M.J.; YAEGASHI, S.; NJITI, V.N.; AHSAN, R.; CRYDER, K.L. & LIGHTFOOT, D.A. Resistance locus pyramids alter transcript abundance in soybean roots inoculated with Fusarium solani f.sp. glycines. Mol. Genet. Genomics, v.268, p.407-417, 2002. IRELAND, R.J. & LEA, P.J. The enzymes of Glutamine, Glutamate, Asparagine and Apartate Metabolism. In: Plant amino acids biochemistry and biotechnology. Ed. B K Singh. pp. 49–111. Marcel Dekker, Inc., New York. 1999. IZAWA, T. & SHIMAMOTO, K. Becoming a model plant: the importance of rice to plant science. Trends in Plant Science, v.1, n.2, p.95-99, 1996. JACKSON, W.A.; VOLK, R.J. Nitrate transport processes and compartmentation in root systems . In: Lyons, J.M.; Valinitine, R.C.; Phillips, D.A.; Rains, D.W.; Huffaker, R.C. (eds) Genetic engineeering of symbiotic nitrogen fixation and conversion of fixed nitrogen. Plenum Press, New York, pp.517-532, 1981. JAIN, M.; KAUR, N.; TYAGI, A.K.; KHURANA, J.P. The auxin-responsive GH3 gene family in rice (Oryza sativa). Funct. Integr. Genomics, v.6, p.36-46, 2006a. JAIN, M.; KAUR, N.; GARG, R.; TAKUR, J.K.; TYAGI, A.K.; KURANA, J.P. Structure and expression analysis of early auxin-responsive Aux/IAA gene family in rice (Oryza sativa). Funct. Integr. Genomics, v.6, p.47-59, 2006b.
85
JAIN, M.; NIJHAWAN, A.; TYAGI, A.K.; KHURANA, J.P. Validation oh housekeeping genes as internal control for studying gene expression in rice by quantitative real- time PCR. Biochemical and Biophysical Research Communications , v.345, p.646-651, 2006. JI, W.; WRIGHT, M.B.; CAI, L.; FLAMENT, A. & LINDPAINTNER, K. Efficacy of SSH PCR in isolating differentially expressed genes. BMC Genomics, v.3, n.1, p.12, 2002. Publicado on- line em 20 de maio de 2002. KHUSH, G.S. What it will take to Feed 5.0 Billion Rice consumers in 2030. Plant Molecular Biology, v.59, p.1-6, 2005. KIM, B.; NAM, H.; KIM, S.; KIM, S.; CHANG, Y. Normalization of reverse transcription quantitative-PCR with housekeeping genes in rice. Biotechonology Letters , v.25, p.1869-1872, 2003. KRAMER, T. Environmental and genetic variation for protein content in winter wheat (Triticum aestivum L.). Euphitica, v.26, p.209-218, 1979. KRAPP, A.; FRAISIER, V.; SCHEIBLE, W.; QUESADA, A.; GOJON, A.; STITT, M.; CABOCHE, M. & DANIEL-VEDELE, F. Expression studies of Nrt2:1Np, a putative high-affinity nitrate transporter: evidence for its role in nitrate uptake. The Plant Journal, v.14, n.6, p.723-731, 1998. KRONZUCKER, H. J.; SIDDIQI, M. Y. & GLASS, A. D. M. Kinetics of NO3
- Influx in
Spruce. Plant Physiology, v.109, p.319-326, 1995. KUMAR, S.; TAMURA, K.; JAKOBSEN, I.B.; NEI, M. MEGA, Molecular Evolutionary Genetics Analysis, Version 2.1, 1993. LEA, P. J. & IRELAND, R. J. Nitrogen metabolism in higher plants. In: B.K. Singh (ed.) MM. Decker Inc. Plant Amino Acids, p.1-47, 1999. LEE, S. W.; THOMASETTO, C. & SAGER, R. Positive selection of candidate tumor-supressor genes by subtractive hybridization. Proc.Natl.Acad.Sci.USA, v.88, p.2825-2829, 1991. LEJAY, L.; TILLARD, P.; LEPETIT, M.; OLIVE, F. D.; FILLEUR, S.; DANIEL-VEDELE, F. & GOJON, A. Molecular and functional regulation of two uptake NO3
- systems by N- and C-status of Arabidopsis plants. The Plant Journal, v.18, n.5, p.509-519, 1999. LIANG, P. & PARDEE, A. B. Differential display of eukaryotic messenger RNA by means of the polymerase chain reaction. Science, v.257, p.967-971, 1992. LI, R.; WANG, H.; MAO, H.; LU, Y.; HUA, W. Identification of differentially expressed genes in seeds of two near-isogenic Brassica napus lines with different oil content. Planta, v.224, p.952-962, 2006. LIMAMI, A.M.; ROUILLON, C.; GLEVAREC, G.; GALLAIS, A.; HIREL, B. Genetic and Physiological Analysis of Germination Efficiency in Maize in Relation to Nitrogen
86
Metabolism Reveals the Importance of Cytosolic Glutamine Synthetase. Plant Physiology, v.130, p.1860-1870, 2002. LIN, C.; KOH, S.; STACEY, G.; YU, S.; LIN, T. & TSAY, Y. Cloning and Functional Characterization of a Constitutively Expressed Nitrate Transporter Gene, OsNRT1, from Rice. Plant Physiology, v.122, p.379-388, 2000. LIU, K.H.; HUANG, C.Y.; TSAY, Y.F. CHL1 is a dual-affinity nitrate transporter of Arabidopsis involved in multiple phases of nitrate uptake. Plant Cell, v.11, p.865-874, 1999. LONGEMAN, J.; SCHELL, J.; WILLMITZER, L. Improved method for the isolation of RNA from plant tissues. Anal. Biochem., v.163, p.16-20, 1987. LOQUÉ, D.; TILLARD, P.; GOJON, A. & LEPETIT, M. Gene Expression on the NO3
- Transporter NRT1.1 and the Nitrate Reductase NIA1 Is Repressed in Arabidopsis Roots by NO2
-, the Product of NO3- Reduction. Plant Physiology, v.132, p.958-967, 2003.
LOULAKAKIS, K.A.; ROUBELAKIS-ANGELAKIS, K.A.; KANELLIS, A.K. Isolation of functional RNA from grapevine tissues poor in nucleic acid content. Am. J. Enol. Vitic., v.47, p.181-185, 1996. MACCLURE, P.R.; KOCHIAN, L.V.; SPANSWICK, R.M. & SHAFF, J.E. Evidence for cotransport of nitrate and proton in maize roots. I. Effect of nitrate on the membrane potential. Plant Physiology, v.93, p.281-289, 1990. MACDUFF, J. H. & JACKSON, S. B. Growth and preferences for ammonium or nitrate upatke by barley in relation to root temperature. Journal of Experimental Botany, Oxford, v.42, n.237, p.521-530, 1991. MAHALINGAM, R.; GOMEZ-BUITRAGO, A.; ECKARDT, N.; SHAH, N.; GUEVARA-GARCIA, A.; DAY, P.; RAINA, R. & FEDOROFF, N.V. Characterization the stress/defense transcriptome of Arabidopsis. Genome Biology, v.4, n.3, p.1-14, 2003. MALAMY, J.E. & RYAN, K.S. Environmental Regulation of Lateral Root Initiation in Arabidopsis. Plant Physiology, v.127, p.899–909, 2001. MAN, H.; BAKI, G.K.A.; STEGMANN, P.; WEINER, H.; KAISER, W.M. The activation state of nitrate reductase is not always correlated with total nitrate reductase activity in leaves. Planta, v.209, n.4, p.462-468, 1999. MARSCHNER, H.; KIRKBY, E. A. & ENGELS, C. Importance of cycling and recycling of mineral nutrients within plants for growth and development. Botanica Acta, v.110, n.4, p.265-273, 1997. MARTINOIA, E.; HECK, U.; WIEMKEN, A. Vacuoles as storage compartments for nitrate in barley leaves. Nature , v.289, p.292-294, 1981.
87
MASCLAUX, C.; VALADIER, M. H.; BRUGIÈRE, N.; MOROT-GAUDRY, J. F. & HIREL, B. Characterization of the sink/source transition in tobaco (Nicotiana tobacum L.) shoots in relation to nitrogen management and leaf senescence. Planta, v.211, p.510-518, 2000. MATHEWS, H.; CLENDENNEN, S.K.; CALDWELL, C.G.; LIU, X.L.; CONNORS, K.; MATHEIS, N.; SCHUSTER, D.K.; MENASCO, D.J.; WAGONER, W.; LIGHTNER, J. & WAGNER, D.R. Activation Tagging in Tomato Identifies a Transcriptional Regulator of Anthocyanin Biosynthesis, Modification, and Transport. The Plant Cell, v.15, p.1689-1703, 2003. MELZER, J.M.; KLEINHOFS, A.; WARNER, R.L. Nitrate reductase regulation: effects of nitrate and light on nitrate reductase mRNA accumulation. Mol. Gen. Genet., v.217, p.341-346, 1989. MILLER, A.J. & CRAMER, M.D. Root nitrogen acquisition and assimilation. Plant and Soil, v.274, p.1-36, 2004. MIN, X.; SIDDIQI, M.Y.; GUY, R.D.; GLASS, A.D.M. & KRONZUCKER, H.J. Induction of nitrate uptake and nitrate reductase activity in trembling aspen and lodgepole pine. Plant, Cell and Environment, v.21, p.1039-1046, 1998. MITCHELL, H.T. Microdetermination of nitrogen in plant tissue. J. Ass. Off. Agric., v.55, p.1-3, 1972. MLADEK, C.; GUGER, K.; HAUSER, M.T. Identifcation and characterization of the ARIADNE gene family in Arabidopsis. A group of putative E3 ligases. Plant Physiology, v.131, p.27-40, 2003. NARDOTO, G.B. and BUSTAMANTE, M.C. Effects of fire on soil nitrogen dynamics and microbial biomass in savannas of Central Brazil. Pesquisa Agropecuária Brasileira, v.38, n.8, p.955-962, 2003. NAZOA, P.; VIDMAR, J.J.; TRANBARGER, T.J.; MOULINE, K.; DAMIANI, I.; TILLARD, P.; ZHUO, D.; GLASS, A.D.M. & TOURAINE, B. Regulation of the nitrate transporter gene AtNRT2.1 in Arabidopsis thaliana: reponse to nitrate, amino acids and development stage. Plant Molecular Biology, v.52, p.689-703, 2003. PÉREZ-GARCIA, A.; CÁNOVAS, F.M.; GALLARDO, F.; HIREL, B. VICENTE, A. Differential expression of glutamine synthetase isoforms in tomato detached leaflets infected with Pseudomonas syringae pv tomato. Mol. Plant Microbe Interact., v.8, p.96-103, 1998. OBARA, M.; KAJIURA, M.; FUKUTA, Y.; YANO, M.; HAYASHI, M.; YAMAYA, T.; SATO, T. Mapping of QTLs associated with cytosolic glutamine synthetase and NADH-glutamate synthase in rice (Oriza sativa L.). Journal of Experimental Botany, v.52, p.1209-1217, 2001. OK, S.H.; PARK, H.M.; KIM, J.Y.; BAHN, S.C.; BAE, J.M.; SUH, M.C.; JEUNG, J.; KIM, K. & SHIN, J.S. Identification of differentially expressed genes during flower development in carnation (Dianthus caryophyllus). Plant Science, v.165, p.291-297, 2003.
88
OKAMOTO, M.; VIDMAR, J.J. & GLASS, A.D.M. Regulation of NRT1 and NRT2 genes families of Arabidopsis thaliana: Responses to nitrate provision. Plant and Cell Physiology, v.44, n.3, p.304-317, 2003. ORLANDO, C.; PINZANI, P.; PAZZAGLI, M. Developments in Quantitative PCR. Clin. Chem. Lab. Med., v.36, p.255-269, 1998. ORSEL, M.; FILLEUR, S.; FRAISIER, V. & DANIEL-VEDELE, F. Nitrate transport in plants: which gene and which crontrol? Journal of Experimental Botany, v.53, n.370, p.825-833, 2002a. ORSEL, M.O.; KRAPP, A.; DANIEL-VEDELE, F. Analysis of the NRT2 Nitrate Transporter Family in Arabidopsis. Strucuture and Gene Expression. Plant Physiology, v.129, p.886-896, 2002b. PINTO, A.C. Genes induzidos por tratamento com cálcio em raízes do milho (Zea mays L.)'Saracura' BRS-4154 em condições de hipoxia. 2004. 61p. Dissertação (Mestrado em Agronomia – Fisiologia Vegetal) – Universidade Federal de Lavras, Lavras – MG. QUAGGIOTTI, S.; RUPERTI, B.; BORSA, P.; DESTRO, T. & MALAGOLI, M. Expression of a putative high-affinity NO3
- transporter and of an H+-ATPase in relation to whole plant nitrate transport physiology in two maize genotypes differently responsive to low nitrogen availability. Journal of Experimental Botany, v.54, n.384, p.1023-1031, 2003. QUESADA, A.; KRAPP, A.; TRUEMAN, L. J.; DANIEL-VEDELE, F.; FERNANDEZ, E.; FORDE, B. G. & CABOCHE, M. PCR-identification of a Nicotiana plumbaginifolia cDNA homologous to the high-affinity nitrate transporters of the CRNA family. Plant Molecular Biology, Dordrecht, v.34, n.2, p.265-274, 1997. RADNEDGE, L.; AGRON, P.G.; HILL, K.K.; JACKSON, P.J.; TICKNOR, L.O.; KEIM, P. & ANDERSEN, G.L. Genome Differences That Distinguish Bacillus anthracis from Bacillus cereus and Bacillus thurigiensis. Applied and Environmental Mibrobiology, v.69, n.5, p.2755-2764, 2003. RAVEN, J.A.; TAYLOR, R. Macro algal growth in nutrient-enriched estuaries: a biogeochemical perspective. Water, Air and Soil Pollution: Focus . v.3, p.7-26, 2003. ROBINSON, D. The responses of plants to non-uniform supplies of nutrients. New Phytol., v.127, p.635-674, 1994. RODRIGUES, F.S.; SOUZA, R.S.; RODRIGUES, F.S. & FERNANDES, M.S. Nitrogen metabolism in rice cultivated under seasonal flush of nitrate. Journal of Plant Nutrition, v.27, p.395-409, 2004. SANCHEZ-BALLESTA, M.; LLUCH, Y.; GOSALBES, M.J.; ZACARIAS, L.; GRANELL, A. & LAFUENTE, M.T. A survey of genes differentially expressed during long-term heat-induced chilling tolerance in citrus fruit. Planta, v.218, p.65-70, 2003.
89
SANDHU, D. & GILL, K. S. Gene-Containing Regions of Wheat and the Other Grass Genomes. Plant Physiology, v.128, p.803-811, 2002. SANGER, F.; NICKLEN, S. & COULSON, A.R. DNA sequencing with chain- terminating inhibitors. Proc. Natl. Acad. Sci., v.74, p.5463-5467, 1977. SANTOS, A. M.; SILVA, S. D.; STARK, E. M. L. M.; FERNANDES, M. S.; SOUZA, S. R. Atividade da Nitrato Redutase e Glutamina Sintetase em duas variedades de arroz cultivadas sob duas doses de nitrato. Brazilian Journal Of Plant Physiology, Atibaia, v.15, n. Suplemento, p.111-111, 2003b. SANTOS, A.M.; STARK, E.M.L.M.; FERNANDES, M.S.; SOUZA, S.R. Teores de nitrogênio, fósforo e frações solúveis em duas variedades de arroz cultivadas em solução nutritiva sob dois níveis de nitrato. Agronomia, v.37, n.1. p.76-81, 2003a. SANTOS, C.V. DOS; DELAVAULT, P.; LETOUSEY, P. & THALOUARN, P. Identification by suppression subtractive hybridization and expression analysis of Arabidopsis thaliana putative defense genes during Orobanche ramose infection. Physiological and Molecular Plant Pathology, v.62, p.297-303, 2003. SASAKAWA, H. & YAMAMOTO, Y. Comparison of the uptake of nitrate and ammonium rice seedlings – influences of light, temperature, oxygen concentration, exogenous sucrose, and metabolic inhibitors. Plant Physiology, v.62, p.665-669, 1978. SCHEIBLE, W.R.; GONZÁLEZ-FONTES, A.; LAUERER, M.; MÜLLER-RÖBER, B.; CABOCHE, M. AND STITT, M. Nitrate Acts as a Signal to Induce Organic Acid Metabolism and Repress Starch Metabolism in Tobacco. The Plant Cell, v.9, p.783-798, 1997. SCHEIBLE, W.R.; LAURER, M.; SCHULZE, E.D.; CABOCHE, M.; STITT, M. Accumulation of nitrate in the shoots acts as a signal to regulate shoot-root allocation in tobacco. The Plant Journal, v.11, p.671-691, 1997. SCHMITTGEN, T.D. & ZAKRAJSEK, B.A. Effect of experimental treatment on housekeeping gene expression: validation by real-time, quantitative RT-PCR. J. Biochem. Biophys. Meth., v.46. p.69-81, 2000. SERS, C.; TCHERNITSA, O.I.; ZUBER, J.; DIATCHENKO, L.; ZHUMABAYEVA, B.; DESAI, S.; HTUM, S.; HYDER, K.; WIECHEN, K.; AGOULNIK, A.; SCHARFF, K.M.; SIEBERT, P.D. & SCHÄFER, R. Gene expression profiling in RAS oncogene-transformed cell lines and solid tumors using subtractive suppression hybridization and cDNA arrays. Advan. Enzyme Regul., v.42, p.63-82, 2002. SHULZ, D.J.; CRAIG, R.; COX-FOSTER, D.L.; MUMMA, R.O.; MEDFORD, J.I. RNA isolation from recalcitrant plant tissue. Plant Mol. Biol. Rep., v.12, p.310-316, 1994. SIDDIQI, M. Y.; GLASS, A. D. M.; RUTH, T. J. & RUFTY, T. Studies of the uptake of nitrate in barley: I. Kinetics of 13NO3
- influx. Plant Physiology, v.93, p.1426-1432, 1990.
90
SIVASANKAR, S.; ROTHSTEIN, S. & OAKS, A. Regulation of the Accumulation and Reduction of Nitrate by Nitrogen and Carbon Metabolites in Maize Seedlings. Plant Physiology, v.114, p.583-589, 1997. SMITH, F. W.; RAE, A. L. & HAWKESFORD, M. J. Molecular mechanisms of phosphate and sulphate transport in plants. Biochimica et Biophysica Acta, v.1465, p.236-245, 2000. SOUZA, S. R.; STARK, E. M. L. M. & FERNANDES, M. S. Foliar Spraying of Rice With Nitrogen: Effect on Protein Levels, Protein Fractions, and Grain Weight. Journal of Plant Nutrition, v.22, n.3, p.579-588, 1999a. SOUZA, S. R.; STARK, E. M. L. M. & FERNANDES, M. S. Nitrogen Remobilization During the Reproductive Period in Two Brazilian Rice Varieties. Journal of Plant Nutrition, New York, US, v.21, n.10, p.2049-2063, 1998. SOUZA, S. R.; STARK, E. M. L. M.; FERNANDES, M. S. & MAGALHÃES, J. R. Effects of Supplemental Nitrogen on Nitrogen-Assimilation Enzymes, Free Amino Nitrogen, Soluble Sugars, and Crude Protein of Rice. Communication in Soil Science and Plant Analysis, New York, US., v.30, n.5&6, p.711-724, 1999b. SOUZA, S.R. & FERNANDES, M.S. Nitrogen-acquisition by plants in a sustainable environment. In: Singh, R.P. & Jaiwal, P.K. (eds.) Biotechnological Approaches to Improve Nitrogen Use Efficiency in Plants, Studium Press, LLC, Houston, Texas, USA, p.41-62, 2006. SOUZA, S.R.; STARK, E.M.L.M.; FERNANDES, M.S. AND MAGALHÃES, J.R. Effects of Supplemental Nitrogen on Nitrogen-Assimilation Enzymes, Free Amino Nitrogen, Soluble Sugars, and Crude Protein of Rice. Communication in Soil Science and Plant Analysis, v.30, n.5&6, p.711-724, 1999. SOUZA, S.R.; STARK, E.M.L.M.; MAGALHÃES, J.R.; FERNANDES, M.S. Supplemental Nitrogen Applied during the Senescence on Two Rice Varieties: Evaluation of Nitrate Reductase and Glutamine Synthetase Activities and Crude Protein. Physiol. Mol. Biol. Plants, v.8, n.1, p.87-95, 2002. STEINER, H.; SONG, W.; ZHANG, L.; NAIDER, F.; BECKER, J. M. & STACEY, G. An Arabidopsis Peptide Transporter Is a Member of a New Class of Membrane Transport Proteins. The Plant Cell, v.6, p.1289-1299, 1994. STEUERWALD, N.; COHEN, J.; HERRERA, R.J.; BRENNER, C.A. Analysis of Gene Expression in Single Oocytes and Embryos by Real-Time Rapid Cycle Fluorescence Monitored RT-PCR. Mol. Hum. Reprod., v.5, p.1034-1039, 1999. STITT, M. Nitrate regulation of metabolism and growth. Current Opinion in Plant Biology, v.2, p.178-186, 1999. STITT, M.; MÜLLER, C.; MATT, P.; GIBON, Y.; CARILLO, P.; MARCUENDE, R.; SCHEIBLE, W.R.; KRAPP, A. Steps towards and integrated view of nitrogen metabolism. Journal of Experimental Botany, v.53, p.959-970, 2002.
91
STÖHR, C. & ULLRICH, W.R. Generation and possible roles of NO in plant roots and their apoplastic space. Journal of Experimental Botany. v.53, p.2293–2303, 2002. TATTERSALL, E.A.R.; ERGUL, A.; ALKAYAL, F.; DELUC, L.; CUSHMAN, J.C.; CRAMER, G.R. Comparison of methods for isolating high-quality RNA from leaves of Grapevine. Am. J. Enol. Vitic., v.56, p.400-406, 2005. THOMAS, F.M. & HILKER, C. Nitrate reduction in leaves and roots of young pedunculate oaks (Quercus robus) growing on different nitrate concentrations. Environmental and Experimental Botany, v.43, p.19-32, 2000. TILMAN, D. G. et al. Forecasting agriculturally driven global environmental change. Science, v.292, p.282-284, 2001. TISCHNER, R. Nitrate uptake and reduction in higher and lower plants. Plant, Cell and Environment, v.23, p.1005-1024, 2000. TRUEMAN, L. J.; RICHARDSON, A. & FORDE, B. G. Molecular cloning of higher plant homologues of the high-affinity nitrate transporters of Clamydomonas reinhardtti and Aspergillus nidulans. Gene , v.175, p.223-231, 1996. TSAY, Y. F.; SCHROEDER, J. I.; FELDMANN, K. A. & CRAWFORD, N. M. The herbicide sensitivity gene CHL1 of Arabidopsis encondes a nitrate- inducible nitrate transporter. Cell, Cambridge, v.72, n.5, p.705-713, 1993. van der LEIJ, M.; SMITH, S.J.; MILLER, A.J. Remobilisation of vacuolar stored nitrate in barley root cells. Planta, v.205, p.64-72, 1998. VELCULESCU, V.E.; ZHANG, L.; VOGELSTEIN, B & KINZLER, K.W. Serial analysis of gene expression. Science, v.5235, p.484-487, 1995. VIDMAR, J. J.; ZHUO, D.; SIDDIQI, M. Y.; SCHJOERRING, J. K.; TOURAINE, B. & GLASS, A. D. M. Isolation and characterization of HvNRT2.3 and HvNRT2.4, cDNAs enconding high-affinity nitrate transporters from roots of Hordeum vulgare. Plant Physiology, v.122, p.783-792, 2000a. VIDMAR, J. J.; ZHUO, D.; SIDDIQI, M. Y.; SCHJOERRING, J. K.; TOURAINE, B. & GLASS, A. D. M. Regulation of High-Affinity Nitrate Transporter Genes and High-Affinity Nitrate Influx by Nitrogen Pools in Roots of Barley. Plant Physiology, v.123, p.307-318, 2000b. VILAINE, F.; PALAUQUI, J.C.; AMSELEM, J.; KUSIAK, C.; LEMOINE, R.; DINANT, S. Towards deciphering phloem: a transcriptme analysis of the phloem of Aipium graveolens. Molecular Plant Journal, v.36, p.67-81, 2003. VINCENTZ, M.; MOUREAUX, T.; LEYDECKER, M.T.; VAUCHERET, H.; CABOCHE, M. Regulation of nitrate and nitrite reductase expression in Nicotiana plumbaginifolia leaves by nitrogen and carbon metabolites. Plant Journal, v.3, p.315-324, 1993.
92
von WIRÉN, N.; GAZARRINI, S.; FROMMER, W.B. Regulation of mineral nitrogen uptake in plants. In: Plant and Soil, Band 196, Heff, 1997, S.191-199. WANG, Y.; GARVIN, D. F. & KOCHIAN, L. V. Nitrate-Induced Genes in Tomato Roots. Array Analysis Reveals Novel Genes That May Play a Role in Nitrogen Nutrition. Plant Physiology, v.127, p.345-359, 2001. WANG, R.; GUEGLER, K.; LABRIE, S. T. & CRAWFORD, N. M. Genomic Analysis of a Nutrient Response in Arabidopsis Reveals Diverse Expression Patterns and Novel Metabolic and Potential Regulatory Genes Induced by Nitrate. The Plant Cell, v.12, p.1491-1509, 2000. WANG, R.; LIU, D. & CRAWFORD, N. M. The Arabidopsis CHL1 protein plays a major role in high-affinity nitrate uptake. Proc.Natl.Acad.Sci.USA, v.95, p.15134-15139, 1998. WANG, R.; OKAMOTO, M.; XING, X. & CRAWFORD, N.M. Microarray Analysis of the Nitrate Response in Arabidopsis Roots and Shoots Reveals over 1,000 Rapidly Responding Genes and New Linkages to Glucose, Trehalose-6-Phosphate, Iron, and Sulfate Metabolism. Plant Physiology, v.132, p.556-567, 2003. WANG, X.; WU, P.; XIA, M.; WU, Z.; CHEN, Q & LIU, F. Identification of genes enriched in rice roots of the local nitrate treatment and their expression patterns in split-root treatment. Gene , v.297, p.93-102, 2002. WATT, D.A. Aluminium-responsive genes in sugarcane: identification and analysis of expression under oxidative stress. Journal of Experimental Botany, v.54, n.385, p.1163-1174, 2003. WELSH, J.; CHADA, K.; DALAL, S. S.; CHENG, R. & MCCLELLAND, M. Arbitrarily primed PCR fingerprinting of RNA. Nucleic Acids Research, v.20, n.9, p.4965-4970, 1992. WETSELAAR, R. Nitrate distribution in tropical soils. I. Possible cause of nitrate accumulation near the surface after a long dry period. Plant and Soil, v.15, p.110-120, 1961a. WETSELAAR, R. Nitrate distribution in tropical soils. II. Extent of capillary accumulation of nitrate during a long dry period. Plant and Soil, v.15, p.121-133, 1961b. WILKINSON, J.Q. & CRAWFORD, N.M. Identification and characterization of a chlorate-resistant mutant of Arabidopsis thaliana with mutations in both nitrate reductase structural genes NIA1 and NIA2. Mol. Gen. Genet., v.239, p.289–297, 1993. WILLIAMS, L. E. & MILLER, A. J. Transporters Responsible for the Uptake and Partitioning of Nitrogenous solutes. Annual Review In Plant Physiology and Plant Molecular Biology, Palo Alto, CA - USA, v.52, p.659-688, 2001. WINFREY, MR.; ROTT, M.A.; WORTMAN, A.T. Unraveling DNA. In: Molecular Biology for the Laboratory. Prentice-Hall, Uper Saddle River, NJ. YEMM, E. W. & COCKING, E. C. The determination of animo-acid with ninhydrin. Anal.Biochem., San Diego, CA - USA, v.80, p.209-213, 1955.
93
YEMM, E. W. AND COCKING, E. C. The determination of animo-acid with ninhydrin. Anal.Biochem., v.80, p.209-213, 1955. YU, J.; HU, S.; WANG, J.; WONG, G. K.; LI, S.; LIU, B.; DENG, Y.; DAI, L.; ZHOU, Y.; ZHANG, X.; CAO, M.; LIU, J.; HUANG, X.; LIN, W.; YE, C.; TONG, W.; CONG, L.; GENG, J.; HAN, Y.; LI, L.; LI, W.; HU, G.; HUANG, X.; LI, W.; LI, J.; LIU, Z.; LI, L.; LIU, J.; QI, Q.; LIU, J.; LI, L.; LI, T.; WANG, X.; LU, H.; WU, T.; ZHUO, M.; NI, P.; HAN, H.; DONG, W.; REN, X.; FENG, X.; CUI, P.; LI, X.; WANG, H.; XU, X.; ZHAI, W.; XU, Z.; JZHANG, J.; HE, S.; ZHANG, J.; XU, J.; ZHANG, K.; ZHENG, X.; DONG, J.; ZENG, W.; TAO, L.; YE, J.; TAN, J.; REN, X.; CHEN, X.; HE, J.; LIU, D.; TIAN, W.; TIAN, C.; XIA, H.; BAO, Q.; LI, G.; GAO, H.; CAO, T.; WANG, J.; ZHAO, W.; LI, P.; CHEN, W.; WANG, X.; ZHANG, Y.; HU, J.; WANG, J.; LIU, S.; YANG, J.; ZHANG, G.; XIONG, Y.; LI, Z.; MAO, L.; CHOU, C.; ZHU, Z.; CHEN, R.; HAO, B.; ZHENG, W.; HEN, S.; UO, W.; I, G.; IU, S.; AO, M.; ANG, J.; HU, L.; UAN, L. & ANG, H. A Draft Sequence of the Rice Genome (Oryza sativa L. ssp. indica). Science, v.296, p.79-92, 2002. ZHANG, H. & FORDE, B. G. Regulation of Arabidopsis root development by nitrate availability. Journal of Experimental Botany, v.51, n.342, p.51-59, 2000. ZHANG, H.; JENNINGS, A.; BARLOW, P.W. & FORDE, B.G. Dual pathways for regulation of root branching by nitrate. Proc.Natl.Acad.Sci.USA, v.96, p.6529-6534, 1999. ZHAO, S.P.; ZHAO, Q.X.; LI, S.M.; SHI, W.M. Optimization and Application of Real-Time PCR Method for Detecting the Expression Levels of Nitrogen Assimilation-Related Genes in Rice. Russian Journal of Plant Physiology, v.53, n.4, p.560-569, 2006 ZHEN, R.G.; KOYRO, H.W.; LEIGH, R.A.; TOMOS, A.D.; MILLER, A.J. Compartmental nitrate concentrations in barley root cells measured with nitrate-selective microeletrodes and by single-cell sap sampling. Planta, v.185, p.356-361, 1991. ZHONG, H. & SIMONS, J.W. Direct comparison of GAPDH, bactin, cyclophilin, and 28S rRNA as internal standards for quantifying RNA levels under hypoxia. Biochem. Biophys. Res. Commun., v.259, p.523–526, 1999. ZHOU, J.; THEODOULOU, F. L.; MULDIN, I.; INGEMARSSON, B. & MILLER, A. J. Cloning and Functional Characterization of a Brassica napus Transporter That is Able to Transport Nitrate and Histidine. The Journal of Biological Chemistry, v.273, n.20, p.12017-12023, 1998. ZHUO, D.; OKAMOTO, M.; VIDMAR, J. J. & GLASS, A. D. M. Regulation of a putative high-affinity nitrate transporter (Nrt2;1At) in roots of Arabidopsis thaliana. The Plant Journal, v.17, n.5, p.563-568, 1999.