DANIEL CABRAL TEIXEIRA - app.uff.br · correlação negativa com as concentrações de Hg somente...
Transcript of DANIEL CABRAL TEIXEIRA - app.uff.br · correlação negativa com as concentrações de Hg somente...
UNIVERSIDADE FEDERAL FLUMINENSE CENTRO DE ESTUDOS GERAIS
INSTITUTO DE QUÍMICA Programa de Pós-Graduação em Geociências
DANIEL CABRAL TEIXEIRA
DEPOSIÇÃO DO MERCÚRIO ATRAVÉS DA SERAPILHEIRA NA
MATA ATLÂNTICA, PARQUE ESTADUAL DA PEDRA BRANCA, RJ
Niterói 2008
DANIEL CABRAL TEIXEIRA
DEPOSIÇÃO DO MERCÚRIO ATRAVÉS DA SERAPILHEIRA NA
MATA ATLÂNTICA, PARQUE ESTADUAL DA PEDRA BRANCA, RJ
Dissertação apresentada ao Curso de Pós-Graduação em Geociências da Universidade Federal Fluminense, como requisito parcial para obtenção do Grau de Mestre. Área de Concentração: Geoquímica Ambiental.
Orientador: Emmanoel Vieira da Silva Filho
Co-orientador: Rogério Ribeiro de Oliveira
NITERÓI
2008
T2661 Teixeira, Daniel Cabral Deposição do mercúrio através da serapilheira na Mata Atlântica, Parque Estadual da Pedra Branca, RJ. / Daniel Cabral Teixeira – Niterói: [s.n.], 2008. 85 f.: il., color., 30 cm. Dissertação (mestrado)-Universidade Federal Fluminense, 2008. Orientador: Prof. Dr. Emmanoel Vieira da Silva Filho; co-orientador: Prof. Dr. Rogério Ribeiro de Oliveira. 1. Deposição atmosférica 2. Floresta Tropical 3. Mercúrio 4. Mata Atlântica 5. Tese 6. Produção intelectual I. Título. CDD 551.51
DANIEL CABRAL TEIXEIRA
DEPOSIÇÃO DO MERCÚRIO ATRAVÉS DA SERAPILHEIRA NA MATA
ATLÂNTICA, PARQUE ESTADUAL DA PEDRA BRANCA, RJ
Dissertação apresentada ao Curso de Pós-Graduação em Geociências da Universidade Federal Fluminense, como requisito parcial para obtenção do Grau de Mestre. Área de Concentração: Geoquímica Ambiental.
Aprovado em ___/____/ 2008.
BANCA EXAMINADORA
______________________________________________________________________
Prof. Dr. : EMMANOEL VIEIRA DA SILVA FILHO – Orientador – PPG
UFF
______________________________________________________________________ Prof. Dr. ROGÉRIO RIBEIRO DE OLIVEIRA– Co-Orientador –
PUC-RJ
______________________________________________________________________ Prof. Dr. WILLIAM ZAMBONI DE MELLO– PPG
UFF
______________________________________________________________________ Prof. Dr. RENATO CAMPELLO CORDEIRO – PPG
UFF
_____________________________________________________________________ Profa Dra.DORA MARIA VILLELA JOSÉ– PPGERN
UENF
Niterói 2008
AGRADECIMENTOS
A Deus,
A minha amada companheira Mariana, sempre tão incentivadora em todos os momentos
dessa dissertação e à nossa pequena Lia, pela descontração e motivação durante o período
desse trabalho.
Aos meus pais, pelo cuidado e suporte, sempre.
Ao professor Emmanoel Vieira da Silva Filho, pela confiança e a atenção dedicadas a mim e
à todas as portas que ele abriu.
Ao professor Rogério Ribeiro de Oliveira, pela enorme ajuda em campo e com a dissertação.
Aos amigos Max e Rita, pelo auxílio em campo nesses dois anos.
A todos os meus amigos e familiares, pelas idéias, críticas e concretização dos ideais desse
trabalho.
A todos os funcionários da UFF e aos colegas de curso que dividiram um ambiente agradável
e construtivo nesse tempo.
RESUMO A Mata Atlântica, um hotspot mundial com grande diversidade de plantas e animais,
está localizado na região mais industrializada do Brasil, uma fonte em potencial de elementos
químicos para a atmosfera. Recentemente, foi descrito a entrada de Hg via serapilheira para o
solo principalmente, após a captação estomática (poros foliares), agindo como via importante
para o transporte deste poluente do ar para o solo durante o seu ciclo biogeoquímico. Este
fluxo de mercúrio é mais evidente em florestas tropicais, que apresentam as maiores
produções de serapilheira. O objetivo deste trabalho foi quantificar a concentração total do Hg
na serapilheira, e estimar sua deposição no Parque Estadual da Pedra Branca, na cidade do
Rio de Janeiro, durante o período de um ano. Foram analizadas, folhas de cinco espécies
dominantes, para se avaliar a concentração de Hg nas folhas do dossel e testar as correlações
com os parâmetros anatômicos foliares, tais como as freqüências estomáticas e tricomáticas.
A média anual da concentração de Hg foi de 237+ 52 ng g-1 e o fluxo de 184 + 98 µg m-2
sobre uma produção de serapilheira de 7,6 t.ha-1. A concentração mensal de Hg variou de
acordo com a temperatura de dois meses anteriores. A precipitação mensal teve uma forte
correlação negativa com as concentrações de Hg somente durante os meses de altas
temperaturas. Estas correlações confirmam a dependência com os eventos fisiológicos,
controlados por processos bioquímicos que definem a abertura estomática, sendo mais
eficiente durante altas temperaturas e solo sem deficiência hídrica. A concentração de Hg na
folhagem do dossel revelou uma grande variação interespecífica de 60 ng g-1 em Metternichia
príncipes; 84 ng g-1em Colubrina. glandulosa; 170 ng g-1 em Cordia trichotoma; 190 ng g-1
em Piptadenia gonoacantha; até 215 ng g-1 em Alchornea iricurana.. Uma correlação positiva
ocorreu entre as concentrações de Hg e a densidade estomática, exceto pelas espécies com
tricomas, demonstrando mais uma evidência da captação estomática e possível papel da
adsorção superficial dos tricomas. Estes valores elevados, mesmo para áreas urbanas poluídas,
mostram a complexidade dos fenômenos climáticos e fisiológicos que regem a captação de
Hg em florestas tropicais. Esta captação potencial da Mata Atlântica deve ser considerada
para sua conservação e preservação, uma vez que o destino do Hg, vindo da serapilheira, no
solo é desconhecido. Devido ao status de poluente global do Hg, o desenvolvimento de leis
internacionais para emissões atmosféricas de Hg, é crucial. .
PALAVRAS-CHAVE: Deposição Atmosférica, Floresta Tropical, Mercúrio, Mata Atlântica
ABSTRACT
The Atlantic Forest, a hotspot in the world with a great diversity of plants and animals,
is located in the most industrialized region of Brazil, a potential source of chemical elements
for the atmosphere. Recently, was described the Hg litterfall input to the soil mainly, after the
stomatal (leaf pores) uptake, acting as an important way to transport this pollutant from air to
soil. This flux of mercury is more notable in tropical forests, which have the higher annual
litter production. The aim of this work was quantify the total concentration of Hg in litterfall,
and estimate how much was deposited in the Parque Estadual da Pedra Branca, na cidade do
Rio de Janeiro. Leaves of the five most predominant species were analyzed to assess the Hg
concentrations by canopy leaves and test the correlations with foliar anatomical parameters,
such as stomatal and trichomatic frequency. The annual mean of Hg concentration was 237,
7+ 52 ng g-1 and the flux was 184, 2 + 98 µg m-2 over a 7,6 t.ha-1 of litter production. The
past two months temperature was correlated to the monthly concentration deviation, showing
the relation with biochemistry process ruling the plant growing. The monthly precipitation
had a strong negative correlation with the Hg concentrations of the higher temperature
months. These correlations confirm the dependency on physiological events, controlled by
biochemistry processes that rule the stomatal opening, being optimal during high temperatures
and soil with no water deficiency. The green foliage Hg concentration revealed a great
interespecific variation, from 60 ng g-1 - Metternichia principes, 84 ng g-1 - Colubrina.
glandulosa,170 ng g-1 - Cordia trichotoma, 190 ng g-1 - Piptadenia gonoacantha to 215 ng g-1 -
Alchornea iricurana. There was a clear positive correlation between these concentrations and
the stomatal density of these species, except by the species with trichomes, showing one more
evidence of the stomatal uptake and the superficial trichomes adsorption roles. These results
are very high even to a polluted urban area, and show the complexity of phenological and
climatic phenomena that rules the Hg uptake in tropical forests. This potential uptake of Mata
Atlantica must be considered for their conservation and preservation, once the Hg soil
destination came from litter, is unknown. Due to the global Hg pollutant status, the
development of international laws, to Hg air emissions, is crucial.
KEYWORDS: Atmospheric Deposition, Tropical Rainforest, Mercury, Trace Element,
Atlantic Florest
SUMÁRIO
1 INTRODUÇÃO............................................................................................................8 . 1.1 APRESENTAÇÃO DO TEMA:....................................................................................8
1.2 BASE TEÓRICA:..........................................................................................................9
1.2.1 O mercúrio: características gerais ............................................................................9
1.2.2 A ciclagem biogeoquímica do mercúrio....................................................................11
1.2.3 A ciclagem do mercúrio em ecossistemas florestais.................................................12
1.2.4 A transferência do mercúrio nas interfaces atmosfera/fitosfera/litosfera.............14
1.2.5 O ecossistema florestal e a poluição atmosférica......................................................16
1.2.6 A fisiologia vegetal e a produção da serapilheira.....................................................23
1.2.7 A transpiração e a abertura estomática....................................................................24 .
2 JUSTIFICATIVA .......................................................................................................27
3 OBJETIVOS................................................................................................................28 ]
4 ÁREA DE ESTUDO ..................................................................................................29 .
5 COLETA DAS AMOSTRAS.....................................................................................34 ..
6 ANÁLISE QUÍMICA.................................................................................................35 .
7 ANÁLISE ESTRUTURAL DA VEGETAÇÃO ......................................................36
7.1 PARÂMETROS ANATÔMICOS............................................................................... 36
8 PARÂMETROS CLIMÁTICOS...............................................................................37
9 RESULTADOS E DISCUSSÃO................................................................................38
9.1 O FLUXO DE SERAPILHEIRA .................................................................................38
9.2 A CONCENTRAÇÃO DE MERCÚRIO NA SERAPILHEIRA.................................40
9.3 O FLUXO DE MERCÚRIO NA SERAPILHEIRA ....................................................45
9.4 CORRELAÇÕES CLIMÁTICAS.................................................................................52
9.4.1 Temperatura................................................................................................................52
9.4.2 Precipitação..................................................................................................................54
9.4.3 Ventos...........................................................................................................................55
9.5 EFEITOS ECOLÓGICOS DO FLUXO DE SERAPILHEIRA NO CICLO DO MERCÚRIO........................................................................................................................57
9.6 O MERCÚRIO FOLIAR EM CINCO ESPÉCIES REPRESENTATIVAS DO PEPB...................................................................................................................................62
9.7 O MERCÚRIO FOLIAR E OS PARÂMETROS ANATÔMICOS..................................65 9.8 POSSÍVEIS FONTES LOCAIS DE MERCÚRIO.......................................................69 10 CONCLUSÃO.............................................................................................................74
11 REFERÊNCIAS .........................................................................................................76
1 INTRODUÇÃO 1.1 APRESENTAÇÃO DO TEMA
Recentemente, foi descrita para as zonas temperadas e boreais, a importância dos
biomas florestais na ciclagem atmosfera/solo do mercúrio (Hg) elementar, através da captação
foliar e posterior transferência pela serapilheira ao solo (ERICKSEN et al., 2003; FLECK et
al., 1999; GRIGAL, 2002; LINDBERG et al., 1991; REA et al., 2002; ST-LOUIS et al.,
2001). No entanto, há carência deste tipo de pesquisa para o bioma de maior produtividade de
serapilheira do mundo: a Floresta Tropical. Este trabalho tem como meta estimar a quantidade
total de Hg0 na serapilheira coletada durante dois anos na Floresta Ombrófila Densa
Submontana da Mata Atlântica (VELOSO et al., 1991) no bairro do Camorim, dentro dos
limites do parque Estadual da Pedra Branca no município do Rio de Janeiro, RJ. Esta área
vive atualmente um franco processo de desenvolvimento das atividades urbanas em seu
entorno e de expansão da degradação no ecossistema florestal. O crescimento da malha
urbana, as cunhas de desmatamento que adentram suas bordas florestais e a expansão das
atividades agrícolas em suas encostas imprimem hoje na paisagem as modificações do arranjo
espacial de seus elementos e definem, assim, sua nova dinâmica geoecológica (SILVA et al.,
2003). Dentre os valores de deposição de Hg presentes na serapilheira dos ecossistemas
mundiais, altas concentrações são encontradas especificamente na Mata Atlântica (FOSTIER
et al., 2003; OLIVEIRA et al., 2006; SILVA-FILHO et al., 2006).. Porém, como ainda são
poucas as publicações, este trabalho vem acrescentar dados a esta discussão ecológica.
Pretende-se testar possíveis correlações com parâmetros botânicos e meteorológicos, podendo
visualizar se estes justificam a elevada estocagem de Hg na serapilheira.
1.2 BASE TEÓRICA:
1.2.1 O mercúrio: características gerais
Comparativamente a outros metais, o mercúrio é considerado um elemento bastante
peculiar que apresenta características únicas: é o único metal líquido a temperatura ambiente;
único que possui temperatura de ebulição abaixo de 650oC; é quase inerte quimicamente; é o
que possui potencial de ionização mais alto do que qualquer outro elemento eletropositivo
com exceção do Hidrogênio; existe em três formas de oxidação: como Hg0, Hg22+ e Hg2+ e
pode formar amálgamas com vários metais (LIDE; KEHIAIAN, 1994). O mercúrio é
considerado um elemento raro, situado em 16º lugar no conjunto dos elementos conforme sua
abundância na Terra, sendo o cinábrio (HgS) o minério de mercúrio mais difundido na
natureza. Suas reservas naturais são avaliadas em cerca de 30 bilhões de toneladas
(MAGARELLI, 2006).
As principais jazidas de cinábrio são encontradas na Espanha e na Itália. A mina de
Almadén na Espanha opera de forma contínua desde 400 a.C, e outras importantes jazidas
podem ser encontradas na Rússia, América do Norte entre outras. O mercúrio é mobilizado
tectonicamente, e significantes depósitos são encontrados em regiões caracterizadas pelo
encontro de placas tectônicas (SCHLUTER, 2000).
Além disso, este elemento se relaciona bem com o enxofre (calcófilo), e é ativo
biologicamente. O Hg não é um bom condutor de calor em comparação a outros metais mas é
condutor de eletricidade, e mistura-se facilmente com muitos metais, tais como o ouro, a
prata, e estanho, formando ligas chamadas de amálgamas. A facilidade do Hg amalgamar com
ouro possibilita o seu uso na recuperação do ouro de seus minérios. Os sais mais importantes
formados pelo mercúrio são o cloreto mercúrico HgCl2 (um veneno poderoso), o cloreto
mercuroso Hg2CI2 (calomelano, ainda usado ocasionalmente na medicina), o fulminato de
mercúrio Hg(ONC)2 (um detonador usado nos explosivos), e sulfeto mercúrico (HgS), um
pigmento usado em tintas (ALMEIDA, 2005).
O mercúrio e alguns de seus compostos apresentam uma pressão de vapor
relativamente elevada, interferindo no estado físico predominante deste na superfície terrestre.
As características físico-químicas conferem ao mercúrio uma aplicabilidade variada em
diversos ramos da indústria. Como por exemplo, o catodo de mercúrio de células eletrolíticas
usadas para produção de cloro e soda cáustica, que nos dias de hoje, vêm sendo banida das
indústrias. As baterias de células secas desenvolvidas durante a Segunda Guerra Mundial
levou a um grande uso do metal em baterias alcalinas até recentemente. O mercúrio foi
essencial para o desenvolvimento de lâmpadas incandescentes por Thomas Edison e hoje é o
componente principal de lâmpadas fluorescentes. Compostos organo-metálicos foram
amplamente empregados como fungicidas na agricultura e na fabricação de tintas
(NRIAGU,1979). Porém os danos ambientais do uso do Hg foram ignorados. O
metilmercúrio (MeHg), por exemplo, é o mais tóxico dos alquil-mercuriais, e constitui o mais
importante composto à base de mercúrio com relação à eficiência na contaminação do meio
ambiente devido ao processo de biometilação, uma vez que o mercúrio inorgânico pode ser
metilado por bactérias sulfo-redutoras no ambiente aquático, ou no solo enxarcado de
florestas tropicais por exemplo. Segundo Grigal (2003), as observações do aumento das
concentrações de MeHg próximas à superfície do solo, no verão, e em associação com o fluxo
do MeHg em charcos são consistentes com a sulfo-redução das bactérias. Além das altas
concentrações de MeHg que seguem as inundações de reservatórios, presumivelmente
estimulada pela decomposição da matéria orgânica inundada. Logo pela incorporação deste
MeHg a níveis tróficos superiores ocorre sua disseminação, sendo acumulado no predador a
soma de todas as concentrações de cada uma de suas presas, o que se denomina
biomagnificação. Um predador de alta ordem trófica absorveria todo o metilmercúrio
acumulado desde os produtores primários até sua presa.
A exposição a esta espécie de mercúrio acontece principalmente através do consumo
de peixes e derivados (FITZGERALD; CLARKSON, 1991). Indíos brasileiros apresentam
altos índices de Hg em sua biomassa (SANTOS et al., 2001) A contaminação patológica por
metilmercúrio é conhecida como "doença de Minamata".
Entre 1950 e 1975, a liberação de grande quantidade de metilmercúrio por indústrias,
provocou severos efeitos e muitas mortes em Minamata e Niigata, no Japão. A tragédia
japonesa resultou do consumo de peixes contaminados por metilmercúrio liberados por uma
fábrica de acetaldeido. O metilmercúrio foi sintetizado como um sub-produto da produção do
acetaldeido, quando mercúrio inorgânico era usado como catalisador. Outro grande incidente
ocorreu no Iraque, cuja a fonte de contaminação foram os pães contaminados, produzidos com
trigo tratado com fungicida a base de metilmercúrio (BAKIR, 1973). Nos dias de hoje, em
muitos países as emissões industriais são controladas por leis ambientais severas. Contudo,
em escala global, o declínio da emissão não pode ser notado, pelo contrário, tem sido
documentado o aumento nas emissões antrópicas de mercúrio das nações em
desenvolvimento, particularmente na Ásia (PACYNA; PACYNA 2002, WHO 2000), que
mantiveram em alta as emissões globais. As emissões de mercúrio associadas à queima de
combustíveis fósseis, especialmente a queima de carvão mineral, e processos de combustões a
altas temperaturas (ex.incineradores de lixo) representam fontes primárias de poluição por
mercúrio em escala global. Em consequência, as emissões de mercúrio desde meados do
século XIX parecem estar relacionadas diretamente com aumentos nas emissões de CO2
(LAMBORG 2000), já que é emitido para atmosfera durante a combustão de materiais
associados. Alguns combustíveis fosseis, como o carvão mineral, possue quantidades
variáveis de Hg em sua composição, assim como, o lixo urbano. Nriagu; Pacyna (1988)
estimaram que em 1983 em todo o planeta, mais da metade da emissão atmosférica de Hg
produzida pelo homem, derivou da queima de carvão mineral e da incineração de lixo urbano.
1.2.2 A ciclagem biogeoquímica do mercúrio
O mercúrio é um elemento natural, assim não pode ser criado ou destruído, e a mesma
quantidade que existe nos dias atuais no planeta existia desde que a terra foi formada, a
exemplo de numerosos elementos. Várias pesquisas indicam que atividades naturais e
antrópicas podem redistribuir este elemento nos ecossistemas terrestres, atmosféricos e
aquáticos com uma combinação complexa de transformações e transporte (ALMEIDA, 2005).
O mercúrio atmosférico, por exemplo, é muito significativo para o ciclo global do mercúrio.
O estoque do mercúrio na atmosfera varia em função das trocas deste metal entre a as
camadas atmosféricas e diferentes superfícies encontradas no meio ambiente (solo, vegetação
e água). A deposição úmida de Hg2+ (dissolvido) e a deposição seca de Hg particulado são
consideradas processos de transferência do Hg da atmosfera para os compartimentos
terrestres. No caso do mercúrio elementar, pode haver um fluxo bidirecional entre atmosfera e
as superfícies terrestres (água/atmosfera, solos/atmosfera e vegetação/atmosfera) como mostra
a figura 1.
Devido a algumas de suas propriedades tais como baixa reatividade, alta pressão de
vapor e baixa solubilidade em água, o Hg0 apresenta um tempo de residência na atmosfera da
ordem de um ano, facilitando a sua distribuição e deposição numa escala global, razão pela
qual foi desenvolvido o conceito de “poluente global” para esse elemento (SCHROEDER;
MUNTHE, 1998).
FIGURA 1 - Ciclo do mercúrio e suas espécies químicas. Adaptado de Mason et al.(1994)
Desde a Revolução Industrial, pelas suas propriedades físico-químicas (massa
específica elevada, resistência elétrica baixa, volume de expansão constante), o mercúrio foi
largamente empregado na indústria, e como resultado de seus usos, a quantidade de mercúrio
mobilizada e liberada na atmosfera aumentou em comparação aos níveis pré-industriais
(FITZGERALD et al., 1998), estando correlacionado com as emissões antrópicas de CO2. O
Hg aumentou 1,5 a 3 vezes sua deposição atmosférica em escala global, desde os tempos pré-
industriais e de 2 a 10 vezes a deposição atmosférica próximo a locais industrializados nas
últimas duas décadas (BERGAN et al.,1999;). Estima-se que atualmente 50-75% (US-EPA,
1997) de todo o aporte anual de Hg da atmosfera, venha de origem humana, já que não há
grandes eventos desgaseificantes acontecendo na crosta terrestre que justifiquem grandes
fontes naturais, como das erupções vulcânicas.
1.2.3 A ciclagem do mercúrio em ecossistemas florestais
A ciclagem biogeoquímica de um dado ecossistema consiste na movimentação de
elementos químicos entre seus compartimentos e nas transferências entre o próprio
ecossistema e os outros ecossistemas. Os compartimentos e/ou sistemas inorgânicos e/ou
orgânicos estão interligados nesses processos de movimentação; assim, os elementos são
continuamente transferidos entre os compartimentos bióticos e os abióticos (POGGIANI et
al., 2000).
A ciclagem em ecossistemas florestais, por tanto, abrange as trocas de elementos
químicos entre os seres vivos e o ambiente que os circunda. A relação entre a vegetação, a
atmosfera e o solo é um dos focos de estudo desta ciclagem. Os ciclos biogeoquímicos em
florestas integram a interface solo/atmosfera de diversos elementos, e em alguns campos estão
sendo amplamente estudados, utilizados na agronomia moderna na nutrição foliar
(RODRIGUES et al., 1997) e justificados na base do manejo agroflorestal nos trópicos
(ARATO et al., 2003). A partir da análise quantitativa do estoque dos elementos na biomassa
podem-se detectar, inclusive, distúrbios de origem natural ou antrópica de determinado
elemento (DE FRANÇA et al., 2004). Desse modo, o dossel das árvores atua como um
sorvedouro de elementos traços, concentrando-os e futuramente transferindo ao solo com a
deposição da serapilheira. Em geral, elementos-traço que não se caracterizam como nutrientes
vegetais não possuem carreadores bioquímicos específicos, limitando-se ao tecido vegetal de
contato. O mercúrio, por exemplo, quando o seu aporte ocorre via atmosfera (BISHOP et al.,
1998) adere-se ao epitélio superficial ou é absorvido pelas células da câmara estomática e não
é expressivamente translocado no interior do vegetal, o mesmo acontecendo quando a entrada
ocorre pela raiz (COCKING et al., 1995), com níveis de concentração foliar significantes
somente quando, em solos contaminados (ELLIS et al., 1997) ou perto de minas de cinábrio
(HgS).
Esta ciclagem envolve poluentes globais como o mercúrio, que por ter baixa pressão
gasosa pode ser transportado na atmosfera a grandes distâncias, até milhares de quilômetros
de sua origem (SCHROEDER; MUNTHE, 1998). Sua deposição atmosférica em áreas
florestais pode representar um importante sumidouro local no ciclo biogeoquímico deste
elemento. Além disso, por ser um poluente global, o efeito deste seqüestro poderia afetar
valores de background regionais e até globais.
A concentração de Hg encontrada na serapilheira (litterfall) é maior do que a
concentração obtida na transprecipitação, (troughfall - chuva que escoa pelo dossel em
direção ao chão depois de ter lavado superfícies de folhas e galhos) e bem maior que a
deposição pela chuva direta ao solo (openfall) (GRIGAL, 2002). Um exemplo do papel
amplificador, que as folhas vivas representam em transmitir o Hg para o solo, é ilustrado em
uma floresta em Gardsjon, na Suécia. Neste tipo florestal a deposição de Hg através da chuva
direta foi de 12µg m-2ano-1 e aproximadamente 40µg m-2ano-1 de transprecipitação (17-19µg
m-2ano-1) mais serapilheira (25µg m-2ano-1) (IVERFELDT, 1991).
O aporte de Hg pela serapilheira ao horizonte O é diretamente proporcional à
quantidade de serapilheira produzida (SILVA-FILHO et al., 2006), e esta deposição por sua
vez, está relacionada principalmente com o clima, sendo menor sua deposição nas regiões
frias do que em regiões quentes (POGGIANI et al., 2000).
Outro fator importante na quantidade de Hg na serapilheira são os valores distintos
encontrados da análise entre as espécies vegetais (MÉLIÈRES et al., 2003), variando perto de
32–114 ng g_1 (n=11), este fato pode estar associado com o período de vida foliar, estado
fisiológico da planta e com características morfológicas como tricomas, ceras epicuticulares e
densidade/condutividade estomática de cada espécie (SILVA-FILHO et al., 2006). Assim,
existe uma aparente relação positiva entre alta diversidade ecofisiológica das espécies e as
altas concentrações de Hg nas florestas tropicais, em contrapartida à baixa diversidade e
concentração encontrada nas florestas temperadas e boreais, mesmo com níveis semelhantes
de mercúrio atmosférico.
1.2.4 A transferência do mercúrio nas interfaces atmosfera/fitosfera/litosfera
As forças físico-químicas que limitam a dinâmica da transpiração estomática são as
mesmas que por conseqüência regem a entrada de CO2 e outros gases pra o interior da planta.
É através de um sistema Ar-Planta-Solo que ocorre o controle do fluxo de gases (inclusive
vapor d´água) e seiva dentro da planta e a atmosfera. A teoria mais aceita da elevação de água
das raízes até o topo do dossel é a teoria da coesão-tensão (KOZLOWSKI; PALLARDY,
1997) que propõe a transpiração como sendo a força motriz. A diferença de potencial hídrico
entre a atmosfera e o solo seriam suficientes para elevar 10 metros ou mais. Para tanto as
plantas dispõem dos poros estomáticos, aberturas sediadas nos estômatos das folhas, estando
sob influência em sua estrutura, frequência e função de fatores genéticos e/ou ambientais. As
estruturas dos complexos estomáticos são características genéticas e podem ser usadas para
distinções taxonômicas, por exemplo. Outros fatores que interferem na dinâmica de abertura
dos estômatos são a quantidade e qualidade da radiação incidente, a temperatura, o vento, a
nutrição, a umidade e a disponibilidade de água no solo (LARCHER, 2000). A exposição a
níveis elevados de CO2 além de causar fechamento dos estômatos, diminui a freqüência
estomática de futuras folhas no mesmo indivíduo.
As florestas ombrófilas tropicais mantêm um dossel fechado e compartimentalizado
diferindo do padrão de comportamento de parâmetros micro-climáticos encontrados ao redor
de folhas no mesmo indivíduo, e no interior da floresta. Almeida (2005), em um trabalho com
fluxo de Hg na Amazônia, aponta para as diferenças refletidas no comportamento atmosférico
do mercúrio em microclimas específicos. Mostrou que a concentração atmosférica no interior
do dossel é menor do que em áreas abertas. Na literatura há alguns trabalhos que
correlacionam as concentrações foliares de Hg com fatores climáticos, porém somente foi
abordada a temperatura e a pluviosidade (SILVA-FILHO et al;. 2006). Fatores da biota e de
micro-clima ainda são pouco relacionados, havendo somente trabalhos que medem o fluxo de
Hg entre folha e atmosfera dentro de câmaras fechadas com alguns parâmetros controlados
(GRAYDON et al.,2006; MILLHOLLEN et al., 2006a)
A hipótese mais aceita é que a entrada de Hg nas folhas ocorre pelos estômatos, cerca
de 50-80% de todo o aporte de Hg atmosférico na área florestal é derivado deste mecanismo
(Figura 2) (REA et al., 2001; SCHWESIG; KREBS, 2003; ST-LOUIS et al., 2001). As vias
de entrada cuticulares e seiva acima (raíz-folhas) são desprezíveis (BISHOP et al, 1998; ST-
LOUIS et al, 2001), sendo desconsideradas também neste estudo. Apesar disso, valores de
fluxo bidirecionais são encontrados nas câmaras de teste, indicando que o Hg é
constantemente adsorvido e re-emitido da folha (HANSON et al., 1995; MILLHOLLEN et
al., 2006).
Com relação ao seqüestro de Hg, é sugerido um ponto de compensação (HANSON;
LINDBERG, 1995). Cada espécie vegetal sorveria Hg quando sua concentração estivesse
acima do ponto de compensação (um valor atmosférico de Hg específico para cada espécie
vegetal), ou, cederia para o ambiente quando houvesse taxas menores do que o seu ponto ou
ainda, dentro dos limites do ponto de compensação, haveria uma faixa de Hg atmosférico
onde o balanço da troca seria neutro.
Por outro lado, Millhollen e colaboradores (2006b) apontam para a possibilidade de
todos os sítios de adsorção nas folhas ficarem saturados acima de 10 ng.m-3 de exposição ao
Hg0. Esses fatores, sem desconsiderar a difusibilidade dos gases no interior do tecido vegetal
e o movimento estomático, evidenciam uma faixa estreita para a absorção. Ou seja, quanto
menor o ponto de compensação e maior o de saturação, maior será o intervalo de captura,
onde estariam as plantas com alto poder seqüestrador, resultando num balanço final positivo
entre a captura e a evasão, acarretando em acúmulo crescente ao longo do tempo (GRIGAL,
2002). Logo o fluxo de Hg na serapilheira deverá variar segundo o clima, fator limitante do
estado ecofisiológico da floresta, proveniente de uma longa adaptação aos nutrientes
disponíveis.
FIGURA 2 - Esquema mostrando as diversas vias do Hg no dossel
(adaptado de ST.-LOUIS et al., 2001)
1.2.5. O ecossistema florestal e a poluição atmosférica
Na Mata Atlântica do Sudeste brasileiro é significativo o crescimento atingido pela
floresta das encostas voltadas para o oceano, principalmente a face voltada para o Sul
(OLIVEIRA et al., 1995). A Mata Atlântica, assim como outras Florestas Tropicais, possui
solos pobres em fito-nutrientes e, depende em parte da entrada destes elementos através da
atmosfera, para seu balanço nutricional (WARING, 1985). A floresta é dependente também
da reciclagem e de outros mecanismos conservadores para manter os nutrientes biodisponíveis
dentro do compartimento florestal, sendo capaz de minimizar a lixiviação constante destes
elementos dos ecossistemas tropicais. Através desta entrada, elementos poluentes ou não são
incorporados como Br, Ca, Co, Cs, Hg, K, Na, Pb, Rb, Sr and Zn (DE FRANÇA et al., 2004;
OLIVEIRA et al., 2006) tanto através da deposição úmida quanto da seca.
As conseqüências da poluição atmosférica nos ecossistemas florestais podem
manifestar-se pela eliminação de espécies sensíveis à contaminação do ar; pela eliminação
seletiva de plantas emergentes; pela redução da produção de biomassa, diminuindo o estoque
de nutrientes disponível no ecossistema, e pela maior incidência de pragas e doenças
(KOZLOWSKI 1980). Dependendo da carga de poluição, a comunidade florestal pode sofrer
grandes alterações na sua estrutura florística, resultando num empobrecimento da
biodiversidade dos ecossistemas, diminuindo os valores de densidade, altura e dominância das
árvores que, em conseqüência, provocam uma diminuição da biomassa aérea e subterrânea
(LIMA, 1980). Esses desdobramentos ocorrem devido à fotossíntese ser o processo
metabólico mais atingido pelos efeitos da poluição atmosférica (INOUE; REISSMANN,
1991)
Os ecossistemas florestais envolvidos em poluição são submetidos às tensões dos
efeitos fitotóxicos diretos dos poluentes do ar, causados pelo aumento dos processos erosivos,
pelo aumento da lixiviação de nutrientes, pela redução do pH, levando a um agravamento dos
processos de degradação do ambiente, o que pode tornar-se um processo irreversível. Na
figura 3, verificam-se as tensões resultantes dos efeitos diretos dos poluentes do ar sobre as
florestas como possíveis tensores:
FIGURA 3 - Esquema das principais alterações provocadas pela poluição do ar na região da
Mata Atlântica, em Cubatão-SP. Adaptado de POMPÉIA, 1998.
Um exemplo de tensor ambiental é a chuva ácida, em que elementos não reativos se
transformam em espécies químicas reativas, acarretando a entrada de uma série de poluentes
atmosféricos. Porém, o Hg foliar é composto em sua maioria por Hg0, disponibilizado pela
deposição seca. Sua passagem pela cutícula da epiderme foliar pode ser composta por
diversas camadas, como mostra a figura 4, existentes na superfície com estruturas químicas e
morfológicas interespecificamente diversas. Já as células da parede da câmara subestomática
são finas facilitando as trocas gasosas (Figuras 5 e 6). Segundo Miller & Mc Bride (1975),
durante os processos de absorção de CO2 e de liberação de vapor de água, na presença de luz,
outros gases presentes próximo à folha serão também absorvidos pelos estômatos.
FIGURA 4: Esquema geral da cutícula. Retirado de: COSTA, 2007.
FIGURA 6 - Interação entre as moléculas dos poluentes gasosos com a folha. Fonte:
Silva-Filho, 1988.
A quantidade de poluentes atmosféricos transferidos para o interior da folha é
controlada por uma série de resistências:
1) atmosférica, sendo alguns dos fatores controladores a velocidade de vento, tamanho e
geometria da folha, difusividade e viscosidade do gás; e segundo Hanson et al. (1995),
no caso do mercúrio, depende inversamente da carga deste elemento na atmosfera. Ou
seja, quanto maior a pressão parcial de Hg no ambiente menor será a resistência
atmosférica para a entrada na folha.
2) estomática, que é regulada pela abertura dos estômatos, sendo influenciada pelo déficit
hídrico, concentração de CO2, estado nutricional da planta, intensidade luminosa e
também pelo déficit de pressão de vapor na atmosfera;
3) mesofílica, regulada pela solubilidade do gás na água, difusão líquida do gás e
metabolismo das folhas (SILVA-FILHO, 1988).
Portanto, um momento ótimo da troca gasosa estomática está nas manhãs ensolaradas
e com suprimento de água abundante, acontece quando a radiação solar incidente na folha
favorece altas taxas de fotossíntese, já que a demanda por CO2 dentro da folha é alta e por isso
o poro estomático permanece amplamente aberto. De noite quando não há fotossíntese e,
portanto, não há demanda por CO2 dentro da folha, a abertura estomática fica pequena ou
fechada. Como demonstrado por Frescholtz e Gustin (2004) em um experimento com câmaras
para análises das trocas gasosas, foram encontrados fluxos próximos a zero durante a noite em
uma espécie de angiosperma do gênero Aspen. Já em uma gimnosperma estudada do gênero
Pinus foram encontrados fluxos presentes, ainda que menores do que os diurnos, mesmo
durante a ausência da fotossíntese, justificado pela disposição e maior eficiência no
fechamento dos estômatos do primeiro grupo. Na maioria das plantas do grupo das
angiospermas os estômatos ficam na parte inferior da folha (abaxial) facilitando sua proteção.
O advento da industrialização tem levado a significantes aumentos na emissão global
de substâncias gasosas (CO, NOx , CH4, etc.) e material particulado atmosférico. A
concentração atmosférica de muitos elementos traços tem sido significativamente afetada por
atividades antropogênicas (AL-MOMANI, 2003), o mercúrio, por exemplo, aumentou 3 vezes
seu nível de background atmosférico devido a fontes antropogênicas, em um período muito
curto, como anteriormente citado (US-EPA, 1997).
Todo esse rápido acréscimo da carga atmosférica de poluentes pode representar,
considerando as devidas proporções, um grande desafio para a biota exposta, principalmente
pelo tempo de vida dos indivíduos de grande porte dos ecossistemas florestais que podem não
acompanhar a velocidade desta mudança atmosférica em seu metabolismo. Como, até agora
não se conhece nenhuma utilidade deste elemento para as plantas e muito provavelmente pela
não abundância deste elemento na natureza e em processos co-evolutivos com a vegetação
(Figura 7), não há via bioquímica de saída exclusiva para ele, produzindo assim acumulação
nas folhas por onde predomina sua entrada. A fotossíntese, ocorrida principalmente nas
folhas, é o principal processo metabólico afetado por contaminação de mercúrio em testes in
vitro e in vivo, porém quantidades muito acima do background foram utilizadas (> 20ppm)
(PATRA; SHARMA, 2000). Os cátions de mercúrio parecem estar intimamente ligados aos
grupos sulfidrilas –SH, presentes em todo o arcabouço de aminoácidos que constituem as
células. Porém, somente a inibição da catalase foi comprovada pela exposição ao vapor de
mercúrio, igualmente em quantidades extremas (PATRA; SHARMA, 2000).
FIGURA 7 - Sistema Biológico dos Elementos construído a partir da correlação de dados da
função fisiológica dos elementos individuais em organismos vivos, do desenvolvimento
evolutivo do ambiente inorgânico e de informações da absorção dos elementos pela planta
(molécula simples ou troca de íons). Os elementos H e Na exercem várias funções no sistema
biológico, por isso não são fixos no sistema. Outros não foram posicionados devido à
ausência de informações. (Fränzle; Markert, 2000 apud De França, 2006.)
As plantas tolerantes bioacumuladoras de mercúrio possuem grande potencial para a
fitoremediação de solos contaminados, inclusive há ensaios bem sucedidos mostrando a
potencialidade de plantas modificadas geneticamente em reduzir Hg(II) para mercúrio
elementar, espécie mais inerte (RUGH et al, 1998).
1.2.6 A fisiologia vegetal e a deposição da serapilheira
A serapilheira é composta pelas partes do vegetal caídas no solo, coletivamente
composta de folhas, galhos e elementos reprodutivos. A queda das folhas por senescência é
um processo controlado pela planta, que ou sazonalmente (decíduas) ou intermitentemente
separa suas folhas do caule, preparando assim o indivíduo para as restrições climáticas de
determinada estação, para as restrições fisiológicas de uma fenofase específica e para o
próprio crescimento do indivíduo. Em caso de estresse hídrico, essa separação também ocorre
evitando perdas excessivas de água. A disponibilidade luminosa também é, responsável pela
reorientação da área de cobertura do dossel, em detrimento de outras partes que se atrofiam. A
separação não natural pode ocorrer devido a ventos muito fortes ou por parasitas e predadores,
porém muito pouco representativo na produção da serapilheira.
Segundo Raven et al (2001), a abscisão das folhas é desencadeada pela inibição da
auxina juntamente com a produção de etileno, um gás fitorregulador (hormônio vegetal) que
desencadeia um processo enzimático responsável pela transferência de elementos,
aminoácidos e carboidratos para outras partes ainda vivas da planta. A formação de um
conjunto de células na base da folha, chamada zona de abscisão é responsável pelo
rompimento desta separando a folha do caule. Isso garante à planta o estoque de alguns
nutrientes importantes e concentra outras moléculas que podem ter relevantes interações
ecológicas com as outras espécies, como por exemplo, através da alelopatia (inibição de
crescimento de outras espécies no solo atingido pela serapilheira) ou do recrutamento de
fauna específica. Esta “maquinaria” florestal pode ser comparada a filtros atmosféricos
descartáveis com área de superfície e peculiaridades anatômicas diversas.
As folhas das árvores das florestas tropicais exibem diferentes características
morfológicas e anatômicas, variando estas formas até entre espécies de um mesmo gênero. As
folhas deste bioma podem exibir um grande número de tricomas (“pêlos foliares”) e outras
estruturas anatômicas em sua epiderme celular. Além disso, podem apresentar rugosidades na
camada mais externa da folha (Figura 4) devido a formação de ceras epicuticulares com
diversas composições químicas. Todas estas peculiaridades influenciam a adsorção e
dessorção de elementos na superfície foliar, ou seja, na concentração total de um elemento por
grama de folha analisada.
Outro ponto que evidencia a contribuição da diversidade dos trópicos sobre os altos
valores de Hg foliar é a correlação positiva entre a concentração de mercúrio e o tempo de
vida das folhas para espécies das zonas temperadas e boreais (MILLHOLLEN, 2006b).
Apesar de não existir estudos em zonas tropicais para esta variação temporal, o mesmo
processo de acúmulo progressivo deve estar acontecendo. Essa absorção foliar é deveras
usada já na agricultura tradicional, principalmente em espécies tropicais onde há mais
densidade de poros nas folhas do que em espécies das zonas temperadas e boreais. Em locais
onde há uma diversidade fenológica interespecífica bem maior como nos trópicos, é provável
que existam também, grandes diferenças entre as concentrações por espécie, já que as folhas
de cada espécie teriam tempos de vida distintos. Portanto, a serapilheira corresponde a um
filtro onde se encontra o registro temporal (aproximadamente de 1 ano nas decíduas e >1 ano
para as não decíduas) do acúmulo de Hg atmosférico referente ao período de vida das folhas
oriundo de um equilíbrio dinâmico da troca gasosa com a atmosfera do fluxo de Hg
estomático.
O monitoramento da dinâmica da serapilheira tem sido um dos métodos mais
utilizados para avaliar a produtividade florestal e o fluxo de Hg por ser um método não
destrutivo e, quando associado a outros dados ecológicos, permite avaliar a resposta da
floresta às alterações ambientais. Na região Sudeste brasileira, estudos da dinâmica da
serapilheira em áreas protegidas de Mata Atlântica com diferentes históricos de uso
reportaram valores de deposição de serapilheira que variam de 6,0 t. ha-1.ano-1 até valores
superiores a 11,0 t. ha-1.ano-1 (ABREU, 2006; CUSTODIO-FILHO et al., 1997; DINIZ;
PAGANO, 1997; MARTINS; RODRIGUES, 1999).
1.2.7. A transpiração e a abertura estomática
A transpiração, também chamada de “mal inevitável”, pode ser extremamente danosa
para uma planta. Isso pode acontecer quando a perda de água excede a absorção, retardando o
crescimento e podendo levar o indivíduo a morte. Porém, além de arrefecer as folhas, deslocar
a seiva com nutrientes e metabólitos e manter uma turgidez ótima onde as células trabalham a
abertura estomática (Figura 8), por onde ocorre parte predominante da transpiração, e é
responsável pela entrada do CO2 na planta, combustível, da fotossíntese. Por isso para a planta
viver ela tem que deslocar água dos solos para a atmosfera (RAVEN et al., 2001). O que
compensa essa perda e otimiza a absorção de CO2 é um complexo sistema fisiológico,
montado sobre um arcabouço genético e morfológico, que responde: ao clima, a
disponibilidade da entrada de nutrientes do solo/ar e a disponibilidade qualitativa e
quantitativa de luz recebida por cada folha do individuo.
FIGURA 8 – Fotomicrografias eletrônicas de um estômato aberto (A) e fechado (B). Retirado
de: RAVEN et al., 2001.
Todos os fatores exógenos e endógenos que afetam a transpiração estão sujeitos a
alterações durante o dia, originando uma periodicidade diurna na taxa a que este processo
ocorre. Para a maior parte das plantas durante a noite a taxa de transpiração é geralmente
baixa, perto de zero, aumentando depois do nascer do sol até atingir um máximo ao meio-dia.
Na parte da tarde a transpiração começa a diminuir até atingir, ao entardecer, os valores
mínimos semelhantes aos da noite.
O crescimento e desenvolvimento de árvores in situ experimentam períodos ocasionais
de stress hídrico dependendo da habilidade do estômato em controlar a perda de água
enquanto mantém o crescimento. Mesmo quando o potencial hídrico das células (a capacidade
que a célula têm para receber a água através de uma gradiente) diminui drasticamente, devido
à perda de turgidez ou diminuição do potencial osmótico, o sistema contínuo de água na
planta permite o fornecimento de água para as células nos locais de evaporação (MEIDNER;
SHERIFF, 1976). A taxa de transpiração pode ser mantida até ser alcançada uma quantia
crítica de umidade do solo (DUNIN; ASTON, 1984), após esse ponto haveria a queda das
taxas de transpiração. Quando o potencial hídrico da folha decresce, a abertura estomática
diminui, reduzindo a transpiração e permitindo que o potencial hídrico foliar se restabeleça. O
potencial hídrico foliar per se não é o transdutor desta resposta estomática perante o estresse
hídrico (GOLLAN et al., 1986; HINCKLEY et al., 1978), mas em geral, normalmente há um
intervalo onde o potencial hídrico foliar varia sem que haja alterações na condutância
estomática. Quando um determinado limite do potencial hídrico é alcançado, a fotossíntese
A B
A B
declina por respostas enzimáticas, a concentração de CO2 interno então aumenta e o estômato
fecha de um modo linear ou curvilíneo até a condutância estomática aproximar-se de zero
(SCHULTE et al., 1987; WANG et al., 1988; DE LÚCIA; HECKATHORN, 1989).
2 JUSTIFICATIVA:
Através deste estudo espera-se contribuir para o conhecimento científico da ciclagem
do Hg nas florestas tropicais, visto que há uma grande carência deste estudo para este bioma,
comparado às pesquisas realizadas em florestas temperadas e boreais. A quantificação do Hg
em serapilheira tropical, por exemplo, foi feita apenas em sete levantamentos, quatro destes
na Floresta Amazônica e apenas três referentes à Mata Atlântica (FOSTIER et al., 2003;
OLIVEIRA et al., 2006; SILVA-FILHO et al., 2006). Assim, espera-se gerar dados para
futuramente se estimar a quantidade de Hg estocada no solo a longo prazo pelo processo
fenológico das florestas tropicais testando possíveis correlações com parâmetros
meteorológicos e botânicos, tais como precipitação, temperatura, densidade estomática e área
foliar, que estariam atuando nas altas taxas de Hg encontradas na serapilheira tropical.
Esta abordagem quantitativa é de suma importância, pois conhecendo o ciclo deste
elemento, e suas vias de entrada, poderá ser avaliada a origem das altas concentrações do Hg
estocado nos solos florestais, que por sua vez, ao ser lixiviado ou erodido o libera para os
cursos d’água onde pode se metilar novamente no sedimento e biomagnificar-se ao longo da
cadeia trófica até chegar no pescado, fonte de alimento humano. O mercúrio também pode ser
liberado em estado gasoso para a atmosfera através das queimadas, que atingem facilmente o
estoque da serapilheira. Logo, o estudo do ciclo do Hg é fundamental para predizer o impacto
potencial sobre os seres humanos, bem como avaliar a qualidade de vida para toda a biota.
Estes dados acrescentam também detalhes à pesquisa de base para a preservação,
conservação e valoração da Mata Atlântica, que é tida como um hotspot (MYERS et al.,
2000), título dado a uma área fortemente ameaçada, com alto grau de endemismo, que abriga
muitas espécies não encontradas em nenhum outro lugar do mundo. Atualmente, dos
1.300.000 km2 que cobriam o território brasileiro pré-colonial, apenas 8% de mata original
pode ser encontrada. Hoje, a maioria dos animais e plantas ameaçados de extinção no Brasil
são encontrados na Mata Atlântica. A situação é agravada pelo fato da região sediar tanto os
centros urbanos mais povoados como os grandes centros industriais e de silvicultura do país.
Aproximadamente 80% do PIB do Brasil são gerados na região da Mata Atlântica, onde
vivem mais de 70% dos 170 milhões de brasileiros. Apesar disso, a Mata Atlântica brasileira
possui uma taxa de biodiversidade relativa mais elevada que a da Amazônia, sua diversidade
de plantas lenhosas pode chegar, em um único hectare, a 454 espécies como no sul da Bahia
(THOMAS et al., 1998). Somente em plantas vasculares, das 20.000 espécies, 8.000 são
endêmicas (MYERS et al., 2000).
3 OBJETIVOS:
• Determinar a concentração de mercúrio elementar na serapilheira durante um ano.
• Estimar o fluxo de mercúrio através da deposição de serapilheira.
• Avaliar também, a influência dos parâmetros climatológicos na concentração de
mercúrio encontrado na serapilheira.
• Analisar a concentração de mercúrio foliar de cinco espécies representativas e testar a
correlação destes valores com parâmetros da anatomia e morfologia gerados também
neste estudo.
• E, realizar o levantamento das possíveis fontes locais de Hg atmosférico, através do
estudo da direção e velocidades dos ventos.
4 ÁREA DE ESTUDO
O Parque Estadual da Pedra Branca (PEPB) está localizado na região Metropolitana do
Rio de Janeiro (Figura 9), que congrega 17 municípios ocupando 11% da área total do Estado
e concentra, numa superfície de pouco menos de 4.690 km2, uma população de 11 milhões de
pessoas, cerca de 70% do Estado, dos quais 54% vivem no município do Rio de Janeiro. Das
regiões metropolitanas existentes no país, a do Rio de Janeiro é a que apresenta a maior
densidade demográfica, aproximadamente 2.285 hab/km2, e é a de maior grau de urbanização,
96,8%, responsável pela geração de cerca de 80% da renda interna do Estado e de 13% da
nacional. É reconhecida como a segunda maior concentração de população, de veículos, de
indústrias e de fontes emissoras de poluentes do país, gerando sérios problemas de poluição
do ar (FEEMA, 2006).
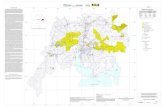
FIGURA 9 – Mapa destacando a Zona Oeste da cidade do Rio de Janeiro, mostrando a área
do PEPB e da are de estudo. Modificado de: OLIVEIRA, 2004
A geologia da região é caracterizada nas partes mais baixas pela presença de ampla
faixa de gnaisse melanocrático, enquanto que nas mais elevadas por granitos de diversos
tipos. O substrato rochoso é superficial e os afloramentos são relativamente comuns. O tipo
climático da região do maciço da Pedra Branca é sub-úmido, com pouco ou nenhum déficit de
água, megatérmico, com calor uniformemente distribuído por todo o ano. A baixada de
Jacarepaguá, onde se encontra a região segundo a classificação de Köppen, acha-se incluída
no tipo Af, ou seja, clima tropical quente e úmido, sem estação seca, com 60 mm de chuvas
no mês mais seco (agosto). Durante o período estudado apresentou 47 mm e 54 mm em julho
e agosto respectivamente. A região, durante novembro de 2005 e outubro de 2006 obteve
pluviosidade de 1.620 mm e a temperatura média anual foi de 23,7 oC.
As matas que revestem o grande anfiteatro montanhoso do Camorim (Figura 10)
fazem parte da Floresta Ombrófila Densa Submontana (VELOSO et al., 1991) e, em termos
legais, encontram-se protegidas pela criação, em 1974, do Parque Estadual da Pedra Branca,
onde se localiza o Pico da Pedra Branca, com 1024 m, ponto culminante do município do Rio
de Janeiro. O que auxiliou fisicamente à sua permanência ao longo dos anos que sucederam a
chegada dos europeus no Brasil com a urbanização da cidade do Rio de Janeiro. Dada à
amplitude de tempo e intensidade de ocupação, muito possivelmente a maior parte destas
florestas tenha tido mais de um uso, pelo menos a partir do período colonial. No entanto, pelo
fato de este trecho da serra do Mar ser constituído por encostas voltadas para o sul, a
recomposição da floresta geralmente se dá em tempo relativamente curto, em função da maior
disponibilidade de água no sistema e do menor grau de insolação (OLIVEIRA et al., 1995).
FIGURA 10 – Fotografia mostrando vista panorâmica do PEPB. Retirado de: CINTRA, 2004
O local de estudos foi uma área de encostas íngremes, com declividade média de 40º,
na vertente sudeste do Pico Itaiaci, na Floresta do Camorim, localizado na zona oeste do
município do Rio de Janeiro. Trata-se de uma floresta secundária com 50 anos
aproximadamente (Figura 11). Na área estudada, a profundidade média do solo é de 50 cm e,
com relação ao conteúdo de nutrientes, podem ser classificados como oligotróficos
(OLIVEIRA et al., 2006). A estrutura da vegetação caracteriza-se por uma área basal
relativamente baixa, de 26,2 m2.ha-1. A área de estudos localiza-se entre os 200 e 300 metros
de altitude, dentro de uma área em forma de anfiteatro que constitui uma das cabeceiras do
Rio Caçambe (PENNA-FIRME et al., 2001). Os perfis de solos levantados por Oliveira e
colaboradores (2004) para a área de estudo revelaram um solo ácido, porém com baixos teores
de alumínio e de acordo com o grau de saturação de bases (valor V), os solos do divisor de
drenagem do Camorim no PEPB, podem ser considerados como distróficos (V < 50%)
(Tabela 1).
FIGURA 11 – Bacia do rio Camorim e localização da área de estudo no vale do rio Caçambe,
maciço da Pedra Branca, Rio de Janeiro. Modificado de Oliveira, 2004.
TABELA 1 – Principais características químicas do solo na área de estudo do Parque Estadual da Pedra Branca (RJ). Médias de quatro repetições feitas com amostras compostas.
pH Al Ca Mg Na K H+Al P S T V N Hg “Oi”
H20 cmolc/dm³ mg/dm³ cmolc/dm³ mg/dm³ cmolc/dm³ % µg/g
4,8 0,17 2,1 0,8 9,5 89 4,7 1,8 3,2 7,9 33,3 1,4 0,19
Fonte: OLIVEIRA et al., 2004.
A análise fitossociológica foi realizada por Solórzano et al. (2005) na área em questão
onde foram empregadas as fórmulas apresentadas por Mueller-Dombois e Ellenberg (1974)
para densidade, freqüência e dominância e valor de importância (VI). A dominância foi
considerada como a área basal ou área da seção do tronco a 1,3 m do solo. A estimativa da
diversidade foi obtida utilizando-se o índice de diversidade de Shannon, descrito em
Magurran (1988). Foi utilizado como critério de inclusão os indivíduos como diâmetro
superior a 5 cm a 1,3 m do solo.
O mesmo autor, em uma área amostral de 2.500m2, registrou 92 espécies arbóreas
subordinadas a 34 famílias, com uma média de altura correspondente a 9 m, com P.A.P. > 15
cm (perímetro à altura do peito) e área basal de 26,2 m2 ha–1. Dez espécies dominaram a
composição florestal (Piptadenia gonoacantha, Cordia trichotoma, Metternichia princeps,
Colubrina glandulosa, Alchornea iricurana, Miconia tristis, Chrysophyllum flexuosum,
Guapira opposita, Senefeldera multiflora e Allophylus sericeus) representando 47,7% de
dominância relativa por espécie (SOLÓRZANO et al., 2005). Estes valores servem como base
para a identificação do Valor de Importância (VI) das espécies presentes. Este parâmetro é
formado pelo somatório dos valores relativos de densidade, freqüência e dominância das
espécies, e estão disponíveis na tabela 2.
TABELA 2 – Parâmetros fitossociológicos das cinco espécies mais bem rankeadas segundo o
valor de importância, amostradas no Parque Estadual da Pedra Branca, Rio de Janeiro (RJ).. N =
número de indivíduos amostrados; DRs = densidade relativa por espécie (%); ABs = área basal da
espécie (m2); DoRs = dominância relativa por espécie (%); FR = freqüência relativa (%); VI =
valor de importância; VC = valor de cobertura.
Familia Espécie N DRs DoRs FR VI VC
Leguminosae Piptadenia gonoacantha (Mart.) J.F.Macbr.
27,0
6,6
19,4
6,0
32,0
26,0
Boraginaceae Cordia trichotoma (Vell.) Arrab. ex. Steud.
25,0
6,1
3,4
3,9
13,5
9,6
Solanaceae Metternichia princeps Mik. 19,0
4,7
3,8
2,5
10,9
8,5
Sterculiaceae Colubrina glandulosa Perkins 17,0
4,2
4,2
2,1
10,5
8,4
Euphorbiaceae Alchornea iricurana Casar. 11,0
2,7
4,2
3,2
10,0
6,9
Valores somados de todas as spp do levantamento 308 100 100 100 300 200
Fonte: Oliveira et al., 2004.
5 – COLETA DAS AMOSTRAS
As amostras de serapilheira foram coletadas quinzenalmente, durante o início de
novembro de 2005 ao final de outubro de 2006, tempo em que permaneceram os coletores em
campo. Os coletores de resíduos florestais foram construídos a partir de caixotes de madeira
com 50 cm de lado, com fundo de tela de polietileno com malha de 2 mm, adaptados de
Proctor (1983). Cada um foi afixado ao solo por meio de estacas, posicionados a 0,7 m do
chão da floresta, sendo utilizados 12 coletores espalhados de forma aleatória pela área
amostral de 5000 m2.
As amostras de serapilheira foram separadas para pesagem do material seco, usando-
se luvas descontaminadas, em folhas, galhos (menores que 2 cm de diâmetro) e materiais
reprodutivos com resíduos (miscelânea de restos vegetais não identificáveis), e mantidas em
estufa a temperatura menor que 60 oC até peso constante. As datas das coletas seguem
discriminadas abaixo:
19/11/2005, 2/12/2005, 17/12/2005, 29/12/2005, 13/1/2006, 27/1/2006, 9/2/2006, 17/3/2006,
10/4/2006, 26/4/2006, 3/6/2006, 19/6/2006, 5/7/2006, 19/7/2006, 9/8/2006, 12/9/2006, 12/10/2006 e
2/11/2006
A partir dos valores de peso seco, foram calculadas as médias mensais em kg/ha da
serapilheira total (serapilheira composta por todas as frações) e de suas frações, como também
seus respectivos desvios. Após pesagem, as frações foram homogeneizadas, e então retiradas
2 gramas de serapilheira total de cada quinzena para mensurar as concentrações de Hg
retirando-se as médias destas para a obtenção da concentração mensal. Para a correção dos
meses em que houveram quinzenas subtraídas por problemas técnicos foram utilizadas as
médias das concentrações da quinzena anterior e posterior a ausente. As folhas vivas também
foram coletadas em duas ocasiões, após período de chuvas em dezembro de 2006 e 2007, para
análises de parâmetros biológicos para correlação com a quantidade de Hg encontrada. A
coleta do material botânico de cada indivíduo amostrado foi realizada utilizando uma tesoura
de alta poda, com 5 m de altura. Quando necessária, para a subida nas árvores foi utilizada a
técnica descrita por Oliveira; Zaú (1995). A identificação das cinco espécies botânicas,
Piptadenia gonoachanta, Metternichia principes, Alchornea iricurana, Cordia trichotoma e
Colubrina glandulosa, foram feitas por Solórzano e colaboradores (2005), por consultas a
especialistas ou por comparação em herbários institucionais, do Jardim Botânico do Rio de
Janeiro e da Universidade Federal do Rio de Janeiro.
6 - ANÁLISE QUÍMICA
A determinação das concentrações totais de Hg foi feita a partir de 1.0g das amostras
secas colocadas em uma bomba de Teflon e a partir de um ataque ácido de 3:1 HCl : HNO3
(LECHLER et al., 1997) a quente em sistema fechado para posterior determinação com um
Espectrofotômetro de Absorção Atômica a Vapor Frio (EAA-VF) para a determinação do Hg,
depois da redução do Hg2+ com SnCl2 (SILVA-FILHO et al., 2006). Brancos analíticos foram
analisados em paralelo às amostras, sempre apresentando um sinal menor do que 0,5 %,
contribuindo para a precisão do método. Para averiguar a exatidão do processo analítico,
amostras de material certificado foram analisadas (NIST SRM 1515 – contituídas por folhas
de macieiras), a média de 92 % foi encontrada para a recuperação das concentrações
certificadas de Hg (n=12).
7 – ANÁLISE ESTRUTURAL DA VEGETAÇÃO
7.1 – PARÂMETROS ANATÔMICOS
As folhas foram coletadas em três plantas de cada uma das cinco espécies com os
maiores Valores de Importância, de ocorrência espontânea em campo. De cada indivíduo
foram coletadas 20 folhas do terço médio do dossel, completamente expandidas. As folhas
foram armazenadas diretamente em FAA (ácido acético + formalina) 50% (KRAUS;
ARDUIM, 1997) e transportadas ao laboratório de anatomia vegetal (LABES) do
Departamento de Biologia Geral da UFF. De cada folha de cada uma das cinco espécies,
foram obtidas duas amostras na região central, com aproximadamente 1cm2, da qual se
contaram os estômatos referentes a uma área de 1mm2 visualizada ao microscópio. Estas
amostras foram utilizadas, para clarificação e contagem dos parâmetros, gerando ao todo 40
observações por espécie.
As amostras foram clarificadas em álcool etílico 70% e branqueadas com solução de
NaOH a 5% e em hipoclorito de sódio durante dois a três minutos. Após essa etapa, as
amostras foram lavadas e desidratadas em série etílica progressiva, coradas com safranina
(1% solução aquosa) e azul-de-astra e montadas em lâminas não permanentes com glicerina e
vedadas com esmalte. Fotomicrografias das epidermes superior e inferior foram feitas em
fotomicroscópio Olympus AX 70 e para a contagem dos estômatos por área e as medidas do
ostíolo foram usados, o microscópio Leitz modelo Diaplan, conectado por placa gráfica de
aquisição de imagem ao software Imaq Vision Builder da National Instruments.
Dessas lâminas foram obtidos o índice estomático, a densidade estomática, o
comprimento do ostíolo e a densidade de tricomas nas superfícies adaxial e abaxial das cinco
espécies observadas. O índice estomático (IE) foi calculado pela razão entre o número de
estômatos e o número total de células da epiderme (número de estômatos + células
epidérmicas) x 100.
8 - PARÂMETROS CLIMÁTICOS
Para verificar a influência da pluviosidade sobre a concentração e fluxo de Hg através
da serapilheira foram utilizados dados de precipitações diárias registrados pela estação
pluviométrica automática localizada no Bairro da Cidade de Deus, que dista
aproximadamente 4 km em linha reta da área amostral e é operada pela Fundação Instituto de
Geotécnica do Município do Rio de Janeiro (GEORIO) (22º58'16''O e 43º22'73''S). Os dados
(atuais e normais climatológicas) de temperatura e direção e velocidade dos ventos, foram
retirados da estação automática de Jacarepaguá que dista aproximadamente 5,5 km da área
amostral e é operada pela FEEMA-RJ (22º59'16''O e 43º22'13''S).
9 - RESULTADOS E DISCUSSÃO
Os resultados referentes à massa de serapilheira depositada mensalmente, massa da
fração folhas e a concentração de Hg na serapilheira da floresta do PEPB, podem ser vistos
aqui resumidos na tabela 3. As análises estatísticas dos dados de todo este trabalho, como
médias, desvio padrão, testes de correlação “r” de Pearson e teste de comparação entre médias
“t” de Student, foram realizadas com o auxílio do software STATISTICA for Windows –
versão 5.1.
TABELA 3 – Médias mensais das deposições de serapilheira, do fluxo de Hg e de sua
concentração foliar encontradas neste estudo.
Massa de serapilheira depositada (t/ha.ano)
[Hg] (ng/g) na
serapilheira total
Massa de Hg depositada na serapilheira (µg/m
2.mês)
Massa de Hg depositada na fração foliar * (µg/m
2.mês)
Nov 4,7 192 7,5 5,2
Dez 6,2 225 11,6 8,6
Jan 7,0 167 9,8 7,6
Fev 7,4 279 17,4 15,5
Mar 11,0 258 23,8 21,9
Abr 9,0 323 24,4 20,3
Mai 3,2 234 6,3 4,3
Jun 2,9 226 5,5 4,1
Jul 4,7 210 8,2 7,2
Ago 10,1 210 17,7 15,4
Set 14,0 192 22,6 19,6
Out 10,3 333 28,9 24,9
Méd. 7,6 237 15,3 12,9
D.P. 3,4 51 8,1 7,5
* estimado a partir da porcentagem da fração folhas sobre a [Hg] da serapilheira total
9.1 O FLUXO DE SERAPILHEIRA
O fluxo total acumulado de serapilheira no período do estudo foi estimado em 7,6 t.ha-
1.ano-1, sendo dividido em: 83,7% folhas, 10,1% galhos, 6,2% elementos reprodutivos mais
resíduos. Em um levantamento feito por Abreu (2005) a média retirada de 16 artigos sobre
deposição de serapilheira em diversas regiões do Sudeste Brasileiro (Tabela 4) apontou para
uma fração de folhas de 68,2% ± 5,5, diferenciando estatisticamente (p=0,01) do encontrado
pelo presente trabalho no período estudado.
TABELA 4 - Média da deposição de serapilheira em 14 áreas de Mata Atlântica no Sudeste do Brasil.
Adaptado de: Abreu et al., 2005.
A produção elevada da fração folhas revela a grande influência deste parâmetro sobre
a deposição total da serapilheira. A fração galhos e elementos reprodutivos contribuiram
significativamente abaixo da média quando comparadas aos valores de outras regiões do
Sudeste brasileiro (Tabela 4). Custódio Filho e colaboradores (1997) consideram que
tempestades poderiam acarretar em maior queda de ramos e elementos reprodutivos. Apesar
de o período estudado ter aproximadamente 30% das chuvas anuais concentradas acima da
faixa dos 50mm diários, o que em um ano com 1620 mm acumulados pode ser considerado
eventos de chuvas fortes. A estrutura e a composição da vegetação são fatores que podem
explicar esta alta produção de folhas na área. Solórzano et al. (2005), estudando a composição
fitossociológica das mesmas áreas amostrais do presente trabalho verificou no divisor de
drenagem a ocorrência de 91 espécies/ha e um índice de Shannon de 3,98, o grande número
de espécies no divisor de drenagem levaria a uma maior diversificação da fisionomia das
copas e folhas, o que se traduziria num melhor aproveitamento da luz na área do divisor de
drenagem e, portanto, numa alta produtividade (JANZEN, 1980; ABREU, 2006).
Os meses com os maiores e menores fluxos foram setembro (1,2 t.ha-1ano-1) e junho
de 2006 (0,2 t.ha-1ano-1) (Figura 12) respectivamente. Se considerarmos a área florestada do
PEPB como a área total do Parque (12.398 ha) teremos aproximadamente 9,4 x 104 t de
serapilheira produzida anualmente por este remanescente florestal da Mata Atlântica.
0
20
40
60
80
100
120
140
nov/0
5
dez/0
5
jan/0
6
fev/0
6
mar/0
6
abr/0
6
mai/0
6
jun/0
6
jul/0
6
ago/0
6
set/0
6
out/0
6d
ep
. sera
pilh
eir
a (
g m
-2)
FIGURA 12 - Variação anual da deposição da serapilheira do PEPB, Rio de Janeiro
9.2 A CONCENTRAÇÃO DE MERCÚRIO NA SERAPILHEIRA
A média anual da concentração de Hg na serapilheira depositada no período de
novembro de 2005 até outubro de 2006 na floresta do Camorim, PEPB, foi de 238+ 52 ng g-1,
tendo como valor mensal mínimo 167 ng g-1 e máximo de 334 ng g-1 (Figura 13), pertencentes
ao mês de janeiro e outubro respectivamente. As maiores concentrações de mercúrio na
serapilheira foram observadas nos meses de fevereiro a abril e em outubro de 2006.
0
50
100
150
200
250
300
350
400
nov/0
5
dez/0
5
jan/0
6
fev/0
6
mar/0
6
abr/0
6
mai/0
6
jun/0
6
jul/0
6
ago/0
6
set/0
6
out/0
6co
ncen
tração
de H
g n
g g
-1
FIGURA 13 – Concentrações de Hg na Serapilheira coletada no PEPB, RJ.
Os valores encontrados para a concentração de Hg na floresta do PEPB são de 2-4
vezes maiores que os encontrados em trabalhos recentes realizados no Hemisfério Norte
(Grigal et al, 2000; Grigal, 2003; Schwesig; Matzner, 2001; St. Louis et al, 2001). Porém em
uma extensa revisão sobre o tema em florestas Boreais e Temperadas do Hemisfério Norte, os
valores do presente estudo estão em 1 ordem de grandeza acima da média das concentrações
de Hg em serapilheira encontradas em 80% das 11 observações realizadas por Grigal (2002).
Quando comparados com os dados das regiões tropicais, os 237,7+ 51,8 ng g-1 encontrados
neste estudo, diferem significativamente dos valores encontrados no sudeste brasileiro
(FOSTIER et al., 2003; OLIVEIRA et al., 2006; SILVA-FILHO et al., 2006) como mostra a
tabela 5. É importante ressaltar que, uma parte desta diferença pode ser creditada à
metodologia de coleta empregada. Esta influência será discutida mais a frente.
Ao compararmos as concentrações de Hg na serapilheira do PEPB na mesma área de
estudo entre 2000/2001 (OLIVEIRA et al., 2006) com os dados do presente trabalho, foi
encontrado com 95% de confiança uma diferença significativa entre as médias através do teste
“t” de student. Logo, duas hipóteses não excludentes são geradas: houve um aumento da carga
atmosférica de Hg na região, juntamente com uma maior eficiência na captura estomática do
Hg por diferenças climáticas. A contribuição da fração folhas também foi ampliada em 20%,
sendo esta a principal fração acumuladora de Hg quando comparada a outras frações (FLECK
et al., 1999; RASMUSSEN, 1991), o que levou a uma maior concentração de mercúrio por
grama de serapilheira. Porém somente considerando esse incremento de biomassa foliar, não
seria suficiente para explicar a diferença entre as médias. Por não haver medidas da carga
atmosférica de Hg na área de estudo, nos respectivos anos dos trabalhos, não podemos estimar
a influência direta da carga atmosférica sobre a concentração destes valores de Hg foliar.
Todavia, tanto a deposição seca do Hg quanto a troca gasosa, são influenciados pelo clima.
Pela análise dos valores de Hg em serapilheira, estimados na mesma área (OLIVEIRA
et al., 2006) e por diversos artigos relatando poluição atmosférica na cidade do Rio de
Janeiro, era esperado valores acima da média para tal parâmetro. Agências governamentais,
em seus relatórios anuais sobre qualidade do ar, apontam para um quadro de poluição do ar
em vários locais deste grande centro urbano (FEEMA, 2006). Outro exemplo é o
levantamento realizado na floresta secundária tardia do Parque Nacional da Tijuca, no qual
Silva-Filho e Ovalle (1984) documentaram a ocorrência de chuva ácida, como conseqüência
da alta carga de poluentes lançados na atmosfera da cidade do Rio de Janeiro. Trindade e
colaboradores (1981) encontraram concentrações de diversos poluentes atmosféricos,
inclusive metais pesados, nas imediações da Floresta da Tijuca que também corroboram para
este quadro de poluição intensa nesta grande Metrópole há décadas. Poucos são os trabalhos
que mensuraram as entradas de Hg em ambientes terrestres nesta região (CINTRA, 2004),
porém, Marins e colaboradores (1996) encontraram valores altos em estudo na Baía de
Sepetiba, à aproximadamente 20 km da área deste estudo, foram encontrados para a
precipitação coletada durante um ano, valores entre 30 ng.L-1 até 164 ng.L-1, resultando numa
deposição média anual total de 76 µg m-2. Estes valores segundo o autor condizem com os
encontrados para outras zonas industrializadas na América do Norte e Europa. Já Cintra
(2004) revela em um estudo mais recente valores extremos de Hg na chuva no período de um
ano, 180 µg m-2. Estas concentrações apontadas aqui representam médias de um grande centro
urbano e industrial, produtor de grande carga atmosférica poluidora, justificando as altas
concentrações de Hg na serapilheira.
A contribuição fisiológica das plantas está indiretamente explícita nas diferenças entre
médias de áreas da Zona Boreal e Temperada, quando comparadas aos valores de áreas
tropicais (Tabela 5). Em latitudes elevadas, mesmo em áreas poluídas (GRIGAL, 2002), não
existem valores de concentração superiores aos encontrados nos trópicos. Mesmo a
concentração de Hg foliar em áreas remotas nos trópicos, como na floresta Amazônica da
Guiana Francesa (MÉLLIÈRES et al., 2003), foi próxima aos maiores valores de Hg
encontrados em florestas temperadas e boreais (Tabela 5).
TABELA 5 - Concentração média e fluxo anual de Hg em diversos ecossistemas florestais.
Tipo florestal Referências ng Hg g-1 µg Hg m-2 ano -1
Floresta Boreal de Coníferas
Schwesig & Matzner, 2001 70 + 20 15
Floresta Boreal Mista St. Louis et al, 2001. 42 + 2,2 12
Floresta Temperada Grigal et al, 2000. 38 + 1,4 12
Floresta Amazônica Roulet et al, 1998. 92 + 13 52*
Floresta Amazônica Mélières et al, 2003. 64 + 14 a 45**
Floresta Amazônica Magarelli, 2006 48 ± 10 43 ± 14*
Mata Atlântica – São Paulo, SP
Fostier et al, 2003 97 72 ± 48*
Mata Atlântica – Cunha, SP
Fostier et al, 2003 70 60 ± 36*
Mata Atlântica – Ilha Grande, RJ
Silva-Filho et al, 2006. 131+ 74 122
Mata Atlântica – Rio de Janeiro, RJ
Oliveira et al, 2006. 170+ 70 128
*estimado a partir de seis meses de coleta ** estimado a partir de um mês de coleta a relativa às folhas vivas do dossel.
Um exemplo da influência climática do ambiente externo da folha sobre o sequestro
de Hg gasoso pode ser ilustrado da seguinte maneira: no período estudado por Oliveira e
colaboradores (2005) no mesmo local, houve apenas 1187 mm de precipitação em 12 meses
enquanto que neste estudo verificamos uma entrada de 1620 mm no mesmo intervalo. O que
pode ter colaborado para um menor stress hídrico, maior produção primária e maior abertura
estomática em períodos pós-chuva no intervalo estudado. Ao mesmo tempo em temperaturas
mais elevadas, haveria uma maior deposição do mercúrio gasoso (SCHROEDER; MUNTHE,
1998), além de uma maior difusibilidade entre as células das folhas neste clima.
Se somente considerarmos os níveis de [Hg] atmosféricos e o fluxo de Hg foliar como
sugerido por Hanson (1995) na estimativa de um ponto de compensação, não haveria grandes
concentrações (MÉLIÈRES et al., 2003; ROULET et al., 1998) em florestas distantes das
áreas urbanas, onde se encontram níveis baixos de Hg na atmosfera. Porém, Graydon (2006)
considera que eventos de deposição apesar de mais raros são muito significativos para o
balanço positivo do seqüestro foliar de Hg. Em contrapartida, o mesmo autor sugere um ponto
de saturação, demonstrando que quando houvesse altas concentrações atmosféricas de Hg,
cessaria o acréscimo, como resposta a saturação dos sítios de ligação para o elemento no
interior do tecido vegetal.
Os desvios padrões relativamente altos (Tabela 6) encontrados nas concentrações de
duplicatas (n=7) das amostras quinzenais (subamostras retiradas da homogeneização
escolhidas aleatoriamente) refletem a dificuldade encontrada na homogeneização (REA;
KEELER, 1996), conseqüência da não completa trituração de partes como vasos xilemáticos e
pecíolos, que diferem negativamente da concentração obtida exclusivamente das lâminas
foliares (MÉLIÈRES et al., 2003). Neste trabalho como obtivemos médias quinzenais, pôde-
se gerar médias mensais mais precisas a partir das médias quinzenais. A partir daí pode-se
avaliar o erro relativo para cada amostra, definido como a diferença entre as concentrações
das duplicatas divididas pela média respectiva, apresentado em porcentagem.
Mata Atlântica – Rio de Janeiro, RJ
Presente estudo 237 +74 184
TABELA 6 – Valores do Erro relativo, a partir de duplicatas das amostras mensais retiradas
da mesma coleta, durante o período de amostragem.
As folhas das espécies florestais, como demonstrado pelas análises de folhas vivas do
dossel, apresentam grandes diferenças em suas concentrações podendo variar entre 32–114 ng
g_1 (n=11) (MÈLIÈRES et al., 2003) na região Amazônica. E em contrapartida, variam entre
13,3 até 49,1 ng g_1 (n=4) para espécies da zona temperada (MILLHOLLEN et al., 2006).
Esse alto desvio encontrado entre as espécies deve-se a alta diversidade de espécies Isso
contribui para uma concentração média na serapilheira com grande variação devido aos
valores discrepantes das espécies produtoras. Como, cada planta sempre-verde, controla a
abscisão de suas folhas em um processo contínuo e complexo variando com a brotação
(FERRAZ et al., 1999) existem concentrações distintas de Hg na serapilheira em
conseqüência do tempo médio de vida das folhas e ainda as diversas características
morfológicas; tricomas, rugosidades e ceras epicuticulares (BOEGER et al., 2004; REA et al.,
2002) que podem variar até mesmo de indivíduo para indivíduo. A presença de espécies
decíduas poderia diluir as concentrações mensais já que estas perante as espécies sempre
verdes, teriam menores níveis de mercúrio (RASMUSSEN et al., 1991). Outro fator
importante a ser lembrado quando discutimos concentrações de mercúrio em folhas de plantas
decíduas, é o de que a serrapilheira possui concentrações maiores que as folhas vivas do
dossel (REA et al., 2001). A translocação dos compostos químicos dentro da folha antes de
sua queda (REA et al., 2002), faz com que se concentrem elementos não essenciais para as
Duplicata referente a coleta do dia: [Hg] ng. g
-1
Diferença entre duplicatas Erro relativo
a
3/1/2006 212,4 35 18%
177,4
27/1/2006 127,5 25 18%
152, 5
26/4/2006 467,5 110 27%
357,5
3/6/2006 222,4 95 54%
127,5
19/6/2006 327,5 55 18%
272,4
19/7/2006 247,5 75 36%
172,5
12/9/2006 207,5 30 16%
177,5
Média do erro relativo 27% Desv. padrão do erro 14%
plantas na massa foliar, como o mercúrio, já que há a retirada de elementos essenciais devido
a essa translocação. O acúmulo superficial de Hg no período entre coletas, descrito por Rea e
colaboradores (1996) onde, as amostras ficaram em campo durante o intervalo de dois meses,
poderia justificar valores mais elevados. Evidenciando, por tanto, a importância da maior
freqüência das coletas para os estudos de análise quantitativa de elementos na serapilheira.
Porém, neste trabalho, a serapilheira permaneceu no máximo duas semanas em campo.
Estas elevadas concentrações refletem uma possível maior captura de Hg via
estômatos pelas plantas tropicais, já que esta é a principal via de entrada de Hg nas folhas
(ERICKSEN et al., 2003; GRIGAL, 2002; St.-LOUIS et al., 2001) e a floresta tem uma área
de superfície porosa (relativa aos estômatos) quase 3 vezes maior do que das florestas
temperadas e boreais (LARCHER, 2000). Outro ponto que corrobora para essa diferença, na
média das concentrações entre latitudes, é a disponibilidade do mercúrio oriundo da deposição
seca, que como visto na literatura (LINDBERG et al, 1991), correlaciona-se positivamente
com a temperatura, sendo este input responsável por 70% - 80% do Hg que entra no sistema
florestal via atmosfera (REA, 1999).
9.3 O FLUXO DE MERCÚRIO NA SERAPILHEIRA
Para a determinação do fluxo foram utilizados os valores mensais da concentração de
Hg na serapilheira total e os da deposição da serapilheira total do mesmo período. A média do
fluxo mensal foi de 15,3 µg m-2, tendo como valor mínimo 5,6 µg m-2 em junho/06 e máximo
de 28,9 µg m-2 em outubro/06 (Figura 14). O fluxo anual de Hg calculado a partir da soma dos
fluxos mensais de Hg na serapilheira no período estudado foi de 184,2 + 97,8 µg m-2 que
corresponde a 1,8+1 g ha-1ano-1.
.
0
5
10
15
20
25
30
35
nov/0
5
dez/0
5
jan/0
6
fev/0
6
mar/0
6
abr/0
6
mai/0
6
jun/0
6
jul/0
6
ago/0
6
set/0
6
out/0
6d
ep
osiç
ão
de H
g (
µg
m-2
)
FI
GURA 14 – Fluxo mensal de Hg na serapilheira do PEPB
Se usarmos como base somente a massa da fração foliar da serapilheira, considerando
que nesta fração está concentrada quase que a totalidade do Hg incorporado, o fluxo anual
seria de 155 + 90 µg.m-2.ano. Correlacionando os fluxos mensais de Hg com os das produções
mensais de cada fração da serapilheira não encontramos nenhuma relação significativa, exceto
pela fração folhas com r de pearson igual a 0,8799 e nível de p= 0,0002 (Figura 15). Esta
fração apresenta uma deposição mensal muito similar à mensal de Hg através da serapilheira
exceto pelos meses de janeiro, abril e outubro, como mostra a figura 16.
FIGURA 15 – Teste de correlação de pearson realizado entre as médias mensais das
concentrações de Hg na serapilheira e as médias das massas das frações da serapilheira. A –
Folhas, B – Galhos, C – Resíduos e D – Elementos reprodutivos. Em vermelho temos as
correlação significativas com p<0,05.
FIGURA 16 – Valores mensais relativos ao fluxo de Hg na serapilheira e a massa produzida
pela fração folhas.
Logo, a correlação encontrada entre o fluxo de Hg e a deposição da serapilheira total foi
positiva e estatisticamente similar a anterior com r= 0,8724 e p<0,0002 , como mostra a figura 17.
A correlação entre a concentração e o fluxo de Hg também foi significativo (Figura 18) porém com
menor grau de certeza, estaria havendo assim uma diluição ou superconcentração do Hg na
serrapilheira em alguns meses. Estes valores de correlação divergem dos encontrados por Silva-
Filho e colaboradores (2006), em floresta primária de Mata Atlântica na Ilha Grande, RJ. Naquela
floresta a temporalidade da deposição da serapilheira não domina a dinâmica de distribuição anual
do fluxo de Hg e sim as concentrações de Hg na serapilheira, o fazem com r=0,88 p<0,001. Já em
trabalhos feitos em latitudes mais elevadas (SHEEHAN et al., 2006; ST-LOUIS et al., 2001) a
dominância da deposição da serapilheira sobre o fluxo de Hg em relação à concentração é evidente.
Como não há possibilidade de se obter correlações entre estes parâmetros para outros trabalhos
realizados para os trópicos, fica o questionamento até onde a floresta primária e sua dinâmica
influencia a dominância da concentração sobre o fluxo de Hg? Já, que a estratégia de reposição de
folhas mais vantajosa numa planta perene, em um ambiente não-estacional, seria a retenção e a
manutenção da atividade fotossintética de folhas velhas até o crescimento das folhas novas
(JACKSON, 1978) e como o metabolismo das espécies clímax é menor levaria mais tempo
concentrando Hg nas folhas. Será que a floresta primária possui uma média maior de tempo de vida
foliar, o qual poderia estar influenciando altas concentrações em períodos de menor deposição total
da serapilheira? E a floresta secundária haveria uma maior freqüência na queda das folhas devido
ao seu metabolismo mais intenso, sendo composta por pioneiras e secundárias, fazendo com que
folhas de vida curta se intercalem com de vida longa levando a correlação mais forte com o fluxo
da serapilheira total do que com a concentração? As espécies pioneiras e secundárias iniciais
apresentam, como características gerais, um crescimento muito rápido e um lapso de vida curto,
investindo pesadamente na produção de biomassa (BUDOWSKI, 1965; VÁZQUEZ-YANNES,
1980; KAGEYAMA; CASTRO, 1989), o que permite gerar um grande aporte de serapilheira. Por
haver muitos fatores influenciando estas correlações e poucos trabalhos em florestas primárias na
Mata Atlântica ainda é cedo para obtermos respostas precisas à estas questões.
4 6 8 10 12 14 16 18 20 22 24 26 28 30
Fluxo de Hg na serapilheira em µg/m2
20
40
60
80
100
120
140
Flu
xo d
e se
rapi
lhei
ra t
otal
em
g/m
2
r2 = 0,7611; r = 0,8724, p = 0,0002
FIGURA 17 – Correlação entre os fluxos de Hg e de serapilheira.
2 4 6 8 10 12 14 16 18 20 22 24 26
Fluxo de Hg na serapilheira em µg/m2
160
180
200
220
240
260
280
300
320
340
360
Con
cent
raçã
o H
g na
ser
apilh
eira
(ng
.g-1
)
r2 = 0,4139; r = 0,6434, p = 0,0240
FIGURA 18 – Correlação entre fluxo e concentração de Hg
Contudo, é notável a diluição da concentração de Hg na serapilheira nos meses
próximos a setembro, tanto para Ilha Grande quanto para o PEPB, estando evidente também a
contribuição da massa de serapilheira mais pobres em Hg, vindo das árvores com o tempo de
vida foliar relativamente menor, obedecendo a uma sazonalidade referente aos dias de
fotoperíodo mais curtos do ano. Esta sazonalidade é seguida por algumas espécies da Mata
Atlântica embora, em número muito reduzido em florestas ombrófilas densas como as
discutidas aqui. Ferraz e colaboradores (1999) demonstraram não haver sazonalidade na
freqüência da queda das folhas de 6 espécies sempre-verdes da Mata Atlântica em São Paulo,
exceto Cordia ecalyculata, apresentou correlação entre queda de folhas a precipitação e a
temperatura. Dois dos gêneros (Cordia e Alchornea) avaliados neste estudo fenológico
também são representativos da floresta do Camorim no PEPB e importantes no fluxo de Hg
como apresentado mais a frente.
A deposição de 184 µg m-2 y-1 é aproximadamente 18 vezes maior que a média de 10
µg m-2 y-1 encontrada por Grigal (2002) ao analisar a deposição em 21 trabalhos de Hg em
serapilheira de florestas em Zonas Temperadas e Boreais do Hemisfério Norte. É ainda oito
vezes maior que o fluxo de Hg em serapilheira encontrados em uma floresta de coníferas no
Canadá de mais de 75 anos (St.-LOUIS et al, 2001). Em comparação ao fluxo encontrado nos
trabalhos nas florestas Tropicais (SILVA-FILHO et al 2006; FOSTIER et al., 2003;
OLIVEIRA et al., 2006) podemos afirmar que é o maior valor encontrado, porém é
significativamente (α<1%) igual aos valores mensurados na Ilha Grande (SILVA-FILHO et
al., 2006) e, apesar de não dispormos dos fluxos mensais do trabalho realizado por Oliveira e
colaboradores (2006), por se tratar da mesma floresta e por também apresentar grandes
desvios nas concentrações mensais de Hg, é provável que não difiram do valor médio do
fluxo de Hg apontados no período entre 2005/2006.
Já os valores encontrados, tanto em São Paulo quanto em Cunha, diferem com 99% de
confiança dos valores encontrados no presente estudo (CECON, 2003; FOSTIER et al.,
2003). É preciso levar em consideração o período menor de amostragem para estas duas
últimas áreas no caso do levantamento inicial publicado por Fostier e colaboradores (2003),
relativo a cinco meses de coletas. Como a variabilidade mensal é grande talvez tenham sido
perdidos pulsos significativos para o fluxo de Hg anual. Para testarmos esta hipótese,
realizamos um teste “t” entre as médias de 6 meses e 12 meses encontrados por CECON
(2003), que completou a amostragem anual dando continuidade aos meses levantados por
FOSTIER (2003) nos mesmos sítios. Estas estimativas não resultaram em diferenças
significativas entre as médias para São Paulo, porém para Cunha, com 95 % de confiança
podemos afirmar que houve diferença das médias devido ao tempo de amostragem. Faz-se
necessário a padronização da frequência da amostragem para regiões com tantas espécies e
variações mensais de deposição compondo a serapilheira.
A amostragem em 12 meses do ano aumentaria a precisão da média do fluxo de Hg
anual devido a possíveis omissões de valores significativos para o fluxo da serapilheira
(deposição de serapilheira e concentração de Hg), que ocorreriam durante uma amostragem
em um período menor. A metodologia usada para a estimativa anual do fluxo de Hg também
pode ocasionar em diferenças no resultado, enquanto neste trabalho e nos demais (OLIVEIRA
et al., 2006; SILVA-FILHO et al., 2006; ST.-LOUIS et al, 2001) os fluxos mensais são
somados para compor o valor anual, porém em Cecon (2003) foram utilizados a média
semestral dos fluxos multiplicada por seis (meses) estimando a deposição semestral que era
somada ao outro semestre resultando no fluxo anual. No entanto diferenças metodológicas
não são as únicas responsáveis pela discrepância entre os fluxos encontrados entre os
levantamentos feitos no Estado do Rio e de São Paulo. Fatores climáticos podem estar
influenciando já que a formação florestal de Cunha localiza-se a 1050m de altitude, enquanto
da cidade de São Paulo fica a 798m e estão distantes do mar 15 e 50 km respectivamente.
As concentrações de Hg em ambas as áreas no Estado de São Paulo são 2 vezes
menores que as do presente estudo, o que sugere uma menor capacidade de captação e difusão
de Hg pelas folhas da floresta, provavelmente pela temperatura média menor em comparação
com Ilha Grande e o PEPB. Porém, a quantidade de coletores também pode estar interferindo
na correta amostragem da concentração de Hg na serapilheira, um baixo número de coletores
representaria poucas espécies contribuintes amostradas do universo total de espécies. Em
Cunha e São Paulo (CECON, 2003), por exemplo, apenas 4 coletores foram usados em cada
área apenas, contra 12 coletores usados no presente trabalho e 26 utilizados por Oliveira e
colaboradores (2006).
Devido ao número restrito de trabalhos nesta região ainda não há comparações
padronizadas entre florestas fisionomicamentes similares, dentro da própria Mata Atlântica.
Mas, devido à diversidade às vezes alcançada pela Mata Atlântica, de até 450 espécies/ha,
quanto maior o número de coletores, mais acuradas serão as médias estimadas para a floresta
estudada. Pois também, a distribuição das espécies na área amostral se dá mais adensada ou
mais dispersa segundo a estratégia espacial de dispersão de cada espécie. Assim se as espécies
contribuintes da serapilheira coletada forem fracas seqüestradoras de Hg, pode haver uma
representatividade inferior do fluxo médio para a floresta.
O fluxo de Hg no presente trabalho esteve também correlacionado com a deposição da
serapilheira, portanto é fundamental levarmos também em consideração a dinâmica deste
processo nos trópicos e no mundo. Para entendermos a temporalidade deste processo dentro
da visão da produtividade primária, talvez seja necessário padronizar a freqüência da
amostragem para regiões tropicais, com fortes influências da precipitação e com tantas
espécies diferentes contribuindo para grandes variações mensais/anuais da deposição da
serapilheira, refletindo diretamente no fluxo do Hg em larga escala. Wood e colaboradores
(2005) relataram a influência de eventos com temporalidades maiores do que de um ano,
como o El Niño, na deposição da serapilheira. Portanto, a amostragem em 12 meses do ano e
durante mais de dois anos aumentaria a precisão da medida do fluxo de Hg anual devido a
possíveis omissões de valores significativos do fluxo da serapilheira ou da concentração, que
ocorreriam durante uma amostragem em um período igual ou menor a seis meses. Ao mesmo
tempo em que a avaliação em longo intervalo amostral revelaria outras influências a
concentração e deposição do Hg.
9.4 CORRELAÇÕES CLIMÁTICAS
As diversas características físicas do meio circundante a floresta, imprimem diversas
restrições no comportamento metabólico dos indivíduos até mesmo sua dispersão espacial.
Em trabalhos de fenologia de espécies arbóreas é importante a verificação das fases de
desenvolvimento biológico com o clima. Fatores como precipitação, temperatura e vento,
podem influenciar tanto na deposição da serapilheira quanto nas trocas gasosas estomáticas. É
comum o estudo dos parâmetros climatológicos de meses anteriores aos eventos estudados
(Ferraz et al., 1999), pois, a velocidade da resposta a essas influências pode variar segundo o
clima geral, tipo florestal e do solo.
9.4.1 Temperatura
A temperatura parece cumprir um papel importante na deposição seca e na
concentração atmosférica do Hg (SCHROEDER; MUNTHE, 1998, LINDBERG et al. 1991),
diferindo muito entre as médias do verão e as do inverno em regiões temperadas. Fica
evidente uma sutil sazonalidade deste parâmetro climático para a floresta do PEPB, não tão
denunciado nos trópicos quanto nas altas latitudes. Porém existe um intervalo entre a média
mensal máxima e a mínima de 6oC durante o período estudado, suficientes para alterar
processos metabólicos da fenologia (crescimento) e difusibilidade do Hg. Essa sazonalidade é
refletida na concentração e fluxo do Hg na serapilheira como mostra os pulsos de ambas
(Figura 19), sendo precedido dois meses das médias máximas de temperatura no caso da
concentração e um mês no fluxo. Apesar da tendência para o fluxo com o mês anterior não foi
possível encontrar uma significância acima de 95% (p=0,12). A tabela 7 expressa os fatores
utilizados na correlação.
FIGURA 19 – Temperaturas médias, fluxo e concentração de Hg. Linhas de tendência
também estão presentes para concentração e o fluxo.
TABELA 7 A correlação entre a concentração de Hg e os fatores Temp 1, 2 e 3 estão
expressos acima, em negrito, estão os valores com p<0,05
Temp 1 Temp 2 Temp 3
Temperatura média referente aos mesmos meses das concentrações de Hg na serapilheira
Temperatura média referente ao mês anterior as concentrações de Hg na serapilheira
Temperatura média referente a dois meses anteriores as concentrações de Hg na serapilheira
r=0,2272 r=0,5746 r=0,7160 Hg ng/g
p=0,502 p=0,064 p=0,013
Essa correlação reforça a deposição seca atmosférica e o aumento da difusibilidade no
tecido foliar, influenciados pela temperatura, afetando a concentração média do Hg na
serapilheira.
9.4.2 Precipitação
A precipitação apresenta uma influência complexa sobre a concentração de Hg, ao
mesmo tempo em que; mantêm o solo constantemente úmido evitando o fechamento dos
estômatos por causa do déficit hídrico, aumentando a concentração, também lava o Hg
adsorvido externamente do dossel (REA et al., 2000) diminuindo assim a concentração foliar,
processo observado no enriquecimento da transprecipitação. E, neste trabalho, apesar de não
ter havido correlação ao longo do ano para as médias de precipitação e concentração de Hg,
tivemos uma correlação parcial durante os meses mais quentes do ano, correlação negativa
significativa nos meses de dezembro a abril (r=-0,91, p=0,032, n=5), ou seja, após um grande
pulso (Figura. 22) da precipitação seguido de dias ótimos para a fotossíntese elevando as
concentrações de Hg. Apesar de haver chovido muito pouco nos meses de julho e agosto, não
houve grande aumento da acumulação de Hg por grama de matéria seca. Além de o seqüestro
e a carga atmosférica de Hg estarem contidos pela baixa temperatura, existe a possibilidade de
uma parte das espécies contribuintes da serapilheira destes meses, serem decíduas anuais ou
bianuais, diluindo a concentração total deste mês como já discutido anteriormente.
Não houve correlação significativa entre a concentração do Hg na serapilheira com as
precipitações dos meses anteriores, nem com a do mesmo mês. Porém há uma tendência de
correlação negativa significativa entre valores de concentração de Hg na serrapilheira com os
valores de chuvas do mesmo mês (Figura 20), isso sugere para uma lavagem do dossel
importante em alguns meses, capaz de retirar espécies de Hg adsorvidas a superfície foliar.
Hg X Chuva
0
50
100
150
200
250
300
350
400
nov/0
5
dez/0
5
jan/0
6
fev/0
6
mar/0
6
abr/0
6
mai/0
6
jun/0
6
jul/0
6
ago/0
6
set/0
6
out/0
6
0
50
100
150
200
250
300
conc ng.Hg/g
chuvas mm
chuv
as m
m3
conc
entr
ação
ng.
g-1
FIGURA 20 - Concentração mensal de Hg na serapilheira e a distribuição de chuvas, no
PEPB, Rio de Janeiro.
TABELA.7 Correlação entre a concentração de Hg e os fatores Chuva 1, 2 e 3.
Chuva 1 Chuva 2 Chuva 3
Precipitação acumulada mensal referente aos mesmos meses dos fluxos de Hg na serapilheira
Precipitação média referente ao mês anterior aos fluxos de Hg na serapilheira
Precipitação média referente a dois meses anteriores aos fluxos de Hg na serapilheira
r=-0,3630 r=0,1387 r=0,2770 Hg ng/g p=0,273 p=0,684 p=0,410
9.4.3 Ventos
Ao confrontarmos as velocidades médias mensais dos ventos com as concentrações de
Hg na serapilheira, também não encontramos nenhuma significância. Porém uma tendência
mais forte para a correlação negativa existiu, quando confrontado com os mesmos meses de
concentração de Hg. A floresta se apresenta como barreira natural para o deslocamento em
massa do ar, diminuindo a velocidade do vento em seu limite. Era esperado que ventos mais
intensos (velocidade) provocassem a diluição das concentrações de Hg na folha devido a sua
influência negativa, dispersando o Hg ao redor da folha, além do encerramento da troca
gasosa estomática pela diminuição local da umidade. Mas averiguar isto, não foi possível
devido a ausência de uma estação metereológica dentro do dossel. Porém, notamos que os
valores da velocidade dos ventos nos meses de maior temperatura se correlacionaram
negativamente com a concentração de Hg nas folhas da serapilheira (Figura 21).
0
50
100
150
200
250
300
350
400
nov/05
dez/05
jan/
06
fev/06
mar
/06
abr/0
6
mai/0
6
jun/
06
jul/0
6
ago/06
set/0
6
out/0
6
7
7,1
7,2
7,3
7,4
7,5
7,6
7,7
7,8
7,9
8 [Hg]ng/g
Ventos Km/h
Ve
nto
s K
m/h[H
g]
ng
/g
FIGURA 21 – Velocidade dos ventos e a concentração de Hg na serapilheira.
Na tentativa de auxiliar no entendimento das complexas correlações encontradas entre
os fatores climáticos aqui apresentados e os acúmulos de Hg, a tabela 8 abaixo fornece as
combinações climáticas onde ocorreriam maior ou menor seqüestro pelas árvores do
Camorim. Foram utilizados a porcentagem de dias com chuva para auxiliar na composição
dos cenários, obtidos do somatório da precipitação registrada de quinze em quinze minutos,
compondo assim a precipitação diária no período do estudo. As chuvas fortes consideradas
nesta comparação foram as de evento contínuos acima de 50 mm por dia. Os eventos fortes e
fracos ainda foram considerados como sendo de longa duração a partir de 3 dias de repetição.
Os eventos que são descritos como intercaladas com dias sem chuva foram considerados
quando, intervalos em que a precipitação não ultrapassou 10 mm diários, persistindo por até
15 dias consecutivos entre chuvas mais intensas.
TABELA 8 - Parâmetros climáticos e sua influência na concentração de Hg na serapilheira. +
e – representam um maior ou menor potencial acumulador de Hg nas folhas, segundo a
influência climática no PEPB, RJ.
Temperatura
alta baixa
chuvas fortes e intercaladas com dias sem chuva
chuvas fortes e de longa duração
chuvas fracas ou fortes e intercaladas com dias sem chuva
chuvas fracas e de longa duração
sequestro +++ -- 0 -
A análise de fatores climáticos e sua interferência na fenologia das espécies da Mata
Atlântica no sudeste brasileiro estão apenas sendo iniciadas com o número reduzido de artigos
recentes (BENCKEL; MORELLATO, 2002; FERRAZ et al., 1999; TALORA;
MORELLATO, 2000). No trabalho apresentado por Talora e Morellato (2000) a respeito da
fenologia de 46 espécies, em formação florestal muito próximo com clima semelhante ao
apresentado pela floresta do PEPB, mostraram que na Floresta Atlântica da planície litorânea
apresentam padrões sazonais fenológicos menos acentuados do que aqueles observados em
florestas semidecíduas, embora a deposição de folhas novas aconteça predominantemente nos
meses chuvosos. Estas influências reforçam a maior incorporação de Hg durante os meses de
crescimento, os quais possuem valores de temperatura também elevados. Apresentando queda
intermitente durante todo o ano e 80% de sincronismo entre os indivíduos da mesma espécie
(BENCKEL; MORELLATO, 2002), as árvores sempre-verdes, representantes quase
totalitárias da Mata Atlântica, respeitam um padrão que contribui para o acúmulo de grandes
quantidades de Hg durante o fim do verão, já que são as contribuintes totalitárias exclusivas
deste período anual. A concentração do Hg não obteve correlação significativa com o fluxo de
Hg, pelos valores dos meses mais secos e frios, de julho e agosto e pela diluição causada pelas
decíduas, citado acima.
9.5 EFEITOS ECOLÓGICOS DO FLUXO DE SERAPILHEIRA NO CICLO DO
MERCÚRIO
A importância da serapilheira para o aporte total do Hg em ecossistemas florestais é
normalmente estimada juntamente com a precipitação direta e a transprecipitação líquida
(transprecipitação menos precipitação direta), porém estas medidas são escassas para as
florestas tropicais. Para auxiliar nesta discussão utilizaremos outros dados de Hg na
precipitação direta no Estado do Rio de Janeiro. Lacerda e colaboradores (2002) apontam para
uma deposição anual de Hg na precipitação direta entre 0,4 – 3,4 µg m_2, o valor mais elevado
foi encontrado em áreas urbanas do Rio de Janeiro. Na Baía de Sepetiba a 20 km da área de
estudo deste trabalho, Marins e colaboradores (1996) encontraram valores elevados de
mercúrio na precipitação anual, uma média de 76 µg m-2. Cintra (2004) em uma análise
multielementar da precipitação no mesmo local deste estudo em 2002/2003, revelou uma
entrada de 180 µg Hg m-2 anuais, demonstrando uma grande influência urbana e industrial, se
comparados com a média de 10 µg m-2 da deposição úmida em dez observações em áreas não
poluídas do Hemisfério Norte (Grigal, 2002). Portanto, podemos afirmar que os valores
encontrados para a Baía de Sepetiba são de até 7 vezes maiores e do Camorim de 18 vezes
maiores do que a média para áreas não-poluídas do Hemisfério Norte. Já na Bacia do Rio
Negro na Amazônia, foi encontrada uma média anual para o Hg na precipitação de
aproximadamente 22 µg m-2 ano-1 (Fadini; Jardim, 2001; Fostier et al., 2000).
Já para a transprecipitação, que é o enriquecimento da precipitação pela lavagem do
dossel, encontramos uma taxa no Hemisfério Norte de 1,8 vezes maior do que a precipitação
direta (Grigal, 2002), tendo como média 17 µg m_2 y_1. Se usarmos a média de 50 µg m-2 ano-
1 obtida das médias de Hg na precipitação direta de Sepetiba (76 µg m-2 ano-1) e da Bacia do
Rio Negro (22 µg m-2 ano-1), podemos de maneira conservadora pela relação citada acima,
assumir que a contribuição anual da transprecipitação no PEPB seja de aproximadamente 90
µg m-2 y_1. Porém, em um raro estudo de transprecipitação em floresta tropical, Fostier e
colaboradores (2000) encontraram na Amazônia 72 µg m-2 ano-1 contra 18 µg m-2 y-1 de
precipitação direta. Esses valores de transprecipitação variaram 4 vezes sobre a precipitação
encontrada na Amazônia, contra a relação de 1,8 vezes do Hemisfério Norte. Esse
enriquecimento maior dos valores de transprecipitação frente aos de precipitação em florestas
tropicais, mostra a importância da área de superfície do dossel das florestas tropicais que é
ampliado devido a uma série de características morfológicas e fitofisionômicas das florestas
tropicais (exemplos: presença de tricomas -pelos foliares- e densidade populacional). Outro
valor único de transprecipitação, encontrado no mesmo sítio do presente estudo no PEPB, RJ,
entre 2002 e 2003 (Cintra, 2004), foi de 20 µg Hg m-2 y-1 da transprecipitação contra 180 µg
Hg m-2 y-1 da precipitação direta. Estes valores não foram discutidos pelo autor quanto a sua
alta taxa perante os valores mundiais, e nem se hipotetizou o porquê do empobrecimento do
Hg na transprecipitação. Neste caso a copa das árvores estaria interceptando o mercúrio da
chuva; hipótese não considerada neste trabalho por ser esta a única exceção encontrada na
bibliografia, além do fato de ser um valor extremo mesmo para áreas poluídas.
Se mesmo assim, levarmos a taxa de enriquecimento entres os parâmetros
(precipitação, transpreciptação e serapilheira) fornecida por Grigal (2002) de 1:1,8:2,2 usando
com valor de deposição de Hg por precipitação direta de 50 µg m-2 ano-1 , teríamos que
encontrar um aporte de Hg através da serapilheira para o PEPB de 198 µg m-2 ano-1, não
distante dos 184 µg m-2 ano-1 encontrados. Apesar das incertezas oriundas da falta de dados
locais, de precipitação direta e transprecipitação para o período de coleta do presente estudo,
acreditamos que nos trópicos a relação entre o fluxo de Hg da precipitação e transprecipitação
seja maior do que a taxa de 1,8 nos levantamentos efetuados no Hemisfério Norte (GRIGAL,
2002) e, um pouco menor do que a taxa de 2,2 sugeridos para a relação entre transprecipitação
e serapilheira. Essa discrepância se dá aparentemente, pela intensidade e freqüência maior das
chuvas tropicais que influencia a transprecipitação anual bruta e, principalmente, pelos
parâmetros morfológicos e fitofisionomicos supracitados da floresta tropical, possuidora de
uma grande diversidade de espécies e com poucos indivíduos por espécie. Corroborando com
a estimativa mencionada anteriormente, Magarelli (2006) ao comparar seus valores de fluxo
de Hg na serapilheira com os de Hg na transprecipitação encontrados por Fadini; Jardim
(2001) revela uma relação de 1,7 vezes contra a taxa de aumento de Grigal de 2,2 vezes.
A partir deste valor de transprecipitação bruta – estimada em 90 µg Hg m-2 ano-1 –
juntamente com o da serapilheira – 184 µg Hg m-2 ano-1 –, podemos calcular a contribuição
atmosférica total do Hg na floresta do PEPB, RJ. Considerando a área florestada como a área
total do Parque (123.980.000 m².), teremos o aporte total em 34 kg de Hg anuais. Se
extrapolarmos estes fluxos, para toda a área remanescente de Mata Atlântica no Brasil (cerca
de 100.000 km2), haveriam aproximadamente 27,4 toneladas de Hg depositados anualmente.
Em um quadro mais conservador, utilizando a menor média de deposição de Hg em
serapilheira encontrada na Mata Atlântica por Fostier e colaboradores (2003) de 60 µg m-2
ano_1 e pela transprecipitação de 27 µg m-2 ano_1 (estimada da mesma relação usada acima
para obter o fluxo de Hg da transprecipitação do PEPB) tem-se uma deposição ao solo de
mercúrio na Mata Atlântica remanescente, de 8,7 toneladas anuais. Essa última medida pode
ser mais condizente com a realidade devido grande parte da Mata Atlântica se encontrar em
escarpas continentais em grandes altitudes, de temperaturas médias inferiores quando
comparadas a Ilha Grande e PEPB, RJ.
Essa estimativa para a Mata Atlântica entre 8,7 – 27,4 t de Hg anuais, apesar de muitas
incertezas e, sem considerar a re-emissão ou a lixiviação do mercúrio foliar durante o
percurso até sua imobilização no solo, reflete apenas uma pequena porção da emissão global
de Hg anual, de origem antropogênica. Esta emissão foi calculada entre 2000-4000
toneladas/ano (MUNTHE, et al.,2001; PIRRONE et al., 1996; LACERDA; MARINS, 1997).
Enquanto que no Brasil as estimativas mais recentes apontam para uma emissão de 67,4
toneladas durante 1998-2002 (LACERDA et al., 2007).
Apesar de expressivo, estes valores estimados para a Mata Atlântica ainda estariam
muito distantes dos valores calculados para a extensa área verde ainda existente na Amazônia.
Das florestas existentes em aproximadamente 4x109 ha da superfície terrestre, somente a
Floresta Amazônica cobre 0,4x109 ha (INPE, 2000), ou seja, 10% de toda a área coberta por
florestas no planeta. Se for utilizado a média dos trabalhos desenvolvidos neste bioma
(MAGARELLI, 2006; MÉLIÈRES et al, 2003; ROULET et al, 1998) – 46 µg m-2 ano-1 –, e a
mesma taxa de enriquecimento resultará em uma estimativa grosseira de 184 toneladas de
mercúrio depositado por ano.
Mesmo assim os fluxos de Hg das florestas tropicais das encostas do Atlântico
representam um importante sumidouro atmosférico local com efeitos no ciclo do mercúrio
local, regional e global. Esse seqüestro retira parte da carga atmosférica local destinada à área
densamente habitada do entorno do Parque, sendo ao mesmo tempo um potencial reservatório
de Hg no solo da Metrópole da cidade do Rio de Janeiro. Isso ocorre já que grande parte do
Hg emitido para atmosfera é depositado num raio de 40 km (SCHROEDER; MUNTHE,
1998) da fonte variando de acordo com o padrão dos ventos da região. E seus efeitos vão até a
escala global, por amortizar o acréscimo regional e global dos níveis atmosféricos de
background do Hg.
O destino do Hg uma vez que atinge o solo florestal é distinto para a transprecipitação
e para a serapilheira devido as suas espécies de Hg dominantes. A transprecipitação é
constituída da lavagem predominantemente da espécie do mercúrio gasoso Hg(II) que fora
adsorvido na superfície do dossel como Hg(II) ou do Hg (0) oxidado na camada limítrofe das
folhas e também adsorvido externamente (LINDBERG et al. 1994), além de ser predominante
também na precipitação direta. Enquanto que o Hg (0) predomina na serapilheira, quase 80%
oriundo da deposição seca (REA et al., 2000) devido a sua retenção pelos complexos
estomáticos e sua entrada no mesofilo, tecido interior da folha.
Em relação às reações químicas que ocorrem no solo podem ser citadas as reações de
metilação do Hg2+, desmetilação do CH3Hg+ e (CH3)2Hg, e oxidação do Hg0 (CARPI;
LINDBERG, 1998). Além destas, umas das reações mais importantes refere-se à redução do
Hg2+ a Hg0. Diversas vias de redução e oxidação do Hg, portanto serão mediados no processo
de incorporação deste ao solo, realizado por bactérias, pela luz e também por redutores como
Fe2+ e ácidos fúlvicos e húmicos. Todavia, é importante conhecer o comportamento de cada
espécie no solo para definir sua retenção potencial, caso esse fomentador de grandes
discussões da comunidade científica devido a sua complexidade. Os processos que envolvem
a adsorção do mercúrio, por exemplo, em partículas minerais e orgânicas no solo
correlacionam-se com a área superficial das partículas, seu conteúdo orgânico e a capacidade
de troca catiônica. Como resultado, solos argilosos e com alto teor orgânico possuem uma alta
capacidade de adsorver e reter o mercúrio que é depositado atmosfericamente. Os
componentes orgânicos do solo são melhores adsorventes em ambientes ácidos (MARK;
WILLIANSON, 2004; MIRETZKY et al., 2005). Logo, o Hg tem sua mobilidade e presença
relacionada aos mesmos parâmetros da matéria orgânica dissolvida (DOM) ou carbono
orgânico dissolvido (DOC) em solos tropicais (ROULET; LUCOTTE, 1998).
Além disso, a lixiviação do Hg dos solos não está correlacionada com a deposição
úmida (MUNTHE; HULTELBERG, 2004; SCHWESIG; MATZNER, 2001) o que restringe
ainda mais a sua mobilização. Em trabalho realizado por Almeida (2005) foi demonstrada em
perfis de áreas florestadas da Amazônia uma tendência crescente com a profundidade,
provavelmente devido à lixiviação do mercúrio para horizontes mais profundos onde, seriam
em parte, retidos na presença de óxidos-hidróxidos de ferro e alumínio.
A menor mobilidade da espécie Hg(0) oriunda da serapilheira fica reforçada também
pela sua menor solubilidade em água quando comparado ao Hg(II) vindo da transprecipitação.
Logo, juntamente com outros processos de redução de Hg (II) pelas bactérias, poderia ser a
serapilheira a fonte de grande parte do Hg(0) associado a matéria orgânica do solo,
permanecendo ali imobilizado até haver a retirada da cobertura vegetal (FOSTIER et al.,
2000; ROULET et al.,1998) e a remobilização do Hg seja em partículas associadas ao Fe e Al
ou a matéria orgânica para os cursos hídricos. Essa suposição encontra lugar em outra
discussão ainda não finalizada entre pesquisadores da área, de qual será a origem dos altos
valores de Hg em solos tropicais, se, de origem natural, quanto poderia ser representativo da
geogênese local ou da incorporação de anos de transferência da floresta aos solos de Hg
atmosférico não nativo?
Destarte, o estado físico do meio de transporte (dissolvido em água ou incorporado às
folhas) do Hg especificaria a maior ou menor permanência deste, no solo florestal. Evidências
para esta permanência foram encontradas em trabalhos no mesmo sítio no PEPB, tanto para a
serapilheira quanto para a transprecipitação para a mesma área, entre 2000 e 2001
(OLIVEIRA et al,.2006) e entre 2002 e 2003 (CINTRA, 2004) respectivamente. Os fatores de
enriquecimento de Hg, obtidos a partir da relação entre a sua concentração na deposição
úmida total e a sua riqueza na crosta (CINTRA, 2004), foi maior do que 22 outros elementos
(Ti, Fe, Ni, Mn, Pb, Ca, Mg, Sn, Cu, Be, K, Co, Na, Cr, Zn, Cd, Ag, Mo, Sb, e As). Já o
enriquecimento medido pela relação da serapilheira, apresentou a menor taxa de
enriquecimento para o Hg em comparação a Cr, Zn, Ni, Pb e Cd (OLIVEIRA et al., 2006),
além disso, neste estudo o tempo de renovação lento do Hg em comparação aos nutrientes,
evidenciou uma baixa dinâmica na serapilheira ao ser decomposta. A quantidade de Hg,
juntamente com a de outros metais na serapilheira estocada, foi maior que a da recém caída,
indicando um ambiente acumulador. Estes apresentaram velocidade de ciclagem
consideravelmente mais lenta do que a dos nutrientes, ou seja, a sua estocagem nos diversos
compartimentos do ecossistema florestal (serapilheira, solo, vegetação, fauna, etc.) é mais
lenta provavelmente em função de diferentes formas de metabolização destes poluentes pela
biota e da preconização dos nutrientes na degradação e posterior reincorporação na biomassa
em relação aos metais poluentes. Pelo fluxo reduzido de Hg entre solo/atmosfera dentro da
floresta, podemos verificar que, existe pouca remobilização (ALMEIDA, 2005) por
volatilização do Hg associado à rica matéria orgânica da camada superficial do solo. Ou seja,
as entradas atmosféricas são de novas cargas no sistema e não provenientes de sua reciclagem
pelo menos em solos tropicais onde o fluxo líquido do Hg solo/atmosfera é quase zero. Porém
nada se sabe da reemissão ocorrida na face externa do dossel (canopéia), onde a exposição
solar é mais intensa e não há nenhuma barreira física (MAGARELLI, 2006).
9.6 O MERCÚRIO FOLIAR EM CINCO ESPÉCIES REPRESENTATIVAS DO PEPB.
A concentração média de Hg nas folhas das 5 espécies que representam à área
estudada, como classificadas pelo levantamento fitossociológico da área através dos seus
valores de importância (VI), foi de 144 + 75 ng g-1 . Estas 5 espécies juntas representam 32%
do valor do VI total somado de todas as espécies levantadas. As espécies e seus respectivos
parâmetros fitossociológicos podem ser vistos na tabela 2 e suas concentrações podem ser
observados na figura 22.
FIGURA 22 - Concentração de Hg e seus respectivos desvios padrão em ng g-1 das 5 espécies
de maior ocorrência, na área estudada no PEPB, Rio de Janeiro
Metternichia principes foi a espécie que apresentou a menor concentração de mercúrio
60±9 ng g-1 e a espécie Alchornea iricurana a mais elevada de 215,2±38 ng g-1. Mesmo, o
menor valor encontrado foi de aproximadamente de 2 a 5 vezes maior do que a média da
concentração foliar das espécies de regiões temperadas sujeitas a valores background de Hg
atmosférico (RASMUSSEN et al, 1991).
Por outro lado, nas únicas análises de Hg por espécie desenvolvidos nos trópicos, para
a concentração de Hg em folhas do dossel, foram atingidos valores mais expressivos que nas
latitudes extremas. Do mesmo modo, como quando comparado às concentrações de Hg na
serapilheira da zona Temperada e Boreal. Em estudos em áreas remotas da Guiana Francesa,
na Amazônia (MÉLIÈRES et al, 2003), e em área de Mata Atlântica no Sudeste do Estado de
São Paulo (De FRANÇA et al., 2004), foi observada uma média entre as espécies analisadas
de 64 ± 14 ng g-1 (n=10) e 73 ± 49 ng Hg g-1 (n=11) respectivamente, significativamente
iguais entre si. Na análise relativa a São Paulo, Mata Atlântica, o alto desvio padrão é
composto por um valor que pode ser considerado outlier de 180 ng g-1, referente a espécie
Eugenia cuprea (Mirtaceae), fazendo com que quando comparado com os valores das
espécies do presente estudo, apesar de estatisticamente diferente, estejam bem mais próximo
(Tabela 10). Assim, se calcularmos a semelhança entre as médias em um teste “t” de Student
encontramos o seguinte quadro:
TABELA 10 – Teste da diferença das médias entre valores de folhas vivas de três tipos de
floresta tropical. Em negrito as médias que apresentaram diferenças significativas.
Mèliéres et al., 2003
Floresta Amazônica
Presente estudo
Mata Atlântica
De França et al., 2004
Mata Atlântica
p=0,61 g.l.=19 t=0,5122 p=0,03 g.l.=13 t=-2,3552
Mèliéres et al., 2003
Floresta Amazônica
p=0,003 g.l.=14 t=3,5544
O valor médio de Hg entre as espécies da Amazônia variou de 32,4 ng g-1 até 103,0 ng
g-1 e as de São Paulo entre 29 ng g-1 e 180 ng g-1. O intervalo entre as concentrações nas
espécies em Camorim foi entre 60 ng g-1 e 215 ng g-1. Apesar de um número menor de
espécies analisadas aqui, houve um grande intervalo das concentrações também, porém com
valores mínimos e máximos superiores aos encontrados para os outros sítios em Zona
Tropical. No trabalho desenvolvido por Mélières e colaboradores (2003) as médias para
famílias como a Bombacaceae foram as mais altas ficando entre 105 e 114 ng g-1, esta família
é caracterizada por ser decídua podendo ter maior condutância estomática em momentos
ótimos de fotossíntese e concomitantemente aos pontos de compensação ambientais do Hg,
devido a sua acelerada taxa de crescimento durante curtos períodos. Assim como observado
por Millhollen e colaboradores (2006b) para espécies sempre verdes e decíduas das Zonas
Temperadas e Boreais, onde Robinia pseudoacacia uma espécie decídua incorporou mais Hg
do que Juniperus scopulorum e Pinus ponderosa em um mesmo período de tempo.
Infelizmente em Camorim no PEPB, RJ não foram usadas nenhuma espécie decídua para
comparações, da mesma forma no levantamento feito em São Paulo (De FRANÇA et al.,
2004). Porém quando analisado o levantamento em conjunto, do Hg presente nas espécies
Tropicais, grandes diferenças são encontradas em espécies da família Sterculiaceae e entre
Leguminosae enquanto valores próximos foram apontados para espécies da família
Clusiaceae. A influência de características genéticas que caracterizam as espécies de uma
mesma Família, até mesmo de um mesmo Gênero, não deve ser predominante no acúmulo de
mercúrio. Comparações mais fidedignas devem ser feitas entre as mesmas espécies em
diversos Biomas dentro da Zona Tropical para que se possa avaliar a influência da carga
genética em relação à ambiental.
A média total das concentrações foliares de Hg das 5 espécies (144 ng g-1) é inferior,
porém relativamente próxima da média dos altos valores encontrados na serapilheira durante
2000/2001 (170 ng g-1) e 2005/2006 (237 ng g-1). Além disso, até o momento da abcisão,
estas folhas acumulariam mais mercúrio se não retiradas antes para a presente análise. Pela
posição assumida por Piptadenia gonoachanta dentro da classificação do Valor de
Importância e a sua concentração no dossel, podemos afirmar que esta espécie desempenha
papel de destaque no sequestro de Hg no PEPB, RJ. Porém para uma melhor comparação
entre contribuintes e a média de Hg na serapilheira, deverão ser feitos estudos de
acompanhamento dos valores de concentração encontrados na serapilheira por espécies e os
coletores devem ser posicionados em torno das espécies arbóreas mais produtoras de
serapilheira da área estudada.
A variação da concentração de mercúrio encontrada entre as espécies nos trópicos
deve estar associada à alta diversidade o que evidencia a importância da correta amostragem
da área estudada, com a quantidade de coletores positivamente correlacionados com a
diversidade de espécies.
9.7 O MERCÚRIO FOLIAR E OS PARÂMETROS ANATÔMICOS.
As especificidades biológicas (Tabela 11), tais como rugosidade, tricomas, organismos
epifíticos e ceras epicuticulares que poderiam estar influenciando o movimento do Hg em sua
interface atmosfera/solo já foram sugeridas (MÉLIÈRES et al.,2003; SILVA-FILHO et
al.,2006), porém não foi ainda analisado quantitativamente a correlação com nenhum destes
parâmetros e o Hg em plantas tropicais ricas em tais características. A relação entre as
concentrações foliares de Hg e a condutância estomática, foi vista por Millhollen e
colaboradores (2006a), onde, através do uso de câmaras fechadas (simuladores
microambientais), variou a concentração de CO2 diminuindo a condutância estomática devido
a maior oferta deste gás para a fotossíntese, levando a uma captura menor da concentração.
TABELA 11 - Parâmetros anatômicos utilizados para a análise com as concentrações de Hg por espécies no PEPB, RJ. Céls. Ab: células abaxiais por mm2. Céls adaxiais por mm2. Freq. Est.: Freqüência estomática por mm2. i.e.:índice estomático (relação entre células epidérmicas e estômatos) a. e. f.: área específica foliar (relação entre área e peso). Est/g: estômato por grama (estimado à partir da relação entre freqüência estomática e a.e.f.)
céls. Ab céls. ad freq. est i.e. ostíolo a.e.f est /g
[Hg]
ng/g
A. iricurana 2930±325 1781±86 186±14 6,0 17,7±2 8,6 1,61E+06 215
C. glandulosa 1087±123 873±42 201±15 15,6 28,7±3 3,8 7,74E+05 84
M. principes 1388±98 689±36 163±12 10,5 23,1±1 2,1 3,41E+05 60
C. trichotoma 933±48 1081±39 101±12 9,7 29,1±0,8 1,5 1,58E+05 170
P. gonoacantha 1950±154 1002±60 323±25 14,2 33,4±3 0,6 2,19E+05 190
Portanto, a condutância estomática é muito importante para avaliarmos o fenômeno da
captura do Hg e da possibilidade de estabelecer espécies bioacumuladoras de Hg através de
um parâmetro mais acessível. Não foi possível medir tal parâmetro pela indisponibilidade do
equipamento de medidas para fotossíntese, porém como condutância estomática se
positivamente correlacionada com a freqüência de estômatos (BOARDMAN, 1977), isso nos
permite através da contagem dos estômatos, avaliar a causa da maior ou menor concentração
de mercúrio por espécies. Para tanto, a contagem da freqüência estomática dada em mm2,
teve que ser transformada em relação a área de uma grama de massa seca da folha (Área
Especifica Foliar), para que fosse possível calcular a média de quantos estômatos existem por
grama de folha de cada espécie. Outra característica anatômica levada em consideração foi a
quantidade de tricomas que amplificam a área de superfície para adsorção de Hg e criam
proteções micro ambientais para uma maior eficiência fotossintética. As espécies que
apresentaram tricomas foram Cordia trichotoma (freqüência de tricomas na face adaxial: 35-
40/mm2 , abaxial: 5-10/mm2) e Piptadenia gonoacantha (freqüência de tricomas na face
abaxial: 58-70/mm2).
A correlação entre mercúrio e estômatos por grama é positiva, se considerarmos as
espécies que não apresentam tricomas (n=3 r=0,98 e p=0,12) e, apesar de apontar a tendência
não é significativa devido ao n muito baixo. A disparidade dos valores de Hg das espécies
com tricomas é evidenciada na figura 23, apesar de possuírem os menores valores de
estômatos por área específica foliar, acumulam grandes concentrações de Hg. Isso se deve ao
aumento da superfície foliar onde ocorre a adsorção de diversas espécies de mercúrio,
também pode estar interferindo na lixiviação do Hg das folhas durante eventos diretos de
chuva e no microclima da camada limítrofe da folha.
0
50
100
150
200
250
A. iricurana
C. glandulosa
M. principes
C. trichotom
a
P. gonoachanta
0,0E+00
2,0E+05
4,0E+05
6,0E+05
8,0E+05
1,0E+06
1,2E+06
1,4E+06
1,6E+06
1,8E+06
[Hg] ng/g
estômatos/a.e.f.
FIGURA 23 – Concentração de mercúrio foliar e a quantidade de estômatos por unidade de
área equivalente a 1 grama do peso seco, por espécie.
O índice estomático (i.e.) é muito utilizado em análise dos estômatos e suas interações.
O índice é composto segundo a equação 100*S / (E+S), sendo S o número de estômatos por
mm2 e E o número de células epidérmicas da mesma unidade. O i.e. é apresentado em
porcentagem e demonstra a relação entre estômatos e o total das células epidérmicas de uma
das faces da folha. Portanto quanto mais células epidérmicas em relação aos estômatos, menor
será o i.e. As concentrações deveriam se correlacionar com o i.e. das espécies, se
considerarmos que o Hg também necessita de um gradiente para se difundir dentro do tecido
vegetal, um maior número de células em relação ao de estômatos iria aumentar o gradiente de
concentração entre as células circundantes ao estômato. Gerando assim, uma maior oferta de
pontos para adsorção do Hg, que se deslocaria a favor do gradiente de concentração. Porém é
importante lembrar que este índice não leva em consideração a área específica foliar, mas de
qualquer forma corrobora com o alto valor de Hg em Alchornea iricurana.o qual possui o
menor valor de índice estomático.
O tamanho do ostíolo também não esteve correlacionado com as concentrações de
mercúrio provavelmente devido a fraca importância deste parâmetro para a fisiologia
funcional final da planta, que compensa o tamanho deste com muitos outros fatores, tais como
a densidade estomática, velocidade e capacidade do aparato fotossintético, além das
expressões bioquímicas dos fitoreguladores.
A quantidade de células adaxiais foi a que mais se aproximou de uma correlação
significativa com as concentrações de Hg (p= 0,09, r=0,80 e n=5), mesmo quando comparado
através da área específica para a freqüência de células adaxiais, abaxiais e estomáticas.
O parâmetro que mais se correlacionou com o Hg foi o número de estômatos por
grama de folha, mudando este comportamento quando a espécie apresentava tricomas. Porém
um maior número de espécies deve ser analisado no sentido de verificar o valor mais acurado
desta correlação, já que as amostras retiradas vieram de uma homogeneização de folhas de
idades diferentes. Pela impossibilidade na datação do brotamento da folha, foram
consideradas sua completa expansão durante a coleta e sua posição em relação aos brotos ou
folhas mais jovens.
O material foi coletado após período longo de chuvas (chuva de 30 mm em um
intervalo contínuo de 5 horas). Segundo Rea e colaboradores (2000), que comparou o Hg na
lavagem de folhas de 5 epécies e de folhas testes de teflon (expostas ao mesmo ambiente e
intervalo), esta precipitação seria mais do que suficiente para lavar o Hg adsorvido nas folhas
pela deposição seca. Mesmo assim, as espécies com tricomas apresentaram concentração
expressiva em relação ao número de estômatos por área específica foliar, o que nos leva a
questionar a influencia da lavagem em plantas tropicais com tricomas. Talvez não sendo tão
eficiente na remoção do Hg total adsorvido, quanto nas folhas com tricomas das espécies
temperadas e boreais, pois a lavagem das folhas em 4 séries de intervalos de 2 min. e 3
lavagens de 5 min. de duração lavou quase todo o Hg adsorvido nas folhas, se aproximando
do limite de detecção (REA et al., 2000)
Outra possibilidade de explicar o Hg persistente nas folhas das espécies com tricomas
do presente estudo, seria a distribuição vertical, já que se encontravam no terço médio do
dossel, onde há uma influência um pouco menor da chuva pois parte é interceptada na faixa
superior do dossel, indicando a necessidade da amostragem do Hg nas folhas de diferentes
partes do dossel. Assim, de modo semelhante a este trabalho, Rea e colaboradores (2000)
encontraram maiores concentrações de Hg adsorvido na superfície das folhas de Betula
papyrifera e Fagus grandifolia, espécies pubescentes (com tricomas), em comparação as
espécies glabras (sem tricomas) Acer rubrum, Quercus rubra e Populus grandidentata por
eles estudadas. De modo geral, neste trabalho, a presença de estruturas na epiderme foliar
estariam mais envolvidas com a adsorção do Hg na superfície das folhas, já que elevariam a
concentração das espécies com tricomas, e não estariam influenciando sozinhos o seqüestro
estomático, o qual predomina no processo de transferência pela serapilheira total e que, por
sua vez, correlaciona-se fortemente com os parâmetros climatológicos.
9.8 POSSÍVEIS FONTES LOCAIS DE MERCÚRIO.
Na tentativa de apontar uma possível fonte local de mercúrio, os ventos foram
divididos em quatro quadrantes, devido à posição da estação coletora de dados e do relevo
local, que restringe as direções. Na área estudada os ventos do quadrante Sul durante os onze
meses estudados, variaram entre 25% até 47% de dominância em relação às outras direções,
tendo menor incidência durante os meses de abril a julho. Os ventos do quadrante Norte
variaram entre 47% e 66% de dominância em relação às outras direções (Figura 24).
FIGURA 24 – Médias mensais da distribuição da direção dos ventos segundo sua dominância.
A velocidade variou significativamente entre as médias mensais do quadrante Sul em
relação às velocidades das direções Leste, Oeste e Norte, Havendo ventos mais intensos
destes últimos quadrantes (Figura 25). A média de todo o período do quadrante Sul foi de 6,6
km/h Leste 10,5 km/h, Norte de 8,0 km/h e Oeste de 9,3 km/h.
FIGURA 25 – Velocidade dos ventos em km/h, por quadrantes.
A direção dos ventos predominantes (S e N) durante cada 24 horas da região estudada
aponta para uma forte influência da brisa marítima sobre o local, os ventos do quadrante Sul
predominam durante o dia e do quadrante Norte durante a noite (Figura.26).
FIGURA 26 – Distribuição média anual dos ventos dominantes ao longo do dia no PEPB, RJ.
Logo a dispersão dos ventos nesta região indica pelo menos localmente, que do
quadrante Norte e Sul do ponto estudado, se originam os principais contribuidores do Hg
gasoso, sediando suas prováveis fontes (Figura 26). Apesar do quadrante Leste se destacar
pela intensidade dos ventos este apresenta uma baixa freqüência de observações, irrelevante
na análise da direção dominante. Em uma abordagem não específica podemos afirmar que a
região ao Norte de Camorim com um grande parque industrial, emissor de diversos gases
poluentes segundo FEEMA (2006), deve estar contribuindo efetivamente com as
Horário em que predominam
ventos NO-N-NE
27%
73%
Dia
Noite
Horário em que predominam
ventos SO-S-SE
71%
29%
Dia
Noite
concentrações de Hg encontrados neste trabalho, mesmo esta direção predominante durante a
noite, quando não existe seqüestro estomático, pois estes se fecham à noite. Ao Sul da região
estudada encontra-se o bairro residencial da Barra da Tijuca, com uma fonte considerável de
tráfego veicular. Estudos recentes demonstram a pequena contribuição de Hg, para a
atmosfera, oriundo do uso do óleo combustível ou gás natural veicular (GNV) (LARCEDA et
al., 2007). Para o primeiro é feito um controle rígido por parte dos produtores retirando o Hg
e outros metais pesados devido aos danos causados aos dutos e à maquinaria, enquanto o
GNV representa uma parte pouco expressiva devido à baixa concentração. A orla oceânica do
Bairro da Barra da Tijuca, distante apenas cerca de 4 km, também poderia estar sendo uma
fonte de Hg segundo a direção, como comentado anteriormente, apesar de os dados da
literatura (MASON et al., 1994) apontar para um balanço global zero entre a entrada e saída
de Hg em ambientes aquáticos, alguma influência local poderia estar sendo originada do mar.
Inclusive, a Baía de Sepetiba, a Sudoeste do sítio estudado, apresenta background elevado de
Hg em seu sedimento, maior que em outros pontos da costa brasileira (MARINS et al., 1996).
A Oeste da área de estudo se concentra um outro parque industrial, o de Santa Cruz, com uma
termelétrica operando com gás natural. Apesar da direção dos ventos superficiais não
apontarem predominantemente para aquela região ela pode representar alguma contribuição
até mesmo local já que está dentro a menos de 40 km do ponto estudado (Figura 26). Como
não há leis específicas para emissões atmosféricas de Hg, indústrias (usinas de cloro-soda e
fábricas de lâmpadas de Hg) e incineradoras de lixo (rejeitos diversos) emitem livremente este
metal para a atmosfera. Desconhecendo assim a precisa quantidade presente no material usado
e no rejeito final, devido também à ausência da análise específica deste elemento na entrada e
saída das indústrias.
As cidades da Baixada Fluminense, como Belford Roxo e São João de Meriti
estiveram classificados no índice de qualidade do ar (FEEMA, 2006) como má ou inadequada
em diversas vezes no ano de 2006, péssimas condições também foram conferidas ao bairro
industrial e residencial de Jacarepaguá contíguo a Camorim. O relatório também revelou que
por ter a segunda maior concentração de população, de veículos, de indústrias e de fontes
emissoras de poluentes do país, a análise atmosférica da Região Metropolitana sempre revela
altas concentrações de dióxido de enxofre (SO2), partículas totais em suspensão (PTS),
partículas inaláveis, (PI), monóxido de carbono (CO), ozônio (O3), hidrocarbonetos totais
(HC) e óxidos de nitrogênio (NOX), oriundos de fontes móveis e fixas. Estes níveis de
poluição, tendo a produção por combustão similar ao processo que leva à emissão de Hg
gasoso, estão de acordo com os níveis aqui encontrados, assim como as possíveis fontes
poluentes sugeridas.
Finalmente, os maciços da Tijuca (onde está a segunda maior floresta urbana do
mundo, a leste da área de estudo) e da Pedra Branca, paralelos à orla marítima, atuam como
barreira física aos ventos predominantes do mar, não permitindo a ventilação adequada das
áreas situadas mais para o interior. Como Camorim é situado entre os maciços estará
preferencialmente recebendo Hg oriundo da Baixada Fluminense (Norte) e da orla marítima
(Sul).
FIGURA 26 - Mapa da região metropolitana do Grande Rio, Sudeste do Estado do Rio de Janeiro. Em destaque o parque Industrial composto por
7 municípios, o Parque Estadual da Pedra Branca e o Parque Nacional da Tijuca. As setas indicam as direções dominantes dos ventos sobre a (1)
área de estudo (2) Estação metereológica da GeoRio e (3) FEEMA. (4) Bairro da Barra da Tijuca. Fonte: Fotosatélite NASA, 2008.
10 CONCLUSÃO
A concentração média de Hg encontrada na serapilheira coletada durante um ano na
Floresta do Camorim no PEPB foi de 238 + 52 ng g-1. O valor encontrado para a deposição
anual de serapilheira foi de 7,6 t ha-1. A partir destes valores foi obtido o fluxo anual de
mercúrio de 184 + 98 µg m-2.. A concentração média de Hg nas folhas vivas do dossel, das
cinco espécies mais representativas do PEPB, foi de 144 + 75 ng g-1. Estes valores revelam,
juntamente com outros trabalhos realizados em Florestas Tropicais, um papel de destaque
deste tipo florestal no seqüestro de Hg atmosférico com posterior deposição ao solo. A
despeito das diferenças entre Hg na serapilheira da Zona Temperada/Boreal e a Tropical, a
carga atmosférica de Hg deve estar influenciando em parte na obtenção destes altos valores.,
porém esta carga não foi medida neste trabalho.
A alta concentração de Hg na serapilheira do PEPB, entre 2005 e 2006 foi maior do
que os valores já levantados em florestas de outros locais do mundo. Sendo maior até quando
comparado aos valores encontrados no mesmo local em 2000 e 2001, e, maior ainda, quando
confrontado com outras análises em locais de maior altitude na Mata Atlântica, mesmo em
uma área inserida em uma região metropolitana maior que a do Rio de Janeiro, como a da
Cidade de São Paulo. A relação entre alta concentração de Hg na serapilheira e alta
concentração atmosférica de Hg, não seria tão dominante no seqüestro, quanto a capacidade
fisiológica para trocas gasosas dos indivíduos e fatores climáticos. Análises controladas em
campo, do fluxo de Hg atmosférico e foliar, devem ser realizadas em espécies tropicais para
certificar o grau de influência intrínseca da floresta.
Os fluxos de Hg encontrados na serapilheira, através de sua alta variação mensal,
apontam para influências climato/fenológicas no seqüestro do Hg realizado pelo grupo de
espécies que compõem a serapilheira analisada. Essa variação correlacionou-se positivamente
com os fluxos da serapilheira depositada, que foi dominante no fluxo de Hg, juntamente com
a concentração. Porém a deposição de serapilheira apresentou uma dominância mais forte. A
fração folhas foi a única que manteve correlação com o fluxo confirmando a relevância deste
órgão na incorporação do Hg.
A precipitação mensal, no período estudado, variou negativamente nos meses mais
quentes do ano em relação a concentração de Hg na serapilheira. Porém, não obteve
correlação em todo o intervalo, de modo que, não podemos postular a precipitação como
sendo fator dominante nesta variação de Hg mensal. A precipitação elevada dos meses mais
quentes do ano estaria lavando as folhas e carreando o Hg da epiderme foliar antes da análise.
A temperatura mostrou-se como o melhor parâmetro climático dominante no processo
de seqüestro do Hg pelas folhas. Porém isso ocorre com a temperatura correspondente aos
dois meses anteriores ao valor da concentração de Hg correlacionada. De fato, as plantas
apresentam um intervalo de ativação dos processos fenológicos, ordenados por
fitoreguladores (hormônios) do crescimento e da abscisão das folhas. Pulsos de seqüestro de
Hg estariam regulados pela temperatura dos meses anteriores. Em uma análise qualitativa
podemos dizer que o melhor momento para absorção do Hg atmosférico pela floresta do
PEPB acontece em meses com dias de alta precipitação, temperatura acima da média anual e
seguido por dias com sol.
A análise do Hg presente nas folhas de 5 espécies representativas da floresta do
Camorim no PEPB, indicam uma média de 143,9 + 75,0 ng g-1, com valores extremos de
215,2 ng g-1 para Alchornea iricurana e 60 ng g-1 para Metternichia principes. Dos
parâmetros anatômicos levantados, somente a quantidade de estômatos por grama de folha se
correlacionou com as concentrações de Hg positivamente, exceto, pelas espécies com
presença de tricomas na superfície foliar. Isto revela que, apesar da entrada via estômatos ser
a dominante, a área de superfície ampliada pelos tricomas pode estar exercendo papel
importante para o acúmulo de Hg na área estudada.
Segundo a estimativa realizada aqui, de 8 a 28 toneladas de Hg anuais são depositados
pela serapilheira e pela transprecipitação, nos 7% restantes de Mata Atlântica original. Mesmo
considerando as incertezas desta estimativa, é evidente o risco em potencial de evasão do
mercúrio acumulado em ecossistemas florestais tropicais, já que se amplia a degradação
destes, além dos riscos diretos na bioacaumulação e biomagnificação da biota. Estes valores
apontam também, para a necessidade da inclusão desta transferência nos planos de manejo
florestais para o trópico, além de ressaltar a importância da preservação e conservação destes
biomas para o bem estar a nível mundial, considerando o caráter global do Hg como poluente.
11 REFERÊNCIAS:
ABREU, J.R.S.P. Dinâmica da serapilheira em um trecho de floresta secundária em área
urbana do Rio de Janeiro. 2006. 79 f. Dissertação (Mestrado) Ciências Ambientais e
Florestais - Universidade Federal Rural do Rio de Janeiro, Seropédica, 2006.
ALMEIDA, M. D. D. Biogeoquímica do mercúrio na interface solo-atmosfera na Amazônia. 187 f. Tese (Doutorado) Geoquímica Ambiental, Universidade Federal Fluminense. Niterói, 2005 AL-MOMANI, I. F. Trace elements in atmospheric precipitation at Northern Jordan measured by ICPMS: acidty and possible sources. Atmospheric Environment, v.37, p.4507-4515, 2003. ARATO, H. D.; MARTINS, S. V.; FERRARI, S. H. D. S. Produção e decomposição de serapilheira em um sistema agroflorestal implantado para recuperação de área degradada em Viçosa-MG. Árvore, v.27, n.5, p.715-721, 2003. BAKIR, F. Methylmercury poisoning in Iraq. Science, v.181, n.96, p.230-241, 1973. BENCKE, C. S. C.; MORELLATO, E. L. P. C. Estudo comparativo da fenologia de nove espécies arbóreas em três tipos de floresta atlântica no sudeste do Brasil. Revista Brasileira de Botânica, v.25, n.2, p.237-248, 2002. BISHOP, K. H.; LEE, Y.-H.; MUNTHE, J.; DAMBRINE, E. Xylem sap as a pathway for total mercury and methylmercury transport from soils to tree canopy in the boreal forest. Biogeochemistry, v.40,, n.2-3 / March, 1998.
BOARDMAN, N.K. Comparative Photosynthesis of Sun and Shade Plants. Annual Review of Plant Physiology. v. 28 p.355-377. 1977
BOEGER, M.R.T., ALVES, L.C., NEGRELLE, R.R.B. Leaf morphology of 89 tree species from a lowland tropical rain forest (Atlantic forest) in South Brazil. Braz. arch. biol. technol., v. 1.47, n.6, p.933-943. 2004
BUDOWSKI, G. Distribution of tropical American Rain Forest trees in the light of successional process. Turrialba v.15, p. 40-45. 1965.
CARPI, A.; LINDBERG, S. E. Application of a Teflon (TM) dynamic flux chamber for quantifying soil mercury flux: Tests and results over background soil. Atmospheric Environment Review, v.32, n.5, p.873-882, 1998. CECON, K. Deposição de elementos traços em solo de floresta de Mata Atlântica via serapilheira. Campinas, 2003. 78 f. Dissertação - Instituto de Química, UNICAMP. CINTRA, A. T. D. F. Entradas atmosféricas de nutrientes e poluentes em um ecossistema florestal urbano, Maciço da Pedra Branca - RJ. Rio de Janeiro, 2004- Departamento Química, PUC.
COCKING, D.; ROHRER, M.; THOMAS, R.; WALKER, J.; WARD, D. Effects of root morphology and Hg concentration in the soil on uptake by terrestrial vascular plants. Water, Air, & Soil Pollution, v.80, n.1-4 February, 1995. COSTA A.R. As relações hídricas das plantas vasculares . Universidade de Évora - Portugal. Disponível em: <http://www.angelfire.com/ar3/alexcosta0/RelHid/RhwIndi ce.htm>. Acesso em: 21 fev. 2007. CUSTODIO-FILHO, A.; FRANCO, G. A. D. C.; DIAS, A. C. Produção de serapilheira em floresta pluvial atlântica secundária, Parque Estadual da serra do Mar (Cunha, São Paulo, Brasil).Revista do Instituto Florestal. v.9, n.2, p.103-110, 1997. DE FRANÇA, E. J.; FERNANDES, E. A. D. N.; BACCHI, M. A.; SAIKI, M. Native Trees as Biomonitors of Chemical Elements in the Biodiversity Conservation of the Atlantic Forest. Journal of Atmospheric Chemistry, v.49, n.1-3 November, p.579-592, 2004. DE FRANÇA, E. J. A biomonitoração da Mata Atlântica na conservação da biodiversidade: epécies nativas acumuladoras de elementos químicos., 380 f. Tese (Doutorado) Ecologia de agroecossistemas. ESALQ/USP, Piracicaba, 2006 DE LUCIA, E.H.; HECKATHORN, S.A. The effect of soil drought on water use efficiency in a contrasting Great Basin desert and Sierran montane species. Plant, Cell and Environment, v.12, p.935-940, 1989 DINIZ, S. e S. N. PAGANO. Dinâmica de folhedo em floresta mesófila semidecídua no município de Araras, SP. I – Produção, decomposição e acúmulo. . Revista do Instituto Florestal, v.9, n.1, p.27-36. 1997. DUNIN, F.X.; ASTON, A.R. The development and proving of models of large-scale evapotranspiration: an Australian study. Agricultural Water Management, v.8, p.305-323, 1984. ELLIS, R. W.; ESLICK, L. Variation and Range of Mercury Uptake into Plants at a Mercury-Contaminated Abandoned Mine Site. Bull. Environ. Contam. Toxicol., v.59, p.763-769, 1997. ERICKSEN, J. A.; GUSTINA, M. S.; SCHORRAN, D. E.; JOHNSON, D. W.; LINDBERG, S. E.; COLEMAN, J. S. Accumulation of atmospheric mercury in forest foliage. Atmospheric Environment, v. 37, p.1613-1622, 2003. FADINI, P. S.; JARDIM, W. F. Is the Negro River Basin (Amazon) impacted by naturally occurring mercury? The Science of the Total Environment, v.275, p.71-82, 2001. FEEMA. Relatório anual da qualidade do ar. 2006.- Fundação Estadual de Engenharia do Meio Ambiente - RJ Disponível em: <www.feema.rj.gov.br>. Acesso em 23/04/2007. FERRAZ, D. K.; ARTES, R.; MANTOVANI, W.; MAGALHÃES, L. M. Fenologia de árvores em fregmento de mata em São Paulo, SP. Revista Brasileira de Biologia, v.59, n.2, p.305-317, 1999.
FITZGERALD, W.F.; CLARKSON, T.W. (1991) Mercury and monomethylmercury: present and future concerns. Environmental Health Perspectives 96:159-166 FITZGERALD, W. F.; ENGSTROM, D. R.; MASON, R. P.; NATER, E. A. The Case for Atmospheric Mercury Contamination in Remote Areas. Environmental Science & Technology, v.32, n.1, 1998. FLECK, J. A.; GRIGAL, D. F.; NATER, E. A. Mercury uptake by trees: an observational experiment. Water, Air, and Soil Pollution, v.115, p.513-523, 1999. FOSTIER, A.-H.; FORTI, M. C.; GUIMARAES, J. R. D.; MELFI, A. J.; BOULET, R.; SANTO, C. M. E.; KRUG, F. J. Mercury fluxes in a natural forested Amazonian catchment Serra do Navio, Amapa State, Brazil. The Science of the Total Environment v.260, p.201-211, 2000. FOSTIER, A.-H.; CECON, K.; FORTI, M. C. Urban influence on litterfall trace metals fluxes in the Atlantic forest of São Paulo (Brazil). J. Phys. IV, v.107, p.491, 2003. FRESCHOLTZ, T. F.; GUSTIN, S. Soil and foliar mercury emission as a function of soil concentration. Water, Air, and Soil Pollution, v.00, p.1-15, 2004.
GOLLAN, T.; PASSIOURA, J.B.; MUNNS, R. Soil water status affects stomatal conductance of fully turgid wheat and sunflower leaves. Australian Journal of Plant Physiology, Melbourne, v. 13, n. 3, p. 459-464, May/Jun. 1986. GRAYDON, J. A.; LOUIS, V. L. S.; LINDBERG, S. E.; HINTELMANN, H.; KRABBENHOFT, D. P. Investigation of Mercury Exchange between Forest Canopy Vegetation and the Atmosphere Using a new Dynamic Chamber. Environ. Sci. Technol., v.40, p.4680-4688, 2006. GRIGAL, D. F.; KOLKA, R. K.; FLECK, J. A.; NATER, E. A. Mercury budget of an upland-peatland watershed. Biogeochemistry v.50, p.95-109, 2000. GRIGAL, D. F. Inputs and outputs of mercury from terrestrial watersheds: a review. Environmental Review, v.10, p.1-39, 2002. GRIGAL, D. F. Mercury Sequestration in Forests and Peatlands. Journal of Environmental Quality, v.32, p.393-405, 2003. HANSON, P. J., S. E. LINDBERG, et al. Foliar exchange of mercury vapor: evidence for a compensation point. Water, Air, and Soil Pollution, v.80, p.373-382. 1995.
HINCKLEY, T.M., J.P. LASSOIE, S.W. RUNNING. Temporal and spatial variations in the water status of forest trees. For. Sci. Monogr. v.20 p.1-72. 1978. INOUE, M. T. E C. B. REISSMANN. Efeitos da poluição na fotossíntese, dimensões da folha, deposição de particulados e conteúdo de ferro e cobre em alfeneiro (ligustrum lucidum) da arborização de Curitiba. PR Floresta v.21, n.12. 1991. INPE, Instituto Nacional de Pesquisas Espaciais. Monitoramento da floresta Amazônica por satélite
IVERFELDT, Å. Mercury in forest canopy throughfall water and its relation to atmospheric deposition. Water, Air, & Soil Pollution, v.56, n.1, p.553-564, 1991. JACKSON, J. F. Seasonality of flowering and leaf-fall in a Brazilian subtropical lower montane moist forest. Biotropica, v.10, n.1, p.38-42, 1978. JANZEN, D. H. Ecologia vegetal nos trópicos. São Paulo: Ed. da Universidade de São Paulo, 1980. 79 p.
JORDAN, C.F., GOLLEY, F.B., HALL, J. Nutrient scavenging of rainfall by the canopy of an Amazonian rain forest. Biotropica v.16, p.61–66. 1980 KAGEYAMA, P.Y. & CASTRO, C.F.A. Secessão secundária, estrutura genética e plantações de espécies arbóreas nativas. Revista do IPEF v. 41/42, p. 83-93, 1989.
KOZLOWSKI T. T. ; Impacts of Air Pollution on Forest Ecosystems. BioScience, Vol. 30, No. 2., pp. 88-93, 1980. KOZLOWKI, T. T. E S. G. PALLARDY. Physiology of Woody Plants: Academic Press. 1997. 411 p. KRAUS, J. E. E M. ARDUIN. Manual basico de metodos em morfologia vegetal Seropedica, RJ (Brazil): Editora Universidade Rural, Universidade Federal Rural do Rio de Janeiro. 1997. 198 p. LACERDA, L. D.; MARINS, R. V. Anthropogenic mercury emissions to the atmosphere in Brazil: The impact of gold mining. Journal of Geochemical Exploration, 58:2-3, pp 223-229. 1997 LACERDA, L.D., PARAQUETTI, H.H.M., REZENDE, C.E., SILVA, L.F.F., SILVA-FILHO, E.V., MARINS, R.V., RIBEIRO, M.G. Mercury concentrations in bulk atmospheric deposition over the coast of Rio de Janeiro. J. Brazil Chem. Soc. v.13 (2), p. 165–169. 2002 LACERDA, L. D.; SANTOS A. F.; MARINS R. V.; Emissão de Mercúrio para a Atmosfera pela Queima de Gás Natural no Brasil. Química Nova v.30 n.2 p. 366-369, 2007 LAMBORG, C. H. An examination of the atmospheric chemistry of mercury using Pb-210 and Be-7. Journal of Atmospheric Chemistry, v.36, n.3, p.325-338. 2000. LARCHER, W. Physiological Plant Ecology. Berlin: Springer. 2000. 324 p. LECHLER P, MILLER J, WARWICK J, LYONS B. Mercury concentrations in channel bed sediments, floodplain sediments, and lateric soils of the Madeira river basin, Brazil: Implications for anthropogenic versus natural sources. EOS, Transactions, American Geophysical Union, v. 78, n. 46, supplement. 1997 LIDE, R.; KEHIAIAN, H. V.; CRC Handbook of Thermophysical and Thermochemical Data, CRD. Press, 1994 pp. 81
LIMA, W. P.; As florestas e a poluição do ar. IPEF - Série Técnica.;v.1, n.1, p.1-41, 1980 LINDBERG, S. E.; TURNER, R. R.; MEYERS, T. P.; JR, G. E. T.; SCHROEDER, W. H. Atmospheric concentrations and deposition of Hg to a Deciduous Forest at Walker Branch Watershed, Tennessee, USA. Water, Air, and Soil Pollution v.56, p.577-594, 1991. LINDBERG, S.E., OWENS, J.G., STRATTON, W., 1994. Application of throughfall methods to estimate dry deposition of mercury. In: WATRAS, C.J., HUCKABEE, J.W. (Eds.), Mercury Pollution: Integration and Synthesis. Lewis Publishers, Palo Alto, pp.261–271. MAGARELLI, G. Fluxos de mercúrio gasoso na interface solo/atmosfera na bacia do rio negro utilizando câmaras dinâmicas de fluxo. Campinas, 2006. 125 f. Tese - Departamento de Química Analítica, UNICAMP. MAGURRAN, A. E. Ecological diversity and its measurement. Cambridge, University Press, London, 1988, 179 p. MARINS, R. V.; SILVA, E. V.; LACERDA, L. D. Atmospheric deposition of mercury over Sepetiba Bay, SE Brazil. Journal of the Brazilian Chemical Society, v.7, n.3, p.177-180, 1996. MARTINS, S. V.; R. R. RODRIGUES. Produção de serapilheira em clareiras de uma floresta estacional semidecidual no município de Campinas, SP. Revista Brasileira de Botânica, v.22, n.3, p.405-412. 1999. MARK, C. G.; WILLIAMSON, D. G. Principal biogeochemical factors affecting the speciation and transport of mercury through the terrestrial environment. Environmental Geochemistry Health, v.26, p.421-434, 2004. MASON, R. P., W. F. FITZGERALD, et al. The biogeochemical cycling of elemental mercury: Anthropogenic influences. . Geochem. Cosmochim. Acta, v.58, n.15, p.31-3198. 1994. MEIDNER, H. E D. W. SHERIFF. The role of water in plants. In: H. MEIDNER E D. W. SHERIFF (Eds.). Water and Plants. New York: John Wiley & Sons, 1976. The role of water in plants, pp.128-135 MÉLIÈRES, M.-A.; POURCHET, M.; CHARLES-DOMINIQUE, P.; GAUCHER, P. Mercury in canopy leaves of French Guiana in remote areas. The Science of The Total Environment, v.311, n.1-3, p.261-267, 2003. MILLER, P. P.; J. R. MC BRIDE. Effects of air pollutants on forests. . In: J. B. MUDD E T. T. KOZLOWSKI (Eds.). Responses of plants to air pollution. New York: Academic Press, 1975. p.195-235 MILLHOLLEN, A. G.; GUSTIN, M. S.; OBRIST, D. Foliar Mercury Accumulation and Exchange for Three Tree Species. Environ. Sci. Technol., v.40, p.6001-6006, 2006a.
MILLHOLLEN, A. G., D. OBRIST, et al. Mercury accumulation in grass and forb species as a function of atmospheric carbon dioxide concentrations and mercury exposures in air and soil. Chemosphere, v.65, p.889-897. 2006b. MIRETZKY, P.; BISINOTI, M. C.; JARDIM, W. E.; ROCHA, J. C. Factors affecting Hg (II) adsorption in soils from the Rio Negro basin (Amazon). Quimica Nova, v.28, n.3, p.438-443, 2005. MUELLER-DOMBOIS, D., ELLENBERG, G.H. Aims and methods of vegetation ecology. New York: Willey & Sons, 1974. 547p. MUNTHE, J.; HULTBERG, H.; IVERFELDT, A. Mechanisms of deposition of methylmercury and mercury to coniferous forests. Water, Air, & Soil Pollution, v.V80, n.1, p.363-371, 1995. MUNTHE, J.; LYVÉN, B.; PARKMAN, H.; LEE, Y.-H.; IVERFELDT, Å.; HARALDSSON, C.; VERTA, M.; PORVARI, P. Mobility and methylation of mercury in forest soils. Water, Air, and Soil Pollution, v.Focus 1, p.385-393, 2001. MUNTHE, J.; HULTBERG, H. Mercury and methylmercury in runoff from a forested catchment - concentrations, fluxes, and their response to manipulations. Water, Air, and Soil Pollution Focus, v.4, p.607-618, 2004. MYERS N, MITTERMEIER RA, MITTERMEIER CG, FONSECA G.A.B., KENT J. Biodiversity hotspots for conservation priorities. Nature 2000;403(24 ):853-8. NASA; Fotosatélites do programa Google Earth® v 4.2, Imagem: DigitalGlobe 2007 Disponível em:<kh.google.com> (servidor) Acesso em 23/01/2007 NRIAGU, J. O. Produces and uses of mercury. In: (Ed.) NRIAGU, J. O. The Biogeochemistry of Mercury in the environmental. Amsterdam: Elsevier, 1979. p.23-40. NRIAGU J. O.; PACYNA J. M. Quantitative assessment of worldwide contamination of air water and soils by trace metals. Nature. v. 333, p. 134-139, 1988. OLIVEIRA, R. R.; ZAÚ, A. S. Método alternativo de subida em árvore. Bromélia, v.2, n.11, p.6-11, 1995. OLIVEIRA, R. R.; ZAÚ, A. S.; LIMA, D. F.; SILVA, M. B. R.; VIANNA, M. C.; SODRÉ, D. O.; SAMPAIO, P. D. Significado ecológico de orientação de encostas no maciço da Tijuca, Rio de Janeiro. Oecologia Brasiliensis: estrutura, funcionamento e manejo de ecossistemas brasileiros. v.1 p.523-541. 1995 OLIVEIRA, R. R. As marcas do homem na floresta - História ambiental de um trecho urbano de mata atlântica. São Paulo: Edições Loyola, 2004. 211 p. OLIVEIRA, R. R. D.; SILVEIRA, C. L. P. D.; MAGALHÃES, A. C.; FIRME, R. P. Ciclagem de metais pesados na serapilheira de uma floresta urbana no Rio de Janeiro. Floresta e Ambiente, v.13, 2006.
OLIVEIRA-FILHO, A. T.; M.A.L., F. Patterns of floristic differentiation among Atlantic forests in south-eastern Brazil, and the influence of climate. . Biotropica, v.32 n.4b, p.793-810., 2000. PACYNA, E. G.; PACYNA, J. M. Global emission of mercury from anthropogenic sources in 1995. Water, Air, and Soil Pollution, v.137, p.149-165, 2002. PATRA, M.; SHARMA, A. Mercury Toxicity in Plants. The Botanical Review, v.66, n.3, p.379-422, 2000. PENNA-FIRME, R.; VICENZ, R. S.; MACEDO, G. V.; SILVA, I. M.; OLIVEIRA, R. R. Estrutura da vegetação de um trecho de mata atlântica sobre solos rasos (Maciço da Pedra Branca, RJ). Eugeniana, v.25, p.3-9, 2001. PIRRONE, N., KEELER, G. J., AND NRIAGU, J. O. Regional differences in worldwide emissions of mercury to the atmosphere: Atmospheric Environment, v. 30, p. 2981-2987. 1996. POGGIANI, F.; SCHUMACHER, M. V., Eds. Ciclagem de nutrientes em florestas nativas. nutrientes em Florestas Nativas. In: GONÇALVES, J. L. M.; BENEDETTI, V. (Eds) Nutrição e Fertilização Florestal. Piracicaba: IPEF, p.427, Nutrição e fertilização florestal. 2000. POMPÉIA, S. L., Ed. Efeitos da poluição atmosférica na floresta tropical e seus reflexos na conservação dos solos na Serra do Mar, em Cubatão (SP). Recuperação de áreas degradadas. . Viçosa-MG: UFV, p.251, Recuperação de áreas degradadas. ed. 1998. PROCTOR, J. Tropical forest litterfall I - Problems of data comparison. In: SUTTON, S. L., et al (Ed.). Tropical rain forest: ecology and management. London: Blacckwell Scientific Publications, 1983. 267-273 p. RASMUSSEN, P. E.; MIERLE, G.; NRIAGU, J. O. The analysis of vegetation for total mercury. Water, Air, and Soil Pollution, v.56, p.379-390, 1991. RAVEN, P. H.; EVERT, R. F.; EICHHORN, S. E. Biologia Vegetal. 6ed. Rio de Janeiro: Guanabara-Koogan S.A., 2001. 906 p. REA, A. W. The processing of mercury in forested ecosystems. Michigan, 1999. 126 f. PhD -, UNIVERSITY OF MICHIGAN. REA, A. W.; KEELER, G. J.; SCHERBATSKOY, T. The deposition of mercury in throughfall and litterfall in the Lake Champlain watershed: a short-term study. Atmospheric Environment, v.30, n.19, p.3257-3263, 1996 REA, A. W.; LINDBERG, S. E.; KEELER, G. J. Assessment of Dry Deposition and Foliar Leaching of Mercury and Selected Trace Elements Based on Washed Foliar and Surrogate Surfaces. Environ. Sci. Technol., v.34, p.2418-2425, 2000.
REA, A. W.; LINDBERG, S. E.; KEELER, G. J. Dry deposition and foliar leaching of mercury and selected trace elements in deciduous forest throughfall. Atmospheric Environment, v.35, p.3453-3462, 2001. REA, A. W.; LINDBERG, S. E.; SCHERBATSKOY, T.; KEELER, G. J. Mercury Accumulation in Foliage over Time in Two Northern Mixed-Hardwood Forests. Water, Air, & Soil Pollution, v.133, n.1, p.49-67, 2002. RODRIGUES, L. A.; SOUZA, A. P. D.; MARTINEZ, H. E. P.; PEREIRA, P. R. G.; FONTES, P. C. R. Absorção e translocação de Zinco em feijoeiro aplicado via foliar. Revista Brasileira de Fisiologia Vegetal, v.9, n.2, p.111-115, 1997. ROULET, M.; LUCOTTE, M.; SAINT-AUBINA, A.; TRANA, S.; RHEAULTA, I.; FARELLA, N.; SILVA, E. D. J. D.; DEZENCOURTB, J.; PASSOS, C.-J. S.; SOARES, G. S.; GUIMARAES, J.-R. D.; MERGLER, D.; AMORIME, M. The geochemistry of mercury in central Amazonian soils developed on the Alter-do-Chão formation of the lower Tapajós River Valley, Pará state, Brazil. The Science of the Total Environment, v.223, p.1-24, 1998. RUGH, C. L.; SENECOFF, J. F.; MEAGHER, R. B.; MERKLE, S. A. Development of transgenic yellow poplar for mercury phytoremediation. Nature Biotech., n.16, p.925-928, 1998. SANTOS, E. C. O.; CÂMARA, V. M.; BRABO, E. S.; LOUREIRO, E. C. B.; JESUS, I. M.; FAYAL, K.; SAGICA, F.; Avaliação dos níveis de exposição ao mercúrio entre índios Pakaanóva, Amazônia, Brasil. Caderno Saúde Pública, Rio de Janeiro, v.19 n.1 p.199-206. 2003. SANTOS, G. M.; CORDEIRO, R. C.; SILVA-FILHO E. V.; TURCQ, B.; LACERDA L. D.; FIFIELD, L.K.; GOMES, P.R.S.; HAUSLADEN, P.A.; SIFEDDINE, A.; ALBUQUERQUE, A. L.S.; Chronology of the atmospheric mercury in Lagoa da Pata Basin, upper Rio Negro Region of Brazilian Amazon. Radiocarbon, v.43, n.2B, p-801-808, 2001 SCHLUTER, K. Review: evaporation of mercury from soils. An integration and synthesis of current knowledge. Environmental Geology, v.39, n.3-4, p.249-271. 2000. SCHROEDER, W. H.; MUNTHE, J. Atmospheric mercury - An overview. Atmospheric Environment v.32, p.809-822., 1998. SCHULTE, P. J., HINCKLEY, T. M., AND STETTLER, R. F. Stomatal responses of Populus to leaf water potential. : Canadian Journal of Botany, v. 65, p. 255-260. 1987. SCHWESIG, D.; MATZNER, E. Dynamics of mercury and methylmercury in forest floor and runoff of a forested watershed in Central Europe. Biogeochemistry, v.53, p.181-200, 2001. SCHWESIG, D.; KREBS, O. The role of ground vegetation in the uptake of mercury and methylmercury in a forest ecosystem. Plant and Soil, v.V253, n.2, p.445-455, 2003. (10.1023/A:1024891014028)
SHEEHAN, K. D.; FERNANDEZ, I. J.; KAHL, J. S.; AMIRBAHMAN, A. Litterfall mercury in two forested watersheds at Acadia National Park, Maine, USA. Water, Air, and Soil Pollution, v.170, p.249-265, 2006. SILVA-FILHO N. L.; Recomposição da cobertura vegetal de um trecho degradado da serra do mar, Cubatão, SP. Campinas: Fundação Gargill; 1988. 53 p.
SILVA-FILHO, E. V.; OLIVEIRA, R. R.; MACHADO, W.; SELLA, S. M.; LACERDA, L. D. Mercury deposition through litterfall in an Atlantic Forest at Ilha Grande, Southeast Brazil Chemosphere, v.65, n.11, p.2477-2484, 2006. SILVA FILHO, E.V., OVALLE, A.R.C., BROWN, I.F. Precipitação ácida no Parque Nacional da Tijuca, Rio de Janeiro, Ciência e Cultura, São Paulo, v. 39, n. 4, p. 419, 1984 SILVA, E. D.; CINTRA, A. T. D. F.; SILVEIRA, C. L. P. D.; OLIVEIRA, R. R. D. Interceptação e propriedades físico-químicas da precipitação na mata atlântica do maciço da Pedra Branca, RJ. In: SIMPÓSIO BRASILEIRO DE GEOGRAFIA FÍSICA APLICADA, 10, 2003, Rio de Janeiro. Anais. Rio de Janeiro: UERJ, 2003. SOLÓRZANO, A.; OLIVEIRA, R. R.; GUEDES-BRUNI R. R. História Ambiental e estrutura da Mata Atlântica. In: OLIVEIRA, R. R. (Org.). As marcas do homem na floresta: História Ambiental de um trecho urbano de Mata Atlântica. Rio de Janeiro: Editora PUC-Rio, 2005, p. 87-118. ST-LOUIS, V. L.; RUDD, J. W. M.; KELLY, C. A.; HALL, B. D.; ROLFHUS, K. R.; SCOTT, K. J.; LINDBERG, S. E.; DONG, W. Importance of the Forest Canopy to Fluxes of Methyl Mercury and Total Mercury to Boreal Ecosystems. Environmental Science Technology, v.35, p.3089-3098, 2001. TALORA, D. C.; MORELLATO, P. C. Fenologia de espécies arbóreas em floresta de planície litorânea do sudeste do Brasil. Revista Brasileira de Botânica, v.23, n.1, p.13-26, 2000. THOMAS, W. W; CARVALHO A. M. V.; AMORIM, A.M.A.; GARRISON J.; ALBERLA´EZ A.L. Plant endemism in two forests in southern Bahia, Brazil. Biodiversity and Conservation, v.7, n.3, p.311-322. 1998. TRINDADE, H.A.; PFEIFFER, W.C.; LONDRES, H.; COSTA-RIBEIRO, C.L. Atmospheric concentration of metals and total suspended particulates in Rio de Janeiro. Environmental Science & Technology, Easton, v.15, n.1, p.84-89. , 1981 USEPA, Fate and transport of mercury and mercury compounds. United States Environmental Protection Agency. EPA-452/R-97-005, 1997. VÁSQUEZ-YANES, C. 1980. Notas sobre la autoecologia de los arboles pioneros de rápido crecimento de la selva tropical lluviosa. Tropical Ecology, v. 21, n. 1, p. 103-112, 1980. VELOSO, H. P.; RANGEL-FILHO, A. L. R.; SILVA, J. C. A. Classificação da vegetação brasileira adaptada a um sistema universal. Rio de Janeiro: IBGE, 1991. 123 p.
WANG, D., BACHELARD, E. P., BANKS, J. C. G., 1988, Growth and water relations of seedlings of two subspecies of E. globulus. Tree Physiology, v. 4, p. 129-138. WARING, R. H.; W. H. SCHLESINGER. Forest Ecosystems Concepts and Management. Orlando Academic Press, Inc. 1985. p.121-157 WHO (World Health Organization). Air Quality Guidelines 2ª edição. 2000.






























































































![e'e - wsrc.mnis.wsrc.mn › uploads › files › ... › sanhuu...sudalgaa.pdf · 3 ®a¯¯ewel¯¯^ Owf`bo gw]` hg hg hg hg hg hg »k»el [mmjZel - Gbcllmk]Zca»\r»»j»e wawfrb]q](https://static.fdocumentos.com/doc/165x107/5f122ea398fae574504c501e/ee-wsrcmniswsrcmn-a-uploads-a-files-a-a-sanhuu-3-aewel.jpg)