MOLECULAR DE TRICHOLOMA EQUESTRE -...
Transcript of MOLECULAR DE TRICHOLOMA EQUESTRE -...

UNIVERSIDADE DE LISBOA
FACULDADE DE CIÊNCIAS
DEPARTAMENTO DE BIOLOGIA VEGETAL
CARACTERIZAÇÃO MORFOLÓGICA E
MOLECULAR DE TRICHOLOMA EQUESTRE /
T. AURATUM PARA UMA ABORDAGEM
TAXONÓMICA
Sofia Isabel Fernandes Gomes
MESTRADO EM MICROBIOLOGIA APLICADA
2011

UNIVERSIDADE DE LISBOA
FACULDADE DE CIÊNCIAS
DEPARTAMENTO DE BIOLOGIA VEGETAL
CARACTERIZAÇÃO MORFOLÓGICA E
MOLECULAR DE TRICHOLOMA EQUESTRE /
T. AURATUM PARA UMA ABORDAGEM
TAXONÓMICA
Dissertação orientada por Prof. Doutor J. L. Baptista-Ferreira
e Prof. Doutor Rogério Tenreiro
Sofia Isabel Fernandes Gomes
MESTRADO EM MICROBIOLOGIA APLICADA
2011

CARACTERIZAÇÃO MORFOLÓGICA E
MOLECULAR DE TRICHOLOMA EQUESTRE /
T. AURATUM PARA UMA ABORDAGEM
TAXONÓMICA
Sofia Isabel Fernandes Gomes
TESE DE MESTRADO
2011
Esta tese foi realizada no Centro de Micologia da Unversidade de Lisboa, sob orientação do Prof. Doutor J. L. Baptista-Ferreira, com a colaboração da Inv. Auxiliar Ireneia Melo, e também no Centro de Biodiversidade, Genómica Integrativa e Funcional (BioFIG-FCUL) sob a orientação directa do Prof. Doutor Rogério Tenreiro no âmbito do Mestrado em Microbiologia Aplicada da Faculdade de Ciências da Universidade de Lisboa.

E, porque passar por esta tese não teria sido a mesma coisa sem vocês…
…………Agradeço a…Agradeço a…Agradeço a…Agradeço a…
Em primeiro, aos meus orientadores por me terem proporcionado esta grande
oportunidade de aprofundar os meus conhecimentos e pelo apoio dado: ao professor Baptista-
Ferreira por todos os meios e ajuda que me proporcionou, tornando possível a execução tanto
desta tese, como de outros trabalhos simultâneos em que estamos envolvidos; à professora
Ireneia Melo por, apesar de não ser minha orientadora oficial, deu uma ajuda essencial na
execução e revisão da tese; ao professor Rogério Tenreiro por acreditar e fazer-me a mim
própria acreditar nas minhas capacidades e por tudo o que eu consegui aprender.
Aos herbários espanhóis que emprestaram o material de referência utilizado neste
estudo.
Ao Sr. Tiago Sena, à Tânia Santos e à Andreia pela ajuda na colheita de alguns
cogumelos.
À professora Lélia Chambel, à Sandra Chaves e ao Daniel McGuire por terem estado
sempre disponíveis para ‘apagar os fogos’ que iam surgindo.
Ao ‘pessoal’ do laboratório, professora Ana Tenreiro, Maria Inês Cardoso, Cátia Fidalgo,
pelo incentivo, preocupação e momentos de descontração.
À Ana Catarina Silva, Inês Modesto e Renata pelas ‘luzes’ na parte filogenética.
À Adri, Çalo, Cisco, Duds, Marta, Natinha, Patt, Pio, Su e Tomé por terem estado sempre
lá e por todos os momentos de diversão.
À Guiglas, ao Leo, ao Blubly e à Mariana por estarem presentes diariamente no final de
cada dia.
À família, mãe, pai e Anita, apenas por existirem.
Obrigada!Obrigada!Obrigada!Obrigada!

Abstract
The yellow tricholoma is one of the most frequently consumed wild mushroom among
the rural populations in Portugal. It is known under a wide range of names throughout the
country, depending on the collecting region. According to some authors, Tricholoma equestre,
T. flavovirens and T. auratum are synonyms for the yellow tricholoma; others believe that
there are enough differences to consider them as more than just one species. Despite recent
substantial contributions to the Tricholoma systematics, the taxonomical issues concerning
these species remain unclear, and it is generally agreed that further studies are still needed in
order to obtain a better understanding of the variability of taxa. For this purpose, it is essential
to investigate the existence (or not) of distinct species and to provide tools for their correct
identification.
In this work, 40 specimens were used, out of which 15 were collected from pine and
mixed forests in Centre of Portugal and 25 specimens obtained from Spanish herbaria,
identified as the three considered species in the Tricholoma complex. The study proceeded
under a polyphasic approach, as it was considered to be the one that provides more
information for characterization.
Several morphological characters of the specimens were observed and compared, but
no sufficient evidence was found to sort them out into two or three groups. Molecular data,
such as the study of ITS region, enabled a phylogenetic analysis, which proved the existence of
a high genetic variability in this region.
The specimens studied in this work show high levels of phenotypic plasticity and
genetic variability, which justifies the controversial found in their identification. Nevertheless,
this work suggests that the Tricholoma equestre complex might be treated as a unique species,
because, despite the various differences found, they do not seem to be indicative enough to
consider more than one species.
Keywords: ITS, phylogeny, polyphasic approach, taxonomy, Tricholoma auratum/ T. equestre/
T. flavovirens.

Resumo
O míscaro-amarelo é um dos cogumelos mais consumidos entre as populações rurais
em Portugal. São adoptadas diferentes designações consoante a região do país onde é
apanhado. De acordo com vários autores, Tricholoma equestre, T. flavovirens e T. auratum são
sinónimos atribuídos ao míscaro-amarelo; outros autores defendem a existência de diferenças
suficientes para os considerar mais do que uma espécie. Apesar dos estudos recentes que
contribuíram para a sistemática do género Tricholoma, os problemas taxonómicos inerentes a
esta espécie mantêm-se por esclarecer, sendo consensual a necessidade de mais estudos para
uma melhor compreensão da variabilidade deste taxa. Para este propósito, é essencial
investigar a existência (ou não) de espécies distintas e providenciar ferramentas para a sua
identificação correcta.
Neste trabalho, foram utilizados 40 espécimes, 15 dos quais provenientes de colheitas
efectuadas em pinhais e matas mistas localizadas no Centro de Portugal e 25 espécimes de
herbários espanhóis, representativos das três espécies consideradas no complexo Tricholoma.
Seguiu-se uma abordagem polifásica, considerada como sendo a mais informativa para a sua
caracterização.
Foram observados vários caracteres morfológicos dos diversos espécimes e
comparados entre si; contudo não foram encontrados dados suficientes para os agrupar em
dois ou três grupos. A análise molecular, nomeadamente pelo estudo da região ITS, permitiu
uma análise filogenética, que demonstrou uma grande variabilidade genética desta região.
Os espécimes estudados neste trabalho expressam uma elevada plasticidade
fenotípica e variabilidade genética, o que justifica a atribuição das identificações controversas
utilizadas. Contudo, este trabalho sugere que o complexo Tricholoma equestre deve ser
tratado como uma única espécie, uma vez que, apesar das várias diferenças encontradas, estas
não parecem ser suficientemente discriminativas para se considerar mais do que uma espécie.
Palavras-chave: Abordagem polifásica, ITS, filogenia, taxonomia, Tricholoma auratum/ T.
equestre/ T. flavovirens.

ÍNDICE página
INTRODUÇÃO GERAL .................................................................................................................... 1
Uma abordagem taxonómica ................................................................................................... 1
Identificação ............................................................................................................................. 3
Posição sistemática .................................................................................................................. 4
Abordagem polifásica............................................................................................................... 7
OBJECTIVOS .................................................................................................................................. 9
FASE 1: CARACTERIZAÇÃO MORFOLÓGICA DOS BASIDIOMAS .....................................................
PROCEDIMENTO ....................................................................................................................... 10
1. Obtenção do material de estudo ....................................................................................... 10
2. Material estudado .............................................................................................................. 11
3. Morfologia macro e microscópica ..................................................................................... 13
4. Conservação do material estudado ................................................................................... 14
RESULTADOS E DISCUSSÃO ...................................................................................................... 15
1. Caracterização morfológica ............................................................................................... 15
2. Dendrograma fenotípico .................................................................................................... 19
3. Análise de Componentes Principais - PCA ......................................................................... 21
FASE 2: CARACTERIZAÇÃO MOLECULAR DOS BASIDIOMAS .........................................................
PROCEDIMENTO ....................................................................................................................... 24
1. Extracção de DNA genómico .............................................................................................. 24
2. Perfis moleculares de 'PCR-fingerptining' .......................................................................... 24
3. Amplificação e análise de restrição da região ITS .............................................................. 25
4. Sequenciação da região ITS e análise filogenética ............................................................. 26
RESULTADOS E DISCUSSÃO ...................................................................................................... 28
1. Perfis de 'PCR-fingerprinting' ............................................................................................. 28
2. Análise filogenética ............................................................................................................ 32
DISCUSSÃO GERAL ...................................................................................................................... 36

CONSIDERAÇÕES FINAIS ............................................................................................................. 40
ANEXOS ....................................................................................................................................... 41
GLOSSÁRIO .................................................................................................................................. 42
BIBLIOGRAFIA ............................................................................................................................. 43

1
INTRODUÇÃO GERAL
Em Portugal, o tricoloma amarelo é dos cogumelos silvestres mais utilizados na
alimentação das populações rurais; aparece à venda nas feiras, no comércio urbano de bairro,
nalguns hipermercados e era objecto de exportação. Também é conhecido, consoante as
regiões do país, pelos nomes vulgares de amarelo, míscaro, míscaro-amarelo e tortulho. Estas
designações correspondem, segundo a taxonomia tradicional (Modesto & Baptista-Ferreira,
2010), às seguintes espécies: Tricholoma auratum (Paulet) Gillet, Tricholoma equestre (L.) P.
Kumm. (=T. flavovirens p.p.).
Segundo relatos vindos sobretudo de França, vários casos de rabdomiólise aguda
ocorreram após ingestão continuada, pelo menos em três refeições consecutivas, de grandes
quantidades de Tricholoma equestre (Bedry et al., 2001). Até à data, não são conhecidos em
Portugal registos de intoxicação por “tricoloma-amarelo”.
Sabendo-se que está para sair legislação que deverá ter em atenção normas
semelhantes às já adoptadas noutros países da União Europeia que proíbem a colheita, a
comercialização e o consumo de Tricholoma equestre, é de toda a urgência esclarecer a
taxonomia das espécies envolvidas.
De facto, se, para alguns autores, Tricholoma equestre e T. auratum são sinónimos
(Index Fungorum), outros consideram que existem diferenças suficientes para os tratar como
mais do que uma espécie (Courtecuisse & Duhem, 1994; Bon, 2004), e as questões
taxonómicas sobre estas espécies continuam por esclarecer. É, pois, geralmente aceite que
ainda são necessários mais estudos para se chegar a uma melhor compreensão da
variabilidade destes taxa, da sua ecologia e distribuição. Como estes tricolomas amarelos
mostram altos níveis de plasticidade fenotípica, os dados morfológicos não são suficientes.
Assim, torna-se necessário complementar a caracterização morfológica com estudos
moleculares que possam contribuir para a delimitação daquelas espécies.
UMA ABORDAGEM TAXONÓMICA
O nome Tricholoma etimologicamente deriva do grego antigo τριχος (tricos), que
significa “pêlo”, e λωμα (loma), que significa “orla/franja”. Foi utilizado pela primeira vez por
Fries (1821), ilustre micólogo do século XIX e considerado o Lineu da Micologia, quando criou
um novo grupo taxonómico (tribo) para agrupar algumas espécies de Agaricus que partilhavam
aquelas características. Surgiu assim o taxon Agaricus tribo Tricholoma Fr. [Syst. mycol.
(Lundae) 1: 9, 36 (1821)] que mais tarde Staude estabeleceu como categoria taxonómica de
género, sob a designação Tricholoma (Fr.) Staude [Schwämme Mitteldeutschl.: xxviii, 125
(1857)].

2
Em 1753, Lineu descreveu a espécie Agaricus equestris L. [Species Plantarum, 2: 1173,
1753] e em 1871, Kummer fez a combinação Tricholoma equestre (L.) P. Kumm [Führ. Pilzk.
(Zwickau): 130 (1871)], utilizando o conceito amplo desta espécie aceite nessa época e que
perdura até aos nossos dias. É uma espécie complexa, para muitos autores englobando mais
duas espécies, T. auratum (Paulet) Gillet [Les Hyménomycètes ou description de tous les
champignons (fungi) qui croissent en France (Alençon): 92 (1874)] e T. flavovirens (Pers.) S.
Lundell [in Lundell & Nannfeldt, Fungi Exsiccati Suecici 23-24: no. 1102 (1942)].
É neste sentido amplo que T. equestre será considerado neste trabalho.
O género Tricholoma pertence ao filo Basiodiomycota e inclui um conjunto de fungos
micorrízicos, formadores de cogumelos de lâminas, de esporada branca e estipe carnudo. É um
género facilmente reconhecível no campo devido à combinação de características
morfológicas únicas (Kibby, 2010). Algumas espécies são fáceis de identificar, especialmente as
que possuem um anel ou ainda outras que apresentam um odor forte, muito característico. A
textura do chapéu, cor, alteração de cor ao manuseamento ou com a idade, odor e sabor são,
muitas vezes, determinantes para a identificação da maioria das espécies. No entanto, existe
um grupo de espécies que exibem tonalidades acinzentadas ou acastanhadas,
morfologicamente bastante semelhantes e difíceis de distinguir (Kuo, 2004).
Como anteriormente já foi referido, os basidiomas são carnudos, normalmente
robustos e fibrosos, cujos chapéus podem ser desde lisos a terem uma textura semelhante à
da camurça, fibrilosos-inatos ou fibrosos-escamosos e em tempo húmido, adquirirem uma
textura viscosa ao toque. As cores do chapéu variam de branco a cinzento, cinzento-
acastanhado, castanho-avermelhado ou de laranja a amarelo brilhante ou esverdeado, sendo
frequentemente mais ou menos mamelonados. As lâminas são brancas ou por vezes tingidas
de cores semelhantes às do chapéu ou do estipe e são geralmente descritas como sinuadas ou
emarginadas e também podem ser adnadas. O estipe é geralmente duro, fibroso, cilíndrico a
esguio ou ligeiramente bolboso, liso, flocoso-escamoso ou com bandas e em algumas espécies
nota-se a presença de um anel distinto ou de uma cortina. O odor e o sabor podem ser
importantes, uma vez que várias espécies têm um odor farináceo ou aromático e um sabor
farináceo ou picante característico (Kibby, 2010).
Há uma grande disparidade quanto ao registo da diversidade deste género, devido ao
carácter subjectivo do conceito de espécie de cada autor. A espécie abordada neste estudo é
um exemplo típico, podendo ser considerada num sentido amplo, como anteriormente foi
referido, ou num sentido mais estricto. Para além disso, foram ainda descritas em T. equestre

3
quatro variedades, nomeadamente, var. albipes Peck., var. equestre (L.) P. Kumm., var.
pinastreti Alb. & Schwein e var. populinum Mort. Chr. & Noordel. (Index Fungorum).
Trata-se de um género cosmopolita, com cerca de 60 espécies registadas no norte da
Europa (Knudsen & Vesterholt, 2008), e 68 (Bom, 1991, in Kibby, 2010) ou 63 espécies (Riva,
2003) citadas na Europa. Na compilação efectuada por Câmara (1956) são referidas 26
espécies Tricholoma para Portugal; mais tarde, em 1997, numa nova revisão, registaram-se 43
espécies (CMUL, 2002), estando incluídos neste último número os registos T. equestre e T.
auratum.
Data de 1887 a primeira citação de T. equestre para Portugal, colhido na região do
Porto (Anónimo, 1887). No nosso País, a espécie está dada para as províncias tradicionais do
Minho, Douro Litoral, Trás-os-Montes e Alto Douro, Beira Alta, Beira Litoral, Estremadura e
Ribatejo, onde se desenvolve nos meses de Setembro a Janeiro (Câmara, 1956; CMUL, 2002),
enquanto que para T. auratum há registos na Beira Litoral, Estremadura e Baixo Alentejo
(CMUL, 2002).
IDENTIFICAÇÃO
Tradicionalmente, a identificação prática e correcta das espécies é efectuada com base
nas características morfológicas, tanto macro como microscópicas. Acontece que, muitas
vezes, prescinde-se da microscopia e a identificação de algumas espécies é baseada somente
nas características físicas observáveis. Tanto a nível microscópico como macroscópico, os
caracteres são muito variáveis dentro do mesmo grupo, o que dificulta a delimitação entre as
espécies (Kuo, 2004). Ao nível microscópico, deve-se observar o tamanho e forma dos esporos
(que são quase sempre lisos e não amiloides, i.e., não coram de azul-violeta com o Reagente
de Melzer), a presença ou ausência de ansas de anastomose e de cistídios e as estruturas da
cutícula do chapéu. O tamanho e forma dos esporos são essenciais para a delimitação dos taxa
“subgénero” e “secção” (Kuo, 2004; Kibby, 2010). Neste género, os esporos são
frequentemente subglobosos, elipsoidais e mais ou menos alongados. Aconselha-se a
observação de esporos retirados da esporada, ao invés de das lâminas, onde ainda não
atingiram o estado de maturação (Kibby, 2010).
Bon (1991) e Riva (2003) demonstraram que se deve prestar especial atenção na
observação das estruturas da pileipelis, principalmente na determinação de novas espécies.
Em muitas espécies, as células da pileipelis formam uma paliçada parcial, sendo geralmente
lisas e alongadas, enquanto que em outras, a parede celular apresenta-se com espessamentos
ou com pigmentos incrustados. Para além disso, as células subcuticulares podem ter as
extremidades dilatadas ou arredondadas ou em forma de tijolo e normalmente de parede fina.

4
Outras espécies apresentam uma camada secundária de células muito dilatadas, quase
subglobosas, com paredes grossas e pigmentadas.
Os cistídios não apresentam grande relevância para estudar este género, uma vez que
na maioria dos casos são de pequenas dimensões e pouco diferenciados.
Em relação ao habitat, todas as espécies de Tricholoma são micorrízicas, geralmente
de árvores e arbustos. A grande maioria estabelece relações específicas com o seu hospedeiro,
ganhando assim extrema importância a descrição do ‘habitat’, conforme referiu Kuo (2004).
Um número reduzido de espécies tem a capacidade de se associar a vários
hospedeiros, como T. saponaceum, mas nestes casos os basidiomas apresentam aspectos
diferentes.
Acredita-se que os estudos moleculares venham desempenhar um importante papel
na correcta delimitação das espécies do género Tricholoma assim como na manutenção de
algumas variedades descritas para esta espécie (Kuo, 2004; Kibby, 2010).
Este trabalho é um contributo para o conhecimento da espécie T. equestre s. l. em
Portugal, com base em dados morfológicos e moleculares, conforme foi apontado por autores
que, recentemente, se debruçaram sobre este problema (Noordeloos & Christensen, 1999;
Christensen & Heilmann-Clausen, 2008; Kibby, 2010).
POSIÇÃO SISTEMÁTICA
O conceito de T. equestre tem variado segundo diferentes autores. Numa revisão dos
estudos mais recentes que incluíram este complexo, é fácil verificar a diferença de opinião que
continua a existir entre os diferentes autores.
Bon (1991) distingue duas espécies: Tricholoma equestre (L. : Fr.) Kumm. (= T.
flavovirens ss auct. non Fr. Sec Kreisel) e T. auratum (Fr.) Gillet (= T. arenarium (Lev.) Gill.). As
características que sugere para as diferenciar encontram-se descritas na Tabela 1. Ainda assim,
este autor questiona-se sobre a possibilidade de T. auratum não atingir o estatuto de espécie
mas poder tratar-se de uma variedade do T. equestre, uma vez que se encontram muitas
formas intermédias entre estes dois taxa, sobretudo nos pinhais arenosos do interior, nos
quais o chapéu se apresenta mais ou menos fortemente escamoso e menos viscoso e as cores
são amarelo vivas.

5
Tabela 1: Distinção entre T. equestre e T. auratum, segundo Bon (1984)
Caract.
diagnóstico Tricholoma equestre Tricholoma auratum
Chapéu: mais escamoso que viscoso mais viscoso que escamoso
Ø cm 5-8 (10) 8-15 (18)
Forma ± fortemente mamelonado convexo ou pouco mamelonado, rapidamente aplanado
Revestimento
com manchas nítidas no centro, subliso no disco e
pouco lubrificado ou pouco viscoso e ± escamoso no
exterior
fortemente liso e viscoso no disco
Cor
amarelo latão na margem, progressivamente
castanho-avermelhado com algumas nuances de
bronze no centro, raramente com reflexos oliváceos
ou citrino-esverdeados
castanho alaranjado, tornando-se ± fibriloso com raras
escamas concêntricas, mais amarelo citrino na margem
por vezes com ligeiros reflexos oliváceos
Lâminas: juntas, totalmente de um belo amarelo enxofre ou
citrino por vezes ferrugem com a idade
pouco juntas, de um amarelo enxofre pálido por vezes
com reflexos citrinos esverdeados
Estipe cm: 6-10 x 0,6-1(1,5) 4-8(10) x (1)2-3(4)
Forma sub-igual 'atarracado', igual ou dilatado a ± comprimido
Cor amarelo vivo com alguns flocos acastanhados ±
'squarreux'
esbranquiçado no topo e ± fibriloso de citrino na base
com raras escamas um pouco rosadas no final
Carne: cor amarelo vivo a ocre amarelado ou latão na periferia esbranquiçado a ± amarelo enxofre no exterior (ou todo
amarelo)
Odor fraco farinhoso ou um pouco aromático fúngico-farinhoso banal
Sabor fúngico doce, agradável avelã
Reacções química:
Amoníaco ou bases rosa a laranja vivo (na carne) rosa pálido (subnulo no estipe)
Esporos: µm 6-8 x 3,5-5 6-8 x 4-5,5
Forma elípticos a subamigdaliformes elípticos
Pêlos marginais: insignificantes ou tortuosos ± evidentes ou clavados
Hifas da pileipelis
µm: x 3-5 (7) x 3-7 com extremidades ± clavadas até x 8(10)
Forma ± bifurcadas ou entrelaçadas, mais fasciculadas no
exterior, com raras placas ± gelificadas no disco francamente gelificadas no disco
Pigmento misto a ± pontilhado misto ou membranar liso ou um pouco incrustante
Subcutis e
hipoderme:
progresivamente espesso sem tendência
pseudoparenquimatosa ----------
Habitat: coníferas ou folhosas, Picea, Abies, mais raramente
Fagus, Carpinus, etc
coníferas sobretudo pinhais arenosos, por vezes sobre a
erva
Tal como Bon, Courtecuisse & Duhem (1994), também consideram T. equestre (L.:Fr.)
Kummer (= T. flavovirens) e T. auratum (Fr.) Gillet (= T. equestre p.p.). Na Tabela 2 sumarizam-
se as diferenças entre ambas.

6
Tabela 2: Características sumárias que distinguem T. equestre e T. auratum, segundo Courtecuisse & Duhem (1994).
Caract. diagnóstico Tricholoma equestre Tricholoma auratum
Chapéu: 10 cm, convexo-mamelonado, amarelo-alaranjado a bronze no disco, escamoso no centro
15 cm, convexo ou quase aplanado, amarelo alaranjado a acastanhado no disco, víscido ou lubrificado, pouco escamoso
Lâminas: apertadas, amarelo vivo pouco apertadas, amarelas
Estipe: 10 x 1 cm, amarelo vivo como a carne 8 x 3 cm, grossas, amarelo pálido
Carne: amarelo vivo esbranquiçada a amarelada
Habitat: Florestas de folhosas e coníferas Florestas de coníferas em solos arenosos
Já para Moser (1983) as espécies a considerar são T. flavovirens (Pers. ex Fr.) Lund et
Nanf. (= T. equestre Fr. fm. pinastri Fr.) e T. auratum (Paul. ex Fr.) Gillet (= T. equestre p.p.). Na
Tabela 3 sumarizam-se as diferenças entre ambas.
Tabela 3: Características sumárias que distinguem T. flavovirens e T. auratum, segundo Moser (1983).
Caract. diagnóstico T. flavovirens T. auratum
Chapéu: 5-8 cm, com escamas parcialmente adpressas castanhas ou castanho-oliváceas e fibras radiais sobre fundo amarelo vivo, rapidamente seco
7-12 cm, amarelo-esverdeado, disco laranja a vermelho-acastanhado, mais víscido
Lâminas: amarelo-limão --
Estipe: 5-10 cm/ 8-12 mm, delgado, amarelo com flocos individuais acastanhados
4-6 cm/10-30 mm, esbranquiçado no topo, amarelo-esverdeado na base
Carne: +- amarelada branca, apenas amarela nas bordas
Esporos: 6-8/3-5 µm 6-7/3-4 µm
Habitat: Florestas de coníferas, mais raramente de decíduas Florestas de pinheiro com solo arenoso
Para outros autores existe apenas uma espécie, T. equestre. É o caso de Quélet (1873,
reeditado em 1964), e Kühner & Romagnesi (1953), e mais recentemente Breitenbach &
Kränzlin (1991), assim como Noordeloos & Christensen (1999). Estes últimos autores
consideram que no norte da Europa distinguem-se duas variedades, que se conseguem
diferenciar principalmente pela ecologia: a) a var. equestre, associada a espécies do género
Pinus, preferencialmente em solos arenosos, pobres em nutrientes, caracterizada por um píleo
normalmente distintamente víscido em tempo húmido, com esporos elipsoidais a oblongos
com 6,0-7,5(-9,0) x 3,5-5,0(-5,5) µm, com quociente médio entre comprimento e largura Qav
=1,5-1,7; b) e a var. populinum, associada a árvores decíduas como Populus sp., encontrada em
solos argilosos ricos em nutrientes, caracterizada pelo píleo quase seco, fibrioso-inato a
finamente escamoso, esporos elipsoides com 5,0-6,5(-7,5) x (3,0-)3,5-4,5(-5,0) µm, com Qav =
1,4-1,5.
À primeira vista, este cogumelo parece pertencer a diversas entidades
morfologicamente diferentes consoante as estações do ano, o que poderá explicar os diversos
epítetos utilizados para descrever as mesmas; assim, para os exemplares menos robustos das

7
florestas de folhosas, fala-se de T. flavovirens, enquanto que os exemplares mais robustos das
florestas de pinheiros são denominados T. auratum (Kibby, 2010). Riva (2003) sugere, com
base em estudos bibliográficos e observações pessoais, que se trata de uma única e mesma
espécie que se deve denominar T. equestre. Porém, não exclui as variedades, nomeadamente
a var. pinastreti Alb. & Schwein. para os espécimes mais robustos das florestas arenosas de
pinheiro. Bon (1984) não contempla esta variedade na sua monografia.
ABORDAGEM POLIFÁSICA
Para se estudar a problemática taxonómica da classificação das espécies T. equestre, T.
auratum e T. flavovirens, seguiu-se uma abordagem polifásica. Segundo Colwell, autor que
cunhou este termo em 1970, a taxonomia polifásica assume que a diversidade biológica não
pode ser resultado de um único caracter e que a variabilidade de caracteres depende de um
conjunto de vários factores. Assim, sugere a análise integrativa de todos os dados possíveis de
obter, através da tradicional caracterização morfológica juntamente com as técnicas de
biologia molecular, segundo diversas abordagens independentes.
Por oposição a uma abordagem unicamente fenotípica, os métodos de análise com
base no DNA dos organismos trazem vantagens, na medida em que as sequências de DNA não
são tão susceptíveis de sofrer alterações a curto-prazo devido a alterações ambientais, como
são as características morfológicas. Portanto, sugere-se que devem fornecer caracteres mais
estáveis para a identificação de espécies.
A utilização de técnicas baseadas na reacção de amplificação em cadeia pela
polimerase (‘Polymerase Chain Reaction’ ou PCR) para estudar o DNA são de fácil e rápida
execução. No final do século XX, o advento da técnica de PCR veio melhorar a capacidade de
estudar a diversidade de fungos ectomicorrízicos, uma vez que possibilitou a identificação dos
fungos directamente a partir das suas estruturas vegetativas, utilizando a informação genética,
de forma rápida, eficaz e com a possbilidade de análise de uma enorme quantidade de
amostras (Horton, 2002; Kikuchi et al., 2007).
Uma abordagem possível consiste na técnica de amplificação aleatória de
polimorfismos de DNA (RAPD), com vista a gerar marcadores moleculares para cada genoma
específico. Este método baseia-se na utilização da técnica de PCR combinada com ‘primers’
únicos e não requer qualquer tratamento após a amplificação. Deste modo, um ‘primer’
aleatório único hibrida com as sequências homólogas no genoma, sendo amplificada a região
entre dois locais de emparelhamento. Cada ‘primer’ aleatório origina um padrão específico de
produtos de PCR. Os dados obtidos por RAPD podem ser utilizados para determinar o grau de

8
semelhança genética entre diferentes estirpes com base nos coeficientes de semelhança (Lusta
et al., 2003).
Recorre-se muitas vezes ao ‘PCR-fingerprinting’ como técnica alternativa aos métodos
que se baseiam unicamente em um gene alvo. O facto de analisar o genoma completo confere-
lhe robustez e poder discriminante.
A reacção de mini/microsatélite (‘mini/microsatellite-primed-PCR’, MSP-PCR) utiliza
um ‘primer’ único com homologia a minisatélites ou microsatélites dispersos no genoma.
Origina perfis de DNA, através da amplificação de sequências genómicas entre esses
mini/microsatélites, o que resulta num conjunto de fragmentos de massa molecular variável
que constitui um perfil, podendo ser úteis na discriminação entre espécies e/ou estirpes de
fungos (Alves, et al., 2007). Contudo, apesar da vasta aplicação das técnicas de MSP-PCR, ainda
não é clara a capacidade de identificação de espécies de fungos (Alves et al., 2007).
Nos estudos filogenéticos, consideram-se preferenciais determinados grupos de genes
alvo para descrever a história evolutiva dos organismos. O grupo de genes mais
frequentemente utilizado inclui os genes que codificam para o RNA ribossomal (rRNA). A
importância nestes estudos deve-se ao facto de ser um gene multi-cópia, não ser codificante e
as cópias repetidas em tandem serem maioritariamente homogéneas devido a evolução
concertada, podendo ser tratado como um gene de single-locus. Para além disso, os
ribossomas estão presentes em todos os organismos a partir de uma origem evolutiva comum
(Guarro et al., 1999). Inclui regiões muito conservadas como os genes de rDNAs 18S, 5,8S e 25S
e também sequências de DNA hipervariáveis como a região ITS1 e ITS2 do ‘Internal Transcribed
Spacer’ (Figura 1). Apesar de serem regiões que não são traduzidas em proteínas, as regiões
codificantes do ITS desempenham um papel essencial no desenvolvimento dos rRNA
funcionais. Como apresentam uma elevada variação intra-específica e poder discriminante ao
nível de estirpe, representam um candidato ideal como assinatura molecular em estudos de
taxonomia de fungos (Iwen et al., 2002; Alves et al., 2007). Como tal, o maior número de
sequências de fungos que se encontra disponível em bases de dados públicas como o GenBank
ou EMBL é da região ITS, tornando-a uma região bastante útil em estudos de identificação de
fungos ectomicorrízicos ao nível de espécie. Actualmente, recomenda-se a sequenciação da
região ITS ou outra, seguida de um ‘blast’ nas bases de dados públicas ou uma análise
filogenética, com o intuito de tornar uma análise taxonómica mais completa (Horton, 2002).

9
1.
Figura 1: Organização esquemática da região ITS e posição dos ‘primers’ utilizados neste estudo
para amplificação da região ITS por PCR. As setas representam a extremidade-3’.
Em estudos anteriores, verificou-se que a região ITS apresenta uma variação
interespecífica bastante elevada dentro do género Tricholoma, em alguns casos podendo o
nível de semelhança não ultrapassar os 83% (Kikuchi et al., 2007).
Devido às características da região ITS, desenvolveu-se uma técnica que permite a
determinação dos polimorfismos de restrição do rDNA, denominada ITS-ARDRA (ITS-Amplified
Ribosomal DNA Restriction Analysis), sendo uma ferramenta útil na análise de genomas de
fungos, dadas as características da região ITS (Grimont & Grimont, 1986). Este método baseia-
se na amplificação por PCR de um fragmento de rDNA seguido da análise dos amplicões
originados pela digestão com endonucleases de corte frequente, o que aumenta a sua
capacidade discriminatória (Alves et al., 2007). Contudo, torna-se uma técnica dispendiosa,
não sendo preferencialmente usada em estudos de identificação de fungos.
OBJECTIVOS
O objectivo deste trabalho é contribuir para um melhor conhecimento de Tricholoma
equestre na Península Ibérica, numa tentativa de esclarecer se constitui um só taxa ou se é
possível distinguir diferentes taxa no complexo, comparando diversas características sugeridas
como relevantes, pelos vários autores que se dedicaram ao seu estudo, em badidiomas
colhidos na Península Ibérica.
Utilizaram-se diferentes métodos para caracterizar Tricholoma equestre, sensu lato,
nomeadamente técnicas tradicionais para uma caracterização morfo-fisiológica, e também
técnicas moleculares para caracterização do DNA, como ‘PCR-fingerprinting’ e análise da
região ITS, com subsequente análise filogenética, com vista a uma abordagem polifásica.
ITS4
ITS5
Região ITS2 Região ITS1 5.8S 18S 28S

10
FASE 1: CARACTERIZAÇÃO MORFOLÓGICA DOS BASIDIOMAS
Após a colheita e obtenção do material para estudo, fez-se a observação e registo das
características morfológicas relevantes, macro e microscópicas, que possibilitam a
identificação dos espécimes (Riva, 2003; Bon, 1991; Noordeloos & Christensen, 1999;
Christensen & Heilmann-Clausen, 2008). Como o material sujeito a uma caracterização proveio
sempre de basidiomas, mesmo no caso do DNA, considera-se sempre o termo espécimes
quando se refere cada indivíduo em vez de isolados.
PROCEDIMENTO
1. Obtenção do material de estudo
Procedeu-se à selecção dos ‘habitats’ referidos como preferências para estes fungos
descritos na bibliografia consultada. Destacam-se portanto a mata de pinheiros e, com menor
incidência, a mata mista. Pretendeu-se comparar os espécimes encontrados em solos arenosos
e argilosos, bem como a localização em mata da região de interior e de litoral. A área de
estudo seleccionada abrangeu a região Centro de Portugal, incluindo zonas de solo arenoso no
litoral ao longo do Pinhal de Leiria, e regiões de solo argiloso localizadas no interior do país.
Para a colheita destes fungos, vulgarmente conhecidos como míscaros amarelos,
foram feitas visitas às estações de campo e estabeleceu-se contacto com apanhadores de
cogumelos. Caracterizou-se os ‘habitats’ seleccionados e o tipo de solo. Fez-se o registo
fotográfico dos espécimes no campo e, com mais pormenor, no laboratório.
Foi possível estudar exemplares de Tricholoma conservados em vários herbários,
permitindo assim alargar o estudo à Península Ibérica, de modo a aumentar a amostragem e
também a área geográfica abrangida. Foram ainda estudados 3 espécimes colhidos na Ilha da
Madeira, um das Canárias e um colhido em França. Esse material foi preveniente de três
herbários espanhóis: Real Jardin Botanico, Madrid (MA-Fungi); Centro de Investigación
Forestal de Lourizán, Galiza (para efeitos deste estudo designado GA); e Sociedad Micológica
de Portugalete, Biskaia (para efeitos deste estudo designado PU).
O mapa da Figura 2, feito utilizando o ‘software’ DIVA-GIS (versão 7.4.0.1), ilustra os
locais de amostragem seleccionados obtidos por georreferenciação, incluindo a localização
geográfica do material conservado em herbários.

11
Figura 2: Locais de amostragem de (T. equestre, T. auratum e T. flavovirens) 15 espécimes recentemente colhidos no campo e 25 espécimes provenientes de colecções de herbário.
2. Material estudado
Os espécimes de Tricholoma estudados eram provenientes de recolhas efectuadas no
campo, em Portugal, e também de material conservado em herbários. Foram estudados um
total de 15 espécimes colhidos no campo e 25 espécimes de herbário (Tabelas 4 e 5,
respectivamente).
Tabela 4: Espécimes colhidos no campo, em Portugal, utilizados neste estudo.
Código Local Colheita Habitat
1 Penhas Douradas, Serra Estrela Pinhal
2 Ferro, Covilhã Pinhal
3 Penha Garcia, Idanha-a-Nova Pinhal
4 Folgosinho, Gouveia Pinhal (Pinus pinaster)
5 Salir do Porto, Caldas da Rainha Mata mista (Pinus sp., Eucalyptus sp., Quercus
suber, vegetação arbustiva)
6 Batalha Mata mista (Pinus sp., Eucalyptus sp., Quercus
suber, vegetação arbustiva)
7 Batalha Mata mista (Pinus sp., Eucalyptus sp., Quercus
suber, vegetação arbustiva)
8 Batalha Mata mista (Pinus sp., Eucalyptus sp., Quercus
suber, vegetação arbustiva)
Madeira
Canárias

12
9 Valado de Frades Pinhal com vegetação arbustiva
10 Valado de Frades Pinhal com vegetação arbustiva
11 Valado de Frades Pinhal com vegetação arbustiva
12 Mangualde, Viseu Pinhal
13 Pedras, Alcobaça Pinhal
14 Monte Maninho, Dalvares (Tarouca) Mata mista (Pinus pinaster e Arbutus unedo)
15 Alagoas, Sabugal (Guarda) Pinhal (Pinus pinaster)
Tabela 5: Espécimes de herbário utilizados neste estudo.
Código Tricholoma Registo de
Herbário Localidade Habitat Data
1MA T.equestre MA-Fungi 74872-2 Navacerrada, La Barranca
(Madrid)
Pinhal (húmus de P.
sylvestris)
15-XII-1998
2MA T. equestre MA-Fungi 57149 Pouso a Santo da Serra
(Madeira)
Pinhal 18-XI-2002
3MA T. equestre MA-Fungi 78369 Poiso (Madeira) Pinhal 21-X-2008
4MA T. equestre MA-Fungi 47155 Portillo (Valladolid) P. pinea e P. pinaster,
em solo arenoso
27-X-1996
5MA T. equestre MA-Fungi 50585 Ponta do Sol, Paul da Serra
(Madeira)
P. pinaster 06-I-2001
6MA T. equestre MA-Fungi 59813 Puerto del Boyar,
Grazalema (Cadiz)
P. pinaster 24-X-2002
7MA T. equestre MA-Fungi 66259 Sra. Leyre (Navarra) P. sylvestris 01-XI-1982
8MA T. equestre MA-Fungi 42739 Pinar de los Realejos
(Tenerife)
Bosque (entre
acículas)
19-XI-1978
9MA T. equestre MA-Fungi 8083 Dehesas de Cercedilla
(Madrid)
- 08-XII-1984
10MA T. equestre MA-Fungi 4519 Untes (Orense) - 26-XI-1982
11MA T.auratum MA-Fungi 342 Porquera del Fraile, Coto de
Doñana (Huelva)
- 17-XI-1976
12MA T. arvernense MA-Fungi 39368 Loma de la Machera,
Valdemeca (Cuenca)
P. sylvestris, P.
pinaster e P. nigra
28-X-1997
13MA T. sejunctum MA-Fungi 73692-2 Hoya de Quiñones, Añadida
Migración (Bustarviejo)
Q. pyrenaica 20-X-2002
14MA T. joachimii MA-Fungi 39371 Portonovo, playa de
Paxariñas (Pontevedra)
P. pinaster 10-XI-1996
15MA T. flavovirens MA-Fungi 8042 Piedralaves (Avila) P. pinea 27-XI-1984

13
16MA T. flavovirens MA-Fungi 1815 Lastros de Cuéllar (Segovia) - 25-X-1981
17M T. flavovirens MA-Fungi 2579 Pozuelo de Alarcón - 21-XI-1976
18MA T. flavovirens MA-Fungi 37212 El Espinar (Segovia) Pinhal 9-XII-1980
19MA T. flavovirens MA-Fungi 1951 Pinar de los Realejos
(Tenerife)
Bosque (entre
acículas)
19-XI-1978
1GA T. auratum GA 8392 Po, Sanil (Vigo) Pinhal dunar 27-IX-1994
2GA T. equestre GA 6025 Po, A. Guarda (Vigo) Pinhal 12-XII-1993
3GA T. flavovirens GA 6261 C. Corcubión (Finisterre) P. sylvestris 4-XII-1993
1PU T. equestre PU 2003111522 Criales (Burgos) Populus tremula 15-XI-1991
2PU T. equestre
var. populinum
PU 2004110601 Manurga, Araba (Zigoitia) P. pinaster em duna
marítima
6-XI-2001
3PU T. equestre/ T.
auratum
PU 2007120202 Playa de Coutis Landes
(France)
- 2-XII-2007
3. Morfologia macroscópica e microscópica
Observaram-se as características morfológicas macroscópicas do material colhido no
campo, nomeadamente forma, diâmetro, textura e cor do píleo, número de lâminas por
centímetro, altura e diâmetro do estipe. Registou-se a reacção a químicos, nomeadamente a
KOH (hidróxido de potássio) na carne do píleo e do estipe.
Os basidiomas foram acondicionados em sacos de pástico e conservados a -20⁰C até ao
momento da extracção de DNA.
De acordo com a bibliografia consultada, para a caracterização de Tricholoma é
importante a observação microscópica da superfície himenial, dos esporos e da estrutura
cuticular da pileipelis e estipitipelis. A partir de material previamente congelado, fizeram-se
cortes finos que se montaram, entre lâmina e lamela, em vermelho de Congo ou azul de
algodão em lactofenol, consoante a estrutura alvo a observar. Para realizar as preparações
com o azul de algodão em lactofenol coloca-se uma gota em lâmina com um corte fino do
material biológico, leva-se rapidamente à chama, cobre-se com lamela e observa-se; é útil na
percepção de estruturas gelatinosas. O vermelho de Congo é útil para a observação de
estruturas esqueléticas, as hifas, facilitando a procura de ansas de anastomose, por exemplo.
A observação das estruturas microscópicas foi feita utilizando o Microscópio Óptico
Composto Olympus BX51, procedendo-se à microfotografia e medições com o ‘software’ de
imagem CellA (Olympus Cell*Family, Münster, Germany).

14
A caracterização morfológica foi efectuada nos 15 espécimes colhidos no campo, uma
vez que os provenientes de colecções de herbário já não mantinham as suas características
originais fidedignas. A identificação atribuida aos basidiomas provenientes dos herbários é da
responsabilidade dos respectivos identificadores. As designações utilizadas neste trabalho
foram consideradas como resultado da sua caracterização morfológica pelos mesmos.
4. Conservação do material estudado
Após a conclusão da caracterização molecular e da extracção de DNA, os basidiomas
foram descongelados e secos numa Câmara de Desidratação (FITOCLIMA S600PH, Aralab),
acondicionados em recipientes apropriados, etiquetados e depositados no Herbário LISU do
Jardim Botânico da Universidade de Lisboa.

15
RESULTADOS E DISCUSSÃO
1. Caracterização morfológica
Todos os exemplares de Tricholoma colhidos no campo foram caracterizados morfo-
anatomicamente, atendendo às características que podem ser consideradas relevantes para a
sua identificação pelos autores consultados. Na Figura 3 ilustram-se aspectos de morfologia
macroscópica de alguns dos exemplares recolhidos em Portugal (incluindo imagens de alguns
'habitats') e na Figura 4 exemplificam-se estruturas observadas por microsopia óptica. A Tabela
6 sumariza os dados obtidos na caracterização a nível macroscópico e microscópico dos 15
espécimes recolhidos em Portugal no âmbito desta dissertação.
Foram observadas várias estruturas microscópicas para todos os espécimes,
exemplificadas na Figura 4. Nas imagens A e B observam-se dois cortes da camada himenial em
que os basídeos apresentam esporos nas extremidades dos seus esterigmas, observam-se
também outras estruturas himeniais estéreis como basidíolos. Na imagem C fez-se uma
montagem de fotografias de esporos de vários espécimes, sendo possível reparar na forma
elipsoidal de todos e nas ligeiras variações de tamanho. A imagem D representa um exemplo
de hifas da pileipelis que se localizam na camada mais externa, sem as extremidades dilatadas
e com bainha gelatinosa, que se observa pelo aspecto difuso da parede das hifas, enquanto
que na imagem E, as hifas da pileipelis apresentam uma coloração mais escura devido à
existência de pigmento intra-citoplasmático. Por oposição, as imagens G e H mostram hifas da
pileipelis com extremidades dilatadas. Na imagem F observa-se um corte da pileipelis,
mostrando a camada mais externa sob a forma de uma tricoderme, em que as hifas se
dispõem mais perpendicularmente e têm a coloração mais escura, formando uma
ixotricoderme, devido a se apresentar gelatinizada na maioria das vezes; na camada seguinte,
as hifas dispõem-se mais horizontalmente e percebe-se mais facilmente que também são
gelatinizadas devido à cor amarelada que se observa nas preparações montadas em água
destilada. A imagem I é representativa da estipitipelis de todos os espécimes, pois não se
observaram diferenças em nenhum deles, sendo formada por uma camada de células
cilíndricas dispostas horizontalmente, aumentando o diâmetro nas mais internas; não foram
observados caulocistídios, tal como as descrições consultadas sugerem.

16
Figura 3: T. equestre, morfologia externa dos basidiomas. Fotografias ilustrativas de diferentes características observadas nos vários espécimes colhidos no campo utilizados neste estudo. A – basidiomas colhidos no Município da Batalha; B – espécime 8, com estipe bolboso na base; C – espécime 11, com forma do estipe igual; D – coloração rosa no píleo e estipe como reacção ao KOH; E – revestimento do píleo viscoso; F – revestimento do píleo escamoso; G – lâminas afastadas; H – lâminas apertadas; I – forma do píleo aplanado; J – forma do píleo mamelonado; L – forma do píleo convexo; M – exemplo de ‘habitats’ seleccionados, do lado esquerdo, pinhal de P.
pinaster e do lado direito, mata mista (Pinus sp., Eucalyptus sp., Quercus suber, vegetação arbustiva).
M
E
D
A BA
C
G
H
I
J
L
F

17
Figura 4: T. equestre. A - camada himenial (do espécime 10); B – camada himenial (espécime 9); C – esporos; D – hifas da pileipelis com extremidades não dilatadas e com bainha gelatinosa (do espécime 7); E – hifas com pigmentos intra-citoplasmáticos (do espécime 7); F – corte da pileipelis (do espécime 5); G – hifas da pileipelis com extremidades dilatadas (do espécime 9); H – o mesmo que G para o espécime 13; I – corte da estipitipel (do espécime 11). (A escala representada na imagem C serve de escala para todas as imagens excepto para F e I em que se representa a própria escala. Todas as preparações foram coradas com vermelho de Congo).
20 μm
200 μm
200 μm
A B C
D E F
G H I

18
Tab
ela
6:
Reg
isto
das
car
acte
ríst
icas
do
s 1
5 e
spéc
imes
co
lhid
os
du
ran
te o
tra
bal
ho
de
cam
po

19
Como já foi referido, o tamanho e forma dos esporos são caracteres determinantes
para a delimitação de espécies dentro do género Tricholoma (Kuo, 2004; Kibby, 2010). No
material estudado, os esporos eram todos elipsoidais; mediu-se o comprimento (C) e a largura
(L), e fez-se o quociente (Qav) entre ambas as medidas (Figura 5), para averiguar se algum
destes caracteres poderia ser determinante na delimitação de espécie neste estudo. Verificou-
se que os diferentes caracteres agrupam os espécimes de formas diferentes.
Houve espécimes, nomeadamente o 2 e 6 em que não foi possível obter esses
caracteres, pois os esporos não eram abundantes e estavam imaturos, podendo induzir em
erro as medições.
Figura 5: Representação gráfica das medidas dos esporos para cada espécime estudado. a) média das larguras (Lav), b) média dos comprimentos (Cav) e c) média dos quocientes (Qav) entre comprimento e largura.
Através dos dados resultantes da caracterização morfológica não foi possível chegar a
uma identificação conclusiva dos espécimes; as características apresentadas enquadravam-se
nos diferentes conceitos dentro do complexo T. equestre. Pela análise das medidas dos
esporos, foi possível enquadrar os espécimes em grupos diferentes, considerando o
comprimento ou o quociente, enquanto que a largura não permitiu a formação de qualquer
grupo.
2. Dendrograma fenotípico
Não sendo possível delimitar grupos de acordo com as características morfológicas dos
indivíduos, visualizou-se a relação fenotípica entre os 15 espécimes através de um
dendrograma. Registaram-se 17 variáveis. Devido à natureza das variáveis, foi necessário
proceder à sua codificação aditiva, para que a matriz de dados tivesse apenas variáveis

20
boleanas, resultando em 72 variáveis. Foi calculada a matriz de semelhança entre os
indivíduos, utilizando como medidas de associação dois dos coeficientes de semelhança mais
utilizados: o Índice de Simple Matching (SM) e o Índice de Jaccard (J). Os dendrogramas foram
produzidos de acordo com o método de aglomeração hierárquica que utiliza a média
aritmética não ponderada (UPGMA: unweighted pair-group mean arithmetic method),
utilizando o ‘software’ NTSYS-pc (Rohlf, 1998). O dendrograma produzido pelo Índice J
encontra-se ilustrado na Figura 6.
Figura 6: Dendrograma fenotípico que reflecte a relação entre os 15 espécimes, de acordo com uma matriz de semelhança com 72 variáveis. Foi utilizado o índice de associação de Jaccard e o método de aglomeração UPGMA.
Relativamente aos dendrogramas feitos com os dois índices de semelhança e com base
no tipo de dados obtidos, em que a codificação aditiva das variáveis induz à construção de
uma matriz de semelhança com mais ausências de características do que presenças, entre os
espécimes, seria de esperar que o índice J fosse defensável relativamente ao índice SM.
Porém, ambos os dendrogramas formam os mesmos ‘clusters’, sendo a única diferença os
coeficientes de semelhança calculados. Desta forma, apesar de o índice SM aproximar os
espécimes pela ausência de caracteres, este facto não é suficiente para determinar um
agrupamento diferente, quando comparado com o índice J, que não considera os caracteres
ausentes em ambos os espécimes comparados.
A
B

21
Pela análise do dendrograma, formam-se dois grandes grupos de indivíduos (A e B;
Figura 6) com 31% de semelhança. No entanto, estes grupos não correspondem a caracteres
diagnosticantes observados, uma vez que todos são partilhados pelos diferentes espécimes. O
grupo B inclui dois subgrupos; os espécimes 8, 9 e 11 parecem os mais semelhantes entre si,
seguindo-se o 2, 4, 5 e 7. Tendo em conta tanto o comprimento como a largura média dos
esporos, estes parecem ter valores mais baixos para ambas as medidas, relativamente aos
restantes, porém inclui também o espécime 1, que se posiciona no grupo A. Já com o
quociente entre o comprimento e a largura dos esporos não existe qualquer relação com o
agrupamento feito. Relativamente à dilatação das extremidades das hifas, apesar de todos os
espécimes incluidos no grupo B as apresentarem dilatadas, outros espécimes do grupo A
apresentam a mesma condição. Tal ocorre novamente quanto às tonalidades verdes do píleo,
que apesar desta caratecterística ser uniforme para o grupo B, outros espécimes do grupo A
também a apresentam; o revestimento do píleo tanto é viscoso como escamoso, a forma do
estipe tanto é bolboso ou igual, e a cor da carne tanto é branca ou amarela, nos espécimes de
ambos os grupos. Os dois grupos formados também não são influenciados pela reacção
química a bases. Entre os espécimes 8, 9 e 11 sugeridos como os mais semelhantes entre si no
grupo B, a forma do chapéu é convexa no 8 e 11, enquanto que o 9 é mamelonado. Deste
modo, comprova-se a não correlacção entre os grupos formados pelo dendrograma e as
características morfológicas observadas.
3. Análise de Componentes Principais
Uma alternativa à construção dos dendrogamas, como forma exploratória dos dados
obtidos através da caracterização morfológica, pode ser uma análise de componentes
principais (PCA). A PCA consiste num método simples, não-paramétrico, utilizado com o
principal objectivo de reduzir o número de variáveis adjacentes a um conjunto de dados
complexos. Pretende redistribuir os dados originais num novo conjunto de eixos através da
transformação das coordenadas. Os novos eixos denominam-se componentes principais.
Nesta análise pretende-se averiguar se existem características determinantes na
delimitação dos grupos de indivíduos que se obtém. Foi feita com o ‘software’ NTSYSpc (Rohlf,
2008). A análise PCA não pode ser feita com dados em falta. Utilizou-se a mesma matriz incial
que serviu de base na construção do dendrograma fenotípico, excluindo-se a variável ‘Forma
do Chapéu’, devido aos dados em falta, contando-se assim com 71 variáveis. Pelo mesmo
motivo, como se refere na Tabela 6, não foi possível medir esporos nos espécimes com os
números 2 e 6, pelo que tiveram de ser excluídos desta análise, ficando apenas 13 espécimes.
A Figura 7 ilustra a representação gráfica da PCA (baseada nas 3 primeiras
componentes principais).

22
A análise dos dados obtidos através da PCA pode ser discutível, uma vez que os 3 eixos
apenas representam 45,7% da variância explicativa dos caracteres, reduzindo para menos de
metade o conteúdo informativo. O componente principal F1 explica 23,0% da variância, o F2
explica 12,1% e o F3 explica 10,6%.
As variáveis explicativas de cada componente principal foram seleccionadas entre as
que apresentam coeficiente de correlação com o componente principal superior a |0,5|.
Quando se verifica correlação desta ordem com mais do que um componente principal, essa
variável não é considerada como variável explicativa relevante para nenhum componente
principal específico.
Figura 7: Representação tridimensional (3D) da projecção dos 13 espécimes, obtida por análise PCA das 71 variáveis. Para F1, F2 e F3 indicam-se as principais variáveis explicativas dos eixos e respectiva variância.
Pela análise da componente F1, as variáveis explicativas que estão correlacionadas
positivamente são as seguintes: o comprimento dos esporos até 6,7 μm, a largura até 3,8 μm,
as hifas da pileipelis com extremidades dilatadas e a forma do estipe igual; as variáveis
correlacionadas negativamente são as seguintes: o comprimento dos esporos a partir de 7,1
μm, a largura a partir de 4,8 μm, as hifas da pileipelis sem extremidades dilatadas e a cor dos
basidiomas com tons esverdeados. Apenas por F1, e apesar das limitações da análise destes
Variáveis explicativas F1-: Comprimento esporos: 7,1-9,4 µm
Largura esporos: 4,8-6,2 µm
Quociente (C/L) 1,00-1,19 e 1,80-1,99 Largura hifas pileipelis 5,3-6,7 µm
Dilatação extremidade hifas 2,5-3,4 µm
Cor basidioma com tons verdes
Variáveis explicativas F1+: Comprimento esporos: 5,0-6,7 µm
Largura esporos: 3,3-3,8 µm
Ausência dilatação visual hifas epicutis
Largura hifas pileipelis até 2,8 µm
Dilatação extremidade hifas 7,5-8,4 µm
Forma do estipe igual
Variáveis explicativas F2-: Largura hifas epicutis 5,6-7,3 µm
Dilatação extremidade hifas 6,5-7,4 µm
Nº lâminas/cm superior a 17
Variáveis explicativas F2+: Comprimento esporos 6,2-6,4µm Bainha gelatinosa nas hifas epicutis
Variáveis explicativas F3-: Largura esporos 3,9-4,1 µm
Quociente (C/L) 2,00-2,19
F2
F1
F3 var. Ʃ var.
F1 23,0% 23,0%
F2 12,1% 35,2%
F3 10,6% 45,7%

23
resultados, o tamanho dos esporos e a dilatação ou não das hifas da pileipelis parecem ser os
caracteres que mais influenciam o agrupamento dos isolados consoante as características
morfológicas.
Para a PCA ser comparável com o dendrograma (Figura 6), devido à ausência de dados
para caracterizar os espécimes 2 e 6, foram elaborados dendrogramas com os dois índices sem
estes dois isolados. Segundo estes, o posicionamento dos espécimes 4, 5 e 7 pode ser dúbio,
uma vez que deixam de ser incluídos no ‘cluster’ constituído pelos espécimes 8, 9 e 11, sendo
considerados mais distantes destes, tal como sugere a PCA.
A não formação de grupos coesos pla PCA é suportada pelos diferentes dendrogramas,
uma vez que utilizado o índice J no dendrograma dos 13 espécimes, o espécime 4 encontra-se
mais próximo dos espécimes 1, 10, 12, 13 e 15, enquanto que pelo SM está mais próximo de 5
e 7. Pela PCA, nenhum destes grupos é justificável de ser formado.
A análise do posicionamento dos indivíduos no espaço, sugere apenas o agrupamento
dos espécimes 8, 9 e 11, tal como indica o dendrograma fenotípico.

24
FASE 2: CARACTERIZAÇÃO MOLECULAR DOS BASIDIOMAS
A par da caracterização morfológica, foi feita uma caracterização molecular dos
basidiomas em estudo, através do uso de técnicas de PCR para obtenção de perfis de ‘PCR-
fingerprinting’, utilizando os ‘primers’ (GACA)4, (GTGC)4 e csM13, de forma a avaliar a
capacidade de discriminação de cada um deles. Foram construídos dendrogramas
representativos das relações de proximidade genómica entre os espécimes, de modo a
escolher espécimes representativos para subsequente sequenciação da região ITS dos genes
de rRNA, com vista a uma análise filogenética.
PROCEDIMENTO
1. Extracção de DNA genómico
A extracção de DNA total dos espécimes em estudo foi feita de acordo com dois
protocolos distintos, consoante o seu estado de conservação.
Para a extracção de DNA dos espécimes colhidos no campo seguiu-se o protocolo de
extracção de DNA de fungos filamentosos adaptado de Saunders & Owens (1998), a partir de
basidiomas (píleo e estipe) frescos/ congelados.
Para os exemplares de herbário foram testados vários protocolos de extracção de
DNA, tendo-se optado pelo kit E.Z.N.A. Fungal DNA (Omega Bio-Tek). Seguindo o protocolo
recomendado pelo fabricante ('short protocol'), conseguiu-se a extracção de DNA da
totalidade dos exemplares seleccionados para o estudo.
2. Perfis moleculares de ‘PCR-fingerprinting’
Tanto os espécimes colhidos no campo, como os de herbário foram analisados por
MSP-PCR (Microsatellite-Primed Polymerase Chain Reaction), utilizando a sequência ‘core’ do
fago M13 selvagem como 'primer' csM13 (5’ – GAGGGTGGCGGTTCT – 3’) (Huey & Hall, 1989) e
os ‘primers’ (GACA)4 (Meyer et al., 1993) e (GTGC)4, obtendo-se os seus perfis de ‘PCR-
fingerprinting’. Comparou-se o potencial discriminante de ambas as técnicas entre os
espécimes estudados.
Foram testadas as mesmas condições de reacção para os três 'primers'. As reacções
foram feitas em volumes de 25 µl, contendo 1X de tampão de reacção, 2,5 mM de cloreto de
magnésio, desoxinucleósidos trisfosfato (0,2 mM de dATP, dCTP, dGTP e dTTP), 0,2 mM de
cada ‘primer’ e 1 U de Taq polimerase (McGuire, 2010). Todos os reagentes provêm da
Invitrogen (Paisley, UK). Em relação à quantidade de DNA, fez-se aplicação directa para csM13
e (GACA)4 e a diluição 1:10 para (GTGC)4.

25
Em todas as reacções de PCR efectuadas, foram incluídos dois controlos, um controlo
negativo sem DNA com água ultra-pura e um controlo positivo com DNA de Saccharomyces
cerevisiae.
As reacções de PCR foram realizadas num termociclador T1 Thermocycler (Biometra,
Göettigen, Alemanha), nas seguintes condições: um ciclo inicial de 5 minutos a 94ºC; 40 ciclos
de 1 minuto a 94ºC, 1 minuto a 50ºC, 2 minutos a 72ºC e uma extensão final de 6 minutos a
72ºC (Lemsaddek, 2008). Os produtos de amplificação foram separados por electroforese
aplicando-se 12 µl em gel de agarose 1,2% (p/v), em tampão TBE (Tris-borato-EDTA) 0,5 X
(Invitrogen, Paisley, UK) durante 3 horas a 80 V. O gel foi corado com brometo de etídeo e
visualizado sob luz ultravioleta. A imagem foi recolhida com o sistema Alliance 4.7, versão
15.15 (2004-2010, UVItec, Cambridge, UK).
As imagens dos perfis de ‘PCR-fingerprinting’ foram tratadas no programa
BioNumerics®, versão 6.6 (Applied Maths, Kortijk, Béligica). Procedeu-se à normalização das
imagens dos géis obtidos, utilizando o mesmo marcador molecular padrão e uma optimização
de 1%, e compararam-se os respectivos perfis densitométricos, aplicando-se o coeficiente de
correlação de Pearson, para cada técnica isoladamente e para as três técnicas em simultâneo.
A análise numérica dos perfis de ‘PCR-fingerprinting’ e a associação entre os vários
espécimes foram determinadas por um método de aglomeração hierárquica utilizando a
média aritmética não ponderada (UPGMA). A avaliação da robustez dos dendrogramas obtidos
como representação da matriz de semelhança foi avaliada pelo coeficiente de correlação
cofenético (ρ; Sokal & Rohlf, 1962). A reprodutibilidade de cada dendrograma foi calculada
pelo índice de similaridade mais baixo de entre os 10% de espécimes, seleccionados
aleatoriamente e analisados em duplicado, os quais foram utilizadas em experiências
independentes. No dendrogama que analisa as três técnicas usadas, a reprodutibilidade é
calculada pela média de reprodutibilidade de cada um individualmente.
3. Amplificação e análise de restrição da região ITS
A região ITS dos genes de rRNA ribossomal foi amplificada utilizando o par de ‘primers’
ITS4 (5’ - TCCTCCGCTTATTGATATGC - 3’) e ITS5 (5’ - GGAAGTAAAAGTCGTAACAAGG - 3’),
segundo White et al (1990).
As reacções foram feitas em volumes de 25 µl, contendo 1X de tampão de reacção, 2,5
mM de cloreto de magnésio, 0,2 mM de cada desoxinucleósido trifosfato, 0,2 mM de cada
‘primer’ (ITS4 e ITS5) e 1 U de Taq polimerase (Guimarães et al., 2010). Todos os reagentes
provêm da Invitrogen (Paisley, UK). A amplificação da região ITS com estes ‘primers’ origina um
amplicão com aproximadamente 700 bp, correspondente à região ITS1+5,8S+ITS2, localizada
entre os genes de rRNA 18S e 23S (Guimarães et al., 2010).

26
As reacções de PCR para a amplificação da região ITS foram realizadas no mesmo
termociclador T1 que os perfis de ‘PCR-fingerprinting’, nas seguintes condições: um ciclo inicial
de 5 minutos a 94 ºC; 35 ciclos de 1 minuto a 94ºC, 1 minuto a 55ºC, 1 minuto a 72 ºC e uma
extensão final de 10 minutos a 72 ºC (Lemsaddek, 2008). Os produtos de amplificação foram
separados por electroforese aplicando 10 µl em gel de agarose 1% (p/v) em tampão TBE 0,5 X
durante 1 hora a 90 V. O gel foi corado com brometo de etídeo e visualizado sob luz
ultravioleta. A imagem foi recolhida com o sistema Alliance 4.7, versão 15.15 (2004-2010,
UVItec, Cambridge, UK).
Para a análise de perfis de restrição da região ITS (ITS-ARDRA), a amplificação foi
realizada nas mesmas condições descritas acima, num volume de mistura total de 50 µl. Os
amplicões foram em seguida submetidos a uma digestão simples utilizando as endonucleases
de restrição HaeIII (GG^CC), Sau 3AI (^GATC) e MseI (T^TAA).
Para cada amostra estudada, distribuiu-se uma alíquota de 10 µl do produto final do
PCR por três tubos novos de PCR e adicionou-se em cada um deles 1 U de enzima para cada
reacção, 1X de tampão específico para cada enzima de acordo com as instrucções do
fabricante e perfez-se com água ultrapura para um volume total de 20 µl. Incubou-se a 37ºC
durante 14 horas, no termociclador T1 (Biometra), tendo sido parada a reacção de digestão
com a adição de azul de bromofenol (loading buffer). Devido à frequente perda de fragmentos
amplificados durante a fase de purificação dos mesmos, optou-se pela sua aplicação directa
em gel de agarose 2% (p/v). A electroforese decorreu durante 90 minutos, a 90 V em tampão
TBE 0,5 X. O gel foi corado com brometo de etídeo, visualizado em luz ultravioleta e a imagem
foi recolhida com o sistema Alliance 4.7, versão 15.15 (2004-2010, UVItec, Cambridge, UK).
4. Sequenciação da região ITS e análise filogenética
Após selecção aleatória dos espécimes representativos dos grupos obtidos pelo
dendrograma baseado na análise de ‘fingerprinting’, passou-se à fase de sequenciação da
região ITS. A sequenciação, efectuada pelo técnico do LMB-BioFIG, foi levada a cabo num
sequenciador capilar automático CEQ2000XL DNA Analysis System (Beckman Coulter) usando
o kit ‘dye terminator cycle sequencer start kit’ (Beckman Coulter), directamente a partir da
amplificação da região ITS (ITS4/ITS5) num volume de reacção de 50 µl e subsequente
purificação dos produtos de PCR, num volume total de 30 µl. A purificação dos produtos de
PCR foi feita de acordo com o protocolo QIAquick (Qiagen), seguindo as instruções do
fabricante. Ambas as cadeias de DNA foram sequenciadas.
As sequências obtidas, após tratamento no BioEdit Sequence Alignment Editor (versão
7.0.5.3, 1997-2005), foram submetidas a uma análise por BLAST (Altschul et al. 1997) para
pesquisa de homologias no GenBank (NCBI).

27
Para além das sequências da região ITS obtidas através da sequenciação de
representantes do material colhido em Portugal e do material proveniente de herbários,
pesquisou-se em bases de dados públicas, nomeadamente NCBI e EMBL, sequências de
Tricholoma equestre sensu lato de forma a complementar a análise filogenética. Todos os
espécimes utilizados nesta análise encontram-se listados na Tabela 7 com os respectivos
números de acesso ('accession numbers') do GenBank. As sequências de T. flavovirens de
Portugal foram todas obtidas a partir de basidiomas colhidos nos arredores de Coimbra
(Portugal et al., 2007).
Tabela 7: Números de acesso no GenBank e códigos utilizados neste estudo de sequências ITS de Tricholoma.
Espécie Tricholoma
Códigoa GenBank Ref.
b Origem
T. auratum TA - NP Portugal
T. equestre 1AGB-EQ HM590875.1 NP Europa
T. equestre 3AGB-EQ HM590873.1 NP Europa
T. equestre 4AGB-EQ HM590872.1 NP Europa
T. equestre 6AGB-EQ HM590870.1 NP Europa
T. auratum 7AGB-AU HM590869.1 NP Europa
T. auratum 8AGB-AU HM590868.1 NP Europa
T. auratum 9AGB-AU HM590867.1 NP Europa
T. equestre 1BGB-EQ EU186278.1 NP Portugal
T. flavovirens 9BGB-FL EU186309.1 NP Portugal
T. flavovirens 14BGB-FL EU186304.1 NP Portugal
T. flavovirens 24BGB-FL EU186294.1 NP Portugal
T. flavovirens 28BGB-FL EU186290.1 NP Portugal
T. equestre 1CGB-EQ EF493263.1 New Phytol. 180 (4), 875-889 (2008) Lituânia
T. equestre 1FGB-EQ AJ236081.1 NP Noruega
T. flavovirens 1HGB-FL JF899574.1 Mycorrhiza 19 (8):535-548 (2009) Canadá
T. flavovirens 1JGB-FL HQ650740.1 Mycorrhiza 19 (8): 535-548 (2009) Canadá
T. flavovirens 1KGB-FL DQ822834.1 Ecol. Lett. 10 (6): 470-480 (2007) EUA
T. flavovirens 3MGB-FL AF458452.1 Plant and Soil 244: 29–39 (2002) EUA
T. flavovirens 7MGB-FL AF458456.1 Plant and Soil 244: 29–39 (2002) EUA
T. flavovirens 1NGB-FL AF377181.1 Mol. Ecol. 11 (3): 557-569 (2002) EUA
T. flavovirens 2OGB-FL AF349689.1 Mol. Ecol. 10 (9): 2285-2295 (2001) EUA
T. magnivelare 1_Tmagnive AF458441.1 Plant and Soil 244: 29–39 (2002) EUA
T. magnivelare 2_Tmagnive AF458442.1 Plant and Soil 244: 29–39 (2002) EUA
T. magnivelare 3_Tmagnive AF309541.1 Mycologia 96 (4), 730-741 (2004) EUA
T. magnivelare 4_Tmagnive AF377223.1 Mol. Ecol. 11 (3): 557-569 (2002) EUA
T.magnivelare 5_Tmagnive AF309541.1 Mycologia 96 (4), 730-741 (2004) EUA a: EQ (T. equestre), AU (T. auratum), FL (T. flavovirens)
b: NP (não publicado)

28
Para originar uma raíz na árvore filogenética incluiu-se o ‘outgroup’ Tricholoma
magnivelare (Peck) Redhead que é uma espécie próxima de T. equestre (Horton, 2002).
As sequências de DNA da região ITS foram tratadas no BioEdit e alinhadas no ClustalX
(Thompson et al. 1997). A análise filogenética foi levada a cabo no PhyML (versão 3.0),
calculando-se as distâncias genéticas através do método de ‘Neighbor-Joining’ (Saitou & Nei
1987), com bootstrap de 1000 (Felsentein 1985).
RESULTADOS E DISCUSSÃO
1. Perfis de ‘PCR-fingerprinting’
Os perfis originados a partir da técnica de ‘PCR-fingerptinting’ com os 'primers' csM13,
(GACA)4 e (GTGC)4 foram analisados no software BioNumerics®, ilustrando-se na Figura 8, a
título exeplifcativo, os perfis obtidos com o 'primer' csM13.
Figura 8: Perfis de ‘fingerprinting’ molecular obtidos nos 15 espécimes colhidos no campo, com a técnica de MSP-PCR usando o ‘primer’ csM13. MW corresponde ao marcador de massas moleculares ‘1Kb plus DNA ladder’ (Invitrogen). O número de cada poço corresponde à identificação da amostra nele aplicado.
Os perfis obtidos pelas três técnicas foram usados para produzir dendrogramas
indivivuais e um dendrograma composto. A Figura 9 mostra o dendrograma composto
utilizando os 15 espécimes colhidos no campo, cuja identificação não fora possível determinar.
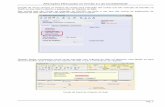
Seleccionaram-se visualmente três macro-grupos (I, II e III), traçando uma linha de corte a 30%
de semelhança. Seleccionaram-se, aleatoriamente, representantes dos principais grupos
formados para sequenciação da região ITS.
MW 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 MW

29
Figura 9: Dendrograma composto representativo dos perfis dos 15 espécimes colhidos no campo, obtidos por MSP-PCR com os ‘primers’ csM13, (GACA)4 e (GTGC)4. Os números I a III representam os 3 ‘megaclusters’ definidos, de onde se escolheram aleatoriamente os espécimes representativos para sequenciação, marcados com um círculo.
(Coeficiente de correlação de Pearson; método de aglomeração UPGMA; ρ= 0,88)
Juntando os perfis de ‘PCR-fingerprinting’ dos espécimes de herbário, obteve-se um
dendrograma composto com a totalidade dos espécimes e com as três técnicas. Na Figura 10
observa-se o agrupamento dos espécimes em qautro macro-grupos (A a D), três deles (A, C e
D) correspondendendo aos mesmos agrupamentos observados na Figura 8 para os isolados
colhidos no campo e o quarto (B) incluindo todos os espécimes de herbário.
No dendrograma inicialmente projectado, incluíram-se os perfis obtidos para os
espécimes 12MA, 13MA e 14MA, correspondentes a T. arvenense, T. sejunctum e T. joachimii,
respectivamente. Estas três espécies posicionaram-se dentro dos grupos formados para os
espécimes em estudo. Tal demonstra que as técnicas de ‘PCR-fingerprinting’ utilizadas não têm
um poder taxonómico discriminante no género Tricholoma, uma vez que não permitem a
separação de espécies. Poderá ser útil para a separação de indivíduos, numa aborgadem feita
em duas fases, o que consiste numa primeira fase de separação dos indivíduos por espécie e
só posteriormente se utiliza esta técnica para averiguar as diferenças entre os indivíduos
pertencentes à mesma espécie.
GACA4 & M13 & GCTGC4
100
90
8070
60
504030
GACA4 M13 GTGC4
Trich 1.
Trich 1.
Trich 1.
Trich 1.
Trich 1.
Trich 2.
Trich 4.
Trich 7.
Trich 1.
Trich 3.
Trich 5.
Trich 1.
Trich 8.
Trich 9.
Trich 6.
I
II
III
Trich. 12
Trich. 13
Trich. 10
Trich. 11
Trich. 15
Trich. 2
Trich. 4
Trich. 7
Trich. 1
Trich. 3
Trich. 5
Trich. 14
Trich. 8
Trich. 9
Trich. 6
(GACA)4 M13 (GTGC)4

30
Figura 10: Dendrograma composto representativo dos perfis dos 15 espécimes colhidos no campo e dos 25 espécimes provenientes de herbário, obtidos por MSP-PCR com os ‘primers’ csM13, (GACA)4 e (GTGC)4. (Coeficiente de correlação de Pearson; método de aglomeração UPGMA; ƿ= 0,93)
Relativamente aos espécimes provenientes de herbário que foram previamente
identificados, não foi possível agrupá-los de acordo com a sua identificação, tendo sido
associados T. equestre, T. auratum e T. flavovirens simultaneamente nos mesmos grupos, não
havendo uma separação consoante a espécie determinada. Tanto ocorre na análise conjunta
dos três perfis, como na análise individual de cada perfil. Este facto parece ser indicativo de
que nenhuma das técnicas tem poder discriminativo para separar os espécimes em estudo de
acordo com a sua distribuição em espécies, o que pode ser explicado por um diferente grau de
conservação filogenética das regiões genómicas analisadas por 'PCR fingerprinting'
relativamente às características morfológicas.
GACA4 & M13 & GCTGC4
100
9590858075706560555045403530
GACA4 M13 GTGC4
Trich 12 gel 1
Trich 13 gel 1
Trich 10 gel 1
Trich 11 gel 1
Trich 15 gel 1
3 MA
5 MA
18 MA
3 GA
1 GA
2 PU
2 GA
15 MA
16 MA
2 MA
3 PU
4 MA
1 MA
6 MA
8 MA
10 MA
11 MA
7 MA
9 MA
19 MA
17 MA
1 PU
Trich 2 gel 1
Trich 4 gel 1
Trich 7 gel 1
Trich 1 gel 1
Trich 3 gel 1
Trich 5 gel 1
Trich 14 gel 1
Trich 8 gel 1
Trich 9 gel 1
Trich 6 gel 1
T. equestre
T. equestre
T. flavovirens
T. flavovirens
T. auratum
T. equestre var popu.
T. equestre
T. flavovirens
T. flavovirens
T. equestre
T. equestre/ auratum
T. equestre
T. equestre
T. equestre
T. equestre
T. equestre
T. auratum
T. equestre
T. equestre
T. flavovirens
T. flavovirens
T. equestre
A
B
C
D
(GACA)4 M13 (GTGC)4

31
No entanto, nota-se um claro agrupamento dos espécimes de herbário relativamente
aos espécimes colhidos no campo, o que pode estar relacionado com a disponibilidade e
qualidade do DNA, tendo em conta o diferente estado de conservação do material, uma vez
que o material de herbário está mais susceptível à degradação.
Relativamente à comparação das três técnicas de MSP-PCR, considerou-se o resultado
da análise conjunta como o que fornece o maior poder informativo, pelo que a comparação é
feita em relação a este. O ‘primer’ (GACA)4 originou perfis com um menor número global de
bandas nos espécimes de herbário, o que à partida iria criar uma separação entre os
espécimes consoante estavam frescos/ congelados por terem sido colhidos no presente ano,
ou desidratados por estarem preservados em herbário. No entanto, foi o único dos três
métodos a agrupar os espécimes 6, 8 e 9, tal como no dendrogama composto, e com o 11
como o seguinte mais próximo deste grupo. O agrupamento dos espécimes 8 e 9, que parece
ser coeso, foi suportado pelas técnicas (GACA)4 e (GTGC)4.
Pela análise do dendrograma composto com os 40 perfis, verifica-se a formação de
dois ‘clusters’ maiores com 27% de semelhança, um deles inclui os espécimes 6, 8 e 9, o outro
subdivide-se em outros quatro ‘clusters’. Os espécimes de herbário agrupam-se num ‘cluster’,
apesar de haver maior semelhança entre os espécimes de Espanha e o de França, separados
por 46% de semelhança do 3MA e 5MA provenientes da Madeira. Contudo, não inclui o
espécime 2MA que também provém da Madeira. O grupo que contém o material de herbário
apresenta 34% de semelhança com os espécimes 1, 2, 3, 4, 5, 7 e 14, que por sua vez tem 30%
de semelhança com o grupo de espécimes que inclui o 10, 11, 12, 13 e 15.
Em relação à reprodutibilidade dos três métodos, foi sempre mais baixa aquando da
análise dos perfis do material de herbário comparativamente com o material colhido este ano.
Tal sugere que o poder discriminante das técnicas depende do estado de conservação do
material de que se extrai DNA. Na análise dos espécimes colhidos no campo, a
reprodutibilidade mais baixa foi de 83% para a técnica M13, 92% para (GTGC)4 e 93% para
(GACA)4. Na análise dos espécimes de herbário, a reprodutibilidade foi de 82% para a técnica
M13, 79% para (GTGC)4 e 89% para (GACA)4. Para o cálculo da reprodutibilidade do
dendrograma composto fez-se a média das reprodubilidades médias obtidas para cada técnica
entre os espécimes do campo e de herbário, sendo portanto considerada a linha de corte a
84%.

32
Deste modo, esta análise não apresenta, por si só, um carácter conclusivo
relativamente à problemática investigada.
De entre os espécimes de herbário foram seleccionados 9 aleatoriamente para
sequenciação da região ITS, para serem incluídos na análise filogenética.
2. Análises ITS-ARDRA e filogenética
Apesar de a sequenciação ter sido levada a cabo nos dois sentidos da sequência, surgiu
um problema de sequenciação que, mesmo após repetição, originou cromatogramas da
sequência originada pelo ‘primer’ ITS5 que não estavam em condição de ser analisados. Só foi
possível obter-se as sequências nos dois lados para os espécimes 6, 15 e 2MA.
Para ter uma ideia do erro que podia estar a induzir a ausência do outro lado na
maioria das sequências, realizou-se um BLAST, confirmando uma homologia superior a 95%
com sequências da base de dados de T. equestre, T. auratum e T. flavovirens. Ao mesmo
tempo, procedeu-se a um alinhamento com as sequências disponíveis no GenBank utilizadas
neste trabalho, tentando corrigi-las com base no mesmo. De seguida, submeteram-se as
sequências corrigidas às restrições utilizadas na análise de ITS-ARDRA in silico, e verificou-se a
existência de 2 perfis diferentes, cujos fragmentos obtidos eram consistentes para todas as
sequências (ver anexos). Considerou-se, portanto, que apesar de poder haver um erro
associado nestas sequências, não havia evidência suficiente que impedisse de serem utilizadas
nas análises subsequentes.
Após corrigidas, as sequências foram alinhadas, obtendo-se um alinhamento de 590
nucleótidos da região ITS, utilizado para fazer uma árvore filogenética (Figura 11).
Como análise complementar da árvore filogenética, procedeu-se ao cálculo das
distâncias genéticas entre os indivíduos (Tabela 8), por comparação dois-a-dois com base nas
sequências de ITS, no ‘software’ MEGA (versão 5.0).
Através da análise conjunta da árvore filogenética e das distâncias genéticas entre
espécimes com base na sequência de ITS, observa-se a formação de 2 clados: A e B, sendo o
clado A constituído por 3 subclados monofiléticos A1, A2 e A3. Estes grupos do clado A incluem
espécimes de Portugal, Espanha e França (A1); EUA, Canadá e Noruega (A2); e Portugal,
Espanha e Lituânia (A3). O clado B inclui espécimes de Portugal, Espanha e EUA. Esta
distribuição demonstra que não existe estruturação geográfica. As sequências do GenBank
distribuem-se por todos os clados, sem se denotar uma separação óbvia consoante a
identificação.

33
Figura 11: Árvore filogenética representativa das relações evolutivas de 33 sequências de ITS de T. equestre considerados neste estudo, como resultado de uma análise de Máxima Verosimilhança (Maximum Likelihood) de um alinhamento de 590 pares de bases de nucleótidos. Os números nos ramos correspondem aos valores de ‘bootstrap’ superiores a 0,5. Os traços do lado direito representam os grupos formados pela análise de ITS-ARDRA.
A
B
A1
I
IIa
III
ITS-ARDRA
A2
A3
IIb

34
Tabela 8: Distância ‘pairwise’ percentual entre os espécimes em estudo. Representa a sequência ITS amplificada a partir dos ‘primers’ ITS4 e ITS5. As diferenças genéticas das sequências de T. equestre variam entre 0% e 10,30%, e variam entre 18,50% e 22,70% do ‘outgroup’ T. magnivelare. Nesta tabela não estão representados os seguintes espécimes que apresentaram 100% de semelhança com outros entre parenteses, o qual foi utilizado como representativo: 8BGB-FL, 19BGB-FL, 21BGB-FL, 31BGB-FL (=24BGB-FL), 1MA (=4MA), 3PU (=10), 26BGB-FL (=9BGB-FL), 6MGB-FL (=1HGB-FL), 5AGB-EQ (=2PU), 2MA (=TA) e 2, 3, 4 e 5_Tmagnivelare (=1_Tmagnivelare).
Os níveis de divergência genética entre as sequências do clado A variam até 4,8%, no
clado B variam entre 1,4 e 7,2%, enquanto que entre os dois clados variam entre 3,3 e 10,3%.
Estas distâncias suportam o facto de o clado A ser mais recente pois contém indivíduos que
divergem no máximo 4,8%, apesar do maior número de amostras, e o clado B ser mais
ancestral, uma vez que acumulou um maior número de mutações ao longo do tempo,
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
[ 1] #1_Tmagnivelare - - - - - - - - - - - - - - - -
[ 2] #24BGB-FL 19,20 - - - - - - - - - - - - - - -
[ 3] #14BGB-FL 19,50 0,20 - - - - - - - - - - - - - -
[ 4] #4MA 19,80 0,50 0,20 - - - - - - - - - - - - -
[ 5] #10 19,50 0,20 0,50 0,70 - - - - - - - - - - - -
[ 6] #5MA 19,80 0,50 0,70 0,50 0,70 - - - - - - - - - - -
[ 7] #15MA 19,60 0,70 0,90 1,20 0,90 1,20 - - - - - - - - - -
[ 8] #8AGB-AU 19,50 0,20 0,50 0,70 0,50 0,70 0,90 - - - - - - - - -
[ 9] #15 20,10 1,20 1,40 1,70 1,40 1,70 1,90 1,40 - - - - - - - -
[10] #7 19,50 0,50 0,70 0,90 0,70 0,90 1,20 0,70 1,40 - - - - - - -
[11] #1PU 21,70 1,90 2,10 2,40 2,10 2,40 2,60 2,10 3,10 2,10 - - - - - -
[12] #7AGB-AU 20,50 1,90 2,10 2,40 1,70 2,40 2,60 2,10 3,10 2,40 3,10 - - - - -
[13] #6AGB-EQ 19,50 0,20 0,50 0,70 0,00 0,70 0,90 0,50 1,40 0,70 2,10 1,70 - - - -
[14] #9BGB-FL 20,10 0,70 0,90 1,20 0,50 1,20 1,40 0,90 1,90 1,20 2,60 2,10 0,50 - - -
[15] #4AGB-EQ 19,80 0,50 0,70 0,90 0,20 0,90 1,20 0,70 1,70 0,90 2,40 1,90 0,20 0,70 - -
[16] #9AGB-AU 19,50 0,20 0,50 0,70 0,00 0,70 0,90 0,50 1,40 0,70 2,10 1,70 0,00 0,50 0,20 -
[17] #28BGB-FL 19,50 0,20 0,50 0,70 0,50 0,70 0,90 0,50 1,40 0,20 1,90 2,10 0,50 0,90 0,70 0,50
[18] #1HGB-FL 19,20 1,20 1,40 1,70 1,40 1,70 1,90 1,40 2,40 1,70 2,90 3,10 1,40 1,90 1,70 1,40
[19] #3MGB-FL 19,50 1,40 1,70 1,90 1,70 1,90 2,10 1,70 2,60 1,90 3,10 3,40 1,70 2,10 1,90 1,70
[20] #1KGB-FL 19,50 1,40 1,70 1,90 1,70 1,90 2,10 1,70 2,60 1,90 3,10 3,40 1,70 2,10 1,90 1,70
[21] #1NGB-FL 18,50 0,70 0,90 1,20 0,90 1,20 1,40 0,90 1,90 1,20 2,60 2,60 0,90 1,40 1,20 0,90
[22] #1AGB-EQ 19,40 2,60 2,40 2,60 2,40 3,10 3,30 2,80 3,80 3,10 4,60 4,10 2,40 2,90 2,60 2,40
[23] #1CGB-EQ 19,10 2,40 2,60 2,90 2,10 2,90 3,10 2,60 3,60 2,90 4,30 3,80 2,10 2,60 2,40 2,10
[24] #2PU 18,80 2,10 2,40 2,60 1,90 2,60 2,90 2,40 3,40 2,60 4,10 3,60 1,90 2,40 2,10 1,90
[25] #1BGB-EQ 19,70 2,90 3,10 3,30 2,60 3,30 3,60 3,10 4,10 3,30 4,80 4,30 2,60 3,10 2,90 2,60
[26] #1JGB-FL 18,80 0,90 1,20 1,40 1,20 1,40 1,70 1,20 2,10 1,40 2,90 2,90 1,20 1,70 1,40 1,20
[27] #2OGB-FL 18,50 0,70 0,90 1,20 0,90 1,20 1,40 0,90 1,90 1,20 2,60 2,60 0,90 1,40 1,20 0,90
[28] #1FGB-EQ 20,10 1,90 2,10 2,40 1,70 2,40 2,60 2,10 3,10 2,40 3,80 3,40 1,70 2,10 1,90 1,70
[29] #9 18,80 4,60 4,80 5,10 4,80 5,10 5,30 4,80 5,90 5,10 6,60 6,60 4,80 5,30 5,10 4,80
[30] #TA 19,70 6,10 6,40 6,60 6,40 6,60 6,60 6,40 6,40 6,60 8,20 8,20 6,40 6,90 6,60 6,40
[31] #7MGB-FL 20,40 5,10 5,30 5,60 5,30 5,60 5,90 5,30 6,40 5,60 7,10 7,10 5,30 5,90 5,60 5,30
[32] #3AGB-EQ 18,60 4,10 4,30 4,10 4,30 4,60 4,10 5,10 4,30 5,80 5,80 4,10 4,60 4,30 4,10 4,10
[33] #6 22,70 8,40 8,70 8,20 8,70 9,00 8,40 9,60 8,70 10,30 10,10 8,20 8,70 8,40 8,20 8,20
17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32[18] #1HGB-FL 1,40 - - - - - - - - - - - - - - -
[19] #3MGB-FL 1,70 0,20 - - - - - - - - - - - - - -
[20] #1KGB-FL 1,70 0,20 0,50 - - - - - - - - - - - - -
[21] #1NGB-FL 0,90 0,50 0,70 0,70 - - - - - - - - - - - -
[22] #1AGB-EQ 2,90 2,40 2,60 2,60 1,90 - - - - - - - - - - -
[23] #1CGB-EQ 2,60 2,10 2,40 2,40 1,60 0,20 - - - - - - - - - -
[24] #2PU 2,40 1,90 2,10 2,10 1,40 0,50 0,20 - - - - - - - - -
[25] #1BGB-EQ 3,10 2,60 2,90 2,90 2,10 1,20 0,90 0,70 - - - - - - - -
[26] #1JGB-FL 1,20 0,70 0,90 0,90 0,20 1,60 1,40 1,20 1,90 - - - - - - -
[27] #2OGB-FL 0,90 0,50 0,70 0,70 0,00 1,90 1,60 1,40 2,10 0,20 - - - - - -
[28] #1FGB-EQ 2,10 1,70 1,90 1,90 1,20 2,60 2,40 2,10 2,90 1,40 1,20 - - - - -
[29] #9 4,80 4,60 4,80 4,60 4,10 5,60 5,30 5,60 6,30 4,30 4,10 5,30 - - - -
[30] #TA 6,40 6,40 6,60 6,40 5,80 7,40 7,10 7,40 8,10 6,10 5,80 7,10 1,70 - - -
[31] #7MGB-FL 5,40 4,80 5,10 4,80 4,60 6,10 5,80 6,10 6,80 4,80 4,60 5,80 3,10 4,80 - -
[32] #3AGB-EQ 4,10 3,80 4,10 3,80 3,30 4,80 4,60 4,30 5,10 3,60 3,30 4,60 1,40 3,10 3,10 -
[33] #6 8,50 7,60 7,90 7,40 7,60 8,90 8,70 8,90 9,70 7,90 7,60 8,70 4,40 6,10 7,20 5,90

35
encontrando-se numa posição mais basal da árvore; engloba os espécimes 6, 9, TA, 7MGB-FL e
3AGB-EQ. A separação dos clados A e B é também antiga, na medida em que se encontram
diferenças genéticas de 10,3%, que é superior a qualquer divergência genética dentro dos
clados. Quando se compara com o ‘outgroup’, a diferença mínima encontrada é de 18,5% e a
máxima 22,7%. Entre os espécimes de T. equestre, as diferenças entre si nunca atingem
valores tão elevados, sendo a diferença máxima encontrada de 10,3%, sugerindo que o mais
provável é os espécimes em estudo constituirem apenas uma espécie.
Relativamente à análise de ITS-ARDRA, resultaram três perfis distintos. Na árvore
filognética, os traços verticais do lado direito representam os grupos de I a III formados pela
análise de ITS-ARDRA. O grupo II divide-se em IIa e IIb, dado que englobam um grupo de
espécimes que partilham o mesmo perfil, contudo distribuem-se em dois grupos que
pertencem a clados distintos pela filogenia. Deste modo, fez-se corresponder aos grupos de
perfis I, IIa, III e IIb, os clados A1, A2, A3 e B, respectivamente. Contudo, há dois espécimes que
ambas as análises não são concordantes, não ficando esclarecido o seu posicionamento: (i)
1FGB-EQ, que pela filogenia não tem um posicionamento muito claro relativamente aos clados
A2 e A3, pertencendo ao grupo IIa pelo ITS-ARDRA; e (ii) 2OGB-EQ, que se encontra mais
próximo do clado A3, porém pertence ao grupo IIa de ITS-ARDRA.

36
DISCUSSÃO GERAL
T. equestre tem sido considerado como uma espécie variável – tanto no que se refere
aos caracteres macroscópicos como microscópicos. Essa variação levou a que muitos autores
considerassem a existência de 3 espécies dentro do complexo, baseados, fundamentalmente,
em pequenas diferenças na macroscopia e no habitat. Avaliando a variação de caracteres e
recorrendo, adicionalmente, a técnicas moleculares, tentou-se resolver este problema: os três
taxa representam realmente três espécies diferentes ou trata-se só de uma espécie?
Apesar do esforço de colheita, durante o ano transacto, as condições climáticas não
foram favoráveis ao surgimento de um grande número de basidiomas de T. equestre e assim se
explica o número reduzido de espécimes caracterizados; os locais onde se desenvolvem estes
cogumelos são pouco divulgados, de modo a defender os interesses dos apanhadores que os
comercializam, não sendo facilmente localizáveis. Só foi possível a determinação das
características morfológicas dos espécimes colhidos no campo, dado que as exsiccata de
herbário já perderam muitas dessas características, sendo possível apenas uma caracterização
molecular. Verificou-se também que os herbários ibéricos que nos disponibilizaram material
para estudo não eram particularmente ricos em colecções desta espécie ou das espécies que
integram o complexo. Uma das razões prováveis está relacionada com o carácter comestível
destes fungos, o que leva a que a sua apanha seja mais direccionada para alimentação e
menos frequentemente para colecções de herbário, o que também torna difícil averiguar o
estado de estatuto de conservação desta espécie. Mesmo assim, nos poucos espécimes
recolhidos do campo, foi possível observar uma enorme diversidade de caracteres.
Apesar de a análise morfológica não ter sido elucidativa para a identificação dos
espécimes em estudo, a análise molecular conjunta veio contibuir com mais informações para
a sua caracterização, esclarecendo algumas questões.
A abordagem morfológica não permitiu distinguir mais do que uma espécie dentro do
complexo T. equestre. Os vários espécimes apresentaram características que se enquadravam
nos conceitos das três espécies do complexo. Como não foi possível a delimitação de grupos
de espécimes com caracterísiticas semelhantes óbvias, procedeu-se ao cálculo dos coeficientes
de semelhança entre pares de indivíduos, representando-os num dendrograma e fazendo uma
análise de componentes principais. A PCA utilizada neste estudo pretende analisar a
delimitação de grupos de indivíduos com base nas características morfológicas que
apresentam. As conclusões que se retiram a partir da PCA podem ser à partida discutíveis dado
que os três componentes principais apenas explicam 45,7% da variância dos caracteres

37
pesquisados. Apesar disso, sugere-se a possibilidade do tamanho dos esporos e a dilatação ou
não das hifas da pileipelis poderem ser dos caracteres com mais influência no agrupamento
dos espécimes consoante as suas características morfológicas.
Pelas duas análises complementares dos caracteres morfológicos, o dendrograma e a
PCA, observa-se a formação de um grupo que inclui os espécimes 8, 9 e 11 mais afastados dos
restantes, que não parecem formar grupos óbvios, pelo menos pela PCA. No dendrograma
foram incluídos os espécimes 2 e 6, os quais foram excluídos na PCA, permanecendo a
localização incerta dos mesmos. Como tentativa de esclarecimento, comparou-se com as
análises moleculares, de modo a pesqisar eventuais resultados que suportem a sua relação
com os restantes. Segundo todas as análises moleculares, o espécime 6 encontra-se mais
próximo do espécime 9 (análise filogenética) e também do 8 (perfis ‘fingerprinting’), ao
contrário do dendrograma fenotípico com os 15 isolados que o aproxima do 3 e 14. Considera-
se que tal se pode dever ao facto de não haver medidas de esporos para o espécime 6 e, como
este caracter se encontra fortemente associado ao componente principal F1, a sua ausência
pode ter sido suficiente para um posicionamente não real deste espécime no dendrograma.
Assim, gera-se a possibilidade de um posicionamente também duvidoso do espécime 2, apesar
deste ser considerado consistentemente, pelos perfis ‘fingerprinting’, como mais próximo dos
espécimes 4, 5 e 7.
A caracterização molecular consistiu na utilização de técnicas de análise do genoma,
tais como técnica de MSP-PCR para obtenção de perfis de ‘PCR-fingerprinting’ e sequenciação
de genes ribossomais com vista a uma análise filogenética. Para se proceder à análise
molecular, foi necessário aumentar a amostragem, recorrendo-se a material de herbário e a
sequências depositadas em bases de dados públicas, de modo a dar mais consistência à análise
filogenética.
Como houve a possibilidade de obter DNA do material de herbário, comparam-se os
seus perfis de DNA com o do material colhido. Esta análise parece não ter uma boa capacidade
discriminante quando se utiliza DNA extraído de material em diferentes formas de
conservação, especialmente de material desidratado, uma vez que tal pode influenciar a sua
qualidade e disponibilidade. No entanto, sugere algum poder discriminante quando aplicado a
DNA extraído de material fresco, pois pelo menos verifica-se uma maior diversidade nos seus
perfis. Ainda assim, foi a partir desta análise que foram seleccionados os espécimes para
sequenciação da região ITS, para se proceder à análise filogenética.
Apesar de a maioria das sequências utilizadas na análise terem sido corrigidas com
base em apenas um dos lados da sequência, considera-se que tal não deve ter afectado os
resultados obtidos. Por um lado, a análise de ITS-ARDRA confirmou a obtenção de perfis

38
consistentes com os restantes, não se notando nenhuma discrepância em qualquer sequência,
e por outro, devido ao facto de na análise filogenética se verificar a formação de dois clados e
em ambos estarem sequências, cuja correcção foi feita com base na sequenciação dos dois
lados.
Pela análise de ITS-ARDRA, todas as sequências obtidas, tanto do material colhido no
campo, como do de herbário e também as sequências do GenBank, formam 3 grupos distintos
segundo os seus perfis: I, II e III. Ao realizar-se uma análise complementar com a filogenética,
subdividiu-se o grupo II, uma vez que, apesar do perfil ser o mesmo, se encontram
filogeneticamente separados em dois clados distintos. De acordo com este resultado,
considera-se que a abordagem de ITS-ARDRA fornece conteúdo informativo na variabilidade
da região ITS para espécimes de T. equestre, mas não reflecte as relações evolutivas entre os
indivíduos. Assim sendo, e porque se trata de um método dispendioso, a abordagem de ITS-
ARDRA não deve ser preferencial, uma vez que fornece informação taxonómica insuficiente no
que respeita à diferenciação de espécimes da espécie T. equestre. Em alternativa, a análise
filogenética e o cálculo da distância genética das sequências pode ser uma mais-valia por
fornecer informações mais completas.
Do presente estudo, infere-se que a distância dos espécimes em estudo ao ‘outgroup’,
uma espécie próxima do mesmo género, é de 18,5% a 22,7%, superior a qualquer distância
encontrada entre os espécimes testados, que atinge no máximo 10,3% e que já é entre os dois
clados formados. As sequências denominadas com os três epítetos estão distribuidas dentro
dos dois clados considerados. Os espécimes de que foi possível saber o local de colheita,
também não estão agrupados em nenhum clado, distribuindo-se uniformemente, o que indica
a não existência de estruturação geográfica.
Assim, numa perspectiva global, tendo em conta as abordagens fenotípica e genómica,
sugere-se o agrupamento consistente dos espécimes 8 e 9, com base no dendrograma
fenotípico e no dos perfis de ‘PCR-fingerprinting’. Segundo a análise de perfis, o espécime 11
não é considerado próximo do 8 e do 9, enquanto que, o espécime 6 é agrupado com o 8 e o 9.
A análise filogenética agrupa os espécimes 6 e 9 e junta-lhes o 2MA e o TA. Assim, com estas
análises sugere-se uma posição incerta para o espécime 11, não havendo suporte filogenético,
e sugere-se a formação de um grupo que inclua, pelo menos, os espécimes 6, 8, 9, 2MA, TA e
talvez o 11, separado dos restantes. Para maior esclarecimento seria conveniente proceder-se
à sequenciação dos espécimes 8 e 11. Dentro deste grupo incluem-se espécimes provenientes
de diferentes localizações geográficas, desde a Europa, nomeadamente de Portugal (6, 8, 9 e
2MA) aos EUA (7MAGB-FL); de diferentes habitats, desde pinhal (9 e 11) a mata mista (6 e 8); e

39
com caracteres morfológicos distintos (6, 8, 9 e 11). Assim, não foi possível atribuir um
caracter que se destaque na caracterização deste grupo de isolados.
A maior dúvida reside nas relações de semelhança entre os restantes espécimes. A
análise morfológica não contribuiu claramente para um agrupamento coerente entre eles; a
análise filogenética indica as relações evolutivas, sem que tal seja suficiente para os agrupar de
alguma forma coerente.
Apesar de a análise morfológica permitir a identificação de diferentes taxa no material
objecto deste estudo, a análise filogenética poderá ser indicativa da possível existência de dois
grupos dentro desta amostra. Porém, tais diferenças não aparentam ser suficientes para a
separação em duas espécies distintas, podendo representar variedades ou formas ecológicas
da mesma espécie. Os resultados obtidos com as diferentes técnicas aplicadas também não
foram uniformes, pois os espécimes apareceram agrupados de maneira diferente. Este facto
leva-nos a ponderar a existência de um só taxon, T. equestre, que apresenta uma grande
plasticidade de caracteres morfológicos como reflexo do efeito de uma grande variabilidade
genética.

40
CONSIDERAÇÕES FINAIS
A delimitação das espécies do complexo T. equestre, T. auratum e T. flavovirens nem
sempre foi clara com base nos critérios morfológicos tradicionais utilizados por diferentes
autores que as estudaram. Tal resultou no reconhecimento das espécies T. equestre e T.
auratum por Bon (1984) e Courtecuisse & Duhen (1994), T. flavovirens e T. auratum por Moser
(1983), T. equestre var. equestre por Noordeloos & Christensen (1999) e apenas T. equestre
por Quélet (1964).
No presente trabalho fez-se uma revisão da espécie em causa e pretendeu-se seguir
uma abordagem polifásica, caracterizando uma colecção de espécimes com base nos
tradicionais métodos morfológicos e também pelos métodos moleculares disponíveis.
Com base nos espécimes de Tricholoma equestre da Península Ibérica utilizados neste
estudo, conclui-se que se deve tratar de uma morfoespécie que apresenta uma grande
variabilidade fenotípica e genética entre os indivíduos que a constituem.
Não foram encontrados factos suficientes, nomeadamente características morfológicas
ou genéticas, de ‘habitat’ ou localização geográfica distinta, que permitam a delimitação de
mais do que uma espécie diferente. De igual modo, não se encontraram evidências para
justificar a atribuição dos 3 epítetos diferentes utilizados para designar as espécies deste
complexo. Portanto, propõe-se que o mais correcto seria designar todos os espécimes
incluídos neste estudo por Tricholoma equestre, designação prioritária entre as três
consideradas.
Como perspectiva futura de aprofundamento deste estudo, sugere-se o aumento da
amostragem, tanto em número como em regiões geográficas pesquisadas, de modo a captar a
maior variabilidade de caracteres possível. Sugere-se também a pesquisa de outros caracteres
fenotípicos ou bioquímicos, bem como a utilização de outros genes alvo na análise
filogenética; ou, ainda, a realização de testes de compatibilidade genética intraspecífica
(pairing-tests) baseados no “fenómeno de Buller” (Quintanilha, 1939), que permitem a
identificação específica de micélios dicarióticos de culturas polispóricas, pelo confronto com
culturas teste homocarióticas (monospóricas) de determinada espécie; a dicariotização dos
homocários (observável pela alteração na morfologia das colónias, ou pela presença de ansas
de anastomose, se for o caso) é indicadora de que os indivíduos pertencem à mesma espécie.
É factor condicionante a possibilidade de se obter aquelas culturas nas espécies de Tricholoma
em estudo.

41
ANEXO
Tabela A: Locais de corte das enzimas de restrição escolhidas para a análise de ITS-ARDRA.
Os fragmentos representados são resultado de uma análise in silico.

42
Glossário:
Adnada (quanto às lâminas) – lâminas que se inserem perpendicularmente no estipe.
Anel – resto de véu parcial, sobre o pé.
Basidioma – corpo frutífero de um fungo Basidiomycota
Caulocistídio – cistídeo localizado na superfície do estipe.
Cistídio – célula normalmente de maiores dimensões que os basídeos, localizada na superfície
himenial de um fungo pertencente ao filo Basidiomycota.
Cortina – véu parcial com filamentos.
Esporada – impressão dos esporos em massa deixada numa superfície.
Estipe – estrutura semelhante a um caule, que suporta o píleo de um cogumelo; também
denominado de pé.
Estipitipelis – camada mais externa no estipe de um basidioma.
Himénio – superfície de um basidioma onde se desenvolvem os basídeos ou ascos e se
produzem os esporos.
Himenóforo – estrutura que suporta o himénio num corpo frutífero; pode ser liso, com
lâminas, pregas, tubos ou dentes.
Ixotricoderme – semelhante a tricoderme, mas com bainha gelatinosa.
Lâmina – elemento do himenóforo onde estão as estruturas reprodutoras.
Mamelonado – forma do píleo em que o centro apresenta uma certa proeminência
arredondada.
Pileipelis – camada mais externa no píleo de um basidioma.
Píleo – designação técnica para o chapéu de um cogumelo, onde se encontra a superfície
portadora dos esporos.
Sinuada ou emarginada (quanto às lâminas) - significa que de repente encurvam para cima
mesmo antes de chegar a tocar o píleo, dando um efeito de gancho.
Superfície himenial – conjunto alinhado de células férteis que pertence ao basidioma.
Tricoderme – tipo de organização de micélio em que as hifas se dispõem mais
perpendicularmente do que horizontalmente.
Véu parcial – tecido membranar temporário que protege o himénio de alguns fungos
Basidiomycota.

43
BIBLIOGRAFIA
Alves A, Phillips AJL, Henriques I & Correia A. 2007. Rapid differentiation of species of Botrysphaeriaceae by PCR fingerprinting. Research in Microbiology 158: 112-121.
Altschul SF, Thomas LM, Alejandro AS, Jinghui Z, Webb M. & David JL. 1997. Gapped BLAST and PSI-BLAST: a new generation of protein database search programs. Nucleic Acids. Research 25: 3389–3402.
Anónimo [Newton I]. (1887). Contributions à la Flore Cryptogamique du Nord du Portugal. I. Bol. Soc. Geogr. Lisboa, Sér. 7, 4 : 243-267.
Arruda MCC, Miller RNG, Ferreira MASV & Felipe MSS. 2003. Comparison of Crinipellis
perniciosa isolates from Brazil by ERIC repetitive element sequence-based PCR genomic fingerprinting. Plant Pathol. 52:236-244.
Bon M. 1991. Les Tricholomes et ressemblants. Flore Mycologique d’Europe. Doc. Mycol. Series no. 2:1–163.
Breitenbach J & Kränzlin F. 1991. Champignons de Suisse Tome 3 (Bolets et champignons à
lames 1ère
partie). Mykologia, Luzern.
Câmara MS. 1956. Catalogus Systematicus Fungorum Omnium Lusitaniae. I Basi diomycetes.
Pars. I Sphaeropsidales. Direcção Geral Serv. Agric. Lisboa
Centro de Micologia da Universidade de Lisboa. 2002. Listagem preliminar de fungos agaricoides de Portugal. Registos de 1878 a 1997. CMUL. Lisboa.
Colwell RR. 1970. Polyphasic taxonomy of the genus Vibrio: numerical taxonomy of Vibrio
cholerae, Vibrio parahaemolyticus and related Vibrio species. Journal of Bacteriology 104:410–433.
Courtecuisse R & Duhem B. 1994. Guide des Champignons de France et d’Europe. Delachaux & Niestlé. Lausanne, Paris.
Christensen M & Heilmann-Clausen J. 2008. Tricholoma (Fr.) P. Kumm. In : Knudsen H & J Vesterholt (Eds). Funga Nordica. Pp. 413-429. Nordsvamp, Copenhagen.
Felsenstein J. 1985. Confidence limits on phylogenies: an approach using the bootstrap. Evolution 39: 783–791.
Grimont F & Grimont. 1986. Ribosomal ribonucleic acid gene restriction patterns as potential taxonomic tools. Ann Inst Pasteur Microbiol 137B: 165-175.
Guarro J, Gené J & Stchigel A. 1999. Developments in Fungal Taxonomy. Clinical Microbiology
Reviews 12(3): 454-500.
Guindon S, Dufayard JF, Lefort V, Anisimova M, Hordijk W & Gascuel O. 2010. New Algorithms and Methods to Estimate Maximum-Likelihood Phylogenies: Assessing the Performance of PhyML 3.0. Systematic Biology 59(3): 307-21.
Guimarães JB, Chambel L, Melzoch K, Pereira P & Tenreiro R. 2010. Cladosporium sp. from phyloplane: a diversity evaluation on a Continental ecosystem. Mycosphere 2(3):191-201.

44
Hall TA. 1999. BioEdit: a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT. Nucl. Acids. Symp. Ser. 41: 95-98.
Horton T. 2002. Molecular approches to ectomycorrhizal diversity studies: variation in ITS at a local scale. Plant and Soil 244: 29-39.
Huey B & Hall J. 1989. Hypervariable DNA. Fingerprinting in Escherichia coli: minisatellite probe from bacteriophage M13. The Journal of Bacteriology 171: 2528-2532.
Iwen PC, Hinrichs SH & Rupp ME. 2002. Utilization of the internal transcribed spacer regions as molecular targets to detect and identify human fungal pathogens. Med Mycol 40(1): 87-109.
Kirk P. (2008). Index Fungorum. http://www.indexfungorum.org
Kibby G. 2010. The Genus Tricholoma in Britain. Field Mycology 11(4): 113-140.
Kikuchi K, Matsushita N & Suzuki K. 2007. Discrimination of Tricholoma species by species-specific ITS primers. Mycoscience 48: 316-320.
Kranabetter JM, Friesen J, Gamiet S & Kroeger P. 2009. Epigeous fruiting bodies of ectomycorrhizal fungi as indicators of soil fertility and associated nitrogen status of boreal forests. Mycorrhiza 19: 535-548.
Kühner R & Romagnesi H. 1953. Flore analytique des Champignons Supérieurs (Agarics, Bolets,
Chanterelles). Masson et Cie, Paris.
Kuo M. 2004. The Tricholomataceae. Retrieved from the MushroomExpert.Com Website: http://www.mushroomexpert.com/tricholomataceae.html
Lemsaddek A. 2008. Estudo de dermatófitos por métodos moleculares: identificação, resistência a antifúngicos e virulência. Tese doutoramento, Universidade de Lisboa, Portugal.
Lusta KA, Kochkina GA, Sul IW, Chung IK, Park HS & Shin D. 2003. An integrated approach to taxonomical identification of the novel filamentous fungus strain producing extracellular lipases: morphological, physiological and DNA fingerprinting techniques. Fungal Diversity 12:135-149.
McGuire D. 2010. Selecção e caractrização de leveduras ‘starter’ a partir de populações autóctones de mosto. Tese mestrado, Universidade de Lisboa, Portugal.
Meyer W, Mitchell TG, Freedman EZ & Vilgalys R. 1993. Hybridization probes for conventional DNA fingerprinting used as single primers in the polymerase chain reaction to distinguish strains of Cryptococcus neoformans. J Clin. Microbiol. 31: 2274–2280.
Modesto, M.L. & Baptista-Ferreira, J.L. (2010). Cogumelos, do campo até à mesa. Lisboa: Babel.
Moser M. 1983. Keys to Agarics and Boleti. Published by Roger Phillips. London.
Noordeloos ME & Christensen M. 1999. Genus Tricholoma. In: Noordeloos ME, Van Creval R & Vellinga EC (Eds.). Flora Agaricina Neerlandica vol. 4: 107-148. CRC Press.

45
Nygren CMR, Eberhardt U, Karlsson M, Parrent JL, Lindahl BD & Taylor AFS. 2008. Growth on nitrate and occurrence of nitrate reductase-encoding genes in a phylogenetically diverse range of ectomycorrhizal fungi. New Phytologist 180(4) :875-879.
Pitcher DG, Saunders NA & Owen RJ. 1989. Rapid extraction of bacterial genomic DNA with guanidium thiocyanate. Letters in Applied Microbiology Volume 8, Issue 4.
Portugal A, Bidartondo M, Rodríguez-Echevería S, Gonçalves S, Freitas H & Gonçalves T. (2007). Contribution to the molecular delimitation of the Tricholoma flavovirens species complex. Oral communication: 1st. World Conference on the Conservation and Sustainable Use of Wild Fungi.
Quélet ML. 1873. Les Champignons du Jura et des Vosges. Réimpression 1964. A. Asher & Co., Amsterdam.
Riva A. 2003. Tricholoma (Fr.) Staude. Fungi Europaei nº 3°, suppl.. Edizioni Candusso, Saronno.
Rohlf, FJ. 2008. NTSYSpc: Numerical Taxonomy System, ver. 2.20. Exeter Publishing, Ltd.: Setauket, NY
Saitou N & Nei M. 1987. The neighbor-joining method: a new method for reconstructing phylogenetic trees. Molecular Biology and Evolution 4: 406–425.
Singer R. 1986. The Agaricales in modern taxonomy. Koeltz, Königstein.
Sokal R R & Rohlf FJ. 1962. The comparison of dendrograms by objective methods. Taxon,11: 33-40.
Thompson JD, Gibson TD, Plewniak FP, Jeanmougin F & Higgins DG. 1997. The CLUSTAL X windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools. Nucleic Acids Res. 25: 4876–4882.
White TJ, Bruns T, Lee S & Taylor JW. 1990. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics: 315-322 In: Innis MA, Gelfand DH, Sninsky JJ, White TJ (Eds). PCR Protocols: A Guide to Methods and Applications. Academic Press, Inc., New York©.