Nutrição do intestino, imunidade intestinal e resistência a parasitas ...
-
Upload
truongtruc -
Category
Documents
-
view
252 -
download
6
Transcript of Nutrição do intestino, imunidade intestinal e resistência a parasitas ...
UNIVERSIDADE TÉCNICA DE LISBOA
Faculdade de Medicina Veterinária
NUTRIÇÃO DO INTESTINO, IMUNIDADE INTESTINAL E
RESISTÊNCIA A PARASITAS DO INTESTINO EM CÃES
NUNO EMANUEL DE OLIVEIRA FIGUEIREDO DA SILVA
CONSTITUIÇÃO DO JÚRI Doutor José Pedro da Costa Cardoso de Lemos Doutora Isabel Maria Soares Pereira da Fonseca Doutor José Augusto Farraia e Silva Meireles
Doutor Aulus Cavalieri Carciofi
ORIENTADOR Doutor Aulus Cavalieri Carciofi
CO-ORIENTADORA Doutora Isabel Maria Soares Pereira da Fonseca
2009
LISBOA
UNIVERSIDADE TÉCNICA DE LISBOA
Faculdade de Medicina Veterinária
NUTRIÇÃO DO INTESTINO, IMUNIDADE INTESTINAL E
RESISTÊNCIA A PARASITAS DO INTESTINO EM CÃES
NUNO EMANUEL DE OLIVEIRA FIGUEIREDO DA SILVA
DISSERTAÇÃO DE MESTRADO INTEGRADO EM MEDICINA VETERINÁRIA
CONSTITUIÇÃO DO JÚRI
Doutor José Pedro da Costa Cardoso de Lemos Doutora Isabel Maria Soares Pereira da Fonseca Doutor José Augusto Farraia e Silva Meireles
Doutor Aulus Cavalieri Carciofi
ORIENTADOR
Doutor Aulus Cavalieri Carciofi
CO-ORIENTADORA Doutora Isabel Maria Soares Pereira da Fonseca
2009
LISBOA
i
Agradecimentos
A Deus e a Jesus por me conceder mais esta oportunidade de estar na Terra.
Aos meus Pais, pela Vida, pela sua formação, pela educação, renúncia, paciência e
testemunhos, essenciais para Ser Médico Veterinário e Ser Humano.
À D. Benilde e à Profª Doutora Maria Lucília Ferreira por terem acreditado em mim.
Aos companheiros e amigos do Centro Espírita Perdão e Caridade em Lisboa por todo o
apoio prestado e por tudo o que aprendo diariamente.
À Dra Gláucia Lima pelos seus conselhos regulares.
À Dra Irvênia Prada, pela Amizade, pela transmissão do profundo respeito pela vida animal,
pela oportunidade para uma experiência humana inesquecível.
Ao meu orientador, Prof Doutor Aulus Carciofi, por toda a aprendizagem em termos
humanos e profissionais, pelo seu bom senso e humildade. Pelas portas abertas na
Faculdade e várias janelas no Brasil. A toda a sua família, que me fez sentir em casa desde
o primeiro dia.
À minha co-orientadora, Profª Doutora Isabel Pereira da Fonseca, pela sua disponibilidade,
sensibilidade, exigência e transmissão de conhecimentos.
À Michele e à Letícia, residentes da Nutrição Clínica, pela ajuda.
A todos os amigos e colegas do Serviço de Nutrição Clínica e do Laboratório de Pesquisa
em Nutrição e Doenças Nutricionais de Cães e Gatos “Prof. Dr. Flávio Prada”, pelo espírito
de equipa e pela companheirismo vivido.
Aos amigos da União Espírita Nosso Lar em Jaboticabal pela oportunidade de trabalho e
aprendizagem numa realidade social tão diferente.
Aos companheiros das residências universitárias pela sua hospitalidade.
Às Profªs Doutoras Mirela Costa e Rosangela Machado, pela oportunidade de realizar os
estágios nas áreas solicitadas, possibilitando a minha melhoria pessoal e profissional.
A toda a equipa do Hospital Veterinário da Faculdade de Ciências Agrárias e Veterinárias
(Jaboticabal/São Paulo), incluindo Médicos Veterinários, Colegas Estagiários, Enfermeiros e
Funcionários, pela aprendizagem proporcionada e por me terem ajudado a constatar que
todos são igualmente importantes. Pelos vários testemunhos de Amor e dedicação aos
animais.
Aos proprietários e aos seus animais, por me reforçarem a convicção de que a Medicina
Veterinária deve ser exercida por vocação e com sensibilidade humana para quem procura
a nossa ajuda profissional e pessoal. Aos Colegas Veterinários pela colaboração no
inquérito realizado.
Aos familiares e amigos, pelo apoio e incentivo demonstrados durante o período de estágio
e execução desta dissertação.
iii
"Que seu remédio seja seu alimento,
e que seu alimento seja seu remédio".
Hipócrates (460 a.C. - 377 a.C.)
v
NUTRIÇÃO DO INTESTINO, IMUNIDADE INTESTINAL
E RESISTÊNCIA A PARASITAS DO INTESTINO EM CÃES
Resumo
A presente dissertação é o resultado do estágio realizado na Faculdade de Ciências
Agrárias e Veterinárias da Universidade Estadual Paulista “Júlio de Mesquita Filho”, Campus
de Jaboticabal, São Paulo, Brasil. É composta por uma descrição resumida das actividades
desenvolvidas durante o estágio, exposição breve da casuística acompanhada, seguida de
uma revisão bibliográfica do tema proposto. Esta revisão incide sobre as funções do
intestino na nutrição do animal e destaca o papel essencial da dieta na nutrição do intestino.
Estuda-se a importância do intestino na imunidade, relacionando os mecanismos de
resistência a parasitas intestinais (endo e extracelulares) em cães. No âmbito do tema escolhido, são referidos os efeitos específicos das deficiências de
nutrientes a nível molecular ou de produção de citoquinas específicas. Há muitas pesquisas
que demonstram que a má nutrição e a infecção ocorrem em conjunto. Não podem ser feitas
generalizações sobre os efeitos de diversos nutrientes sobre os vários componentes da
resposta imune, e a falta de compreensão da base de imunidade funcional contra
nemátodes, torna difícil identificar as deficiências nutricionais que deveriam ser de maior
preocupação. Neste estudo, o foco é centrado no intestino, que é o local da digestão e
absorção de nutrientes e de permanência da maioria dos parasitas. Como complemento do
tema, procede-se ao estudo dos aspectos nutricionais de sete casos clínicos acompanhados
pelo autor com a respectiva discussão. Por fim, salientam-se as conclusões obtidas.
Em Portugal, o autor realizou um inquérito a Médicos Veterinários sobre Nutrição Clínica,
demonstrando-se que é uma área subvalorizada no nosso país. É abordada a importância
de profissionais nesta área e de cursos de Nutrição Clínica para os veterinários. O tecido
linfóide associado ao intestino é o maior componente do sistema imunitário do organismo.
Há uma relação dinâmica entre nutrição, imunidade e doença e esta área interdisciplinar de
investigação necessita de uma maior cooperação entre veterinários, parasitologistas,
nutricionistas, imunologistas, biólogos moleculares e profissionais de saúde pública.
Palavras-chave: intestino, dieta, imunidade, infecção, parasitas, cão
vii
GUT NUTRITION, INTESTINAL IMMUNITY AND RESISTANCE TO INTESTINAL PARASITES OF DOGS
Abstract
This thesis is the result of the training held at the Faculty of Agriculture and Veterinary
Sciences, Universidade Estadual Paulista “Júlio de Mesquita Filho”, Jaboticabal Campus,
São Paulo, Brazil. The description of the activities undertaken during the training, brief
overview of the casuistic, followed by a literature review of the proposed theme are
presented. This review focuses on the functions of the gut in animal nutrition and highlights
the essential role of diet in the nutrition of the intestine. The importance of gut immunity and
the relationship between mechanisms of resistance to intestinal parasites (endo and
extracellular) in dogs are mentioned. As a complement of the subject, a study of nutritional
aspects of seven clinical cases are referred and followed by discussion and conclusions.
Considering the aim of the present work the specific effects of nutrient deficiencies at the
molecular level or production of specific cytokines are highlighted. There are many studies
showing that malnutrition and infection occur together. No generalizations can be made on
the effects of various nutrients on the various components of the immune response. The
knowledge of functional immunity basis against nematode is needed to clear identify
nutritional deficiencies. In this study, the focus is centred in the intestine, an organ were
absorption and digestion of nutrients as well as localization of a large number of parasites do
occur.
In Portugal, the author conducted a questionnaire to Veterinarians about Clinic Nutrition. The
results allowed to conclude that this area is undervalued in our country and it must be taken
into account the need of experts and training courses in clinical nutrition for veterinarians.
The lymphoid tissue associated with the intestine is the major component of the body's
immune system. There is a dynamic relationship between nutrition, immunity and disease,
and this interdisciplinary research requires greater cooperation between veterinarians,
parasitologists, nutritionists, immunologists, molecular biologists and public health
professionals.
Keywords: gut, diet, nutrition, immunity, infection, parasites, dog
ix
ÍNDICE GERAL Pág.
Agradecimentos………………………………………………………………………..……… i
Resumo………………………………………………………………………..……………….. v
Abstract……………………………………….………………………………..………………. vii
Índice de figuras ………………………………………………………………………. …….. xii
Índice de gráficos………………………………………………………………………..……. xii
Índice de tabelas……………………………………………………………………. …….. … xiii
Índice de abreviaturas, símbolos e siglas…………………………………………………... xiv
I. INTRODUÇÃO………………………………………………………………………….…… 1
1. Actividades desenvolvidas durante o estágio………………...………...………………. 1
1.1 Nutrição Clínica de Cães e Gatos………………………………………………………. 1
1.2 Nutrição de Cães e Gatos……………………………………………………………….. 5
1.3 Clínica Médica de Pequenos Animais………………………………………………….. 7
1.4 Técnicas laboratoriais de Imunoparasitologia…………………………………………. 7
II. REVISÃO BIBLIOGRÁFICA - NUTRIÇÃO DO INTESTINO, IMUNIDADE
INTESTINAL E RESISTÊNCIA A PARASITAS DO INTESTINO EM CÃES ……………
9
1. A FUNÇÃO DO INTESTINO NA NUTRIÇÃO DO ANIMAL……………………............ 9
1.1 Fisiologia do tracto gastrointestinal…………………………………………………...... 9
1.1.1 Intestino delgado (ID)…………………………………………………………………... 10
1.1.1.1 Digestão e absorção do alimento…………………………………………………… 12
1.1.1.1.1 Digestão proteica…………………………………………………………………… 13
1.1.1.1.2 Digestão de carbohidratos……………………………………………….....…….. 14
1.1.1.1.3 Digestão de gorduras……………………………………………………………… 14
1.1.1.2 Microbiologia do ID…………………………………………………................ …….. 16
1.1.2 Intestino Grosso …………………………………………………................................ 17
1.1.2.1 Fermentação no IG………………………………………………………………....... 18
1.1.2.2 Microbiologia do IG………………………………………………………………....... 19
2. O PAPEL DA DIETA NA NUTRIÇÃO DO INTESTINO………………………………… 21
2.1 Nutrição trófica e citoprotectora para o intestino………………………………………. 22
2.2 Efeitos do estado nutricional e via de nutrição na mucosa intestinal………..……… 22
2.3 Mecanismos de desenvolvimento intestinal e nutrição no lúmen………. ………….. 23
2.4 Efeitos dos Nutrientes sobre a estrutura e função do tracto gastrointestinal (TGI).. 24
2.4.1 Proteínas e aminoácidos………………………………………………………………. 24
2.4.1.1 Glutamina………………………………………………………………………. ……. 24
2.4.1.2 Glutamato………………………………………………………………………. ……. 25
2.4.1.3 Glutationa………………………………………………………………………. …..... 26
2.4.1.4 Arginina………………………………………………………………………………... 26
x
2.4.1.5 Glicina e Histidina…………………………………………………………………….. 27
2.4.1.6 Efeitos dos derivados dos aminoácidos no epitélio do cólon……………………. 28
2.4.2 Gordura - Ácidos gordos essenciais…………………………………....................... 29
2.4.3 Fibras…………………………………………………………………………………….. 29
2.4.3.1 Ácidos Gordos de Cadeia Curta……………………………………………………. 32
2.4.3.2 Efeitos benéficos da fibra sobre a absorção de minerais………………………... 33
2.4.4 Minerais………………………………………………………………………. ………… 33
2.4.5 Vitaminas………………………………………………………………………. ………. 35
2.4.6 Prebióticos………………………………………………………………………. ……... 36
2.4.7 Probióticos……………………………………………………………………................ 38
2.4.8 Enzimas………………………………………………………………………. ………… 40
2.4.9 Influência de outros nutrientes na composição da microbiota intestinal................ 40
3. A IMPORTÂNCIA DO INTESTINO NA SAÚDE E IMUNIDADE……………….……… 41
3.1 Imunidade associada à mucosa intestinal……………………………………….......... 42
3.2 Microbiota do TGI…………………………………………………………………………. 44
3.3 Nutrição e função imunitária…………………………………………………………….. 45
3.4 Interacção entre nutrição, imunocompetência e doenças……………………………. 46
3.5 Imunomodulação - Regulação Nutricional da Imunidade…………………………….. 48
3.6 Efeito dos Nutrientes em funções e componentes do Sistema Imunitário ………… 49
3.6.1 Proteínas e aminoácidos………………………………………………………………. 49
3.6.1.1 Glutamina………………………………………………………………………. ……. 49
3.6.1.2 Arginina………………………………………………………………………. ……….
3.6.1.3 Poliaminas…………………………………………………………………. …………
50
50
3.6.2 Ácidos Gordos Poliinsaturados (AGPI)………………………………………………. 51
3.6.2.1 AGPI omega-6………………………………………………………………………… 52
3.6.2.2 AGPI omega-3………………………………………………………………………… 52
3.6.3 Carbohidratos…………………………………………………………………………… 53
3.6.4 Nucleótidos………………………………………………………………………. …….. 54
3.6.5 Nutrientes antioxidantes……………………………………………………………….. 54
3.6.5.1 Vitamina E e selénio…………………………………………………………………. 54
3.6.5.2 Carotenóides………………………………………………………………………….. 55
3.6.6 Vitaminas………………………………………………………………………. ………. 55
3.6.7 Minerais………………………………………………………………………. ………… 56
3.6.8 Prebióticos………………………………………………………………………. ……... 57
3.6.9 Probióticos………………………………………………………………………. ……... 59
3.7 Tolerância Oral……………………………………………………………………………. 61
3.7.1 Resposta imunitária aos antigénios da dieta………………………………………… 61
3.8 Efeito da via do alimento no lúmen intestinal………………………………………….. 63
xi
3.9 Neuroimunomodulação pela Nutrição………………………………………………….. 64
4. MECANISMOS DE RESISTÊNCIA A PARASITAS DO INTESTINO EM CÃES……. 64
4.1 Parasitas gastrointestinais (GI), nutrição e imunidade……………………………….. 64
4.2 Nemátodes gastrointestinais e má nutrição…………………………………………… 65
4.3 Deficiências de nutrientes promovem a sobrevivência de nemátodes GI…………. 65
4.3.1 Deficiências de macronutrientes……………………………………………………… 65
4.3.2 Deficiências de micronutrientes……………………………………………………….. 66
4.3.2.1 Zinco………………………………………………………………………. …………. 66
4.3.2.2 Vitamina A………………………………………………………………………. …… 66
4.3.2.3 Ferro………………………………………………………………………. …………. 67
4.4 Mecanismos imunológicos subjacentes à interacção nutrição – infecção…………. 67
4.4.1 Imunidade aos nemátodes GI………………………………………………………… 67
4.4.2 Importância da imunidade intestinal em infecções por nemátodes………………. 68
4.4.3 Imunidade contra as infecções por protozoários e helmintes gastrointestinais…. 70
4.4.3.1 Imunidade Inata………………………………………………………………………. 71
4.4.3.2 Imunidade Adquirida…………………………………………………………………. 72
4.4.3.2.1 Imunidade Humoral………………………………………………………………… 73
4.4.3.2.1.1 Resposta imune da mucosa às infecções parasitárias……………………… 74
4.4.3.2.1.2 Processos envolvidos na expulsão de nemátodes intestinais……………… 74
4.4.3.2.1.3 Eosinófilos e destruição de Parasitas…………………………………………. 76
4.4.3.2.2 Imunidade mediada por células………………………………………………….. 76
4.5 Mecanismos de evasão da resposta imune…………………………………………… 78
4.6 Consequências imunopatológicas das infecções parasitárias………………………. 80
4.7 Nutrição, infecção e imunidade – um paradigma co-evolutivo………………………. 80
4.8 Intervenções nutricionais………………………………………………………………… 83
4.9 Antihelmínticos……………………………………………………………………………. 84
4.10 Reforço da imunocompetência………………………………………………………… 84
4.10.1 Vacinação……………………………………………………………………………… 84
4.11 Sorodiagnóstico…………………………………………………………………………. 85
4.12 Modulação neuroimunoendócrina no hospedeiro pelos helmintes………………… 85
III. CASOS CLINICOS E INQUÉRITO……………………………………………………… 1. CASOS CLÍNICOS OBSERVADOS NA FCAV (BRASIL)…………………………….
87
87
1.1. Caso 1 - Gastroenterite aguda associado a Giardiose ou Isosporose…………….. 87
1.2. Caso 2 - Gastroenterite parasitária - Ancilostomose………………………………… 88
1.3. Caso 3 - Gastroenterite crónica……………………………………………………….. 91
1.4. Caso 4 - Hipersensibilidade alimentar………………………………………………… 94
1.5. Caso 5 - Enterite crónica - Doença Inflamatória Intestinal………………………….. 97
1.6. Caso 6 - Gastroenterite aguda e Diabetes mellitus…………………………………... 99
xii
1.7. Caso 7- Obstrução intestinal por corpo estranho…………………………………….. 102
1.8. DISCUSSÃO DOS ASPECTOS NUTRICIONAIS DOS CASOS CLÍNICOS………
2. INQUÉRITO REALIZADO EM PORTUGAL A MÉDICOS VETERINÁRIOS SOBRE NUTRIÇÃO CLÍNICA……………………………………………………………….
2.1 Materiais e métodos ………………………………………………………………………
2.2 Resultados…………………………………………………………………………………
105
117
117
117
2.3 Discussão dos resultados do inquérito…………………………………………………. 120
IV. CONCLUSÕES GERAIS…………………………………………………………………. 121
V. BIBLIOGRAFIA……………………………………………………………………… …… 124
VI. ANEXOS…………………………………………………………………………………… 135
1. Inquérito realizado em Portugal a Médicos Veterinários sobre Nutrição Clínica
(Questionário)………………………………………………………………………………….
135
2. Actividades complementares durante o período de estágio curricular na FCAV…… 138
3. Apresentação realizada pelo autor de seminário “Imunonutrição e Intestino” na
FCAV……………………………………………………………………………………………
140
4. Apresentação e discussão realizada pelo autor de Caso Clínico em Clínica Médica
na FCAV………………………………………………………………………………………...
146
5. Sistema de avaliação de Escore de Condição Corporal (ECC) em cães……………. 152
6. Escore Fecal…… ………………………………………………………………………….. 153
7. Escore de Doença…………………………………………………………………………. 153
8. Protocolo para Nutrição Parenteral Parcial (NPP) …………………………………….. 154
xiii
Índice de gráficos Pág. Gráfico 1 - Percentagem de casos atendidos distribuídos conforme a espécie, no
período de 2 de Dezembro de 2008 a 13 de Março de 2009…………………………………
3
Gráfico 2 – Atendimentos nutricionais realizados pelo Serviço de Nutrição Clínica de
Cães e Gatos do Hospital Veterinário “Governador Laudo Natel”, durante o período de
2/12/2008 a 13/03/2009, separados por mês …………………………………………………
3
Gráfico 3 – Alimentos formulados e prescritos e alimentações realizadas pelo Serviço de
Nutrição Clínica de Cães e Gatos do Hospital Veterinário “Governador Laudo Natel”,
durante o período de 2/12/2008 a 13/03/2009………………………………………………..
4
Gráfico 4 – Vias de administração empregadas na alimentação de cães e gatos
atendidos pelo Serviço de Nutrição Clínica de Cães e Gatos do Hospital Veterinário
“Governador Laudo Natel”, durante o período de 2/12/2008 a 13/03/2009………………..
4
Gráfico 5 – Distribuição da casuística do Serviço de Nutrição Clínica de Cães e Gatos,
dividida pelos sistemas de órgãos afectados (valores das respectivas frequências
relativas em percentagem) no período de 2/12/2008 a 13/03/2009…………………………
5
Gráfico 6 – Distribuição de resultados do inquérito relativos ao facto de a nutrição
integrar ou não a rotina médica diária, como parte do tratamento médico no local em
que os veterinários exercem ……………………………………………..……………………..
117
Gráfico 7 - Distribuição de resultados do inquérito relativos à questão de os Hospitais
ou Clínicas Veterinárias em que os veterinários exercem, terem ou não um critério
rigoroso para o controlo do consumo de alimentos dos animais internados……………….
117
Gráfico 8 - Distribuição das respostas dos veterinários quando questionados sobre o
procedimento nutricional adoptado quando o animal não come …………………………….
118
Gráfico 9 - Distribuição de resultados do inquérito relativos à opinião dos veterinários
sobre o que fazer quanto à nutrição de animais hospitalizados……………………………...
118
Gráfico 10 - Distribuição das respostas dos veterinários quando questionados sobre a
sua atitude na assistência nutricional ao paciente hospitalizado…………………………….
118
Gráfico 11 - Distribuição de resultados do inquérito relativos à opinião dos veterinários
sobre o estado nutricional calórico em que se encontram a maioria dos animais
internados no local onde exercem………………….. …………………..………………………
118
Gráfico 12 - Distribuição (frequência relativa) das respostas dos veterinários quando
questionados se conheciam os diferentes métodos de suporte nutricional enteral
utilizados nas doenças gastrointestinais…………………..…………………..………………..
119
Gráfico 13 - Distribuição (frequência absoluta) dos resultados do inquérito relativos ao
número de veterinários que nunca utilizaram estes tipos de vias de administração
empregues na alimentação de cães e gatos…………………..……………………………….
119
xiv
Índice de figuras Pág. Figura 1 - Entrada do Hospital Veterinário “Governador Laudo Natel” da FCAV………….
Figura 2 - Logotipo do Laboratório de Pesquisa de Nutrição de Cães e Gatos…………..
1
5
Figura 3 - Vista dos fundos do canil, do solário dos cães e “playground” relvado onde
são soltos diariamente para prática voluntária de exercícios. ………………………………
6
Figura 4 - Vista da área de sociabilização do gatos, onde estes permanecem soltos
quando não estão em experimento………………………….…………………………………
6
Figura 5 - Imagem de imunofluorescência indirecta positiva para anticorpos anti-Babesia
canis (A) e anti-Ehrlichia canis (B) no Laboratório de Imunoparasitologia da
FCAV……………………………………………………………………………………………….
7
Figura 6 - Inter-relação entre desnutrição, imunidade e infecção…………………… …….. 47
Figura 7 - Expulsão de nemátodes do intestino………………………………………………. 75
Figura 8 - A) Vista lateral da Pantera apresentando ECC 1;
B) Vista dorsal do animal , com ECC 1………..……………………………………..
99
Figura 9 - Solução preparada de Nutrição Parenteral Parcial …………………………….. 103
Figura 10 - Suporte de Nutrição Parenteral Parcial com a solução revestida de papel de
alumínio para protecção das vitaminas do complexo B………………………………………
103
Índice de tabelas
Tabela 1 - Dieta de manutenção para cães adultos ( caso clínico 1)…………………… 88
Tabela 2 - Dietas para cães em crescimento (caso clínico 2)……………………………. 89
Tabela 3 - Resultados dos exames hematológico, de bioquímicas séricas e
coproparasitológico (caso clínico 2)…………………………………………………………
91
Tabela 4 - Dieta de Eliminação Fase I (caso clínico 4)…………………………………..
Tabela 5 - Fase II da dieta de eliminação (caso clínico 4)………………………………..
95
96
Tabela 6 - Resultados do hemograma (caso clínico 6)……………………………………
Tabela 7 - Resultados do hemograma e de bioquímicas séricas (caso clínico 6)……..
100
102
Tabela 8 - Resultados do hemograma (caso clínico 6)…………………………………... 102
Tabela 9 - Dieta para cães hipermetabólicos e/ou com perda proteica extra (caso
clínico 7)………………………………………………………………………………………...
104
xv
Índice de abreviaturas, símbolos e siglas % - Percentagem < - Menor > - Maior ≈ - Aproximadamente ® - Marca Registrada AA - Ácido Araquidónico Ac - Anticorpo ADCC - Citotoxicidade Dependente de Anticorpo ADN - Ácido Desoxirribonucleico AG - Ácidos Gordos Ag - Antigénio AGCC - Ácidos Gordos de Cadeia Curta AGPI - Ácidos Gordos Poliinsaturados ALA - Ácido α-Linolénico ALT - Alanina Aminotransferase ANR - Até Novas Recomendações APC - Células Apresentadoras de Antigénios ARN - Ácido Ribonucleico ASP-2 - Proteínas secretadas por Ancylostoma AST - Aspartato Aminotransferase BID - A cada doze horas BSO - Butionina Sulfoximina CMH - Complexo Maior de Histocompatibilidade COX-2 - Ciclooxigenase-2 DHA - Ácido Docosahexaenóico DII - Doença Inflamatória Intestinal dL - Decilitro DTH - Hipersensibilidade Dérmica Tardia ECC - Escore de Condição Corporal EGF - Factor de Crescimento Epidérmico ELISA - Enzyme-Linked Immunosorbant Assay EPA - Ácido Eicosapentaenóico ESP - Produtos de Excreção/Secreção EV - Endovenosa FA - Fosfatase Alcalina FAP - Factor Activador Plaquetário FOS - Frutoligossacáridos g - Grama GH - Hormona do Crescimento GI - Gastrointestinal Gln - Glutamina GLP - Glucagon-like peptide GM-CSF - Granulocyte macrophage colony-stimulating factor GOS - Glicoligossacáridos GP - Glutationa-peroxidase GSH – Glutationa ICAM - Moléculas de Adesão Celular Inflamatórias ID - Intestino Delgado IEC - Células Intraepiteliais IEL - Linfócitos Intraepiteliais IF - Factor Intrínseco IFI - Imunofluorescência Indirecta IFN - Interferão Ig - Imunoglobulina IG - Intestino Grosso
xvi
IGF-I - Factor de Crescimento I associado à Insulina IL - Interleucina IM - Intramuscular IRM - Modificadores da Resposta Imune IV - Intravenosa Kcal - Quilocaloria Kg – Quilograma L – Litro LA - Ácido Linoleico LPL - Leucócitos da Lâmina Própria LPS - Lipopolissacáridos m2 – Metro quadrado mEq - Miliequivalente mg - Miligrama mL - Mililitro MOS - Mananoligossacáridos MVM - Membrana de Microvilosidades NADPH - Fosfato de dinucleótido de nicotinamida e adenina NE - Nutrição Enteral NF-kB - Factor Nuclear de transcrição-kB NK - Natural Killer NO - Óxido Nítrico NP - Nutrição Parenteral NRC - National Research Council ºC - Graus Celsius PCL - Parede Celular de Leveduras PCR - Polymerase Chain Reaction ou reacção em cadeia pela polimerase PGE - Prostaglandina PMAP - Padrões Moleculares Associados a Patogénios ROI - Intermediários Reactivos do Oxigénio RRP - Receptores de Reconhecimento de Padrões Rx - Radiografia SC - Subcutânea SDS PAGE - sodium dodecyl sulfate polyacrylamide gel electrophoresis SI - Sistema Imunitário SIBO - Sobrecrescimento Bacteriano no Intestino Delgado SID - A cada vinte e quatro horas SIRS - Síndrome da Resposta Inflamatória Sistémica TCM - Triglicéridos de Cadeia Média TGF - Factor de Crescimento Transformador TGI - Tracto Gastrointestinal Th - T helper TID - A cada oito horas TLAI - Tecido Linfóide Associado ao Intestino TLR - Receptores toll-like TNF - Factor de Necrose Tumoral TRC - Tempo de Repleção Capilar TSLP - Linfopoietina RNAm do Estroma do Timo UFC - Unidades Formadores de Colónias UI - Unidade Internacional US - Ultrasonografia VO - Via Oral α - alfa β - beta λ - gama ω - ómega
1
I. INTRODUÇÃO
O estágio de final de curso que deu origem a esta dissertação de mestrado foi realizado na
Faculdade de Ciências Agrárias e Veterinárias da Universidade Estadual Paulista (UNESP)
“Júlio de Mesquita Filho”, campus de Jaboticabal, São Paulo, Brasil. O local escolhido teve
em conta o facto do orientador Prof. Dr Aulus Carciofi ser uma referência a nível nacional e
internacional na área de Nutrição de Cães e Gatos. Foi possível acompanhar uma casuística
variada no Hospital Veterinário “Governador Laudo Natel” da FCAV, a partir da qual foram
analisados sete casos clínicos de doenças gastrointestinais frequentes com ênfase nos
procedimentos nutricionais adoptados. A discussão destes casos constitui um complemento
ao estudo bibliográfico.
1. Actividades desenvolvidas durante o estágio
A componente prática do estágio curricular foi desenvolvida na Faculdade de Ciências
Agrárias e Veterinárias (FCAV) e decorreu no período de 2 de Dezembro de 2008 a 19 de
Maio de 2009, com uma carga horária total de 724 horas. O estágio decorreu em 4 áreas
científicas: Nutrição Clínica de Cães e Gatos, Nutrição de Cães e Gatos, Clínica Médica de
Pequenos Animais e Técnicas Laboratoriais de Imunoparasitologia.
O estágio em Nutrição e Nutrição Clínica de Cães e Gatos decorreu sob orientação do Prof.
Dr Aulus Cavalieri Carciofi, entre 2/12/2008 a 13/03/2009, num total de 505 horas. O estágio
teve duas sub-áreas: na primeira, o estagiário dedicou-se à nutrição clínica de cães e gatos,
realizada no Serviço de Nutrição Clínica do Hospital Veterinário “Governador Laudo Natel”
da FCAV (Figura 1).
1.1 Nutrição Clínica de Cães e Gatos
A Nutrição Clínica de cães e gatos é uma área pouco difundida pela maioria das Faculdades
de Medicina Veterinária no Brasil. Esta realidade atrai estudantes de várias regiões, que
buscam conhecimento nessa área, e vêm para a FCAV estagiar no Serviço de Nutrição
Clínica de Cães e Gatos. Os Médicos Veterinários Residentes auxiliam na recepção e
Figura 1 - Entrada do Hospital Veterinário
“Governador Laudo Natel” da FCAV A segunda, em nutrição de cães e gatos,
desenvolveu-se no Laboratório de Pesquisa em
Nutrição e Doenças Nutricionais de Cães e Gatos
“Prof. Dr. Flávio Prada” do Departamento de
Clínica e Cirurgia Veterinária e no Laboratório de
Nutrição Animal do Departamento de Zootecnia.
As duas sub-áreas decorreram em simultâneo de
acordo com a programação das pessoas
disponíveis, tendo-se realizado diversas
actividades complementares (Anexo 2).
2
acompanhamento dos estagiários, colaborando para o bom andamento do serviço e
cumprimento de suas regras e orientações, de forma a adequar a actuação dos estagiários
quanto à postura durante as consultas e execução das suas atividades. Os estagiários
acompanham e participam da rotina dos residentes, os quais procuram passar os
conhecimentos adquiridos. Também são realizadas reuniões semanais para apresentação
de seminários pelos estagiários, com discussão de casos clínicos ou temas relacionados à
área, com participação activa dos aprimorandos e estagiários. O autor apresentou um
seminário com o tema “Imunonutrição e Intestino” (Anexo 3).
As actividades desenvolvidas pelo Serviço de Nutrição Clínica de Cães e Gatos incluem o
atendimento ambulatorial complementar nas áreas de Clínica Médica e Clínica Cirúrgica de
Pequenos Animais e Obstetrícia, com orientações nutricionais para animais em diferentes
situações, alimentação de animais internados, participação em projectos de pesquisa,
formulação e prescrição de dietas caseiras e acompanhamento dos estagiários do Serviço.
Grande parte dos animais que chegam ao Hospital para consultas de afecções diversas,
passa pelo Serviço de Nutrição Clínica de Cães e Gatos para tratamento nutricional
adjuvante ou simplesmente para esclarecimento em relação ao tipo e quantidade de dieta a
ser fornecida.
Nestas consultas, o principal é esclarecer os proprietários de cães e gatos sobre o melhor
alimento a ser oferecido. Durante a rotina clínica, nota-se um elevado grau de
desconhecimento em relação aos vários tipos de dietas comerciais e dietas caseiras. Os
principais erros relacionam-se com o facto de muitos proprietários acreditarem que o
alimento caseiro é mais saudável, sem necessidade de balanceá-lo, que é mais barato,
variado e palatável. Muitos também suplementam alimentos industrializados, levando a
doenças por excesso. Grande percentagem dos proprietários dão petiscos ou dieta caseira
juntamente com a ração, levando à obesidade, ou, ainda, não usam o alimento correcto para
cada fase de vida ou espécie. No atendimento, os aprimorandos (residentes) e estagiários
dialogam com os proprietários informando sobre os tipos de dietas (comercial/caseira),
vantagens e segurança do emprego de dietas comerciais de boa qualidade, instruindo sobre
maneio alimentar e quantidade a ser fornecida, entre outras instruções. Realiza-se, também,
a prescrição de dieta caseira balanceada quando necessário. A consulta nutricional inclui
minuciosa anamnese com enfoque nutricional, avaliação da condição corporal e outros
sinais que possam indicar desnutrição crónica como qualidade da pele e dos pêlos,
condição muscular, etc., bem como a solicitação de exames complementares quando
necessários.
Em pacientes com doenças específicas, o maneio alimentar e medicamentoso é sempre
discutido em conjunto com os aprimorandos responsáveis pelo animal, das áreas de Clínica,
Cirurgia ou Obstetrícia e pelos responsáveis pelos Serviços de Cardiologia, Nefrologia,
Oncologia, Odontologia e Oftalmologia. Assim, cães e gatos com problemas de
3
85,76%
14,24%
Canina Felina
51
19
75
19
75
21 165
217
64
0
50
100
150
200
250
Dezem bro
Jane
iroFe
verei
ro
Março
Total
Casos NovosRetornos
Mês de estágio
N.º
de
anim
ais
aten
dido
s
desenvolvimento ósseo, cardiopatias, hepatopatias, nefropatias, dermatopatias, doenças
gastroentéricas, caquexia, anorexia, pacientes oncológicos, com doenças endócrinas e
metabólicas recebem adequado suporte alimentar, com a aplicação de protocolos
nutricionais adequados a cada condição específica. Destaca-se, ainda, o estabelecimento
do programa de tratamento da Obesidade, que é actualmente a doença nutricional mais
frequente em cães e gatos. Neste âmbito, depois do animal ser atendido pelas outras
especialidades do Hospital, ele é avaliado pelo Serviço de Nutrição Clínica e escolhe-se a
alimentação de acordo com o quadro clínico, exames laboratoriais e apetite, seleccionando
o alimento e a via de administração mais apropriados para cada caso. Além de uma sala de
Nutrição, o Serviço tem uma copa para a preparação da dieta dos animais internados e de
dietas especificas que são entregues aos proprietários, sendo também utilizada para o
preparação de nutrição parenteral.
Durante o período de 2 de Dezembro de 2008 a 13 de Março de 2009, foram realizadas 281
consultas em cães e gatos (Gráfico 1). No Gráfico 2 encontram-se descritos os números de
atendimentos nutricionais realizados, separados por mês. No Gráfico 3 são apresentados os
tipos de dietas recomendadas e no Gráfico 4, as vias de administração do alimento
empregues nos pacientes atendidos. Por fim, no Gráfico 5 apresentam-se as afecções
diagnosticadas, nos animais que receberam suporte nutricional, separadas por sistema ou
orgão afectado.
Gráfico 1 - Percentagem de
casos atendidos distribuídos
conforme a espécie, no
período de 2 de Dezembro de
2008 a 13 de Março de 2009.
Gráfico 2 - Atendimentos nutricionais realizados pelo Serviço de
Nutrição Clínica de Cães e Gatos do Hospital Veterinário
“Governador Laudo Natel”, durante o período de 2/12/2008 a
13/03/2009, separados por mês.
4
11
0
6
40
34
3
32
155
0 20 40 60 80 100 120 140 160
Nutrição Parenteral
Sucedâneo lácteo
Dieta Enteral
Dietas Caseiras
Rações Terapêuticas
Ração Económica
Ração Premium
Ração Super Premium
Número total
11
0
7
7
5
251
0 50 100 150 200 250 300
Nutrição Parental
Sonda Gástrica
Sonda Esofágica
Sonda Nasoesofágica
Ingestão Forçada
Ingestão Voluntária
Nutrição Parenteral
Número total
Gráfico 3 - Alimentos formulados e prescritos e alimentações realizadas pelo Serviço de
Nutrição Clínica de Cães e Gatos do Hospital Veterinário “Governador Laudo Natel”, durante
o período de 2/12/2008 a 13/03/2009
Gráfico 4 - Vias de administração empregues na alimentação de cães e gatos atendidos
pelo Serviço de Nutrição Clínica de Cães e Gatos do Hospital Veterinário “Governador
Laudo Natel”, durante o período de 2/12/2008 a 13/03/2009
5
19%
8%
2%
12%
9%3%3%2%10%
14%
2%
3% 7% 1% 4%
)
Gráfico 5 - Distribuição da casuística do Serviço de Nutrição Clínica de Cães e Gatos,
dividida pelos sistemas de órgãos afectados (valores das respectivas frequências relativas
em percentagem), no período de 2/12/2008 a 13/03/2009
1.2 Nutrição de Cães e Gatos
Esta área desenvolveu-se no Laboratório de Pesquisa em Nutrição e Doenças Nutricionais
de Cães e Gatos “Prof. Dr. Flávio Prada” (Figura 2) e no Laboratório de Nutrição Animal do
Departamento de Zootecnia. Diferencia-se do Serviço de Nutrição Clínica uma vez que se
realizam actividades específicas de Nutrição Básica.
Participou-se num projecto que de certa forma se relaciona com a tema desta dissertação,
intitulado “Avaliação da suplementação de β-1,3/1,6-glucano e mananoligossacarídeos
Os estagiários acompanham a realização de
experimentos, participando do trabalho que incluiu:
maneio e preparação dos animais, oferta e recolha
do alimento, colecta de fezes e urina, análises
laboratoriais, procedimento de cálculos e
interpretação dos resultados. É possível assim,
conhecer e aprender, na prática, esta importante
etapa na avaliação dos alimentos.
Colaborou-se num estudo sobre a “Influência do
consumo de bebida palatabilizada sobre a ingestão
hídrica e parâmetros urinários em gatos”.
Figura 2 – Logotipo do Laboratório de
Pesquisa de Nutrição de Cães e Gatos
6
sobre a resposta imune de cães adultos.”, auxiliando em testes de hipersensibilidade
dérmica tardia (DTH), em técnicas imunohistoquímicas e de citometria de fluxo.
No laboratório existem actividades escalonadas de sociabilização com cães e gatos
demonstrando preocupação com o bem estar animal (Figuras 3 e 4).
1.3 Clínica Médica de Pequenos Animais
O estágio curricular foi também desenvolvido na área de Clínica Médica de Pequenos
Animais, Hospital Veterinário da FCAV, sob a orientação da Profª Doutora Mirela Tinucci
Costa, do Departamento de Clínica e Cirurgia Veterinária, durante o período de 23/03/2009
a 15/04/2009, perfazendo um total de 150 horas.
Desenvolveram-se as seguintes actividades: acompanhamento dos residentes do sector,
anamnese e exame físico dos pacientes, colheita de materiais necessários para realização
de exames complementares no laboratório de Patologia Clínica, solicitação de
medicamentos e utensílios na Farmácia, encaminhamento do animal ao serviço de
diagnóstico por imagem (Radiologia e Ultrasonografia), preenchimento das prescrições
previamente orientadas pelo residente responsável, preparação e administração de
fármacos aos animais atendidos e/ou internados. Também era função do estagiário
acompanhar os pacientes que estivessem em fluidoterapia durante o horário de almoço.
Eram discutidos com o médico veterinário assistente, os diagnósticos diferenciais, os
exames complementares de diagnóstico e a terapêutica a instituir. Assistiu-se também a
consultas nos Serviços de Cardiologia e de Nefrologia/Urologia. O Hospital tem canis de
internamento e de alojamento de animais em experimento, sala de fluidoterapia e sala de
enfermagem (que possui gaiolas fechadas para oxigenioterapia).
Figura 3 - Vista dos fundos do canil, do solário dos
cães e “playground” relvado onde são soltos
diariamente para prática voluntária de exercícios.
Figura 4 - Vista da área de
sociabilização dos gatos, onde estes
permanecem soltos quando não estão
em experimento.
7
De acordo com a área de interesse desta dissertação, estivemos mais focalizados em casos
do foro entérico em que a Nutrição Clínica também interveio com os respectivos
procedimentos nutricionais. Foram os casos de: gastroenterites agudas e crónicas; gastrite
medicamentosa; doença inflamatória intestinal (DII); inflamação intestinal neoplásica;
linfoma intestinal; hipersensibilidade alimentar; atopia; dermatite nutricional; piodermite
nutricional secundária; demodicose; giardiose; erliquiose; hepatozoonose; neosporose e
hemoparasitose; lipidose hepática e pancreatite. Semanalmente, houve a apresentação de
temas e casos clínicos pelos estagiários do Hospital. O autor apresentou a discussão de um
caso clínico de enterite linfoplasmocítica associada a sobrecrescimento bacteriano e
hipersensibilidade alimentar (Anexo 4).
1.4 Técnicas laboratoriais de Imunoparasitologia O Estágio de treino em técnicas de Imunohistoquímica e diagnóstico sorológico ocorreu no
Laboratório de Imunoparasitologia sob a orientação da Profª. Doutora Rosangela Zacarias
Machado do Departamento de Patologia Veterinária da FCAV, de 11/05/09 a 19/05/09, num
total de 54 horas. Com o objectivo de aprender e obter experiência, solicitou-se este estágio
para acompanhar diversas técnicas laboratoriais com os mestrandos e doutorandos que
trabalham neste departamento. O Laboratório de Imunoparasitologia da FCAV está
sobretudo especializado no Diagnóstico de Hemoparasitoses. Seguindo os respectivos
protocolos experimentais, colaborou-se em testes serológicos e métodos
imunohistoquímicos.
Para além dos esfregaços sanguíneos corados com a técnica de coloração de Giemsa,
utilizaram-se técnicas mais sensíveis e específicas utilizadas para a pesquisa de
hemoparasitas, como o Ensaio Imunoadsorvente associado às enzimas (ELISA) e a
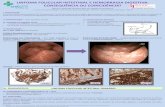
Imunofluorescência Indirecta (IFI). Utilizou-se a reacção de IFI para detecção de anticorpos
de Babesia canis, Ehrlichia canis, Leishmania chagasi e Toxoplasma gondii. Observou-se
reacção de IFI positiva para anticorpos anti-Babesia canis (figura 5A) e anti-Ehrlichia canis
(figura 5B).
Figura 5. Imagem de imunofluorescência indirecta positiva para anticorpos anti-Babesia
canis (A) e anti-Ehrlichia canis (B) no Laboratório de Imunoparasitologia da FCAV
A B
(ampliação x 750 aprox.) (ampliação x 133 aprox.)
8
Usou-se o método de ELISA para detecção de Anticorpo IgG anti-Leishmania chagasi e a
técnica de Dot-Blot – ELISA para Toxoplasma gondii. A técnica de Dot-ELISA é utilizada
como um rastreador para saber se o antigénio funciona. É um teste de triagem qualitativo,
para avaliar a reactividade do complexo Ag-Ac. Para determinar a concentração de
antigénios de Toxoplasma gondii e Leishmania chagasi utilizou-se um padrão de dosagem
da proteína com soroalbumina bovina. O produto colorimétrico formado pode ser visualizado
com um espectrofotómetro. Fez-se ELISA para Trypanosoma evansi e ELISA de
Competição para Anaplasma marginale. Realizou-se Electroforese e Western Blotting com
antigénio de Anaplasma marginale e soro bovino.
A reacção em cadeia pela polimerase (PCR) é uma técnica de biologia molecular que foi
utilizada para a pesquisa de parasitas hemáticos. Realizou-se a extracção de ADN seguida
de PCR. O diagnóstico por PCR tornou possível a detecção molecular de Ehrlichia canis e
Babesia canis. As leituras de produtos da PCR fizeram-se por Electroforese em Gel de
Agarose para ADN ou em Gel de Poliacrilamida (SDS Page). Foram realizadas análises por
PCR para as seguintes espécies: Babesia sp., Anaplasma phagocytophilum, Ehrlichia chaf-
feensis, Hepatozoon sp., Neospora caninum, Trypanosoma cruzi, T.evansi. e T. vivax.
Recorreu-se à tecnica de Nested PCR para Anaplasma marginale e para Ehrlichia canis. Na
PCR do tipo “nested”, o molde é o fragmento inicial produto da PCR. A análise de dados foi
realizada com base em métodos de estatística descritiva utilizando o programa Microsoft®
Excel.
9
II. REVISÃO BIBLIOGRÁFICA - NUTRIÇÃO DO INTESTINO, IMUNIDADE INTESTINAL E
RESISTÊNCIA A PARASITAS DO INTESTINO EM CÃES
1. A FUNÇÃO DO INTESTINO NA NUTRIÇÃO DO ANIMAL
O corpo necessita de uma nutrição completa e equilibrada, definida como a que fornece
todos os nutrientes essenciais, e em quantidades adequadas, de forma proporcional entre
eles. Como órgão digestivo, o tracto gastrointestinal (TGI) tem um papel fundamental na
extracção desses nutrientes dos alimentos e na sua libertação no corpo numa forma
utilizável. Na sua capacidade de garantir a absorção dos nutrientes de que o corpo
necessita, o TGI tem um papel regulador e protector. O TGI tem uma grande adaptabilidade
para regular a digestão e a absorção de nutrientes, por estímulo ou inibição, quando estes
se encontram em falta ou em excesso (Case, Carey & Hirakawa, 2000).
Esta função do TGI é uma importante parte da capacidade homeostática do organismo, de
forma a manter o meio ambiente interno constante. Alguns exemplos gerais de adaptação
são: o aumento ou diminuição na produção de enzimas digestivas, alterações na área
superficial de absorção por meio do alongamento das microvilosidades intestinais,
alterações na microbiota gastrointestinal (GI) e alterações hormonais na capacidade de
absorção do cálcio. Tendo em conta as diversas funções do TGI, não surpreende que o
sistema digestivo contenha alguns dos tecidos mais metabolicamente activos do corpo. O
estômago, os intestinos, o pâncreas e o baço juntos representam menos de 6% do peso
corporal, mas representam cerca de 20% do gasto total de energia do corpo e 50% do
turnover das proteínas de todo o corpo (Laflamme, 2008).
1.1 Fisiologia do tracto gastrointestinal
Além do TGI, que inclui o estômago, o intestino delgado (ID) e o intestino grosso (IG), o
sistema digestivo também é composto pelo tracto alimentar superior (boca, dentes e
esófago superior), o fígado com a vesícula biliar, e o pâncreas.
Os principais factores que influenciam o esvaziamento gástrico (que no cão varia de 72 a
240 minutos) são: volume estomacal, conteúdo energético da dieta, viscosidade do
alimento, temperatura, conteúdo duodenal de ácidos gordos e monossacáridos, tamanho
das partículas do alimento, peso corporal, conteúdo ácido do duodeno, ingestão de água,
tamanho da refeição e tipo de dieta (húmida ou seca). O tracto digestivo dos carnívoros tem
um trânsito intestinal rápido, com pequeno tempo de permanência do alimento. O tempo de
trânsito no ID é influenciado por aspectos físicos (hormonas, sistema nervoso) e nutricionais
da dieta (características do alimento). Os cães têm um tempo de trânsito de 60 a 70 minutos
e um tempo de esvaziamento deste órgão de 180 a 300 minutos. Acredita-se que em 5
horas e meia, 50% do alimento tenha completado o trânsito oro-ileal nos cães (Carciofi,
2008a).
10
A digestão é uma série de eventos, mecânicos, químicos e microbiológicos que visam a
degradação de compostos alimentares. Os processos mecânicos incluem a mastigação e os
movimentos peristálticos e têm como objectivo a redução do tamanho de partículas. A
degradação química é realizada com fluidos ricos em enzimas do estômago, pâncreas e ID.
A digestão enzimática visa a produção de monómeros que são absorvidos juntamente com
a água, vitaminas e minerais libertados dos alimentos. Os microrganismos do IG produzem
enzimas que fazem a digestão química.
1.1.1 Intestino delgado
O intestino delgado é o principal local da digestão final e da absorção de nutrientes e é
essencial para a absorção de fluidos e electrólitos. O comprimento total do ID de um cão
varia entre 1,8 a 4,8 metros. De forma geral, o comprimento do TGI é considerado 5 vezes
maior do que o comprimento corporal em cães. Em comparação com outras espécies
animais, os cães apresentam um tracto intestinal relativamente curto.
O ID está dividido em três partes: duodeno, jejuno e íleo. O jejuno ocupa a maior parte do
comprimento do ID. Todas as partes do ID têm a sua função na digestão, mas as
contribuições específicas da parte proximal (a primeira parte) e da distal (a parte mais
distante) são diferentes. Dentro do intestino, a superfície mucosa cria diversas criptas que
aumentam a área de superficie. Sobre estas criptas existem vilosidades, que se encontram
cobertas por células epiteliais da mucosa. Na extremidade destas células há
microvilosidades, invaginações da superfície celular, que aumentam ainda mais a área
superficial dos intestinos. A altura das vilosidades e criptas mucosas é maior no duodeno e
jejuno proximal, onde ocorre a absorção activa, e menor no íleo. A área total de superfície
para digestão e absorção é 400 a 600 vezes maior do que um tubo simples de tal forma que
o ID canino com 4 metros de comprimento tem uma área superficial de 100m2. Esta área
superficial aumentada eleva significativamente a capacidade digestiva e absorvente dos
intestinos (Laflamme, 2008).
As células epiteliais que revestem as vilosidades e as criptas são os enterócitos, que são
células altamente especializadas nos processos de absorção. Na superfície luminal dos
enterócitos está presente uma membrana de microvilosidades (MVM) ou “bordadura em
escova”, que contém enzimas necessárias para a digestão final e absorção de nutrientes
(German & Zentek, 2006). Na base das vilosidades estão estruturas semelhantes a
glândulas, que são as criptas de Lieberkühn, que são um local de proliferação de células.
Dispersas entre os enterócitos, estão as células de Goblet ou células caliciformes (epiteliais
glandulares) que segregam uma rica camada de muco que recobre a mucosa. Também há
células endócrinas que fazem a regulação do processo digestivo.
O espaço paracelular é fechado por diferentes proteínas, que previnem a entrada de
macromoléculas. Na camada mucosa existe o glicocálice, constituído por carbohidratos e
11
proteínas, que cobre a MVM. O glicocálice tem uma intensa actividade enzimática e quebra
as macromoléculas em unidades absorvíveis. Ele proporciona ambiente específico para as
bactérias associadas à parede intestinal. A superfície intestinal é assim um microambiente
formado por glicocálice, muco e uma camada de água estacionária (Cunningham, 2004).
Proteínas transportadoras ajudam no transporte de aminoácidos, monossacáridos e
electrólitos. O turnover de enterócitos e proteínas das microvilosidades é influenciado por
factores do lúmen, como enzimas pancreáticas, sais biliares e bactérias.
A maturação dos enterócitos ocorre durante o processo de migração da cripta para a
extremidade da vilosidade, sendo dependente de estímulos para a sua diferenciação. O
número e tamanho das vilosidades dependem do número de células que as compõem.
Assim, quanto maior o número de células, maior o tamanho da vilosidade e, por
consequência, maior a área de absorção de nutrientes. Dessa forma, a absorção somente
se optimizará quando houver integridade funcional das células das vilosidades. Outro factor
relevante para a absorção dos nutrientes é a quantidade de microvilosidades existentes nos
enterócitos. O número de microvilosidades actua como um amplificador de área para a
absorção de nutrientes (Gomes, 2009).
Os enterócitos expostos no lúmen intestinal são células polarizadas com duas membranas
distintas. Anexadas na membrana apical estão numerosas enzimas para os estágios finais
da hidrólise e transportadores para os nutrientes resultantes. Após absorção, os nutrientes
saem dos enterócitos através de outra série de transportadores presentes na outra
membrana (basolateral) e são recolhidos pelos vasos sanguíneos e lacteais (linfáticos) na
lâmina própria da mucosa. Apesar de serem mais conhecidas as funções digestivas da
membrana apical, a regulação dos processos na membrana basolateral desempenha um
papel importante na entrega de nutrientes para o organismo (Buddington, 1996).
A mucosa intestinal dos mamíferos é uma das que mais rapidamente faz a replicação dos
tecidos no corpo. Por exemplo, estudos cinéticos em roedores demonstram que o epitélio do
ID é completamente substituído a cada 2 ou 3 dias. No ID as células estaminais localizadas
na região das criptas diferenciam-se em enterócitos, células enteroendócrinas e células de
Goblet. Estas células especializadas migram de forma ascendente ao longo das vilosidades
intestinais e eventualmente sofrem apoptose ou são expulsas para o lúmen intestinal. As
células de Paneth, cuja função parece envolver a defesa de barreira contra microorganismos
do lúmen, movem-se para baixo, na região da base das criptas. O turnover do ID e das
células do cólon depende de: taxa de proliferação das células estaminais da mucosa
intestinal, migração ao longo do eixo das vilosidades das criptas no ID, e morte celular via
apoptose. A apoptose é uma chave reguladora do turnover normal da mucosa intestinal.
(Ziegler, Evans, Estívariz & Jones, 2003). A vilina é uma proteína actina reguladora expressa
por todas as células do epitélio intestinal bem como pelas glândulas exócrinas associadas
com o TGI. Num estudo de Wang et al. (2008), foi demonstrado pela primeira vez que a
12
vilina é uma proteína anti-apoptótica específica da célula epitelial, desempenhando um
papel na sua sobrevivência e homeostase. A sua ausência predispôs o rato a uma colite
promovida pela apoptose.
1.1.1.1 Digestão e absorção do alimento
A digestão no ID pode dividir-se em dois processos: intraluminal e epitelial. Ela é facilitada
pelas enzimas do pâncreas, dos ácidos biliares do fígado (armazenados, concentrados e
libertados pela vesícula biliar) e pelas enzimas produzidas pelas próprias células intestinais.
Os cães adaptaram-se a uma digestão de dietas concentradas, de baixa fibra, com elevada
proteína e gordura. Assim, o processo digestivo no tracto digestivo superior, sobretudo no
ID, é muito importante. Os cães e os gatos estão bem preparados para digerir diferentes
fontes de gordura dietéticas de forma altamente eficiente. O processo digestivo intraluminal
é suportado por uma grande diversidade de actividades enzimáticas da mucosa intestinal.
As enzimas digestivas intraluminais, quer a pepsina das secreções gástricas ou as
diferentes proteases, amilases e lipases do pâncreas permitem a digestão dos alimentos
(Zentek, 2008). A actividade enzimática na camada de muco quebra as grandes moléculas
libertadas do lúmen intestinal em pequenas unidades, que podem ser absorvidas por
processos de transporte activo ou passivo. As proteínas transportadoras ajudam no
transporte de aminoácidos, monossacáridos e electrólitos. O desenvolvimento da digestão
enzimática é determinado pela espécie, raça, idade, dieta e factores individuais.
O controlo hormonal da digestão no ID envolve diversos componentes. A secretina é
produzida pela mucosa da porção superior do duodeno, em resposta à entrada do quimo
(massa gástrica semi-líquida) ácido no duodeno. Ela estimula a libertação de bicarbonato
pelo pâncreas e controla a taxa de fluxo biliar da vesícula biliar. A colecistoquinina também é
libertada por esta parte da mucosa intestinal, em resposta à presença de gorduras na massa
alimentar. Esta hormona estimula a contracção da vesícula biliar, ocasionando a libertação
de bílis no lúmen intestinal. A colecistoquinina, também denominada pancreozimina,
estimula a secreção de enzimas pancreáticas e aumenta a disponibilidade de cálcio para os
linfócitos (Case et al., 2000).
Juntamente com a função digestiva, o intestino e os órgãos digestivos anexos representam
uma grande parte do sistema endócrino, e muitos tipos de células endócrinas foram
identificados nos intestinos de cães e gatos. As hormonas com origem no TGI são
essenciais para a regulação do processo digestivo e do metabolismo de todo o corpo. É
importante saber como as funções do intestino, digestivas, imunitárias, endócrinas e
nervosas interagem, bem como o impacto da nutrição nas funções endocrinoimunológicas.
Williams, Baskin e Schwartz (2009) descobriu em ratos, que um dos sinais fisiológicos
activos da saciedade é o GLP-1 (glucagon-like peptide-1), secretado pelo intestino distal em
resposta à ingestão de nutrientes. Estudos em cães adultos demonstraram que o aumento
13
da osmolaridade é suficiente para estimular a absorção jejunal de electrólitos e água, e que
a estimulação física da mucosa causa hiperémia. As vias reguladoras destes mecanismos
incluem hormonas e sinais neurais.
1.1.1.1.1 Digestão proteica
A digestão das proteínas inicia-se no estômago pelas endopeptidases pepsina e tripsina. A
pepsina é desactivada assim que passa ao duodeno. A digestão proteica no ID é feita pelas
enzimas pancreáticas e da MVM. Os péptidos e os aminoácidos livres são libertados pelos
processos digestivos e os pequenos péptidos e aminoácidos são absorvidos por
transportadores específicos na MVM. As proteases pancreáticas, que dividem as proteínas e
os polipéptidos em partículas menores atacando diferentes porções da proteína, incluem
tripsinogénio, quimiotripsinogénio, carboxipeptidases, aminopeptidases, nuclease e
elastase. Várias destas enzimas são segregadas na forma inactiva e são activadas pela
acção de outros componentes no ID, depois da sua libertação. O tripsinogénio é activado
pela enteroquinase para formar a enzima activa, a tripsina, que por sua vez vai activar
outras proteases pancreáticas. A tripsina hidroliza apenas ligações básicas que envolvem os
aminoácidos lisina ou arginina. As quimiotripsinas activas dividem as proteínas em
aminoácidos aromáticos, bem como a metionina, leucina e asparagina. As
carboxipeptidases e as aminopeptidases quebram os aminoácidos das extremidades das
proteínas. A elastase hidroliza específicamente as proteínas do tecido conjuntivo fibroso, e
aquelas que também são hidrolizadas pela tripsina e quimiotripsina (German & Zentek,
2006).
Os produtos finais da digestão luminal de proteínas são pequenos péptidos e alguns
aminoácidos livres. A digestão final de proteínas ocorre na MVM ou no citoplasma dos
enterócitos, resultando na libertação de aminoácidos livres na corrente sanguínea portal.
Entretanto, as células intestinais aproveitam uma grande parte destes aminoácidos como
fonte de energía, fazendo com que apenas metade das proteínas digeridas seja libertada
pelo fígado para uso pelo resto do corpo. Os aminoácidos mais simples e alguns dipéptidos
e tripéptidos são absorvidos por transporte activo com transporte de sódio, utilizando uma
proteína transportadora específica. As pequenas moléculas de péptidos absorvidas na
célula são imediatamente hidrolizadas até unidades simples de aminoácidos, antes de
serem libertadas na circulação portal. Os aminoácidos são absorvidos nos capilares vilosos
e a partir daí, penetram na veia porta que transporta os nutrientes até ao fígado (Laflamme,
2008).
O ID desempenha um papel importante no catabolismo da glutamina arterial e dos
aminoácidos da dieta. A maior parte da glutamina e quase todo o glutamato e aspartato na
dieta são catabolizados na mucosa intestinal. Esta mucosa também tem um papel na
degradação da arginina, prolina e aminoácidos de cadeia ramificada na dieta, de tal forma
14
que 30 a 50% dos aminoácidos dietéticos não estão disponíveis aos tecidos extra-intestinais
(Wu, 1998).
1.1.1.1.2 Digestão de carbohidratos
A digestão de carbohidratos ocorre predominantemente no ID. Amido e glicogénio são
cadeias longas de glicose, unidas por uma ligação α entre as moléculas. A digestão
intraluminal é facilitada pela α-amilase pancreática, que quebra a ligação α directa. Contudo,
ela não pode quebrar ligações em pontos de ramificações, nem pode quebrar o açúcar final.
Assim, esta enzima deixa pequenos complexos de dois ou três açúcares (maltose ou
maltotriose), ou açúcares com ramificações, chamados de dextrinas-limite. As enzimas da
MVM incluem: sacarase, lactase, maltase, isomaltase (ou α-dextrinase, que hidroliza as
dextrinas-limite através da remoção sequencial de moléculas de glicose). A absorção final
de glicose ocorre via transporte activo facilitado com sódio, com libertação de glicose na
corrente sanguínea portal. A maltose e outros dissacáridos da dieta (lactose e sacarose) são
digeridos pelas enzimas da MVM em monossacáridos, que são depois absorvidos por
transportadores específicos ou por transporte facilitado. Os monossacáridos são então
transportados através da membrana basolateral até à circulação portal (Laflamme, 2008).
1.1.1.1.3 Digestão de gorduras
A digestão de gorduras é mais complexa do que a das proteínas e dos carbohidratos. Inclui
as seguintes etapas: digestão intraluminal, solubilização micelar, permeabilização desde o
lúmen até à célula, re-esterificação intracelular, formação de quilomícrons, e transporte via
circulação linfática. Para uma digestão completa, são necessários lipase, colipase e
fosfolipase A2 do pâncreas, bem como ácidos biliares que são produzidos pelo fígado, e
depois armazenados e libertados pela vesícula biliar. O pH no ID (duodeno e jejuno) é
alcalino, devido à secreção da glândula epitelial e de bicarbonato pelo suco pancreático. A
bílis é produzida no fígado, armazenada e concentrada na vesícula biliar, e tem o seu pico
de libertação 30 minutos após a refeição, em resposta à presença de lípidos e seus
produtos de digestão no duodeno. A principal função da bílis no ID consiste na emulsificação
e digestão de lípidos e na activação de certas lipases. A maior parte da digestão de
triglicéridos (principal forma da gordura da dieta) começa com a emulsificação das gorduras
pelos ácidos biliares, criando partículas minúsculas, solúveis em água, que podem ser
digeridas pelas enzimas pancreáticas. As gorduras e ácidos gordos (AG) não são solúveis
em água e, por isso, não são facilmente transportados. Para facilitar o transporte, sais
biliares, lecitina e colesterol da bílis combinam-se para formar micelas com as gorduras
parcialmente digeridas. As micelas (que contêm ácidos biliares, monoglicéridos, diglicéridos
e AG de cadeia longa) são solúveis em água e facilitam a transferência de AG livres e
monoglicéridos para a MVM, onde estas substâncias são absorvidas pelas células
15
intestinais. Ao entrarem nas células, os AG e os monoglicéridos são transformados
novamente em triglicéridos. Este processo é activo, consome energia e resulta na produção
de quilomícrons (constituídos por triglicéridos, colesterol e apoproteínas). Depois, estes
quilomícrons solúveis na água e revestidos de proteínas, entram nos vasos quilíferos
intestinais e são transportados pelo sistema linfático para a corrente sanguínea sistémica. O
quilomícron é metabolizado e no fígado sobram partículas que dão origem a lipoproteínas de
densidade muito baixa. Isto difere de outros nutrientes, que são transportados directamente
para o fígado pela corrente sanguínea portal. Todos os AG com mais de 16 carbonos de
comprimento são absorvidos e transportados dessa forma (German & Zentek, 2006).
Os AG de cadeia mais curta, como os que se encontram em triglicéridos de cadeia média
(TCM), podem passar por um processo digestivo e de absorção mais simples via corrente
sanguínea portal. Os TCM podem ser parcialmente hidrolizados pela lipase gástrica na
ausência da lipase pancreática. Enquanto os triglicéridos de cadeia longa (16 ou mais
carbonos) são digeridos de forma limitada pela lipase gástrica, os triglicéridos de cadeia
curta e média (cadeia de até 12 carbonos) são rapidamente hidrolizados em diglicéridos e
AG livres pela lipase gástrica. Os diglicéridos são depois digeridos no ID, antes da absorção.
No entanto, os triglicéridos de cadeia curta e média podem ser absorvidos para a corrente
sanguínea ao longo da mucosa gástrica. Aqui ligam-se à albumina e são levados para o
fígado, onde são oxidados como fonte de energia. Isso é fundamental em animais recém-
nascidos e pode ser importante em certos tipos de doenças gastrointestinais que
comprometem a digestão normal de gordura. Comparado com outras espécies, os cães
apresentam um nível mais elevado de lipase gástrica. Os TCM são solúveis em água, e
portanto, não necessitam de sais biliares para emulsificação. Além disso, após a absorção,
os TCM são sobretudo oxidados para energia, em vez de serem armazenados no tecido
adiposo. Assim, os TCM podem constituir uma fonte de energia alternativa em animais cuja
digestão ou absorção de gorduras esteja comprometida (Laflamme, 2008).
Macrominerais e microelementos são absorvidos, sob a forma ionizada, sobretudo no ID,
mas o IG também pode fazer parte deste processo. A absorção do cálcio activo está sujeita
a mecanismos reguladores mediados pela vitamina D, paratormona e calcitonina. Estes
mecanismos homeostáticos permitem ao organismo adaptar-se a diferentes consumos nas
dietas, dentro de certos limites. Por exemplo: a absorção do cálcio duma fonte altamente
disponível pode variar entre aproximadamente 30% a mais de 95%, dependendo da
necessidade do animal. Contudo, em cães, parte do cálcio da dieta é absorvido por
processos passivos. A absorção de fósforo parece ser regulada por semelhantes
mecanismos. O magnésio é absorvido sem regulação homeostática e por isso, os seus
níveis no sangue têm uma grande variação. Sódio, potássio e cloro são maioritariamente
absorvidos no ID (a sua taxa de absorção pode exceder os 90%) (German & Zentek, 2006).
16
Os microminerais são na sua maioria absorvidos no ID, mas o cólon também pode contribuir
para a sua absorção. As taxas de absorção do zinco, ferro e manganésio estão sujeitas a
mecanismos reguladores. Foram demonstrados sistemas de transporte activo para o
manganésio e o cobre. Outros elementos são absorvidos por difusão passiva (Case et al.,
2000).
As vitaminas lipossolúveis (A, D, E, K) solubilizam-se nas micelas e depois são absorvidas
mediante difusão passiva através da fase lipídica da MVM. Em geral, quando existe uma
absorção lipídica normal, existe uma absorção normal de vitaminas lipossolúveis.
As vitaminas hidrossolúveis, em especial as do complexo B, são absorvidas por difusão
passiva, transporte facilitado ou activo. Algumas podem ser absorvidas mediante um
processo activo quando os níveis da dieta são baixos. A vitamina B12 (cobalamina) é a
única que requer a presença de um factor intrínseco para a sua adequada absorção. Após a
ingestão, a vit. B12 é libertada da proteína da dieta no estômago. Então liga-se a uma
proteína de ligação não específica. No ID, a cobalamina transfere-se para um factor
intrínseco (IF) que é sintetizado no pâncreas. O complexo cobalamina-IF passa através do
intestino até ao ID distal, onde a cobalamina é transportada através da mucosa até à
circulação portal. O folato (vit. B9) está presente na dieta numa forma conjugada (com
resíduos de glutamato). Este conjugado é digerido pela folato-deconjugase, uma enzima da
MVM, que remove quase todos os resíduos, antes da absorção via transportadores
específicos situados no ID médio (German & Zentek, 2006).
1.1.1.2 Microbiologia do ID
Logo após o nascimento, as superfícies mucosas dos animais, que, em condições fetais são
estéreis, rapidamente são colonizadas por diversos microrganismos, tornando-se um
ecossistema de alta complexidade com cerca de 106 UFC (unidades formadores de
colónias) por mL no ID, pertencentes a mais de 400 espécies diferentes. Em mamíferos,
incluindo as espécies de animais de companhia, a colonização da mucosa intestinal inicia-se
com o fornecimento do colostro e leite materno. As primeiras experiências dietéticas, a
exposição a microrganismos e a exploração do ambiente por estes animais contribuem para
a formação e estabelecimento da microbiota intestinal. A nutrição subsequente, para o resto
de sua vida, ditará as mudanças na composição desta microbiota, incluindo o
estabelecimento ou prevenção de doenças digestivas (Gomes, 2009).
O ID dos cães possui uma população microbiana simples. No duodeno e jejuno encontram-
se, predominantemente, Streptococcus e Lactobacillus (<104/mL) e, no íleo, Escherichia coli
e bactérias anaeróbias (<106/mL). A baixa densidade de microorganismos é resultado,
principalmente, da influência da acidez gástrica e da bílis que proporcionam um ambiente
desfavorável à proliferação dos microrganismos (National Research Council [NRC], 2006).
As populações microbianas aumentam quantitativamente do duodeno ao cólon. A eubiota
17
residente é parte integrante da saúde do TGI, influencia o desenvolvimento da sua
microanatomia, ajuda no processo digestivo, estimula o desenvolvimento do sistema
imunitário entérico e pode proteger da invasão patogénica. Os cães saudáveis são
imunologicamente tolerantes a esta microbiota estável e a perda de tolerância contribui para
a patogénese de enteropatias crónicas, como a doença inflamatória intestinal (German &
Zentek, 2006).
Existem diversos mecanismos de regulação endógena da população microbiana como: a
motilidade intestinal, disponibilidade do substrato e a imunidade local. Outra forma de
controlo microbiano são as diversas secreções bacteriostáticas e bacteriocidas, como a
gástrica ácida, a bílis e as pancreáticas. O suco pancreático tem actividade antimicrobiana,
contendo uma proteína que é bactericida contra Escherichia coli e Salmonella, e que é
bacteriostática contra Staphylococcus. A microbiota indígena utiliza resíduos alimentares,
controla a concentração de oxigénio e produz factores antimicrobianos (Carciofi, 2008a). Os microrganismos presentes no TGI mantêm relações simbióticas ou antagónicas,
nutrindo-se dos componentes de alimentos não digeridos e das secreções do TGI. Podem
encontrar-se associados intimamente com o epitélio ou livres no lúmen intestinal. Em
condições normais, estas populações encontram-se em equilíbrio. No entanto, em
condições de stress (doença, antibioterapia, mudança da dieta, alterações climáticas ou
qualquer outra situação desfavorável) as populações comensais tendem a diminuir e as
nocivas a proliferar. Este desequilíbrio é chamado de disbiose, e reflecte-se negativamente
na saúde do animal (Gomes, 2009). Nas situações de desequilíbrio entre bactérias
benéficas e patogénicas, há interferência nas necessidades nutricionais do hospedeiro pelo
aumento da velocidade de renovação dos enterócitos e diminuição da altura das vilosidades.
Estes factores determinam aumento na profundidade das criptas e espessura da mucosa
intestinal, aumento na velocidade de passagem da digesta e, por conseguinte, diminuição
da absorção dos nutrientes. Além disso, a população microbiana indesejável compete com o
hospedeiro por nutrientes presentes no lúmen intestinal, resultantes do processo digestivo.
Dessa forma a manutenção do estado de eubiose, ou seja, o estabelecimento de uma
microbiota estável e benéfica ao tracto digestivo, é factor chave na preservação da saúde do
animal (Wenk, 2006).
1.1.2 Intestino Grosso
É um órgão curto nos cães (cerca de 0,6m), constituído pelo ceco, cólon e recto. Os cães
possuem cólon simples, não saculado e com desenvolvimento cecal reduzido. O cólon
divide-se em três secções: ascendente, transverso e descendente. Tem como funções a
absorção de água e electrólitos, a fermentação da matéria orgânica não digerida e não
absorvida pelo ID, e armazenamento de fezes. É assim um ambiente de suporte para a
fermentação de compostos que escapam à digestão enzimática e local de absorção de
18
metabolitos bacterianos. O tempo de residência médio no IG é de 12 horas. A mucosa do IG
tem uma superfície lisa, sem vilosidades, e é constituída pelas criptas de Lieberkühn, que
têm células de absorção e secreção. As suas células epiteliais secretam apenas muco
alcalino que é importante para a protecção da mucosa, sua lubrificação e para inactivar
ácidos da fermentação (Carciofi, 2008a).
As secreções intestinais representam uma quantidade de fluidos que entra no TGI quase
cinco vezes maior do que a água ingerida. A maior parte (cerca de 90%) da água é
reabsorvida no ID. Ainda que uma grande quantidade de água seja reabsorvida no ID, o
material que entra no cólon tem consistência líquida. Grande parte da água restante e
muitos electrólitos, principalmente sódio, potássio e cloro, são absorvidos no cólon,
formando-se material fecal semi-sólido a sólido, à medida que os restos se aproximam da
extremidade rectal do cólon distal. Esta absorção final da água é um processo activo que
envolve co-transporte de sódio e de cloro. Outras substâncias podem ser substituídas pelo
ião cloro de carga negativa (Cunningham, 2004). Entre elas encontram-se os ácidos gordos
de cadeia curta (AGCC). Os AGCC são produzidos a partir da fermentação bacteriana de
fibras da dieta que entram no íleo e no cólon. As fibras dietéticas não são digeríveis pelas
enzimas digestivas do animal, mas as fibras fermentáveis podem ser digeridas por bactérias
no íleo e no cólon para produzir AGCC, que são facilmente absorvidos. A microbiota
intestinal no íleo e no cólon de cães produz AGCC, que nutrem as células do cólon, facilitam
a absorção de água e, através de várias formas, ajudam a prevenir a proliferação de
bactérias potencialmente patogénicas.
1.1.2.1 Fermentação no IG
A proporção relativa dos produtos da fermentação gerados depende de: composição da
microbiota, interacções metabólicas entre bactérias, nutrientes disponíveis, tempo de
trânsito intestinal e factores do hospedeiro (idade, estado imunitário, genética). Os principais
substratos para a microbiota presentes no IG incluem os próprios componentes dietéticos
que não foram digeridos ou absorvidos no ID. A fermentação no IG é repartida: o amido,
polissacáridos não amiláceos, açúcares e oligossacáridos são fermentados no cólon
proximal; as proteínas, enzimas endógenas e muco no cólon distal. Em diferentes regiões
do TGI estão presentes grupos específicos de microrganismos capazes de produzir grande
diversidade de compostos com diversos efeitos na fisiologia intestinal e sistémica. Estes
grupos produzem enzimas capazes de actuar metabolicamente no intestino e na catalização
de substâncias em compostos que podem ser benéficos ou nocivos ao hospedeiro.
A capacidade metabólica das bactérias intestinais é extremamente diversa. Qualquer
composto ingerido ou qualquer substância que entre no lúmen intestinal através do tracto
biliar, sangue ou directamente por secreção no lúmen, é um substrato em potência para a
fermentação ou transformação bacteriana (Teshima, 2003). Embora não se conheça bem a
19
actividade enzimática na maioria dos grupos bacterianos intestinais, acredita-se que a
degradação de materiais altamente polimerizados seja, neste órgão, uma actividade
cooperativa, com a participação de vários grupos bacterianos. Os principais géneros
envolvidos na degradação dos poli e oligossacáridos são os Bacterioides e Bifidobacterium.
O grande número de bactérias presentes contribui significativamente para a fermentação, no
cólon, de carbohidratos complexos e proteínas levando à produção de AGCC, considerados
benéficos, e vários componentes putrefactivos, considerados tóxicos (aminas biogénicas,
amónia, indol e fenol). A proporção relativa em que os supracitados compostos são
produzidos está directamente relacionada com o balanço de bactérias e de substratos
disponíveis no cólon. Quando alcançam o IG, a maioria dos oligossacáridos não digestíveis
são hidrolisados a monossacáridos e, posteriormente, metabolizados num processo
fermentativo por bactérias anaeróbias presentes no IG. Apesar dos produtos da fermentação
intestinal de proteínas serem geralmente considerados tóxicos à saúde humana e animal, os
produtos da fermentação de carbohidratos, os AGCC, podem contribuir positivamente na
digestão e metabolismo do hospedeiro, além de poder atenuar os efeitos negativos dos
produtos gerados pela degradação das proteínas (Gomes, 2009).
1.1.2.2 Microbiologia do IG
A microbiota do cólon dos cães apresenta uma população de microrganismos heterogénea,
complexa e dinâmica. Segundo um estudo de Vanhoutte, Huys, Brandt, Fahey e Swings
(2005) a densidade das bactérias presentes no IG pode alcançar 1010 por grama de fezes na
matéria seca, sendo composta principalmente por Streptococcus, bifidobactérias,
lactobacilos, Bacterioides e Clostridium. Há um grande número de bactérias anaeróbias, que
fermentam restos alimentares e secreções endógenas que escapam do ID. Acredita-se que
a microbiota benéfica pode auxiliar a digestão e absorção de nutrientes, produz vitaminas
que serão utilizadas pelo hospedeiro e diminui, por exclusão competitiva, a proliferação de
agentes patogénicos. Entre estes géneros de bactérias comensais, Lactobacillus e
Bifidobacterium são dos mais considerados e estudados. As bactérias nocivas, por outro
lado, podem causar inflamações na mucosa intestinal, gerar metabolitos tóxicos e
proporcionar o aparecimento de doenças, como é o caso da Escherichia coli, Clostridium,
Staphylococcus e Salmonella.
Estudos indicam que a microbiota do cólon contribui para o seu funcionamento normal, e
também participa significativamente no desencadeamento ou prevenção de várias doenças
pela biotransformação de diversos compostos da ingesta, ou mesmo endógenos, em
derivados benéficos ou prejudiciais. Assim, a eubiota produz AGCC (acético, propiónico e
butírico) e ácido láctico. Estes ácidos orgânicos diminuem o pH fecal, favorecendo a inibição
das bactérias patogénicas e estimulam a proliferação de enterócitos, o que favorece a
capacidade de absorção intestinal de nutrientes. O contrário ocorre em situação de disbiose,
20
quando o aumento da população microbiana indesejável pode levar à diminuição da
absorção de nutrientes, aumento da espessura da mucosa e da velocidade de passagem da
digesta, além de aumentar a produção de aminas biogénicas, amónia e gases, que são
prejudiciais à integridade da mucosa e à saúde intestinal (Gomes, 2009). Verifica-se, assim,
que a adição de carbohidratos fermentáveis à dieta de animais de companhia é importante
para que haja um adequado suprimento de matéria orgânica para o IG, sem a qual podem
ocorrer efeitos negativos na digestão pós-ileal resultante de alterações na microbiota do
lúmen deste órgão (Carciofi, 2005; NRC, 2006). Esta medida aumenta a função de barreira
da mucosa intestinal e diminui o risco de translocação bacteriana e septicémia,
demonstrando que são componentes importantes das dietas de cães e gatos. Ao formular
alimentos para estas espécies é necessário considerar que o alimento deve prover
nutrientes tanto para o indivíduo como para as bactérias residentes no TGI (Buddington &
Sunvold, 2000).
Em suma, a microbiota gastrointestinal desempenha um importante papel nas funções
fisiológicas do hospedeiro. Entre estas funções estão: protecção contra infecção intestinal;
diminuição do pH intestinal; diminuição no número de bactérias intestinais putrefactivas e
patogénicas; melhoria da função intestinal; estímulo da resposta imunitário local e sistémica
(Bazolli, 2008). A microbiota residente influencia a estrutura e função da mucosa intestinal.
As bactérias aderentes à mucosa do IG influenciam a capacidade endocítica e hidrolítica
intracelular, melhorando a degradação de antigénios presentes no lúmen intestinal através
da regulação do sistema imunitário (sobretudo imunoglobulina A), com melhor
funcionamento da mucosa e do seu potencial anti-inflamatório (Carciofi, 2008a)
A microbiota residente pode ter efeitos protectores adicionais de forma directa e indirecta.
Os microorganismos do tracto digestivo normalmente agem de forma competitiva contra
potenciais invasores, evitando que eles adiram ao epitélio GI. A microbiota GI pode
estimular a expressão de glicoconjugados epiteliais específicos em superfícies luminais, que
podem actuar como receptores para a aderência bacteriana. A especificidade destes
receptores pode influenciar o tipo de bactérias que se podem ligar a determinada célula.
Além disso, a microbiota GI influencia a camada de muco que cobre as células epiteliais dos
intestinos (Deplancke & Gaskins, 2001). Assim, a capacidade de defesa do muco, que se
deve em parte à sua capacidade para prender bactérias patogénicas, pode ser
comprometida. Quando se elimina a microbiota natural do intestino ou a sua composição é
alterada drasticamente, podem ocorrer diversas doenças, incluindo infecções, inflamação
intestinal e alergias (Benyacoub, 2007).
A colonização bacteriana do TGI é específica de cada espécie, varia individualmente e
também depende da composição da dieta. A colonização microbiana começa após o
nascimento e a composição da microbiota intestinal aproxima-se do espectro dos adultos
durante as primeiras semanas de vida. Investigando os efeitos, com o avançar da idade, na
21
microbiota luminal de cães de raça Beagle, parece que o impacto da idade é mais
pronunciado no IG do que no estômago ou no ID (Benno, Nakao, Uchida & Mitsuoka, 1992).
2. O PAPEL DA DIETA NA NUTRIÇÃO DO INTESTINO
A mucosa intestinal apresenta as maiores taxas de multiplicação e renovação celular de
todo o organismo, o que demonstra a grande importância do fornecimento de nutrientes
para o intestino. As células intestinais obtêm grande parte da sua nutrição através do lúmen
intestinal e outra parte pelo fluxo sanguíneo. A absorção de nutrientes directamente do
lúmen intestinal corresponde a 50% das necessidades energéticas dos enterócitos e 70%
das necessidades energéticas dos colonócitos, sendo o restante suprido pela corrente
circulatória (Brunetto, 2009). A nutrição tem, assim, impacto significativo no TGI de animais
saudáveis e doentes, com especial importância para a função do intestino e do sistema
imunitário associado ao TGI. A entrada de nutrientes no lúmen intestinal permite a nutrição
das próprias células intestinais e a presença desses nutrientes é um estímulo trófico para a
mucosa intestinal, permitindo maiores taxas de replicação e diferenciação celular, com
formação de uma melhor membrana mucosa, maior capacidade de absorção de nutrientes e
defesa contra a penetração de antigénios. Mantém a integridade da mucosa ao evitar a
atrofia do intestino, o comprometimento imune e a translocação bacteriana (Brunetto, 2009).
O comprimento total dos intestinos, a altura das vilosidades e a profundidade da cripta são
influenciados por diversos factores ligados à dieta. A camada única de células epiteliais que
recobre os intestinos desde as criptas às extremidades das vilosidades, forma uma lâmina
contínua por todo o órgão. Estas células são constantemente renovadas a partir de células-
tronco nas criptas, de forma que as células epiteliais (enterócitos) do intestino são
substituídas a cada 3 dias. Esta rápida regeneração ajuda o intestino a cicatrizar uma lesão
com rapidez, mas o turnover contínuo de células exige uma grande ingestão de nutrientes
pelo hospedeiro. Estas células usam 10 a 20% do gasto total de energia do corpo e utilizam
até 50% do turnover proteico corporal de alguns aminoácidos essenciais (Laflamme, 2008).
Além disso, o uso de aminoácidos da dieta pelo ID pode ter um efeito substancial sobre a
disponibilidade sistémica dos aminoácidos essenciais. Por exemplo, a oxidação intestinal da
lisina corresponde a um terço da oxidação total da lisina do corpo e mais de 90% da
glutamina e do glutamato da dieta são utilizados no TGI (Schoor, Reeds & Stool, 2002).
Portanto, os intestinos são metabolicamente activos, e são altamente sensíveis à
disponibilidade de nutrientes essenciais.
As capacidades funcionais totais do intestino para hidrolizar e absorver os constituintes
dietéticos são fundamentais para o organismo. O intestino dos vertebrados pode compensar
alterações qualitativas e quantitativas na ingestão da dieta, pela adaptação de estrutura e
funções intestinais. Estas respostas adaptativas podem ser caracterizadas em três
situações. Durante a evolução das espécies, as características intestinais adaptaram-se
22
para uma dieta natural. De forma semelhante, durante a história de vida dos mamíferos, o
intestino altera-se para acompanhar a troca do leite para uma dieta adulta, que é diferente
na sua composição. Isto é exemplificado pelas alterações de actividades da lactase e α-
glicosidase durante o desenvolvimento de cães e gatos. Finalmente, as mudanças na
composição da dieta geram alterações rápidas e reversíveis nas características intestinais
(Buddington, 1996).
2.1 Nutrição trófica e citoprotectora para o intestino
Há pesquisas que estão a definir potenciais funções terapêuticas para nutrientes específicos
e compostos derivados da dieta no turnover da mucosa intestinal, sua reparação e
adaptação depois de uma ressecção massiva do intestino, e a sua função de barreira. Entre
eles incluem-se arginina, glutamato, glutamina, glutationa, glicina, vitamina A, zinco e lípidos
específicos. Estudos estão a definir o papel destes nutrientes como agentes tróficos e
citoprotectores e a sua interacção com os factores de crescimento endógenos e exógenos
no intestino. O papel e a regulação da microbiota endógena intestinal na produção de AGCC
a partir de fibras derivadas da dieta e outros compostos derivados da dieta, e os efeitos
destes agentes na função do intestino estão também cada vez mais a ser elucidados
(Ziegler et al., 2003)
2.2 Efeitos do estado nutricional e via de nutrição na mucosa intestinal
A má nutrição generalizada, a depleção proteica, ou deficiências de nutrientes específicos
(incluindo ácidos gordos essenciais, zinco, vitamina A, folato, vitamina B12) inibem o
crescimento e turnover da mucosa intestinal. Durante períodos de fome extrema ou má
nutrição calórico-proteica severa, a mucosa entérica e as camadas musculares atrofiam num
grau desproporcionado comparado com as alterações na massa e peso de outros tecidos. A
má nutrição também é associada com capacidades digestivas/absortivas alteradas ou
diminuídas das células intestinais. A má nutrição induzida por privação de alimento por 1 ou
3 dias em ratos causa um decréscimo significativo na altura das vilosidades e/ou
profundidade da cripta no jejuno, íleo, e em menor extensão no cólon (Ziegler et al., 2003).
Além disso, a privação de alimento e outras formas de má nutrição energético-proteica são
associadas com debilidade celular da mucosa intestinal, marcada pelos níveis diminuídos de
glutationa (GSH) reduzida, aumento da permeabilidade a macromoléculas, translocação
bacteriana aumentada a partir do lúmen, e estimulação da apoptose das células epiteliais. A
privação de alimento também reduz significativamente a actividade específica e a expressão
de certas enzimas digestivas na mucosa do ID. A realimentação via nutrição enteral resulta
numa estimulação rápida do ID e numa extensão menor no crescimento da mucosa do
colón, estimula o estado redox de GSH na mucosa, aumenta a expressão das enzimas
23
digestivas e transportadores de nutrientes, e normaliza a função de barreira intestinal
(Ziegler et al., 2003).
A via de nutrição e a complexidade da dieta influenciam a proliferação celular intestinal e as
funções de barreira, bem como a composição da microbiota fecal. A nutrição parenteral e a
provisão de dietas enterais elementares ou semi-elementares (por ex., contendo
aminoácidos livres e açúcares simples) estão associados com a atrofia da mucosa e
aumento da translocação bacteriana luminal. Isto ocorre apesar da provisão adequada de
micro e macronutrientes, presumivelmente porque estes procedimentos não estimulam
adequadamente factores importantes para a renovação da células intestinais e/ou fornecem
quantidades inadequadas de nutrientes específicos. Os efeitos atrofiantes da nutrição
parenteral ou de dietas enterais elementares são rapidamente revertidos quando as dietas
enterais contendo proteínas, carbohidratos complexos e fibras são administradas. Outros
benefícios associados à nutrição enteral são o aumento da IgA intraluminar, a regulação na
produção de mediadores inflamatórios e a redução da virulência bacteriana, consequentes à
menor expressão de adesinas (Brunetto, 2008a).
A presença intraluminal de alimento relaciona-se com a maior produção de colecistoquinina,
que por sua vez aumenta o cálcio disponível para os linfócitos, servindo como co-factor de
multiplicação. A quantidade e a qualidade do alimento consumido regulam hormonas
gastrointestinais, que são importantes no desenvolvimento e reparação do intestino,
incluindo a gastrina, o factor de crescimento epidérmico (EGF) e o factor de crescimento I
associado à insulina (IGF-I). O leite é uma fonte de nutrientes rica numa variedade de
factores de crescimento tróficos do intestino incluindo hormona do crescimento (GH), IGF-I,
insulina, prolactina e EGF. Estes péptidos interagem com receptores específicos da mucosa
intestinal para estimular a regeneração e a função dos enterócitos e podem também ser
absorvidos com efeitos sistémicos em todo o corpo (Ziegler et al., 1999). O intestino é um
tecido-alvo para o IGF-I, que é estimulado por nutrientes disponíveis nas células da mucosa
por via: autócrina e parácrina, do trajecto da circulação (endócrina) e do lúmen do intestino
(via leite, saliva, e secreções biliares e pancreáticas). A privação de alimento em ratos
diminui muito a expressão de IGF-I no plasma e no ID, sendo os níveis de IGF-I
rapidamente estimulados com a realimentação. Assim, os nutrientes no lúmen são
importantes para a síntese adequada de factores de crescimento locais que por sua vez,
podem regular o turnover e a renovação das células da mucosa (Ziegler, Mantell, Chow,
Rombeau & Smith, 1996).
2.3 Mecanismos de desenvolvimento intestinal e nutrição no lúmen
A presença de nutrientes no lúmen proporciona: aumento do fluxo sanguíneo esplâncnico;
aumento da entrega de oxigénio, nutrientes e factor de crescimento às células da mucosa
intestinal; aumento da actividade neuronal intestinal e do peristaltismo; aumento das
24
secreções salivares, gástricas, pancreáticas, biliares e das células epiteliais intestinais;
provisão de nutrientes antioxidantes presentes no alimento; criação na mucosa de factores
de crescimento para acção endócrina, parácrina, e/ou autócrina. Certos factores de
crescimento e nutrientes específicos podem interagir duma forma sinérgica ou aditiva para
aumentar o desenvolvimento, adaptação e função de barreira da mucosa intestinal. Apesar
do conhecimento da fisiologia da renovação das células epiteliais intestinais e dos factores
nutricionais que a afectam, permanecem desconhecidos os mecanismos moleculares
responsáveis pela regulação celular, crescimento e reparação em resposta à dieta e
nutrientes específicos (Ziegler et al., 1999).
2.4 Efeitos dos Nutrientes sobre a estrutura e função do TGI
2.4.1 Proteínas e aminoácidos O turnover celular ocorre aproximadamente a cada 3 dias no ID. Os enterócitos aproveitam
uma grande parte dos aminoácidos como fonte de energia, fazendo com que apenas
metade das proteínas digeridas seja libertada no fígado para uso pelo resto do corpo. A
energia e os nutrientes necessários para ajudar no crescimento das novas células são
consideráveis. As células do sistema digestivo utilizam aproximadamente 50% da proteína
ingerida, e os tecidos intestinais utilizam mais de 90% do aspartato, glutamato e glutamina
(Laflamme, 2008). Portanto, o TGI é altamente sensível à deficiência de proteínas ou
aminoácidos. A ingestão adequada de proteínas da dieta e de aminoácidos essenciais é
necessária para proteger o TGI da atrofia, que resulta em diminuição das células
absorventes, alterações nas enzimas digestivas, redução nas imunoglobulinas e nas células
imunológicas do intestino, e um alto risco de colonização e translocação de
microorganismos patogénicos. A deficiência de proteínas dietéticas também pode levar à
perda da função digestiva enzimática do pâncreas. A correcção da deficiência de proteínas
permite restabelecer a função normal antes que se atinja uma fase irreversível. Os
aminoácidos dietéticos são grandes fontes energéticas, obrigatórios para a manutenção e
integridade da massa mucosal intestinal. Eles são precursores essenciais para a síntese
intestinal de glutationa, óxido nitrico, poliaminas, nucleótidos de purina e pirimidina, e outros
aminoácidos como alanina, citrulina e prolina (Wu, 1998).
2.4.1.1 Glutamina
O aminoácido glutamina (Gln) tornou-se um dos nutrientes mais estudados na pesquisa
gastrointestinal, pois é um substrato em muitos processos metabólicos chave, incluindo a
transferência interorgânica de nitrogénio, síntese proteica, gluconeogénese, homeostase
ácido-base e biossíntese de ácidos nucleicos. A Gln é também usada como substrato
energético principal pela mucosa intestinal e pelas células imunitárias ao longo do corpo,
incluindo as do sistema imunitário associado ao intestino. A Gln é um aminoácido dietético
não essencial, pois pode ser sintetizado pelo animal desde que a ingestão de precursores
25
na dieta seja adequada. É frequentemente considerado um aminoácido "condicionalmente
essencial", pois podem ser produzidas quantidades insuficientes sob certas condições, em
geral aquelas associadas a uma ingestão limitada por via oral (Laflamme, 2008).
A Gln é sintetizada para preencher adequadamente as necessidades metabólicas durante o
estado hígido, mas parece ser necessária em grandes quantidades sob certas condições
catabólicas, devido em parte ao aumento da sua utilização pelo TGI (Reeds & Burrin, 2001).
Durante a doença, o músculo esquelético exporta grande quantidade de Gln no sangue.
Concomitantemente, os tecidos que utilizam a Gln, como o intestino e as células imunitárias
aumentam intensamente a absorção e metabolismo de Gln. Foi proposto que o turnover da
mucosa intestinal e a sua função de barreira estão comprometidos durante estados de
stress, devido em parte à deficiência relativa de Gln. Para suportar esta hipótese,
numerosos estudos em modelos animais mostram que a suplementação enteral de Gln
acentua o crescimento, reparação e função da mucosa intestinal, diminui a sepsis e
inflamação com origem no intestino e melhora o equilíbrio nitrogenado durante a atrofia,
lesão e adaptação intestinal em modelos animais (Ziegler et al., 2000). Quando as células
intestinais estão danificadas, como numa inflamação, a Gln reduz a apoptose excessiva. A
apoptose cumpre um papel fundamental na restituição da mucosa após lesão e/ou
inflamação, mas a apoptose exagerada pode causar úlceras e comprometer a reparação da
mucosa (Evans, Jones & Ziegler, 2003). Se a Gln da dieta for excluída após uma lesão
intestinal, a mucosa intestinal atrofia-se e ocorre a translocação bacteriana, a partir do
lúmen intestinal. Tais efeitos podem ser muito reduzidos com o fornecimento da Gln. Além
disso, a glutamina e seu aminoácido relacionado, o glutamato, funcionam como precursores
para a síntese de glutationa (GSH), um potente antioxidante (Laflamme, 2008).
2.4.1.2 Glutamato
Acredita-se que o glutamato (Glu) e a glutamina (Gln) tenham uma via metabólica comum
no enterócito. No ID a Gln é metabolizada principalmente via hidrólise da Gln em Glu mais
amónia pela glutaminase e a degradação subsequente do Glu via transaminação (Wu,
1998). Reeds e Burrin (2001) observaram que as células da mucosa intestinal das criptas e
das vilosidades sintetizam simultaneamente Gln. Estas evidências indicam que a Gln tem
um papel mais regulador que metabólico ao activar uma série de genes associados com o
ciclo de progressão das células na mucosa e que a inibição da síntese de Gln inibe tanto a
proliferação, quanto a diferenciação de culturas de células da mucosa.
Além disso, o metabolismo do Glu no lúmen é maior que o da Gln no sangue arterial e a
presença de altas concentrações de Glu no lúmen intestinal tem pouco efeito (≈25%) sobre
a utilização intestinal de Gln. Isto indica que o Glu dietético tem funções no intestino que são
diferentes das desempenhadas pela Gln arterial. O ID tem um papel importante no
catabolismo da Gln arterial circulante e dos aminoácidos dietéticos, e a maior parte da Gln
(dois terços) e quase todo o Glu da dieta são catabolizados pela mucosa do ID. Sob
26
condições de alimentação, o Glu dietético é um substrato oxidativo muito mais importante
que a glicose dietética ou que a Gln arterial. O glutamato da dieta parece ser um precursor
específico da biossíntese de glutationa, arginina e prolina na mucosa do ID de leitões,
enquanto que a glutamina arterial é um mau substrato para estes três produtos finais
(Reeds, Burrin, Stoll & Jahoor, 2000). Estes estudos indicam que o Glu derivado da dieta
desempenha um papel importante na fisiologia e metabolismo intestinal, mas são
necessários novos estudos sobre a eficácia de Glu na dieta como um nutriente trófico e
citoprotector.
2.4.1.3 Glutationa (GSH)
A GSH (γ-glutamilcisteinilglicina) é o principal antioxidante tiol intracelular, constituído por
três aminoácidos: glicina, ácido glutâmico e cisteína, sendo o grupo tiol deste último o local
activo responsável pelas suas propriedades bioquímicas. A GSH é sintetizada nas células
da mucosa intestinal, pode ser derivada da dieta (como tripéptido intacto ou pela síntese via
aminoácidos sulfurados, glutamina, glutamato e glicina da dieta) ou pode entrar no lúmen via
bílis ou pela secreção directa pelas células mucosas. A GSH desempenha um papel na
destoxificação dos radicais livres das células, de toxinas e carcinogénios no intestino e
outros tecidos. É necessária para a função intestinal normal, por manter o muco e por
proteger as membranas das células epiteliais do perigo dos ácidos gordos hidroperóxidos e
electrófilos (Jones, 2002).
Estudos recentes in vitro e in vivo em células epiteliais do intestino mostram que
em comparação com células em diferenciação, as concentrações de GSH são mais
elevadas e o potencial redox de GSH diminui quando as células sofrem proliferação.
A butionina sulfoximina (BSO) diminui as concentrações de GSH no sangue e nos tecidos
através da inibição da enzima limitante da síntese de GSH. A BSO jejunal diminui os níveis
de GSH em associação com atrofia das vilosidades, danificação das células epiteliais e
degeneração mitocondrial em ratos. A GSH também parece ser importante para a função de
barreira intestinal devido à translocação bacteriana do intestino). A administração dietética
quer de GSH ou de Gln aumenta os níveis de GSH no plasma, na mucosa do intestino, e
noutros tecidos em roedores. Jones (2002) descobriu que o factor de crescimento
recombinante de queratinócitos (KGF) em ratos em jejum/realimentados estimulou o
crescimento da mucosa do intestino e preveniu a diminuição do estado redox de GSH no ID
e cólon. Assim, a administração de certos factores de crescimento tróficos do intestino e de
substratos específicos da dieta para a síntese de GSH, é uma estratégia potencial para
melhorar o estado redox de GSH da mucosa intestinal.
2.4.1.4 Arginina (Arg)
Várias evidências sugerem que a suplementação de arginina pode ter efeitos benéficos no
intestino, sendo que o ID é um local importante do metabolismo deste aminoácido. A sua
conversão para ornitina explica o papel da Arg na produção de poliaminas, que são
27
moléculas-chave envolvidas no crescimento e diferenciação celulares. L-Arg é o substrato
para a síntese de óxido nítrico (NO). O NO é necessário para a maturação normal do epitélio
intestinal. Pode ser o neurotransmissor inicial inibidor da motilidade intestinal, é essencial
para manter o fluxo sanguíneo da mucosa e causa vasodilatação local em caso de
inflamação ou lesão (Soeters et al., 2002). O NO também estimula a migração epitelial
celular e a redução da permeabilidade transepitelial paracelular, que parece estar envolvida
na manutenção da função de barreira gastrointestinal. A suplementação de Arg melhorou o
tratamento de lesões e da função imunitário celular em modelos animais e humanos de
ulceração e cirurgia gastrointestinal e acelerou a regeneração da mucosa intestinal após
radioterapia (Wu et al., 2000).
2.4.1.5 Glicina e Histidina Estudos in vivo sugerem que a glicina e a histidina dietética ou luminal podem ter efeitos
protectores nos tecidos GI. A perfusão de glicina diminuiu o dano de isquémia-reperfusão na
mucosa do ID em ratos. Em ratos, a injecção intraperitoneal e luminal intestinal de L-
histidina reduziu a quantidade de fluido acumulado no lúmen intestinal e protegeu a mucosa
do ID do dano induzido por Salmonella typhimurium (Ziegler et al., 2003).
2.4.1.6 Efeitos dos derivados dos aminoácidos no epitélio do cólon
Consoante a quantidade de proteínas alimentares, varia a matéria nitrogenada que entra por
dia no lúmen do IG. Esta matéria é usada como substrato pela microbiota, do que resulta
eventualmente a presença de uma mistura complexa de metabolitos como: a amónia, sulfito
de hidrogénio, AGCC e de cadeia ramificada, aminas, compostos fenólicos e indólicos. Os
efeitos benéficos ou deletérios no epitélio do colón dependem de parâmetros como: as suas
concentrações luminais, a duração da estase do colón, a capacidade de destoxificação das
células epiteliais em resposta ao aumento das concentrações de metabolitos, a utilização
metabólica celular destes metabolitos, bem como os seus efeitos no metabolismo
intermediário e oxidativo dos colonócitos. Além disso, devem ser considerados os efeitos
dos metabolitos nos movimentos dos electrólitos através do epitélio do cólon (Blachier,
Mariotti, Huneau & Tomé, 2007).
As aminas são formadas principalmente pela descarboxilação de aminoácidos pelos
microrganismos do TGI. Podem ser classificadas em função do número de agrupamentos
amina, da estrutura química e da via biossintética. Quanto à via biossintética, as aminas
classificam-se em naturais e biogénicas. As biogénicas são formadas pela descarboxilação
de aminoácidos por enzimas microbianas. Incluem-se a putrescina, a cadaverina, a
histamina e a serotonina. As aminas naturais, putrescina, agmatina, espermina e
espermidina são formadas in situ nas células à medida que são necessárias. A histamina
está armazenada nos mastócitos e basófilos (Gomes, 2009).
As poliaminas espermina e espermidina, são indispensáveis às células por estarem
directamente relacionadas com o crescimento, renovação e metabolismo celular. São
28
necessárias para o desenvolvimento e a manutenção da saúde do organismo. São também
importantes para os filhotes, principalmente durante o desmame precoce, devido à sua
participação no crescimento e maturação do TGI. A presença das aminas biogénicas na
dieta, em quantidades adequadas, é importante para a saúde do animal, mas apesar de
necessárias em alguns processos bioquímicos, podem causar efeitos tóxicos quando em
altas concentrações. Devido a sua rápida absorção no ID, a produção microbiana de
poliaminas é provavelmente de grande importância para o fornecimento desses compostos
à mucosa do IG (Gomes, 2009). As poliaminas têm um papel importante na regulação do
crescimento e proliferação celular, na estabilização de cargas negativas de ADN, transcrição
de ARN, síntese proteica, apoptose e regulação da resposta imune. A administração oral de
poliaminas induz a proliferação e a maturação do TGI em ratos neonatos e efeitos tróficos
na mucosa intestinal de ratos adultos. Durante os primeiros meses de vida, o TGI deve
amadurecer rapidamente e no desmame deve adaptar-se às mudanças drásticas do leite
para o alimento sólido. As actividades das membranas enzimáticas dos enterócitos são
modificadas de acordo com a situação. Além disso, deve ocorrer uma adaptação
imunológica do intestino ao novo conteúdo de antigénios microbianos e nutricionais. Em
ratos lactantes, a administração oral de poliaminas, induz alterações em diversas
actividades de enzimas, relacionadas com a maturação intestinal, como a fosfatase alcalina
e as dissacaridases (Larqué, Molina & Zamora, 2007). Uda et al. (2002) sugeriram que o
aumento da absorção da glicose promovido pelas poliaminas luminais no ID era devido ao
aumento da concentração do transportador sódio-glicose-1. Além disso, as poliaminas
exógenas podem interromper a motilidade intestinal pós-prandial através da libertação da
colecistoquinina, agindo nos seus receptores A e B.
Durante a fermentação no cólon de aminoácidos endógenos e dos não digeridos da dieta,
vários compostos putrefactivos são formados. Estes são considerados os principais
responsáveis pelo mau odor das fezes, incluindo a amónia, aminas, AG de cadeia
ramificada, indóis, fenóis e compostos sulfurados voláteis. Muitos desses compostos
apresentam efeitos adversos ao equilíbrio da microbiota intestinal, estando vários deles
relacionados com a tumorogénese. A importância da determinação do perfil e do teor de
aminas em alimentos está ligada ao facto destas substâncias serem importantes indicadores
de processos tóxicos fermentativos. As aminas biogénicas podem causar desnaturação ou
efeitos tóxicos quando consumidas em grande quantidade. A intoxicação alimentar causada
por ingestão de histamina provoca efeitos cutâneos, gastrointestinais, hemodinâmicos e
neurológicos. Outras aminas, como putrescina, espermina, espermidina podem acelerar o
desenvolvimento de tumores. Em compostos não fermentáveis, a presença de aminas
biogénicas em alta quantidade é considerado um indicativo de actividade de bactérias
indesejáveis (Swanson et al., 2002).
29
2.4.2 Gordura - Ácidos gordos essenciais
Os ácidos gordos (AG) omega-6 (ω6) e omega-3 (ω3) são importantes na saúde e doença.
O ácido linoleico (LA) e o seu derivado ácido araquidónico (AA) são ácidos gordos ω6,
essenciais para a estrutura normal da membrana celular, incluindo as células do sistema
digestivo. A estrutura polinsaturada destes AG influencia a fluidez e a permeabilidade da
membrana celular, incluindo as estreitas junções entre as células, e permite também que as
células da mucosa intestinal formem uma barreira protectora efectiva. Os ácidos gordos ω6
e seus derivados eicosanóides são responsáveis por funções fundamentais, como a
protecção gastrointestinal, imunomodulação, regulação da expressão genética, regulação do
fluxo sanguíneo renal e função normal do cérebro (Laflamme, 2008). O ácido α-linolénico
(ALA), um ácido gordo ω3, é menos eficiente na redução dos sinais da deficiência de AG.
Assim, os AG ω3 não foram considerados essenciais. O ácido docosahexaenóico (DHA) é
um AG ω3 condicionalmente essencial e é importante para a função cerebral. O ácido
eicosapentaenóico (EPA) e o DHA fornecem efeitos anti-inflamatórios que podem ser
benéficos nas doenças crónicas (Bauer, 2009).
Quanto à importância da relação entre os AG ω6 e ω3, conclui-se que a dose apropriada de
AG ω3 vai depender do objectivo dietético, da saúde e da disposição genética do paciente e
da fonte de AG ω3 utilizada. Uma pequena quantidade de óleo de peixe contendo DHA e
EPA é mais eficaz que uma grande quantidade de óleo com ALA como principal AG ω3.
Assim, a avaliação duma dieta baseada na razão ω6:ω3 não representa o efeito fisiológico
da dieta, uma vez que cada AG ω3 e ω6 tem uma eficiência diferente para as diversas
funções biológicas. A incorporação na dieta de proporções ideais de AG ω6 e ω3 oferece
benefícios profilácticos e terapêuticos para animais de estimação apresentando condições
inflamatórias específicas. Ao considerar o uso terapêutico ou profiláctico dos AG nutritivos, é
importante que haja uma compreensão do metabolismo dos AG ω3 no corpo e dos efeitos
da administração de uma dieta contendo um perfil ajustado de AG. A relação entre eles
determina as proporções relativas dos respectivos metabolitos pró-inflamatórios (AG ω6) e
menos inflamatórios (AG ω3) que são produzidos. Num estudo de Reinhart e Davenport
(1998), cães alimentados com dietas contendo relação ω6 para ω3 entre 5:1 e 10:1,
aumentaram as concentrações dos ácidos gordos ω3 EPA e DHA nas mucosas intestinais e
do cólon. Esta e outras descobertas experimentais estabeleceram uma lógica no uso de
dietas com proporções óptimas de ácidos gordos ω6:ω3 em muitas condições inflamatórias,
como a DII e colite.
2.4.3 Fibras
As fibras da dieta são polissacáridos de origem vegetal, resistentes à digestão no ID e que
chegam ao cólon indigeríveis. Estes carbohidratos indigeríveis são estruturalmente
semelhantes ao amido e a outros carbohidratos digeríveis, uma vez que são compostos por
30
cadeias de moléculas de açúcares unidas entre si. Mas, contrariamente aos carbohidratos
digeríveis (que são unidos por uma ligação α que se quebra facilmente por acção da α-
amilase dos mamíferos), os açúcares nas fibras da dieta encontram-se unidos por uma
ligação ß. As ligações ß entre as moléculas de açúcares não são digeríveis pelas enzimas
digestivas dos mamíferos, mas são quebradas pelas enzimas bacterianas, e desse modo,
tais substratos permanecem intactos até serem fermentados pelas bactérias (Maulden, Gore
& Roos, 2008). Duma forma geral, as fibras têm influência nos seguintes factores: saúde
intestinal e saúde geral; consistência e volume fecal; digestão e absorção de nutrientes;
ingestão de alimentos; tempo de trânsito intestinal. A sua produção de AGCC influencia a
estrutura da mucosa intestinal, a composição da microflora intestinal e a saúde do intestino.
Devido às diversas características e funções das fibras, não se pode dizer qual é a fonte de
fibra ideal, mas sim, qual a melhor fibra para determinada função.
As fibras dietéticas podem ser classificadas de diversas formas, embora a mais comum se
baseie na solubilidade da fibra na água (insolúvel ou solúvel) ou na sua fermentabilidade por
microorganismos (fermentável ou não fermentável). A funcionalidade das fibras da dieta
relaciona-se com estas duas características. Apesar de existirem excepções, em geral, as
fibras mais solúveis tendem a ser as mais fermentáveis. As fibras altamente solúveis
encontram-se nas pectinas, gomas, psyllium e oligofrutoses. Como absorvem água, estas
fibras promovem a gelatinização do bolo alimentar e maior hidratação das fezes, podendo
reduzir a digestibilidade do alimento (se o teor da fibra for elevado). A fibra solúvel possui
como características gerais: diminuir a velocidade de esvaziamento gástrico e o tempo de
trânsito intestinal; atrasar a absorção de nutrientes; aumentar a retenção de água, podendo
melhorar a consistência fecal (Maulden et al., 2008). A relação entre os benefícios
potenciais e os malefícios do emprego das fibras solúveis tem a ver com o tipo de fibra,
especialmente a sua taxa de fermentação, e, principalmente, com a quantidade adicionada
na dieta. Quantidades elevadas podem reduzir a digestibilidade da dieta e promover a
ocorrência de diarreias.
As fibras insolúveis são basicamente compostas por celulose, hemicelulose e outros
polissacáridos estruturais. São resistentes à fermentação, e por isso aumentam o volume
fecal (diminuem a digestibilidade da matéria seca) e normalizam o tempo de trânsito
intestinal. Os benefícios principais da fibra insolúvel são manter a regularidade e promover a
expulsão de toxinas e carcinogénios para fora do TGI. Apresentam pouco efeito no
esvaziamento gástrico e absorção de minerais. As fibras insolúveis tendem a adsorver água
(não gera viscosidade) e adicionar volume ao conteúdo intestinal e às fezes, o que traz
vários benefícios para a saúde GI. O volume estimula a motilidade gastrointestinal e os
movimentos peristálticos, prevenindo a estase intestinal e promovendo hábitos intestinais
regulares. O efeito esponja da água adsorvida ajuda a amolecer o conteúdo fecal,
favorecendo a sua passagem. Além disso, o volume fornece um efeito de diluição para
31
qualquer toxina endógena ou exógena que possa estar presente no intestino, reduzindo
assim a probabilidade de efeitos adversos (Maulden et al., 2008). O efeito da fibra na
motilidade intestinal colabora na regulação do trânsito no estômago, ID e IG, e controla
muitos casos de colite. Os mecanismos pelos quais a fibra insolúvel colabora na resolução
das colites incluem: retenção de água e massa bacteriana, que é eliminada nas fezes;
estimulação intraluminal física que colabora para o restabelecimento e coordenação
neuromuscular e endócrina do trânsito intestinal; absorção de resíduos tóxicos e irritativos
presentes no intestino (Carciofi, 2005).
Muitos ingredientes fibrosos nos alimentos contêm quantidades diferentes de fibras solúveis
e insolúveis. Do mesmo modo, o grau de fermentabilidade das fibras nos alimentos para
cães e gatos também varia. A celulose passa por pouca fermentação, a polpa de beterraba
é moderadamente fermentável, enquanto as pectinas e a goma-agar têm fermentação alta e
rápida (Laflamme, 2008). Fibras de baixa fermentação e insolúveis podem ser empregues
em maior quantidade, com menor interferência no funcionamento gastrointestinal. De modo
geral, recomenda-se o emprego de fibra de moderada fermentação e solubilidade,
agregando os benefícios destas duas características à dieta do animal. Em situações de
diarreia de ID recomenda-se pouca fibra (<2-3%), de modo a se aumentar a digestibilidade,
e para diarreia de IG maior quantidade deste nutriente (>8-10%), o que poderia favorecer a
função do cólon. Uma recomendação empírica seria a suplementação da dieta com 2% de
fibra de psyllium, na matéria seca, uma fonte de fibra de elevada solubilidade e baixa
fermentação (Carciofi, 2008e).
Uma vez no cólon e dependendo de suas características químicas, os polissacáridos podem
ser hidrolizados e fermentados pelas bactérias do cólon, produzindo AGCC (acetato, butirato
e propionato), juntamente com dióxido de carbono, metano, e gases hidrogenados, o que
gera energia para o crescimento microbiano. Assim, as fibras fermentáveis da dieta
funcionam como substrato para a produção de AGCC que são importantes para o
metabolismo do cólon. As fibras fermentáveis promovem melhor nutrição do cólon, com
aumento de sua massa e área de absorção, diminuem o pH local e aumentam a
concentração de bactérias benéficas, favorecendo a absorção de nutrientes e a redução da
água fecal (Laflamme, 2008). Estudos in vitro e in vivo demonstram que os produtos
intermediários e finais da fermentação realizada pela microbiota intestinal dependem da
composição química do carbohidrato. Assim, a fermentação do amido produz elevada
quantidade de butirato, enquanto um substrato mais oxidado como a pectina produz maior
quantidade de acetato. Outros factores que podem contribuir para a utilização de
polissacáridos pela microbiota incluem a solubilidade do polissacárido em água, o tipo de
processo submetido ao alimento e o tamanho da partícula que chega ao intestino (Teshima,
2003).
32
2.4.3.1 Ácidos Gordos de Cadeia Curta
A energia proveniente dos AGCC, que pode ser utilizada pelas células intestinais, fígado e
músculos, é de aproximadamente 1,5 a 2,0 Kcal/g de fibra fermentável da dieta. A
quantidade de AGCC produzida depende da taxa e da extensão da degradação dos
polissacáridos pelas bactérias, o que depende da composição química da fibra, sua
quantidade e do tipo e quantidade de microbiota no lúmen intestinal. Além disso, a
proporção de cada AGCC produzido varia entre indivíduos e depende da idade, do género e
do tipo de polissacáridos ingeridos. O tipo de fibra, na sua composição de monossacáridos,
sua estrutura e grau de polimerização influenciam a espécies de bactérias, a proporção de
AGCC produzidos, o local e a velocidade de sua produção. Desta forma, o efeito final da
dieta depende do tipo de AGCC e das concentrações produzidas (Carciofi, 2008a). O ácido butírico é a principal fonte de energia para os colonócitos, podendo representar até
70% de seu consumo energético (Swanson & Fahey, 2007). O ácido acético e propiónico
são prontamente absorvidos e entram na corrente sanguínea, sendo fonte de energia extra
para o hospedeiro. A produção destes AGCC mais a produção de ácido láctico determinam
o pH no lúmen intestinal (5,5 a 7,5). As necessidades energéticas do cólon são supridas por
ordem decrescente de utilização, pelo ácido butírico (4,5 vezes mais que glicose), ácido
acético, glutamina e glicose. O butirato é particularmente importante para melhorar a saúde
digestiva, ajuda a manter a integridade da mucosa do cólon e contribui na modulação da
imunidade da mucosa do TGI (Gomes, 2009). É um regulador importante do crescimento e
diferenciação celular, colabora na manutenção de um fenótipo celular normal, inibe o
desenvolvimento de células do colón malignas (NRC, 2006) e possui propriedades anti-
inflamatórias. O ácido butírico é necessário para a remoção de sódio do lúmen do colón e a
presença deste ácido no cólon pode prevenir a diarreia osmótica.
Os AGCC estimulam directamente a maturação, a proliferação e diferenciação de
colonócitos in vitro e in vivo e sua apoptose. Também estimulam o fluxo sanguíneo
mesentérico e diminuem a permeabilidade intestinal. O consumo de fibra fermentável
aumenta o peso e tamanho da mucosa, que pode contribuir para melhorar a absorção de
nutrientes e optimizar a função celular intestinal. Uma propriedade muito importante dos
AGCC é o seu efeito trófico, ao promover o crescimento do epitélio intestinal e o turnover
celular no intestino grosso. O butirato é o que tem efeito trófico mais eficaz, aumentando a
área superficial de absorção, o que pode facilitar as funções de secreção e absorção do IG.
Outras funções dos AGCC incluem: proliferação de enterócitos, alteração da actividade
muscular no cólon, estimulação da síntese proteica e da produção de mucina, assegurando
a saúde da população de células e a existência de uma barreira física de protecção eficaz
(Topping & Clifton, 2001). Os AGCC estimulam a expressão do gene enteroglucagon da
mucosa intestinal. O Glucagon-like peptide-2 (GLP-2), um produto desse gene, é um péptido
trófico para as células epiteliais intestinais. As acções sistémicas dos AGCC podem
33
sustentar a estimulação do crescimento da mucosa jejunal e ileal com administração
intravenosa destes ácidos gordos. A administração enteral de AGCC, fibras ou
oligossacáridos, previne a falha da barreira intestinal associada com a nutrição parenteral
em roedores (Tappenden, Drozdowski, Thomson & McBurney, 1998).
2.4.3.2 Efeitos benéficos da fibra sobre a absorção de minerais
As fibras fermentáveis podem apresentar efeito positivo sobre a absorção dos
macrominerais cálcio e magnésio assim como na absorção dos microminerais ferro, cobre e
zinco. O aumento da absorção de minerais em resposta à ingestão de fibra fermentável
resulta de dois mecanismos principais (Scholz-Ahrens et al., 2001). Em primeiro lugar, a
fermentação das fibras diminui o pH no ceco, o que aumenta a solubilidade dos minerais,
acentuando-se a absorção mineral. Sustentando esta teoria, Abrams et al. (2007)
demonstraram que o aumento na absorção de cálcio ocorre principalmente no cólon. Em
segundo lugar, o aumento na altura das criptas e das vilosidades e uma maior quantidade
de células epiteliais por cripta são efeitos já conhecidos das fibras fermentáveis. Como
resultado, a absorção passiva de cálcio, fósforo e magnésio pode aumentar. O aumento de
absorção de minerais parece ser um benefício de várias fontes de fibra fermentável. São
exemplos os estudos da relação de: frutanos tipo inulina, a lactulose, o maltitol, os
transgalactooligossacáridos, a polidextrose que melhoraram a absorção do cálcio nos
intestinos; o amido resistente e goma-agar com cálcio e magnésio (Zentek, Marquart &
Pietrzak, 2002b). No entanto, vários estudos já demonstraram, também, diminuição da
absorção mineral em dietas ricas em fibra, por poder resultar em aumento da taxa de
passagem, retenção de água e minerais no lúmen intestinal e adsorção de minerais pela
fibra. Deste modo, um balanço entre possíveis benefícios e malefícios deve sempre ser
considerado na escolha tanto do tipo como da quantidade de fibra a ser adicionada no
alimento.
2.4.4 Minerais
Níveis adequados de zinco e selénio na dieta parecem ser muito importantes para a
manutenção da intensa actividade metabólica da mucosa intestinal e das suas propriedades
digestivas e de protecção. O zinco é necessário para uma variedade de funções fisiológicas
e bioquímicas, incluindo a manutenção da barreira intestinal e da função imune associada
ao intestino, a redução do stress oxidativo, e a inibição da apoptose. O TGI é o local mais
importante para a regulação da homeostase do zinco. O zinco é um co-factor de centenas
de enzimas, entre elas a timidina-quinase, as ADN e ARN polimerases (Laflamme, 2008).
Entre estas enzimas encontram-se algumas das peptidases envolvidas na digestão de
proteínas. Portanto, o nível adequado de zinco na dieta é importante para promover a
digestão apropriada e a utilização das proteínas da dieta (Guyton, 2006). O zinco é um
componente importante na estrutura e funcionamento da membrana celular, e tem funções
34
essenciais no crescimento e replicação celular. Participa na síntese de proteínas e os
"dedos de zinco” que regulam a transcrição dos genes, são importantes na regulação da sua
expressão. Assim, o zinco é importante para a divisão rápida das células com um alto índice
de turnover, como as células epiteliais GI e as células do sistema imunitário (Laflamme,
2008).
A suplementação com zinco pode proteger contra lesões intestinais provocadas por
bactérias patogénicas in vitro e por colite tóxica in vivo. Estas condições inflamatórias
aumentam a permeabilidade intestinal e as citoquinas pro-inflamatórias, que são
compensadas pelo zinco (Rohweder, Runkel & Fromm, 2003). A absorção deficiente de
gorduras da dieta ocorre secundariamente à deficiência de zinco, com acumulação de
lípidos nos enterócitos. A absorção da vitamina A e do β-caroteno e a condição nutricional
podem ser comprometidas com a deficiência de zinco, sendo que deficiência de vitamina A
também pode comprometer a função intestinal. Alterações funcionais na mucosa do TGI têm
sido observadas em animais com deficiência de zinco, tais como ulceração, edemas e
inflamação, bem como lesões oxidativas. O zinco funciona como antioxidante e protege da
peroxidação lipídica. Tem um papel na remoção dos radicais livres, como constituinte
intrínseco da superoxido-dismutase ou através da prevenção da formação de dissulfetos
que disparam a formação de RL. A glutationa peroxidase diminui com a deficiência de zinco,
o que leva a um aumento na peroxidação lipídica. A deficiência de zinco na dieta é
frequentemente associada a má nutrição calórico-proteica, que altera a capacidade para
absorver zinco na mucosa do ID em animais e causa má absorção generalizada devido à
atrofia morfológica da mucosa intestinal (Wapnir, 2000).
A deficiência de selénio pode comprometer o sistema antioxidante da glutationa, já que o
selénio é um co-factor integrante da enzima glutationa-peroxidase (GP) do sistema
tioredoxina-redutase. A GP catalisa a degradação de peróxidos, impedindo que estes
causem dano à membrana celular. A vitamina E ajuda ao estabilizar a membrana e evita a
sua peroxidação. O selénio destrói os peróxidos e remove a sua acção sobre a membrana
celular. O TGI sintetiza e secreta de forma activa a GP, que combate os radicais livres e
reduz o peróxido de hidrogénio e os peróxidos orgânicos. Estes radicais aumentam nas
afecções do cólon, e os pacientes com DII podem apresentar níveis baixos de selénio. A
absorção do selénio dá-se no duodeno e é eficiente (35 a 85%). O selénio também cumpre
um papel importante na protecção do TGI e outros órgãos contra a carcinogénese. Embora
se desconheçam os mecanismos para isso, a deficiência de selénio encontra-se associada
à supra-regulação na expressão do ARNm de muitos genes envolvidos em lesões do ADN,
ao stress oxidativo, ao controlo do ciclo celular e à inibição de genes envolvidos na
destoxificação (Rao, Puschner & Prolla, 2001).
35
2.4.5 Vitaminas A vitamina A exerce papel central na integridade das células epiteliais e na função
imunológica. No intestino, a sua deficiência pode comprometer sua função, reduzir a divisão
e diferenciação das células intestinais, e alterar a barreira protectora formada pelo TGI
(Laflamme, 2008). Mesmo a deficiência ligeira de vitamina A pode levar a um
comprometimento imune e a um maior risco de diarreia. A suplementação de vit. A em
indivíduos com deficiência nessa vitamina, diminui os riscos de diarreia e disfunção da
barreira intestinal, reforçando o importante papel deste nutriente na reparação e função da
mucosa intestinal. No seu metabolismo, a vit. A dos tecidos animais (ou a sintética) origina o
palmitato de retinal, que é hidrolizado por enzimas pancreáticas no jejuno, e depois é
incorporado em micelas e absorvido por transporte activo como retinol, que segue para o
enterócito onde é re-esterificado e incorporado ao quilomícron.
O β-caroteno (um dos carotenóides precursores da vitamina A) é absorvido e transformado
em retinol e segue o mesmo percurso (no cão, pois o gato não faz esta biotransformação). É
armazenado no fígado, como retinil éster e para ser libertado, é novamente transformado
em retinol e transportado aos tecidos periféricos pela “proteína transportadora de retinol”. O
β-caroteno também tem funções orgânicas: é anti-mutagénico, anti-carcinogénico e
antioxidante (German & Zentek, 2006).
A vit. A e os seus análogos são reguladores nutricionais essenciais do crescimento e
diferenciação das células epiteliais intestinais. A deficiência proteica pode levar a
hipovitaminose A por diminuir o seu transporte. A deficiência de vit. A diminui a altura da
vilosidade do ID e a actividade das dissacaridases. A suplementação de vitamina A tem um
efeito protector nos efeitos iniciais da radiação no ID, o que pode resultar da capacidade da
vit. A para induzir a diferenciação das células das criptas, tornando essas células menos
susceptíveis a um dano genómico. A vit. A regula os estágios iniciais da adaptação intestinal
que se segue a uma ressecção de ID em ratos, aumentando a proliferação celular nas
criptas no intestino (Warden et al., 1997).
A vitamina E é o principal antioxidante biológico lipossolúvel, cumprindo um papel crucial na
manutenção da integridade da mucosa gastrointestinal e da função imunológica intestinal. A
sua absorção no jejuno é mais sob a forma de α-tocoferol, e com a ajuda da bílis e da
secreção pancreática, é nessa forma incorporado em micelas. Tem como funções: a
remoção de radicais livres, participa do metabolismo de ácidos nucleicos e proteínas, e do
metabolismo mitocondrial. Tem papel importante na manutenção e estabilização da
membrana celular, e modula a síntese de prostaglandinas (interfere com a fosfolipase A2).
Os níveis de vit. E adequados para prevenir os sintomas de deficiência (lesões
neuromusculares, anomalias testiculares, degeneração da retina e reabsorção fetal) podem
não ser os adequados para manter os sistemas de protecção, tais como a função
imunológica celular e protecção contra os danos oxidativos (Muir, Husband & Bryden, 2002).
36
As vitaminas hidrossolúveis do complexo B, de forma geral são co-factores para várias
enzimas envolvidas no metabolismo celular e energético. Como tal, estes nutrientes
essenciais são importantes para os tecidos metabolicamente activos do sistema digestivo. A
biotina (vit. B8), por exemplo, é essencial para o turnover celular normal, bem como para a
função imunológica. A deficiência de folato (vit. B9) é um factor de risco de tumor colorectal,
enquanto a sua suplementação pode ser benéfica para a protecção de carcinogénese. A
tiamina (vit. B1) é muito importante para a função digestiva normal, conforme demonstrou a
redução de 42 a 66% na actividade de várias enzimas intestinais da MVM de ratos com
deficiência de tiamina. Enquanto as vitaminas A e E lipossolúveis podem ser armazenadas
no corpo durante um certo intervalo de tempo, as vitaminas hidrossolúveis esgotam-se
rapidamente se não forem supridas com regularidade na dieta. Portanto, uma óptima
manutenção do sistema digestivo e de suas funções de protecção, requer a provisão diária
de uma nutrição completa e balanceada, contendo as vitaminas essenciais (Laflamme,
2008).
2.4.6 Prebióticos
Os prebióticos podem ser definidos como compostos não digeridos por enzimas, sais e
ácidos produzidos pelo organismo animal, mas que são selectivamente fermentados pelos
microrganismos do TGI. É um subconjunto de fibras fermentáveis que diferem das fibras
(polissacáridos) por serem oligossacáridos. Podem estar presentes nos ingredientes da
dieta ou serem adicionados a ela através de fontes exógenas concentradas. Os prebióticos
fornecem benefícios para a saúde que geralmente se associam às fibras da dieta, tais como:
redução dos lípidos sanguíneos; melhor absorção do cálcio da dieta, e possivelmente de
outros minerais: auxílio em várias condições inflamatórias do TGI, melhoria da função de
barreira e do tecido linfóide associado ao intestino (TLAI), aumento da produção de IgA,
além de serem substratos para a produção de AGCC (Gomes, 2009).
O principal modo de acção dos prebióticos é sobre a modulação benéfica da microbiota
nativa presente no hospedeiro, estimulando o crescimento e/ou activando o metabolismo de
bactérias benéficas do TGI. Desta forma, a colonização intestinal indesejável é reduzida,
resultando em menor incidência de infecções e melhor integridade da mucosa intestinal,
tornando-a mais apta para exercer as suas funções de secreção, digestão e absorção de
nutrientes. Os prebióticos também podem causar modificações benéficas nas características
anatómicas do TGI e nas condições luminais, promovendo aumento na área de absorção da
mucosa intestinal devido às suas características tróficas (Gomes, 2009).
Nem todos os carbohidratos dietéticos são prebióticos. Roberfroid (2007) definiu os critérios
para que um ingrediente possa ser assim considerado: a) resistência à ácidez gástrica, à
hidrólise por enzimas dos mamíferos e absorção gastrointestinal; b) fermentação pela
microbiota intestinal; c) estimulação selectiva do crescimento e/ou actividade metabólica das
37
bactérias intestinais que contribuem para a saúde e bem-estar. A resistência, no primeiro
critério, não significa necessariamente que o prebiótico seja completamente indigerível, mas
deve assegurar-se que uma quantidade significativa do composto esteja disponível no IG
para servir como um substrato à fermentação. Embora cada um destes critérios seja
importante, o terceiro é o mais difícil de se comprovar e cumprir.
Os oligossacáridos que resistem à digestão no ID são completamente fermentados pelas
bactérias do colón. Os oligossacáridos mais estudados quanto ao seu efeito prebiótico na
alimentação animal são os frutoligossacáridos (FOS), os mananoligossacáridos (MOS) e os
glicoligossacáridos (GOS). Os FOS são polímeros ricos em frutose, podendo ser naturais,
derivados de plantas (da hidrólise da inulina) ou sintéticos, resultante da polimerização da
frutose. Trabalhos têm evidenciado redução na mortalidade e na colonização intestinal por
Salmonella, na incidência de diarreias e constipação, redução dos lípidos e do colesterol
sanguíneo, bem como aumento na resposta imune, com o uso de FOS na alimentação de
animais de produção (Swanson et al., 2002).
Os MOS e GOS podem ser obtidos a partir da parede celular de leveduras (PCL). Esta
parede celular consiste principalmente de proteína e carbohidratos, sendo os carbohidratos
constituídos por quantidades semelhantes de glicose e manose mais N-acetilglicosamina.
Os MOS consistem de fragmentos de parede celular de Saccharomyces cerevisiae com
uma estrutura complexa de manose fosforilada, glicose e proteína (Swanson & Fahey,
2007). A composição da PCL em MOS, a disponibilidade deste açúcar para a fermentação
microbiana, a dose empregada e sua interacção com a composição e digestibilidade da
dieta como um todo, são factores importantes e ainda não totalmente esclarecidos para
cães. Calabrò et al. (2008), demonstraram que a PCL é efectivamente fermentada pelas
bactérias intestinais de cães, o que é evidenciado pelo aumento de butirato.
Num estudo efectuado em cães por Gomes (2009), a parede celular de levedura não
interferiu na digestibilidade, consumo e qualidade das fezes. A sua adição não resultou em
alterações das populações microbianas das fezes, mas modificou a sua actividade
metabólica, aumentando a concentração fecal de ácido butírico e reduzindo as de histamina,
tiramina, triptamina e feniletilamina. Os efeitos dos oligossacáridos na produção de aminas
são ainda controversos. Diferenças nas composições nutricionais e de ingredientes das
dietas teste, bem como no nível de inclusão e tipo de oligossacárido estudado são
importantes. A redução da concentração de algumas aminas nas fezes dos cães verificadas
pelo consumo de PCL no estudo de Gomes (2009) pode ser considerada importante,
representando alteração positiva do metabolismo bacteriano intestinal dos cães.
Comprovou-se o seu efeito prebiótico, pela mudança na actividade metabólica da microbiota
intestinal e imunoestimulante para cães.
Outros suplementos prebióticos estudados são : lactulose, amido resistente, pectina,
chicória, a inulina e os oligossacáridos relacionados que contêm frutose. Amido resistente
38
refere-se a todos os produtos do amido que escaparam à digestão do ID e parecem dar um
contributo significativo para a produção de AGCC (Laflamme, 2008). A alteração da
microbiota intestinal consequente ao uso de prebióticos pode ocorrer, basicamente, através
de dois mecanismos: pelo fornecimento de nutrientes para as bactérias desejáveis e por
exclusão competitiva. Para que as bactérias indesejáveis consigam colonizar o TGI e criar
uma condição de doença, precisam inicialmente aderir à superfície epitelial dos enterócitos.
Esta adesão ocorre através das lectinas ou fímbrias bacterianas, que reconhecem
determinados açúcares da superfície do epitélio intestinal. Portanto, se as bactérias se
ligarem a um açúcar ou oligossacárido dietético, e não à mucosa intestinal, irão passar com
a digesta sem causar transtornos para os animais (Gomes, 2009).
Desta forma, a exclusão competitiva ocorre quando determinados oligossacáridos, como os
MOS, actuam directamente na fase de colonização de bactérias patogénicas. Os MOS
ligam-se às fímbrias destas bactérias tornando-as indisponíveis para a aderência à mucosa
intestinal, fazendo com que percam a sua capacidade de colonização e sejam eliminadas
junto com as fezes. Os microorganismos gram negativos, como Salmonella e E.coli, são
incapazes de fermentar os FOS e MOS, podendo ter o seu crescimento diminuído na
presença desses produtos, que desta forma podem ser utilizados como depressores do
crescimento microbiano indesejável (Flemming, 2005). A produção de ácidos por bactérias
lácticas é outro mecanismo que pode inibir o crescimento de patogénios, seja pela
diminuição do pH ou pelo efeito directo dos ácidos sobre as bactérias. A colonização e a
diversidade das populações de microrganismos presentes no TGI são influenciadas por
inúmeros factores, entre os quais a disponibilidade de nutrientes, o pH luminal, a presença
de substâncias antibacterianas naturais (bacteriocinas) e a estimulação do sistema
imunitário, estando possivelmente todos estes mecanismos envolvidos na acção benéfica do
MOS e FOS na saúde intestinal de cães.
Silva e Nönrberg (2003) verificaram que eventuais sub-doses de prebióticos podem causar
efeito limitado ou nulo sobre a microbiota. Já uma sobredosagem pode provocar um
desequilíbrio nas populações microbianas. Relatam ainda, que doses elevadas de FOS
causam efeito laxativo e excesso na produção de gases em humanos, o que caracteriza um
desequilíbrio na microbiota do TGI. O efeito adverso mais comum do alto consumo de
prebióticos é a intolerância gastrointestinal (Dzanis, 2003). Uma fonte ideal de fibra
fornecerá os benefícios da fibra e ao mesmo tempo, minimizará os efeitos negativos do
consumo da fibra. Uma fibra dietética que é bem tolerada deverá resultar num mínimo
desconforto intestinal e produção de gases, e fezes de boa qualidade.
2.4.7 Probióticos
Os probióticos podem ser definidos como microorganismos vivos que, quando ingeridos em
quantidades suficientes, alteram positivamente a microbiota intestinal, beneficiando a saúde
39
do hospedeiro (Benyacoub, 2004). Vários probióticos mostraram as suas influências
marcantes na saúde e função imune. Os organismos probióticos são bactérias ácido-
lácticas, como Lactobacillus, Bifidobacterium e Enterococcus sp. Ao contrário da microbiota
residente, os probióticos não colonizam o intestino, não se tornando membros permanentes
da eubiota GI residente. Logo, devem ser consumidos de acordo com as necessidades
actuais do animal para fornecer os seus benefícios para a saúde. Os probióticos têm que ter certas qualidades e ser consumidos em quantidades suficientes
para obter os seus efeitos benéficos e protectores. Um probiótico para ter valor e ser eficaz
tem que ter as seguintes características: sobreviver no TGI; aderir às células epiteliais
intestinais ou localizar-se na mucosa intestinal temporariamente; ser resistente ao pH do
suco gástrico e enzimas proteolíticas digestivas; excluir ou reduzir a aderência de
patogénios; ajudar a atingir o equilíbrio das populações da microbiota normal; ser seguro,
não ser invasivo, não carcinogénico e não patogénico para o animal; ter a sua eficácia
comprovada, ser estável e sobreviver no produto (Benyacoub, 2007).
Os efeitos benéficos dos probióticos na microbiota intestinal dependem do número de bactérias activas que colonizam temporariamente o TGI. A sobrevivência do probiótico varia
e depende do tipo e da localização da colonização no TGI. Estudos em animais e humanos
mostraram que certos probióticos aumentam as contagens fecais de bactérias benéficas,
enquanto diminuem o número de bactérias patogénicas. O equilíbrio da microbiota intestinal
ajuda a assegurar uma função e um tempo de trânsito óptimo, para que o animal possa
proteger-se dos efeitos gastrointestinais do stress. Devem ser feitos estudos cuidadosos
para se determinar a estabilidade dum probiótico e benefícios verdadeiros resultantes para o
animal.
Em contraste com o IG altamente colonizado, há uma população pobre de microbiota no ID
e uma limitada barreira de protecção contra patogénios. Por outro lado, a maioria do TLAI
localiza-se no ID, com a estimulação imunitária a ter lugar preferencialmente na mucosa
intestinal. Assim, os probióticos exercem um importante efeito benéfico no ID, usando
diversos mecanismos para diminuir a aderência e a colonização de patogénios. Eles nutrem
as células intestinais, produzem AGCC que diminuem o pH no TGI, destruindo bactérias
patogénicas e toxinas (as bactérias benéficas geralmente crescem em ambientes mais
ácidos, enquanto as bactérias patogénicas preferem meios com níveis mais altos de pH);
reduzem ou competem pelos nutrientes que os patogénios necessitam; fixam-se a locais de
ligação, tornando-os inacessíveis às bactérias patogénicas; produzem substâncias
antimicrobianas (bacteriocinas e peróxido de hidrogénio, ácido láctico, metabolitos oxigénio-
tóxicos) que inibem a ligação de patogénios entéricos à mucosa intestinal, caracterizando-se
por uma exclusão competitiva de patogénios (Maulden, 2006).
As pesquisas em cães, gatos e outros animais mostraram benefícios e/ou mecanismos
similares aos dados clínicos sobre o uso de probióticos em humanos. Um probiótico do
40
género Enterococcus proporcionou a cães saudáveis alterações benéficas na microbiota
fecal e também alterou os lípidos séricos. Os probióticos interagem com as defesas
imunitárias do hospedeiro e fornecem benefícios para a saúde em diversas condições,
sobretudo as relacionadas com perturbações da eubiota GI. Nos últimos anos, numerosos
estudos em animais e humanos demonstraram a eficácia de vários probióticos no
tratamento de formas comuns de diarreia, sobretudo Lactobacillus GG, Saccharomyces
boulardii e Enterococcus faecium SF68 (Maulden, 2006). Os probióticos são usados com
frequência em nutrição clínica objectivando estabilizar a microecologia intestinal. Evidências
de um estabelecimento temporário destas bactérias indicam que algumas estirpes de
probióticos podem ter efeitos clínicos benéficos em cães com afecções gastrointestinais
crónicas (Sauter et al., 2005).
Certas estirpes probióticas de Lactobacillus podem induzir a uma maior expressão dos
genes MUC2 e MUC3 que promovem a secreção de muco no cólon e inibem a adesão da E.
coli (Deplancke & Gaskins, 2001). Em estudo com cães, Swanson et al. (2002) observaram
que animais que receberam cápsulas de gelatina com Lactobacillus acidophilus tiveram
maiores concentrações de compostos sulfurados voláteis nas fezes. No entanto, quando o
probiótico foi oferecido conjuntamente com o prebiótico FOS ocorreu diminuição de
compostos fecais putrefactivos como as aminas biogénicas, fenóis e indóis. Estes resultados
demonstram que, apesar das evidências dos benefícios do uso dos probióticos em cães,
ainda há necessidade de maiores estudos para comprovar esta acção (Bazolli, 2008).
2.4.8 Enzimas
Enzimas são moléculas proteicas globulares com actividade catalisadora específica. Os
cães não possuem enzimas que digerem os polissacáridos não-amiláceos e por isso, dietas
ricas neste nutriente podem aumentar a viscosidade no ID e dificultar o contacto entre as
enzimas digestivas e o substrato, reduzindo a absorção dos nutrientes (Case et al., 2000)
Além disso, as bactérias presentes no IG podem fermentar estes polissacáridos
aumentando a produção de gases, podendo ocasionar flatulência e amolecimento de fezes.
As enzimas digestivas exógenas actuam basicamente de duas formas: rompendo paredes
celulares e degradando nutrientes. Um dos benefícios da adição de enzimas exógenas à
dieta é a hidrólise parcial dos polissacáridos não-amiláceos o que reduzia a viscosidade do
conteúdo intestinal e poderia aumentar a acessibilidade dos nutrientes para as enzimas
digestivas endógenas (Bazolli, 2008). No entanto, este aspecto ainda não foi
adequadamente comprovado para cães.
2.4.9 Influência de outros nutrientes na composição da microbiota intestinal
Não se pode perder de vista que a dieta como um todo é o factor mais importante que
influencia a composição e actividade da microbiota gastrointestinal. Do mesmo modo que
41
esta microbiota tem um papel na saúde do hospedeiro suportando o processo da digestão,
ela pode ser um factor de patogénese do intestino. Assim, a composição química e os
ingredientes da dieta, quantidade e qualidade das proteínas, carbohidratos digestíveis,
processamento dos alimentos e aditivos devem sempre ser considerados (Duggan, Gannon
& Walker, 2002). Dietas com altos teores de proteína de baixa digestibilidade favorecem o
crescimento de bactérias proteolíticas, especialmente Clostridia. O consumo de dietas de
alto teor proteico, sobretudo de fontes de proteína de origem animal favorece o crescimento
de Clostridium perfringens e diminui as contagens fecais de bifidobactérias e algumas vezes
de Lactobacilli (Zentek, Molitor & Kamphues, 1998). Nestas circunstâncias, a consistência
fecal piora e a excreção de enterotoxinas de C. perfringens e outros produtos metabólicos
relacionados com a decomposição bacteriana de proteínas aumenta (Zentek et al., 2003).
Os níveis de gordura e seu impacto potencial na microbiota intestinal ainda não foram
adequadamente investigados, mas é esperado que seu efeito seja mínimo ou que tenha um
efeito depressor na actividade da microbiota intestinal. O tipo e processamento do alimento
também foi estudado quanto aos seus efeitos na microbiota intestinal. Cães adultos que
comeram uma dieta seca extrusada, tiveram baixo pH e indol fecal, baixas concentrações de
sulfito e amónia e aumentos de AGCC totais, comparando com cães que comeram uma
dieta enlatada. Os marcadores fecais do metabolismo microbiano, β-glicosidase, β-
glicuronidase, β-galactosidase e nitroreductase fecais tiveram as suas actividades
aumentadas em cães com dieta seca (Zentek, 1995). Estas alterações na actividade
metabólica microbiana são consistentes com os efeitos benéficos da dieta seca na saúde do
cólon (Martineau & Laflamme, 2002).
3. A IMPORTÂNCIA DO INTESTINO NA SAÚDE E IMUNIDADE
O TGI e outras superfícies mucosas e epiteliais fornecem uma primeira linha de defesa
contra o mundo exterior. Para ter acesso ao ambiente interno, patogénios, alergénios e
nutrientes ingeridos devem primeiro passar através do TGI. A membrana mucosa do
sistema digestivo serve como uma barreira protectora que auxilia na prevenção contra a
invasão de patogénios, acção de toxinas e outras substâncias indesejáveis, durante a
digestão e absorção de nutrientes essenciais. A complexa função de protecção é realizada
tanto por meios físicos (não imunológicos) como imunológicos (Laflamme, 2008).
Uma parte importante das defesas do animal provém de sistemas não imunológicos. A
barreira física, fornecida pelas células mucosas do intestino, unidas por junções firmes e
cobertas por uma camada de muco, minimiza a capacidade das substâncias estranhas
entrarem no corpo. Os movimentos peristálticos intestinais, o vómito ou a diarreia ajudam a
expulsar substâncias do TGI. Muitos organismos são destruídos pela acidez extrema do
estômago (barreira gástrica), enquanto outros são destruídos pelas enzimas digestivas do
42
estômago e dos intestinos. Entre as substâncias antibacterianas incluem-se a lisozima,
secreções pancreáticas e ácidos biliares. As bactérias benéficas que normalmente residem
nos intestinos oferecem protecção. A filtração hepática também tem essa função (Gomes,
2009). Pesquisas nutricionais recentes focam-se na regulação das funções anatómicas e
imunológicas da barreira intestinal que protegem contra a invasão dos microorganismos
luminais endógenos e/ou as suas toxinas.
3.1 Imunidade associada à mucosa intestinal
A defesa imunológica do intestino é importante porque este órgão é a via principal de
entrada de antigénios no corpo, tais como as proteínas da dieta, as bactérias, e outros
organismos ou proteínas estranhas. A sua população de células imunitárias é diversa e
inclui: linfócitos T e B, plasmócitos, células dendríticas, macrófagos, eosinófilos e
mastócitos. As respostas imunes são essenciais na protecção contra a invasão patogénica,
e ambas as respostas mediadas por células (síntese de células citotóxicas) e humoral
(produção de anticorpos) podem ser produzidas no órgão (Cave, 2008).
O tecido linfóide associado ao intestino (TLAI) constitui a parte mais extensa e complexa do
sistema imunitário (SI) do organismo, possuindo aproximadamente 80% das células de
defesa do corpo e mais de 50% das células imunitárias efectoras. Pelo menos 25% da
mucosa e da submucosa intestinal são compostas por tecido linfóide (Swanson & Fahey,
2007). O conhecimento da constituição do TLAI permite compreender como se desenvolve e
regula a resposta imunitária no intestino e como esta pode estender-se ao resto do
organismo. O TLAI é composto por: uma área aferente, de tecido linfático organizado com
locais indutores da resposta imunitária (placas de Peyer, linfonodos mesentéricos e folículos
linfóides isolados), onde são seleccionados os antigénios dietéticos e microrganismos
patogénicos; uma área eferente, de tecido difuso com locais efectores que são os linfócitos
intraepiteliais (IEL) e linfócitos da lâmina própria do intestino (com células intraepiteliais -
IEC), através dos quais a imunidade celular e humoral responde ao estimulo antigénico, ou
seja, onde a resposta imune é efectuada. Estas células imunológicas são fundamentais para
a manutenção da barreira mucosa protectora (Laflamme, 2008; Gomes, 2009).
As placas de Peyer são o maior dos tecidos linfóides mucosos. Estas placas contêm todos
os componentes necessários para iniciar uma resposta imunológica: células T, células B e
células dendríticas. As placas de Peyer recolhem os antigénios das superfícies epiteliais do
TGI. Cada tipo de célula tem uma função diferente na reacção imunológica. As células B são
percursoras dos plasmócitos, que produzem anticorpos (imunoglobulinas). Também
funcionam como células apresentadoras de antigénios (APC), como as células dendríticas.
Os antigénios são recolhidos por estas células, processados e levados às células T, que têm
várias funções dependendo do seu tipo específico. As respostas mediadas por células T são
mais eficazes contra patogénios intracelulares, enquanto reacções mediadas por células B
43
são mais efectivas contra os patogénios extracelulares. Além destas células, o contorno
epitelial sobre cada placa de Peyer contém APC especializadas, chamadas células M
(células das vilosidades) que têm um papel no desenvolvimento da tolerância alimentar
(Tizard, 2002). Se os antigénios forem levados às células intestinais, serão rapidamente
degradados por lisossomas. As células M recolhem antigénios do lúmen intestinal e
apresentam-nos directamente aos linfócitos nas placas de Peyer. Isto permite ao SI
desenvolver um reconhecimento apropriado e uma resposta adequada perante aquele
antigénio específico, seja para desenvolver uma tolerância a uma proteína alimentar ou para
armar uma defesa contra o organismo invasor. Erros neste processo podem produzir
alergias ou infecções.
As células B activadas (plasmócitos) produzem imunoglobulinas (Ig). A IgG é o anticorpo
predominante que circula no sangue dos cães, enquanto que a IgA e a IgE encontram-se
sobretudo no TGI e no respiratório. Cerca de 70% a 80% das células produtoras de Ig estão
localizadas no TGI e mais de 60% da produção total diária de imunoglobulinas é de IgA
intestinal. O TLAI é especializado em produzir grandes quantidades de IgA. Esta é a única
classe de anticorpos que é eficientemente secretada através das células epiteliais para o
lúmen do TGI e pode actuar tanto dentro como fora da célula intestinal (Grieshop, 2002). A
partir do estímulo imunológico da mucosa ocorre produção de IgA, principalmente nas
placas de Peyer, que bloqueiam os receptores e reduzem o número de bactérias
patogénicas no lúmen intestinal. A produção constante de IgA ocorre devido a estimulação
contínua pela microbiota normal do intestino. O principal modo de acção da IgA é evitar a
aderência de bactérias e vírus às superfícies mucosas, um processo denominado exclusão
imunológica. Se as bactérias ou os vírus não conseguirem aderir às células epiteliais
intestinais, eles simplesmente passarão pelo conteúdo intestinal e serão expulsos sem
causar qualquer dano. Dentro das células intestinais, a IgA pode ligar-se a vírus e evitar que
se reproduzam e reajam. Além disso, pode ligar-se a bactérias e antigénios estranhos e
transportá-los da célula para o lúmen intestinal (Deshmukh, 2008).
A função principal do TLAI é a defesa do organismo hospedeiro contra diferentes tipos de
agentes infecciosos, incluindo vírus, bactérias, fungos, protozoários e outros parasitas. O
TLAI executa as seguintes actividades: 1) captura, processamento e apresentação de
antigénios que estiverem no intestino; 2) produção de anticorpos locais, em especial da
classe IgA; 3) activação de respostas imunes cito-mediadas, particularmente as mediadas
por células T citotóxicas CD8+, ou de células NK (natural killer) e por macrófagos (Gomes,
2009). O TLAI controla a invasão patogénica e induz tolerância oral em resposta a
antigénios inofensivos da dieta e do epitélio intestinal. A mucosa intestinal é exposta a
numerosos factores exógenos e tem mecanismos reguladores diferenciados, que permitem
uma permeabilidade selectiva para os nutrientes e certas macromoléculas, mas também a
exclusão duma potencial dieta prejudicial ou de antigénios bacterianos ou do ambiente.
44
A descriminação na mucosa intestinal de absorção e exclusão, tolerância e reactividade é
resultado de processos reguladores complexos que dependem da idade do indivíduo, de
mecanismos funcionais e reguladores do SI e da influência de factores externos. A
interacção entre factores luminais de origem dietética ou bacteriana e a parede da mucosa é
de particular importância (Zentek et al., 2002a). Antigénios dos alimentos exógenos e
microrganismos têm capacidade de interagir com a parede da mucosa e induzir reacções e
processos reguladores. Esta interacção influencia a digestão (secreção, absorção,
motliidade), mecanismos imunológicos (exclusão de antigénios, regulação do TLAI,
processamento de antigénios, sensibilidade, alergia) e processos neuroendócrinos (Cave,
2008). A estimulação do sistema imunitário dentro do TGI também pode provocar efeitos
sobre todo o corpo. Os plasmócitos activados migram para a corrente sanguínea e para
outras partes do corpo. Deste modo, a apresentação de antigénios numa área de superfície
(a mucosa intestinal) pode resultar na síntese de anticorpos e em reacções secundárias
noutros locais. Por exemplo: as células B apresentadas podem migrar para a glândula
mamária e promover a produção de IgA secretada no leite. Isto pode fornecer uma
protecção importante contra patogénios intestinais em recém-nascidos lactentes (Tizard,
2002).
3.2 Microbiota do TGI
A microbiota GI tem um papel fundamental no desenvolvimento normal do SI do animal
hospedeiro. O desenvolvimento do TLAI é altamente dependente da colonização bacteriana
do intestino. Os animais impedidos de criar uma microbiota GI normal - gnotobióticos (germ-
free) - não desenvolvem um SI normal. Apresentam morfologia intestinal anormal e SI local
subdesenvolvido, incluindo diminuição no número total de linfócitos intestinais, perfil de
anticorpos alterado e placas de Peyer subdesenvolvidas. Os seus órgãos linfóides são
subdesenvolvidos e seus níveis de imunoglobulinas são apenas 2% do normal (Swanson &
Fahey, 2007). As bactérias residentes no TGI exercem uma influência considerável sobre a
saúde e estado imunológico do cão. Quando um animal nasce, o seu TGI é estéril. Depois
de um ou dois dias de vida, todo o seu tracto digestivo é povoado por microorganismos
provenientes do meio ambiente. Os organismos específicos mudam com a maturidade do
hospedeiro e são influenciados por factores ambientais e maternos. Após o desmame, a
composição da microbiota assemelha-se com a da eubiota adulta. A eubiota fornece o
estímulo principal para o desenvolvimento e maturação das células linfóides nas placas de
Peyer, bem como para os linfócitos produtores de IgA. Estes linfócitos modulam as reacções
imunológicas específicas e permitem a indução da tolerância oral aos antigénios do
alimento. Certas espécies e estirpes de bactérias GI, incluindo Bifidobacterium, Lactobacillus
e outras, podem alterar respostas imunológicas sistémicas, como as concentrações de
anticorpos no soro. A microbiota normal ajuda a prevenir o crescimento excessivo de
45
bactérias potencialmente patogénicas que podem promover diarreias, colite ou translocação
bacteriana (Buddington, 2003).
Dois dos mecanismos pelos quais a microbiota normal ajuda a proteger a saúde do animal
hospedeiro são a diminuição do pH no colón e a produção de AGCC. Os AGCC cumprem
um papel directo na regulação do TLAI. O butirato estimula a catalase que destoxifica
produtos do stress oxidativo, melhorando a resposta dos genes em situações de stress
oxidativo e metabólico (Sauer, Richter & Zobel, 2007). O butirato inibe a IL-6 e a expressão
de ciclooxigenase-2 (COX-2) nas células expostas a toxinas lipopolissacáridos (LPS). A IL-6
é uma citoquina inflamatória, enquanto a COX-2 é uma enzima que limita a taxa responsável
pela produção excessiva de prostaglandina PGE2, durante períodos de inflamação. Estes e
outros efeitos auxiliam a função directa dos AGCC na modulação da imunidade mucosal do
TGI. O butirato inibe a COX-2 e estimula a catalase, o que protege as células dos danos
oxidativos. A inibição da COX-2 é promotora de processos anti-inflamatórios. (Knudsen et
al., 2003).
3.3 Nutrição e função imunitária
A interacção entre nutrição e o SI efectua-se a vários níveis. Consideremos quatro níveis,
sendo o 1º e 2º níveis passivos, porque envolvem o fornecimento de nutrientes essenciais
para permitir que o SI funcione bem; os 3º e 4º níveis são activos, com uma abordagem que
objectiva a modificação imunológica.
1º nível - Nutrição completa: dá-se importância à energia dietética, proteínas, vitaminas,
microminerais e macrominerais;
2º nível - Optimização de macro e micronutrientes: envolve a optimização de nutrientes que
são essenciais para as células imunitárias;
3º nível - Modulação activa do SI: a abordagem é interagir activamente com o SI na tentativa
de modular a sua função em direcção a um determinado objectivo.
Exemplos: 1) Indução polarizada à célula Th1, permitindo uma apresentação antigénica
eficiente já que a resposta Th1 (pró-inflamatória) é importante para proteger contra
infecções microbianas. O componente Th1 é impulsionado pela estimulação do SI com
modificadores da resposta imune (IRM), tais como β-glucanos da levedura e probióticos
(Benyacoub et al., 2003). Os bioactivos de colostro de bovinos têm efeitos de estimulação
imune em estudos em humanos e ratos e são IRM interessantes. O colostro contém
imunoglobulinas, citoquinas, lactoferrina e lactoperoxidase, cada uma das quais pode
influenciar o SI (Artym, 2003);
2) Modular a inflamação para prevenir danos: uma dieta rica em ácidos gordos ω3, pode
controlar os efeitos danosos da inflamação devido à redução dos níveis activos de
mediadores dos efeitos inflamatórios (Casserly, Topol & Lancet, 2004); 3) Modificações
específicas da doença: a promoção de um equilíbrio imunitário menos inflamatório
46
(direccionado a Th2) em animais com DII, usando recursos da dieta são um exemplo de
uma abordagem objectiva da imunomodulação. Algumas bactérias probióticas induzem a
secreção de citoquinas anti-inflamatórias, como IL-10, TGF-β e IL-13.
A doença inflamatória intestinal (DII) crónica é idiopática, mas a hipótese mais consistente é
a perda da tolerância imunológica face à eubiota do intestino, o que conduz a uma reacção
imunitária anómala ao microambiente intestinal. Há evidências de alterações nas
populações de células imunitárias na enterite linfo-plasmocítica, incluindo aumento nas
células T da lâmina própria (sobretudo CD4+), plasmócitos IgG+, macrófagos e granulócitos.
Há também aumento da expressão de citoquinas da mucosa como Th1 (IL-2, IL-12, IFN-λ),
Th2, pró-inflamatórias (TNFα) e imunoreguladoras (TGF-β). Isto sugere uma desregulação
do SI, mas não confirma como surgiu (German & Zentek, 2006).
4º nível - Nutrição personalizada: nutrição preditiva, preventiva e personalizada. As
interacções entre dieta, ambiente e genoma definem o estado de saúde influenciando
criticamente doenças crónicas. Para uma estratégia prática de dieta personalizada, há dois
requisitos básicos: um entendimento claro da patogénese da doença e da disponibilidade de
biomarcadores confiáveis da doença para diagnosticá-la ou identificar a susceptibilidade. Os
biomarcadores são indicadores objectivos que medem os processos biológicos normais,
processos patológicos ou respostas farmacológicas à intervenção terapêutica. O último
objectivo é modificar a fisiologia através deste regime dietético “personalizado” antes do
animal entrar na doença, prevenindo, atrasando ou monitorando a doença e assim melhorar
a qualidade de vida (Ames, 2001; Milner, 2004).
3.4 Interacção entre nutrição, imunocompetência e doenças
Existe uma relação dinâmica entre doença, nutrição e imunidade (Figura 6). Uma doença
primária leva ao aumento do catabolismo e das necessidades nutricionais, estado
denominado hipermetabolismo, que frequentemente é acompanhado por anorexia. A
associação destes factores culmina com um acelerado consumo e perda das reservas
nutricionais do organismo, resultando em desnutrição. A desnutrição proteico-energética é
resultado de um baixo consumo de alimentos, que resulta na deficiência de calorias e
aminoácidos. Os efeitos da má nutrição calórico-proteica tendem a ser específicos para
cada tecido e podem tornar-se generalizados quanto maior for a demora na sua correcção.
Longos períodos de privação alimentar culminam em grande mobilização de aminoácidos,
que são utilizados na síntese de ADN e ARN, na produção de proteínas de fase aguda e de
energia (gliconeogénese), agravando ainda mais o estado de desnutrição (Seim & Bartges,
2003).
47
Figura 6 - Inter-relação entre desnutrição, imunossupressão e infecção (Carciofi, 2007a)
Na desnutrição “simples”, ou desnutrição não acompanhada de doença, a oxidação de
gorduras é acompanhada por cetogénese e reduzida degradação proteica. Quando a
desnutrição e o hipermetabolismo - consequente às doenças - ocorrem ao mesmo tempo
(“desnutrição-stress”), a degradação proteica não é suprimida e pode mesmo acelerar-se
ainda mais. Como não há armazenamento de proteína no corpo, os substratos para a
gliconeogénese são obtidos à partir de tecidos estruturais e funcionais. O catabolismo de
tecido muscular periférico pode sustentar o paciente por um período, até que funções vitais
começam a ser afectadas. Sistemas orgânicos que dependem de um turnover celular
rápido, tais como o intestino e o SI, são mais vulneráveis. A combinação de função imune
deprimida e a falha da barreira da mucosa gastrointestinal apresenta graves consequências
para o prognóstico do paciente. O TLAI sofre depleção e há uma redução na secreção de
IgA, aumentando-se os riscos de translocação bacteriana do lúmen intestinal, através da
mucosa comprometida, para o sangue portal (Carciofi, 2007a). A resposta imune é
dependente de replicação celular e da síntese de compostos proteicos activos. Desta forma,
é fortemente afectada pelo estado nutricional do animal, que determina a habilidade
metabólica celular e a eficiência com que a célula reage aos estímulos, iniciando e
perpetuando o sistema de protecção e autoreparação orgânicas.
São consequências das deficiências nutricionais na imunocompetência: a diminuição de
anticorpos humorais e da superfície de mucosas, da imunidade celular, da capacidade
bactericida de fagócitos, da produção de complemento, do número total de linfócitos, do
equilíbrio da proporção e relação dos subtipos de linfócitos T (helper, supressor, citotóxico,
NK). Também são afectados os mecanismos inespecíficos de defesa, que incluem as
barreiras anatómicas da pele e mucosas, a microbiota intestinal, as substâncias secretoras
48
(como linfocina, suco gástrico e muco), a febre, as alterações endócrinas e o sequestro de
ferro sérico e tecidual. O sistema antimicrobiano dos neutrófilos é afectado pela desnutrição,
tanto os sistemas oxigénio-dependentes como os oxigénio-independentes (lactoferrina,
lisozimas, hidrolases e proteases). Geralmente, o SI é o primeiro a sofrer alterações na
desnutrição, respondendo antes mesmo que o sistema reprodutor (Carciofi , 2007a).
3.5 Imunomodulação - Regulação Nutricional da Imunidade
Devido ao papel vital que o SI tem de forma benéfica, ou em certas doenças (como as auto-
imunes) de forma prejudicial, é importante entender como a nutrição afecta a imunidade na
saúde e na doença. Esta interacção é complexa, bidireccional, mas não completamente
compreendida. A nutrição afecta directamente a resposta imune através de três formas:
estímulo, inibição ou alterando a natureza da resposta. A diminuição da resposta imune
pode ser benéfica para doenças de hipersensibilidade (alimentar ou atopia) ou pela inibição
da activação imune sistémica (como na síndrome da resposta inflamatória sistémica - SIRS).
A melhoria da resposta imune também pode ser desejável para prevenir ou eliminar
infecções por microrganismos, ou na imunidade para o controlo do desenvolvimento de um
tumor. Por outro lado, a modulação da imunidade pode ser prejudicial ou até fatal para o
hospedeiro. A imunossupressão face à infecção pode conduzir a morbilidade prolongada ou
até a sepsis. O acentuar da imunidade pode conduzir ao aumento do perigo nos estados
caracterizados por excessiva ou fraca activação imune regulada (SIRS, reacções de
hipersensibilidade). Assim sendo, uma dieta não pode preencher todas as necessidades
(Cave, 2008).
Vários estudos demonstraram o impacto agudo da privação de nutrientes na função imune e
a reversão do comprometimento imune através de uma nutrição apropriada. As pesquisas
actuais em nutrição de suporte começam a focalizar-se mais nos efeitos dos processos
metabólicos de modulação em órgãos específicos do que a simples melhoria da nutrição
(Saker, 2006). Os efeitos de nutrientes específicos no SI são promissores neste aspecto.
Muitos deles têm um papel na função imune e para alguns deles já estão bem definidos os
mecanismos da imunomodulação. Os receptores imunitários no intestino servem como
principais alvos para a imunomodulação através da dieta. Por exemplo, agonistas dos
receptores toll-like (TLR) como os -glucanos da levedura, mananos da levedura, ácidos
nucleicos e probióticos são grandes exemplos de modificadores da resposta imune (IRM).
Estes IRM iniciam a secreção de citoquinas que activam as APC locais, possibilitando que
elas apresentem os antigénios aos linfócitos T e iniciem uma resposta imune eficaz. A
melhoria da função imune induzida pelos IRM dietéticos pode difundir-se a todo o SI através
de linfócitos activados e citoquinas. Assim, as células imunitárias conduzem as mensagens
do TLAI ao resto do SI (Saavedra, 2007).
49
3.6 Efeito dos Nutrientes em funções e componentes do Sistema Imunitário
3.6.1 Proteínas e aminoácidos
Todas as formas de imunidade são afectadas pela má nutrição e em particular pela
deficiência nutricional de proteínas e energia. As proteínas são importantes para manter a
funcionalidade e responsividade da maior parte das células do SI. As imunoglobulinas são
proteínas que desempenham um papel crucial na resposta imunológica adaptativa. A
anorexia associada a mudanças endócrinas, sobretudo representadas pelo aumento do
glucagon, hormona de crescimento e corticosteróides circulantes, conduz o animal doente a
um balanço nitrogenado negativo (Carciofi, 2007b). Este é decorrente do catabolismo de
aminoácidos oriundos da degradação das proteínas de reserva do organismo. Várias
citoquinas, sobretudo a IL-1 e o factor de necrose tumoral (TNFα) também contribuem para
este processo. No organismo, ocorre um redireccionamento dos aminoácidos, que passam a
ser uma importante fonte de energia, num processo denominado gliconeogénese (Remillard,
Armstrong & Davenport, 2000). Este processo resulta na perda de massa corporal magra e,
com ela, a redução de resposta imune. Os efeitos da deficiência proteica sobre o SI incluem:
atrofia do timo e órgãos linfóides, inadequada produção de anticorpos, diminuição da
concentração plasmática de imunoglobulinas, da secreção de IgA e da produção de
complemento, barreiras mecânicas, muco e lisozima; decréscimo na proliferação linfocitária,
das respostas mediadas por células e na produção de citoquinas (ex. IL-1, IL-2, IFN-λ)
redução da migração de neutrófilos e redução na resposta de hipersensibilidade dérmica
tardia (DTH). Se considerarmos que a expansão clonal do SI depende de síntese proteica e
que as citoquinas são constituídas por aminoácidos, é fácil compreender porque uma
ingestão inadequada de proteínas leva a tão grande comprometimento imune (Brunetto,
Gomes, Jeremias, Oliveira & Carciofi, 2007).
3.6.1.1 Glutamina
A glutamina é o principal composto neoglicogénico, aumenta as vilosidades intestinais e
melhora o TLAI. As concentrações de Gln no plasma afectam a susceptibilidade das células
à apoptose e as células carentes de Gln são mais sensíveis à apoptose (German & Zentek,
2006). A Gln pode proteger as células T activadas da apoptose. Este efeito protector
também foi demonstrado nos neutrófilos, no qual a glutamina também aparece para regular
a expressão da NADPH oxidase. A suplementação da glutamina melhora a actividade
fagocítica dos macrófagos, ajuda a manter o número de linfócitos T circulantes e normaliza a
função linfocítica em situações de sepsis severa. Case et al. (2000) verificaram, em cães
adultos hipercatabólicos em estado de alimentação normal, que a suplementação enteral de
glutamina diminuiu bastante a oxidação de leucina, melhorou o equilíbrio das leucinas, e
assim preservou a proteína corporal. A glutamina é usada como fonte energética, para a
síntese de nucleótidos e pelos linfócitos em replicação, efeito potenciado pela arginina.
50
3.6.1.2 Arginina
A suplementação enteral de Arg tem efeitos benéficos no número e função de células do SI.
Além destes efeitos imunoestimuladores, dietas enriquecidas com Arg atenuam a atrofia do
timo, aumentam a sobrevivência do animal em caso de sepsis e melhoram o tratamento de
lesões. A suplementação dietética de Arg é acompanhada pelo aumento da função dos
linfócitos e monócitos, activação dos macrófagos e da citotoxicidade das células NK. A Arg
estimula linfócitos T helper e deprime linfócitos T supressores, melhora a fagocitose e
aumenta a produção de citoquinas (Suchner, Heyland & Peter, 2002).
A L-Arg é o substrato para a síntese do óxido nítrico (NO) pela NO sintase. O papel da
arginina na produção de NO é crucial para os mecanismos homeostáticos do corpo, uma
vez que é um regulador importante do endotélio vascular (como vasodilatador) e está
envolvido na fisiologia do macrófago e nas respostas inflamatórias celulares, entre outras
funções celulares. As isoenzimas NO sintase (endotelial e neuronal) geram baixas
concentrações de NO, mas isoenzimas induzidas produzem, dentro dos leucócitos, grandes
quantidades de NO em resposta a uma variedade de citoquinas, factores de crescimento e
estímulos inflamatórios no intestino e outros tecidos (Witte & Barbul, 2002). Além disso, o
NO inibe a expressão celular das moléculas de adesão celular, limitando a entrada
desnecessária de leucócitos, sobretudo dentro dos tecidos da mucosa. O NO inibe a
proliferação de células T, diminui a activação do factor nuclear de transcrição-kB (NF-kB) e
induz uma resposta local Th2. Há casos em que o suplemento de arginina pode ser
benéfico, mas há outros casos em que pode ser prejudicial (Stechmiller, Childress & Porter,
2004).
3.6.1.3 Poliaminas
As poliaminas estão envolvidas na diferenciação das células imunitárias e na regulação da
resposta inflamatória. Uma absorção insuficiente de poliaminas favorece o desenvolvimento
de hipersensibilidade alimentar. Em ratos em lactação, a administração oral de espermina
ou espermidina induziu maturação intestinal pós-natal precoce e mudanças nos níveis de
imunoglobulina A. Steege, Buurman e Forget (1997) relataram que a suplementação de
espermina para ratos neonatos aumentou a percentagem de linfócitos intraepiteliais que
expressam antigénios (TCRab, CD4, CD5 e CD54) como ocorre na maturação natural.
Durante as reacções de inflamação local envolvendo dano ou células mortas, a
suplementação de espermina induziu a migração e crescimento celular. Nestas situações,
as poliaminas exercem um efeito negativo na activação dos macrófagos com interacções
complexas entre o metabolismo do NO e as poliaminas. Além disso, foi descrito que as
poliaminas podem exercer um efeito supressor nas respostas imunoalérgicas intestinais e
imunológicas pulmonares (Larqué et al., 2007).
51
3.6.2 Ácidos Gordos Poliinsaturados
Os ácidos gordos poliinsaturados (AGPI) nas membranas celulares funcionam como
precursores para a síntese de mensageiros celulares e dos mediadores da inflamação,
cumprindo desse modo uma função na imunidade associada ao intestino. Eles são
precursores dos eicosanóides: tromboxanos, prostaglandinas e leucotrienos, que intervêm
nos processos inflamatórios e imunitários. Os eicosanóides são derivados do metabolismo
dos AGPI com cadeia de 20 carbonos que modulam o processo inflamatório. Tanto os AGPI
ω6 como ω3 são precursores dos eicosanóides, competindo pelo mesmo sistema de
enzimas. Qualquer dano à célula, activa a fosfolipase da membrana e inicia uma reacção
inflamatória em cascata dos lípidos, onde os AG ω6 e ω3 são metabolizados. O
metabolismo dos AGPI ω6 e ω3 produz eicosanóides com capacidades inflamatórias muito
diferentes. O efeito final do metabolismo do AA ω6 é a produção de eicosanóides que
promovem fortemente a inflamação, agregação e as reacções imunossupressivas e
trombóticas. Pelo contrário, o metabolismo do EPA ω3 produz eicosanóides muito menos
inflamatórios, vasodilatadores, anti-agregantes e não imunossupressivos. As dietas ricas em
AG ω3 têm como efeitos benéficos: supressão na proliferação de linfócitos, supressão na
produção de IL-2, supressão na actividade de células NK e redução da toxicidade mediada
por macrófagos (Reinhart & Davenport, 1998).
A complexidade de produção de eicosanóides e seus efeitos é potenciada pela
complexidade das interacções dos AGPI da dieta e do seu metabolismo. A previsão do
efeito de uma dada dieta tem em conta o seguinte: gordura total da dieta, proporção relativa
de AG ω3:ω6 de 18 carbonos (ALA ω3; LA ω6); proporção relativa de AG ω3:ω6 de 20
carbonos (EPA ω3; AA ω6), quantidades absolutas de todos os AG ω3:ω6 individuais;
história prévia da dieta do animal; duração da exposição da dieta em questão (Saker, 2006).
Além destas relações, o ácido gordo λ-linolénico, da família ω6, apresenta efeito anti-
inflamatório inibindo a fosfolipase A2.
Assim, a descrição somente do conteúdo em gordura da dieta com base na razão simples
AG ω3: ω6 dá uma informação limitada e enganosa. A suplementação da dieta com fonte de
AG ω3 pode ter efeitos variáveis dependendo da natureza da dieta básica e do paciente e
do tipo de AGPI suplementado, sendo que os de 20 carbonos são mais efectivos que os de
18. A maioria das dietas comerciais tem uma grande concentração de LA, devendo-se ter
atenção à suplementação de AGPI ω3. As preocupações com o suplemento excessivo de
AG ω3 são: supressão das funções imunológicas; retardamento da cicatrização de feridas;
diminuição dos níveis de vitamina E e atraso da coagulação sanguínea. Os AG ω3 são
melhor administrados aos animais através da dieta alimentar. Os suplementos de ácidos
gordos são dispendiosos e inconvenientes para uso a longo prazo.
O uso prático de dietas com proporções ideais entre os AGPI ω6 e ω3 inclui o tratamento
preventivo ou terapia adjunta para atopia, hipersensibilidade alimentar, dermatite alérgica a
52
picada de pulgas, e dor articular associada a artrites. Acredita-se que essas condições
envolvem processos alérgicos ou inflamatórios associados ao metabolismo do AA (Reinhart
& Davenport, 1998). Quanto à qualidade das fontes de gorduras, Saker (2006) estudou os
efeitos de uso da gordura de aves oxidada (média e alta) em cães em crescimento, tendo
chegado à conclusão que a gordura oxidada afecta negativamente: o crescimento, o
estatuto oxidante e a função imune de cães (neutrófilos e monócitos com menor capacidade
oxidativa, menor formação de linfócitos).
3.6.2.1 AGPI omega-6 (ω6)
Os óleos vegetais, incluindo milho e soja, são a fonte principal de AGPI ω6 nas dietas dos
animais de companhia. Os prostanóides derivados do metabolismo de AGPI ω6 parecem ter
efeito em função da dose. Concentrações muito baixas induzem os linfócitos a
diferenciarem-se em células T. Contudo, a produção excessiva de PGE2 baixa as funções
da célula T, que incluem a resposta a mitógenos, proliferação clonal, produção de linfocinas,
migração e criação de células T citotóxicas, e actividade de destruição dos fagócitos. Os
leucotrienos são activadores de leucócitos para a sua agregação e adesão às células
endoteliais. Também influenciam a actividade das células NK. Os AG ω6 desempenham um
papel importante na imunossupressão, tumorigénese e no aumento da inflamação (Saker,
2006).
3.6.2.2 AGPI omega-3 (ω3)
O ALA é um nutriente essencial pois é necessária a sua inclusão na dieta para promover o
crescimento e desenvolvimento normal. Dos AGPI ω3 derivados do óleo de peixe, o EPA é
o componente mais activo. EPA e DHA atenuam a resposta inflamatória, estabilizam os
complexos do factor nuclear NF-kB, diminuem a agregação plaquetária, melhoram a função
linfocitária e dos neutrófilos, e ajudam na estabilidade da membrana e perfusão
microvascular (Babcock, Dekoj & Espat, 2005). Clinicamente, os AG ω3 têm demonstrado
benefícios em várias doenças, incluindo DII, colite, sepsis, disfunções cardíacas e tumores.
O principal mecanismo de acção dos AGPI ω3 parece ser, directa e indirectamente, o seu
foco anti-inflamatório. Através de sinais celulares em cascata, os AG ω3 influenciam a
expressão de COX-2 e no final exibem uma acção inibitória de COX-2 para inibir a produção
de PGE2 e diminuir a resposta inflamatória. Os AG ω3 têm demonstrado que diminuem a
translocação nuclear do macrófago NF-kB e consequentemente inibem a produção de
citoquinas pró-inflamatórias via NF-kB. Os AG ω3 também alteram as proteínas e os
factores de transcrição nuclear especificos da actividade mitogénica das vias da proteína
cinase, incluindo o activador da proteína-1. Estas vias no final activam ou inibem a
proliferação celular ou a apoptose (Cowing & Saker, 2001).
Os AGPI da dieta podem regular a resposta imune através de diversos mecanismos: 1. Os
AG ω3 EPA e DHA podem inibir directamente a sinalização de LPS através de TLR4; 2.
EPA e AA de 20 carbonos aumentam a produção de eicosanóides com acções biológicas
53
diferentes; 3. alterações nas propriedades físicas da membrana celular lipídica diminuem a
sinalização através de receptor de célula B; 4. EPA bloqueia a proteína citosólica PPAR-y,
que se difunde pelo núcleo, onde bloqueia sequências específicas e pode inibir a transcrição
do gene induzida pela activação de NF-kB, seguindo a sinalização dos receptores
membranários Toll-like (TLR) (Takeda, Kaisho & Akira, 2003).
Várias dietas comerciais (terapêuticas e não terapêuticas) focaram-se na razão AG ω6: ω3
numa tentativa para maximizar as propriedades imunomoduladoras da família de AGPI ω3.
Actualmente, o objectivo é uma variação de aproximadamente 12:1 para 1:1 dependendo da
situação clínica. Uma razão AG ω6: ω3 geral ‘‘óptima’’ ainda tem que ser estabelecida, mas
tem que se ter em mente que o valor clínico dietético ω6:ω3 é específico da doença. Uma
segunda abordagem é aumentar as dietas com AG ω3 especificamente, e ter mais atenção
na quantidade total de AG ω3 do que no rácio (Saker, 2006).
3.6.3 Carbohidratos
Os polissacáridos possuem propriedades imunomoduladoras como se verifica na
incorporação de LPS como agente estimulador em vários modelos de imunidade. Apesar
dos 3 componentes da endotoxina terem diversidade antigénica, o papel imunodominante
principal é do componente polissacárido específico de LPS. As endotoxinas estão
localizadas na membrana exterior de bactérias gram-negativas e provocam respostas
específicas de anticorpos. Em caso de translocação bacteriana através da mucosa GI
comprometida, o componente polissacárido das endotoxinas bacterianas associadas a LPS,
pode de facto influenciar a imunomodulação do TLAI (Saker, 2006).
Factores de risco associados ao aumento da incidência da infecção passam por melhorar a
nutrição pré-operativa, escolha do tipo de suporte nutricional adequado, tipo de
suplementação nutricional e controlo glicémico rigoroso em pacientes, através da alteração
da absorção de carbohidratos. Repetidos estudos indicam os efeitos adversos da
hiperglicémia ligeira na função dos neutrófilos, incluindo a diminuição da quimiotaxia, da
fagocitose, combustão oxidativa e capacidade bacteriocida. Além disso, a hiperglicémia
ligeira promove um estado pró-inflamatório através do aumento dos níveis do mediator
inflamatório TNFα e activando NF-kB, que promove a produção de TNF (McCowen &
Bistrain, 2004).
A glicose é essencial para monócitos, neutrófilos e linfócitos. A seguir à activação de
macrófagos e neutrófilos, ou estimulação da proliferação de linfócitos, a oxidação de glicose
aumenta bastante, apesar de ser apenas parcialmente oxidada. A oxidação incompleta de
glicose e glutamina ocorre apesar da presença de mitocôndrias e ciclos de Krebs funcionais.
As altas taxas de uso de glicose e glutamina são em parte para servir de intermediários para
a biossíntese de nucleótidos, que são necessários para a síntese de ADN e ARNm para
estas células (Saker, 2006).
54
3.6.4 Nucleótidos
O fornecimento de nucleótidos necessários para os processos bioquímicos é sobretudo
suportado pela síntese de purinas e pirimidinas. A absorção dietética é uma fonte
secundária em condições de saúde mas pode ser de maior importância durante a doença.
Os estudos em animais indicam que a necessidade básica dietética de purina ou pirimidina
pré-formada pode ser requerida para o desenvolvimento normal. O uracilo parece ser o
ácido nucleico mais importante a influenciar a resposta imune. Saker (2006) demonstrou que
os nucleótidos dietéticos podiam reverter a imunossupressão induzida pela má nutrição e
privação de alimento em ratos. Mostrou também que os linfócitos Th necessitam de
nucleótidos exógenos para responder normalmente após estimulação imunitária. Estes
estudos realçaram o papel dos nucleótidos na função e metabolismo dos linfócitos e
macrófagos, embora as fontes dietéticas sejam tão importantes para suportar o crescimento
óptimo e função de outras células metabólicas activas, como as próprias células intestinais.
3.6.5 Nutrientes antioxidantes Os radicais livres (originados pela má nutrição, stress, raios UV, poluição) são compostos
altamente reactivos que podem danificar importantes moléculas e compostos do corpo,
como o ADN, as proteínas e as gorduras. Os antioxidantes da dieta protegem o hospedeiro
e os leucócitos do perigo endógeno devido aos radicais livres. Estes nutrientes
desempenham funções vitais na manutenção e apoio do SI, e no aumento da sua função de
protecção. O aumento da capacidade antioxidante intracelular nos neutrófilos e macrófagos,
são preenchidos pela glutationa, ascorbato e tocoferol. A glutationa desempenha papel
importante como antioxidante quer através da interacção directa com os radicais livres, quer
como substrato do ascorbato. A disponibilidade da glutamina pode limitar a produção de
glutationa, e a sua suplementação pode aumentar a produção superóxida de neutrófilos
(Cave, 2008).
3.6.5.1 Vitamina E e selénio A vitamina E é um composto que elimina os radicais livres na fracção solúvel em gordura
das células e estabiliza as membranas celulares. Sinais de deficiência de vitamina E são:
diminuição do poder bactericida de leucócitos e linfócitos, redução da reacção de linfócitos T
e da função fagocítica, menor produção de imunoglobulinas e menor produção e
funcionamento de linfocinas e citoquinas, aumento na produção de IgE e PGE2. Estudos
têm demonstrado que a suplementação com doses suprafisiológicas aumenta o poder de
fagocitose e a resposta imune humoral e celular dos animais e a resistência a doenças. Este
efeito é mais marcado em populações geriátricas (Saker, 2006). Em roedores e aves, a
suplementação com vitamina E acima dos padrões recomendados pela NRC (2006)
aumentou a função imunológica intestinal ao aumentar a produção de IgA secretora
(Laflamme, 2008).
55
O selénio está intimamente associado à vitamina E. O selénio como componente da
glutationa peroxidase é importante na estabilização dos peroxissomas dos fagócitos, tendo
correlação com seu poder de inactivar agentes infecciosos. Sinais de deficiência de selénio
são: redução na resposta imunológica e da reacção de anticorpos, decréscimo nas funções
fagocíticas e nas reacções linfocíticas. Afecta a capacidade proliferativa de linfócitos, bem
como todos os componentes do SI (Deshmukh, 2008).
3.6.5.2 Carotenóides
Os cães e gatos são capazes de absorver carotenóides da dieta, como o ß-caroteno e a
luteína. Foi sugerido que a sua eficiência em absorver e estabilizar radicais livres e a sua
capacidade de permanecer dentro da mitocôndria estão na base da sua eficácia
antioxidante. A suplementação de carotenóides na dieta, com actividade da vitamina A (no
caso do ß-caroteno) ou sem (no caso da luteína), acentuou as respostas em diversas
análises imunológicas (Chew & Park, 2004). O ß-caroteno e a luteína incorporam-se nos
linfócitos e neutrófilos de cães e gatos, e a sua localização sobretudo nas membranas das
mitocôndrias, tornam-nos eficazes na protecção das suas proteínas, membranas lipídicas e
ADN do perigo endógeno dos radicais livres (Chew & Park, 2004). O ß-caroteno da dieta
melhora a resposta imunológica humoral e mediada por células em cães, aumentando o
número de células Th e a proliferação de linfócitos. Num estudo em cães, a suplementação
com ß-caroteno reverteu o declínio associado à idade nos números da população de células
T e da sua actividade de proliferação. Os cães absorvem quantidades significativas de
luteína da dieta. Um estudo sobre a absorção da luteína dietética pelo sangue e leucócitos
circulantes em cães, revelou que este acréscimo de luteína está associado a um aumento
da resposta imune mediada por células em cães suplementados com a luteína, como
verificado numa resposta de DTH (Chew et al., 1997). Mortes precoces de cachorros
ocorrem devido a infecções e/ou comprometimento do SI. Filhotes que a partir da 6ª semana
de vida receberam uma dieta com suplemento de vitamina E, ß-caroteno e luteína
apresentaram níveis mais altos de activação de células T e B na 14ª e 22ª semanas de vida
do que os filhotes que receberam a dieta-padrão (Deshmukh, 2008).
3.6.6 Vitaminas O ácido ascórbico (ou vitamina C) tem um papel na fracção hidrossolúvel de componentes
celulares e, sobretudo em situações de stress, pode ter um efeito benéfico na função
imunológica. Os sintomas da deficiência de vit. C são: redução da capacidade de eliminação
dos linfócitos e leucócitos, redução nas funções fagocíticas e na reacção dos linfócitos T.
Deve considerar-se, no entanto, que cães e gatos não necessitam deste composto, que é
sintetizado de forma suficiente no fígado a partir da glicose (Deshmukh, 2008).
A função protectora da vitamina A compensa parcialmente os danos causados pelas
deficiências de outros nutrientes. A suplementação com vit. A melhorou a função
imunológica da mucosa em ratos com comprometimento imune induzido por deficiência de
56
proteínas. A deficiência de vit. A está associada ao aumento da susceptibilidade às
infecções. A metaplasia escamosa verificada em várias mucosas na hipovitaminose A
representa uma quebra de barreira anatómica, favorecendo a penetração de agentes
infecciosos. Além disso, verifica-se redução do tamanho do timo e do baço, redução da
maturação de macrófagos e neutrófilos, redução da proliferação linfocitária, diminuição da
resposta dos linfócitos a mitógenos, menor actividade de células NK, redução da produção
de interferão (IFN) e da resposta DTH. A vitamina D actua como hormona imunorreguladora
e para a diferenciação de linfócitos, além do seu papel no metabolismo dos minerais (Saker,
2006).
Vitaminas do complexo B - As deficiências de piridoxina (B6) e ácido pantoténico (B5) levam
à redução da resposta antigénica, tanto humoral como celular. A deficiência conjunta destas
duas vitaminas leva a uma inibição quase completa da imunidade que é revertida com a
suplementação das mesmas. O ácido fólico (B9) e a vitamina B12 são essenciais para a
replicação celular; a deficiência pode levar a atrofia do timo, redução na formação de
anticorpos, redução na imunidade mediada por células e na replicação de linfócitos
(Deshmukh, 2008). A deficiência de colina (B7) está associada à atrofia do timo. As
vitaminas hidrossolúveis não são armazenadas no organismo, sendo necessária uma
ingestão constante. Além da sua interferência na imunidade, são fundamentais nos
processos de produção e uso de energia, sendo co-factores enzimáticos em várias etapas
do ciclo de Krebs. Como na doença associam-se anorexia, hipermetabolismo e catabolismo,
é aconselhável a suplementação destas vitaminas (Carciofi, 2007a).
3.6.7 Minerais
O Zinco é o elemento mais importante para o desenvolvimento e manutenção do SI. Para as
funções fagocíticas identificaram-se mais de 100 metaloenzimas dependentes do zinco. Os
sinais de deficiência do zinco são: redução na reacção humoral e funções das células B,
redução na estrutura e função do timo, alteração da síntese de linfócitos, alteração na
diferenciação de linfócitos T, redução na função fagocítica, deficiente apresentação de
antigénios (Deshmukh, 2008). Há também alterações epidérmicas associadas à maior
penetração de agentes. A deficiência de zinco resulta em imunossupressão que enfraquece
a defesa contra as infecções bacterianas e parasitárias (Ramakrishnan, 2002). O excesso
de zinco também pode prejudicar a resposta imune, de forma que o equilíbrio deste
nutriente essencial é fundamental na dieta para manter um funcionamento óptimo do SI.
A suplementação de zinco antes da administração de uma vacina por via oral com toxóides
contra a cólera resultou num aumento de quatro vezes da quantidade do antigénio
específico IgA na matéria fecal. Numa outra pesquisa, a deficiência de zinco causou uma
alteração na resposta imunológica de citoquinas que promovem a tolerância oral (IL-4, IL-10,
TGF-β) para um padrão mais consistente com a alergia e a inflamação (Laflamme, 2008).
57
A deficiência de Ferro é bastante comum na espécie humana, mas parece ser de menor
ocorrência em cães e gatos. Ocorre redução do poder de eliminação dos antigénios, menor
proliferação linfocitária, redução da produção de anticorpos, diminuição de células NK,
menor produção de IFN e da reacção de DTH. O ferro é necessário para os animais e aos
microorganismos, de modo que o organismo secreta três proteínas, a transferrina,
conalbumina e lactoferrina, que possuem elevada capacidade de se ligar ao elemento,
tornando-o indisponível para as bactérias. Esta reduzida disponibilidade de ferro livre
apresenta efeito protector para o hospedeiro. Uma suplementação excessiva de ferro,
principalmente por via parenteral, pode ter efeito desastroso em animais doentes, sobretudo
se estão desnutridos e com baixa quantidade de proteínas sequestradoras de ferro. Nesta
condição ocorre aumento de infecções e morte. Uma suplementação diária fisiológica num
animal desnutrido, por outro lado, tem efeito positivo na redução da morbilidade por doenças
infecciosas (Carciofi, 2007a).
O Cobre tem como sinais de deficiência: redução do número de linfócitos circulantes, na
produção de anticorpos, do poder fagocitário, atrofia do timo e menor produção de
citoquinas. O Magnésio participa da proliferação de linfócitos. Como sinais de deficiência
ocorrem: alteração em funcionamento de linfócitos T e B, menor produção de
imunoglobulinas, redução da capacidade bactericida de fagócitos e menor produção de
citoquinas. Atribui-se estes efeitos ao fato deste microelemento ser um co-factor na síntese
de ADN (Carciofi, 2007a).
3.6.8 Prebióticos
Ao estimularem o crescimento das bactérias produtoras de ácido láctico, os prebióticos
actuam indirectamente de forma benéfica sobre o SI do hospedeiro. Estas populações
bacterianas produzem substâncias com propriedades imunoestimuladoras, incluindo
lipopolissacáridos e peptidoglicanos. Estas substâncias interagem com o SI em vários
níveis, incluindo produção de citoquinas, proliferação de células mononucleares, fagocitose
macrofágica e indução de síntese de maiores quantidades de imunoglobulinas, sobretudo
IgA (Macfarlane & Cummings, 1999).
O prebiótico mananoligossacárido (MOS) induz a activação de macrófagos por ocuparem
sítios receptores de manose nas glicoproteínas da superfície celular do macrófago. Uma vez
que três ou mais destes sítios estejam ocupados, inicia-se uma reacção em cascata que
resulta na activação dos macrófagos e libertação de citoquinas, o que caracteriza a
activação da resposta imune adquirida. A acção prebiótica de MOS é a adsorção de
bactérias patogénicas com bloqueio dos locais de adesão de bactérias ao intestino. Isto vai
estimular a resposta imune contra patogénios específicos impedindo a sua colonização no
intestino e fazendo com que sejam apresentados às células imunitárias como antigénios
atenuados (Gomes, 2009). Estudos demonstram que cães que consumiram uma dieta com
58
MOS possuíam tendência de maiores concentrações de lactobacilos fecais e maiores níveis
de IgA e de linfócitos séricos, quando comparados com uma dieta controlo sem
suplementação (Swanson et al., 2002). Acredita-se que os MOS possuam, também, efeito
directo sobre as células imunitárias do TGI quando absorvidos nas células M, localizadas no
interior das placas de Peyer. Desta forma, os MOS estimulariam tanto a imunidade sistémica
como a imunidade associada ao intestino, actuando como oligossacáridos não patogénicos,
e exercendo efeito semelhante a um adjuvante.
Os MOS podem ser obtidos a partir de parede celular de leveduras (PCL). Os mecanismos
específicos pelos quais a PCL actua sobre a imunidade, ainda não estão completamente
esclarecidos. Além da capacidade de ligação com patogénios entéricos e de adsorção de
micotoxinas potencialmente imunossupressivas, sugere-se que a manose presente na
superfície destes compostos possa estimular a produção de uma lectina que se liga à
manose, com importante função de auxiliar a fagocitose, fundamental na resposta imune
inata a microorganismos (Gomes, 2009). A modulação imunitária decorrente do consumo de
prebióticos parece actuar sobre o TLAI, tecidos linfóides secundários e células em
circulação periférica, podendo ser resultantes de: contacto directo das células imunitárias do
intestino com as bactérias lácticas ou seus componentes (parede celular e conteúdo
citoplasmáticas); produção de AGCC; alteração na produção de mucina. As bactérias
lácticas produzem substâncias com propriedades imunoestimulatórias, como
lipopolissacáridos, peptidoglicanos e ácidos lipoteicóicos, que interagem com o sistema
imunitário a vários níveis: produção de citoquinas, proliferação de células mononucleares,
fagocitose macrofágica e indução da síntese de imunoglobulinas, em especial as IgA (Silva
& Nörnberg, 2003). Isto foi demonstrado por Swanson et al. (2002), que demonstraram
aumento de IgA em conteúdo ileal de cães suplementados com MOS.
Num estudo de Gomes (2009) a PCL apresentou efeito prebiótico, pela imunoestimulação
verificada em oito Beagles adultos. Fez-se quantificação imunofenotípica por citometria de
fluxo das subpopulações linfocitárias e populações de linfócitos pan T e B aumentaram, o
que sugere melhoria na resposta imune dos cães. Segundo Vogt (2005), este aumento de
linfócitos circulantes pode ser decorrente do estímulo causado pela presença de PCL no
lúmen intestinal. As alterações no padrão metabólico da população bacteriana fecal,
evidenciadas pelo aumento de ácido butírico e diminuição de quatro aminas bioactivas,
parecem ter sido suficientes para provocar aumento de linfócitos circulantes, mesmo sem a
alteração da microbiota.
Quase 75% do peso seco da parede celular das PCL são polissacáridos, integrados por um
complexo de ß(1,3)- e ß(1,6)-D-glucano e quitina mais componentes amorfos denominados
mananoproteínas. As mananoproteínas e sua porção de carbohidrato α-D-manano são
responsáveis pelo reconhecimento e interacções célula-célula, interacções com o meio-
ambiente e determinam a especificidade imunológica de leveduras. Os dois principais
59
polissacáridos constituintes da parede celular das leveduras - ß-D-glucanos e α-D-manano -
podem promover modulação do SI de diversos organismos vivos, desde insectos a
humanos, mediante interacções especificas com diferentes células imunocompetentes
(Gomes, 2009).
O componente activo da parede celular foi identificado como ß-glucano, um polissacárido
insolúvel em água, que possui a capacidade de melhorar a actividade fagocítica, actividade
citotóxica nos macrófagos e outras actividades biológicas (Gomes, 2009). Os ß-glucanos
não possuem efeitos antimicrobianos directos, mas estimulam as actividades
antimicrobianas das células imunológicas do hospedeiro. O ß-1,3/1,6 glucano da levedura
exerce fortes efeitos sobre o SI ao estimular a actividade antitumoral e antimicrobiana.
Todas estas moléculas imunomoduladoras da parede celular da levedura ligam-se a
receptores específicos que se encontram nas células imunológicas, denominados
Receptores de Reconhecimento de Padrões (RRP). Os RRP são ferramentas usadas pelos
animais para identificar potenciais patogénios, que se reconhecem pelas suas estruturas
moleculares únicas, os Padrões Moleculares Associados a Patogénios (PMAP). O glucano
actua ligando-se aos receptores que se encontram nos macrófagos e outros leucócitos,
activando-os. Os glucanos ligam-se a receptores, como o receptor do complemento tipo 3
(CR3) e a dectina-1. As manoproteínas ligam-se a um grupo de RRP chamado Receptores
de Ligação a Carbohidratos, presentes nos macrófagos nas células dendríticas. A quitina
parece mediar seus efeitos imunomoduladores ao ligar-se aos receptores do tipo lectina
presentes sobre a superficie dos macrófagos. Além disso, os fragmentos de ADN e ARNm
que formam parte das leveduras integrais e semi-purificadas ligam-se e estimulam TLR
(Anderson, Gore & Roos, 2008).
Uma vez que as células imunológicas estão ligadas a estes componentes
imunoestimuladores, elas são estimuladas a secretar moléculas de sinalização (citoquinas),
que afectam vários sistemas biológicos de forma favorável. Algumas destas citoquinas
podem aumentar a formação de novos leucócitos, outras activam os leucócitos para produzir
anticorpos, enquanto outras ajudam a contra-atacar as inflamações no corpo. Estes efeitos
dos componentes da parede celular da levedura mostram como o estado imunológico e a
eficácia das vacinas podem ser positivamente afectados (Anderson et al., 2008).
3.6.9 Probióticos
Os efeitos protectores do probiótico na saúde em geral são: produz factores de coagulação,
activa o TLAI, modula a resposta Th1/Th2 (envolvida no equilíbrio alergia/tolerância),
promove acção antioxidante, controla microorganismos potencialmente patogénicos, reduz a
produção de endotoxinas e a mutagenicidade. No SI humoral: estimula a produção de IgA,
inibe a produção de IgE, estimula produção de óxido nítrico, modula as respostas de
citoquinas. No SI celular: estimula a função dos macrófagos, a proliferação de linfócitos e a
60
actividade das células NK; promove apoptose, induz crescimento e regeneração das células
intestinais (Maulden, 2006). As bactérias probiotas ajudam a regular o equilíbrio entre as
respostas imunes apropriadas ou não, por aumentarem as respostas das células Th1, e por
induzirem citoquinas imunoreguladoras. Além disso, os probióticos protegem os intestinos
competindo com patogénios pelos locais de ligação das bactérias, fortalecendo as junções
estreitas entéricas e intensificando a resposta imune (IgA) aos patogénios.
Lactobacilli fazem parte da microbiota natural de cães e gatos saudáveis. Estes organismos
são encontrados ao longo do TGI, e o seu número aumenta desde o estômago até ao cólon
e também nas fezes. As alterações nas populações da microbiota (ex. níveis reduzidos de
lactobacilos e bifidobactérias, aumento dos níveis de Clostridia) e o avanço da idade, podem
levar o animal a ser menos tolerante às mudanças de dieta e a diarreia induzida pelo stress.
Nos cães, as causas parasitárias da diarreia são lideradas por Giardia e Cryptosporidium
(Zentek, 2000). Os probióticos ajudam a controlar a diarreia infecciosa, uma vez que usam a
exclusão competitiva, competem pelos nutrientes disponíveis e locais de ligação, e
aumentam as respostas imunes específicas e não específicas (Gismondo, Drago &
Lombardi, 1999). Uma espécie de Enterococcus faecium (tipo SF68) é um agente probiótico. A selecção de E.
faecium SF68 como probiótico foi feita por várias razões: excelente actividade biológica,
crescimento rápido e colonização temporária no TGI; inibição do crescimento de organismos
patogénicos como Salmonella e E. coli; produção de ácido láctico e substâncias
bacteriocidas; promove estimulação do SI. Esta estirpe tem uma história de segurança de
uso em animais e humanos, pois apresenta como características: não é resistente a
antibióticos; tem resistência antibiótica não transferida; não é patogénica nem tóxica e não é
absorvida na corrente sanguínea. O probiótico E. faecium SF68 melhora diversos
parâmetros da função imune em cachorros, e também promove a microbiota intestinal
normal em cães e gatos. Em cachorros suplementados com E. faecium SF68, aumentaram:
as concentrações de IgA fecais e circulantes; a proporção das células B maduras e diversos
marcadores da função dos linfócitos; a produção de imunoglobulinas em resposta à
vacinação. As pesquisas de Benyacoub et al. (2007) confirmaram que os cães também
mostram um aumento imunoespecífico na resposta imune frente às bactérias benéficas. E.
faecium SF68 pode ajudar o maneio nutricional de cães e gatos com diarreia. Ele aumenta a
produção de anticorpos em ratos expostos a Giardia. Os ratos alimentados com probióticos
diminuíram os níveis de trofozoítos activos no ID e diminuíram as concentrações fecais de
Giardia. A capacidade de E. faecium SF68 melhorar a imunidade sistémica e de mucosa,
demonstra os mecanismos pelos quais os probióticos podem antagonizar patogénios in vivo
e reduzir o risco de infecção protozoária (Kayser, 2003).
61
3.7 Tolerância Oral 3.7.1 Resposta imunitária aos antigénios da dieta
A tolerância imunológica é um mecanismo do SI que permite ao organismo distinguir entre
self e não self, tentando assim protegê-lo contra patogénios externos sem reagir contra
constituintes self. Os antigénios estranhos da dieta interagem com o TLAI, de forma que se
previna reacções imunes desnecessárias e prejudiciais contra eles. Se o mesmo antigénio
chega à circulação sistémica, o SI faz com que não haja reacção. A ausência de
reactividade para os antigénios administrados oralmente é designada por tolerância oral .
Esta tolerância é gerada duma forma activa, antigénio-específica e envolve a indução duma
resposta imune atípica (Magalhães, 2008).
As placas de Peyer são os principais locais de indução da resposta imune aos Ag do lúmen
intestinal. Neste fenómeno, as células M especializadas da superfície do epitélio intestinal
recolhem por pinocitose, macromoléculas, microrganismos e complexos antigénio-anticorpo
(Ag-Ac). Estes são transportados para os leucócitos que residem dentro das invaginações
da membrana basal, sobretudo linfócitos B, macrófagos e células dendríticas (Xavier &
Podolski, 2007). No intestino normal, as APC não expressam moléculas co-estimuladoras
como CD80 e CD86, pelo que quando são apresentadas a linfócitos B e T imaturos, estes
últimos pouco proliferam. As células activadas deixam a via linfática e passam via linfonodos
mesentéricos para a circulação sistémica. Depois, saem em locais da mucosa através da
ligação com moléculas de adesão celular (CAM), especificamente expressas pelas vénulas
endoteliais dos tecidos da mucosa. Estes linfócitos T e B activados (ou de memória) vão
entrar na corrente sanguínea e são distribuídos pelas mucosas do organismo,
permanecendo na lâmina própria, esperando um novo contacto com o antigénio que as
originou (Cave, 2003). No entanto, para que ocorra uma nova estimulação destes linfócitos,
os antigénios necessitam de atingir a lâmina própria, geralmente mediante as APC. As
células epiteliais intestinais são responsáveis pela absorção do Ag, sua libertação para APC
“profissionais” e por limitar a apresentação para células dentro da mucosa do Complexo
Maior de Histocompatibilidade (CMH) classe II. No intestino normal, estas APC secundárias
vão (tal como as apresentadoras primárias) inibir a expressão de moléculas co-
estimuladoras pelo que a resposta imune é suprimida, o que contribui ainda mais para a
tolerância ambiental (Cave, 2003).
Os linfócitos T activados por estas APC secundárias vão dirigir a resposta para a
diferenciação em linfócitos Th2 e Th3, produtores de IL-10 e factor de crescimento
transformador-β (TGF-β), os quais inibem a proliferação de linfócitos Th1 (através da
indução de apoptose) e a produção de IgG, ao mesmo tempo que estimulam a diferenciação
dos linfócitos B para plasmócitos produtores de IgA. A IgA liga-se a vários agentes
microbianos, impedindo a aderência destes aos tecidos e liga-se a antigénios no interior da
62
camada mucosa intestinal, formando complexos Ag-Ac que são excretados para o lúmen
intestinal (Prescott, Harley & Klein, 2002).
No entanto, o SI ainda assim consegue responder a antigénios microbianos através de
receptores específicos, como os TLR, dos quais já foram identificadas diversas variantes
caninas (TLR-2, 3, 4, 5 e 9) e os seus correspondentes citossólicos Nod (Nod1 e Nod2)
identificados em células de mamíferos (Swerdlow et al., 2006). Foi descoberto que estes
receptores, além de estarem em células da linha mielóide (monócitos, granulócitos e
linfócitos), são também expressos em células epiteliais do colón de caninos. A activação dos
TLR inicia uma cascata de sinalização que culmina na libertação do factor nuclear de
transcrição (NF-kB), permitindo a translocação para o núcleo e induzindo a transcrição de
genes específicos, tais como para citoquinas pró-inflamatórias (IL-1, IL-6, IL-8, IL-12),
síntese de factores co-estimuladores (CD80/CD86) e de radicais livres do oxigénio e azoto
(Cave, 2003). Para evitar respostas exageradas aos antigénios luminais, a expressão destes
receptores é praticamente inexistente no intestino normal, sendo apenas aumentada em
resposta a estímulos infecciosos e inflamatórios (Swerdlow et al., 2006).
A função das APC é decisiva para a resposta imune alterada que é característica do SI
neonatal, para o decréscimo da resposta imune dum SI idoso e resposta imune durante o
stress. Nestes três casos, devido à falta de citoquinas inflamatórias, as APC não estão aptas
a responder eficazmente ao desafio imunitário.
A manutenção da tolerância da mucosa é crucial, e ela verifica-se porque a maioria dos Ag
luminais são derivados de componentes inofensivos da dieta ou da microbiota endógena. A
criação de uma resposta imune activa a estas moléculas ubiquitárias é potencialmente
prejudicial, pois pode levar a uma inflamação descontrolada. De facto, uma quebra na
tolerância imunológica às bactérias comensais pode ser um passo crítico na patogénese da
DII (Saker, 2006).
A perda da tolerância aos antigénios da dieta vai produzir uma resposta imune convencional
mas prejudicial contra os Ag da dieta. Esta resposta desadequada pode provocar inflamação
local, e é caracterizada por uma ou pela combinação destas situações: 1) inflamação
mediada por células locais - o estímulo crónico resultante pode levar a uma infiltração de
linfócitos intestinais, característica da DII; 2) produção de isotipos de Ac locais diferentes de
IgA: a produção de IgE conduz os mastócitos maduros a uma reacção de hipersensibilidade
intestinal, isto é, uma alergia alimentar com sinais GI (vómito e/ou diarreia); 3) produção de
Ac sistémicos: IgE circulantes conduzem os mastócitos a uma reacção de hipersensibilidade
dérmica, ou seja, uma alergia alimentar com prurido como sinal clínico (Cave, 2008).
Os eventos iniciais que levam à perda de tolerância oral ou os que a previnem, ainda não
foram descritos em cães e gatos. Os mecanismos sugeridos incluem: 1) aumento da
permeabilidade da mucosa – exemplo: depois de uma lesão da mucosa ou no intestino do
neonato; 2) co-administração de adjuvantes da mucosa, que activam e alteram o fenótipo
63
das células dendríticas intestinais – exemplo: enterotoxinas das bactérias; 3) o parasitismo
intestinal em gatos leva a uma resposta humoral sistémica exagerada, que inclui o aumento
da produção de IgE (Gilbert & Halliwell 2005).
Actualmente, há especulação quanto à importância das infecções que estimulam uma
resposta imune Th1 e que poderiam colaborar na prevenção de reacções de
hipersensibilidade tipo I em pessoas. Esta situação é designada por “hipótese da higiene”,
que estabelece que a falta de maturidade do SI infantil, especificamente de uma resposta
imune do tipo Th1 ou Th2 pode ser causada pela menor estimulação microbiana nas
sociedades ocidentais (Romagnani, 2004). É proposto que as infecções virais e bacterianas
durante o início da vida promovem ligações ao SI maduro através de respostas Th1, e
reduzem respostas Th2 potencialmente alérgicas. Presume-se que a redução na carga
microbiana geral permita aos Th2 natural dos neonatos persistirem e assim aumentar a
alergia. O papel especial dos parasitas na regulação da resposta alérgica ao alimento e
outros alergénios tem sido alvo de discussão desde há 50 anos e será desenvolvido
posteriormente nesta revisão. 3.8 Efeito da via do alimento no lúmen intestinal
No tratamento de doenças GI, o uso do suporte nutricional enteral é preferível ao parenteral
por ser mais próximo do fisiológico e garantir o aporte de nutrientes ao lúmen intestinal. O
intestino tem um papel muito importante na recuperação do paciente, pois desempenha
funções endócrinas e imunológicas e actua como barreira protectora. A capacidade de
permeabilidade selectiva da parede intestinal está directamente ligada à sua integridade.
Situações graves, como pancreatite aguda e jejum prolongado, podem ocasionar a perda
dessa função, o que resulta na entrada e translocação de bactérias e produtos bacterianos
(endotoxinas, exotoxinas, fragmentos de parede celular) do lúmen intestinal para territórios
extra-intestinais o que, por sua vez, promove a queda da resposta imune e da secreção de
substâncias imunológicas. Esse aumento da permeabilidade intestinal resulta na SIRS.
Segundo estudos realizados em seres humanos e animais, pacientes em estado grave que
receberam algum tipo de suporte de nutrição enteral (NE), apresentaram índices de infecção
muito menores do que aqueles que receberam nutrição parenteral (NP) ou foram mantidos
em jejum alimentar, o que pode ser explicados pelo importante papel imunológico que o
intestino apresenta. Há evidências cada vez maiores de que a manutenção do TLAI
preserva a imunidade local e sistémica. Outros benefícios associados à NE são o aumento
da IgA intraluminar, a regulação na produção de mediadores inflamatórios e a redução da
virulência bacteriana, consequentes à menor expressão de adesinas (Brunetto, 2009).
A carência de nutrientes no lúmen resulta no aumento da expressão das moléculas de
adesão celular pró-inflamatórias, sobretudo as ICAM-1. A falta de NE conduz à infiltração de
linfócitos na lâmina própria, o que é revertido rapidamente com a ingestão de alimentos. A
64
NP leva a um decréscimo de IL-4 e IL-10, o que se relaciona com o decréscimo de IgA e o
acréscimo de ICAM-1. A falta de NE impede a coordenação do sistema de sensibilização,
distribuição e interacção de células B e T, importantes na produção de IgA, na manutenção
das citoquinas intestinais normais e na regulação da inflamação endotelial. Esta falta de
nutrientes luminais é descrita como a causa primária e o aumento da resposta inflamatória
como o insulto secundário no TGI, mas também nos pulmões, fígado e outros órgãos. Por
outro lado, a provisão de NE é um dos mais importantes mecanismos pelo qual as respostas
inflamatórias sistémicas podem ser diminuídas e a septicémia evitada (Cave, 2008).
3.9 Neuroimunomodulação pela Nutrição Há muito tempo que se suspeita que o stress tem um papel na etiologia de muitas doenças.
Actualmente, a comunicação entre os sistemas neuroendócrino e imunitário está bem
estabelecida e há evidências suficientes de que a intensidade da desregulação imunitária
associada ao stress tem grandes implicações na saúde. Em condições de stress, a
modulação do SI pelo sistema nervoso central (SNC) é mediada por uma complexa rede de
sinais, mostrando a relação entre stress e a resistência à infecção. Por outro lado, um
desequilíbrio na dieta vai ter um papel crucial no maneio do stress, e a nutrição parece ser
um determinante crítico nas interacções entre SNC e o SI sob situações de stress. Deste
modo, as interacções entre nutrição, SNC e SI podem ser as chaves para entender as
implicações das situações fisiológicas do stress (Romeo et al., 2008).
4. MECANISMOS DE RESISTÊNCIA A PARASITAS DO INTESTINO EM CÃES
4.1 Parasitas gastrointestinais, nutrição e imunidade
O estado de nutrição celular é decisivo no parasitismo tal como a resposta imunitária de
acordo com o tipo de localização de cada parasita. Em geral, os anticorpos controlam na
circulação e fluidos teciduais, os níveis de parasitas extracelulares, enquanto a resposta
celular é direccionada contra parasitas intracelulares (Tizard, 2002). Há uma correlação
entre infecção parasitária, desnutrição e imunossupressão. A má nutrição prejudica a
imunidade inata e adaptativa, que por sua vez, aumenta a susceptibilidade à infecção. As
infecções parasitárias comprometem a imunidade humoral e mediada por células. A
imunidade aos parasitas é dependente de deficiências de macro e micronutrientes ou da
composição corporal (Hughes & Kelly, 2006). As interacções entre infecção-nutrição-
imunidade levantam questões importantes. Pode e deve o tratamento de nemátodes
intestinais ser utilizado como um meio indirecto de melhorar o estado nutricional? Podem os
suplementos nutricionais ser utilizados como um meio de reduzir indirectamente a infecção?
A resistência (e até mesmo a direcção) da associação entre a infecção e subnutrição
65
depende da espécie do parasita, da idade e sexo do indivíduo e de infecções
concomitantes.
Há estudos epidemiológicos sobre má nutrição e nemátodes, mas a maioria dos estudos
continua a ignorar as deficiências nutricionais múltiplas em infecções concomitantes de
helmintes, protozoários, bactérias e vírus (Solomons & Scott, 1994). É necessário estudar as
interacções entre as deficiências nutricionais e infecções por protozoários e nemátodes
intestinais, os factores nutricionais que influenciam a imunidade do hospedeiro aos parasitas
GI e as implicações para o seu controlo. O problema das zoonoses parasitárias na saúde
pública é a principal razão para o grande interesse na imunidade aos parasitas e para o
desenvolvimento da imunoparasitologia (Scrimshaw & Giovanni, 1997).
4.2 Nemátodes gastrointestinais e má nutrição Os nemátodes gastrointestinais (GI) aqui estudados (entre os quais Toxocara canis e
Ancylostoma caninum) têm um ciclo de vida directo que envolve um hospedeiro (e por vezes
um paraténico), em que os helmintes adultos amadurecem e reproduzem-se no tracto GI, e
libertam os ovos ou larvas no meio ambiente através das fezes do hospedeiro.
Há várias relações de causa-efeito entre a má nutrição e os nemátodes GI. A infecção leva à
má nutrição, e alternativamente a subnutrição aumenta a susceptibilidade a infecções. No
entanto, como ambas as vias podem ocorrer concomitantemente, muitas vezes, é difícil
saber se a má nutrição precedeu ou resultou da infecção parasitária. Os nemátodes
intestinais podem levar à má nutrição, pois causam anorexia e uma variedade de respostas
fisiopatológicas no TGI (vómitos, diarreia, má absorção) que afectam directamente a
capacidade do hospedeiro para obter os efeitos nutritivos da dieta. Só posteriormente foi
reconhecida a importância da má nutrição como um factor predisponente aos nemátodes.
Em geral, a má nutrição promove o estabelecimento, sobrevivência e fecundidade destes
parasitas, mas a magnitude do efeito depende de factores como: espécie do hospedeiro,
espécie do parasita; protocolo particular da infecção usado, a magnitude da infecção,
presença de infecções simples ou múltiplas; severidade da deficiência nutricional; e
existência de deficiências nutricionais únicas ou múltiplas (Koski & Scott, 2001).
4.3 Deficiências de nutrientes promovem a sobrevivência de nemátodes GI 4.3.1 Deficiências de macronutrientes
A má-nutrição energético-proteica continua a ser a mais estudada deficiência nutricional
associada a doenças infecciosas e imunossupressão. A eliminação da infecção por
nemátodes facilita o crescimento, talvez devido a uma melhor digestibilidade proteica. Há
poucos estudos sobre a intervenção dietética para averiguar o impacto da má nutrição sobre
nemátodes intestinais. Deficiências ligeiras de energia têm uma influência dramática sobre a
resposta imune do hospedeiro às infecções por nemátodes GI. Há evidências que os efeitos
66
da restrição energética durante estas infecções são independentes e superiores aos da
restrição proteica (Koski & Scott, 2001).
Os nemátodes prejudicam a produtividade dos bovinos, ovinos e suínos, uma vez que
induzem a redução no consumo alimentar, a má digestão e absorção dos alimentos, e
defeitos fisiopatológicos em processos epiteliais, como a fuga intestinal de proteínas
plasmáticas. As infecções com nemátodes aumentam as necessidades de proteína do
hospedeiro ou reduzem a eficácia da resposta imune (Koski & Scott, 2001).
A espécie Heligmosomoides polygyrus normalmente induz uma fraca resposta imune do
hospedeiro, devido à acção imunossupressora dos nemátodes adultos, que promovem
infecções crónicas prolongadas. Protocolos de infecção repetidos com H. polygyrus
normalmente estimulam uma forte imunidade após a re-infecção, e todos os estudos
suportam a hipótese de que a restrição de proteína dietética prolonga a sobrevivência do
nemátode GI e que a deficiência proteica compromete a capacidade de resistência adquirida
do hospedeiro em ratos previamente imunizados (Koski & Scott, 2001). O mecanismo
subjacente à sobrevivência do nemátode é a imunidade comprometida do hospedeiro, e em
todos os casos de eliminação do parasita houve mediação imunológica normal (Ing, Su,
Scott & Koski, 2000).
4.3.2 Deficiências de micronutrientes 4.3.2.1 Zinco
Em ratos com deficiência de zinco houve redução da absorção dos alimentos, maior número
de nemátodes e maior produção individual de ovos. Os parasitas desenvolveram-se
rapidamente em larvas adultas e sobrevivem melhor em ratos com restrição energética
durante uma infecção primária, e mais ainda em ratos com deficiência de zinco, o que pode
reflectir que alterações nos hábitos de migração do nemátode, na resposta inflamatória local
à fase larvar, e/ou na fisiologia GI (como o tempo de trânsito ou contractilidade intestinal),
dependem de zinco e de energia. A deficiência de zinco leva a uma perturbação da resposta
inata e mediada por células T (Koski & Scott, 2001). Níveis subóptimos de zinco diminuiram
a capacidade de destruição dos parasitas fagocitados pelos macrófagos. Esta capacidade
dos macrófagos pode ser restaurada após o tratamento com zinco (Hughes & Kelly, 2006).
4.3.2.2 Vitamina A Vários estudos sugerem que a infecção por Ascaris conduz a má absorção de vitamina A
(Koski & Scott, 2001), mas esta relação ainda é controversa. Poucos estudos têm analisado
os efeitos da deficiência de vitamina A na resistência do hospedeiro a infecções por
nemátodes. Durante a infecção primária com Trichinella spiralis, a deficiência de vitamina A
não alterou: a taxa de expulsão do nemátode, o número de larvas no intestino ou no
músculo, ou o nível de saída dos ovos, apesar da indução de defeitos imunológicos
sistémicos e associados ao intestino, em ratos. No entanto, o número de larvas no intestino
67
ou no músculo, e a produção de ovos de H. polygyrus foram elevados em ratos com
deficiência de vitamina A (Gagnon et al., 1996). O parasitismo intestinal pode levar a
hipovitaminose A porque prejudica o enterócito, que apresenta menor capacidade de
conversão de β-caroteno em retinol (Hughes & Kelly, 2006).
4.3.2.3 Ferro
A deficiência de ferro e anemia hemorrágica têm sido frequentemente observados em
pacientes com infecção por ancilóstomos. Estes nemátodes obtêm os seus nutrientes do
sangue e tecidos do hospedeiro e podem induzir perdas significativas de ferro no intestino.
Estudos em humanos mostram que altos níveis de ingestão de ferro, não baixam a
prevalência de infecção e levaram à conclusão de que a infecção por ancilóstomos provoca
deficiência de ferro, em vez da deficiência de ferro predispor à infecção. Mas em ratos, a
deficiência de ferro aumentou o estabelecimento de larvas e sobrevivência de adultos de Nippostrongylus brasiliensis (Hughes & Kelly, 2006). A repleção de ferro não restaurou
completamente os valores de hemoglobina mas foi eficaz na aceleração da expulsão do
parasita, sugerindo que a resistência adquirida a infecções secundárias de nemátodes é
dependente da nutrição adequada de ferro. É necessária uma investigação sobre os efeitos
da deficiência de ferro em outros nemátodes GI, particularmente os que causam infecções
crónicas, para averiguar o papel do ferro dietético no desenvolvimento e controlo de
parasitismo intestinal (Koski & Scott, 2001).
A má-nutrição energético-proteica bem como a deficiente ingestão de vitamina A, zinco e
ferro predispõem a infecções por nemátodes GI, que, por sua vez, agravam as deficiências
nutricionais e ainda prolongam a sobrevivência de nemátodes no hospedeiro. O grau de
deficiência para que a carga de helmintes aumente difere para cada nutriente. Para a
proteína e energia, alterações nas cargas dos parasitas ocorreram sem sintomas de estado
nutricional comprometido. Isto sugere que as mudanças nos mecanismos de defesa do
hospedeiro ocorreram antes de sinais bioquímicos de deficiência clínica de proteína e
energia. Enquanto que, para a vitamina A e zinco, as deficiências dietéticas severas (que
foram acompanhadas por diminuições nas concentrações no soro e/ou tecidos) surgiram
antes dos efeitos nas defesas do hospedeiro serem notados. Além disso, cada deficiência
nutricional foi independente das outras, sugerindo que cada uma tem um efeito fisiológico
diferente sobre o SI do hospedeiro. Estudos futuros poder-se-ão focar na elucidação da
sensibilidade nutricional das respostas imunes subjacentes à infecção parasitária (Koski &
Scott, 2001).
4.4 Mecanismos imunológicos subjacentes à interacção nutrição - infecção 4.4.1 Imunidade aos nemátodes GI
O fenótipo da resposta produz um padrão dominante de citoquinas e efectores imunitários.
Além disso, cada perfil fenotípico (Th1/Th2) é antagónico na diferenciação e actividade de
68
efectores pertencente ao fenótipo recíproco. Células primárias Th2 secretam interleucinas
IL-4, IL-5, IL-9 e IL-10, que promovem a proliferação e a activação de efectores associados
a Th2, como IgE ou IgG1 secretoras de plasmócitos, eosinófilos e mastócitos, enquanto as
células Th1 produzem IL-2 e IFN-λ e interagem com APC para sintetizar IL-12. As citoquinas
associadas a Th1 são importantes na actividade de macrófagos e para a selecção de
isotipos IgG2a, IgG2b e IgG3, que medeiam respostas contra infecções bacterianas e virais.
A distinção entre estes dois ramos não é completa, e ambos os tipos de células Th secretam
IL-3, factor de necrose tumoral-α, e factor estimulador de colónias de granulócitos e
macrófagos. Além disso, cada citoquina tem efeitos pleiotrópicos (fenotípicos) sobre vários
tipos de células linfóides, e há duplicação de funções entre as diferentes citoquinas (Abbas,
Lichtmann & Pober, 2005).
A imunidade funcional a nemátodes GI envolve citoquinas e efectores sistémicos do tipo Th2
e a IL-4 é um requisito para a resposta de células Th2 (com raras excepções). Em humanos
infectados com helmintes, os níveis séricos de IgE e IgG1 são directamente proporcionais à
produção de IL-4 induzida pelo parasita e inversamente relacionados com a síntese de IFN-
λ, e as actividades de eosinófilos e mastócitos mediadas por IgE são associadas com a
resolução eficaz das infecções helmínticas. Ratos infectados com N. brasiliensis e com
deficiência no sinal activador da transdução e transcrição de IL-4, secretaram quantidades
inferiores de anticorpos dependentes de Th2, mas não de anticorpos dependentes de Th1
(Hughes & Kelly, 2006).
A deficiência de nutrientes prejudica a imunidade sistémica Th1/Th2. A regulação recíproca
de citoquinas Th1/Th2 e seus efectores, produz um fenótipo imunológico dominante, que
para os nemátodes GI é representado pelo fenótipo Th2. As deficiências nutricionais podem
impedir a expressão do fenótipo Th2 dominante. As restrições de energia, proteína, zinco e
vitamina A, resultam na inibição de IL-4 e outras citoquinas Th2, e na sobreexpressão de
citoquinas Th1 IFN-λ. A ausência de citoquinas Th2 e seus efectores resulta na
sobrevivência prolongada do nemátode GI. Estudos em vários nemátodes, demonstram
diferenças importantes de mecanismos entre nutrientes, na sua capacidade para modificar a
relação recíproca entre fenótipos Th1/Th2 e sugerem que a imunopatologia pode ser
resultado de defeitos em vias específicas, e não simplesmente um resultado da
desregulação nos fenótipos Th1/Th2 (Hughes & Kelly, 2006).
4.4.2 Importância da imunidade intestinal em infecções por nemátodes
O TGI é um componente fundamental do sistema imunológico do corpo e a primeira linha de
defesa contra os nemátodes GI. As células no TLAI respondem aos parasitas intestinais
através do processamento de antigénios para reconhecimento pelos linfócitos. Inicia-se uma
cascata de respostas imunes Th2 especializadas aos antigénios específicos de parasitas,
em locais intestinais e sistémicos, através da regulação do trânsito de mediadores
imunitários desde da periferia até ao intestino infectado. As células intestinais participam em
69
actividades citotóxicas que limitam o estabelecimento e a sobrevivência do parasita. Os
progenitores dos mastócitos, basófilos e eosinófilos são atraídos por quimiotaxia à lâmina
própria e ao intraepitélio intestinal. Aí eles ligam-se a IgE e antigénios do parasita, o que
leva à desgranulação e libertação de histamina e proteases, que estão associados com a
expulsão do helminte (Koski & Scott, 2001).
Estes acontecimentos ocorrem rapidamente após a infecção, com um início precoce de
síntese, produção e absorção de citoquinas Th2 pelo TLAI. Outra resposta imune única na
mucosa intestinal é a grande percentagem de células T com receptores delta gama (T- δ / λ)
que fornecem um sinal de contacto para troca de isotipo para produção de IgE na presença
de IL-4. Estas observações demonstram que as células mucosas residentes no intestino são
a fonte essencial de citoquinas locais durante a infecção parasitária inicial (Koski & Scott,
2001).
A imunidade intestinal é afectada por deficiências nutricionais durante as infecções por
nemátodes. Em estudos no modelo de H. polygyrus em ratos, as respostas imunes de locais
linfóides intestinais e periféricos são diferentes, durante as deficiências de proteína, de
energia e de vitamina A. A má nutrição proteica prejudicou mais a produção de IL-4
associada ao intestino do que a sistémica. Células deficientes de linfonodos mesentéricos
secretaram menos IL-4 e mais INF-λ pouco tempo depois do desafio imunitário, enquanto
células deficientes do baço secretaram mais INF-λ após 2 semanas de infecção. A ingestão
proteica adequada foi necessária para a expressão de ARNm e síntese de proteínas de IL-4
no TLAI, mas não afectou a produção de IL-5 e IL-10. A diminuição da IL-4 combinada com
o aumento do INF-λ contribuiu para a redução dos níveis de IgE, mastócitos e eosinófilos
intestinais e para prolongar a sobrevivência do parasita, apoiando a hipótese de que a má
nutrição proteica aumenta a sobrevivência do nemátode, diminuindo citoquinas e efectores
Th2 associados aos intestino e aumentando INF-λ (Ing et al., 2000).
No entanto, nem as deficiências de vitamina A nem de energia, suportam a teoria clássica
que postula a inibição de Th2 e estímulo simultâneo de citoquinas Th1. A restrição de
energia baixou ambos os perfis Th1 (IFN-λ) e Th2 (IL-4, IL-5, IgE, IgG1 e eosinófilos), quer
nos tecidos linfóides intestinais quer nos esplénicos. É necessário um aumento inicial
repentino na produção de IL-4 pelos sistemas imunitários sistémico e TLAI, durante a
primeira exposição a uma infecção por nemátode, mas a restrição energética impede isso
(Koski, Su & Scott, 1999).
Evidências actuais mostram que o SI, durante as infecções por nemátodes em hospedeiros
desnutridos (em proteína, energia, zinco e vitamina A), é caracterizado por redução de
vários efectores imunitários Th2: IgE, IgG1 específicos de parasita e eosinófilos. O zinco e a
energia alteram o funcionamento de componentes celulares específicos, sobretudo células T
e APC (Urguhart et al., 1998), o que indica que defeitos celulares específicos resultam de
deficiências nutricionais. Nenhuma deficiência de um nutriente suprimiu todas as respostas
70
imunes nem todas respostas imunes respondem da mesma forma a cada nutriente. Cada
nutriente tem um papel diferente em modificar perfis Th1/Th2 durante infecções por
nemátodes GI, e as respostas nos tecidos intestinal e sistémico diferem significativamente.
O estado imunológico do hospedeiro limita o nível de contaminação por modificar o
desenvolvimento de novas infecções, pela destruição de parasitas, ou por inibição nos
estágios larvais, enquanto as cargas de parasitas adultos existentes são expulsas ou a sua
produção de ovos é drasticamente reduzida.
O número de parasitas que sobrecarrega o hospedeiro é controlado por factores genéticos
do hospedeiro e pela natureza da resposta do hospedeiro a esses parasitas. Alguns animais
podem estar predispostos a uma forte infecção, como resultado de factores genéticos,
comportamentais, nutricionais ou ambientais. Esta predisposição deve também reflectir
diferenças na exposição, susceptibilidade ou resistência. Há evidências de que a resistência
a infecções intestinais por protozoários como a coccidiose, cai durante a gravidez e a
lactação, aumentando, portanto, a disseminação destas importantes infecções (Urguhart et
al., 1998).
4.4.3 Imunidade contra as infecções por protozoários e helmintes gastrointestinais
Ao contrário das infecções agudas de curta duração causadas pelas bactérias e vírus, as
infecções causadas pelos protozoários ou helmintes são de longa duração e crónicas. Estas
infecções indicam uma inibição do SI do hospedeiro bem sucedida, em que esses parasitas
manipulam as respostas imunes e regulam a imunidade do hospedeiro para assegurar um
ambiente benéfico para a sobrevivência de ambos (Tizard, 2002). O parasita, ao mesmo
tempo, permite que outras respostas ocorram, prevenindo a morte do hospedeiro por outras
infecções. Além disso, muitos parasitas fazem uso das vias metabólicas ou de controlo para
seu próprio uso. Por exemplo, vários protozoários fazem uso de citoquinas e factores de
crescimento para promover seu próprio crescimento, tais como IL-2, GM-CSF (Granulocyte
macrophage colony-stimulating factor), IFN-λ e factor de crescimento epitelial (Roitt &
Delves, 2006).
Os protozoários e helmintes dão origem a infecções crónicas e persistentes, porque a
imunidade inata contra eles é fraca e os parasitas desenvolveram múltiplos mecanismos
para escapar e resistir à imunidade específica (Abbas et al., 2005). A resistência do
hospedeiro depende de inúmeros mecanismos de defesa, mas de uma forma geral, os
protozoários que vivem dentro das células do hospedeiro são destruídos pela imunidade
mediada por células, enquanto os helmintes são eliminados por anticorpos IgE e pela
destruição mediada por eosinófilos e por outros leucócitos (Roitt & Delves, 2006).
Geralmente estes parasitas têm especificidade de hospedeiros e os antigénios dos parasitas
são estágio-específicos (Roitt, Brostoff & Male, 2003).
71
4.4.3.1 Imunidade Inata
Apesar de diversos protozoários e helmintes activarem diferentes mecanismos de imunidade
inata, estes parasitas são frequentemente capazes de sobreviver e replicar-se nos seus
hospedeiros, porque estão bem adaptados para resistir às suas defesas. A principal
resposta imune inata aos protozoários é a fagocitose, mas muitos deles são resistentes à
morte fagocítica e podem mesmo replicar-se dentro dos macrófagos. Os coccídeos são
extremamente hospedeiro-específicos (Tizard, 2002). Os fagócitos também atacam
helmintes e secretam substâncias microbicidas para destruir parasitas que são muito
grandes para serem fagocitados. Muitos helmintes possuem tegumento duro que os tornam
resistentes aos mecanismos citocidas dos neutrófilos e macrófagos. Os macrófagos actuam
como células killer através da citotoxicidade celular dependente de anticorpo (ADCC). Os
intermediários reactivos do oxigénio (ROI) são gerados pelos macrófagos e granulócitos
após a fagocitose de alguns protozoários. Quando activados pelas citoquinas, os
macrófagos libertam mais superóxidos e peróxido de hidrogénio do que os macrófagos
residentes normais, e os mecanismos de destruição O2-independentes também são
potencializados. Células efectoras como macrófagos, neutrófilos, eosinófilos e plaquetas
podem destruir os protozoários e os helmintes. Estas células secretam moléculas
citotóxicas, como os radicais livres e o óxido nítrico (NO), e todas são mais eficientes
quando activadas por citoquinas. O NO contribui para a resistência do hospedeiro e no
controlo da maioria das infecções parasitárias. A acção conjunta de citoquinas, IFN-λ e
TNFα potencia a síntese de NO pelos macrófagos. Alguns helmintes podem também activar
a via alternativa do complemento, embora parasitas recuperados de hospedeiros infectados,
possam desenvolver resistência à lise mediada pelo complemento (Abbas et al., 2005).
As infecções helmínticas são influenciadas por outros helmintes dentro do mesmo
hospedeiro. A presença de parasitas adultos no intestino pode retardar o desenvolvimento
posterior dos estágios larvares da mesma espécie dentro dos tecidos. A competição
interespecífica entre os helmintes por habitats mútuos e nutrientes no tracto intestinal
determina o número, localização e composição de helmintes de um animal. Os factores
inatos do hospedeiro que influenciam as cargas de helmintes incluem idade, sexo e base
genética do hospedeiro. A influência da idade e do sexo nas cargas de helmintes parece ser
em grande parte hormonal. Nos animais cujo ciclo sexual é sazonal, os parasitas tendem a
sincronizar o seu ciclo reprodutivo com os dos seus hospedeiros. As larvas de Toxocara
canis podem migrar de uma cadela infectada para o fígado do feto, resultando em infecção
congénita. Uma vez nascidos, os cachorros infectados podem reinfectar a mãe através da
via fecal-oral mais convencional (Tizard, 2002).
Os mecanismos hormonais e imunológicos medeiam as diferenças sexuais na infecção
parasitária. A prevalência e intensidade de infecções causada por protozoários e
nemátodes, são maiores no sexo masculino do que no feminino. As diferenças imunológicas
72
subjacentes entre os sexos aumentam o parasitismo no sexo masculino. Vários estudos
relacionam as diferenças sexuais na função imune com hormonas esteróides circulantes
(como a testosterona, estradiol, progesterona e glicocorticóide). Além do hospedeiro afectar
as respostas hormonais à infecção, os parasitas podem produzir hormonas e alterar as suas
concentrações nos seus hospedeiros. Apesar das diferenças imunológicas entre os sexos,
as diferenças genéticas e comportamentais podem explicar algumas diferenças de
variabilidade na resposta à infecção. A resistência do hospedeiro aos helmintes pode ser
geneticamente regulada. Em muitos casos, a resistência aos parasitas está associada ao
CMH (Klein, 2004).
4.4.3.2 Imunidade Adquirida
A diversidade estrutural e antigénica dos protozoários e helmintes, com diferentes
propriedades bioquímicas, ciclos de vida e mecanismos patogénicos, reflecte-se na
heterogeneidade das respostas imunes adaptativas que eles desencadeiam. De forma geral,
os protozoários evoluíram para sobreviver dentro de células do hospedeiro, de forma que a
imunidade contra estes parasitas é mediada por mecanismos semelhantes aos que
eliminam bactérias e vírus intracelulares. Os protozoários escondem-se dos anticorpos
dentro dos macrófagos e são destruídos quando os macrófagos são activados por
citoquinas Th1 produzidas durante as respostas imunes mediadas por células (Abbas et al.,
2005). Os mecanismos de imunidade contra alguns coccídeos intestinais são obscuros. Por
exemplo, infecções em galinhas com algumas estirpes do parasita intestinal Eimeria maxima
levam ao desenvolvimento da imunidade que pode impedir uma reinfecção, e que inibe o
crescimento de trofozoíta (o 1º estágio invasivo) dentro das células epiteliais intestinais. Na
infecção pelo estágio coccidiano de T. gondii nos gatos, ele estimula efectivamente uma
resposta imune capaz de inibir uma reinfecção (Tizard, 2002).
Os helmintes são um desafio para o SI. Eles sobrevivem em tecidos extracelulares, e a sua
eliminação depende frequentemente de respostas de anticorpos. Ao contrário de bactérias
ou protozoários, os nemátodes possuem uma cutícula extracelular espessa que protege a
membrana plasmática hipodérmica da agressão tóxica (Roitt et al., 2003). Na larva
infectante de Toxocara canis, o revestimento de superfície está ligado a uma ferrina
cationizada sobre a cutícula. As cutículas dos helmintes não podem ser penetradas pelo
complexo de ataque de membrana do complemento ou pelas perforinas derivadas de
células T. Os helmintes adultos são banhados nas enzimas do hospedeiro, IgA e mucinas
enquanto se alimentam, e encontram células efectoras no TGI, citoquinas, anticorpos e
complemento, que podem destruir a cutícula (Tizard, 2002).
73
4.4.3.2.1 Imunidade Humoral
As superfícies da mucosa intestinal são defendidas por mecanismos antigénio-específicos e
antigénio-inespecíficos. A imunidade específica é proporcionada pela IgA secretora e pela
IgM, com a IgA1 a predominar no intestino delgado e a IgA2 no intestino grosso. Se um
agente infeccioso é bem sucedido e consegue atravessar a barreira de IgA, ele defronta-se
com a próxima linha de defesa do sistema excretor, que é dotada de IgE. A maior parte da
IgE sérica origina-se de plasmócitos nas mucosas e nos linfonodos que as drenam. Apesar
de estar presente em baixa concentração, a IgE liga-se intensamente aos receptores Fc do
mastócito, e o contacto com o antigénio leva à libertação de mediadores que recrutam
agentes da resposta imune e geram uma reacção inflamatória local. De forma geral, a
exclusão imunológica no intestino não é inflamatória, mas a eliminação imunológica dos
microrganismos que penetram na mucosa é pró-inflamatória (Roitt & Delves, 2006).
O anticorpo por si só, ou com complemento, é eficiente contra os parasitas extracelulares,
favorece o potencial fagocítico e citotóxico das células efectoras e pode impedir a invasão
de novas células do hospedeiro pelos parasitas (Roitt et al., 2003). As reacções mediadas
por IgE podem ser vitais para a recuperação da infecção, enquanto a resistência em
hospedeiros vacinados pode ser mais dependente dos anticorpos IgG e IgA pré-formados
(Roitt & Delves, 2006).
A resposta mediada por eosinófilos IgE-dependente é talvez o mecanismo mais importante
de resistência aos helmintes, mas outras classes de imunoglobulinas também exercem um
papel protector. Os mecanismos envolvidos incluem: o bloqueio dos poros anal e oral de
larvas por meio de imunocomplexos, como os anticorpos combinados com os seus produtos
excretores e secretores (exemplo: precipitados imunes dos poros da larva de Toxocara
canis); o dano directo, em que o anticorpo activa a via clássica do complemento e provoca
lesão na membrana do nemátode; a neutralização mediada por anticorpos das proteases
utilizadas pelas larvas para penetrar nos tecidos; o impedimento da ecdise e inibição do
desenvolvimento larvar por anticorpos direccionados contra os antigénios fora da cutícula
(Tizard, 2002). Os produtos de excreção e secreção da larva de T. canis são os antigénios
funcionais mais importantes na resposta imune contra a toxocariose. No estudo da
localização ultraestrutural do 2º estágio da larva de T. canis, foram observadas partículas de
alta densidade nas células secretoras, ductos excretores, epitélio intestinal e na cutícula da
larva (Else, 2005). Em estudo sobre os efeitos do endoparasitismo na resposta imune,
demonstrou-se o papel da infecção por Toxocara cati no estímulo da resposta IgE a
antigénios administrados oralmente em gatos, e, portanto, possivelmente, em indivíduos
geneticamente susceptíveis, no desenvolvimento de hipersensibilidade alimentar (Gilbert &
Halliwell, 2005).
74
4.4.3.2.1.1 Resposta imune da mucosa às infecções parasitárias A infecção por Giardia sp. começa quando o hospedeiro ingere cistos deste protozoário
presentes na água ou comida contaminada. No ID proximal, os cistos libertam trofozoítos
móveis, que se escondem na camada mucosa e atacam a superfície do epitélio. O género
Giardia pode submeter a superfície a uma variação antigénica através da modulação da
expressão de diferentes proteínas de superfície variantes-específicas, permitindo a evasão
imune. Os produtos de excreção/secreção (ESP) são glicoproteínas termoestáveis sensíveis
a proteases. Anticorpos séricos de pacientes com Giardia reconhecem a proteína ESP
purificada. A imunização de ratos com ESP estimula a imunidade local, evidenciando o
aumento da actividade das células Th e de IgA (Mohamed & Jonathan, 2005).
Em ascarídeos, como Toxocara canis, a deficiência nutricional diminui a imunidade da
mucosa e aumenta a produção de anticorpos IgE policlonais. A espécie Ancylostoma
caninum do cão pode habitar humanos, causando diarreia e gastroenterite eosinofílica
severa. A infecção do nemátodo adulto é associada com resposta de anticorpos dominada
por IgE, IgG1 e IgG4, que são controlados pelas citoquinas Th2. Estes Ac são detectados
pela imunoprecipitação à volta da abertura oral do parasita ou por ELISA ou Western
Blotting com o uso de antigénios excretores/secretores. Anticorpos anti-larva L3 reconhecem
a superfície do antigénio na bainha da larva L3 mas não retiram a bainha. Os Ac detectados
no fluido da bainha retirada reflectem os Ag que se desviam da resposta imune. As
respostas dos Ac IgE aos antigénios L3 do parasita são altamente específicos e sensíveis a
um diagnóstico da infecção com alguma reactividade cruzada. A rápida resistência a L3
desenvolvida em ratos é atribuída aos níveis aumentados de IgM, IgG1 e IgE, apesar do
ciclo de vida incompleto. A resposta leucocítica à infecção por nemátodos adultos é
dominada pela eosinofilia, e o número de eosinófilos no sangue periférico reflecte a carga
parasitária (Mohamed & Jonathan, 2005).
4.4.3.2.1.2 Processos envolvidos na expulsão de nemátodes intestinais
Há dois estágios na expulsão de nemátodes intestinais, alcançada por uma combinação de
mecanismos T-dependentes e T-independentes:
1º) Células T (sobretudo Th2) respondem aos antigénios do parasita e induzem a: (a)
produção de anticorpos pelas células que sofreram proliferação, em resposta a IL-4 e IL-5;
(b) proliferação dos mastócitos da mucosa, em resposta a IL-3, IL-4, IL-9 e IL-10; (c)
hiperplasia das células caliciformes, secretoras de muco no epitélio intestinal, induzida por
citoquinas libertadas por células T antigénio-específicas. O nemátode é danificado pelo
anticorpo IgG passando para o lúmen intestinal, em consequência da inflamação mediada
por IgE e possivelmente auxiliado por células ADCC acessórias (Tizard, 2002).
2º) Moléculas inflamatórias inespecíficas, secretadas pelos macrófagos (incluindo TNF e IL-
1), estimulam a proliferação das células caliciformes e aumentam a secreção de muco, que
75
reveste o helminte lesionado e facilita a sua expulsão do animal (Roitt et al., 2003). A
combinação dos antigénios de helmintes, com as IgE ligadas a mastócitos desencadeiam
desgranulação e libertação de moléculas vasoactivas e proteases. Estas moléculas
estimulam a contracção da musculatura lisa intestinal e o aumento da permeabilidade dos
capilares intestinais, o que permite um efluxo do fluido no lúmen intestinal levando ao
desalojamento e expulsão de muitos helmintes (evasão intestinal). A defesa contra muitas
infecções por helmintes é mediada pela activação de células Th2, que resulta na produção
de anticorpos IgE e na destruição pelos eosinófilos e por outros leucócitos (Tizard, 2002).
Os mastócitos da mucosa contêm vários mediadores como as prostaglandinas, proteases e
histamina, e são uma fonte de citoquinas (como IL-3, IL-4, IL-5, GM-CSF e TNFα), que
podem regular a indução de respostas Th2 protectoras e de inflamação intestinal,
associadas com a expulsão do nemátode (Ierna, Scales, Saunders & Lawrence, 2008). Os
macrófagos ligados com as larvas de helmintes por meio de IgE, activam-se com o aumento
das enzimas lisossomais, produção de ROI, IL-1, leucotrienos, prostaglandinas e factor
activador plaquetário (FAP), que potencializam a destruição do helminte (Tizard, 2002).
Na expulsão do nemátode (Figura7), há uma combinação da estimulação da motilidade
intestinal por mediadores do mastócito e da activação das inúmeras células caliciformes
intestinais por citoquinas. Estas células secretam um gel viscoelástico à volta do helminte,
protegendo, assim, as superfícies intestinal e do colón contra a invasão (Roitt & Delves,
2006).
Figura 7 - Expulsão de nemátodes do intestino (Roitt & Delves, 2006)
O número de células caliciformes no epitélio jejunal e a secreção do muco aumentam em
proporção à carga parasitária (Roitt et al., 2003). A expulsão do helminte pode ser facilitada
pela diarreia, resultante da inibição da absorção de sódio glicose-dependente por histamina
derivada do mastócito e PGE2 (Roitt & Delves, 2006).
76
4.4.3.2.1.3 Eosinófilos e Destruição de Parasitas
Os eosinófilos são atraídos aos locais de invasão dos nemátodes por meio de moléculas
quimiotáticas libertadas por mastócitos em desgranulação. A reacção antigénio-específica
dos mastócitos revestidos por IgE leva à exsudação de proteínas séricas, contendo
elevadas concentrações de anticorpos protectores e à libertação do factor quimiotático do
eosinófilo. Citoquinas como IL-5 de células Th2 também mobilizam um grupo de eosinófilos
da medula, libertando um grande número de eosinófilos na circulação. Outras moléculas
quimioatractivas incluem as quimiocinas e as eotaxinas, que têm actividade quimiotática
selectiva para eosinófilos e actuam sinergicamente com IL-5 (Tizard, 2002).
Os eosinófilos podem ser mais eficazes na destruição de helmintes do que outros
leucócitos, porque a proteína básica principal dos grânulos dos eosinófilos é mais tóxica
para os helmintes do que as enzimas proteolíticas e os ROI produzidos por neutrófilos e
macrófagos. Como possuem receptores de FcE, os eosinófilos podem ligar-se aos parasitas
recobertos com anticorpos IgE. Uma vez ligados, eles desgranulam e libertam o seu
conteúdo granular sobre a cutícula do parasita. Esses conteúdos granulares incluem os
produtos da oxidação respiratória gerados pela peroxidade de eosinófilos e enzimas líticas.
A proteína básica principal e o núcleo cristalino dos grânulos específicos, podem danificar as
cutículas dos helmintes. A proteína catiónica eosinófilica e a neurotoxina dos eosinófilos são
ribonucleases letais para helmintes. Dada a diversidade dos helmintes, é importante
salientar que os eosinófilos não devem ser efectivos contra todos os parasitas. Por exemplo,
a larva de Toxocara canis exposta a eosinófilos in vitro, liberta apenas a sua capa larvar
juntamente com células aderentes (Abbas et al., 2005). Evidências sugerem que os
eosinófilos estão envolvidos na defesa específica contra os estágios teciduais dos helmintes
que são grandes demais para serem fagocitados, e que a reacção do mastócito dependente
de IgE vai localizar os eosinófilos próximos ao parasita e, então, potencializar as suas
funções anti-parasitárias (Roitt et al., 2003).
4.4.3.2.2 Imunidade Mediada por Células
As respostas imunes aos microorganismos infecciosos envolvem duas categorias de células
T helper (Th). As Th1 são responsáveis pela imunidade mediada por células contra
bactérias, vírus, protozoários e parasitas intracelulares, enquanto as Th2 medeiam a
imunidade dependente de anticorpo contra parasitas extracelulares, como os nemátodes GI
(Roitt & Delves, 2006). O principal mecanismo de defesa contra protozoários que
sobrevivem dentro dos macrófagos é a imunidade mediada por células, particularmente a
activação do macrófago por citoquinas de células Th1. A infecção de ratos com Leishmania
major é o exemplo melhor documentado de como a predominância das respostas Th1 ou
Th2 determina a resistência ou susceptibilidade à doença. A resistência à infecção está
associada à activação de células Th1 CD4+ específicas para Leishmania, que produzem
77
citoquinas (como o IFN-λ) que activam macrófagos para destruírem parasitas intracelulares.
Pelo contrário, a activação de células Th2 pelos protozoários resulta no aumento da
sobrevivência do parasita e exacerbação das lesões devido às acções supressoras no
macrófago das citoquinas Th2, sobretudo a IL-4 (Abbas et al., 2005).
Um aspecto marcante da reacção imune às infecções por helmintes é a eosinofilia e altos
níveis de anticorpos IgE produzidos, características da resposta às citoquinas do tipo Th2.
Os melhores exemplos de imunidade adquirida aos helmintes são descritos em estirpes de
ratos consanguíneos, que têm diferenças na capacidade de expulsar nemátodes intestinais
(Roitt & Delves, 2006). Alguns hospedeiros montam uma resposta Th1 e então desenvolvem
infecção crónica, enquanto outros montam uma resposta Th2 e expulsam os seus parasitas.
A capacidade para expulsar nemátodes intestinais depende das células T CD4+. A resposta
Th2 está associada com a produção de citoquinas IL-4, IL-5, IL-9, IL-10 e IL-13, induzindo a
uma produção de IgE e hipertrofia dos mastócitos intestinais (mediadas pela IL-4), bem
como o desenvolvimento da eosinofilia (mediado pela IL-5). A produção de citoquinas Th2
tem efeito directo na população dos parasitas. A espécie do parasita, sua localização
anatómica no intestino e o estado imunitário do hospedeiro, são factores que provavelmente
influenciam se um determinado mecanismo efector será ou não eficaz na eliminação do
parasita (Tizard, 2002).
O que determina se um animal monta uma resposta Th1 ou Th2 não está esclarecido. Isso
depende de como o antigénio é processado, da carga antigénica ou do haplótipo do CMH do
animal. Pode ser que a natureza da resposta seja influenciada pelos próprios parasitas.
Estirpes de parasitas diferem na sua habilidade de desencadear respostas Th1 e Th2.
Alguns predominantemente desencadeiam uma resposta ou outra. A quantidade de parasita
também deve causar algum efeito. Assim, baixos níveis de infestações de T. muris
estimulam uma resposta Th1. Quando a carga parasitária aumenta, a resposta muda
gradualmente para Th2 e os parasitas são expulsos. Dessa forma, o limiar de detecção é
crítico para a construção da resistência. As células T sensibilizadas deprimem as
actividades dos helmintes por meio de dois mecanismos: 1) desenvolvimento de uma
hipersensibilidade retardada que atrai as células mononucleares para o local de invasão
larvar e torna o ambiente local inadequado para o crescimento ou a migração; 2) os
linfócitos citotóxicos podem causar a destruição larvar. Os antigénios de helmintes
estimulam preferencialmente respostas Th2, mas podem ocorrer respostas Th1 e, como
resultado, as células citotóxicas atacam os helmintes que se encontram profundamente
incrustados na mucosa intestinal ou que sofrem migrações teciduais. Parece que a resposta
Th1 ocorre, quando o parasita não consegue modular muito tempo a resposta imune do
hospedeiro (Tizard, 2002). A capacidade dos helmintes em direccionar as respostas do tipo
Th2 ainda precisa ser explicada, mas existem inúmeras possibilidades. As APC, em
78
particular a célula dendrítica que apresenta o antigénio para a célula T, parece exercer um
papel fundamental na determinação do fenótipo final da resposta (Roitt et al., 2003).
Um estudo de Little, Bell, Cliffe e Else (2005) fez a caracterização de linfócitos intraepiteliais
(IEL), leucócitos da lâmina própria (LPL) e folículos linfóides isolados no intestino grosso de
ratos infectados com o nemátode intestinal Trichuris muris, para averiguar o papel das
citoquinas e o mecanismo efector local que culmina na expulsão dos nemátodes do intestino
grosso. Utilizaram-se técnicas imunohistoquímicas e de citometria de fluxo para caracterizar
o fenótipo de IEL e LPL do intestino grosso de estirpes resistentes e susceptíveis de ratos
infectados com T. muris. Assim, este estudo revela as respostas imunes locais subjacentes
à expulsão de nemátodes (Th2 - IEL CD4+ e LPL F4/80+) ou a persistência de uma infecção
crónica (Th1 - IEL CD8+ e LPL F4/80+).
A sinalização da célula T TGF-β é essencial para a estimulação helmíntica da produção de
IL-10 da mucosa, na modulação da imunidade intestinal de helmintes através de IFN-λ e na
supressão de colite crónica mediada pelo helminte (Ince et al., 2009). A IL-33 é um indutor
potente da imunidade adaptativa aos nemátodes intestinais, com capacidade para induzir
uma resposta Th2, sobretudo no início da mesma. A IL-33 actua independentemente das
células T, alterando a patologia da mucosa intestinal em ratos cronicamente infectados,
conduzindo a um aumento do comprimento da cripta e da proliferação celular intestinal, mas
reduzindo a hiperplasia das células de Goblet (Humphreys, Xu, Hepworth, Liew & Grencis,
2008). As células epiteliais intestinais produzem TSLP (linfopoietina RNAm do estroma do
timo). A TSLP regula a imunidade intestinal e a inflamação em modelos de rato com
infecção de helmintes e colite. A TSLP e o seu receptor induzem respostas Th2 e a
expulsão do helminte (Taylor et al., 2009).
4.5 Mecanismos de evasão da resposta Imune
Os parasitas desenvolveram várias estratégias para escapar à imunidade do hospedeiro:
perda de imunogenicidade, variação antigénica, eliminação do glicocálice, bloqueio dos
anticorpos e de tolerância.
a) Alguns helmintes evitam o reconhecimento do antigénio ao se disfarçarem como o
hospedeiro, através do mimetismo molecular ou da absorção, síntese e expressão dos
antigénios do hospedeiro na sua superfície, de tal forma que este não os distingue dos seus
próprios antigénios. Muitos helmintes desenvolveram métodos de resistência, expressando
antioxidantes de superfície como superóxido-dismutase e glutationa-peroxidase (Roitt &
Delves, 2006);
b) Os parasitas modificam os seus antigénios de superfície durante o seu ciclo de vida nos
hospedeiros. Duas formas de variação antigénica estão bem definidas em protozoários. A 1ª
é uma alteração estágio-específica na expressão antigénica, de tal forma que os estágios
teciduais maduros produzem antigénios diferentes dos produzidos pelos estágios
79
infecciosos. A 2ª é variação contínua dos seus antigénios de revestimento externo, a
glicoproteína variável de superfície. O novo antigénio dominante é alterado por mecanismos
de troca genética para uma molécula diferente quando é formado o anticorpo para a
primeira variante. Uma consequência da variação antigénica é que é difícil vacinar de forma
eficaz indivíduos contra estas infecções. Nos helmintes é reconhecida uma variação
antigénica sequencial. Os antigénios cuticulares das larvas de T. spiralis são muito alterados
após cada muda (Abbas et al., 2005).
c) Alguns helmintes, eliminam o seu glicocálice e, a partir disso, os seus antigénios de
superfície quando expostos a anticorpos específicos (Tizard, 2002);
d) Alguns nemátodes desenvolveram um mecanismo elegante de neutralização dos
anticorpos que consiste na secreção de proteases que clivam as imunoglobulinas,
removendo a porção Fc do anticorpo (Roitt et al., 2003);
e) Os parasitas também podem expelir as suas coberturas antigénicas, espontaneamente
ou após ligação com anticorpos específicos. A expulsão torna o parasita resistente aos
mecanismos imunitários efectores (Abbas et al., 2005).
Os parasitas desviam-se da resposta imunológica do hospedeiro. Os protozoários podem
esconder-se do SI dentro das células do hospedeiro ou desenvolvendo cistos que são
resistentes aos efectores imunes. Os nemátodes que residem no lúmen intestinal são
protegidos dos mecanismos mediados por células (Roitt & Delves, 2006). A invasão dos
parasitas na resposta imune do hospedeiro ocorre de várias maneiras. Alguns exploram as
respostas do hospedeiro para o seu próprio desenvolvimento, mas a maioria interfere na
resposta. A imunossupressão pode contribuir para a sobrevivência dos helmintes e reflecte-
se na redução da resistência a outras infecções e uma pobre resposta à vacinação.
Enquanto alguns parasitas podem causar o rompimento das células ou dos tecidos linfóides
directamente (por ex. larvas jovens de T. spiralis que libertam um factor solúvel linfotóxico),
a supressão pode resultar da interferência com a função macrofágica, com indução de
macrófagos que suprimem a proliferação de células T. Também existem consideráveis
evidências de que os parasitas interferem com a apresentação de antigénios (Roitt et al.,
2003).
Os parasitas produzem moléculas que interferem na função imune do hospedeiro. Um
nemátode com fosforilcolina inibiu a proliferação das células T e B. Esta molécula causa
uma redução nos níveis de proteína cinase C e pode tornar as células T e B alérgicas. Os
parasitas também produzem moléculas semelhantes a citoquinas que mimetizam o TGF-β, o
factor de inibição da migração e um factor libertador da histamina. Os genes que codificam
os possíveis homólogos das citoquinas estão a ser encontrados como parte dos projectos
em curso de sequenciação do genoma de parasitas. Embora as sequências estejam
relacionadas com as citoquinas ou seus receptores, as suas funções ainda precisam ser
estabelecidas (Roitt et al., 2003).
80
4.6 Consequências imunopatológicas das infecções parasitárias
Além dos efeitos destrutivos directos de alguns parasitas e seus produtos, nos tecidos do
hospedeiro, muitas respostas imunes possuem por si só efeitos patológicos. A
imunopatologia é sobretudo mediada pelas células T. A IgE das infecções helmínticas pode
ter efeitos severos no hospedeiro, através da libertação de mediadores pelos mastócitos. As
infecções parasitárias estão associadas com grandes quantidades de anticorpos
inespecíficos, esplenomegália e hepatomegália. As infecções helmínticas apresentam sinais
característicos da hipersensibilidade do tipo I, como eosinofilia, edema, asma e dermatite.
Reacções semelhantes à asma ocorrem nas infecções por Toxocara canis (Roitt et al.,
2003). Quando ocorre no intestino, a reacção está associada ao aumento de permeabilidade
intestinal a macromoléculas como proteínas, o que pode ser um factor significativo em
animais imunes sob desafio larvar intenso (Ulguhart et al., 1998) Algumas infecções
helmínticas, como a ancilostomose, são acompanhadas por uma reacção positiva de
anafilaxia cutânea passiva aos antigénios do parasita (Tizard, 2002).
4.7 Nutrição, infecção e imunidade – um paradigma co-evolutivo
O conceito dum compromisso co-evolutivo entre a imunidade protectora no hospedeiro e a
infecção parasitária não é novo. Ao invés de conspirarem contra o SI, os helmintes têm co-
evoluído com ele, vivendo em equilíbrio através da produção de uma gama de agentes
imunomoduladores que apoiam uma relação parasita-hospedeiro bem sucedida. Os
nemátodes GI têm desenvolvido uma capacidade afinada de reconhecer sinais bioquímicos
e fisiológicos do hospedeiro, a fim de iniciar o seu estabelecimento. A resistência do
hospedeiro aos nemátodes GI é uma característica hereditária ligada directamente à
expressão de imunidade do hospedeiro, com um espectro fenotípico que varia da
susceptibilidade exagerada à rápida depuração da infecção. Como as infecções helmínticas,
em geral, não induzem imunidade de longa duração, a estratégia imunitário mais eficaz
pode não ser debelar completamente uma infecção já existente, mas suportar uma infecção
crónica de baixo nível que forneça uma estimulação antigénica contínua (Koski & Scott,
2001).
Será que com a melhoria das condições nutricionais, o hospedeiro fez evoluir os recursos
adicionais para investir em crescimento, reprodução e manutenção dos tecidos, ou para
montar uma resposta imune mais vigorosa? A resposta poderá estar na hipótese da higiene
que propõe que a estimulação do SI pelos microrganismos protege o hospedeiro do
desenvolvimento de doenças inflamatórias. Assim, uma exposição reduzida a agentes
infecciosos pode explicar o aumento de doenças alérgicas e auto-imunes em países
desenvolvidos, devido a regulação desordenada do SI (Roitt & Delves, 2006). A hipótese
estabelece que a falta de maturidade no SI de crianças, de uma resposta imune do tipo Th1
ou Th2, pode ser causada pela menor estimulação microbiana nesses países (Romagnani,
81
2004). É proposto que as infecções virais e bacterianas durante o início da vida, estimulam
uma resposta imune Th1, reduzem respostas Th2 potencialmente alérgicas, prevenindo
reacções de hipersensibilidade tipo I. A suposta redução na carga microbiana geral permite
que as respostas Th2 naturais dos neonatos persistam e assim aumenta a alergia (Cave,
2008).
Os países desenvolvidos são caracterizados pela abundância de alimentos, cuidados
adequados de saúde, intervenções farmacêuticas, e redução drástica das infecções por
nemátodes GI, apesar do aumento da incidência de alergias alimentares. Em contraste,
países em desenvolvimento, caracterizam-se por má nutrição, cargas elevadas de helmintes
e outros parasitas, mas redução da prevalência de alergias e doenças auto-imunes (Koski &
Scott, 2001). A contribuição de estudos com parasitas e alergia para a compreensão da
hipótese da higiene tem duas vertentes: 1º vários estudos mostraram uma associação
inversa entre a exposição a helmintes intestinais e a alergia, com supressão de reacções
alérgicas tipo Th2 pela infecção helmíntica; 2º os mecanismos que suportam estes efeitos
protectores forneceram novas perspectivas e teorias sobre a capacidade das moléculas
derivadas do parasita em inibir as respostas imunes e desse modo, controlar doenças
inflamatórias como as alergias (Roitt & Delves, 2006).
Os parasitas têm um papel relevante na regulação da resposta alérgica ao alimento e outros
alergénios. O aumento de níveis de citoquinas (como a IL-10), que ocorre durante uma
infecção prolongada de helmintes, está inversamente relacionado com a alergia. Foi
sugerido que a resposta do hospedeiro ao parasita determina a sua predisposição para o
desenvolvimento de doenças alérgicas, e que a indução de uma resposta reguladora anti-
inflamatória intensa (IL-10), induzida pelo desafio imune persistente, oferece uma explicação
unificadora para a associação inversa de muitas infecções com as alterações alérgicas
(Yazdanbakhsh, Kremsner & Ree, 2002). Com a “hipótese da higiene”, o papel do
parasitismo e outras infecções tem de ser definido relativamente à sua influência no
desenvolvimento da hipersensibilidade alimentar.
Demonstrou-se que a colonização com helmintes altera a reactividade imune e protege
contra a inflamação desregulada. Os helmintes podem minimizar a imunopatologia, reduzir a
susceptibilidade a doenças alérgicas e imuno-mediadas, bem como a sua severidade
(Elliott, Summers & Weinstock, 2007). Também há evidências que a infecção com helmintes
pode proteger o desenvolvimento de DII, doenças neuroinflamatórias, depressão associada
com o aumento das citoquinas inflamatórias e algumas neoplasias (McKay, 2009).
As respostas Th2 induzidas por alergénios ou helmintes têm características comuns.
Contudo, IgE alergénio-específicos podem ser sempre detectados em pacientes atópicos,
enquanto IgE helmintes-específicos não são frequentemente detectados e a anafilaxia
ocorre na atopia mas não na infecção helmíntica. Isto pode ser devido a respostas T
82
reguladoras induzidas por helmintes ou pela falta de IgE específicos dos helmintes (Erb,
2007).
Os helmintes protegem contra a doença alérgica e a atopia. Estes parasitas induzem uma
rede sistémica imunomoduladora, que inclui células T reguladoras e anti-inflamatórias IL-10,
que podem proteger contra o fenótipo alérgico. Estudos recentes não apoiam a hipótese de
saturação dos mastócitos IgE, mas sugerem que a protecção é associada com produção de
IL-10. Há uma relação negativa entre asma clínica e infecção com algumas espécies de
helmintes, sobretudo Ancylostoma. Além disso, nenhum estudo demonstrou um aumento na
alergia clínica após o tratamento anti-helmíntico.
Começam-se a compreender os factores genéticos do hospedeiro que podem estar
envolvidos. Uma célula do tipo Th2 geneticamente predeterminada num meio dominado por
citoquinas, reduz a carga parasitária e melhora a sobrevivência do hospedeiro num
ambiente em que os helmintes são prevalentes. A falta de exposição ao parasita nesses
hospedeiros pode levar a uma hipersensibilidade a um estímulo alergénio ambiental
aparentemente menor (Flohr, Quinnell & Britton, 2009). As respostas Th2 de limpeza da
mucosa são patológicas na alergia e protectoras nas infecções helmínticas. As variantes
genéticas comuns estimuladoras de Th2, sobretudo IL-13 e STAT6, predizem o aumento do
risco de alergia e o decréscimo da infecção pelo nemátode Ascaris (Hopkin, 2009).
Croese e Speare (2006) observaram que a alergia intestinal expulsa os nemátodes. Ao
contrário da resposta neutral à volta dos nemátodes residentes, os adultos recém-chegados
provocam uma enteropatia eosinofílica. Esta reacção alérgica restringe o ataque dos
nemátodes e acompanha a passagem de outros, à medida que eles são expulsos do ID
proximal. Estudos mostraram que a activação de glicanos - expressos pelos helmintes nas
células imunitárias do hospedeiro - regula grande parte da polarização Th2 e anti-
inflamatória observada. Os glicanos dos helmintes induzem a produção de citoquinas,
quimiocinas e anticorpos (Thomas & Harn, 2004). Alguns biólogos evolucionistas têm
sugerido que os parasitas intestinais têm exercido uma força selectiva intensa para um
fenótipo imune específico de Th2 no TLAI (Koski & Scott, 2001). O TLAI é considerado o
órgão imunológico mais primitivo dos vertebrados, e existe um suporte considerável para a
ideia de que as consequências patológicas da resposta Th2 (por exemplo, alergia alimentar)
são um efeito evolutivo secundário de uma época em que hospedeiro necessitava de uma
forte resposta Th2 para se proteger contra os parasitas (Pritchard, Hewitt & Moqbel, 1997).
Se essas observações se confirmarem, então poderíamos argumentar que o aumento da
incidência de alergia resulta não só da menor exposição às infecções por nemátodes, mas
também de uma maior disponibilidade de nutrientes. É pouco provável que a relação entre a
co-evolução hospedeiro-parasita e o estado nutricional termine com a imunidade do
hospedeiro. O estado nutricional pode afectar directamente os parasitas, e estes adaptam-
se rapidamente de acordo com o ambiente nutricional presente.
83
Assim, há questões a considerar em intervenções que visam as deficiências nutricionais e
os nemátodes GI. Tais como: os possíveis efeitos do estado nutricional na biologia do
parasita, a heterogeneidade genética na população dos hospedeiros relativamente à
resistência e susceptibilidade à infecção; e o papel de um melhor estado nutricional na
redução da infecção e imunopatologias (Solomons & Scott, 1994). Para combater
directamente a tríade má nutrição-infecção-imunossupressão, há 3 principais tipos de
intervenções: melhoria do estado nutricional; prevenção ou tratamento da infecção; reforço
da imunocompetência. Cada intervenção pode ser alcançada de muitas formas, e cada uma
deveria, em teoria, ter repercussões benéficas nas outras condições (Koski & Scott, 2001).
4.8 Intervenções nutricionais
Apesar de se presumir que os hospedeiros bem nutridos estão em melhores condições de
controlar as suas infecções helmínticas, há falta de estudos sobre os benefícios da melhoria
nutricional na resistência às infecções. No laboratório, a repleção com zinco após dietas
com deficiência de zinco, restabeleceu a capacidade de roedores para controlar infecções
por T. spiralis. A realimentação de ratos deficientes em proteína, com metionina, melhorou a
sua capacidade de controlar N. brasiliensis (Koski & Scott, 2001). Estes estudos indicam
que a melhoria do estado nutricional reduz a infecção ou a patologia induzida pela infecção.
A população de hospedeiros é constituída por um largo espectro de indivíduos que diferem
em suas predisposições genéticas para resistir a determinadas infecções, e que podem
diferir na resposta à suplementação.
Existem três paradigmas: 1º) se os efeitos da má nutrição são subtis relativamente à
resistência a uma infecção determinada geneticamente, as intervenções nutricionais não
podem modificar a prevalência global de infecção, mas podem ser benéficas para aqueles
indivíduos fortemente infectados que têm alta necessidade de nutrientes para reparação
tecidular; 2º) se a deficiência nutricional age de uma maneira sinérgica nos indivíduos
geneticamente susceptíveis, a nutrição será muito importante para eles, mas terá pouco
impacto nos indivíduos geneticamente resistentes que estão protegidos da infecção apesar
de desnutridos; 3º) se a má nutrição inibe o desenvolvimento da resistência, as intervenções
nutricionais serão úteis em restaurar a capacidade dos indivíduos geneticamente resistentes
para controlar a infecção, mas podem aumentar o risco de imunopatologia.
As intervenções nutricionais também podem ser benéficas se os próprios constituintes
dietéticos tiverem propriedades antiparasitárias. A ingestão de plantas medicinais
antihelmínticas, adicionada ao alimento pode controlar parasitas intestinais em cães. Num
estudo de Deshpande (2004) com uma combinação de plantas (como o alho), a quantidade
de hemoglobina aumentou e o número de ovos por grama nas amostras fecais diminuiu nos
grupos de cães tratados.
84
4.9 Antihelmínticos
A eficácia dos fármacos também é afectada pelo estado nutricional. A capacidade de
benzimidazol para eliminar N. brasiliensis é significativamente menor nos hospedeiros
alimentados com uma dieta deficiente em ferro e proteína, em comparação com hospedeiros
bem nutridos, presumivelmente devido ao reduzido nível de absorção de fármaco pelo
parasita (Koski & Scott, 2001). Uma variedade de mecanismos pode contribuir para esta
observação, incluindo o facto do estado nutricional poder afectar o metabolismo do fármaco,
e a absorção do fármaco pelo hospedeiro e/ou pelo parasita. A má nutrição pode reduzir a
eficácia dos fármacos, que é susceptível de promover a selecção de parasitas resistentes a
fármacos, limitando ainda mais o controlo quimioterapêutico de infecções por nemátodes GI.
Pode-se concluir, que a intervenção nutricional deve preceder os tratamentos
antihelmínticos para assegurar a máxima eficácia dos fármacos. No entanto, as infecções
parasitárias podem, por sua vez, reduzir a absorção de nutrientes e portanto, a eficácia da
intervenção nutricional pode ser melhorada se os parasitas forem primeiro eliminados. São
necessários mais estudos para avaliar as vantagens da tratamentos medicamentosos antes,
durante ou após as intervenções nutricionais, de modo a alcançar o objectivo de maximizar
os benefícios destas abordagens integradas.
4.10 Reforço da imunocompetência
Os nemátodes GI não induzem imunidade prolongada, talvez porque não conseguem
estimular células B IgE+ de longa vida, responsáveis pela memória, como relatado em ratos
infectados por N. brasiliensis (Gros et al., 1996). Uma consequência de uma resposta
protectora incompleta é a necessidade de ponderar cuidadosamente se se deve administrar
uma vacina para nemátodes, de forma a obter a máxima protecção. É conhecida uma
experiência de vacinação para um nemátodo GI em ratos, na qual a vacina foi ineficaz em
crianças desnutridas e o mesmo problema pode surgir quando vacinas para uso contra
nemátodes GI estiverem disponíveis (Koski, Su & Scott, 1999). Outras formas de reforços
imunes nas infecções por nemátodes GI têm sido consideradas, como injecções
intradérmicas em ratos de plasmídeos de DNA contendo genes que expressam citoquinas-
chave (Raz et al., 1996) e a administração de probióticos para estimular a resposta Th1 no
intestino.
4.10.1 Vacinação
Apesar de intensos esforços de investigação, as vacinas contra os helmintes não fazem
parte das estratégias imunoprofiláticas de controlo regular. Os principais antigénios de
helmintes são de 2 tipos: 1) excretor solúvel/produtos secretores; 2) antigénios somáticos -
uns fixados na superfície de parasitas, outros como os do intestino do parasita, estão
escondidos uma vez que eles não são expostos à resposta do SI do hospedeiro e podem,
dessa forma, ser potenciais candidatos para vacinas (Mulcahy et al., 2004).
85
A vacinação de cães com a protease cisteína recombinante a partir do intestino de
ancilóstomos de cães diminui a fecundidade e o crescimento destes nemátodes (Loukas et
al., 2004). A vacinação com larvas L3 de Ancylostoma caninum irradiadas induz uma
resposta Th2 protectora em cães. Animais vacinados tiveram uma forte resposta anticorpo
para ASP-2 (Proteínas secretadas por Ancylostoma), uma promissora vacina-antigénio que
é um produto de excreção/secreção de L3 (Fujiwara et al., 2006). A infecção de helmintes
concorrentes altera as respostas óptimas induzidas por vacinas. As consequências desta
condição não foram ainda devidamente estudadas, sobretudo no caso de uma infecção
após a vacinação (Urban et al., 2007).
4.11 Sorodiagnóstico
Os testes imunológicos nunca foram largamente utilizados no diagnóstico das infecções por
helmintes. É geralmente muito mais fácil chegar-se a um diagnóstico ao examinar a
presença de ovos nas fezes. Na larva migrante visceral (Toxocara canis), em que os ovos
não são eliminados, o diagnóstico serológico torna-se essencial. Os testes de ELISA
correspondem às técnicas diagnósticas mais úteis (Tizard, 2002).
4.12 Modulação neuroimunoendócrina no hospedeiro pelos helmintes
Para que os nemátodes GI sobrevivam dentro dos seus hospedeiros, é necessário que eles
fiquem durante tempo suficiente para se reproduzirem. Para suportar as suas formas de vida
parasitárias sofisticadas, os nemátodes GI têm explorado o nicho intestinal e escolhido o
intestino como um habitat independentemente do forte potencial do TLAI. Eles têm a
capacidade de modular a resposta imune dos seus hospedeiros. A imunomodulação é
essencial para evitar a sua própria destruição mas é subtilmente equilibrada para evitar
comprometer a sobrevivência do hospedeiro. As capacidades imunomoduladoras dos
nemátodes reflectem-se a vários níveis do SI. Os nemátodes desenvolveram uma série de
estratégias nesse contexto, como: a indução de células T reguladoras e a modificação do
fenótipo dos macrófagos activados; a produção de moléculas derivadas do parasita que são
capazes de interferir com a apresentação de antigénios; imitar citoquinas do hospedeiro,
destruir quimioatractivos e desarmar potenciais respostas efectoras (Else, 2005).
A indução de respostas Th2 muito polarizadas podem prejudicar a capacidade dos
hospedeiros dos parasitas para eliminar outros patogénios. Evidências recentes indicam que
apesar dos helmintes serem responsáveis pela doença, imunopatologia e comprometimento
da imunidade para outros patógenos, uma ausência completa de infecção helmíntica
durante o início da vida pode ser um factor predisponente para o desenvolvimento da
patologia auto-imune. Os helmintes que estão na mucosa do TGI, não vivem (no sentido
estrito) dentro do organismo hospedeiro, e estão, de certa forma menos expostos aos
mecanismos de defesa imunitários do hospedeiro do que os helmintes que vivem dentro dos
tecidos do hospedeiro (Mulcahy et al., 2004).
86
Na infecção helmíntica intestinal, há fases no ciclo de vida do parasita em que ele interage
com a parede intestinal. Existe a possibilidade da exposição do SI aos antigénios do
parasita via mucosa do intestino, favorecer uma resposta tolerante a esses antigénios (Roitt
& Delves, 2006). No entanto, a típica resposta imune Th2 induzida por helmintes, que entre
os seus mecanismos efectores inclui o aumento da motilidade intestinal, pode ser adaptada
à eliminação de helmintes intestinais. Outro passo de evolução pode ter ocorrido, quando os
helmintes no TGI de seus hospedeiros, atravessaram esta barreira mucosa para continuar o
seu ciclo de vida noutros locais, dentro dos tecidos do hospedeiro, em alguns casos
voltando para o intestino de forma a ter um acesso fácil para estádios reprodutivos num
ambiente exterior. Existem muitos exemplos deste tipo entre helmintes, entre os quais
Toxocara canis. A evolução destes padrões de migração entre os helmintes pode ter sido
impulsionada pela necessidade de escapar aos mecanismos de defesa imune, dirigidos
especificamente a helmintes que habitam locais da mucosa (Mulcahy et al., 2004).
À medida que o conhecimento do sistema neuroendócrino cresce, é cada vez mais claro
que a rede complexa de neurotransmissores, hormonas e citoquinas, desempenham um
papel na modulação da imunidade. Os helmintes têm uma relação complexa com estes
sistemas fisiológicos, e factores do hospedeiro dependentes de hormonas, como o sexo e a
idade, estão relacionados com o sucesso do parasita (Escobedo, Griego & Montor, 2009).
A avaliação da resposta imunofisiológica aos helmintes permite identificar que a infecção
com helmintes específicos pode ser útil em termos terapêuticos (apesar de muitos helmintes
não terem esta função). Isto poderá levar ao conhecimento preciso dos eventos imunes que
se seguem à infecção, para identificar vias para intervir em processos patológicos, e
eventualmente tratar de doenças inflamatórias e auto-imunes. A imunoparasitologia pode
levar à identificação de novos biomarcadores e até ajudar na terapêutica de doenças
alérgicas (McKay, 2009).
A compreensão das estratégias imunomoduladoras empregues pelos nemátodes GI pode
trazer duas grandes vantagens. Assim, poder-se-á produzir vacinas contra as moléculas
imunomoduladoras para permitir as respostas efectoras antiparasitárias, sem provocar
doença. Além disso, poderemos utilizar factores imunomoduladores dos nemátodes para
desenvolver novas estratégias para controlar a alergia e doença auto-imune (Else, 2005).
87
1 Plamet® (bromoprida) 2 O método de flutuação com centrifugação de sulfato de zinco permite encontrar cistos de protozoários como Giardia e coccídios (Isospora), mas a giardiose oculta pode ser diagnosticada mais facilmente por resposta à terapêutica sintomática com metronidazol. 3 Plasil® (cloridrato de metoclopramida) 0,5 mg/kg SC, BID durante 3 dias; Ranitidina (25 mg/ml) 2 mg/kg SC, BID durante 3 dias e após (15 mg/ml) 2 mg/kg SC, PO 12 dias seguintes; Sulfametoxazol + Trimetoprim (40 mg/ml) 5 mg/Kg PO, BID 15 dias; Metronidazol (40 mg/ml) 25 mg/Kg PO, BID 15 dias.
III. CASOS CLÍNICOS E INQUÉRITO 1. CASOS CLÍNICOS OBSERVADOS NA FCAV (BRASIL)
Nesta secção da dissertação são apresentados 7 casos clínicos que correspondem a
doenças gastrointestinais (GI) frequentes, seguidos por uma discussão conjunta dos casos
com ênfase nos procedimentos de Nutrição Clínica. Foram acompanhados no Hospital
Veterinário (HV) da FCAV no atendimento ambulatorial do Serviço de Nutrição Clínica de
Cães e Gatos, complementar às áreas de Clínica Médica e Clínica Cirúrgica de Pequenos
Animais e Obstetrícia. São casos com vários tipos de suporte nutricional, como enteral,
parenteral, microenteral, dieta caseira e dieta comercial, o que permite discutir as possíveis
modalidades nutricionais a serem empregues.
1.1 Caso 1 - Gastroenterite aguda associada a Giardiose ou Isosporose
Joey, um cão macho de raça Poodle, com 4 anos de idade e 2,350 kg de peso corporal,
apresentou-se à consulta com queixa de emése, diarreia e fraqueza. Este quadro clínico
tinha-se iniciado havia 2 semanas. O vómito continha água com espuma, por vezes
alimento; as fezes eram amolecidas e escuras. Num tratamento anterior em clínica
veterinária foi prescrito silimarina, oxitetraciclina e Plamet®1 com certa melhoria. As fezes
ficaram mais duras mas 2 dias antes da consulta voltaram a estar moles. A proprietária
referiu aplicação de antibiótico injectável na clínica, cada dia de um tipo diferente. Já teve
diarreia noutras ocasiões. Tinha puliciose e ixodidiose. Uma das vacinas estava
desactualizada e não tinha sido desparasitado. Referiu normodipsia e urina de cor amarelo
ouro, volume normal. O Joey tinha criptorquidismo unilateral, tendo sido sendo
recomendada castração. O exame físico revelou abdómen tenso à palpação.
Foram solicitados exames complementares: hemograma, ALT, creatinina e glicémia. Os
resultados indicaram leucopénia (leucócitos globais 3,9 · 103/µL) e hipoglicémia (53 mg/dL),
sem outras alterações. Não se realizou o exame coproparasitológico2. Estabeleceu-se
suspeita clínica de Gastroenterite e Giardiose (Giardia sp.) ou Isosporose (Isospora canis).
Prescreveu-se3: Plasil®; ranitidina; sulfametoxazol + trimetoprim; metronidazol2.
No serviço de Nutrição Clínica verificou-se que o animal comia ração semi-húmida Delidog
Purina®. Uma semana antes havia mudado para Ração Super Premium Royal Canin®
Crescimento, misturada com frango cozido em água. Apresentava normorexia e além da
ração ad libitum, alimentava-se de comida caseira e petiscos. A proprietária informou que o
animal foi sempre magro. Peso actual: 2,350 Kg; peso ideal estimado: 2,8 Kg (aumento de
20%). Estipulou-se um aumento de 20% de peso devido à sua condição corporal (ECC 3).
88
1 Atropina 0,022 mg/kg 0,3 ml SC e Imidocarb 5 mg/kg 0,3 ml SC
2 Drontal® (praziquantel + pamoato de pirantel + febantel); Ranitidina 2mg/kg 1ml VO, BID 30 mins. antes da Doxiciclina 5 mg/kg ¾ comp. 50 mg VO, BID, ANR (21 dias); Frontline® spray (fipronil) a cada 30 dias.
Prescrição: Dieta caseira branda 100 g/dia dividida em 2 refeições, por uma semana; depois
passar para Ração Super Premium Cães Adultos 60 g/dia em 2 refeições mais
palatibilizante.
Procedimento de cálculo: Necessidade Energética de Manutenção (NEM) em cães adultos
NEM = 95 x (peso desejado em kg) 0,75 = 95 x 2,16 = 205,6 Kcal por dia.
Energia metabolizável (EM) por grama da dieta: caseira 2 Kcal/g; comercial 3,70 Kcal/g.
Quantidade de alimento = NEM (Kcal/dia) / EM (Kcal/g)
Dieta caseira = 205,6/2,00 ≈ 100 g/dia; Dieta comercial = 205,6/3,70 = 55,6 g
Após calcular a quantidade a ser administrada em gramas por dia da dieta, deve calcular-se
a quantidade de cada ingrediente da dieta caseira, como no exemplo a seguir:
Arroz*: do total calculado (100 gramas), 60% será compreendido por arroz:
100 gramas da dieta ----------------- 100% (total)
x gramas de arroz ----------------- 60% (% de arroz); x = 60 gramas de arroz por dia
* realizar este cálculo para todos os ingredientes. Prescrição da dieta calculada:
60 g de arroz cozido; 20 g de carne moída bovina; 5 g de fígado bovino; 13 g de cenoura;
0,7 g de fosfato bicálcico; 0,7 g de levedura de cerveja; 1 g de suplemento mineral e
vitamínico; 0,1 g de sal e 1 ml de óleo de soja (consultar Tabela 1).
Tabela 1 - Dieta de manutenção para cães adultos
Composição (% da Matéria Seca) Ingredientes - Fórmula (% da Matéria Original)
Proteína Bruta
Carbohidrato
Extrato Etéreo
Fibra Bruta
Matéria Mineral
Humidade
Cálcio
Fósforo
25,30
50,45
16,31
1,48
1,78
55,15
1,03
0,92
Arroz cozido Carne moída bovina ou peito de frango Fígado bovino Cenoura Fosfato Bicálcico Levedura de Cerveja Suplemento Mineral e Vitamínico Sal Óleo de soja
Energia Metabolizável 2,00 Kcal/g
60
20
5 13 0,7 0,7 1 0,1 1
1.2 Caso 2 - Gastroenterite parasitária - Ancilostomose
Pity, um cão macho de raça American Pitbull, apresentou vários antecedentes mórbidos.
Com 4 meses e 6,4 Kg (ECC 4) apresentou vómitos, diarreia e hematoquésia. Nessa altura
foi submetido a uma transfusão sanguínea IV de 200 ml devido a anemia grave (hematócrito
9,3%), além de trombocitopénia severa (plaquetas 26 · 103/µL) e babesiose. No ambulatório1
deu-se atropina e imidocarb. Foi prescrito2: Drontal®; ranitidina; doxiciclina; Frontline® spray
Foi solicitado apoio nutricional, prescrevendo-se duas opções para a dieta. A primeira
escolha era a ração comercial : Ração Premium Cães Filhotes 400 g/dia. Se o animal não
comesse esta ração, o proprietário teria a alternativa da dieta caseira.
89
1 Drontal® Plus para 10 Kg 1 cp + ¼ comp. VO (repetir após 15 dias). 2 Fluidoterapia Lactato Ringer + complexo B IV 200 ml; Ampicilina 22mg/kg 1,4 ml SC; Ondansetrona 0,2 mg/Kg 2ml IV; Ranitidina 2 mg/Kg 1 ml SC; Metronidazol 15 mg/kg 40 ml IV. 3 Prescrição: Ampicilina 22mg/kg 1,4 ml SC; Ranitidina + Metoclopramida 0,5 mg/kg 1,3 ml SC, por 3 dias consecutivos + dieta branda + água gelada + água de coco; depois Ampicilina 22mg/kg (250 mg/5ml) 6 ml VO, BID 14 dias; Ranitidina 2 mg/Kg 1,7 ml (15mg/ml) VO, BID 14 dias; Metronidazol 15 mg/kg 5 ml (40 mg/ml) VO, BID 10 dias; Vitamina B uma drageia VO, SID ANR.
Procedimentos de cálculos: necessidade energética de cães em crescimento:
NE = 130 x (peso corporal ideal)0,75 x 3,2 x [2,718 ( - 0,87 x p ) – 0,1] ≈ 1400 Kcal/dia;
como o ECC era 4 usou-se o peso ideal 7,68 Kg (6,4 Kg +20%)
p = Peso actual (kg)/peso estimado adulto (30 Kg) = 6,4/30 = 0,21
EM por grama da dieta: caseira 2,04 kcal/g; comercial 3,5 kcal/g
Dieta caseira = NE/EM = 1400/2,04 ≈ 686 g/dia de dieta caseira
Dieta comercial Ração Premium Cães Filhotes = 1400/3,5 = 400 g
Aplicando o mesmo raciocínio da tabela 1 na tabela 2, calculou-se 685 g/dia de dieta
caseira, constituída por: 397 g (58%) de arroz cozido; 137 g (20%) de carne moída; 55 g
(8%) de fígado; 55 g (8%) de cenoura; 6,85 g (1%) de fosfato bicálcico; 2,05 g (0,3%) de
carbonato de cálcio; 6,85 g (1%) de levedura de cerveja; 6,85 g (1%) de suplemento mineral
e vitamínico; 9,11 g (1,33%) de sal light e 36,4 ml (5,32%) de óleo.
Tabela 2 - Dieta para cães em crescimento Composição (% da Matéria Seca)
Ingredientes - Fórmula (% da Matéria Original)
Proteína Bruta
Carbohidrato
Extrato Etéreo
Fibra Bruta
Matéria Mineral
Humidade
Cálcio
Fósforo
26,47
47,52
16,35
1,27
2,53
53,98
1,32
0,93
Arroz cozido Carne moída bovina ou peito de frango Fígado bovino
Cenoura
Fosfato Bicálcico
Carbonato de cálcio
Levedura de Cerveja
Suplemento Mineral e Vitamínico Sal light Óleo
Energia Metabolizável 2,04 Kcal/g
58
20
8 8
1
0,3
1
1
1,33 5,32
O proprietário empregou a Ração Premium Cães Filhotes 400 g/dia em 4 refeições mais
palatibilizante e o animal comeu bem a ração com carne moída e arroz.
Sujeito a tratamento teve melhoria do quadro clínico. Com 5 meses prescreveu-se Drontal®
Plus1 e enfatizou-se a necessidade de controlo de ectoparasitas. O Pity engordou 2,8 kg em
20 dias (11,4 Kg); ECC 5. Era-lhe oferecida ração misturada com carne moída. A Nutrição
Clínica prescreveu só ração Premium Cães Filhotes 400g/dia: 3 refeições.
Com 6 meses e meio, o Pity tinha 12,6 Kg (ECC 5) e regressou com queixa de diarreia,
vómito quando bebe, anorexia e emése. À palpação sentiu-se conteúdo fluido nas alças
intestinais. Estabeleceram-se como diagnósticos diferenciais: Gastroenterite
(viral/bacteriana/verminótica); cinomose, pancreatite, ingestão de corpo estranho. A
terapêutica ambulatorial2 incluiu: fluidoterapia Lactato Ringer + complexo B IV 200 ml;
ampicilina; ondansetrona; ranitidina; metronidazol. Após cumprimento da prescrição do
protocolo terapêutico3 houve normalização do quadro clínico.
90
1 Ranitidina (25 mg/ml) 2 mg/kg, SC, BID durante 3 dias e após (150 mg/ml) 2 mg/kg SC, PO nos 15 dias seguintes; Plasil® (5 mg/ml) 0,5 mg/kg SC, BID 3 dias; Sulfametoxazol + Trimetoprim (400 mg) 15 mg/Kg PO, BID 15 dias; Metronidazol (400 mg) / 25 mg/ Kg PO, BID 15 dias 2 Ranitidina 2 mg/kg 2 ml SC, BID durante 4 dias e Ranitidina ½ comp. 150 mg VO, BID 15 dias, após término da medicação injectável; Metaclopramida 0,5 mg/Kg 2,5 ml SC, BID, 4 dias; Endogard® (febantel + pirantel + praziquantel + ivermectina) para 30 Kg (repetir após 15 dias); Metronidazol 15 mg/Kg 1 comp. 400 mg VO, BID 10 dias.
Aos 7 meses, Pity tinha peso corporal de 16,8 Kg. Com 11 meses, já com 20 Kg (ECC 5)
regressou ao HV e o proprietário referiu que na véspera da consulta o animal apresentou 3
episódios de emése de conteúdo esbranquiçado. Tinha fezes amolecidas, inicialmente eram
escuras, depois amareladas e após tinha hematoquésia. Antes da diarreia, fezes sem
alterações. Tinha normorexia até 3 dias antes, depois hiporexia, hipodipsia e urina de cor
alaranjada. A vermifugação estava desactualizada e tinha ixodidiose. As vacinações
estavam actualizadas. Negou medicações. O exame físico revelou condição normal.
Solicitou-se hemograma, glicémia, creatinina e dosagens de enzimas (ALT e FA). A
fosfatase alcalina estava um pouco elevada (157,5 U/L). Os resultados indicaram ligeira
trombocitopénia (plaquetas 147 · 103/µL ). O exame coproparasitológico pelo Método directo
de Willis teve resultado negativo.
Com base nos sinais clínicos, foram considerados como diagnósticos diferenciais:
hemoparasitose, gastroenterite, giardiose ou isosporose. Prescreveu-se o protocolo
terapêutico1: ranitidina; Plasil®; sulfametoxazol + trimetoprim; metronidazol.
Após dois meses, o Pity já com 1 ano e 24,4 Kg (ECC 5) voltou e o proprietário referiu que
após a última consulta, fez tratamento conforme prescrito e o animal apresentou melhoria do
quadro clínico. Só que na véspera apresentou diarreia pastosa alaranjada. No dia da
consulta não defecou e nessa manhã apresentou 4 episódios eméticos com aspecto de
espuma branca. Referiu hiporexia, emése após alimentação e após ingestão de água. A
urina estava normal, quanto ao volume, frequência e aspecto. A vacinação e desparasitação
estavam actualizadas. Negava ectoparasitas nos últimos 2 meses. Não estava com
nenhuma medicação. Ao exame físico, a temperatura rectal era de 39,1ºC, apresentava
mucosas hipercoradas e TRC 1”. À palpação sentiu-se conteúdo fluido em alça e alças
intestinais espessadas. Foram solicitados os seguintes exames complementares:
hemograma, dosagens de ALT e FA, creatinina e exame coproparasitológico (Tabela 3).
Diagnosticou-se gastroenterite verminótica - Ancilostomose. A medicação prescrita2 foi:
ranitidina; metoclopramida; Endogard®; metronidazol. Foi aconselhada desparasitação a
cada 4 meses. Na consulta de Nutrição Clínica soube-se que o Pity só comia ração
económica, se misturada com arroz e carne moída, frango ou bife. De manhã, era-lhe
oferecido pão e leite. Durante a consulta não aceitou alimento. Foi prescrita Ração Premium
Cães Adultos 300 gramas, dividida em 2 refeições diárias.
Procedimentos de Cálculos: Necessidade energética de manutenção em cães adultos
NEM = 95 x (peso em kg) 0,75 = 95 x 10,9 ≈ 1042 Kcal por dia. EM dieta comercial 3,5 Kcal/g
Quantidade de alimento = NEM (Kcal/dia) / EM (Kcal/g) = 1042/3,5 ≈ 297g/dia.
91
1 Atropina 0,022 mg/kg 1 ml SC e Imidocarb 5 mg/kg 1ml SC
2 Ranitidina 2 mg/kg 1/2 comp. 150 mg VO, BID 28 dias; Doxiciclina 5 mg/kg 1 e 1/4 100 mg VO, BID 28 dias; Luftal® (dimeticona + metilbrometo de homatropina) 1 g VO, TID até 2 dias antes da ultrasonografia (US) abdominal marcada para 2 semanas depois
Tabela 3 - Resultados dos exames hematológico, de bioquímicas séricas e coproparasitológico
Parâmetros (unidades) Resultados Valores de referência
Hemácias (· 106/µL) 6,35 5,5-8,5
Hemoglobina (g/dL) 15,3 12-18
Hematócrito (%) 45,1 37-55
Leucócitos globais (· 103/µL) 6,8 6-18
Segmentados (%) 76 60-77
Bastonetes (%) 1 0-3
Eosinófilos (%) 6 2-10
Basófilos (%) 0 0-1
Linfócitos (%) 13 13-30
Monócitos (%) 4 3-10
Plaquetas ( 103/µL) 147 180-400
Hemoparasitas Negativo Negativo
Parâmetros (unidades) Resultados Valores de referência
Glicémia (mg/dL) 64 60-110
ALT (U/L) 23,11 10-88
FA (U/L) 84,48 20-150
Creatinina (mg/dL) 1,26 0,5-1,5
Exame microscópico Material: fezes
Método: Willis Resultado: Ancylostoma caninum
1.3 Caso 3 - Gastroenterite crónica
Jully, uma cadela de raça Collie de 5 anos de idade, com 23 kg de peso corporal (ECC 5)
chegou à consulta apresentando episódios de emése havia 4 meses. Estes eram
praticamente contínuos, por vários dias, parando por 1 ou 2 dias. O vómito tinha conteúdo
esverdeado com espuma, por vezes com alimento. O proprietário referiu que o animal teve
erliquiose havia 1 ano, que a última desparasitação tinha sido 1 mês antes e negou
ectoparasitas. O animal apresentava normorexia e a sua alimentação consistia em ração
comercial mais carne, leite e petiscos. O exame hematológico revelou trombocitopénia
severa (plaquetas 86 · 103/µL) e eosinofilia. Considerou-se como diagnósticos diferenciais:
gastroenterite crónica (eosinofílica/linfocítica-plasmocítica), hemoparasitose, pancreatite,
trombocitopénia imunomediada e hipoplasia medular. O ionograma indicou hiponatrémia
(devido ao vómito crónico). Com base no exame clínico e resultados laboratoriais,
estabeleceu-se o diagnóstico de gastroenterite crónica e hemoparasitose. Teve tratamento
ambulatorial1 com atropina e imidocarb. Foi prescrito: ranitidina, doxiciclina e Luftal®2
92
1 Omeprazol 0,7 mg/kg VO, SID ANR; Sucralfato 30 mg/kg 5 ml VO, TID durante 5 dias; Mesalazina (sulfasalazina) 500mg/kg ano-rectal BID ANR; Domperidona 5 mg ½ comp. 10 mg VO, BID ANR.
Duas semanas depois a Jully regressou à consulta, aparentemente bem. O proprietário
relata que 5 dias antes o animal ficou apático. Continuava com emése, quando comia ração
o vómito tinha conteúdo alimentar, quando não comia a coloração era esverdeada. No dia
da consulta teve 2 episódios de emése mas só com espuma. Apresentava normoquésia,
mas defecava poucas vezes, pois não se alimentava normalmente. Tinha normodipsia, urina
normal, apenas um pouco amarelada. Relatava ixodidiose. A proprietária não cumpriu a
prescrição, pois interrompeu a administração de doxiciclina e administrou metoclopramida
por conta própria. No hemograma, o número de plaquetas aumentou para 109 · 103/µL. As
alterações na urianálise eram: aspecto turvo, cor amarelo ouro e pH 7,5. A sedimentoscopia
revelou presença de células epiteliais de transição, ligeira presença de células granulosas e
leucócitos.
O protocolo terapêutico1 foi: omeprazol, sucralfato, mesalazina e domperidona. Foi solicitado
apoio do Serviço de Nutrição Clínica. A Jully perdeu 500 g em 2 semanas (22,5 Kg)
apresentando ECC 5. Havia 5 dias que só tomava leite, tendo dificuldade na mastigação por
ter um dente partido. Apresentava anorexia havia 4 dias, continuava a vomitar (sem
conteúdo alimentar) e não o fazia no máximo durante 3 dias. Na véspera tinha comido bem
peito de frango.
Prescrição: Dieta caseira branda 490 g/dia divididas em 3 refeições, para diminuir o volume
por refeição, já que o animal estava a vomitar. Cálculos: Dieta caseira de manutenção
NEM = 95 x (peso em kg) 0,75 ≈ 981 Kcal por dia. EM da dieta 2 Kcal/g.
Quantidade de alimento = NEM / EM = 981/2 = 490,5 gramas por dia. Consultando a tabela
1 prescreveu-se: 294 g (60%) de arroz cozido; 98 g (20%) de carne moída bovina; 24,5 g
(5%) de fígado bovino; 63,7 g (13%) de cenoura; 3,43 g (0,7%) de fosfato bicálcico; 3,43 g
(0,7%) de levedura de cerveja; 4,9 g (1%) de suplemento mineral e vitamínico; 0,49 g (1%)
de sal e 4,9 ml (1%) de óleo de soja.
No retorno a Jully estava melhor, só tinha tido emése na véspera. Havia 5 dias que
aumentou o apetite e aumentou o seu peso em 600 g (23,1 Kg). Relatou normorexia,
normodipsia e urina normal. O proprietário cumpriu o tratamento prescrito, tendo iniciado a
medicação com sucralfato e domperidona havia 4 dias. O número de plaquetas continuou a
subir para 135 · 103/µL. O serviço de radiologia não estava disponível. Na ultrasonografia
(US) abdominal observou-se o estômago com paredes espessadas. O abdómen direito
apresentava ecogenicidade aumentada. O baço preservava a estrutura, com vasos
dilatados; o fígado apresentava ecoestrutura grosseira; não foi visível o pâncreas. Manteve-
se o protocolo terapêutico prescrito. Em face da gastrite, optou-se por não retornar ao
tratamento com doxiciclina.
Uma semana depois o animal retornou com melhoria do quadro clínico. Neste período
vomitou apenas uma vez e o proprietário parou de fornecer sucralfato havia oito dias, pois o
93
1 Sucralfato 1 comprimido 1g 2 Omeprazol ANR e Mesalazina até completar 30 dias
animal apresentava vómito após a sua toma.
Referiu normorexia, normoquésia, normodipsia e urina normal. O número de plaquetas
estabilizou em 137 · 103/µL. Não foi possível a realização de exame radiográfico. A US
revelou-se semelhante à anterior. O exame coproparasitológico pelo Método de Willis teve
resultado negativo e a citologia fecal registou a presença de quantidades normais de
bactérias e alguns cristais. Diminuiu a dose de sucralfato1 e manteve as outras medicações2.
Após mais uma semana, o animal melhorou significativamente, mas tinha dias em que
comia menos. Referiu normorexia, normoquésia, normodipsia e urina normal. Estava a
realizar todo a terapêutica prescrita. Não teve mais emése e negava diarreia. Engordou
1,150 Kg (23,650 Kg) e tinha ECC 6. Comeu bem a dieta caseira branda. As fezes e urina
estavam normais. Ao exame físico revelou alguma sensibilidade à palpação abdominal. Na
radiografia (Rx) abdominal observou-se esplenomegália e conteúdo alimentar líquido no
estômago; sem alterações sugestivas em projecção ventro-dorsal. O tratamento manteve
omeprazol e mesalazina e suspendeu-se a domperidona e sucralfato; reforçou-se o controlo
de ectoparasitas.
Em relação à alimentação, continuou-se com a dieta caseira de manutenção (510 g) mas
com a possibilidade de alteração para Ração Premium Cães Adultos (290 g/dia) dividida em
2 refeições. Deve mudar-se gradualmente de ração para evitar que o animal tenha alteração
da qualidade das fezes.
Procedimentos de Cálculos: Necessidade energética de manutenção em cães adultos
NEM = 95 x (peso em kg) 0,75 = 95 x 10,7 = 1018,81 Kcal por dia.
EM da Dieta Caseira 2 Kcal/g. NEM/EM ≈ 510 g/dia
EM da Ração Premium 3,5 Kcal/g. Quantidade de alimento = NEM / EM ≈ 291 g/dia.
Marcou-se retorno para três semanas depois, para reavaliação geral; se o quadro clínico
piorasse seria recomendado fazer trânsito gastrointestinal e endoscopia. Nesse período, foi
referido bem estar geral, tendo apenas 3 episódios eméticos em 30 dias. O animal estava
mais activo e ao exame físico não apresentou sensibilidade à palpação. Estava a comer
ração com frango cozido. O número de plaquetas desceu bastante para 61 · 103/µL. O valor
da glicémia era de 75 mg/dl .
A Jully regressou um mês depois com 23,9 Kg (mais 250 g) e ECC 5, revelando bem estar
geral. Em 30 dias, houve 3 episódios eméticos espaçados. O número de plaquetas
normalizou em 348 · 103/µL. Relatou ixodidiose. Estava a comer uma ração de qualidade
média (e não Premium), com arroz, frango e cenoura. Neste dia, teve alta médica, com a
indicação de não fornecer alimentos condimentados (como o proprietário confessou que
fazia) restringindo-se à dieta caseira de manutenção ou Ração Premium cães adultos 290 g
dividida em 2 refeições. Manteve-se a quantidade prescrita de energia para não deixar o
animal continuar a engordar.
94
1 Ranitidina 2 mg/kg VO, BID, 2 h antes de Itraconazol até novas recomendações; Itraconazol 5 mg/kg 33mg VO, BID, ANR; Óleo de peixe 1g VO, SID, ANR; Banhos e Champô manipulado: Clorexidine 3% + Miconazol 2% + Glicerina 2% a cada 2 dias por 10 dias, e depois a cada 3 dias; 2 Cefalexina 500 mg: ¼ comp. BID 21 dias e Clemastina (como fumarato ácido) 10 dias
1.4 Caso 4 - Hipersensibilidade alimentar
Frederico, um cão macho de raça Maltês com 2 anos de idade, 6,550 kg de peso corporal,
(ECC 6) apresentou-se à consulta com queixa de prurido intenso e áreas alopécicas com
crostas eritematosas distribuídas pelo corpo. Estava em tratamento para suspeita de
hipersensibilidade alimentar, mas sem obter a melhoria esperada. Estava a ser tratado com
meticortex (corticóide), óleo de peixe e banhos com champô à base de clorexidine. Tinha
sido mudada a ração para hipoalergénica, mas também comia biscoitos e palitos de couro.
Não mudou os hábitos alimentares depois das lesões. O paciente apresentava as
vacinações e desparasitações em dia. O exame físico apenas revelou aumento dos
linfonodos submandibulares. A inspecção indireta com lâmpada de Wood mostrou-se
positiva. Apresentava lesões eritematosas, crostosas, circunscritas no dorso e abdómen, e
quérions dermatofíticos. Com base nos sinais clínicos e na resposta insatisfatória ao
tratamento realizado, foram considerados como diagnósticos diferenciais: dermatofitose,
atopia, hipersensibilidade alimentar e piodermite superficial secundária.
Os exames hematológico e bioquímicos não apresentaram alterações significativas. Ao
exame microscópico, a raspagem cutânea teve resultado negativo (Imprint e swab sem
alteração). De acordo com o exame clínico e resultados laboratoriais, estabeleceu-se o
diagnóstico de dermatofitose e piodermite superficial secundária. Prescreveu-se o protocolo
terapêutico1: ranitidina; itraconazol; óleo de peixe; banhos e champô manipulado. Reduziu e
retirou-se o corticóide que estava a tomar.
Cerca de um mês depois, o Frederico regressou à consulta para reavaliação geral. A
proprietária relatou que o animal não teve melhora, tendo parado todas as medicações e
suspendido o itraconazol por conta própria. O animal apresentava lesões perioculares mais
eritematosas, com prurido intenso por todo o corpo. Lambia muito a região ventroabdominal
e as patas torácicas; apresentava poucas crostas, mas houve aparecimento de pústulas.
Teve uma convulsão recente, medicada com Gardenal® (fenobarbital) por outro veterinário.
Referiu normorexia, normodipsia, normoquésia e urina normal. Surpreendentemente o
exame com lâmpada de Wood foi negativo. Ao exame microscópico, a raspagem cutânea
teve resultado negativo. Imprint: apenas células queratinizadas. Institui-se nova terapêutica2
com cefalexina e clemastina, mantendo a ranitidina e os banhos. Perdeu 50 g (6,5 Kg) e
tinha ECC 6. Foi solicitado apoio do Serviço de Nutrição Clínica para se realizar a dieta de
eliminação específica para confirmação ou eliminação da suspeita de hipersensibilidade
alimentar. A dieta era Ração hipoalergénica Royal Canin® 2x/dia, prescrita por outro
veterinário, oito meses antes mas sem melhoria. Tomava suplemento de óleo de peixe e
comia dois petiscos por semana.
95
1 Hidroxizina 1/2 comp. VO, BID durante 15 dias; Capstar® (nitempiram), Frontline® (fipronil) e Triatox® (amitraz). 2 Ranitidina: 2 mg/kg 1 ml VO, BID, ANR ; Cefalexina 30 mg/Kg ¼ comp 500 mg BID, ANR; Óleo de peixe 1g VO, SID ANR; Banhos com Clorexidine 2% + fluoxinolona 0,01% + Glicerina 2% a cada 3 dias ANR; Clorexidine 2% diluída em 100 ml H20 (5 ml) para pedilúvios ANR + Rifocina® spray (rifamicina) ANR.
A alimentação prescrita anteriormente foi substituída pela dieta de eliminação fase I. A
quantidade oferecida baseou-se nos seguintes cálculos: Necessidade Energética de
Manutenção em cães adultos NEM = 95 x (peso em kg) 0,75 = 95 x 4,07 ≈ 386,7 Kcal por dia.
EM da dieta caseira 0,91 Kcal/g; NEM/ EM = 390 : 0,91 ≈ 428 g/dia.
Após calcular a quantidade a ser administrada em gramas por dia da dieta, calcula-se a
quantidade de cada ingrediente da mistura, de acordo com a Tabela 4 (% da Matéria
Original). A fase I da dieta consistia em 320 g (75%) de batata cozida mais 110 g (25%) de
carne de cordeiro, totalizando 430 gramas de alimento, dividido em duas refeições diárias.
Tabela 4 - Dieta de Eliminação Fase I
Composição (% da Matéria Seca) Ingredientes - Fórmula (% da Matéria Original) Proteína Bruta Carbohidrato Extrato Etéreo Fibra Bruta Matéria Mineral Humidade Cálcio Fósforo
27,55 58,62 6,66 4,24 2,24 73,10 0,013 0,26
Batata cozida Carne de cordeiro
Energia Metabolizável 0,91 Kcal/g
75 25
Um mês depois, a proprietária trouxe o Frederico ao HV, informando que houve melhoria
significativa do prurido e das lesões dermatológicas durante 15 dias, dando a clemastina nos
primeiros 10 dias. O prurido tinha cessado mas houve recidiva. Houve um episódio
convulsivo para o qual foi medicado havia 20 dias, negando crises neste período. Devido à
recidiva do prurido, conduziu o animal a outro veterinário, que prescreveu1 hidroxizina,
Capstar®, Frontline® e Triatox®. Deu hidroxizina durante 15 dias e parou havia 2 dias.
Voltou a ter sinais de prurido nos membros posteriores, anteriores, face e períneo. Relatou
lesão em região inguinal. Ao exame clínico constatou-se eritema em região periocular e
perianal, lesões húmidas interdigitais. Contrariando o que afirmou, a proprietária não estava
a cumprir o prescrito. Ela notou que quando o animal saía da rotina, as lesões pioravam. O
novo protocolo terapêutico2 incluiu: ranitidina, cefalexina; óleo de peixe; banhos, pedilúvios e
Rifocina® spray.
Na consulta de Nutrição constatou-se que emagreceu 150 g em 4 semanas (6,35 Kg) e tem
ECC 6. Notou melhora com a clemastina e com a dieta caseira que manteve. Negava ter
dado petiscos. Sem vómito e diarreia, as fezes estavam normais. Relatou puliciose (suspeita
de doença alérgica à picada de pulga). Foi orientada a continuar a fase I da dieta de
eliminação. Em próximo retorno estabeleceu-se reavaliar prurido e pele - se melhorasse
passava para a dieta caseira de fase II; senão mudar-se-ia para Ração Super Premium
Cães Adultos, porque provavelmente seria atopia.
Um mês depois o animal retornou com melhoria no quadro dermatológico. Não havia
nenhuma lesão na região ventral e relatava melhoria no prurido, que permanecia, no entanto
96
1 Vetriderm® ceruminolítico (champô de clorexidine) BID 5 dias e Otogen® (sulfato de gentamicina, betametasona e miconazol) BID 21 dias
nos membros. As regiões interdigitais estavam ligeiramente eritematosas. A proprietária
estava a cumprir a prescrição, com excepção da cefalexina que tomou durante 21 dias.
Confirmou execução dos pedilúvios, banhos, Frontline®. Teve um episódio emético durante
o tratamento. Negou convulsões e ectoparasitas. O exame de raspagem cutânea obteve
resultado negativo. O swab otológico revelou bactérias Coccus no ouvido direito e esquerdo
e fungos raros no ouvido esquerdo. Orientou-se para manter óleo de peixe, pedilúvios,
Rifocina® e banhos a cada 5 dias. Foi instituída nova terapêutica1 com Vetriderm®
ceruminolítico e Otogen® para otite externa.
O animal estava a comer batata e carneiro havia 2 meses, suplementado com óleo de peixe (rico em ácidos gordos ω3) havia 1 mês. Engordou 400 g (6,85 Kg) e tinha ECC 7. Foi
instituída a fase II da dieta de eliminação. Nesta fase introduziu-se cálcio, fósforo e ácidos
gordos, balanceando melhor a dieta do paciente.
Procedimento de cálculo: Necessidade Energética de Manutenção em cães adultos
NEM = 95 x (peso em kg) 0,75 = 95 x 4,2 ≈ 402,1 Kcal por dia.
EM da dieta caseira 1,22 Kcal/g; NEM/ EM = 402/1,22 ≈ 329 g/dia
Tabela 5 - Fase II da dieta de eliminação
Composição (% da Matéria Seca) Ingredientes - Fórmula (% da Matéria Original) Proteína Bruta Carbohidrato Extrato Etéreo Fibra Bruta Matéria Mineral Humidade Cálcio Fósforo
25,0 55,12 12,45 4,14 3,29 65,74 0,8 0,7
Batata cozida Carne de cordeiro Carbonato de Cálcio Fosfato Bicálcico Óleo de Soja Sal
Energia Metabolizável 1,22 Kcal/g
72 25 0,2 0,6 2,2 0,1
De acordo com a tabela 5, a fase II da dieta consistia em 240 g de batata cozida (72%), 80
g de carne de cordeiro (25%), 0,66 g de carbonato de cálcio (0,2%), 1,98 g de fosfato
bicálcico (0,6%), 7,26 ml de óleo de soja (2,2%), 0,33 g de sal (0,1%), totalizando 330
gramas de alimento, divididos em 3 refeições diárias.
Um mês depois, Frederico regressou em bom estado geral e a proprietária relatou grande
melhoria no quadro dermatológico e ausência de alopécia. Apresentava ligeiro prurido
sobretudo nas orelhas (com excepção do prurido pela lesão por fungo). Relatou melhoria da
hiperémia, prurido nos membros e da otite externa. Demonstrou zonas hiperémicas com
formação de crostas de coloração amarela. Apresentou 3 lesões crostosas no dorso de 1,5
cm de diâmetro. Duas semanas antes observou 2 lesões no pescoço e dorso. Referiu
normorexia, normodipsia, normoquésia e urina normal. Relatou que está fazer
correctamente medicações e dieta. O tratamento com Vetriderm® e Otogen® terminou havia
poucos dias e obteve sucesso. O exame com lâmpada de Wood obteve resultado muito
positivo, reforçando o diagnóstico de dermatofitose.
97
1 Drontal® Plus ¾ comp. VO repetir após 15 dias. 2 Plasil® 0,5mg/Kg/ BID 5 dias; Ranitidina 2 mg/ Kg/ BID 5 dias; Bactrim® (sulfametoxazol + trimetoprim) 15 mg/Kg BID 10 dias; Metronidazol 25 mg BID 10 dias.
O Frederico estava a manter o peso (6,85 Kg) e com ECC 6. Comia batata, carneiro e
suplementação. Não comia nada além do prescrito e diminuiu a ingestão hídrica. Na fase III
da dieta de eliminação administrou-se suplemento vitamínico e mineral (Centrum®),
juntamente com a dieta de eliminação II. A dose de Centrum® é um comprimido para 20 kg
de peso corporal. Assim a dieta passou a consistir em 330 g/dia: 2 refeições + Centrum ¼
comprimido/24h, além da suplementação com óleo de peixe. Definiu-se mudar
progressivamente da dieta de eliminação fase III para Ração Hypoallergenic Royal Canin®.
Cálculo da Necessidade Energética de Manutenção em cães adultos:
NEM = 95 x (peso em kg) 0,75 ≈ 402,1 Kcal por dia. EM da dieta comercial 3,99 Kcal/g
Quantidade de alimento NEM/ EM = 402/3,99 ≈ 101 g/dia de ração em 3 refeições.
Caso o animal voltasse a apresentar prurido, retornaria à dieta anterior com suplementação
e Centrum®. Passadas 5 semanas, o Frederico registou melhoria absoluta, com resolução
do quadro dermatológico, sem prurido. Apresentava normorexia, normodipsia, normoquésia.
Estava a realizar o tratamento prescrito com banhos, Gardenal® e dieta. Os exames
hematológico e bioquímicos não apresentaram alterações significativas. Engordou 100 g
(6,9 Kg) num mês, tinha ECC 6, estava a comer batata, carneiro e suplementação. A
proprietária ofereceu ração hipoalergénica e em 2 dias, o animal começou a apresentar
prurido e lesões. Voltou como recomendado à dieta anterior, deixando de apresentar
prurido. Foi aconselhada a manter banhos de manutenção com champô hidratante e dar
Drontal® Plus.1 Manteve a dieta de eliminação fase III 330 g/dia em 2 refeições (com
suplementação). O animal teve alta médica.
1.5 Caso 5 - Enterite crónica - Doença Inflamatória Intestinal
Bebel, uma cadela de raça Maltês com 4 anos e 2,5 kg, compareceu à consulta de Clínica
Médica com queixa de emése havia 2 dias. Teve 4 episódios de vómito por dia, de
coloração amarelada com espuma. Teve 4 episódios de diarreia. As fezes eram pastosas,
escuras, com muco. Apresentava anorexia havia 2 dias e estava apática. Não bebia água
havia 2 dias. A urina estava mais escura e em menor volume. Alimentava-se de Ração
Super Premium com “bifinho” Pedigree®. Emagreceu cerca de 600 gramas em 3 dias. A
vacinação e desparasitação estavam actualizadas e negava presença de ectoparasitas. Ao
exame físico detectou-se mucosas hipocoradas, presença de pústulas na pele, mas
nenhuma alteração à palpação abdominal. Foram realizados exames complementares
hemograma, ALT e creatinina, que não indicaram alterações. O exame directo das fezes
pelo método directo de Willis não revelou qualquer estágio de parasitas. O Rx abdominal
não demonstrou alterações. Suspeitou-se de gastroenterite e a terapêutica sintomática foi:
Plasil®; ranitidina; Bactrim® e metronidazol.2
98
1 Panacur® (fenbendazole) 50 mg/Kg BID 5 dias. 2 Prednisona 5 mg ¼ BID 7 dias; Bentyl® (diciclomina) gota/kg TID ANR : a diciclomina alivia o espasmo da musculatura lisa do tracto gastrointestinal por um duplo mecanismo: um efeito anticolinérgico específico (anti-muscarínico) nos receptores acetilcolínicos, e um efeito directo sobre o músculo liso (musculotrópico) 3 Buscopan® (butilescopolamina) 4 Óleo de peixe 500 mg 1comp. VO, SID, ANR.
A proprietária regressou com a Bebel 9 dias depois, relatando que fez o tratamento
conforme prescrito. No entanto, o animal continuava a apresentar emése com líquido
amarelo e espumoso, esporadicamente de conteúdo alimentar não digerido. As fezes
permaneceram amolecidas e com muco. Apresentava prurido anal manifestando com
frequência o hábito de lambedura. Aumentou 100 g de peso (2,6 Kg) e estava um pouco
menos apática. Diminuiu a ingestão hídrica e a urina estava com odor mais forte e coloração
mais intensa. Estava com normorexia até ao dia anterior à consulta, mas no dia desta não
aceitou alimento. As mucosas já estavam normocoradas e o hemograma não tinha
alterações significativas. As concentrações séricas de enzimas hepáticas ALT e FA eram
normais. Suspeitando-se de Giardiose prescreveu-se Panacur®.1
A Bebel retornou 5 dias depois e estava melhor. Os episódios eméticos cessaram. As fezes
estavam só amolecidas, mas quase próximo do normal. Engordou 300 g (2,9 Kg).
Apresentava normorexia e normodipsia. Ao exame físico constatou-se conteúdo fluido e
alças espessadas à palpação. Dois dias depois regressou mais magra 300 g (2,6 Kg) e mais
apática. Tinha fezes amolecidas com muco, hiporexia, normodipsia e urina normal. No dia
da consulta estava “arqueada” em posição de dor. O proprietário acreditava que o animal
tinha vomitou, embora não tivesse observado.
Face à diarreia crónica e suspeita de Doença inflamatória intestinal prescreveu-se2
Prednisona e Bentyl® na tentativa de se estabelecer diagnóstico de exclusão pela
terapêutica, uma vez que o diagnóstico definitivo só com análise histopatológica do tecido
intestinal por endoscopia. Pediu-se retorno uma semana depois para reavaliação e se não
houvesse melhora indicar-se-ia endoscopia. O animal só regressou 20 dias depois com
queixa de desconforto abdominal para a qual se administrou Buscopan® 3. Relatou que com
o uso da prednisona as fezes ficaram mais firmes e sem muco. Foi solicitado apoio ao
Serviço de Nutrição Clínica. O animal vinha mantendo o peso e alimentava-se de Ração
Super Premium Royal Canin® Mini Adult. Prescreveu-se uma dieta caseira para
Hipersensibilidade alimentar fase I de 215 g/dia dividida por 2 refeições e cápsulas de óleo
de peixe.4 Cálculo da Necessidade Energética de Manutenção em cães adultos:
NEM = 95 x (2,6 Kg) 0,75 = 194,5 kcal/dia; EM da dieta caseira hipoalergénica: 0,91 kcal/g.
Quantidade de alimento: NEM/EM = 194,5/0,91 ≈ 215 g/dia, com 160 g (75%) de batata
cozida e 55 g (25%) de carne de cordeiro (cálculos de acordo com a tabela 4).
A Bebel regressou mês e meio depois com grande melhoria no quadro clínico de enterite
crónica. Engordou 400 gramas em 40 dias (3,0 Kg); não tinha desconforto abdominal.
Na consulta de Nutrição referiu que o animal não aceitou bem a dieta caseira hipoalergénica
99
1 Conteúdo nutricional: Humidade: 10%; Proteína: 21%; gorduras: 19%; amido: 37,1%; matéria fibrosa: 2,2%; minerais: 8,5 %; EM (NRC 85): 3761 Kcal/kg; cálcio: 1%; fósforo: 0,8%; sódio: 0,4%. Composição básica : Arroz quebrado, proteína hidrolisada de soja, gordura animal estabilizada, polpa de beterraba, óleo vegetal, óleo de borragem, zeolita, óleo de peixe refinado, fruto-oligossacáridos, tirosina, taurina, extrato de rosa da Índia, palatabilizante, premix micromineral transquelatado, premix vitamínico-mineral.
mudando para Ração Hypoallergenic Canine DR 21 Royal Canin®.1 A quantidade
necessária para o paciente foi de 55 g/dia em 2 refeições, à qual se adaptou. Cálculo da
Necessidade Energética de Manutenção em cães adultos:
NEM = 95 x (3 Kg) 0,75 ≈ 216,5 Kcal por dia. EM da dieta comercial 3,76 Kcal/g.
Quantidade de alimento NEM/ EM = 216,5/3,76 ≈ 57,5 g/dia de ração em 2 refeições.
Não administrou as cápsulas de óleo de peixe. As fezes estavam normais, firmes, sem muco
e deixou de ter fezes pastosas com a nova dieta. Referiu normoquésia e esporadicamente
havia ocorrência de fezes um pouco amolecidas. Negava emése e referiu melhoras após
suspender Buscopan®.
1.6 Caso 6 - Gastroenterite aguda e Diabetes mellitus
Pantera, uma cadela de raça American Pitbull, com 2 anos, 12,7 Kg (ECC 1), pariu 8 filhotes
havia 2 meses, data a partir da qual que o proprietário começou a observar emagrecimento
contínuo. Perdeu 22 Kg em 20 dias! Depois de aplicar pentabiótico houve uma melhoria e
começou a comer melhor. Dez dias antes o animal ficou apático e parou de comer. Cada
vez que bebia água vomitava um conteúdo com sangue. Relatou pouca ingestão hídrica e
não estava a urinar. Três dias antes começou com secreção vaginal sanguinolenta.
Suspeitou-se de endometrite e de gastroenterite ou hepatopatia. Veio do Serviço de
Obstetrícia e foi solicitado apoio aos serviços de Clínica Médica, Cirurgia e Nutrição.
Figura 8 – A) Vista lateral da Pantera, apresentando ECC 1;
B) Vista dorsal do animal, com ECC1
A
B
100
A vermifugação estava desactualizada, revelando presença de ectoparasitas. Tinha
anorexia havia 10 dias e não estava a defecar. Ao exame físico constatou-se mucosas
hipocoradas, 8% de desidratação e estado nutricional caquético (Figura 8). Foram
solicitados exames complementares (Tabela 6). O hemograma indicou anemia grave e
trombocitose, e a bioquímica sérica revelou hipoalbuminémia e hiperglicémia.
Tabela 6 - Resultados dos exames hematológico e de bioquímicas séricas
Parâmetros (unidades) Resultados Valores de referência
Hemácias (· 106/µL) [He] 2,67 5,5-8,5
Hemoglobina (g/dL) [Hb] 6,8 12-18
Hematócrito (%) [Ht] 19,6 37-55
Leucócitos globais (· 103/µL) 8,3 6-18
Plaquetas (· 103/µL) 883 180-400
Hemoparasitas Negativo Negativo
Parâmetros (unidades) Resultados Valores de referência
ALT (U/L) 40,45 10-88
Creatinina (mg/dL) 0,63 0,8-2,0
Albumina (g/dL) 1,62 2,6-4,3
Glicémia (mg/dL) 218 70-150
Após a recolha por cistocentese realizou-se a urianálise e detectou-se acentuada glicosúria,
acetato na urina, marcada presença de sangue oculto na urina e ligeira proteinúria. A
densidade urinária era 1.042 - hiperstenúria; pH 5,0; cor amarelo ouro. A análise do
sedimento indicou presença de células epiteliais de transição, hemácias raras e ligeira
presença de células granulosas e leucócitos. A US abdominal revelou pelvis renais dilatadas
e conteúdo uterino com 3,5 cm diâmetro.
A hipoalbuminémia pode geralmente ser atribuída a causas hepáticas (diminuição da
produção de proteínas), renais, gastrointestinais (perda de proteínas) ou nutricionais. Dada
a ausência de sinais de envolvimento hepático, excluiu-se a participação deste órgão como
o responsável pela hipoalbuminémia. A análise da densidade urinária, aliada aos dados da
creatinina e ureia séricas permite avaliar a função renal. Como a proteinúria era ligeira pode-
se assim eliminar causas renais de hipoalbuminémia. Com base nos resultados destes
exames, sobretudo a hipoalbuminémia, descartou-se lesão hepática e renal e a suspeita
clínica recaiu sobre uma possível enteropatia e hiporexia, com baixo consumo proteico.
Dada a perda de peso bastante severa e a hipoalbuminémia, optou-se por iniciar o
tratamento. Devido à severidade da anemia e após exame hematológico do dador,
procedeu-se à transfusão sanguínea IV 500 ml. Na terapêutica ambulatória foram usados:
solução fisiológica + bicarbonato IV (9ml em 250 ml); solução fisiológica + potássio IV (10 ml
em 1L). Foi diagnosticada Diabetes mellitus e enterite. Para combater a hiperglicémia
101
1 Enrofloxacina 5 mg/kg SC, BID; Metronidazol 25 mg/kg IV, BID; Ranitidina 2mg/kg SC, TID; Furacin® (nitrofurazona em base de polietilenoglicol) com açúcar; Plasil ® 0,5 mg/kg SC, TID. Limpeza da ferida cirúrgica com solução fisiológica 0,9% + iodo. 2 Medição da glicémia, 10 min depois alimentação, 30 mins. depois administração de insulina com registo dos picos de glicémia após 6h e 8h).
administrou-se insulina regular 0,1 UI/Kg BID. Protocolo prescrito: enrofloxacina;
metronidazol; ranitidina; Plasil®; Furacin® com açúcar para limpeza de ferida cirúrgica.1
Foi solicitado apoio à Nutrição Clínica. Antes do parto, a Pantera comia ração económica
para adultos, após o qual passou a comer essa ração para filhotes, além de arroz, carne
cozida e ossos. O animal estava muito mal e ficou internado. No 1º dia esteve em jejum
alimentar e restrição hídrica. Como não comia, foi sugerida a nutrição parenteral, mas esta
não foi realizada devido aos custos do procedimento para o proprietário. No 2º dia colocou-
se a sonda esofágica (Folley 18). Foi fornecida Ração Super Premium Cães Filhotes e
depois de diagnosticada a Diabetes, passou para Ração Super Premium Cães Light.
Durante o internamento traçou-se a curva glicémica regularmente2. A prescrição médica
incluiu enrofloxacina, metronidazol, ranitidina, Plasil®, Tramal® (tramadol), ondansetrona,
ampicilina e Buscopan®. Durante este período, a Pantera foi submetida a fluidoterapia dia
16/4, no dia 18 comeu espontaneamente e as fezes eram normais. Dias 19, 20 e 21/4 foi
alimentada via sonda esofágica e dia 21 teve um episódio de emése à tarde.
No caso da Pantera foi calculada alimentação para manutenção e um aumento de peso de
20% (12,7 kg + 20% =15,24 kg). EM da ração comercial de filhotes empregada = 3,8 Kcal/g
NEM = 95 x (P)0,75 = 95 x (15,24)0,75 ≈ 732 Kcal/dia; NEM/EM = 732/3,8 ≈ 193 g/dia.
Protocolo alimentar: a ração foi previamente humedecida em água potável, batida no
liquidificador e coada em peneira. O alimento foi introduzido gradualmente e fornecido em
bolus com seringa.
No dia 16/4 o hemograma indicou que a anemia tinha diminuído. A glicémia aumentou para
244 mg/dl. A urianálise diferenciava-se da anterior: densidade 1011 e presença acentuada
de hemácias. Dia 22/4 apresentou emése sob alimentação enteral. Colectou-se amostras
para hemograma: hematócrito teve ligeira subida 24,8%; hemácias 3,5· 106/µL; hemoglobina
8,3 g/dL; nº plaquetas 899·103/µL. A albumina (1,99 g/dL) subiu um pouco. Urianálise:
densidade 1017; pH 8,0; sem glicosúria, traços de proteína e diminuição do sangue oculto
na urina. Neste dia foi prescrita Insulina e Ração SP Light 210 g/dia.
Cálculos : NEM = 95 x (P)0,75 = 95 x (15,24)0,75 ≈ 732 Kcal/dia. EM Ração Light 3,1Kcal/g.
Quantidade de alimento NEM/ EM = 732/3,1 ≈ 235 g/dia de ração em 2 refeições a cada 12
horas antes da insulina.
No dia 23 fez-se fluidoterapia IV com soluto fisiológico. No dia 24, durante o exame
ultrasonográfico foram verificados 2 pontos de intussuscepção intestinal, sendo o paciente
encaminhado de emergência ao centro cirúrgico, onde se fez uma enterectomia. Dia 25
demonstrou apetite, comeu voluntariamente e defecou. Dia 26 teve alimentação voluntária
de manhã e de tarde. Dia 30 teve alta médica.
102
1 Atropina 0,022mg/kg 0,5 ml SC; Imidocarb 5mg/kg 0,5 ml 2 Silimarina 10mg/kg 140 mg VO, TID, ANR
Dia 07/05 a Pantera regressou para reavaliação geral. O proprietário referiu bem estar geral;
normorexia, normoquésia, normodipsia e urina normal. Tinha ganho um pouco de peso (13,1
Kg). Estava a ser alimentada às 9h e 18h, recebendo insulina e petiscos durante o dia. Ao
exame físico a única alteração detectada à palpação foi conteúdo fluido nas alças
intestinais. Foram pedidos análises hematológicas e de bioquímicas séricas (Tabela 7).
Interpretação do hemograma: anemia moderada/grave e leucocitose. O nº de plaquetas
normalizou. O valor de fosfatase alcalina (FA) denota hepatoxicidade.
Tabela 7 - Resultados do hemograma e de bioquímicas séricas
Parâmetros (unidades) Resultados Valores de referência
Hemácias (· 106/µL) 2,72 5,5-8,5
Hemoglobina (g/dL) 6,7 12-18
Hematócrito (%) 20,9 37-55
Leucócitos globais (· 103/µL) 22,9 6-18
Plaquetas (· 103/µL) 258 180-400
Hemoparasitas Negativo Negativo
Observações: anisocitose; policromasia
Parâmetros (unidades) Resultados Valores de referência
ALT (U/L) 52,0 10-88
Creatinina (mg/dL) 0,64 0,8-2,0
FA (U/L) 131,4 10-80
Albumina (g/dL) 2,7 2,6-4,3
Glicémia (mg/dL) 511 (jejum) 70-150
Deu-se1 atropina e imidocarb e prescreveu-se2 silimarina. Uma semana depois, a Pantera
regressou com 14 Kg, em bom estado geral e sem alterações no decorrer do exame físico.
A glicémia havia diminuído para 355 mg/dl em jejum. O hemograma indicou que a anemia
era moderada (Tabela 8). Mudou-se a insulina de 2UI para 3UI/3V (0,21 UI/Kg).
Tabela 8 - Resultados do hemograma
Parâmetros (unidades) Resultados Valores de referência
Hemácias (· 106/µL) 3,02 5,5-8,5
Hemoglobina (g/dL) 7,3 12-18
Hematócrito (%) 22,6 37-55
Leucócitos globais (· 103/µL) 9,9 6-18
1. 7 caso 7 - Obstrução intestinal por corpo estranho (Enterectomia)
Ursinha, uma cadela de raça Husky siberiano, com 6 meses de idade e 9,55 Kg (ECC 4)
apareceu na consulta com vómitos havia 3 dias, vomitando após a ingestão de água. A
proprietária relatava ingestão de pequenos ossos. A sua alimentação era composta por
ração com petiscos. Estava com anorexia, emése, normodipsia, urina normal e sem diarreia.
103
Figura 9 – Solução preparada de Nutrição Parenteral Parcial
1 Fluidoterapia - Ringer simples 250 ml em 2 horas; Indomectina IV 0,05 mg/kg; Ranitidina SC 2,2 mg/kg. 2 No pós-operatório foi administrado : Tramal® injectável 4 mg/kg 0,7 ml IM, BID 10d; Cefazolina 30 mg/kg 1,3 ml IM, BID 10 dias; Metronidazol 25 mg/kg 50 ml IV, BID 10 dias; Ranitidina 2,2 mg/kg 0,8 ml SC, BID; Maxican® (meloxicam) 0,1 mg/kg (15mg/1,5ml) 0,09ml IM SID 5 dias.
Figura 10 – Suporte de Nutrição Parenteral Parcial com a solução revestida de papel de alumínio para protecção das vitaminas do complexo B
Ao exame físico apresentou mucosas hipercoradas; TRC > 2”; 5% de desidratação. Sentiu
dor à palpação e tinha alças espessadas, configurando indicação para Rx, para avaliar o
trânsito GI. Os exames hematológicos e das bioquímicas séricas não revelaram alterações
significativas. O ionograma indicou hiponatrémia e hipocalémia (devido ao vómito). Tinha
hiperglicémia (175 mg/dL). Suspeitou-se de corpo estranho intestinal, que depois se
confirmou (gastroenterite aguda severa). Para estabilizar a sua condição, foi tratada
preliminarmente com Fluidoterapia - Ringer simples; indomectina; ranitidina.1 A Ursinha
regressou no dia seguinte, tendo durante a noite apresentado alguns episódios eméticos.
Perdeu 500g (tinha 9,50 Kg) em 3 dias e ECC 4. Apresentava anorexia havia 4 dias, vomita
havia 4 dias (também neste dia) e tinha disquésia.
No dia 14/4 no centro cirúrgico foi realizada uma enterectomia com remoção do corpo
estranho linear do intestino. Ficou internada e não apresentou emése durante a noite. No dia
15/04 tinha 9,250 Kg e ECC 4. Estava alerta e caminhou um pouco. No pós-operatório foi
administrado:2 Tramal®; cefazolina; metronidazol; ranitidina; Maxican®. Esteve internada até
dia 17/4.
Em Nutrição Clínica soube-se que comia Ração Premium Filhotes e pão. Quando evacuava,
as fezes estavam ressecadas, pois não se alimentava normalmente. Foi indicada Nutrição
Parenteral. Fez-se a preparação da solução num total de 692,61 mL por dia, de acordo com
o protocolo (anexo 8). A receita diária do animal foi: 74,1 mL de solução de glicose 50%;
37,8 mL de solução de lípidos 20%; 56,7 mL de solução de aminoácidos a 10%; 3,78 mL de
complexo B; 496,03 mL de Ringer Simples; 5,34 mL de solução de NaCl a 20%; 8,98 mL de
solução de KCl a 2mEq/mL. A velocidade de infusão foi de 47,5 mL/hora (Figuras 9 e 10).
104
No 1º dia deu-se 692 ml de Nutrição Parenteral Parcial (NPP). No 2º dia deu-se somente
500 ml de NPP (não foi possível dar 692 ml) mais nutrição microenteral 100ml (10 ml/hora).
No 3º dia infundiu-se apenas 190 ml de NPP mais nutrição microenteral 120ml (12 ml/h).
A solução microenteral foi administrada por meio de seringa directamente na cavidade oral
(podendo também ser feita via sondas). A solução é composta por glicose (5% a 25 %),
enriquecida com um quarto de solução de Lactato de Ringer e adicionada de soluções
comerciais de polímeros e péptidos.
A partir do dia 19/04, após a recuperação da cirurgia, forneceu-se dieta enteral
hipermetabólica. Utiliza-se esta dieta para cães em estado de hipermetabolismo através de
sonda nasoesofágica, via seringa ou por consumo voluntário do animal (que foi o caso). A
quantidade total diária foi de 750 ml/dia, com início gradual nas proporções de 33% no 1º
dia, 66% no 2º e 100% no 3º, de forma a evitar-se o risco de síndrome da realimentação.
Cálculos : NEM = 130* x (peso em kg) 0,75 ≈ 720 Kcal por dia (*factor para filhotes)
Volume de solução = NEM/ EM = 720 Kcal por dia / 0,96Kcal/mL = 750 ml/dia ≈ 700 ml/dia.
Cinco dias depois a Ursinha, com 9,0 Kg e ECC 4, foi trazida pela proprietária que disse que
no dia seguinte à última consulta no HV foi para uma clínica por causa de um edema ao lado
das suturas. Foi alimentada com a dieta enteral prescrita na clínica no dia 18/4 e o animal
não defecou; no dia seguinte as fezes eram aquosas, fétidas e escuras. Na clínica
suspendeu a dieta no dia 18 à noite e desde então não se alimentou; dias 20 e 21/4 recebeu
apenas fluidoterapia. Foi retirado Tramal® na clínica. A proprietária não sabia se o animal
defecou nos dias 20 e 21 mas no dia 22 produziu fezes moles.
Dieta enteral hipermetabólica no volume de 700 ml/dia (início gradual 33%, 66%, 100%),
conforme o mesmo cálculo apresentado anteriormente. A fórmula da dieta está apresentada
na Tabela 9. A administração da dieta hipermetabólica foi feita por via oral, já que o animal
tinha apetite e tomou a dieta sozinho sem sonda.
Para fazer os cálculos da preparação - administração durante 3 dias: 230 ml (33%) + 460 ml
(66%) + 700 ml (100%) = 1390 ml ; prepara-se 1500 ml (tabelado).
Tabela 9 - Dieta para Cães Hipermetabólicos e/ou com perda proteica extra
% Ingredientes 1500 mL 1,1 Nutrilon/Mucilon 16,5 g 1,1 Dextrose 16,5 g 15,3 Extrato solúvel de soja 229,5 g 11,4 Creme de Leite 171 ml 69,5 Água 1042,5 ml 0,8 Suplemento Mineral e Vitamínico 12 g 0,5 Ornitagin® 7,5 ml 0,3 KCl a 20% 4,5 ml
Composição nutricional na matéria seca (% da MS) Proteína Bruta: 32,1%
Extrato Etéreo: 27,3 %
Energia Metabolizável: 0,96 Kcal/ml
105
Forneceu-se ainda 15 g de prebiótico (levedura de cerveja) e 2 g de probiótico para auxiliar
na microbiota intestinal, uma vez que o animal passou por uma cirurgia intensa e ficou um
tempo sem alimentação por via oral.
Dia 24/04 o animal retornou para retirar os pontos. Estava bem, com normorexia e
normoquésia. Estava a comer bem a dieta enteral hipermetabólica. As fezes ainda estavam
pastosas e um pouco aquosas; urina normal. No entanto, emagreceu 450 g em 3 dias (8,55
Kg) e tem ECC 3. A partir deste ponto foi prescrita ração Super Premium para cães filhotes.
Procedimentos de cálculo – Dieta para cães em crescimento
NE = 130 x (peso corporal) 0,75 x 3,2 x [2,718 ( - 0,87 x p ) – 0,1] ≈ 684 Kcal por dia
p = Peso actual (kg)/peso estimado adulto = 8,55/20 ≈ 0,427
Ração Super Premium com EM de 3,8 Kcal/g. NE/EM = 684/3,8 ≈ 180 g/dia.
Divide-se o alimento em várias refeições.
1º dia: 60g (33%) de ração seca e 66% de dieta enteral;
2º dia: 120 g (66%) de ração seca e 33% de dieta enteral;
3º dia: apenas ração seca 180 g/dia (100%).
A Ursinha regressou dia 30/4 para acompanhamento pós-cirúrgico. Estava bem, sem
vómito, com bastante apetite, já estava a comer a ração seca recomendada. Fezes
diarreicas, na véspera pastosas. Relata que está a ingerir muita água mas a urina está
normal. A radiografia abdominal não contrastada não revelou alterações. Estava com 8,600
Kg e ECC 3. Manteve-se a prescrição da dieta: Ração Super Premium Cães Filhotes 180
g/dia em 4 refeições. Teve alta médica.
1.8 DISCUSSÃO DOS ASPECTOS NUTRICIONAIS DOS CASOS CLÍNICOS
O correcto maneio nutricional do animal doente depende de uma adequada recolha de
informações a respeito da alimentação e estado nutricional do paciente durante a anamnese
e exame físico (incluindo a determinação da condição ou escore corporal) e da realização de
exames laboratoriais específicos, quando necessário. Devem estruturar-se protocolos e
procedimentos internos que permitam a definição das necessidades energéticas do animal,
tipo de alimento a ser empregue, sua composição nutricional, via de administração e a
quantidade de alimento a ser fornecida (Carciofi, Fraga & Brunetto, 2003).
Animais que durante 24 ou 48 horas não apresentem consumo voluntário de alimento, as
suas necessidades energéticas entrarão em balanço calórico-proteico negativo, devendo
receber intervenção nutricional enteral ou parenteral (Remillard et al., 2000). A necessidade
energética de manutenção (NEM) pode aumentar bastante no animal hipermetabólico.
Deste modo, em algumas condições, mesmo ingerindo uma quantidade importante de
alimentos verifica-se emagrecimento no animal, em função da sua elevada exigência
calórico-proteica (Carciofi, 2008b).
106
Como regra geral deve alimentar-se o animal da maneira mais simples, eficiente e barata.
Esta é, sem dúvida, a alimentação voluntária. Quanto esta não é efectiva, em função de
anorexia ou é contra-indicada, a próxima opção passa a ser a alimentação enteral. Esta via
é mais fisiológica, barata e menos sujeita à complicações. A terceira opção será a nutrição
parenteral (Carciofi, 2008e).
A estruturação e condução de um protocolo ou serviço nutricional para animais doentes
deve incluir, no mínimo, os seguintes pontos: a) determinar a condição nutricional do
paciente; b) estimar a proporção e relação entre as fontes de energia do alimento (proteínas,
gorduras e carbohidratos); c) estimar as necessidades energéticas do paciente; d)
seleccionar a dieta e a via de administração (oral, enteral ou parenteral); e) condução do
programa nutricional; f) avaliar as respostas e realizar ajustes necessários; g) planear a
transição para a dieta e alimentação de manutenção.
Todos os animais, na avaliação clínica, devem ser pesados e ter estimada a sua
Necessidade Energética de Manutenção (NEM), em Kcal de energia metabolizável por dia.
Esta pode ser estimada por meio de fórmulas publicadas, como por exemplo pelo Nutrient
Requirements of Dogs and Cats (NRC, 2006). O registo do peso é fundamental, ainda, para
se avaliar a eficácia do programa nutricional por meio da perda, manutenção ou ganho de
peso. Ganhar peso não é importante, essencial é a manutenção de um balanço energético
positivo. Uma melhor avaliação da condição nutricional do paciente depende da
determinação e registo na ficha clínica do seu escore de condição corporal ou nutricional
(ECC). Este é determinado com base na escalas de 1 a 9, sendo 1 o animal caquético e 9 o
animal obeso. Uma descrição mais completa do sistema de avaliação da condição corporal
dos cães encontra-se no Anexo 5. Uma avaliação da condição muscular do paciente, por
meio de palpação, também é importante. Depleção muscular na região parietal e frontal do
crânio determina atenção nutricional imediata, pois esta sinaliza um estado avançado de
perda de massa corporal magra e vem acompanhada de perda de massa hepática, cardíaca
e intestinal.
Pode-se determinar também, o escore de doença (ED), apresentado no Anexo 7. Este é um
guia de prognóstico que também é útil na definição de estratégias nutricionais. Pacientes
com escores de doença 4 e 5 não podem deixar de receber calorias, mas também não as
podem receber em excesso, pois devido ao seu comprometimento funcional isto poderia
precipitar a sua morte (Carciofi, 2007b).
A quantidade de alimento a ser administrada deve ser calculada considerando-se a NEM do
paciente e a energia metabolizável (EM) do alimento. Esta última pode ser verificada junto
ao fabricante do alimento industrializado ou, na ausência desta informação, estimada a partir
da composição de rótulo dos alimento pelas fórmula:
EM = [(proteína bruta x 3,5) + (extrato etéreo x 8,5) + (extrativos não nitrogenados x 3,5)]
Kcal por 100 gramas para alimentos para cães (NRC, 1985).
107
De posse das informações a respeito da NEM do paciente e da EM do alimento, a
quantidade a ser fornecida é calculada como:
Quantidade de Alimento (gramas) = NEM / EM do alimento.
O maneio alimentar deve incluir o fornecimento de 2 refeições por dia para cães. Deve
registar-se, também, a produção e qualidade das fezes. A qualidade das fezes pode ser
avaliada com base no sistema de escore fecal de 0 a 5. No Anexo 6 encontra-se uma
ilustração dos 6 tipos de fezes (Carciofi, 2008d).
As doenças gastrointestinais (GI) constituem o terceiro grupo de afecções mais comuns em
cães e gatos (Lund, 1999). Os sinais mais comuns associados com afecções digestivas
incluem vómitos, diarreia, anorexia e perda de peso. As doenças GI provocam alterações
directas nos órgãos envolvidos e na perda da capacidade de absorção de nutrientes, e a
consequente desnutrição pode levar a complicações sistémicas. Desta forma, o objectivo do
maneio nutricional destes pacientes é fornecer nutrientes que favoreçam a restauração das
funções digestivas, o restabelecimento do equilíbrio da microbiota intestinal, com efeito
modificador no TLAI e no SI geral. A terapêutica dietética desempenha um papel essencial
no tratamento e, dependendo da condição subjacente, pode ser mais importante que a
intervenção farmacológica, podendo a modificação da dieta ser por vezes a única
intervenção necessária (Carciofi, 2007b). Nesta discussão faz-se uma abordagem conjunta
dos aspectos da composição e utilização de dietas nos casos clínicos (CC) estudados. A
função dos dietéticos é considerada especificamente para cada tipo de doença.
As necessidades nutricionais de pacientes com doença gastrointestinal são aumentadas. O
fornecimento inicial de 0,85 x NEM, ou seja 25% a mais, pode ser um ponto de partida.
Nestas situações a necessidade de maior ingestão para suplantar perdas e gastos maiores
deve ser contrabalançada com a menor habilidade e capacidade intestinal, reforçando a
importância do oferecimento de alimentos de elevadas digestibilidade e densidade
nutricional.
O tratamento de doenças GI agudas, muitas vezes envolve algum descanso para o tracto
digestivo. O alimento é retirado por um período de 24 a 48 horas de forma a reduzir-se a
carga digestiva e osmótica intestinal, bem como reduzir-se o substrato intestinal para
fermentação bacteriana. Este conceito foi recentemente revisto. A interrupção da
alimentação pode ter consequências nutricionais desastrosas. A continuação da
alimentação, mesmo com diarreia, mantém a integridade da mucosa intestinal e aumenta a
taxa de sobrevivência dos pacientes (Hall, 1996).
Na prática veterinária, no entanto, por vezes a alimentação é impossível, nas patologias GI
agudas, devido ao vómito dos animais (vide CC 6). De qualquer forma, assim que se
controle o vómito deve alimentar-se o animal (como se fez nos casos 1, 2, 6 e 7) evitando-se
com isto a atrofia de vilosidades intestinais, a imunossupressão local no intestino, a
translocação intestinal de bactérias com septicémia e degradação da condição nutricional do
108
paciente (Rabelo, 2008). Deve corrigir-se o desequilíbrio hidro-electrolítico e se não
ocorrerem vómitos, oferecer soro oral em forma de cubos de gelo (Costa, 2007) (como se
fez no CC 2).
Após um período de descanso GI, a dieta deve ser reintroduzida gradualmente em
pequenas e frequentes refeições, durante um período de 4 a 7 dias. Um alimento de elevada
digestibilidade e gordura e fibras moderadas é a melhor opção. Este pode ser caseiro ou
comercial, para manutenção (CC 1) ou crescimento (CC 2), desde que apresente menos de
2,5% de fibra bruta e seja composto por ingredientes proteicos e fontes de amido de alta
digestibilidade.
Em muitas situações, seja por decisão do clínico ou do proprietário, opta-se pelo emprego
de dietas caseiras no maneio nutricional de cães com gastroenterite (GE). Foi o que
sucedeu nas GE agudas dos CC 1 e 2 e nas GE crónicas dos CC 3 e 5. Esta opção pode
basear-se no elevado custo de dietas comerciais específicas, por problemas de
palatabilidade, desejo do proprietário, falta de uma dieta específica que reúna as
necessidades nutricionais de pacientes com mais de uma condição clínica concomitante,
entre outros. Uma alimentação caseira correcta depende de preparar-se alimentos
especialmente para os animais. De forma geral, um bom alimento industrializado formulado
para a condição fisiológica específica de cada animal é mais barato, simples e seguro do
ponto de vista nutricional (Carciofi, 2008c).
Algumas dietas de suporte (terapêuticas) para o maneio de doenças GI estão disponíveis
comercialmente. Elas são formuladas para terem elevada digestibilidade (> 87% da proteína
e > 90% dos carbohidratos e gorduras), sendo compostas por fontes proteicas e de
carbohidratos refinadas, de elevada qualidade. Estas dividem-se, de forma geral em 2 tipos:
1) Dietas enriquecidas em fibra: contêm mistura ou combinação de fontes de fibra, que
podem colaborar no maneio clínico de patologias de ID ou IG. De forma geral, recomenda-
se o emprego de fibra de moderada fermentação e solubilidade, agregando os benefícios
destas duas características à dieta do animal. Em casos de diarreia de ID (como parecem
ser os casos 1, 2, 6 e 7) recomenda-se pouca fibra (< 2-3%), de modo a se aumentar a
digestibilidade. Para diarreia de IG (como no caso 5) maior quantidade deste nutriente (> 8-
10%), o que pode favorecer a função do cólon. Também se devem fornecer dietas ricas em
fibras em casos de presença de corpo estranho intestinal (CC 7) e cirurgias (CC 6 e 7)
(Carciofi & Brunetto, 2008). No caso 6, como foi diagnosticada Diabetes também se
aumentou a fibra.
2) Dietas com teor moderado ou reduzido de gordura: via de regra as gorduras são mais
digeríveis do que carbohidratos e proteínas, fornecendo 2,25 vezes mais energia aos
animais. Pacientes com doença gastroentérica podem não tolerar dietas ricas em gordura (>
25% da matéria seca), pois ácidos gordos não absorvidos no lúmen intestinal provocam
diarreia osmótica. Alimentos com teor moderado de gordura (em cães - 12 a 15% da matéria
109
seca) como nos CC 1, 3 e 7, geralmente são tolerados pelos animais e apresentam
densidade calórica suficiente para lhes fornecer energia. Menores teores de gordura (9% na
dieta Light do CC 6) podem tornar necessário o fornecimento de maiores quantidades de
alimento. Várias alterações do TGI induzem má digestão e/ou má absorção. Em pacientes
com gastroenterites, com marcada redução da superfície das vilosidades secundária a
inflamações crónicas (CC 3 e 5), agentes infecciosos (parasitários dos CC 1 e 2), neoplasia
ou cirurgia (CC 6 e 7), dietas com gordura reduzida são indicadas, pelo menos no início da
realimentação (Carciofi, 2008c).
Outras características das dietas para doenças intestinais: altamente digestível, porém não
marcadamente hipertónica; suplementada com vitaminas lipo e hidrossolúveis;
nutricionalmente balanceada e de elevada palatabilidade. Esta deve ser fornecida em 2 ou 3
pequenas refeições. Um maior número de refeições pode abolir a “limpeza” intestinal
promovida pelas ondas peristálticas interdigestivas, o que não é recomendável (Carciofi &
Brunetto, 2008).
Por vezes a dieta habitual do animal é o principal factor causal da afecção gastroentérica,
seja devido a alergia ou intolerância alimentar. A alergia (ou hipersensibilidade) é
imunologicamente mediada enquanto a intolerância é uma reação não imunológica ao
alimento. Nestas situações, a modificação dietética é curativa e o tratamento primário da
afecção. Em casos agudos, o proprietário facilmente associa o alimento causal ao episódio
gastroentérico, o que resulta na remoção do alimento e cura do animal. Em casos crónicos,
no entanto, o alimento particularmente envolvido na doença é de mais difícil detecção.
As dietas de eliminação são utilizadas para o diagnóstico e mesmo para o maneio da alergia
ou hipersensibilidade alimentar em cães, como ocorreu no CC 4. A dieta deve ser composta
de uma única fonte proteica e uma única fonte de carbohidrato. Os ingredientes propostos
para a sua formulação foram carne de carneiro e batata, que provavelmente o animal foi
pouco exposto previamente. Essa dieta é recomendada para o início do maneio dos animais
suspeitos, como forma de se confirmar o diagnóstico, sendo fornecida por um período de 6 a
8 semanas. Não deve ser empregue a longo prazo pois não é uma dieta completa e
balanceada, sendo nutricionalmente inadequada para crescimento ou manutenção. As
dietas caseiras, em geral, são pobres em cálcio, certas vitaminas e outros micronutrientes,
portanto devem ser suplementadas. Confirmado o diagnóstico, quando o proprietário não
opta pelo emprego de alimentos comerciais hipoalergénicos (no CC 4 não foi aceite pelo
animal) ou não se propõe a realizar a exposição provocativa para detecção dos alimentos
para os quais o animal é alérgico, o cão pode receber o mesmo alimento que resultou em
melhoria clinica, mas a dieta deve receber novos ingredientes, de forma a tornar-se
nutricionalmente completa e balanceada.
Quadros de hipersensibilidade alimentar com processo dermatológico associado, nos quais
as infecções secundárias por bactérias ou fungos já tenham sido controladas, só
110
apresentam melhoria quando a terapia nutricional adequada for estabelecida por
aproximadamente 6 a 10 semanas (Costa, 2007), o que se verificou no caso 4.
A doença inflamatória intestinal pode também ser manifestação de alergia alimentar. O
maneio dietético de pacientes com DII crónica (como o do CC 5) é semelhante aos
princípios estabelecidos para as reacções adversas ao alimento, com dietas
“hipoalergénicas”, ou dietas com alimentos novos, nunca oferecidos ao animal, na tentativa
de eliminar antigénios e intolerâncias (Zentek, 2008). Dietas comerciais ou caseiras podem
ser usadas, com teor moderado de gordura e ingredientes de baixa antigenicidade e de fácil
digestão. Os objectivos da dieta são facilitar a regulação da motilidade intestinal, modificar
de forma benéfica a composição e a actividade metabólica da microbiota intestinal e excluir
os antigénios da dieta. Uma fonte de proteína de alta digestibilidade (ex. frango) em
combinação com carbohidratos de alta digestibilidade (ex. arroz cozido), é a base da dieta
recomendada. A concentração da gordura deve ser restringida, mas o fornecimento de
ácidos gordos ω3 (óleo de peixe no CC 5) tem efeitos anti-inflamatórios. Deve ser dada
suplementação adequada de vitaminas e oligoelementos (Zentek, 2008). A
“hipoalergenicidade” é conferida por conter uma única fonte proteica ou a proteína ser
hidrolizada (tratada enzimaticamente para alterar a sua estrutura) (German & Zentek, 2006),
podendo ser incorporada em dietas terapêuticas comerciais. No caso 5 o animal adaptou-se
melhor à dieta comercial hipoalergénica. Frequentemente, a modificação da dieta requer
tratamento adicional com medicamentos antibacterianos ou imunossupressores (o que se
verificou no CC 5).
Diferentes condições clínicas resultam em diarreia crónica, como DII (CC 5), intolerância
alimentar, colite responsiva à fibra e neoplasias do IG. O maneio dietético varia de acordo
com a doença subjacente. Geralmente, o animal deve receber uma dieta com níveis
moderados de fibras e gordura, dividida em pequenas porções durante o dia. Os princípios
de maneio dietético são similares aos expostos para a DII. Muitos pacientes com colite
crónica respondem a dietas hipoalergénicas (vide CC 5) (Carciofi & Brunetto, 2008).
Mais frequentemente, no entanto, a dieta do animal não é a causa da doença
gastroentérica. No entanto, devido ao comprometimento do TGI, o oferecimento de uma
dieta convencional pode resultar em diarreia. Nesta condição, modificações na dieta não
curam propriamente a doença, mas reduzem os sinais clínicos, actuando como coadjuvante
da terapia medicamentosa. Danos na “bordadura em escova” da mucosa intestinal podem
reduzir a capacidade digestiva e absortiva do animal, de modo que alimentá-lo com uma
dieta altamente digestível é recomendado (digestibilidade da matéria seca > 87%). (Carciofi,
2008c). A proteína deve ser de elevada digestibilidade (> 85%) e valor biológico. O emprego
de uma única fonte proteica pode ser a melhor opção para várias doenças GI, reduzindo-se
o risco do intestino doente desenvolver hipersensibilidade à dieta habitual do animal. Nos
111
carbohidratos, o arroz é o grão de maior digestibilidade para cães, tendo o arroz cozido sido
uma excelente opção nas misturas caseiras dos casos 2, 3 e 6.
Nas dietas caseiras, o fígado e a levedura de cerveja (usado no CC 7 como prebiótico)
entram como fontes naturais de vitaminas e minerais. Os minerais (fosfato bicálcico,
carbonato de cálcio e suplemento vitamínico-mineral) e a levedura de cerveja devem ser
adicionados após o alimento arrefecer. Deve-se conversar com o proprietário sobre a
importância deste manter as quantidades prescritas dos ingredientes, como sucedeu no CC
4. Alguns dos ingredientes são necessários em muito pequena quantidade, podendo a sua
preparação ser feita em farmácias de manipulação (Carciofi, 2008b).
Pacientes com doença grave (como nos casos 6 e 7) devem ser alimentados com
quantidade moderadas de calorias. Para estes animais, recomenda-se o fornecimento de
calorias suficientes para atender a sua necessidade energética de repouso (NER), o que se
considerou no CC 7. A ingestão da NER, estimada para cães como 70 x (peso em kg) 0,75
Kcal/dia, é utilizada como o critério para considerar-se o animal em balanço energético
positivo (Carciofi, 2008b). Deve empregar-se alimentos de alto valor calórico (conferido pela
elevada inclusão de gorduras), alto valor proteico e de alta digestibilidade. No caso 7 a dieta
enteral hipermetabólica tem 32% de proteína e 27% de gordura na matéria seca. A elevação
de gorduras na dieta favorece a ingestão de energia por animais hiporéticos, que
apresentam reduzida ingestão de alimento (vide CC 2, 3, 5, 6 e 7). Minimizar o estado
catabólico e o balanço nitrogenado negativo são um dos principais objetivos do suporte
nutricional. Em função disso, deve empregar-se alimentos com elevado teor proteico: acima
de 24% para cães adultos (CC 1, 3, 4, 5 e 6); acima de 26% para cães filhotes (CC 2) e
idosos; acima de 30% para cães filhotes (CC 7) em reparação tecidual importante (Carciofi,
2008e).
Se o alimento oferecido não é consumido ou se o for em baixa quantidade, pode utilizar-se
palatabilizantes como ração húmida, água morna, creme de leite e comida caseira. Quando
este artifício não contorna a anorexia, pode praticar-se a ingestão forçada, com a colocação
de alimento directamente na boca do animal. Este recurso, no entanto demora muito tempo
e tem baixa eficácia (Carciofi, 2008b).
Nesta condição, o melhor é partir para o suporte nutricional enteral através da colocação de
sondas nasoesofágica, esofágica, gástrica ou duodenal, dependendo da situação clínica do
paciente. Nos animais em que a via gastroentérica apresenta-se inviável, devido a vómitos
ou recuperação de cirurgias do sistema digestivo, deve instituir-se o suporte nutricional
parenteral, que pode ser total ou parcial (caso 7) (Carciofi, 2008e). Armstrong (1988)
apontou os seguintes critérios para a identificação dos pacientes que necessitam de apoio
nutricional: ingestão oral reduzida por 3 a 5 dias (CC 6) ; ingestão oral interrompida durante
3 dias (só no CC 7); evidências que sugiram uma perda aguda de peso maior que 5% (em
ausência de perda de líquidos); exame físico que indique sinais de depleção muscular ou
112
perda de peso maior que 8 a 10%. O CC 6 preencheu estes requisitos em limites inferiores
ao mínimo, mas só o caso 7 fez nutrição parenteral, porque o dono do animal do caso 6 não
aceitou a sugestão de nutrição parenteral devido ao custo mais elevado.
Nas gastroenterites, o fornecimento de alimento no primeiro momento pode estar contra-
indicado, havendo a necessidade do uso de suporte microenteral ou parenteral. Evidências
crescentes sugerem que a nutrição enteral em pacientes anoréticos ou durante o período
em que não há nenhuma ingestão oral de alimento, é benéfica para os animais com
gastroenterite (Brunetto, 2008).
A terapia nutricional enteral (NE) é definida como um conjunto de procedimentos
terapêuticos utilizados para a manutenção ou recuperação do estado nutricional por meio do
fornecimento de nutrientes no lúmen do tracto GI, administrados pela boca, sondas ou
ostomias (Brunetto, 2008b). Sempre que possível, o uso do suporte nutricional enteral é
preferível ao parenteral, por ser mais próximo do fisiológico, mais seguro e económico, além
de garantir o aporte de nutrientes ao lúmen intestinal, mantendo dessa forma a integridade
da mucosa e evitando a translocação bacteriana (Macintire, 2000). As pesquisas dão
suporte à ideia de que a alimentação enteral em geral, mais do que o aporte e nutrientes
através do jejuno, é a razão primária para os efeitos benéficos da nutrição enteral, mas esta
hipótese precisa ser mais bem avaliada (Mohr, Leisewitz & Jacobson, 2003).
A opção da nutrição parenteral não deve ser excluída, mas o seu uso deve ser restrito a
pacientes em que o consumo calórico adequado está dificultado por vómitos persistentes
(Simpson & Birnbaum, 2006). A nutrição enteral deve ser iniciada o mais cedo possível,
restringindo a nutrição microenteral ao período de transição entre a anorexia e o suporte
nutricional enteral. O suporte nutricional como factor independente influencia no prognóstico
e deve ser considerado como parte integrante do tratamento do paciente crítico (Carciofi,
Fraga & Brunetto, 2003). Apresenta como objectivos prevenir a desnutrição calórico-
proteica, situação muito comum devido ao hipermetabolismo e anorexia, e actuar como um
agente modulador sobre a resposta inflamatório-metabólica, melhorando as condições do
paciente e aumentando as hipóteses de recuperação (Brunetto, 2008a).
Animais inapetentes, mas que apresentem o tracto GI funcional devem ser prioritariamente
alimentados via sonda nasoesofágica, esofágica, gástrica ou intestinal (Brunetto, 2008). A
colocação da sonda pela via nasoesofágica é o método mais indicado para cães que
necessitam de suporte nutricional por período inferior a uma semana, como ocorre nas
gastroenterites (Abood & Buffington, 1992). A alimentação deve ser iniciada logo após a
colocação do tubo, de forma lenta e gradual para a adaptação dos pacientes, prevenindo a
síndrome de realimentação. Como dieta indica-se o uso de alimentos enlatados
hipercalóricos para cães. O Serviço de Nutrição Clínica do Hospital Veterinário da Unesp de
Jaboticabal desenvolveu fórmulas caseiras de dietas para uso em sondas de reduzido
calibre, sendo de fácil preparação e que têm demonstrado bons resultados (Brunetto, 2008).
113
A dieta enteral hipermetabólica para cães pode ser administrada via sonda nasoesofágica
ou por consumo voluntário do animal, de que é exemplo o caso 7. O hipermetabolismo é
uma doença catabólica com aumento da necessidade de energia e nutrientes, em especial
de proteína. É caracterizada pelo aumento do consumo de oxigénio e nutrientes, elevação
dos níveis de cortisol, catecolaminas e glucagon, o que origina balanço nitrogenado
negativo. Este estado limita a eficiência de uso de glicose infundida parenteralmente; a
glicose não limita a gliconeogénese e a lipólise (Carciofi, 2007b).
Quando a desnutrição e o hipermetabolismo ocorrem ao mesmo tempo, a degradação
proteica não é suprimida e pode mesmo acelerar. Sistemas orgânicos que dependem de um
turnover celular rápido, tais como o intestino e o sistema imunitário, são mais vulneráveis. A
combinação de função imunitária deprimida e falha da barreira da mucosa GI apresenta
graves consequências para o prognóstico do paciente. O TLAI sofre depleção e há uma
redução na secreção de IgA, aumentando-se os riscos de translocação bacteriana (Carciofi,
2007a). O animal deve receber alimentos ricos em proteína e gordura, prevenindo-se no
entanto, ingestões excessivas de energia, acima da NEM. Sem um adequado suporte
nutricional, o balanço nitrogenado negativo com perda de massa magra, pode resultar em
dificuldades de cicatrização, imunossupressão, maior tempo de recuperação e mortalidade
(Carciofi, 2007b).
No caso 6 utilizou-se uma sonda esofágica, cuja técnica de colocação é de fácil realização e
não apresenta desconforto para o animal. A simplicidade do maneio da sonda e
administração do alimento permite a cooperação dos proprietários, minimizando os custos
de internamento no hospital veterinário. A sua vantagem é o maior diâmetro do tubo
(relativamente à sonda nasoesofágica), o que viabiliza a administração de alimento mais
grosseiro e em maior quantidade, próximo ao usualmente consumido por cães (Devitt &
Seim, 2000). As complicações associadas a esta técnica são: infecção do campo operatório,
esofagite, aspiração de alimento, disfagia, vómito, saída da sonda através da cavidade oral
e gastrite (Remillard et al., 2000). A alimentação através da sonda esofágica deve iniciar-se
aproximadamente 8 horas após o término do procedimento cirúrgico.
Os pacientes anoréticos há mais de 7 dias devem passar por um processo inicial de
adaptação, sendo conveniente iniciar com aproximadamente 25 a 30% da quantidade
calculada no 1º dia de suporte e atingir os 100% em torno do 3º ao 7º dia, dependendo da
gravidade do caso (vide CC 7). Como alimento pode utilizar-se, via sonda esofágica, ração
comercial seca tipo Super Premium, para cães em crescimento, como a que se usou no
caso 6. A ração deve ser humedecida em água potável, triturada em liquidificador, coada em
peneira e depois administrada via sonda com o auxílio de uma seringa. A quantidade total
de alimento diário é dividido em 6 refeições, com o intervalo mínimo de duas horas entre
elas e duração de 10 a 15 minutos cada refeição, sendo a dieta fornecida em bolus. A
capacidade gástrica pode ser estimada em 50 ml por Kg de peso corporal em cada refeição,
114
para evitar possível sobrecarga. O cálculo da necessidade hídrica é estimado em 70 ml por
kg de peso corporal. O volume hídrico utilizado para humedecer a dieta e para a
higienização da sonda deve ser considerado neste cálculo (Brunetto, 2008a).
A terapia nutricional parenteral (NP) consiste na administração de todas ou parte das
exigências nutricionais diárias através da via intravenosa (Chan, Freeman & Labato, 2002).
A administração de todas as necessidades nutricionais, incluindo calorias, aminoácidos,
lípidos, vitaminas e minerais é denominada Nutrição Parenteral Total (NPT). A
administração de apenas parte das necessidades nutricionais é denominada Nutrição
Parenteral Parcial (NPP), como se fez no CC 7. Esta pode ou não incluir lípidos e
microelementos. Normalmente na NPP são administrados os electrólitos e vitaminas
necessários e apenas parte das necessidades energéticas e de aminoácidos do paciente
(Remillard et al., 2000). As principais indicações para o uso desta terapia são a obstrução
GI, hipomotilidade GI, diarreias profusas, vómitos severos, período pós-operatório de
determinados procedimentos cirúrgicos do TGI (CC 6 e 7). Esta via pode ser empregue,
também, como forma de suplementação da via enteral (Seim & Bartges, 2003).
Há cinco soluções básicas utilizadas na nutrição parenteral: dextrose, aminoácidos, lípidos,
electrólitos e compostos vitamínico-minerais. Na NPP estas soluções podem ser diluídas na
necessidade hídrica do paciente, sendo assim melhor toleradas em vasos periféricos. As
soluções de aminoácidos e dextrose poderão ou não apresentar electrólitos. Compostos
multivitamínicos e oligoelementos também são incorporados. As vitaminas, especialmente
as hidrossolúveis, são rapidamente perdidas durante a anorexia e o estado catabólico, pois
o organismo animal não armazena estes nutrientes, devendo sempre ser suplementadas. O
protocolo para NPP está indicado no anexo 8 e pode ser calculado numa tabela de Excel. A
preparação da solução deve seguir a seguinte ordem: 1º no frasco de solução de fluido
seleccionado, desprezar o volume que não será infundido, baseado no cálculo efectuado; 2º
adicionar aminoácidos, Ornitagin® e electrólitos; 3º dextrose; 4º emulsão lipídica e 5º
vitaminas (Carciofi & Brunetto, 2005).
As principais complicações da TNP são, em ordem de ocorrência, distúrbios mecânicos
durante a infusão, transtornos metabólicos, septicémia e flebite. A hiperglicémia é o
transtorno metabólico mais comum, seguido pela hiperlipidémia e hiperbilirrubinémia. A
hipocalémia é o principal transtorno electrolítico. Para evitar estes transtornos deve-se
utilizar a velocidade de infusão de 4-6 mL de soluto/Kg de peso corporal/hora, sendo
recomendável o emprego de uma bomba de infusão. Isto é importante pois os transtornos
metabólicos são muito mais susceptíveis de ocorrerem em função de uma velocidade muito
rápida de infusão do que em função da qualidade do fluido administrado (Chan et al., 2002).
A fluidoterapia microenteral, administrada no caso 7, consiste em fornecer pequenas
quantidades de água, electrólitos e nutrientes facilmente absorvidos (glicose, aminoácidos e
pequenos péptidos) por via digestiva, em bolus ou infusão constante. Ela objectiva estimular
115
o uso do TGI sem causar os efeitos colaterais da nutrição enteral e tentar compensar os
possíveis efeitos deletérios do não uso do TGI, geralmente associado à nutrição parenteral
prolongada. Assim, o objectivo da fluidoterapia microenteral não é manter os níveis
proteicos ou calóricos do paciente, mas activar o fluxo sanguíneo intestinal, proteger a
mucosa do processo degenerativo e da disfunção mecânica, prevenir o mau funcionamento
do sistema enzimático digestivo e preservar a integridade imunitária do intestino. Todas
estas são dificuldades apresentadas quando se usa a NP sozinha.
Por isso, a fluidoterapia microenteral pode ser utilizada juntamente com a NP (como ocorreu
no CC 7) para tentar diminuir os efeitos colaterais da NPT e NPP e manter o paciente em
condições de responder à afecção que o agride (Brunetto, 2008b). É também indicada para
aqueles pacientes que não podem receber a NE completa. A terapia microenteral pode ser
iniciada a partir de 2 a 12 horas após o internamento. A solução deve ser administrada por
meio de seringa directamente na cavidade oral ou por tubos (por ex: nasoesofágico,
esofágico), e pode ser composta por glicose (5% a 25 %), solução de aminácidos, solução
de Lactato de Ringer e adicionada de soluções comerciais de polímeros e péptidos. A
solução deve ser administrada em pequenos volumes e intervalos frequentes, ou infusão
constante (preferencialmente). Inicia-se com 0,05 ml/Kg por hora e se o paciente a tolerar
bem, o volume pode ser aumentado em intervalos de 0,05 ml/kg por hora por 24 a 48 horas.
Se não ocorrer nenhum sinal de intolerância, pode-se transferir para a NE total (Rocha &
Rabelo, 2005), como se fez no CC 7.
A reabilitação nutricional pós-jejum é uma etapa essencial. Indivíduos desnutridos,
particularmente que perderam mais de 10% do peso corporal nos últimos meses ou não se
alimentaram nos últimos 7 a 10 dias (como no CC 6), estão sujeitos à síndrome da
realimentação. É comum o proprietário encaminhar o animal ao clínico quanto este já está
há vários dias sem se alimentar e com importante perda de peso, portanto sob risco de
desenvolvimento da síndrome. A reabilitação nutricional destes pacientes deve sempre ser
feita gradualmente. Durante o jejum, a homeostasia energética do animal é mantida em
mais de 70% pela utilização de triglicéridos, seguido pelas proteínas, corpos cetónicos e, por
último, pelo glicogénio hepático, que representa menos de 1% do processo. Estão em
vigência catabolismo e mecanismos de conservação dos nutrientes. Ao ser realimentado,
este passará para uma fase anabólica, com reconstituição das reservas corporais. É
importante que a dieta a ser oferecida nesta situação tenha alta proteína e gordura e seja
reduzida em carbohidratos. É essencial que seja reintroduzida gradualmente. O animal deve
receber no 1º dia apenas 25% de sua NEM, divididos em 4 a 6 refeições. No 2º dia este
deve receber 50%, no 3º dia 75% e só no 4º dia recebe a totalidade de suas necessidades
calóricas. Se estes animais receberem muito alimento, principalmente se forem alimentados
com uma grande quantidade de carbohidrato, poderão desenvolver alterações metabólicas
incompatíveis com a vida. A síndrome da realimentação pode apresentar um difícil
116
diagnóstico e, se não for tratada adequadamente, poderá ser fatal para o animal (Carciofi,
2008b).
A convalescença é uma fase bastante importante dentro do maneio nutricional do paciente,
mas talvez seja a mais negligenciada. De 40 a 60% do ganho de peso na convalescença
corresponde à recuperação da massa magra (músculos e órgãos). Para que esta seja
efectiva é importante que a dieta do animal tenha elevados teores de proteína e gordura,
alta digestibilidade e adequada suplementação vitamínico-mineral. Uma opção de alimento
industrializado para para este período são boas formulações Super Premium para animais
em crescimento (vide CC 1, 2, 6 e 7). É importante discutir com o proprietário que uma
adequada nutrição na convalescença pode assegurar um mais rápido retorno da saúde e
prevenir o aparecimento de novas doenças, justificando o emprego de alimentos de melhor
qualidade (Carciofi, 2007b).
Finalizado o tratamento deve determinar-se com o proprietário a dieta de manutenção do
paciente. O alimento a ser oferecido dependerá de opções do proprietário e da existência
por parte do animal de necessidades nutricionais especiais como condições responsíveis à
fibra, sódio, proteína, etc. Seja qual for o alimento, é importante estabelecer-se um período
de transição entre as dietas, que pode ser de 2 a 4 dias em casos simples, 4 a 8 em casos
complicados e 10 a 14 para problemas gastroentéricos. Neste período ainda é importante
monitorar-se o volume consumido e o peso do animal (Carciofi, 2007b).
117
68,75%
31,25%
Sim Não
37,50%
62,50%
Sim Não
2. INQUÉRITO REALIZADO EM PORTUGAL A MÉDICOS VETERINÁRIOS SOBRE NUTRIÇÃO CLÍNICA 2.1 Materiais e métodos
O autor desta dissertação realizou um inquérito a 16 Médicos Veterinários em Portugal
Continental, incluindo professores universitários, profissionais de clínica de animais de
companhia, de hospitais escolares, e recém-formados. Da população em estudo, 12 (75%)
dos indivíduos eram do sexo feminino e quatro (25%) do sexo masculino. O inquérito
decorreu entre Junho e Setembro de 2009, e os clínicos responderam ao questionário
pessoalmente, via e-mail ou por contacto telefónico. O questionário foi constituído por 22
perguntas (ver Anexo 1).
2.2 Resultados
Apesar da amostra ser pouco significativa (mas heterogénea) não deixa de ser interessante
realçar alguns pontos que se constatam do inquérito realizado. Nos hospitais e clínicas em
que exercem, cinco (31,25%) veterinários revelam que a nutrição não integra a rotina
médica diária como parte do tratamento veterinário (Gráfico 6) e 10 (62,5%) dizem que não
há um critério rigoroso para o controlo do consumo de alimentos dos animais internados
(Gráfico 7). Quando o animal não come, quatro (25%) clínicos preferem sempre esperar
(Gráfico 8) e em animais hospitalizados, cinco (31,25%) acham que se houver uma terapia
adequada, o apetite pode regularizar-se até ao 5º dia (Gráfico 9).
Gráfico 6 – Distribuição de resultados do inquérito
relativos ao facto de a nutrição integrar ou não a
rotina médica diária, como parte do tratamento
médico no local em que os veterinários exercem
Gráfico 7 - Distribuição de resultados do inquérito
relativos à questão de os Hospitais ou Clínicas
Veterinárias em que os veterinários exercem, terem
ou não um critério rigoroso para o controlo do
consumo de alimentos dos animais internados
118
50,00%
18,75%
31,25%
Fluidoterapia com glicoseEspera sempreVia sondas
81,25%
18,75%
Alimentar o animalEsperar que o animal melhore
62,50%
37,50%
Intervenção nutricional é necessária
Apetite regulariza-se até ao 5ºdia,se a terapia for adequada
Na assistência nutricional ao paciente hospitalizado, três (18,75%) veterinários preferem
esperar que o animal melhore para que o apetite retorne e volte a alimentar-se, enquanto 15
(81,25%) alimentam o animal para que este se sinta melhor e recupere mais rapidamente
(Gráfico 10). Onze (68,75%) dizem que a maioria dos animais internados estão em balanço
calórico negativo (Gráfico 11) e há três (18,75%) que acham que a principal causa para isso
é a prescrição dietética incorrecta por parte do veterinário.
31,25%
68,75%
Balanço calórico positivoBalanço calórico negativo
Gráfico 8 - Distribuição das respostas dos
veterinários quando questionados sobre o
procedimento nutricional adoptado quando o
animal não come
Gráfico 9 - Distribuição de resultados do inquérito
relativos à opinião dos veterinários sobre o que fazer
quanto à nutrição de animais hospitalizados
Gráfico 10 - Distribuição das respostas dos
veterinários quando questionados sobre a sua
atitude na assistência nutricional ao paciente
hospitalizado
Gráfico 11 - Distribuição de resultados do inquérito
relativos à opinião dos veterinários sobre o estado
nutricional calórico em que se encontram a maioria
dos animais internados no local onde exercem
Gráfico 9 - Distribuição de resultados do inquérito
relativos à opinião dos veterinários sobre o que fazer
quanto à nutrição de animais hospitalizados
119
25,00%
50,00%
25,00%
Sim Não Alguns
6
12
5
8
0 2 4 6 8 10 12 14
Nutrição parenteral
Sonda gástrica
Sonda esofágica
Sonda nasoesofágica
6
12
5
8
0 2 4 6 8 10 12 14
Nutrição parenteral
Sonda gástrica
Sonda esofágica
Sonda nasoesofágica
Oito (50%) clínicos desconhecem os diferentes métodos de suporte nutricional utilizados nas
doenças gastrointestinais (Gráfico 12), mas só cinco (31,25%) assumem que não sabem
quando, qual e como usar cada um deles. Quatro (25%) só conhecem alguns, só dois
(12,5%) referiram todos os tipos de nutrição enteral e só um (6,25%) falou da microenteral.
Quanto à terapia enteral, cinco (31,25%) nunca indicaram/colocaram sonda esofágica, nem
oito (50%) a sonda nasoesofágica e 12 (75%) não o fizeram com a sonda gástrica. Seis
(37,5%) nunca indicaram ou fizeram nutrição parenteral e só um diferenciou a parenteral
parcial e total (Gráfico 13).
Quinze (93,75%) veterinários não conhecem nenhum hospital/clínica veterinária que tenha
uma área especializada de Nutrição e o que conhece é em França. Catorze (87,5%) já
sentiram necessidade de saber mais na área da Nutrição, seis (37,5%) consideram
insuficientes os seus próprios conhecimentos nesta área, mas só três (18,75%) pediram a
colaboração de um nutricionista veterinário. No entanto, sete (43,75%) avaliam o estado
nutricional do animal de forma incompleta. Dois (12,5%) dizem que não tratam animais com
obesidade, dois (12,5%) não prescrevem dietas terapêuticas e um (6,25%) não prescreve a
caseira. Dos que prescrevem dietas caseiras, cinco (31,25%) clínicos sugerem alguns
alimentos sem se preocuparem com quantidade extra nem se são balanceadas.
Quando questionados sobre o cálculo das necessidades energéticas de manutenção em
cães e gatos adultos: dois (12,5%) clínicos não calculam, quatro (25%) fazem-no de forma
empírica ou com “cálculo aproximado” e quatro (25%) com tabelas nutricionais das
embalagens das rações. Dois (12,5%) assumem não saber como calcular a quantidade de
Número total
Gráfico 12 - Distribuição (frequência
relativa) das respostas dos veterinários
quando questionados se conheciam os
diferentes métodos de suporte nutricional
enteral utilizados nas doenças
gastrointestinais
Gráfico 13 - Distribuição (frequência absoluta) dos
resultados do inquérito relativos ao número de
veterinários que nunca utilizaram estes tipos de
vias de administração empregues na alimentação
de cães e gatos
120
alimento a ser administrada por dia, dois (12,5%) dizem que não calculam, um (6,25%) faz
“a olho” e três (18,75%) com tabelas e indicações dos fornecedores de alimentos para
animais. 2.3 Discussão dos resultados do inquérito
Hoje em dia, em Portugal e no Brasil, raramente se encontra algum Hospital ou Clínica
Veterinária que possua um rigoroso critério para o controlo do consumo de alimentos dos
animais internados. Alguns clínicos ainda acreditam que a intervenção nutricional não é tão
necessária e que se houver uma terapia adequada, o apetite pode regularizar-se até ao 5º
dia. A maioria dos animais doentes requer uma atenção crítica para a quantidade e
qualidade do que comem. O suporte nutricional pode ser tão vital como qualquer outra
terapia, como fluidos ou antibióticos (Carciofi 2007a).
O autor deste trabalho realizou o seu estágio sob a orientação do Prof. Aulus Carciofi, que é
um profissional de referência a nível nacional e internacional na área de Nutrição de cães e
gatos. Esta experiência pessoal enriquecedora levou a conhecer na prática uma realidade
bem diferente da presenciada em Portugal. Do contacto com veterinários de ambos os
países o autor apercebeu-se que a área de Nutrição Clínica é uma área subvalorizada. A
grande maioria dos veterinários que responderam ao inquérito, nunca utilizaram alguns dos
tipos de nutrição enteral, demonstrando desconhecimento dos mesmos e desperdiçando
uma intervenção que pode ser tão útil. No entanto, o facto de 10 (62,5%) dos clínicos já
terem realizado a nutrição parenteral é um indicador positivo, uma percentagem que será
superior à média em Portugal e também no Brasil, de acordo com indicações de colegas
brasileiros.
O autor recolheu algumas opiniões de profissionais portugueses com experiência, sobre a
possibilidade de vir a trabalhar na área de Nutrição Clínica em Portugal. As opiniões foram
díspares: as pessimistas disseram que “é uma área com pouco futuro, sobretudo porque os
donos dão pouca importância à alimentação do animal, não investindo muito nela”; as
optimistas disseram que “a Nutrição é uma área de grande interesse e terão que ser os
veterinários a sensibilizar os proprietários sobre a medicina preventiva, uma alimentação
saudável e os benefícios terapêuticos duma intervenção nutricional adequada”. Uma postura
realista conduz a este tipo de abordagem.
R. Romão, que colaborou no inquérito, comenta que “muitas das questões de falta de
intervenção dos médicos veterinários nesta área devem-se à recusa quase constante dos
proprietários em assumir que esta é uma questão importante para os seus animais. Dos
animais que atendo e que têm muito frequentemente situações de obesidade ou dieta
incorrecta, os donos são incapazes de seguir as instruções que damos. São geralmente
casos perdidos…” (comunicação pessoal, Agosto 28, 2009). Depois de fazer o questionário,
J. Gonçalves recorda “fiquei a pensar que na minha altura na faculdade não aprendemos
121
nada acerca de nutrição de cães e gatos nem como se calculam as doses diárias para eles
(comunicação pessoal, Setembro 7, 2009). Estes testemunhos, entre outros, podem ajudar-
nos a reflectir objectivando a melhoria das nossas capacidades.
Nas últimas duas décadas houve um grande crescimento das informações científicas a
respeito da nutrição do animal enfermo. A síndrome de imunodeficiência adquirida
nutricional é hoje bem conhecida e estabelecida. Este conhecimento, no entanto, ainda não
faz parte da rotina médica de clínicas e hospitais veterinários, que usualmente não têm a
nutrição como parte do tratamento médico veterinário (Remillard et al., 2000). A má nutrição
dos animais internados é mais comum do que habitualmente se reconhece, como comprova
um estudo de Remillard et al. (2001). A má nutrição é um factor prognóstico negativo em
pacientes criticamente doentes, sendo portanto de essencial relevância a sua identificação e
correcção precoces. A literatura apresenta inúmeros factores pelos quais a baixa ingestão
calórico-proteica correlaciona-se com uma maior mortalidade.
Carnevale et al. (1991) verificaram uma incidência de desnutrição ou subnutrição de 25% a
65%, baseando-se no histórico, efeitos fisiológicos da doença primária e parâmetros
bioquímicos dos pacientes caninos e felinos estudados. Na nossa rotina clínica é comum
recebermos os pacientes com histórico de hiporexia, ou mesmo anorexia, há vários dias.
Esta condição não pode ser desconsiderada pelo clínico, pois nesse momento o paciente já
entra no consultório desnutrido, necessitando de intervenção nutricional imediata.
Um dos objectivos primários do suporte nutricional é prevenir o catabolismo de proteínas
teciduais, pois pacientes hospitalizados frequentemente apresentam-se em balanço de
nitrogénio negativo. A prevenção do catabolismo pode ser conseguida pelo fornecimento de
calorias suficientes e proteína dietética em proporções óptimas (Carciofi 2007b).
Num estudo conduzido pelo Serviço de Nutrição Clínica de Cães e Gatos do Hospital
Veterinário da FCAV (Carciofi et al., 2003), os resultados obtidos demonstraram que:
animais que receberam um adequado suporte nutricional durante a hospitalização
apresentaram maior taxa de alta; a quantidade de energia metabolizável ingerida pelo
animal mostrou-se directamente relacionada com sua alta e tempo de internamento e
relação inversa com o óbito; a condição corporal do animal demonstrou associação com as
taxas de alta e óbito: animais sem reservas corporais, em estado de magreza ou caquéxia,
apresentaram maior taxa de óbito; o suporte nutricional intensivo mostra-se como uma
opção para colocar o animal em balanço energético positivo.
IV. CONCLUSÕES GERAIS
Já está comprovado que a ingestão de alimentos é fundamental para a manutenção da
imunocompetência, reparação de tecidos e metabolismo intermediário de fármacos, sendo
fundamental para o sucesso da terapia e recuperação do animal (Remillard et al., 2001). A
122
desnutrição pode ser a causa ou a consequência da doença. Compete ao veterinário
investigar estas relações durante a anamnese e exame físico, compondo o raciocínio clínico
com a integração de todos os factores causais de morbidade. Limitar-se ao emprego de
fármacos é restringir as opções terapêuticas e piorar o prognóstico do paciente. A instituição
de um plano nutricional adequado é fundamental para as duas situações. Este foi o método
seguido pelo autor na abordagem dos casos clínicos deste estudo. É fundamental uma
mudança de paradigma: não se deve esperar que o animal melhore para que o apetite
retorne e ele volte a alimentar-se, mas sim alimentá-lo para que se sinta melhor e recupere
mais rápido.
Como se depreende do inquérito analisado pelo autor, os clínicos em Portugal não estão a
potencializar a intervenção nutricional que pode em muitos casos ser fundamental. Há vários
métodos à sua disposição que podem ser vantajosos para a terapêutica e o prognóstico dos
pacientes. Várias das respostas a este questionário revelam desconhecimentos básicos
práticos e teóricos, chamando a atenção para a importância de profissionais especializados
nesta área e a necessidade de cursos de formação de nutrição clínica para os veterinários.
Há uma relação dinâmica entre nutrição, imunidade e doença e esta área interdisciplinar de
investigação necessita de uma maior cooperação entre veterinários, parasitologistas,
nutricionistas, imunologistas, biólogos moleculares e profissionais de saúde pública.
Relativamente ao tema escolhido para a presente dissertação, algumas limitações
impediram a realização de um estudo clínico mais completo: a) não ter sido possível
comprovar na prática o tema proposto, avaliando por exemplo, efeitos nutricionais positivos
em parâmetros imunológicos de cães (com resultados objectivos) o que também por falta de
tempo e meios sairia fora do âmbito deste tipo de mestrado; b) o período de estágio apenas
possibilitou a recolha de um pequeno número de casos de foro entérico; c) o baixo número
de retornos, com os proprietários a não voltarem à consulta, impediu o seguimento completo
de alguns casos; d) as restrições financeiras dos proprietários levaram à ausência de
realização de exames complementares, como análises bioquímicas, biópsias e necrópsias;
e) o facto do serviço de radiologia do hospital escolar não estar a funcionar de acordo com
as necessidades. Todavia, os casos clínicos estudados permitiram a discussão de vários
aspectos do maneio dietético das afecções gastrointestinais mais frequentes.
O estágio em Nutrição e Nutrição Clínica de Cães e Gatos foi de imenso valor técnico-
prático, possibilitando aprender e consolidar os conhecimentos adquiridos, tanto em nutrição
básica quanto em nutrição clínica. A prática clínica obtida durante o estágio consolida a real
importância da nutrição clínica, claramente notada pelos benefícios a curto e longo prazos,
tanto aos pacientes hígidos quanto aos portadores de doenças. Na busca de longevidade e
saúde de cães e gatos, deve estabelecer-se: como alimentar, com o quê e quanto fornecer a
cada animal. O atendimento realizado pelo Serviço de Nutrição Clínica só se torna possível
através da colaboração dos Aprimorandos e pós-graduandos das demais áreas, discutindo
123
em conjunto o melhor maneio nutricional, medicamentoso e cirúrgico que deve ser utilizado
para cada paciente. O Serviço de Nutrição Clínica tem crescido a cada ano, antes com
enfoque nos internamentos e agora priorizando o atendimento de cães e gatos. Compete
aos aprimorandos e estagiários da Nutrição, sob orientação do Professor Aulus Carciofi, o
estudo constante na área, para a realização de novos protocolos nutricionais e melhoria das
dietas já empregues no Hospital Veterinário da FCAV.
Com esta experiência, obteve-se um melhor conhecimento na área de nutrição clínica e
clínica médica com o objectivo de preparar o autor desta dissertação para o mercado de
trabalho em Hospitais e Clínicas Veterinárias, assim como uma maior preparação na área
da pesquisa, através do acompanhamento e desenvolvimento de trabalhos nos Laboratórios
de Nutrição de Cães e Gatos e de Imunoparasitologia.
124
V. BIBLIOGRAFIA Abbas, A., Lichtmann, A. & Pober, I. (2005). Imunologia celular e molecular. (tradução da 5ª
edição). Rio de Janeiro: Editora Revinter Abood, S. K. & Buffington, C. A. (1992). Enteral feeding of dogs and cats: 51 cases Journal
of the American Veterinary Medical Association, 201 (4), 619-622. Abrams, S., Hawthorne, K., Aliu O., Hicks, P., Chen, Z. & Griffin, I. (2007). An inulin-type
fructan enhances calcium absorption primarily via an effect on colonic absorption in humans Journal of Nutrition, 137, 2208 - 2212.
Ames, B.N. (2001). Research Update from the Purina Pet Institute for the Veterinarian
Nutritional Immunology, 13 (1), 475, 7-20. Anderson, W., Gore, A. & Roos, M. (2008). Efeitos benéficos do levedo natural e da fibra de
trigo integral na saúde imunológica dos cães. In Efeitos benéficos do levedo natural e da fibra de trigo integral na saúde imunológica e digestiva dos cães. Proplan Purina®, 4-11.
Armstrong, P. J. (1988). Selected Aspects of Enteral and Parenteral Support. Seminars in
Veterinary Medicine and Surgery, 3, 216-219. Artym, J. (2003) Immunology Letters. Research Update from the Purina Pet Institute for the
Veterinarian Nutritional Immunology, 13 (1), 89, 9-15. Babcock, T.A., Dekoj, T. & Espat, N.J. (2005). Experimental studies defining ω3 fatty acid
anti-inflammatory mechanisms and abrogation of tumor-related syndromes. Nutrition in Clinical Practice, 20(1), 62–74.
Bauer, J.E., (2009). Fatty Acid Metabolism in Dogs and Cats. I International Congress of Pet
Nutrition. VII Annual Symposium of Pet Nutrition, Campinas, 7-8 Maio, pp. 7-12 Campinas:Brazilian College of Animal Nutrition.
Bazolli, R.S. (2008). Aditivos que auxiliam a função digestiva nas rações comerciais para
cães e gatos. In IV Curso teórico-prático sobre Nutrição de Cães e Gatos. Faculdade de Ciências Agrárias e Veterinárias da Universidade Estadual Paulista.
Benno, Y., Nakao, H., Uchida, K., Mitsuoka, T. (1992). Impact of the advances in age on the
gastrointestinal microflora of Beagle dogs. Journal of Veterinary Medical Science, 54 (4), 703-706.
Benyacoub, J., Journal of Nutrition. (2003). Research Update from the Purina Pet Institute for
the Veterinarian Nutritional Immunology, 13 (1), 133, 1158-1162. Benyacoub, J. (2004). Probiotics in health and disease: Potential for pets. Supplement to
Compendium on Continuing Education for the Practicing Veterinarians, 26(2), 29-33. Benyacoub, J. (2007). Probiotics as tools to improve health: Perspective for pets. A
Supplement to Compendium: Continuing Education for Veterinarians, 29 (2), 11-19. Benyacoub, J., Maulden G. L. C., Cavadini C., Sauthier T., Anderson R. E., Schiffrin E. J.,
Weid T. v. d. (2003). Supplementation of food with Enterococcus faecium (SF68) stimulates immune functions in young dogs. Journal of Nutrition, 133 (4), 1158-1162.
Blachier, F., Mariotti, F., Huneau ,J.F. & Tomé, D. (2007). Effects of amino acid-derived
luminal metabolites on the colonic epithelium and physiopathological consequences. Amino Acids, 33 (4), 547-62.
125
Brunetto, M.A., (2008a). Suporte nutricional enteral em cães e gatos hospitalizados. Apontamentos teóricos das disciplinas de Clínica das Doenças Carenciais, Endócrinas e Metabólicas.
Brunetto M. A., (2008b). Suporte nutricional enteral, microenteral e parenteral nas afecções
gastrintestinais: quando, qual e como usar. In II Simpósio de Nutrição Clínica de Cães e Gatos - Foco em Doenças Gastrintestinais. Faculdade de Ciências Agrárias e Veterinárias da Universidade Estadual Paulista.
Brunetto M. A., (2009). Nutrição Clínica – Emergência e cuidados intensivos. Revista Clínica
Veterinária, XIV (78), 41-46. Brunetto, M.A., Gomes, M.O.S., Jeremias, J.T., Oliveira, L.D. & Carciofi, A.C. (2007).
Imunonutrição: o papel da dieta no restabelecimento das defesas naturais. Acta Scientiae Veterinariae, 35, s230-s232.
Buddington, R.K. (1996). Structure and functions of the dog and cat intestine. In Recent
Advances in Canine and Feline Nutrition, Proceedings Iams Nutrition Symposium, pp. 61-74. Wilmington: Frazer Press.
Buddington, R.K. & Sunvold, G.D. (2000). The use of fermentable fibers to manage the
gastrointestinal tract. In G.A. Reinhart & D.P. Carey, Recent Advances in Canine and Feline Nutrition, vol.III. Proceedings Iams Nutrition Symposium Proceedings, pp.169-181. Wilmington: Frazer Press
Buddington, RK. (2003) Postnatal changes in bacterial populations in the gastrointestinal
tract of dogs. American Journal of Veterinary Research, 64, 646-651. Calabrò S., Cutrignelli, M.I., Bovera, F., Carciofi, A.C.;,Tudisco, R., Guglielmelli, A., Piccolo,
G. , (2008). In vitro evaluation of different fiber sources and potential prebiotics for dogs. In 12th congress of the european society of veterinary and comparative nutrition. (pp. 63). Vienna: University of Veterinary Medicine.
Carciofi, A.C. (2005). Emprego de fibras em alimentos para cães e gatos. In V Simpósio
sobre Nutrição de animais de estimação, pp. 95-108. Campinas: Colégio Brasileiro de Nutrição Animal.
Carciofi, A.C. (2007a). A inter-relação nutrição e doença: quando a desnutrição é causa e
quando é conseqüência? Apontamentos teóricos das disciplinas de Clínica das Doenças Carenciais, Endócrinas e Metabólicas e de Nutrição e Alimentação de Cães e Gatos.
Carciofi, A.C. (2007b). Continuar comendo, a importância da manutenção de um balanço
calórico positivo. Apontamentos teóricos das disciplinas de Clínica das Doenças Carenciais, Endócrinas e Metabólicas e de Nutrição e Alimentação de Cães e Gatos.
Carciofi, A.C. (2008a). Apontamentos teóricos das disciplinas de Clínica das Doenças
Carenciais, Endócrinas e Metabólicas e de Nutrição e Alimentação de Cães e Gatos. Carciofi, A.C. (2008b) Dietas Caseiras (actualizadas) para Cães e Gatos. Fórmulas Práticas
e Princípios de Utilização. Serviço de Nutrição Clínica. Departamento de Clínica e Cirurgia Veterinária Faculdade de Ciências Agrárias e Veterinárias da Universidade Estadual Paulista.
Carciofi, A.C. (2008c). Doença gastroentérica, preciso de uma dieta leve: o que é isso?. In II
Simpósio de Nutrição Clínica de Cães e Gatos - Foco em Doenças Gastrintestinais. Faculdade de Ciências Agrárias e Veterinárias da Universidade Estadual Paulista.
126
Carciofi, A.C. (2008d). Effects of six carbohydrate sources on dog diet digestibility and post-prandial glucose and insulin response. Journal of Animal Physiology and Animal Nutrition, 92, 326-336.
Carciofi, A.C. (2008e). Manejo nutricional do cão e do gato hospitalizado. Apontamentos
teóricos das disciplinas de Clínica das Doenças Carenciais, Endócrinas e Metabólicas e de Nutrição e Alimentação de Cães e Gatos.
Carciofi, A. C. & Brunetto, M. A. (2005). Nutrição parenteral. In Anais do I Simpósio de
Nutrição Clínica de Cães e Gatos, São Paulo, 56-61. Carciofi, A.C. & Brunetto, M.A. (2008). Nutritional management of the most common digestive
diseases in dogs and cats. Clinical Nutrition Service, Teaching Veterinary Hospital, São Paulo State University, Jaboticabal, Brazil.
Carciofi, A. C., Fraga, V. O. & Brunetto, M. A. (2003). Ingestão calórica e alta hospitalar em
cães e gatos. Revista de Educação Continuada do CRMV-SP, São Paulo, 6 (1/3), 16-27.
Carnevale, J. M., Kallfelz, F. A., Chapman, G. & Meguid, M. M. (1991) Nutritional
Assessment: Guidelines to selecting patients for nutritional support. The Compendium of Continuing Education for the Practicing Veterinarian, Princeton, 13 (2) p. 255-261.
Case, L. P., Carey, E. P., Hirakawa, D. (2000). Canine and feline nutrition: a resource for
companion animal professionals. (2nd ed.). St. Louis: Linda P.C. Casserly, I., Topol, E. & Lancet, T. (2004). Research Update from the Purina Pet Institute for
the Veterinarian Nutritional Immunology, 13 (1) 363, 1139-1146. Cave, N.J. (2003). Chronic inflammatory disorders of the gastrointestinal tract of companion
animals. New Zealand Veterinary Journal, 51(6), 262-274. Cave, N. J. (2008). Nutrition e Immunity. In P. Pibot, V. Biourge & D. Elliot (Eds.),
Encyclopedia of Feline Clinical Nutrition (2nd ed.). (pp.480-506). St Charles, MO USA: Royal Canin®.
Chan, D. L., Freeman, L. M. & Labato, M. A. (2002). Retrospective evaluation of partial
parenteral nutrition in dogs and cats. Journal Veterinary Internal Medicine, 16, 440-445.
Chew, B.P. & Park, J.S. (2004). Carotenoid action on the immune response. Journal of
Nutrition, 134(1), 257S-261S. Chew, B.P., Wong, T.S., Park, J.S. & Weng B.B. (1997). The role of Dietary Lutein in the
Dog and Cat. Recent Advances in Canine and Feline Nutrition. Iams Nutrition Symposium Proceedings. pp. 547-543.
Costa, M.T. (2007). Afecções Gastrintestinais: quando o tratamento é medicamentoso e
quando é nutricional? Departamento de Clínica e Cirurgia Veterinária Faculdade de Ciências Agrárias e Veterinárias da Universidade Estadual Paulista.
Cowing, B.E. & Saker, K.E. (2001). Polyunsaturated fatty acids and epidermal growth factor
receptor/ mitogen-activated protein kinase signaling in mammary cancer. Journal of Nutrition, 131, 1125-1128.
Croese, J. & Speare, R. (2006). Intestinal allergy expels hookworms: seeing is believing.
Trends in Parasitology, 22 (12), 547-550.
127
Cunningham, J.G. (2004). Digestão e absorção: os processos não fermentativos. In Tratado de Fisiologia Veterinária (tradução 3ª edição). (pp.263-287). São Paulo: Editora Guanabara Koogan.
Deplancke, B, & Gaskins, H.R. (2001). Microbial modulation of inate defense: Goblet cells
and the intestinal mucus layer. American Clinical Nutrition, 73 (Supl.), 1131-1141. Deshmukh, A. (2008). O Sistema imunológico e seu papel como um sistema protector para
cães In Sistemas de Protecção Natural em Caninos Proplan Purina®, 1-15. Deshpande, S.P. (2004). Use of herbal preparations in dog foods as a therapy in parasitic
infestation [abstract]. In India Supplement to Compendium on Continuing Education for Practicing Veterinarian, 26, 2 (A), Nestlé Purina Fórum, p.81.
Devitt, C. M. & Seim, H. B. (2000). Esophageal feeding tubes. In J. D. Kirks Current
Veterinary Therapy - Small Animal Practice. (13th ed). (pp. 597-599). Philadelphia: W. B. Saunders Company.
Duggan C., Gannon J. & Walker W.A. (2002). Protective nutrients and functional foods for
the gastrointestinal tract. American Journal of Clinical Nutrition, 75, 789-808. Dzanis, D. (2003). Novel ingredients: Safety and utility. In J.L. Kvamme & T.D. Phillips, Pet
food Technology. (pp. 57-61). Mt. Morris: Illinois. Elliott, D.E., Summers, R.W. & Weinstock, J.V. (2007). Helminths as governors of immune-
mediated inflammation. International Journal for Parasitology , 37(5), 457-464. Else KJ. (2005). Have gastrointestinal nematodes outwitted the immune system? Parasite
Immunology, 27(10-11), 407-415. Erb, K.J. (2007). Helminths, allergic disorders and IgE-mediated immune responses: where
do we stand? European Journal of Immunology, 37(5), 1170-1173. Escobedo, G., Griego, L.L. & Montor, J. M. (2009). Neuroimmunoendocrine modulation in the
host by helminth parasites: a novel form of host-parasite coevolution? Neuroimmunomodulation, 16(2), 78-87.
Evans, M.E., Jones, D.P. & Ziegler T.R. (2003), Glutamine prevents cytokine induced
apoptosis in humans colonic epithelial cells. Journal of Nutrition, 133, 3065-3071. Flemming, J. S. (2005). Utilização de leveduras, probióticos e mannanoligossacarídeos
(MOS) na alimentação de frango de corte. Tese de Doutorado em Tecnologia de Alimentos. Universidade Federal do Paraná, Curitiba. Acedido em Março 24, 2008, disponível em <http://hdl.handle.net/1884/2344>
Flohr, C., Quinnell, R.J., Britton, J. (2009). Do helminth parasites protect against atopy and
allergic disease? Clinical & Experimental Allergy, 39(1), 20-32. Fujiwara, R.T., Loukas, A., Mendez, S., Williamson, A.L., Bueno, L.L., Wang, Y., Samuel, A.,
Zhan, B., Bottazzi, M.E., Hotez, P.J. & Bethony, J.M. (2006). Vaccination with irradiated Ancylostoma caninum third stage larvae induces a Th2 protective response in dogs. Vaccine, 24 (4), 501-509.
Gagnon, C.M.A., Koski, K.G., Conly, S., Scott, M.E. & Stevenson, M.M. (1996). Dietary
vitamin A deficiency alters Th2 cytokine profiles in mice infected with a gastrointestinal (GI) nematode. Federation of American Societies for Experimental Biology, 9, A480.
128
German, A. & Zentek, J. (2006). The most common digestive diseases: the role of nutrition. In P. Pibot, V. Biourge & D. Elliot (Eds.), Encyclopedia of Canine Clinical Nutrition. (pp.92-133). St Charles, MO, USA: Royal Canin®
Gilbert, S. & Halliwell R.E. (2005). The effects of endoparasitism on the immune response to
orally administered antigen in cats. Veterinary Immunology and Immunopathology, 106(1-2), 113-20.
Gismondo, M.R., Drago, L. & Lombardi, A. (1999). Review of probiotics available to modify
gastrointestinal flora. International Journal of Antimicrobial Agents,12 (4), 287–292. Gomes, M.O.S. (2009). Efeito da adição de parede celular de levedura sobre a
digestibilidade, microbiota fecal e parâmetros hematológicos e imunológicos de cães. Dissertação de Mestrado em Jaboticabal, São Paulo: Faculdade de Ciências Agrárias e Veterinárias da Universidade Estadual Paulista.
Grieshop, C.M. (2002). The interaction of nutrition and the immune system: the role of fatty
acids, antioxidants and carbohydrates. In Alltech´s 18th annual Symposium. (pp.481-487). Lexington: Nottingham University Press.
Gros G.L., Schultze N., Walti S., Einsle K. & Finkelman F., (1996). The development of IgEC
memory B cells following primary IgE immune responses. European Journal of Immunology, 26(12), 3042–3047.
Guyton, A.C. (2006). Textbook of Medical Physiology, (11th ed.). Philadelphia: WB Saunders Hall, E. (1996). Gastrointestinal Problems. In N.C., Kelly & J.M. Will (Eds). Manual of
Companion Animal Nutrition and Feeding. Iowa State: University Press. Hopkin, J. (2009). Immune and genetic aspects of asthma, allergy and parasitic worm
infections: evolutionary links. Parasite Immunology, 31 (5), 267-273. Hughes, S. & Kelly, P. (2006). Interactions of malnutrition and immune impairment, with
specific reference to immunity against parasites. Parasite Immunology, 28(11), 577-588.
Humphreys, N.E., Xu, D., Hepworth, M.R., Liew, F.Y. & Grencis, R.K. (2008). IL-33, a potent
inducer of adaptive immunity to intestinal nematodes. Journal of Immunology, 180(4), 2443-2449.
Ierna, M.X., Scales, H.E., Saunders, K.L., Lawrence, C.E. (2008). Mast cell production of IL-
4 and TNF may be required for protective and pathological responses in gastrointestinal helminth infection. Mucosal Immunology, 1(2), 147-155.
Ince, M.N., Elliott, D.E., Setiawan, T., Metwali, A., Blum, A., Chen, H.L., Urban, J.F., Flavell,
R.A. & Weinstock, J.V. (2009). Role of T cell TGF-beta signaling in intestinal cytokine responses and helminthic immune modulation. European Journal of Immunology, 39 (7), 1870-1878.
Ing, R., Su, Z., Scott, M.E. & Koski, K.G. (2000). Suppressed T helper 2 immunity and
prolonged survival of a nematode parasite in protein-malnourished mice. In Proceedings of the National Academy of Sciences USA , 97(13), 7078-7083.
Jones, D.P. (2002). Redox state of GSH/GSSG couple: assay and biological significance.
Methods in Enzymology , 348, 93–112. Kayser, F.H. (2003). Safety aspects of enterococci from the medical point of view,
International Journal of Food Microbiology, 88(2-3), 255–262.
129
Klein, S.L. (2004). Hormonal and immunological mechanisms mediating sex differences in parasite infection. Parasite Immunology, 26(6-7), 247-264.
Knudsen, K., Serena, A., Canibe, N. & Juntunen, K. (2003). New insights into butyrate
metabolism. In Proceedings of the Nutrition Society, 62, pp. 81-86. Koski, K.G., Su, Z. & Scott, M.E. (1999). Energy deficits suppress both systemic and gut
immunity during infection. Biochemical and Biophysical Research Communications, 264, 796-801.
Koski, K.G. & Scott, M.E. (2001). Gastrointestinal nematodes, nutrition and immunity:
breaking the negative spiral. Annual Review of Nutrition, 21, 297-321. Laflamme, D. (2008). O trato gastrointestinal: sua dupla função como sistema digestivo e de
protecção nos cães. In Sistemas de Protecção Natural em Caninos Proplan Purina®, 18-35.
Larqué, E, Molina, M.S. & Zamora, S. (2007). Biological significance of dietary polyamines.
Nutrition, 23(1), 87-95. Little, M.C., Bell, L.V., Cliffe, L.J. & Else, K.J. (2005). The characterization of intraepithelial
lymphocytes, lamina propria leukocytes, and isolated lymphoid follicles in the large intestine of mice infected with the intestinal nematode parasite Trichuris muris. Journal of Immunology, 175 (10), 6713-6722.
Loukas A., Bethony J.M., Williamson A.L., Goud G.N., Mendez S., Zhan B., Hawdon J.M.,
Bottazzi M.E., Brindley P.J. & Hotez P.J. (2004). Vaccination of dogs with a recombinant cysteine protease from the intestine of canine hookworms diminishes the fecundity and growth of worms. Journal of Infectious Diseases, 189(10), 1952-1961.
Lund, E. M. (1999). Health status and population characteristics of dogs and cats examined
at private veterinary practices in the United States. Journal of the American Veterinary Medical Association, 214, 1336-1341.
Macfarlane, G.T. & Cummings, J.H. (1999). Probiotics and prebiotics: can regulating the
activities of intestinal bacteria benefit health? British Medical Journal, 18, 999-1003. Macintire, D. K. (2000). Bacterial translocation: clinical implications and prevention. In J. D.
Kirks Current Veterinary Therapy - Small Animal Practice. (13th ed). (pp. 201-203). Philadelphia: W. B. Saunders Company.
Magalhães, T.M.L.P (2008). Enterite linfoplasmocítica canina. Dissertação de Mestrado.
Lisboa: Faculdade de Medicina Veterinária – Universidade Técnica de Lisboa. Martineau, B. & Laflamme, D.P. (2002). Effect of diet on markers of intestinal health in dogs.
Research in Veterinary Science, 72(3), 223-227. Maulden, G.C. (2006). Health Probiotic Value for Dogs and Cats. In The Role of Probiotics in
GI Tract. Purina Veterinary Diets - Overview of Probiotics , 10-11. Maulden G.C. Gore A. & Roos, M. (2008). Efeitos benéficos da aleurona de trigo na
absorção de nutrientes e na saúde digestiva em cães. In Efeitos benéficos do levedo natural e da fibra de trigo integral na saúde imunológica e digestiva dos cães. Proplan Purina®, 12-21.
McCowen, K.C., Bistrain, B.R (2004). Hyperglycemia and nutrition support: theory and
practice. Nutr Clin Pract , 19(3), 235-244.
130
McKay, D.M. (2009). The therapeutic helminth? Trends in Parasitology, 25(3), 109-114. Milner, J.A. (2004) Journal of Nutrition.; Research Update from the Purina Pet Institute for
the Veterinarian Nutritional Immunology, 13 (1)134:2492S-2498S. Mohamed, D.A-A. & Jonathan, I.R. (2005). Mucosal Immune Response to Parasitic
Infections. In J. Bienenstock, M.E. Lamm, J.Mestecky W. Strober J.R. McGhee & L. Mayer (Eds.) Mucosal Immunology (3rd ed.). (pp. 815-829) Boston: Elsevier Publishers.
Mohr, A. J., Leisewitz, A. L. & Jacobson, L. S. (2003). Effect of early enteral nutrition on
intestinal permeability, intestinal protein loss and outcome in dogs with severe parvoviral enteritis. Journal of Veterinary Internal Medicine, 17, 791- 798.
Muir, W.I., Husband, A.J. & Bryden, W.L. (2002) Dietary supplementation with vitamin E
modulated avian intestinal immunity. British Journal of Nutrition, 87, 579-585. Mulcahy, G., O'Neill, S., Donnelly, S. & Dalton, J.P. (2004). Helminths at mucosal barriers
interaction with the immune system. Advanced Drug Delivery Reviews, 56(6), 853-868.
National Research Council (1985). Nutrient requirements of cats. Washington: National
Academy Press. National Research Council (2006). Nutrient requirements of dogs and cats. Washington, DC,
USA: National Academy Press. Prescott, L.M., Harley, J.P. & Klein, D.A. (2002). Microbiology. (5th ed.). USA: McGraw-Hill. Pritchard, D.I., Hewitt, C., Moqbel, R. (1997). The relationship between immunological
responsiveness controlled by T-helper 2 lymphocytes and infections with parasitichelminths. Parasitology, 115 (Supl.), 33-44.
Rabelo, R.C. (2008). A importância do intestino na recuperação do paciente crítico. In II
Simpósio de Nutrição Clínica de Cães e Gatos - Foco em Doenças Gastrintestinais. Faculdade de Ciências Agrárias e Veterinárias da Universidade Estadual Paulista.
Ramakrishnan, U. (2002). Prevalence of micronutrient malnutrition worldwide. Nutrition
Reviews, 60, 46-52S. Rao, L., Puschner B. & Prolla T.A. (2001) Gene expression profiling of low selenium status in
the intestine: Transcriptional activation of genes linked to ADN damage, Journal of Nutrition, 131(12), 3175-81.
Raz, E., Tighe, H., Sato, Y., Corr, M. & Dudler, J.A. (1996). Preferential induction of a Th1
immune response and inhibition of specific IgE antibody formation by plasmid ADN immunization.In Proceedings of the National Academy of Sciences USA, 93(10), 5141-5145.
Reeds, P.J., Burrin, D.G., Stoll B. & Jahoor F. (2000). Intestinal glutamate metabolism.
Journal of Nutrition, 130, 978-982S. Reeds, P.J. & Burrin, D.G. (2001). Glutamine and the bowel. Journal of Nutrition, 131,
2505s-2508s. Reinhart, A.G., & Davenport, M.G. (1998). Practical Applications of omega-3 fatty Acids and
Fermentable fiber in Gastrintestinal Pacients. In Recent Advances in Canine and Feline Nutrition, Proceedings Iams Nutrition Symposium, pp. 21-75. Wilmington: Frazer Press.
131
Remillard, R.L., Armstrong, P.J. & Davenport, D.J. (2000). Assisted feeding in hospitalization patients: enteral and parenteral nutrition. In M.S. Hand, C.D. Thatcher, R.L. Remillard & P. Roudebush (Eds.). Small Animal Clinical Nutrition. (4th ed.). (pp. 351-400). Topeka: Mark Morris Institute.
Remillard, R. L.; Darden, D. E.; Michel, K. E.; Marks, S. L.; Buffington, C. A.; Bunnell, P. R.
(2001). An investigation of the relationship between caloric intake and outcome in hospitalization dogs. Veterinary Therapeutics, 2 (4), 301-310.
Roberfroid, M. (2007). Prebiotics - The Concept Revisited. Journal of Nutrition, 137, 830S-837S.
Rocha, D. B. & Rabelo, R. C. Fluidoterapia microenteral. In R.C. Rabelo, R. C. & D.T. Crowe, Fundamentos de Terapia Intensiva Veterinária. (pp. 617-622). Rio de Janeiro: LF Livros.
Rohweder, J., Runkel, N. & Fromm, M. (2003). Zinc acts as protective agent on mucosal
barrier in experimental TNBS colitis. Langebecks Archives Chir Supplement Kongressbd , 115(Supl.), 223-227.
Roitt, I., Brostoff, J. & Male, D. (2003). Imunologia. (tradução 6ª edição). Local: Editora
Manole. Roitt, I.M. & Delves, P.J. (2006). Adversarial strategies during infection ‘Roitt’s Essential
Immunology’ (11th edition). (pp. 249-280). Oxford: Blackwells Publishing. Romagnani, S. (2004). The increased prevalence of allergy and the hygiene hypothesis:
missing immune deviation, reduced immune suppression, or both? Immunology, 112(3), 352-63.
Romeo, J., Warnberg, J., Gómez-Martínez, S., Díaz, L.E. & Marcos, A. (2008).
Neuroimmunomodulation by nutrition in stress situations. Neuroimmunomodulation, 15 (3), 165-169.
Saavedra, J.M. (2007). Nutrition in Clinical Practice Research Update from the Purina Pet
Institute for the Veterinarian Nutritional Immunology, 13 (1), 22, 351-365. Saker, K.E. (2006). Nutrition and immune function. Veterinary Clinics of North America:
Small Animal Practice , 36 (6), 1199-1224. Sauer, J, Richter, KK, Pool-Zobel, BL. (2007). Physiological concentrations of butyrate
favourably modulate genes of oxidative and metabolic stress in primary human colon cells. The Journal of Nutritional Biochemistry, 18 (11), 736 - 745.
Sauter, S. N., Allenspach K., Gaschen F., Grone A., Ontsouka E., Blum J. W. (2005).
Cytokine expression in an ex vivo culture system of duodenal samples from dogs with chronic enteropathies: modulation by probiotic bacteria. Domestic Animal Endocrinology, 29(4), 605-622.
Scholz-Ahrens, K.E., Schaafsma, G., Heuvel, E.v.d. & Schrezenmeir, J. (2001). Effects of
prebiotics on mineral metabolism. American Journal of Clinical Nutrition, 73, 459S - 464S.
Schoor S.R.v.d., Reeds P.J.& Stool B. & (2002). The high metabolic cost of functional gut.
Gastroenterology, 123, 1931-1940.
132
Scrimshaw, N.S. & Giovanni, J.P.S. (1997). Synergism of nutrition, infection and immunity: an overview. American Journal of Clinical Nutrition, 66(Supl.), 464-477.
Seim, H. B. & Bartges, J. W. (2003). Enteral and parenteral nutrition. In T.T. Tams,
Handbook of small animal gastroenterology. (pp. 416-462). Missouri: Saunders. Silva, L.P. & Nörnberg, J.L. (2003). Prebióticos na nutrição de não ruminantes. Ciência
Rural, 33 (5), 983-990. Simpson, K. W. & Birnbaum, N. (2006). Fluid and electrolyte disturbances in gastrointestinal
and pancreatic diseases. In S.P. Dibartola, Fluid, Electrolyte, and Acid-Base Disorders In Small Animal Practice. (pp. 420-436). St. Louis: Saunders Elsevier.
Soeters, P.B., Hallemeesch, M.M., Bruins, M.J., van Eijk ,H.M. & Deutz, N.E. (2002).
Quantitative in vivo assessment of arginine utilization and nitric oxide production in endotoxemia. American Journal of Surgery, 183, 480–88.
Solomons, N.W. & Scott, M.E. (1994). Nutritional status of host populations
influencesparasitic infections. In M.E. Scott & G. Smith, Parasitic and Infectious Diseases, Epidemiology and Ecology. (pp. 101–114). San Diego: Academic.
Stechmiller, J.K., Childress, B. & Porter, T. (2004). Arginine immunonutrition in critically ill
patients: a clinical dilemma. American Journal of Critical Care, 13(1):17-23. Steege, J,C., Buurman, W.A., Forget, P.P.(1997). Spermine induces maturation of the
immature intestinal immune system in neonatal mice. Journal of Pediatric Gastroenterology and Nutrition, 25, 332-340.
Suchner, U., Heyland, D.K. & Peter, K. (2002). Immune-modulatory actions of arginine in the
critically ill. British Journal of Nutrition, 87, S121-132. Swanson, K.S., Grieshop, C.M., Flickinger, E.A., Bauer, L.L., Healy, H.P., Dawson, K.A.,
Merchen, N.R. & Fahey, G.C.Jr. (2002). Supplemental Fructooligosaccharides and Mannanoligosaccharides Influence Immune Function, Ileal and Total Tract Nutrient Digestibilities, Microbial Populations and Concentrations of Protein Catabolites in the Large Bowel of Dogs. Journal of Nutrition, 132, 980-989.
Swanson, K.S. & Fahey, G.C. Jr. (2007) Prebiotics in companion animal nutrition.
Theriogenology. Acedido em: Abr. 3, 2009, disponível em http://www.engormix.com/e_articles_view.asp?art=414
Swerdlow, M.P., Kennedy, D.R., Kennedy, J.S., Washabau, R.J., Henthorn, P.S., Moore,
P.F., Carding, S.R. & Felsburg, P.J. (2006). Expression and function of TLR2, TLR4, and Nod2 in primary canine colonic epithelial cells. Veterinary Immunology and Immunopathology, 114 (3-4), 313-319.
Takeda, K., Kaisho T. & Akira, S. (2003) Toll-like Receptors. Annual Review of Immunology,
21, 335-376. Tappenden, K.A., Drozdowski, L.A., Thomson, A.B. & McBurney, M.I. (1998). Shortchain
fatty acid-supplemented total parenteral nutrition alters intestinal structure, glucose transporter 2 (GLUT2) mRNA and protein, and proglucagon mRNA abundance in normal rats. American Journal of Clinical Nutrition, 68, 118–25.
Taylor, B.C., Zaph, C., Troy ,A.E., Du, Y., Guild K.J., Comeau, M.R. & Artis, D. (2009). TSLP
regulates intestinal immunity and inflammation in mouse models of helminth infection and colitis. Journal of Experimental Medicine, 206(3), 655-667.
133
Teshima, E. (2003). Aspectos Terapêuticos de probióticos, prebióticos e simbióticos. In
C.L.L.F. Ferreira, Prebióticos e Probióticos: Atualização e Prospecção. (pp.35-60). Viçosa, Minas Gerais.
Thomas, P.G., Harn, D.A. Jr. (2004). Immune biasing by helminth glycans. Cellular
Microbiology, 6(1), 13-22. Tizard, I.R. (2002). Veterinary Imumunology: An introduction. (6th ed.). Philadelphia: WB
Saunders. Topping D.L. & Clifton P.M. (2001). Short chain fatty acids and human colonic function: roles
of resistant starch and non starch polysaccharides. Physiological Reviews, 81, 1031-1064.
Uda, K., Tsujikawa, T., Ihara, T., Fujiyama, Y. & Bamba, T. (2002). Luminal polyamines
upregulate transmural glucose transport in the rat small intestine. Journal of Gastroenterology , 37, 434 - 441.
Urban, J.F.Jr. , Steenhard, N.R., Solano-Aguilar, G.I., Dawson, H.D., Iweala, O.I., Nagler,
C.R., Noland, G.S., Kumar, N., Anthony, R.M., Shea-Donohue, T., Weinstock, J., Gause, W.C. (2007). Infection with parasitic nematodes confounds vaccination efficacy. Veterinary Parasitology, 148 (1), 14-20.
Urguhart, G. M., Armour J., Duncan J. L., Dunn A. M. & Jennings F. W. (1998). Parasitologia
Veterinária. (tradução 2ª edição). Rio de Janeiro: Guanabara. Vanhoutte, T., Huys, G., Brandt, E., Fahey, G.C.Jr., Swings, J. (2005) Molecular monitoring
and characterization of the fecal microbiota of healthy dogs during fructan supplementation. FEMS Microbiology Letters, 249, 65-71.
Vogt, L.K. (2005). Avaliação da imunocompetência e alternativas para a modulação
nutricional de frangos de corte. Tese de Doutorado em Zootecnia. 151pp. Faculdade de Agronomia - Universidade Federal do Rio Grande Sul, Porto Alegre.
Wang, Y., Srinivasan, K., Siddiqui, M.R., George, S.P., Tomar, A. & Khurana, S. (2008). A
novel role for villin in intestinal epithelial cell survival and homeostasis. Journal of Biology and Chemistry, 283(14), 9454-9464.
Wapnir, R.A. (2000). Zinc deficiency, malnutrition and the gastrointestinal tract. Journal of
Nutrition, 130, 1388-1392S. Warden, R.A., Noltorp, R.S., Francis, J.L., Dunkley, P.R. & O’Loughlin, E.V. (1997). Vitamin
A deficiency exacerbates methotrexate- induced jejunal injury in rats. Journal of Nutrition, 127, 770-776.
Wenk, C. (2006). Prebiotics in companion animals. In Recent Advances in Pet Nutrition. (pp.
47-55). Nottingham: University Press Williams, D.L., Baskin, D.G. & Schwartz, M.W. (2009). Evidence that intestinal glucagon-like
peptide-1 plays a physiological role in satiety. Endocrinology, 150(4), 1680-1687. Witte, MB, Barbul, A. (2002). Role of nitric oxide in wound repair. The American Journal of
Surgery, 183, 406-412. Wu, G. (1998). Intestinal mucosal amino acid catabolism. Journal of Nutrition, 128(8), 1249-
1252.
134
Wu, G., Meininger, C.J., Knabe, D.A., Bazer, F.W. & Rhoads, J.M. (2000). Arginine nutrition
in development, health and disease. Current Opinion in Clinical Nutrition and Metabolic Care, 3, 59–66.
Xavier, R.J. & Podolsky, D.K. (2007). Unravelling the pathogenesis of inflammatory bowel
disease. Nature, 448, 427-434. Yazdanbakhsh, M., Kremsner, P.G., Ree, R.v. (2002). Allergy, parasites, and the hygiene
hypothesis. Science, 296 (5567), 490-494. Zentek, J. (1995). Influence of diet composition on the microbial activity in the gastro-
intestinal tract of dogs. Effects on the microflora in the ileum chyme. Journal of Animal Physiology and Animal Nutrition, 74(1/2), 53-61.
Zentek, J., Molitor, D., Kamphues, J. (1998). Enterococcus faecium as probiotic feed additive
in dogs. Kleintierpraxis, 43(3), 187-197. Zentek, J. (2000). Bacterial flora of the canine alimentary tract - physiology, feeding
influences and dietary consequences. Kleintierpraxis, 45, 523. Zentek, J., Hall, E. J., German, A., Haverson K., Bailey, M., Rolfe, V., Butterwick, R. & Day,
M. J. (2002a). Morphology and immunopathology of the small and large intestine in dogs with nonspecific dietary sensitivity. Journal of Nutrition, 132 (6), 1652s-1654s.
Zentek, J., Marquart B. & Pietrzak T. (2002b). Intestinal effects of mannanoligosaccharides,
transgalactooligosaccharides, lactose and lactulose in dogs. Journal of Nutrition, 132(6), 1682s-1684s.
Zentek, J., Marquart, B., Pietrzak, T., Ballevre, O. & Rochat, F. (2003). Dietary effects on
bifidobacteria and Clostridium perfringens in the canine intestinal tract. Journal of Animal Physiology and Animal Nutrition, 87(11/12), 397- 407.
Zentek, J. (2008), Nutrition in dogs and cats with gastrointestinal problems. In II Simpósio de
Nutrição Clínica de Cães e Gatos - Foco em Doenças Gastrintestinais. Faculdade de Ciências Agrárias e Veterinárias da Universidade Estadual Paulista.
Ziegler, T.R., Bazargan, N., Leader, L.M. & Martindale, R.G. (2000). Glutamine and the
gastrointestinal tract. Current Opinion in Clinical Nutrition and Metabolic Care, 3, 355-362.
Ziegler, T.R., Estívariz C.F., Jonas C.R., Gu L.H., Jones D.P. & Leader L.M. (1999)
Interactions between nutrients and peptide growth factors in intestinal growth, repair and function. Journal of Parenteral and Enteral Nutrition, 23, S174-183.
Ziegler, T.R., Evans, M.E., Estívariz, C.F. & Jones, D.P. (2003). Trophic and cytoprotective
nutrition for intestinal adaptation, mucosal repair, and barrier function. Annual Review of Nutrition, 23, 229-261.
Ziegler, T.R, Mantell, M.P., Chow, J.C., Rombeau, J.L. & Smith, R.J. (1996). Gut adaptation
and the insulin-like growth factor system: regulation by glutamine and insulin-like growth factor-I administration. American Journal of Physiology, 271 (G8), 66-75
135
VI. ANEXOS
1. Inquérito realizado em Portugal a Médicos Veterinários sobre Nutrição Clínica (Questionário)
1. Costuma avaliar o estado nutricional do animal?
Não
Às vezes
Sim
1.1 Como o avalia? ...............................................................................................................
2. O que faz quando o animal não come?
aplica fluidoterapia com glicose
espera
utiliza sondas para alimentação
3. Quando prescreve dietas caseiras, elas são:
balanceadas e com quantidade certa para o peso do animal
sugere alguns alimentos sem se preocupar com a quantidade extra e se são balanceados
4. Já prescreveu dietas terapêuticas (adaptadas a cada doença do animal)?
não
sim, raramente
sim, frequentemente
5. Já tratou animais com obesidade?
não
sim, raramente
sim, frequentemente
5.1 Se respondeu “sim” à questão nº 5
controla a quantidade e peso constantemente
apenas indica uma marca de ração
6. Conhece os diferentes métodos de suporte nutricional (exemplo: nutrição enteral) utilizados
nas doenças gastrointestinais?
Sim
alguns
Não
6.1 Quais os que conhece?....................................................................................................
136
6.2 Sabe quando, qual e como usar cada um deles?
Sim
Não
7. Já indicou/colocou uma sonda nasoesofágica?
não
sim, raramente
sim, frequentemente
8. Já indicou/colocou uma sonda esofágica?
não
sim, raramente
sim, frequentemente
9. Já indicou/colocou uma sonda gástrica?
não
sim, raramente
sim, frequentemente
10. Já indicou/fez alimentação parenteral?
não
sim, raramente
sim, frequentemente
11. Como determina as necessidades energéticas de manutenção em cães e gatos adultos?
................................................................................................................................
12. Como calcula a quantidade de alimento a ser administrada por dia?
................................................................................................................................
13. Nos locais onde trabalha (trabalhou) ou estagia, a nutrição integra a rotina médica diária
como parte do tratamento médico veterinário?
Não
Sim
14. Os Hospitais ou Clínicas Veterinárias em que está (ou esteve) têm um critério rigoroso para o
controlo do consumo de alimentos dos animais internados.
Não
Sim
137
15. Em animais hospitalizados acha que:
a intervenção nutricional é necessária
se houver uma terapia adequada, o apetite pode regularizar-se até 5 dias
16. Na assistência nutricional ao paciente hospitalizado, acha que se deve:
esperar que o animal melhore para que o apetite retorne e volte a alimentar-se
alimentar o animal para que este se sinta melhor e recupere mais rapidamente
17. De uma forma geral, acha que a maioria dos animais internados:
ingerem alimento suficiente para atingir balanço calórico positivo
estão em balanço calórico negativo
18. Que causas podem levar ao balanço energético negativo:
(Classifique de 1-3 por ordem decrescente de importância)
recusa do animal em alimentar-se ou anorexia
prescrição de jejum
prescrição dietética incorrecta por parte do veterinário
19. Conhece algum hospital ou clínica veterinária que tenha uma área especializada de
Nutrição?
Sim, qual/onde? Não
20. Já sentiu necessidade em ter mais conhecimentos na área da Nutrição?
Não
Sim
21. Considera os seus próprios conhecimentos sobre Nutrição
bons
suficientes
insuficientes
22. Já pediu a colaboração de um nutricionista veterinário?
não
sim, raramente
sim, frequentemente
138
2. Actividades complementares durante o período de estágio curricular na FCAV
Como participante:
I Congresso Internacional e VIII Simpósio sobre Nutrição de Animais de Estimação,
promovido pelo Colégio Brasileiro de Nutrição Animal, dias 7 e 8 de Maio 2009, em
Campinas - SP, com 13 horas de duração
Como aluno ouvinte: em Disciplina de Pós Graduação da Unesp - Jaboticabal,
“Metabolismo de lípidos em cães e gatos” ministrada pelo Prof. Dr. John E. Bauer do
College of Veterinary Medicine, Universidade de Texas – EUA, nos dias 4 e 5 de Maio de
2009 com 12 horas de duração Programa: 1- Necessidades nutricionais de ácidos graxos em cães e gatos; 2- Digestão,
absorção e transporte de gorduras; 3- Metabolismo dos ácidos graxos em cães; 4- Fontes de
ácidos graxos em dietas para cães e gatos; 5- Particularidades metabólicas dos gatos (ausência
de delta-6 dessaturase); 6- Usos clínicos de ácidos graxos poliinsaturados em medicina
veterinária; 7- Dislipidemias; 8- Uso de diacilglicerol para cães e gatos.
Assistência a apresentações de temas de Nutrição básica e clínica: “Uso de psyllium (plantago psyllium) para controlo de constipação em cães”. Relatório de
conclusão do programa de Aprimoramento profissional - resultado de pesquisa de Letícia
Tortola (Janeiro de 2009)
“Avaliação de fontes protéicas e de tratamentos industriais da farinha de carne e ossos para
cães e gatos. ” Dissertação de Mestrado de Luciana Oliveira (19/01/09)
“Cromo nos ensaios de Digestibilidade de Cães e Gatos” seminário do pós-doutorando
Ricardo Vasconcellos (21/01/09)
“The effect of dietary supplementation with 9-cis:12-trans and 10-trans:12-cis conjugated
linoleic acid (CLA) for nine months on serum cholesterol, lymphocyte proliferation and
polymorphonuclear cells function in Beagle dogs” Nunes et al. (2008) discussão do artigo
(28/01/09)
“Técnicas de análise de extrato etéreo para determinação de coeficientes de digestibilidade
de dietas extrusadas para cães” Carciofi et al. discussão do artigo (11/02/09)
“Análise Bromatológica” seminário de Fabiano (04/02/09)
139
“Relação entre o excesso de bases do alimento e pH urinário de gatos” Dissertação de
Mestrado de Juliana Jeremias (16/02/09)
“Efeito da adição de parede celular de levedura sobre a digestibilidade, microbiota fecal e
parâmetros hematológicos e imunológicos de cães” Dissertação de Mestrado de Márcia
Gomes (18/02/09)
“Manejo Dietético em Cardiomiopatias Caninas”. Seminário de Carla Maion (Fevereiro 2009)
“Fiber” Lu Felipe discussão do artigo (12/03/09)
“Saúde Oral” - seminários de estagiárias do Serviço de Nutrição Clínica (25/03/09)
“Nutracêuticos” seminário de Gabriel (01/04/09)
“Cognitive and behavioral assessment in dogs and pet food market applications” Zicker
(2005) discussão do artigo (28/04/09)
“Hipersensibilidade Alimentar: Fatores Dietéticos Relacionados e Manejo Alimentar” palestra
do Doutorando Márcio Brunetto (13/05/09)
3. Apresentação realizada pelo autor de seminário “Imunonutrição e Intestino” na FCAV (18/03/09) (ver págs. 140-145)
4. Apresentação e Discussão realizada pelo autor de Caso Clínico em Clínica Médica na FCAV (15/04/09) - Enterite linfoplasmocítica (DII) associada a sobrecrescimento
bacteriano (SIBO) e hipersensibilidade alimentar (ver págs. 146-151).
140
20-09-2009
1
NUTRIÇÃO DO INTESTINONUTRIÇÃO DO INTESTINOIMUNIDADE INTESTINAL IMUNIDADE INTESTINAL EE RESISTÊNCIA A PARASITASRESISTÊNCIA A PARASITAS
1 1 -- A função do intestino A função do intestino na nutrição do animalna nutrição do animal
2 2 -- O papel da dieta O papel da dieta na nutrição do intestinona nutrição do intestino
3 3 -- A importância do intestino A importância do intestino na saúde e Imunidadena saúde e Imunidade
4 4 -- Mecanismos de resistência intestinalMecanismos de resistência intestinala microrganismos e parasitas a microrganismos e parasitas
Interação nutriçãoInteração nutrição--imunidadeimunidade--doençadoença
•Prejuízo ao sistema Imune
•Neutropénia
•consumo do Complemento
• Integridade epitelial
Secreções
• Prejuízo funções imunes
Actividade céls.T
complemento
microbicida
imunossupressão
infecção
desnutrição
Febre
Anorexia
necessidades
Catabolismo
Fisiologia TGIFisiologia TGI
Sistema digestivo• Digestão e absorção
de nutrientes
Sistema protector• Barreiras não imunológicas• Defesas imunológicas
Intestino DelgadoIntestino Delgado
• Superfície da mucosa• Vilosidades• Microvilosidades
Comprimento total intestinoAltura vilosidadesProfundidade da criptafactores ligados à dieta
Digestão ID Digestão ID processos: intraluminal e epitelial
Mucosa duodenal : digestão final (a monómeros)Enzimas de:• Pâncreas• Ácidos biliares do fígado• Células intestinais (bordadura em escova)
Enzimas pancreáticas (digestão intraluminal)
Amilases!-amilase(digestão intraluminal)
Proteases tripsinaquimotripsinacarboxipeptidasesaminopeptidases
Secreção pancreática (hormonas entéricas)libertação: secretina => suco rico em bicarbonato
colecistoquinina => rico em enzimas, Ca p/ linfócitos
! amilaseSacaraseMaltaseIsomaltaseLactase
LipasescolipaseFosfolipase A2
140
141
20-09-2009
2
Digestão das gordurasDigestão das gorduras
1. Digestão intraluminal2. Solubilização micelar3. Permeabilização do lúmen à celula4. Resterificação intracelular5. Formação quilomicrons6. Transporte via circulação linfática corrente sangúineap ç g
• 1º emulsificação gorduras pelos Ác. Biliares micelas• AGL + monoglicéridos = triglicéridos quilomicrons
TGcm solúveis em água (sem ác.biliares p/ emulsificação)AGCC no TGcm – processo digestão/absorção + simples via portalApós absorção TGcm energia
Intestino Grosso (Cólon)Intestino Grosso (Cólon)
• Superfície lisa, sem vilos• Criptas de Lieberkulin
lubrificaçãomuco alcalinoproteção mucosainativar ácidos da fermentação
Funções:• Absorção de água e eletrólitos (Na, K, Cl)• Fermentação matéria orgânica não digerida
e não absorvida no ID• Armazenamento de fezes
Microbiologia TGIMicrobiologia TGIPopulação microbiana complexa - “afetada pela dieta”
Fermentação no IGFermentação no IG• Bactérias fermentam restos alimentares e secreções
endógenas que escapam do ID
• Proporção relativa dos produtos da fermentação gerados depende:Composição da microfloraInterações metabólicas entre bactériasNutrientes disponíveisTempo de trânsito intestinalHospedeiro (idade, estatuto imune, genética)
Bactérias residentes ! estrutura e função da mucosa intestinalBactérias aderentes à mucosa :
capacidade endocítica e hidrolítica intracelularMelhora degradação de antígenos do lúmen intestinal:• regulação do sistema imune (> IgA)• potencial anti-inflamatório
Efeitos nutricionais no TGIEfeitos nutricionais no TGI
Nutrição céls.intest. Lúmen intestinal Via hematógena
ID enterócitos 50% 50%
IG colonócitos 70% 30%
Aporte de nutrientes no lúmen intestinalAporte de nutrientes no lúmen intestinal
•Nutrição próprias céls. intestinais•Presença nutrientes : estímulo trófico p/ mucosa intestinal
Mantém integridade da mucosa – evita:Atrofia do intestinoComprometimento imuneTranslocação bacteriana
NutrientesNutrientes--chave c/ efeito direto na função do TGIchave c/ efeito direto na função do TGI
Proteínas e aminoácidosProteínas e aminoácidos
• 50% proteína ingerida ! céls sistema digestivo• 90% aspartato, glutamato, glutamina ! tecido intestinal
Ingestão adequada na dieta necessária p/ proteger:Atrofia da mucosa, c/ céls. absorçãoçAlterações nas enzimas digestivas
Ig e céls. imunológicas intestinaisrisco colonização e translocação bacteriana
GlutaminaGlutamina: aa. Condicionalm/ essencial
1ª Fonte energia p/ céls. ID
! Função natural barreira da mucosa intestinal
apoptoseGlutamina + glutamato= glutationa (anti-oxidante)
Aminas bioativasAminas bioativasAminas descarboxilação de aminoácidos pelos microrganismos TGI
• 1) Aminas Naturais Aminas Naturais ex. putrescina, espermina e espermidinaindispensáveis às células
crescimento, renovação e metabolismo celular.
• 2) Aminas BiogénicasAminas Biogénicasex. cadaverina, histamina, serotonina, feniletilamina- descarboxilação de aminoácidos por enzimas microbianasdescarboxilação de aminoácidos por enzimas microbianas
presença na dieta em quantidades adequadas é importante, mas apesar de necessárias em alguns processos bioquímicos, podem causar efeitos tóxicos (em altas concentrações)- reflexos na integridade da mucosa e na saúde intestinal
• Apesar de efeitos indesejáveis das aminas, Poliaminas estimulam a síntese de DNA, RNA e proteica importantes p/ maturação da mucosa intestinal. Devido à sua rápida absorção no ID, a produção microbiana de poliaminas é relevantep/ o fornecimento desses compostos à mucosa do IG
141
142
20-09-2009
3
Carbohidratos Indigeríveis (Fibras) e PrebióticosCarbohidratos Indigeríveis (Fibras) e Prebióticos
• Fibras dietéticas – não digeríveis pelas enzimas digestivas animais
• Fibras fermentáveis – digeridas pelas bactérias íleo/cólon • (enzimas bacterianas)
• Fermentação de bactérias AGCC
• Ácidos graxos de cadeia curta (AGCC) :Ácidos graxos de cadeia curta (AGCC)
energia para colonócitos (4,5 x mais que glicose)
absorção de Na e H2O pela mucosa (ATP)desenvolvimento da mucosasintese protéica e absorção nutrientespH conteúdo intestinal ! translocação bacteriana
+ Butirato – efeitos na função directa dos AGCC na modulação da imunidade da mucosa do TGI
Características gerais fibras dietéticasCaracterísticas gerais fibras dietéticas
Fibras solúveis Fibras insolúveishidrossolúvel Não hidrossolúvel
Absorve água – gel viscoso Adsorve água – não viscosoEsvaziamento gástrico Controla trânsito intestinal
Absorção de nutrientes Volume fecalFonte de AGCC motilidade cólon
Fibras mto. solúveis : pectinas, gomas, psyllium
Fibras insolúveis: celulose, frutose
Fibras fermentáveis – substrato AGCC
Butirato > acetato > propionato(efeito da dieta depende do tipo de AGCC e [ ] produzidos)
PrebióticosPrebióticosFibras selectivamente fermentadas por:
Lactobacilos, Bifidobacterium, Eubacterium, BacterioidesSalmonella, Clostridium, E.Coli
Fibras prebióticasFibras prebióticas :
• Oligossacarídeos (inulina, frutose)
• Pectina . Mananoligossacarídeos (MOS)
•Amido resistente . Frutooligossacarídeos (FOS)
Vantagens :
•Absorção Ca da dieta e outros minerais
Prebióticos + fibras dietéticas saúde:
• Lípidos do sangue e colesterol
• constipação
•Auxílio em diarreia e inflamação TGI
•Substrato p/ AGCC
Ácidos Gordos essenciaisÁcidos Gordos essenciais
• Ácido Linoleico e Ác. Araquidónico – membrana céls. intestinais
• Estrutura polinsaturada fluidez /permeabilidade – tight junctions
F õFunções
• Céls. Mucosa intestinal barreira protectora• AG nas membranas celulares
síntese mensageiros das células função imunológicae mediadores da inflamação intestinal
MineraisMineraisZinco
• Digestão apropriada e uso proteína dieta• Papel no crescimento celular e replicação• Função imunológica• Antioxidante – protege vs peroxidação lipídica• Zn absorção deficiente gorduras lípidos nos enterócitos
absorção vit.A e ß-caroteno
Selénio• Proteção TGI vs carcinogénese• Co-factor no sistema antioxidante da glutationa
Níveis Zn + Se dietéticos actividade metabólica mucosa intestinal
(propriedades digestivas e proteção)
VitaminasVitaminasVit.AVit.A
• integridade céls epiteliais e função imunológica• Deficiências : comprometimento intestinal e imune
risco diarreiaVit.EVit.E
• principal antioxidante lipídico solúvel • Crucial integridade mucosa• Manutenção função imunológica associada ao intestino
• Níveis vit E adequados p/ prevenir sintomas de deficiência:• Níveis vit.E adequados p/ prevenir sintomas de deficiência:
VitsVits. complexo BB – hidrossolúveis
•B8 (biotina) – turnover celular normal + função imunológica
•B9 (folato) – proteção risco cancer coloretal
•B1 (tiamina) – função digestiva normal (p/ activação enzimas intestinais)
Podem não ser adequados para manter os sistemas de proteção:•Defesas vs danos oxidativos•Função imunológica celular
lesões neuromusculares
Anomalias testiculares
Degenerescência retina
Reabsorção fetal
142
143
20-09-2009
4
TGI sistema natural de proteçãoTGI sistema natural de proteção
GALT Tecido Linfóide Associado ao Intestino
Intestino > orgão imunológico do corpo
70-80% sistema imunológico organismo – Intestino
25% submucosa e mucosa intestinal – tecido linfóide
Imunidade IntestinalImunidade Intestinal
• Tecido Linfóide - linfócitos AC • Placas de Peyer > dos tecidos linfóides mucosos
céls. BComponentes p/ reacção imunológica céls. T
céls dendríticasCél.B plasmócitos AC (Ig)Céls dendríticas – céls apresentadoras de AG (CPA) Céls.M (Microdobras) - CPAAG cél.T
Componentes do Sistema Imunológico Componentes do Sistema Imunológico -- Tipos de ImunidadeTipos de ImunidadeNatural Adaptativa (AG adquirido ou
específico)
(AG não específico) Celular Mediada por células (céls. T e B)
Humoral
Macrófagos Células T Células BBarreiras nãoespecíficas
Th (CD4+)Céls. helper
Tc (CD8+) Céls. citotóxicas/
Mediada por ACIgA, IgE, IgG, IgM
Th1(IL-2,TNF,INF-")Th2(IL-4.IL-10;IL-13)
supressoras
TGI TGI 70-80% céls produtoras IgA+ 60% Ig/dia - IgA intestinal
plasmócitos na mucosa intestinal
IgA secretória
Proteção do intestinovs bactérias/vírus
M d ã I A Modo ação IgA : dentro e fora da célula intestinal
• Evitar aderência microrganismos- superfícies mucosas
Exclusão imunológicaExclusão imunológica
IgAVírus
BactériasAG estranho
célula –! lúmen intestinal
Estimulação sistema imunológico no TGIEstimulação sistema imunológico no TGI
Apresentação AG na mucosa intestinal síntese AC• Reações 2árias. em locais imunes doutras mucosasex. cél.B mama secreção IgA, Ag – específico no leiteProteção ao lactente vs patógenos intestinais
Microflora do TGIMicroflora do TGI3 grupos Bactérias no intestino
1º potencialm/ patogénicasClostridium, Staphylococcus, Salmonellainvadem mucosasToxinas diarreiaactivam carcinogenos intestinais
• 2º promotoras saúdeBifidobactérias LactobacilusBifidobactérias, Lactobacilus
Proteção vs infeçãoem Adultos: > responsável função barreira TGI> estímulo função imunológica saudável
Mecanismos proteção imunidade do animal• pH colónia bacteriana ! bactérias patogénicas ! absorção tóxicos• Produção AGCC quando fermentam fibras dietéticas
turnover / proliferação celularefeito trófico no epitélio intestinal
superfície absorção
143
144
20-09-2009
5
Microbiota GI Microbiota GI ––!! desenvolvimento normal Sistema Imune hospedeiro
EubiotaEubiota – efeitos protectores adicionais directos/indirectos• Ação competitiva vs potenciais invasores - evita adesão epitélio GI
ã li j d it li i ífi fí i lú
Animais gnotobióticos – não criam microflora GI normal
não desenvolvem sistema imune normal
• Modulam reações imunológicas específicas• Indução tolerância oraltolerância oral a AG alimentares
(# alergia/hipersensibilidade alimentar)
• expressão glicoconjugados epiteliais específicos superfície lúmen(receptores selectivos p/ adesão de bactérias)
• Camada de muco (defesa) – céls. epiteliais intestino
Tolerância OralTolerância OralResposta imunitária aos antigenes da dieta
Bases imunológicas para a tolerância oral
• Indução IgAApoptose cél.TAnergiaImunosupressão
• Retenção linfócitos AG específicos capazes resposta invasoresTroca isotipos de AC p/ IgM, IgE, IgG
• produção de citoquinas inflamatórias (INF-!, IL-6, IL-12)
Perda da tolerância aos antigenes da dieta
1. Inflamação mediada por céls. locaisestímulo crónico infiltração linfócitos IBD
2. Produção de isotipos de AC locais # IgA: produz IgE conduz mastócitos hipersensibilidade intestinalAlergia alimentar com sinais GI ( vómito/diarreia)
3. Produção sistémica de AC : IgE circulantes conduz mastócitos hipersensibilidade dérmica
PrebióticosAlimentos específicos providos p/ influenciar microflora GI- carbohidratos não digeridos crescimento bactérias benéficas
Probióticos
Prebióticos / ProbióticosPrebióticos / Probióticos
ex. cepas Probióticas lactobacilos expressão genes MUC 2 e 3
secreção muco cólonaderência E. Coli patogénica
alteração flora natural c/ AB ! bactérias patógenas colite
• Microrganismos vivos benéficos consumidos através alimentos- influenciam indicadores de saúde e da função imunológica
Regulação Nutricional da ImunidadeRegulação Nutricional da ImunidadeNutrientes essenciais moduladores função imune
Proteínas e AminoácidosProteínas e Aminoácidos• formas imunidade afetadas má nutrição energético-proteica• Dietas com proteínas fraca qualidade:• Sinais deficiência proteica soro Ig
Função Timo
Formação AC e complemento
Ácidos Gordos EssenciaisÁcidos Gordos EssenciaisÓleo de peixe – fontes ricas em $3 e $6Consumo adequado alterações inflamatórias e auto-imunes• Dietas ricas AG $3 – efeitos benéficos na supressão de:
Proliferação linfócitosProdução IL-2Actividade Células NKToxicidade mediada por macrófagos
ç p
Nutrientes AntioxidantesNutrientes AntioxidantesRadicais livresRadicais livres – compostos mto. Reativos danificam compostos
DNA, Proteínas, gorduras
AntioxidantesAntioxidantesreação c/ radicais livres reativos efeitos nocivos
papéis vitais manutenção SI SI e apoio sua função protetora
Vit i EVit i EVitamina EVitamina E• Elimina RC da fração solúvel na gordura das céls.• Estabiliza membranas celulares• Sinais vit.E poder eliminação linfócitos/leucócitos
reação linfócitos TFunção fagocítica
SelénioSelénio (associado vit.E)Sinais Se Reação imunológica
reação de ACsreação linfocítica
Vitamina CVitamina Cácido ascórbico na dietaimpacto na fração hidrossolúvel de componentes celularesdeficiência vit.C – efeitos adversos na função imunológicasintomas vit. C = sinais vit. E
ßß-- carotenocarotenoUm dos mtos carotenóides c/ actividade antioxidantena dieta resposta imune humoral e celular (cães)
nº céls. Thproliferação linfócitosratio CD4+ : CD8+plasmático de IgG
Vits. BVits. BB6 (piridoxina) – deficiência imunidade mediada por céls.B9 (ác. Fólico) e Vit. B12 ! Replicação celularDeficiências: atrofia Timo
Formação ACimunidade mediada por céls
144
145
20-09-2009
6
MineraisMineraisZincoZinco+ essencial p/ desenvolvimento/ manutenção SIe p/ funções fagocíticasZn + 100 metaloenzimas• Sinais deficiência Zn
reação humoral e função céls. Bestrutura/função Timoçfunção fagocítica
• Excesso tb. prejudica na reação imune
FerroFerro• Sintomas Fe
poder de eliminação de leucócitos/ linfócitosfunção céls. Bestrutura/função Timo
Resistência intestinal a microrganismos e parasitasResistência intestinal a microrganismos e parasitas
Papel dos parasitas na regulaçãoda resposta alérgica à comida
I f ã l d d h l i t i t ti i
Parasitismo intestinal Parasitismo intestinal mecanismo perda de Tolerância Oral
Conduz a resposta humoral exagerada
c/ produção IgE
• Infecção prolongada de helmintes intestinaiscitoquinas anti-inflamatórias (IL-10) ! alergia
• Resposta hospedeiro ao parasita predisposição à alergiaForte resposta anti-inflamatória reguladora
desafio imune prolongado • Gatos – papel parasitismo e outras infecções
no desenvolvimento da hipersensibilidade alimentar – a definir…Teoria da Higiene (Yazdanbankhsh et al, 2007)NeuroEndocrinoImunomodulação no hospedeiro pelos helmintes (Galileo et al,2009)“uma nova forma de co-evolução hospedeiro – parasita?”...
Mecanismos de reacção contra helmintes intestinaisMecanismos de reacção contra helmintes intestinaisProdução IgE mediada por céls. Th2
nemátodos resposta Th2 ! níveis IgE e nº eosinófilos
Imunidade contra infecções por helmintes e protozoários GI
Imunidade inataImunidade adquirida- Imunidade humoral
. Eosinófilos e destruição de parasitas- Imunidade mediada por células
sinais hipersensibilidade tipo I• Vermes AG na mucosa intestinalAG de helmintes + IgE ligados a mastócitos desgranulação
libertação moléculas vasoactivas e proteasesContração musculo liso e permeabilidade vascularefluxo no lúmen intestinal expulsão vermes
• Desgranulação mastócitos moléculas quimiotáxicasInfiltração de eosinófilos no local invasão
Nutrição MicroenteralNutrição MicroenteralImportância Intestino na recuperação paciente crítico
Objectivos Fluidoterapiamáximo o fluxo sanguíneo GI p/ :- proteção mucosa do processo
degenerativo e disfunção mecânica- Prevenção alteração do sistema enzimático- Preservar a integridade imunitária do intestino
Vantagens:Fluido, electrólitos, nutrientes facilm/ absorvíveisEstímulo mecânico do TGI - Funcionalidade e integridadePrevine atrofia trato digestivoEstimulação imunológica: IgAPrevine translocação bacterianaApoio à nutrição parenteral e < custo
Via digestiva, em bolus ou infusão constante1as. 12h pós-stress até aceitação nutrição enteral(volume – 0,05 ml/kg/h 1-2 ml/kg/h por 24-48h)
Obrigado Obrigado pela atençãopela atençãoe pela ajuda e pela ajuda !!
NutriVetNutriVet JaboticabalJaboticabal Espírito de equipaEspírito de equipa
145
1
CASO CLÍNICA MÉDICACASO CLÍNICA MÉDICA
• Shar Pei, canídeo, macho, 5 anos, 15 Kg
ANAMNESEANAMNESE
• Diarreia dura há 6 meses • fezes volumosas, por vezes aquosas,
cor acastanhada, sem sangue.g• frequência de defecação aumentou
não tem tenesmo, mas tem flatulência• Perdeu peso (4 Kg) desde o início da diarreia• Alimentação: ração para cão, alimentos não
indicados. Menos apetite. Manteiga agravou a diarreia.
ANAMNESEANAMNESE
• Vómito pouco frequente.• Vacinado há 6 meses• Vacinado há 6 meses• Vermifugação: pirantel há 4 meses• Dieta hipoalergénica (queijo+arroz):
melhorou a qualidade das fezes durante 6 semanas e depois piorou.
• Comportamento: menos activo, não brinca com as crianças.
EXAME FÍSICOEXAME FÍSICO
• Frequência cardíaca: 110/min(60-120)• Frequência respiratória:20/min (10-40)
• Pulso: 110/min (60-120)• Temperatura: 38,5ºC (37,8-39,2 ºC )• Mucosas: rosadas
Li f d i• Linfonodos: normais• Pelagem seca• Palpação abdominal: normal• Auscultação: cardíaca
e pulmonar normais• Exame rectal: doloroso
LISTA DE PROBLEMASLISTA DE PROBLEMAS
• DIARREIA CRÓNICA
• PERDA DE PESO
• VÓMITO
DiarreiaDiarreiaSinaisSinais Intestino DelgadoIntestino Delgado Intestino GrossoIntestino Grosso
Alimento Não digerido Digerido
Frequência Aumento 3 a 5 vezes Aumento 5 a 10 x
Perda de peso Acentuada Rara
Flatulência Presente Rara
Motilidade Normal AumentadaMotilidade Normal Aumentada
Volume de fezes Aumentado Diminuído
Sangue Melena rara Hematoquezia
Esteatorreia Presente Ausente
Muco Ausente Presente
Tenesmo Ausente Presente
Vómito Pode existir Pode existir
146
2
Diagnósticos DiferenciaisDiagnósticos Diferenciais
•• DIARREIA CRÓNICADIARREIA CRÓNICA– Parasitose intestinal– Intolerância alimentar– Insuficiência pancreática exócrina (IPE)– Sobrecrescimento bacteriano intestinal(SIBO)– Doença Inflamatória intestinal (IBD)
• Intolerância alimentar ou alergia• Parasitismo intestinal
– Giardia sp.– Cryptosporidium parvum
Diagnósticos Diagnósticos diferenciaisdiferenciais
Diarreia crónica de Intestino DelgadoDiarreia crónica de Intestino Delgado
yp p p– Isospora sp.– Toxocara canis– Ancylostoma caninum– Trichuris vulpis, – Dypilidium caninum
• Enteropatia por resposta a antibioterapia
• IBD (Inflamatory Bowel Disease)– Enterite
linfoplasmocíticaE i i fíli
• Histoplasmose do trato alimentar
• Linfangietasia intestinal
Diagnósticos diferenciaisDiagnósticos diferenciaisDiarreia crónica de Intestino DelgadoDiarreia crónica de Intestino Delgado
– Enterite eosinofílica – Atrofia idiopática
das vilosidades– Enterite purulenta
• Hemorragia do trato digestivo
• Invaginação crónica• Neoplasia
– Adenoma/Adenocarcinoma
– Linfoma
• Enteropatias não comuns - enteropatia crónica - ectasia severa das criptas da mucosa
Diagnósticos diferenciaisDiagnósticos diferenciaisDiarreia crónica de Intestino DelgadoDiarreia crónica de Intestino Delgado
- edema severo da mucosa• SIBO (por Clostridium sp.)• IPE (Insuficiência Pancreática Exócrina)
Diagnósticos DiferenciaisDiagnósticos Diferenciais
•• VÓMITOVÓMITO– Trato gastrointestinal: gastrite aguda gastrite crónica gastrite crónica enteropatia neoplasia GI obstrução/oclusão GI
– receptores periféricos– doença central
Diagnósticos Diferenciais
•• PERDA DE PESOPERDA DE PESO– problemas na dieta– anorexia– uso excessivo de calorias
p d d p t ín : in ( lb min ) – perda de proteína: urina (albumina) trato GI (parasitismo, enteropatia com perda de proteína)
– perda de glucose: diabetes mellitus– doença cardíaca– Insuficiência Renal Crônica (IRC)– neoplasia
147
3
PLANO DE DIAGNÓSTICOPLANO DE DIAGNÓSTICO
• Análises de rotina: Hemograma/Bioquímica Sanguínea
DIARREIA CRÓNICAPERDA DE PESOVÓMITO
Análises de rotina: Hemograma/Bioquímica Sanguínea
• Coprologia - Exame Fecal
• Rx simples abdominal • Endoscopia alta + biópsia + aspirado duodenal• TLI• Cobalamina/Folato séricos
Diarreia +
Perda de PesoHistória Pregressa/Exame Físico
causas nutricionais(ex.má qualidade do alimento,restos,lixo)
Exames fecais +/-Diagnóstico Terapêutico
(para despiste de parasitismo, especialmente Giardíase)
Hemograma Enteropatia Enteropatia sem perda de proteína
Má digestão
HemogramaPainel bioquímico
ppor perda de proteína
p m p p(albumina) sérica normal
EndoscopiaBiópsia Intestinal
TLI
Exclusão IPE Patologia Int.Delgado
Terapia empírica Dieta Hipoalergénica
falha terapêuticaAntibioterapia
falha terapêutica
Testes de Diagnóstico +amostras p/biópsia intestinal
RESULTADOSRESULTADOS
HEMOGRAMAHEMOGRAMAHemácias 6x106 /!l (5,5-8,5) Ht 37% (37-55) Hb 13,2g/dl (12-18) VCM 68 fl (60-77) HCM 22 pg (19,5-24,5) CHCM 35 g/dl (32-36) Reticulócitos 0,4% (0-1) , ( )Plaquetas 280x103/!l (200-500) Leucócitos 17,5x103/!l
Basófilos 0 Eosinófilos 0 Neutr segm 92 Neutr não seg 2 Linfócitos 5 Monócitos 1
(6-17) (raro) (2-10) (60-77) (0-3) (12-30) (3-10)
RESULTADOSRESULTADOS
BIOQUÍMICABIOQUÍMICASANGUÍNEASANGUÍNEA
Ácidos biliares(jejum) 4 !mol/L (<15) Bilirrubina 0,17 mg/dl (0-0,2) Cálcio 2,0 mmol/L (2,3-3,0) Cloro 109 mmol/L (95-115) Colesterol 124 mg/dl (70-150) Creatinina 0,72 mg/dl (<1,6) Glucose 77,4 mg/dl 55-130) Fosfato 1,2 mmol/L 0,8-2,0 Sódio 142 mmol/L 140-155 Sódio 142 mmol/L 140 155 Potássio 3,9 mmol/L 3,5-5,5 Proteína total 5,4 g/dl (6,6-8,4) Albumina 2,0 g/dl (2,2-4,6) Globulina 3,4 g/dl (2,2-4,8) Ureia 22,2 mg/dl (20-65) Fosfatase alcalina 132 U/L (14-71) ALT 25 U/L (44-59) AST 35 U/L (37-47)
RESULTADOSRESULTADOS
•• UrianáliseUrianálise– cor amarela, transparente– pH 6,9 (6,0-7,1)– glucose: neg (neg)– bilirrubina: 0 (0-indícios)– sangue: neg (neg)– densidade: 1,037 (>1,025)– corpos cetónicos: neg (neg)– proteína: neg (neg de densidade <1,035;
2+ se densidade >1,035)– sedimento: cristais oxalato raros
EXAMES COMPLEMENTARESEXAMES COMPLEMENTARESRESULTADOSRESULTADOS
•• RxRx simples abdominalabdominal – normal
•• CoprologiaCoprologia - negativa
• “Serum trypsin-like immunoreactivity” Serum trypsin like immunoreactivity TLI TLI - 11 !g/L (>5)
•• Cobalamina/Folato séricosCobalamina/Folato séricos– cobalamina 200 pg/ml (200-400)– folato 24 pg/ml (5-13)
148
4
EXAMES COMPLEMENTARESEXAMES COMPLEMENTARES
•• ENDOSCOPIA GASTROINTESTINALENDOSCOPIA GASTROINTESTINAL–– EstômagoEstômago: normal–– DuodenoDuodeno: parede rugosa/avermelhadaaparência ligeiramente granular e friável.Sem erosões ou úlcerasSem erosões ou úlceras.
RESULTADOSRESULTADOS•• ENDOSCOPIA GASTROINTESTINALENDOSCOPIA GASTROINTESTINAL
–– BIÓPSIASBIÓPSIAS: EstômagoEstômago: infiltração ligeira de
linfócitos e plasmócitos - gastrite linfoplasmocítica ligeira
DuodenoDuodeno: infiltração moderada a severa de DuodenoDuodeno: infiltração moderada a severa de linfócitos e plasmócitos
- duodenite linfoplasmocítica moderada
–– ASPIRADO DUODENALASPIRADO DUODENAL:Negativo para GiardiaCultura quantitativa 109 UFC/ml
IBDIBD Sinais clínicosSinais clínicos
• Diarreia • Alteração apetite
(polifagia, diminuição de apetiteou anorexia)
•• Diarreia de Diarreia de intestino delgadointestino delgado(grande volume, aquosas, melena)
• Ansas intestinais espessadas
ou anorexia) • Perda de peso• Vómito bilioso • Hematemese• Hipoproteinémia ou
ascite
• Diarreia de intestino grosso (hematoquezia, mucóide, tenesmo)
• Dor ou desconforto abdominal
• Aumento borborigmos e flatulência
PatogeniaPatogeniaIBDIBD
EtiologiaDesconhecida. Provavelmente multifactorial:Susceptibilidade genéticaFactores ambientais (flora bacteriana residente)Sistema imunológico da mucosa intestinalSistema imunológico da mucosa intestinal
Hipótese + consistente: Perda da tolerância imunológica face à flora bacteriana normal do intestino, o que conduz a uma reacção imunitária anómala ao microambiente intestinal.
Enterite linfoplasmocíticaEnterite linfoplasmocíticaIBDIBD
Doenças concomitantes
Sobrecrescimento Bacteriano no
Intestino Delgado
Hipersensibilidade
alimentar
SIBOSIBOSinais clínicos
• Diarreiaintermitente
• Coprofagia• Fezes líquidas
• Perda de pesocrónica
• Polifagia• Picacismo
Fezes l qu das• Vómito• Borborigomos• Flatulência
149
5
DIAGNÓSTICODIAGNÓSTICO
E t it li f l íti (IBD)E t it li f l íti (IBD)•• Enterite linfoplasmocítica (IBD)Enterite linfoplasmocítica (IBD)associada a
•• Sobrecrescimento Bacteriano (SIBO)Sobrecrescimento Bacteriano (SIBO)- possível hipersensibilidade alimentar
TRATAMENTOTRATAMENTOTerapêutica MédicaTerapêutica Médica
• CorticoterapiaPrednisona ou prednisolonaInício : 2mg/Kg VO BID – 4 semanas5ª semana : 1,5 mg/Kg VO BID – 4 sem9ª semana : 1 mg/Kg VO BID – 4 sem13ª semana : 0,5 mg/Kg VO BID – 4 sem
Imunossupressores•Azatioprina 1-1,5 mg/Kg VO SID até estabilização ½ doseTerapêutica adjuvante na IBD severa ou refratária
(prednisolona+ metronidazol + azatioprina)
•Ciclofosfamida 50 mg/m² VO por 4 dias e 3 dias de descansoEfeitos 2.ários:Mielossupressão (hemogramas regulares)Cistite hemorrágica (principalmente cães)
• Metronidazol10-20 mg/Kg VO BID 2-3 sem.
Agente anti-protozoárioInibe a imunidade mediada por célulasLargo espectro contra anaeróbiosníveis dos enzimas da bordadura em escovaabsorção de nutrientes pelo intestino (glucose e aminoácidos)
• Inclusão !3 (acção anti-inflamatória intestinal)
Terapêutica dietéticaTerapêutica dietética
• Tratamento dietético - importante pilar
2 objectivos principais:- Providenciar os requisitos nutricionais adequados- Fornecer alimentos altamente digeríveis
no maneio de todas as IBD. • Nalguns tipos (enterite linfo-plasmocítica
moderada): modificação dietética permite a resolução parcial ou total dos sinais clínicos e das lesões histológicas
• Maneio dietético continuado permite manter a IBD controlada quando se reduz a terapêutica médica
NUTRIÇÃO CLÍNICANUTRIÇÃO CLÍNICADieta de eliminação – hipoalergénica• Melhorias no estado nutricional do animal• Repouso intestinal• Alterações na motilidade intestinal• Alterações na composição da flora• Alterações na morfologia e funções da mucosa intestinal• quantidade de substratos não absorvíveis • no intestino Diarreia osmótica• no intestino Diarreia osmótica• SIBO• Estímulo antigénico sobre a mucosa
• Dieta caseira75% batata25% carne de carneiro
• Ração Intestinal Royal Canin®nível lipídico
fibras digestíveisproteínas parcialm/ hidrolisadas
Dietas intestinaisDietas intestinaisCATEGORIA DA DIETA DIETAS COMERCIAIS
PROTEÍNA/CARBOHIDRATOS/FIBRA/OUTROS
Hills canine d/d (húmidos e secos)
Eukanuba response formula FP, KO (húmidos e secos)
IVD canine limited
Hills húmido: peixe branco ou borrego & arroz; seco: ovo & arroz, pato & arroz, salmão & arroz
Eukanuba húmido/ seco : peixe gato, arenque & batata, canguru & aveia.
Hipoalergénica (Novas fontes de proteína
e carbohidratos)
IVD canine limited ingredient diets (húmidos e secos)
Royal canin waltham diets canine selected protein (húmidos e secos)
Purina CNM HA formula/ canine and purina CNM LA formula/ canine (secos)
IVD: coelho, borrego, peixe branco, veado ou pato e batatas.
Walthman húmido: borrego & arroz; secos: peixe gato & arroz, capeline & tapioca.
Purina HA seco: proteína de soja modificada e amido de milho ; LA seco: salmão, truta & arroz
150
6
Dietas intestinaisDietas intestinaisCATEGORIA DA DIETA DIETAS COMERCIAIS
PROTEINA/ CARBOHIDRATOS/ FIBRAS/ OUTROS
Hills canine i/d húmido e seco
Eukanuba low residue/ canine (seco) (fórmula intestinal)
IVD canine neutral formula
Hills húmido & seco: fibra de soja (fibra solúvel)
Eukanuba polpa de beterraba, frutooligossacáridos (FOS), óleo de peixe
IVD neutral: peixe & batatas, farelo e casca de aveia, FOS.
Alta digestibilidade(pouca gordura e poucos
resíduos)
IVD canine neutral formula (seco)
IVD sensitive formula (húmido e seco)
Royal canin qalthman canine low fat diet (húmido e seco)
Purina CNM canine EN formula (húmido e seco)
IVD sensitive húmido: frango, ovo, queijo fresco, farelo de aveia e fibra solúvel,
FOS; seca: borrego, arroz & batatas, fibra de ervilha (misturada), FOS.
Waltham húmido: peixe, carne & arroz, celulose em pó; seca: celulose (fibra insolúvel), proteína de soja & arroz.
Purina húmido: carne de vaca, arroz, ovo, goma arábica, triglicéridos de cadeia média e óleo de peixe; seca: arroz & milho, fibra, MCT e óleo de peixe.
Dietas intestinaisDietas intestinais
CATEGORIA DA DIETA DIETAS COMERCIAISPROTEÍNA/CARBOHIDRATOS/
FIBRA/OUTROS
Hills canine w/d (húmido e seco)
Hills canine r/d (húmido e seco)
Hills w/d húmido: fibra de celulose (fibra insolúvel); seco: casca de amendoim (fibra insolúvel)
Hills r/d húmido: celulose (fibra insolúvel); seco: cascas de amendoim (fibra insolúvel)
IVD hú id l l f i h d
Rica em fibra (pouca gordurae muita fibra)
IVD canine hifactor formula (húmido e seco)
Royal canin waltham canine High fiber diet (seco)
Purina canine DCO formula (seco)
Canine OM formula (seco e húmido)
IVD húmida: celulose, farinha de arroz & fibra (mistura de fibras), FOS, óleo de peixe
Waltham: farelo de trigo & celulose (mistura de fibras)
Purina DCO seco: polpa de beterraba, fibra de ervilha (mistura), óleo de peixe
Purina OM húmido: fibra de ervilha & polpa de beterraba (mistura); seca: celulose, glúten de trigo (mistura)
PrognósticoPrognóstico
Reservado?Bom?
Resposta ao tratamento?
IBD
Enterite Linfoplasmocítica
SIBO
Obrigadopela
atenção
BibliografiaBibliografia• Ettinger, S. J. and Feldman, E. C. (2000). Textbook of
Veterinary Internal Medicine: diseases of dog and cat, 5th Edition, WB Saunders Company
• Nelson, R. W. e Couto, C. G. (2003). Small Animal Internal medicine, 3rd Edition, Mosby Inc.
• Tennant, B (2005). BSAVA small animal formulary, 5th
Edition, British Small Animal Veterinary Associaton• Jain, N. C. (1993). Essentials of veterinary hematology,
F biFebinger• Hall, E. J. ; Simpson, J. W. ; Williams, D. A. (2005).
BSAVA Manual of canine and feline gastroenterology 2 nd Edition, British Small Animal Veterinary Associaton
• Case, L. P. ; Carey, D. P. ; Hirakawa, D. A. (2000). Canine and Feline Nutrition, a resource for companion animal professionals, 2nd edition, Leighann Daristotle
• Gruffydd-Jones, T. J. (2006) Inflammatory bowel disease – current concepts in etiology and control, Hill’s european symposium on advance in feline medicine
151
152
5. Sistema de avaliação de Escore de Condição Corporal (ECC) em cães
(adaptado de Laflamme, 2008)
153
6. Escore Fecal
0 - fezes líquidas;
1 - fezes pastosas e sem forma;
2 - fezes macias, mal formadas e que assumem o formato do recipiente de colheita;
3 - fezes macias, formadas e úmidas, que marcam o piso;
4 - fezes bem formadas e consistentes e que não aderem ao piso;
5 - fezes bem formadas, duras e secas.
Fezes de escore 4 são ideais, escores inferiores indicam má absorção e escore 5 fezes
ressecadas (Carciofi, 2008d).
1 2 3
4 5 6 7. Escore de Doença (classificação da condição do animal)
1. Paciente normal, sem doença sistémica. Afecção localizada
2. Paciente com doença sistémica moderada.
3. Paciente com doença sistémica severa e limitante, mas não incapacitante.
4. Paciente com doença sistémica incapacitante, que representa uma ameaça constante à
vida.
5. Paciente moribundo, sem esperança de viver mais de 24 horas, com ou sem tratamento. (adaptado de Brunetto, 2008a)
154
8. Protocolo para Nutrição Parenteral Parcial (NPP) (Adaptado de Carciofi, 2008)
Disciplina de Clínica das doenças carenciais, endócrinas e metabólicas.
Serviço de Nutrição Clínica da FCAV – Campus Jaboticabal (Unesp).
O protocolo para NPP em cães obedece aos seguintes cálculos:
1 - necessidade energética de repouso, NER = 70 x (peso em kg) 0,75 = “A” Kcal/dia.
2 - necessidade hídrica: 70 x peso vivo em Kg = “B” mL de fluido dia.
3 - volume de dextrose 50% (30% da necessidade calórica diária do animal será suprida
pela glicose):
A/3 = “C” Kcal por dia provindas da dextrose, cada mL de dextrose 50% contém 1,7Kcal:
C/1,7 = “D” mL de dextrose 50% ao dia.
4 - volume de lípidos 20% (20% da necessidade calórica diária):
A/5= ‘E” Kcal por dia, provindas desta solução; cada mL de lípidos contém 2 Kcal.
“E”/2 = “F”mL de lípidos ao dia.
5 - volume de aminoácidos (atende-se a 50% das necessidades proteicas).
Para cães, a necessidade diária é de 3 g para cada 100 Kcal de energia metabolizável.
A/2 = “F” Kcal provindas dos aminoácidos. A necessidade proteica em gramas por dia será
“G” = (“F”x3) /100. Para cada 100 mL de solução de aminoácidos a 10%, têm-se 10 g de aa.
“G”x 10 = “H”mL da solução de Aa 10%.
6 - vitaminas do complexo B (CB) devem ser suplementadas caso o paciente não estiver a
receber por outra via. Utilizar 1 mL de CB para cada 100 Kcal de energia metabolizável:
“I”mL de CB = A /100 (proteger da luz com papel de alumínio!).
7 - Ringer Simples: o volume da solução de fluido que será administrado deve ser subtraído
do volume das demais soluções já calculadas,
pela fórmula “J” = B – (D+F+H).
8 - Sódio e potássio devem ser adicionados caso o paciente não esteja a recebê-los. Os
cálculos irão depender da solução de fluido que está a ser administrada e da composição
em electrólitos das demais soluções. O objectivo final é que a mistura de NP apresente 30
mEq/L de K e 0,9 g de Na para cada 100 mL de solução a ser infundida.
9 - A suplementação de arginina é recomendada para a grande maioria dos pacientes que
recebem nutrição parenteral. Utilizar uma ampola de Ornitagin® para cada 10 Kg de peso
corporal.
10 - Suplementar vitamina K na dose de 0,5 mg/Kg/SC no 1º dia e depois semanalmente.
11 - Utilizar a velocidade de infusão de 4-6 mL /Kg de peso corporal/hora.
A mistura deve ser feita da forma mais asséptica possível. Recomenda-se a seu preparação
em capela de fluxo laminar, mas pode utilizar-se o centro cirúrgico. O frasco de solução
155
depois de aberto deve ser refrigerado, observando-se as recomendações do fabricante
(Carciofi & Brunetto, 2005). O protocolo de monitorização dos pacientes que estão receber a
TNP deve, se possível, incluir (Seim & Bartges, 2003): avaliação dos sinais vitais a cada 6
ou 12 horas (temperatura, pulso, membranas mucosas, frequência respiratória); pesar os
animais todos os dias; mensurar a glicémia a cada 6 ou 12 horas de início e depois a cada
72 horas; determinar a concentração de electrólitos a cada 24 horas durante os primeiros 2
ou 3 dias; determinar a ureia sérica 12 horas após o início da nutrição; determinar
hematócrito, sólidos totais, contagem de plaquetas e verificar a turgidez e coloração do
plasma a cada 24 horas por 2 a 3 dias, depois semanalmente; determinar hemograma
completo e perfil bioquímico (enzimas hepáticas e creatinina), uma ou duas vezes por
semana.