Produção da proteína recombinante Fator IX da coagulação sanguínea humana em células de...
-
Upload
espaco-cientifico-livre-projetos-editoriais -
Category
Documents
-
view
241 -
download
21
description
Transcript of Produção da proteína recombinante Fator IX da coagulação sanguínea humana em células de...

Produção da proteína recombinante Fator IX da coagulação sanguínea humana em células de mamífero
ANDRIELLE CASTILHO-FERNANDESLUCINEI ROBERTO DE OLIVEIRA
MARTA REGINA HESPANHOLAPARECIDA MARIA FONTES
DIMAS TADEU COVAS
1ª edição - 2014 c

ESPAÇO CIENTÍFICO LIVREprojetos editoriais

Duque de Caxias
2014
1ª edição
ANDRIELLE CASTILHO-FERNANDESLUCINEI ROBERTO DE OLIVEIRA
MARTA REGINA HESPANHOLAPARECIDA MARIA FONTES
DIMAS TADEU COVAS
ESPAÇO CIENTÍFICO LIVREprojetos editoriais
Produção da proteína recombinante Fator IX da coagulação sanguínea humana em células de mamífero

sEste conteúdo pode ser publicado livremente, no todo ou em parte, em
qualquer mídia, eletrônica ou impressa, desde que:
bAtribuição. Você deve dar crédito, indicando o nome do autor e da Espaço
Científico Projetos Editoriais, bem como, o endereço eletrônico em que o livro está disponível para download.
nUso Não-Comercial. Você não pode utilizar esta obra com finalidades
comerciais.
C 2013, Espaço Científico Livre Projetos Editoriais
_______________________________________________________________________
Ficha Catalográfica
C3521 Castilho-Fernandes, Andrielle;Oliveira, Lucinei Roberto de; Hespanhol, Marta Regina; Fontes, Aparecida Maria; Covas, Dimas Tadeu. aaaProdução da proteína recombinante Fator IX da coagulação sanguínea humana em células de mamífero / Andrielle Castilho-Fernandes / Autor Dois – Duque de Caxias, 2014.
aaa2,87 MB; il.; PDF
aaaISBN 978-85-66434-13-2
aaa1. Hemofilia B. 2. Fator IX recombinante. 3. Sistema Retroviral . I. Produção da proteína recombinante Fator IX da coagulação sanguínea humana em células de mamífero. II. Castilho-Fernandes, Andrielle. III. Oliveira, Lucinei Roberto de. IV. Hespanhol, Marta Regina. V. Fontes, Aparecida Maria. VI. Covas, Dimas Tadeu.
CDU 610 _______________________________________________________________________
Autores: Andrielle Castilho-Fernande; Lucinei Roberto de Oliveira; Marta Regina Hespanhol; Aparecida Maria Fontes; Dimas Tadeu CovasRevisão: Verônica C. D. da SilvaCapa: Verano Costa Dutra / Ima'gem: Svilen Milev / FREE IMAGES – (http://www.freeimages.com/browse.phtml?f=view&id=1010761)Coordenador: Verano Costa DutraEditora: Monique Dias Rangel DutraEspaço Científico Livre Projetos Editoriais é o nome fantasia da Empresa Individual MONIQUE DIAS RANGEL 11616254700, CNPJ 16.802.945/0001-67, Duque de Caxias, [email protected] / http://issuu.com/espacocientificolivre
ESPAÇO CIENTÍFICO LIVREprojetos editoriais
2014,

ESPAÇO CIENTÍFICO LIVREprojetos editoriais

ESPAÇO CIENTÍFICO LIVREprojetos editoriais

7
SUMÁRIO RESUMO................................................................................................................... 9 ABSTRACT............................................................................................................... 10 I. INTRODUÇÃO....................................................................................................... 11 1 – Hemofilia B.......................................................................................................... 11 2 – Caracterização Molecular do Fator IX: gene, RNAm e proteína……………….... 11 2.1 - Ativação do FIX……………………………………………………………………... 16 3 – Fator IX recombinante comercial………………………........................................ 18 4 – Expressão do FIX recombinante………………….……………......…................... 19 II. JUSTIFICATIVA.................................................................................................... 21 III. OBJETIVO............................................................................................................ 22 1 - Geral..................................................................................................................... 22
2 - Específicos.................................................................................................... 23 IV. MATERIAL E MÉTODOS..................................................................................... 24 A – MATERIAL BIOLÓGICO..................................................................................... 24 1 - Clone isolado a partir da biblioteca de cDNA....................................................... 24 2 - Cepas de Escherichia coli.................................................................................... 24 3 - Vetores................................................................................................................. 24 4 - Linhagens celulares de mamíferos...................................................................... 26 B – MÉTODOS.......................................................................................................... 28 1 - Clonagem do cDNA de fator IX em vetor de expressão...................................... 29 1.1 - Preparação do vetor e expressão..................................................................... 29 1.2 - Preparação do inserto de DNA relativo ao cDNA do fator IX............................ 29 1.3 - Ligação do gene isolado no vetor de expressão............................................... 32 1.4 - Preparação de bactérias competentes.............................................................. 32 1.5 - Transformação bacteriana................................................................................ 33 1.6 - Extração do DNA plasmidial retroviral............................................................... 33 1.7 - Análise da extração do DNA plasmidial retroviral............................................. 33 2 - Sequenciamento do DNA..................................................................................... 33 3 - Transfecção do DNA plasmidial retroviral recombinante na linhagem celular
EcoPack2-293................................................................................................... 34
4 - Transdução retroviral em linhagens celulares RetroPack2TM-PT67, CHO, Hek-293 e Hep-G2.......................................................................................................
34
5 - Análise da expressão do RNA mensageiro.......................................................... 35 6 - Imunodetecção da proteína recombinante Fator IX por citometria de
fluxo...................................................................................................................... 36
7 - Análise da atividade biológica do Fator IX recombinante.................................... 37 8 - Caracterização do rFIX presente no sobrenadante das linhagens celulares
Hek-293/rFIX e Hep-G2/rFIX............................................................................... 38

8
V. RESULTADOS...................................................................................................... 40
1 - Clonagem do cDNA relativo ao FIX no vetor plasmidial retroviral pLXIN..........................................................................................................
40
2 - Sequenciamento do cDNA relativo ao FIX clonado no vetor pLXIN......... 41
3 - Geração de uma linhagem celular ecotrópica portadora em seu genoma do cDNA relativo ao rFIX...............................................................................
42
4 - Expressão permanente do RNA mensageiro relativo ao FIX na linhagem celular ecotrópica EcoPack™-293/FIXr/GFP+............................
43
5 - Geração de uma linhagem celular dualtrópica portadora em seu genoma do cDNA relativo ao rFIX..............................................................
44
6 - Geração de três linhagens celulares de mamífero portadoras em seu genoma do cDNA relativo ao rFIX: CHO, Hek-293 e Hep-G2....................
46
7 - Análise da atividade biológica do rFIX presente no sobrenadante das linhagens celulares CHO/rFIX, Hek-293/rFIX e Hep-G2/rFIX.............................
51
8 - Análise da proteína rFIX presente no sobrenadante de Hek- 293/rFIX e Hep-G2/rFIX por western blot.......................................................................................
52
VI. DISCUSSÃO........................................................................................................ 55 VI. CONCLUSÃO...................................................................................................... 58 VIII. REFERÊNCIAS.................................................................................................. 59 r

9
RESUMO
hemofilia B é uma doença ligada ao cromossomo X e consiste na deficiência do fator IX da coagulação sanguínea. O cDNA relativo ao fator IX apresenta 1.4 kb e codifica uma proteína de 281 aminoácidos e peso molecular de 57 kDa.
Atualmente, existe no Brasil cerca de 1300 pacientes hemofílicos B e a forma de tratamento envolve o uso do fator IX derivado do plasma (pdFIX). O custo deste produto é muito elevado e está sujeito a contaminação viral que não é eliminada por completo durante o processo de purificação do pdFIX. Isso gera incentivo para a produção do mesmo em sistemas celulares in vitro de origem brasileira, livre de agentes infecciosos. O objetivo principal desse trabalho consistiu em clonar e expressar o cDNA relativo ao FIX da coagulação sanguínea humana em células de mamífero utilizando o sistema retroviral. A estratégia experimental consistiu em isolar e clonar o cDNA a partir de um clone de cDNA previamente isolado de uma biblioteca de fígado humano. O cDNA relativo ao fator IX foi isolado deste clone por meio de PCR e subsequentemente foi submetido a digestão com enzimas de restrição específicas para a clonagem no vetor retroviral pLXIN. Em seguida foi confirmada a autenticidade do clone recombinante por meio do sequenciamento de DNA. O vetor de expressão recombinante, pLXIN-rFIX, foi transfectado na linhagem produtora de retrovírus Eco-Pack2™-293. Pela técnica de “ping-pong” os vírus produzidos por essa linhagem EcoPack2™-293/rFIX+ foram utilizados para infectar a linhagem empacotadora de retrovírus Retro-Pack2™-PT67. A análise por citometria de fluxo mostrou que a população RetroPack2TM-PT67/rFIX+ apresenta elevados níveis de rFIX, da ordem de 96%. Finalmente, os vírus produzidos pela RetroPack2TM-PT67/rFIX+ foram utilizados para transduzir três linhagens celulares de mamífero: CHO, Hek-293 e Hep-G2. A presença do mRNA relativo ao FIX foi mostrado nas três linhagens recombinantes por RT-PCR. Também a presença da proteína citoplasmática rFIX foi demonstrada por citometria de fluxo nas três linhagens celulares em diferentes níveis (CHO/rFIX+ - 14,5%; Hek-293/ rFIX+ - 21% e Hep-G2/rFIX+ - 46%). Em seguida, a análise da atividade biológica do rFIX produzido por essas linhagens celulares mostrou a secreção de altos níveis de FIX biologicamente ativo, em duas linhagens Hep-G2/rFIX+ (2,4 IU/mL/24 h) e Hek-293/rFIX+ (11 IU/mL/24 h) e a ausência do mesmo na linhagem CHO/rFIX+. Finalmente, os sobrenadantes das culturas que mostraram apresentar o FIX biologicamente ativo foi caracterizado por western blot confirmando a presença de uma banda imunoreativa esperada de 57 kDa. Em conjunto, esse trabalho mostrou a potencialidade do sistema retroviral para a expressão do FIX humano em linhagens celulares de mamífero e a existência de peculiaridades em cada linhagem as quais podem proporcionar diferentes níveis de expressão e produção do FIX biologicamente ativo. Esse trabalho permitiu estabelecer toda a tecnologia para geração de linhagens celulares transgênicas produtoras de rFIX e futuros estudos em modelos animais poderão ser conduzidos para a elucidação minuciosa da molécula recombinante rFIX aqui gerada. Palavras-chave: Hemofilia B, Fator IX recombinante e Sistema Retroviral.
A

10
ABSTRACT
emofilia B is an illness linked to chromosome X and consists of a deficiency of factor IX blood coagulation. The relative cDNA of factor IX has 1,4 kb and codifies a protein of 281 amino acids with 57 kDa. Currently, in Brazil there are
about 1300 hemophilic B patients and the treatment form involves the use of factor IX derived from the plasma (pdFIX). The cost of this product is expensive and it is subject to viral contamination that is not completely eliminated during the pdFIX purification process. This motivates the production of a Brazilian product in vitro, free of infectious agents. The main objective of this work consisted of clone and expressing relative cDNA of human factor IX of blood coagulation in mammal cells using the retroviral system. The experimental strategy was first isolating and then cloning the factor IX gene from one clone of previously isolated cDNA of a library of human liver. The relative cDNA of factor IX was isolated of this clone by PCR and after that, it was submitted to digestion with specific restriction enzymes for the cloning in the retroviral plasmidial vector pLXIN. After that, the authenticity of recombinant clone was confirmed by DNA sequencing. The recombinant vector expression, pLXIN-rFIX, was transfected into producing cell line of retroviruses, Eco-Pack2™-293. By using the ping-pong technique, the viruses produced by this cell line EcoPack2™-293/rFIX+ were used to transducer the Retro-Pack2™-PT67, in order to increase the recombinant retroviral title. The analysis by flow cytometry showed the RetroPack2TM-PT67/rFIX+ population with high levels of rFIX (96%). Finally, the viruses produced by RetroPack2TM-PT67/rFIX+ were used to transduce three mammal cell lines : CHO, Hek-293 and Hep-G2. The presence of mRNA relative to the FIX was shown in these three recombinant cell lines by RT-PCR. Also, the presence of cytoplasmic protein rFIX was demonstrated by flow cytometry in these three cellular lines in different levels (CHO/rFIX+ - 14,5%; Hek-293/ rFIX+ - 21%; e Hep-G2/rFIX+ - 46%). After that, the analysis of the rFIX biological activity produced by these cellular lines showed the secretion of high levels of biological active FIX, in two lines Hep-G2/rFIX+ (2,4 IU/mL/24 h) and Hek-293/rFIX (11 IU/mL/24 h) and the absence in the CHO/rFIX+ line. Finally, the cultures supernatants that had shown FIX biological active were characterized by western blot confirming the presence of recombinant protein of 57 kDa. In set, this work showed the potentiality of retroviral system for the expression of human FIX in cellular mammal lines and the existence of peculiarities in each cell line which can provide different levels of expression and production of biological active FIX. This work allowed establishing the technology for generating rFIX cellular line producers and futures studies in animal models could be leaded for the understanding of rFIX recombinant molecule generated here. Keywordskey: Hemophilia B, Recombinant Factor IX, Retroviral System.
H

11
I. INTRODUÇÃO
1 – Hemofilia B
Hemofilia B é uma doença hereditária associada ao cromossomo X e consiste na deficiência do fator IX da coagulação sanguínea (CHOO et al., 1982; BITHELL, 1998; PEYVANDI et al., 2001). Também é conhecida como doença
de Christmas, em virtude do sobrenome do primeiro paciente descrito portador dessa doença (Stephen Christmas). Esse relato foi publicado no volume Christmas da Bristish Medical Journal em 1952 por um grupo britânico liderado por Rosemary Biggs, oito anos após a primeira descrição da Hemofilia A. Clinicamente, esta doença apresenta muitas similaridades com a hemofilia A, isto é, o paciente apresenta frequentes episódios de sangramento, na maioria das vezes em regiões muco-cutâneas, músculo-esquelético e em tecidos moles. O sangramento pode ocorrer também em outros espaços críticos como, por exemplo, no espaço intracranial ou retroperitoneal (ROBERTS; LILES, 1997). A hemofilia B é classificada em graus leve, moderado e grave de acordo com o nível de fator IX ativo presente no plasma. A forma leve possui níveis acima de 5% de fator IX ativo circulante, e os pacientes raramente sangram; a moderada apresenta de 1 a 5 % deste fator circulante, e os sangramentos são escassos; por outro lado, a forma grave da doença é definida por quantidades de FIX ativo inferiores a 1%, e os pacientes apresentam episódios de sangramento espontâneo nos músculos, articulações e nas mucosas (LILLICRAP, 1998; HIGH, 2001; FRANCO, 2001). Dados obtidos do Registro das Coagulopatias Hereditárias do Brasil em e apresentados pela Coordenação da Política Nacional de Sangue e Hemoderivados (CPNSH) do Ministério da Saúde mostram que no Brasil existem cerca de 1.299 hemofílicos do tipo B e o tratamento é realizado com o fator IX concentrado derivado do plasma, sendo administrado anualmente 30.000 IU/paciente (<http://portal.saude.gov.br/saude>).
2 – Caracterização Molecular do Fator IX: gene, RNAm e proteína s estudos de caracterização molecular do cDNA e do gene do fator IX iniciaram-se em 1982 por dois grupos, Kurachi & Davie de Washington e Choo e Brownlee de Londres (CHOO et al., 1982; KURACHI; DAVIE, 1982). Nestes
estudos foi mostrada a caracterização parcial do gene do fator IX. Posteriormente, esses mesmos grupos mostraram a caracterização completa do cDNA e do gene do fator IX (ANSON et al., 1984; YOSHITAKE et al., 1985), passos esses críticos em futuros estudos que visavam a clonagem e expressão do fator IX em células de mamíferos. Neste mesmo período, um terceiro grupo francês demonstrou a localização do gene do fator IX no braço longo do cromossomo X na banda Xq27.1 (CAMERINO et al., 1984) (FIGURA 1).
A
O

12
Figura 1 - Localização do gene do fator IX. O gene do fator IX está situado no braço
longo do cromossomo X na banda Xq27.1 O gene do fator IX contém 33.5 kilobases (FIGURA 2 A), incluindo sete íntrons e oito éxons. O transcrito possui 2.803 bases, composto por uma pequena região 5’ UTR de 29 bases, 1.383 bases correspondentes a região codificadora e uma região 3’ UTR de 1.390 bases (KURACHI; DAVIE, 1982; YOSHITAKE et al., 1985; para rev. BOWEN, 2002) (FIGURA 2 B). O fator IX é uma glicoproteína plasmática dependente de vitamina K, sintetizada inicialmente no hepatócito como uma proteína precursora de peso molecular 57 kDa (DI SCIPIO et al., 1978; TARAN,1997). É também conhecida como zimogênio (forma inativa) de serino-protease e ativada proteoliticamente, de acordo com a via de coagulação moderna, pelo complexo Fator VIIa/fator tecidual, o que resulta na formação de sua forma ativada denominada FIXa (para rev. SCHMIDT; BAJAJ, 2003). A ativação do fator IX ocorre no plasma após a clivagem em duas regiões (Arg145-Arg146 e Arg180-Val181) resultando na formação das cadeias leve (N-terminal de 145 aminoácidos e peso molecular de 16 kDa) e pesada (C-terminal de 234 aminoácidos e peso molecular 29 kDa) as quais são unidas por uma única ponte dissulfídica entre os resíduos de cisteína 132 e 279 (para rev. SCHMIDT; BAJAJ, 2003). A proteína deduzida da sequência de nucleotídeos do cDNA do gene do fator IX contém 461 aminoácidos. Nesta forma é conhecida como proteína precursora e contém o peptídeo sinal de 27 aminoácidos que encaminha a proteína para o retículo endoplasmático e em seguida apresenta a sequência pró-leader a qual é reconhecida
pela enzima -glutamil carboxilase (FIGURA 2 C e 3). Esses dois segmentos peptídicos são removidos antes da proteína ser secretada para a circulação (FURIE B.C.; FURIE B., 1995). Além da remoção das sequências pré e pró-peptídica, o fator IX, antes de sua
secreção, apresenta cinco outras modificações pós-traducionais, entre eles: -
carboxilação; -hidroxilação; glicosilação; sulfatação e fosforilação. Algumas modificações ocorrem no retículo endoplasmático rugoso (RER) e outras no Complexo de Golgi e em conjunto têm a finalidade de que a proteína atinja em sua estrutura o dobramento adequado, a sua secreção seja apropriada e o seu funcionamento tornando-a biologicamente ativa se necessária (KAUFMAN, 1998; WHITE et al.,1998; LILLICRAP, 1998).

13
Abaixo temos as principais características do FIX (FIGURA 2 e 3):
1) peptídeo sinal – da metionina -46 ao ácido glutâmico -20. É clivado pela enzima peptidase sinal do REG e codificado pelo éxon 1 (117 pb);
2) região propeptídica – da cisteína -19 a arginina -1. É o sítio de reconhecimento
para a interação com a enzima -glutamil carboxilase dependente de vitamina
K, a qual é responsável pela -carboxilação dos 12 resíduos de ácido glutâmico (posições 7, 8, 15, 17, 20, 21, 26, 27, 30, 33, 36 e 40) do domínio GLA da proteína. É codificada pelo éxon 2 (164 pb);
3) domínio GLA – da tirosina 1 ao ácido glutâmico 40. Além das modificações
pós-traducionais acima mencionadas esse domínio apresenta elevada afinidade por íons cálcio (Ca2+), os quais juntamente com a pequena região hidrofóbica (fenilalanina 41 a valina 46) são necessários para a interação do FIX com lipídeos da membrana plasmática durante a coagulação sanguínea. É codificado pelos éxons 2 (164 pb) e 3 (25 pb);
4) dois domínios de fator de crescimento epidérmico – do ácido aspártico 47 a
arginina 145. O domínio EGF-1 do aminoácido 47 ao 83 apresenta dois tipos
de modificações pós-traducionais: a) -hidroxilação do ácido aspártico 64 e b) glicosilação dos aminoácidos serina (S53 e S61). Esse domínio contém sítios de interação com íons Ca2+. O domínio EGF-2 (da cisteína 88 a asparagina 145) apresenta sítios de interação com as plaquetas e o FVIIIa. Os dois domínios são unidos por uma região linker de 4 aminoácidos (leucina 84 a treonina 87). Esses domínios são codificados pelos éxons 4 (114 pb) e 5 (129 pb);
5) peptídeo de ativação – da alanina 146 a arginina 180. Esse domínio é
responsável pela conversão do zimogênio serino-protease FIX para a forma FIXa. Durante a ativação esse domínio é removido gerando a cadeia leve (da tirosina 1 a arginina 145 = domínio GLA + domínio EGF-1 e EGF-2) e cadeia pesada (da valina 181 a treonina 415). Esse domínio apresenta três principais modificações pós-traducionais, entre elas: a) sulfatação na tirosina 155; b) glicosilação em seis aminoácidos (asparagina 157 e 167 e treonina 159, 169, 172 e 179) e c) fosforilação na serina 158. É codificado pelo éxon 6 (203 pb);
6) domínio catalítico – da valina 181 a treonina 415. Possui a tríade catalítica
conservada das enzimas serino-proteases (Histidina221, Serina365 e Ácido aspartico264). Como mencionado acima consiste na cadeia pesada do fator IX. É codificado pelos éxons 7 (115 pb) e 8 (1.935 pb).

14
Figura 2 – Gene, RNA mensageiro, Proteína precursora e Proteína madura do FIX. (A) Organização genômica do gene fator IX humano, os éxons estão numerados de 1 - 8. (B) RNAm do fator IX mostrando as regiões 5’ e 3’UTR e a região codificadora. (C) proteína de Fator IX precursora, compreendendo as sequências PRÉ (peptídio sinal), PRÓ (propetídio) e com um peptídeo maduro de 415 aminoácidos, que contém a região ativação (peptídio de ativação). (D) Fator IX ativado composto por cadeia leve (N-terminal) e uma cadeia pesada (C-terminal) unidas por uma ponte dissulfídica entre os resíduos de cisteína 132 e 279. Possui as regiões GLA (domínio GLA), EGF (domínios de fator de crescimento epidêrmico) e catalítico (domínio serino-protease) (modificado de BOWEN, 2001)

15
Figura 3 - Estrutura primária do Fator IX humano com sua sequência de aminoácidos e respectivos domínios. Os aminoácidos que apresentam modificação pós-traducionais se encontram destacados. No peptídeo sinal o aminoácido metionina (M) é destacado em rosa. No domínio GLA os doze resíduos de Glu estão sublinhados e em vermelho. No domínio EGF-1 as S53 e S61 estão em verde; e o D64 em lilás. A posição de clivagem do peptídeo de ativação é encontrada em azul escuro R145 e R180. No peptídeo de ativação a Y155 sulfatada é destacada em azul, em vermelho os resíduos glicosilados N157, N167, T159, T169, T172 e T179, e em verde claro a S158 fosforilada
PEPTÍDEO SINAL
-46 MQRVNMIMAE SPGLITICLL GYLLSAE
SEQUÊNCIA PROPETÍDEO
-19 CTVFLDHENA NKILNRPKR
DOMÍNIO GLA
1 YNSGKLEEFV QGNLERECME EKCSFEEARE VFENTERTTE
REGIÃO HIDROFÓBICA
41 FWKQYV
DOMÍNIO EGF-1
47 DGDQ CESNPCLNGG SCKDDINSYE CWCPFGFEGK NCE
LINKER 84 LDVT
DOMÍNIO EGF-2
88 CNI KNGRCEQFCK NSADNKVVCS CTEGYRLAEN QKSCEPAVPF
131 PCGRVSVSQT SKLTR
PEPTÍDEO DE ATIVAÇÃO
146 AETVFPDVDY VNSTEAETIL DNITQSTQSF NDFTR
DOMÍNIO CATALÍTICO
181 VVGGEDAKPG QFPWQVVLNG KVDAFCGGSI VNEKWIVTAA HCVETGVKIT
231 VVAGEHNIEE TEHTEQKRNV IRIIPHHNYN AAINKYNHDI ALLELDEPLV

16
2.1 – Ativação do FIX
o plasma humano o FIX encontra-se na concentração de 4-5 g/mL com uma meia vida de 18-24 horas (BUTENAS; MANN, 2002).
Como mencionado acima, os dois pontos essenciais para a ativação do fator IX envolvem:
1) a -carboxilação dos resíduos de glutamina que são essenciais para a ligação de cálcio ao domínio GLA, os quais por sua vez resultam em uma mudança conformacional na proteína que expõe os resíduos hidrofóbicos e permitem sua interação com a bicamada lipídica;
2) a clivagem da cadeia única em duas cadeias (leve e pesada) que permanecem unidas por uma ponte dissulfídica.
A respeito do mecanismo que governa a clivagem das ligações peptídicas e resulta na formação das cadeias leve e pesada há dois mecanismos propostos:
1) o primeiro modelo propõe que as duas clivagens do FIX são sequenciais. Inicialmente, ocorre a clivagem entre os resíduos Arg145-Ala146, produzindo o
intermediário FIX, e em seguida, ocorre a segunda clivagem entre os resíduos Arg180-Val181, que resulta na liberação do peptídeo de ativação e formação do
produto final FIXa (BURNIER et al., 1981); 2) o segundo modelo propõe que as duas clivagens proteolíticas ocorrem
simultaneamente sendo, portanto, utilizado uma única molécula de substrato. De acordo com esse modelo é inexistente a formação do produto intermediário
FIX (WOLBERG et al., 1997, FIGURA 4).
Figura 4 - Ativação do fator IX. As setas mais largas indicam a ativação do fator IX pelo fator VII/TF/Ca2+ por clivagens iniciais entre a cadeia leve (CL) e o peptídeo de
ativação (PA) produzindo um precursor inativo FIX. A segunda clivagem entre o PA e
a cadeia pesada (CP) libera o PA e gera o produto final denominado fator IXa. O caminho representado pela seta central degrade representa a ativação do fator IX pelo fator XIa. (figura modificada GAILANI, 2000) De acordo com o modelo clássico da coagulação sanguínea, conhecida como “Cascata da Coagulação”, a principal protease da coagulação responsável pela ativação do fator IX é o fator XIa, o qual se tornou ativado pelo Fator XIIa que por sua
N

17
vez se tornou ativado após a interação do fator XII com o cininogênio de alto peso molecular (HMWK), a pré-calicreina (PK) e o colágeno expostos na superfície endotelial após a lesão do vaso sanguíneo (DAVIE; RATNOFF, 1964; MACFARLANE, 1964). Vários avanços ocorreram no conhecimento dos mecanismos da coagulação sanguínea. Nos últimos anos, entende-se melhor a importância da superfície celular como o sítio contendo receptores específicos que organizam os processos hemostáticos. De acordo como o modelo moderno da coagulação sanguínea, o complexo FT/VIIa seria o principal ativador do fator IX. Desta maneira, em uma primeira fase, uma célula (fibroblasto, monócito ou endotélio) expressaria o fator tecidual (FT), o qual se associaria com o fator VIIa e conduziria à geração de Xa, IXa e trombina. Em uma segunda fase, a reação se moveria para a superfície das plaquetas, as quais são ativadas, bem como os co-fatores da coagulação (V e VIII). O fator VIIIa, como no modelo anterior, é o co-fator do fator IXa e ativa o fator X convertendo-o em FXa. Este se associa com o fator Va formando o complexo FXa/FVa/Ca2+/fosfolipídeos, que resulta na formação de trombina. Esta, por sua vez, converte o fibrinogênio em fibrina e consequentemente a formação do coágulo (HOFFMAN, 2003; ROBERTS; ESCOBAR; MONROE, 2004; BUTENAS et al., 2004, FIGURA 5).
Figura 5 – Novo modelo da cascata de coagulação sanguínea. De acordo com esse modelo não há separação das vias intrínseca e extrínseca. O fator tecidual e o fator VII são os componentes centrais do mecanismo hemostático. Inicialmente após a lesão, o fator VII é ativado através da ligação como fator tecidual. A seguir, o complexo TF/VIIa se liga e ativa o fator X e IX. O fator Xa na presença do fator Va converte a protrombina em trombina. Por outro lado, o fator IXa na presença de fator VIIIa, Ca2+ e a membrana das plaquetas, ativa uma maior quantidade de fator X, o qual gera ainda mais trombina. Algumas dessas trombinas ativam o fator XI que ativa o fator IX em um episódio de amplificação (figura modificada HOFFMAN et al., 2003)

18
3 – Fator IX recombinante comercial
tualmente existe apenas um Fator IX recombinante licenciado pelo US Food and Drug Administration para o uso clínico no tratamento da hemofilia B, o
BeneFIX (THOMPSON, 1998; <http://www.fda.gov/cber/efoi/approve.htm>).
A produção do Fator IX recombinante, BeneFIX envolveu quatro etapas. Inicialmente, em meados da década de 80 foi realizado o isolamento e clonagem do cDNA relativo ao fator IX a partir de uma biblioteca de cDNA de fígado humano (KAUFMAN et al., 1986). A clonagem do FIX foi realizada em um vetor de expressão plasmidial convencional e o mesmo foi transfectado na linhagem celular de ovário de hamster chinês (CHO) deficiente em dihidrofolato redutase (DHFR). Para a seleção de uma linhagem celular produtora de elevados níveis de rFIX foi realizada a co-transfecção com um plasmídeo portador do gene da DHFR. Após a seleção com alta estringência de metotrexato, seguido do tratamento com vitamina K foi possível a obtenção de uma população celular recombinante cujo nível de FIX biologicamente ativo presente no sobrenadante da cultura celular foi da ordem de 0,8 IU/mL. Esse nível de FIX inferior ao nível de FIX presente no plasma poderia ser explicado pelo processamento parcial da proteína recombinante. De fato, estudos, em paralelo, envolvendo a caracterização de outras proteínas plasmáticas, entre elas, pro-albumina e pro-Fator von Willebrand mostraram a importância da enzima PACE-SOL (serino-protease PACE, do inglês Paired basic Amino acid Cleaving Enzyme) para o processamento completo das mesmas (BRENNAN; PEACH, 1991; WISE et al., 1990). Tendo isso em mente, sete anos mais tarde, em uma segunda etapa do processo de produção do rFIX, esse mesmo grupo mostrou que a co-transfecção da linhagem recombinante CHO/rFIX com o cDNA relativo ao gene PACE-SOL humano resultou em um aumento de 2-3 vezes na quantidade de FIX biologicamente ativo no sobrenadante dessas culturas celulares (WASLEY et al., 1993). A terceira etapa consistiu na adaptação da linhagem celular recombinante CHO/rFIX para o crescimento em suspensão, em meios de cultura isentos de produtos de origem animal e de proteínas derivadas do plasma humano. Finalmente, a quarta etapa consistiu na adaptação ao crescimento em biorreatores inicialmente em pequena escala (250 litros), seguido de biorreatores em larga escala (2500 litros). O sobrenadante de cultura dessa suspensão celular foi submetido a várias etapas de purificação e concentração resultando na obtenção do liofilizado
conhecido BeneFIX. Em 11 de fevereiro de 1997, a organização americana FDA (Food and Drug Administration) aprovou a comercialização desse produto pela empresa Genetics Institute (Cambridge/Andover, MA) (WHITE; BEEBE; NIELSEN, 1997; HARRISON et al.,1998). Esse produto foi patenteado sob número US Patent
5.171.569 (http://www.freepatentsonline.com/). Em 2003, a organização United Kingdom Haemophilia Center Doctors Organization (UKHCDO) publicou no periódico Haemophilia Journal a estratégia para a seleção dos
pacientes portadores de hemofilia B que se tornam aptos ao uso do BeneFIX como forma de tratamento (UKHCDO, 2003). O produto recombinante tem sido fabricado em apenas algumas regiões por uma única empresa e isso leva a uma carência no fornecimento do produto. Atualmente no Reino Unido todos os hemofílicos podem ser tratados com o recombinante, porém na
A

19
América do Norte uma fração significativa recebe o tratamento com o fator IX derivado do plasma (SCHULTE, 2013; YU; MILLAR, 2014). A situação brasileira é um pouco diferente. Até o momento, nosso país não apresenta tecnologia para a produção do fator IX derivado do plasma, bem como do fator IX recombinante. Temos uma dependência total de produtos importados. O plasma brasileiro é fracionado por companhias europeias e retorna ao país na forma de concentrado de fator liofilizado, tendo assim um elevado custo. O Brasil é um dos maiores consumidores mundiais dos fatores concentrados (ANTUNES, 2005; REZENDE; PIMENTEL; ARAÚJO, 2005). É estimado um gasto anual de US$ 120 milhões para o tratamento dos hemofílicos (<http://portal.saude.gov.br/saude>). Outro problema mundial a respeito do uso do fator IX derivado do plasma diz respeito à contaminação com agentes virais. Apesar dos avanços biotecnológicos que conduziram ao aprimoramento das metodologias de inativação viral, permitindo formulações mais seguras de fator IX derivado do plasma (pdFIX), a possibilidade de contaminação com parvovírus B19, príons infecciosos que causam a nova variante da doença de Creutzfeldt-Jakob (vCJD) e outros vírus emergentes é uma preocupação frequente (BURNOUF, 2007; SERBAN et al., 2012; BJÖRKMAN, 2013 ).
Em conjunto, o alto custo do BeneFIX e sua quantidade disponível limitada no mercado tem incentivado a comunidade científica ao desenvolvimento de novas formulações de rFIX tornando-o mais acessível a população de hemofílicos B (BOLTON-MAGGS, 2006; LAMBERT et al., 2007; POWELL et al., 2013, Liu et al., 2014).
4 – Expressão do FIX recombinante
as últimas décadas, a produção em larga escala de proteínas recombinantes em células de mamíferos vem sendo objeto de intensa pesquisa (WURM, 2004). Em todos os casos, o passo primordial é a caracterização bioquímica e
molecular da proteína de interesse o que conduzirá ao desenvolvimento de estratégias específicas de produção em cada situação. Por exemplo, no caso do fator VIII, seu elevado peso molecular (300 kDa), cinco vezes maior que o tamanho do FIX (57 kDa) conduziu aos pesquisadores desenvolverem moléculas recombinantes com um domínio deletado (redução de 40% do peso molecular) sem comprometimento de sua atividade biológica (BOWEN, 2002; LIND et al., 1995). Por outro lado, no caso do FIX, apesar do peso molecular não ser um fator limitante, a
complexidade das modificações pós-traducionais, entre elas, -carboxilação, -hidroxilação, remoção do domínio pró-peptídico, e outras, conduziram a comunidade científica focarem seus estudos iniciais na investigação da linhagem celular mais apropriada para a produção do fator IX biologicamente ativo utilizando o sistema plasmidial convencional e o vetor viral vaccinia (ANSON; AUSTEN; BROWNLEE, 1985; DE LA SALLE et al., 1985; BUSBY et al., 1985; KAUFMAN et al., 1986). Nestes estudos as moléculas recombinantes foram produzidas em linhagens celulares de hepatoma de rato (H4-11-E-C3) e humano (HepG2), fibroblasto (LM-TK e 4A) de camundongo e rim (BHK) e ovário (CHO) de hamster. Nesse período, a análise do fator IX recombinante presente no sobrenadante destas culturas celulares mostraram que não foi possível a produção de elevados níveis de fator IX biologicamente ativo nessas linhagens celulares (ANSON; AUSTEN; BROWNLEE, 1985; DE LA SALLE et al., 1985; BUSBY et al., 1985; KAUFMAN et al., 1986). Alguns pesquisadores sugeriram que o mesmo poderia ser explicado pela
N

20
ausência de um sistema -carboxilase eficiente na linhagem celular em estudo (ANSON; AUSTEN; BROWNLEE, 1985). Para contornar esse problema, optou-se pelo tratamento das linhagens recombinantes com vitamina K. De fato, nesses estudos foi mostrado um aumento de pelo menos 2 vezes no nível de fator IX ativo após a adição de vitamina K ao meio de cultura. Entretanto, em todos os casos, os níveis de rFIX foram inferiores à quantidade de fator IX presente no plasma (1 IU/mL = 5 μg/mL) (DE LA SALLE et al., 1985; BUSBY et al., 1985). Em conjunto, estes estudos demonstraram a importância da vitamina K como um co-fator do fator IX, bem como, a importância do desenvolvimento de novos vetores de expressão que permitissem a expressão estável e duradoura do rFIX pela linhagem celular. Neste sentido, nas décadas seguintes, houve o desenvolvimento de outros sistemas de expressão, em particular, sistema de expressão adenoviral, adeno-associado e retroviral, o que resultou na geração de novas linhagens celulares recombinantes produtoras de fator IX (GORDON et al., 1993; SMITH et al., 1993; MIAO et al., 2000; NATHWANI et al., 2001; WAJIH et al., 2005). Nestes estudos, as linhagens celulares utilizadas foram HepG2, BHK, Hep1A (hepatoma de camundongo), NMH (hepatócito de camundongo não transformado) e C57B1/6 (mioblasto primário de camundongo). De maneira sucinta, a análise do rFIX presente no sobrenadante destas culturas celulares mostrou que independente do sistema de expressão, em todos os casos, a linhagem celular HepG2 se mostrou mais eficiente para a produção do fator IX recombinante, quando comparado às demais linhagens celulares (GORDON et al., 1993; SMITH et al., 1993; MIAO et al., 2000, NATHWANI et al., 2001). Esses estudos mostraram ainda, de forma definitiva, a importância da vitamina K, como co-fator para a produção do FIX. Em linhagens celulares BHK produtoras de rFIX utilizando o sistema retroviral, a super-expressão de uma segunda proteína recombinante, no caso, a enzima VKORC1 (enzima epóxi-redutora do sistema de vitamina K) resultou em um aumento de três vezes no nível de fator IX presente no sobrenadante desta cultura celular, quando comparado a linhagem celular BHK/rFIX+ (WAJIH et al., 2005). Em conjunto, esses resultados mostram que o sistema retroviral é um sistema apropriado para a produção do fator IX recombinante e permite a geração de linhagens celulares com expressão estável e duradoura de rFIX. Entretanto, até o momento, a comparação sistemática do nível de produção do fator IX recombinante em diferentes linhagens utilizando um mesmo sistema de expressão é inexistente. Tendo isso em mente, e considerando as três principais vantagens dos vetores retrovirais, quando comparado aos demais vetores virais, que são: 1) possuir alta eficiência de transdução em vários tipos celulares; 2) permitir a integração do gene de interesse no genoma da célula alvo proporcionando uma expressão estável e duradoura e 3) apresentar deleções de genes virais que estão ligados a patogênese e replicação, evitando assim a expressão de antígenos imunogênicos ou proteínas virais, neste trabalho, optamos pelo uso do vetor retroviral comercial pLXIN para a construção de uma molécula recombinante do FIX e testamos a sua eficácia de produção em três linhagens celulares, CHO, HEK-293 e HepG2.

21
II. JUSTIFICATIVA
stima-se que, anualmente, 1 em 30 mil homens nascem com hemofilia B em todo o mundo. Os tratamentos atuais para hemofilia, como as infusões intravenosas de fator IX da coagulação, derivado do plasma ou do
recombinante, são caras e em quantidade limitada. Outro agravante na terapia de infusão do concentrado derivado do plasma é o risco de contaminação por patógenos presentes no plasma dos doadores, como os vírus da hepatite B (HBV), da hepatite C (HCV), o vírus linfotrófico de células T humanas (HTLV), os vírus da imunodeficiência humana (HIV), o parvovírus B19 e outros vírus emergentes. Em virtude de tais dificuldades, estudos baseados na produção de um produto terapêutico recombinante para o tratamento de hemofílicos vêm sendo desenvolvidos por pesquisadores em todo o mundo. Trata-se de empregar técnicas de biologia molecular, engenharia genética e biologia celular para isolar e expressar proteínas de interesse, livres de contaminantes, que facilitem o acesso, sobretudo do ponto de vista de custos e melhoramento da qualidade de vida aos pacientes. Uma vez administrados em hemofílicos, esperam-se resultados mais efetivos do que os alcançados pela terapêutica atual.
E

22
III. OBJETIVOS
objetivo desse trabalho consistiu em produzir a proteína recombinante Fator IX da coagulação sanguínea humana em diferentes linhagens de mamífero utilizando o sistema retroviral.
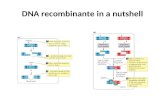
FLUXOGRAMA REPRESENTATIVO DA ESTRATÉGIA EXPERIMENTAL
1º) ETAPA: Clonagem e Produção retroviral
Figura 6 - Fluxograma referente à primeira etapa do projeto
O

23
2º) ETAPA: Expressão da proteína humana Fator IX recombinante em células de mamífero
Figura 7 - Fluxograma referente à segunda etapa do projeto

24
IV. MATERIAL E MÉTODOS
planejamento deste estudo foi resumido nas figuras 6 e 7.
A – MATERIAL BIOLÓGICA
1 – Clone isolado a partir da biblioteca de cDNA humano
DNA molde utilizado para a clonagem do cDNA relativo ao fator IX no vetor retroviral plasmidial foi purificado de uma biblioteca de cDNA de fígado humano denominada Lambda TriplEx e construída em fago (CLONTECH). O clone
isolado foi purificado após 4 ciclos de hibridação utilizando o cDNA gentilmente cedido pelo Prof. Dr. Marcelo Brígido do Departamento de Biologia Celular do Instituto de Ciências Biológicas da Universidade de Brasília.
2 – Cepas de Escherichia coli
cepa de E. coli DH10 foi utilizada como receptora para transformação, clonagem e propagação dos vetores de DNA plasmidial.
3 – Vetores
oram utilizados os seguintes vetores de DNA plasmidial:
-pLXIN – vetor plasmidial retroviral bicistrônico, designado a integração do gene de interesse no genoma da célula hospedeira. A região 5’ LTR é derivada do Moloney murine sarcoma virus (MoMuSV) e a 3’ LTR é derivada do Moloney Murine Leukemia Virus (MoMuLV). Contém o elemento IRES (Internal Ribosome Entry Site) entre o MCS (Multiple Cloning Site) e o gene Neo, o qual confere resistência a geneticina. Possui Col E1, região de origem de replicação em E. coli, o gene Amp que confere resistência a ampicilina e a região gênica designada a emitir o sinal de
empacotamento viral, +. Este foi utilizado para a clonagem do fragmento de 1.4 kb relativo ao cDNA do Fator IX da coagulação sanguínea humana. Este vetor está depositado na Clontech sob o número de acesso PT3155-5 (FIGURA 8); -pEGFP-C1 – vetor plasmidial portador do cDNA relativo ao gene gfp (Green Fluorescent Protein). Foi utilizado nos experimentos de co-transfecção por eletroporação com o vetor pLXIN-FIX. Este vetor está depositado na Clontech sob o número de acesso PT3028-5 (FIGURA 9); -pGEMFIX13 – vetor plasmidial portador do cDNA relativo ao gene fator IX, utilizado como controle positivo durante as reações de PCR (Polymerase Chain Reaction). Este vetor foi cedido gentilmente pelo Prof. Dr. Marcelo Brígido (FIGURA 10).
O
O
A
F

25
Figura 8 – vetor de DNA plasmidial retroviral bicistrônico. Nesse vetor foi clonado
o fator IX recombinante nos sítios HpaI e BamHI
Figura 9 – vetor de DNA plasmidial portador do cDNA relativo ao gene gfp
Figura 10 – Vetor de plasmidial portador do cDNA relativo ao fator IX. Utilizado
como controle positivo

26
4 – Linhagens celulares de mamíferos
a fase de transfecção e transdução de vetores recombinantes foram utilizadas as linhagens celulares aderentes:
EcoPack2TM-293 – linhagem celular utilizada para a produção de retrovírus recombinante. Os genes gag, env e pol são derivados do vírus de leucemia de murinos da família Moloney (MoMuLV). A partícula viral produzida por ela possui um envelope ecotrópico, podendo infectar camundongos e ratos. Essa linhagem celular é derivada de células de rim embrionário humano (HEK-293). Está depositada na Clontech sob o número de acesso C3203-1 (FIGURA 11); RetroPack2TM-PT67 - linhagem celular empacotadora de retrovírus, capaz de potencializar a produção dos títulos retrovirais recombinantes. Essa linhagem é derivada da linhagem celular de fibroblasto de camundongo (NIH/3T3), e apresenta em seu genoma os genes gag e pol derivados do MoMuLV, enquanto o gene env é derivado do vírus 10A1. O retrovírus produzido por esta linhagem possui um envelope dualtrópico, capaz de reconhecer receptores das linhagens celulares de camundongo, rato, hamster, gato, cachorro, macaco e humano. Esta depositada na Clontech sob o número de acesso K1060-D (FIGURA 12); Hep-G2 - linhagem celular de hepatócito humano, derivada de carcinoma hepatocelular. Está depositada no American Type Culture Collection (ATCC) sob o número de acesso HB-8065 (FIGURA 13); Hek-293 - linhagem celular de rim humano da fase embrionária. Está depositada no American Type Culture Collection (ATCC) sob o número de acesso CRL-1573 (FIGURA 14); CHO - linhagem celular de ovário de hamster chinês. Esta linhagem foi gentilmente cedida pelo Prof. Dr. Diógenes Santiago Santos do laboratório de Biologia Molecular e Funcional da Faculdade de Química da Universidade Federal de Rio Grande do Sul (FIGURA 15);
Figura 11 – Células EcoPack2TM-293 em cultura. Células observadas em
microscópio invertido de contraste de fase, em aumento de 100X. Observa-se o aspecto estrelado das células
N

27
Figura 12 – Linhagem celular RetroPack2TM-PT67 em cultura. Células observadas em microscópio invertido de contraste de fase, em aumento de 100X. Observa-se o
aspecto estrelado alongado das células
Figura 13 – Linhagem celular Hep-G2 em cultura. Células observadas em
microscópio invertido de contraste de fase, em aumento de 100X. Observa-se o aspecto fusiforme das células
Figura 14 – Linhagem celular Hek-293 em cultura. Células observadas em
microscópio invertido de contraste de fase, em aumento de 100X. Observa-se o aspecto estrelado das células

28
Figura 15 – Linhagem celular CHO em cultura. Células observadas em microscópio invertido de contraste de fase, em aumento de 100X. Observa-se o aspecto fusiforme
das células
B – MÉTODOS
s experimentos utilizados nesse trabalho tiveram como referência os protocolos descritos em Sambrook et al., 1989, com algumas modificações.
A estratégia utilizada para a geração de linhagens celulares recombinantes portadoras do fator IX humano utilizando o sistema retroviral é resumida na figura 16.
Figura 16 – Estratégia para a geração de uma linhagem celular de mamífero produtora de fator IX humano recombinante. Após a obtenção do cDNA relativo ao fator IX no vetor retroviral plasmidial pLXIN, o mesmo foi utilizado para a transfecção na linhagem celular produtora de retrovírus EcoPack2TM-293. Essa linhagem é uma linhagem celular transgênica portadora em seu genoma dos genes gag e pol em um
O

29
sítio e o gene env, em outro sítio impedindo a geração de retrovírus competente em replicação. Como o próprio nome diz, essa linhagem gera em seu citoplasma o RNAm recombinante relativo ao fator IX (B), o qual é empacotado em uma partícula viral. Essa partícula viral portando o FIX é utilizada para a infecção na célula alvo (C). Durante a infecção, a membrana do vetor viral se funde com a membrana citoplasmática da célula alvo, permitindo a entrada do RNA viral recombinante (C). O RNA viral é convertido em DNA fita-dupla pró-viral (D). Esse DNA é translocado para o núcleo e integrado no genoma da célula alvo (E). A célula alvo, agora portadora em seu genoma do cDNA relativo ao FIX, passa a expressá-lo constitutivamente. Após a síntese do RNAm do fator IX o mesmo é traduzido e a proteína recombinante secretada para o meio extracelular (figura modificada VERMA; SOMIA, 1997)
1 – Clonagem do cDNA de fator IX em vetor de expressão
1.1 – Preparação do vetor de expressão
nicialmente, foi realizada a linearização do DNA do vetor pLXIN, utilizando as enzimas de restrição BamHI e HpaI (Biolabs), conforme as instruções do fabricante. A seguir o DNA foi precipitado com acetato de sódio (concentração final 0,3M, pH
5,2) e etanol absoluto (2 ½ volumes) durante 16 horas à -20°C. Em seguida o DNA precipitado foi recuperado por centrifugação a 11.000 rpm durante 30 minutos, lavado
com etanol gelado 70% e purificado por meio do kit: QIAquick Gel Extraction Kit (QIAGEN) para a retirada das impurezas que poderiam interferir na reação de ligação com o produto de PCR (Polymerase Chain Reaction), o qual foi digerido com as mesmas enzimas. O DNA (pLXIN) purificado foi desfosforilado por meio de incubação com 0,2U de fosfatase alcalina de camarão [SAP - Shrimp Alkaline Phosphatase (USB)] e seu respectivo tampão (200mM Tris-HCl, pH 8.0, 100mM MgCl2), com o intuito de minimizar a possibilidade de recirculação do mesmo. Após a desnaturação dessa enzima 5μL do vetor de DNA foi misturado a 5μL de tampão (azul de bromofenol 0,25% e glicerol 30%) e aplicado em gel de agarose 1% (Sigma), contendo 0,1 μg/mL de brometo de etídio (Sigma). Como tampão de corrida utilizou-se TAE (40mM Tris-HCL, 20mM ácido acético e 1mM EDTA, pH 8,0). A eletroforese foi realizada a 100 V, durante 40 min, seguida da visualização através de
iluminação com UV a 300m. Uma fração do mesmo foi utilizada para a reação de ligação com o inserto de DNA do gene do fator IX.
1.2 – Preparação do inserto de DNA relativo ao cDNA do fator IX
ara a construção dos oligonucleotídios sintéticos, primers, foi utilizado como referencia a sequência de nucleotídeos depositados no GenBank (NCBI - National Center for Biotechnology Information) sob o número de acesso
NM_000133.2 com a denominação de Homo sapiens coagulation factor IX (plasma thromboplastic component, Christmas disease, hemophilia B) (F9), RNAm (FIGURA17). Foi realizada por PCR a amplificação do cDNA fator IX presente no clone previamente isolado de uma biblioteca de cDNA de fígado humano, utilizando os primers P5FIXKHP e P3FIXXINBAM (TABELA 1 e FIGURA 17 e 18). Procedeu-se a digestão enzimática utilizando BamHI e HpaI de acordo com os procedimentos descritos para a
I
P

30
preparação do vetor. A purificação da amostra do DNA digerido foi realizada por meio do Quiaex II Gel Extraction Kit (QUIAGEN), conforme as instruções do fabricante.
A amplificação do cDNA fator IX foi realizada em um volume final de 50l utilizando-se
20ng do clone de cDNA, 1L de P3FIXXINBAM e P5FIXKHP a 5 pmoles, 10mM de
uma mistura de dNTPs; 0,5L da enzima Taq DNA polimerase (Amersham Bioscience)
e 5L do tampão 10x (500mM KCl, 15mM MgCl2, 100mM Tris-HCl, pH 9.0) da respectiva enzima (Amersham Bioscience). Essa reação foi levada ao termociclador
GeneAmp® PCR System 9700 (Amplied Biosystems) com o programa: 95C por 2 min;
35 ciclos de 95C por 40 s, 55C por 40 s e 72C por 1 min; 72C por 10 min. A reação
de PCR foi estocada a 4C até o momento da análise em gel de agarose 1% como descrito no item 1.1.
Figura 17 – cDNA do FIX depositado no NCBI (NM_000133.2). Sequência de nucleotídeos do cDNA do fator IX, contendo as regiões 5’UTR, codificadora e 3’UTR, com 2.804pb. A região codificadora inicia-se na posição 30 e estende-se até a posição

31
1415. O aminoácido metionina é traduzido pelo códon ATG em rosa. A região 5’UTR é composto por 29 nucleotídeos; e a região 3’UTR por 1386 nucleotídeos. A cadeia leve é destacada em azul, o peptídeo de ativação compreende-se os nucleotídeos sublinhados em negrito. A cadeia pesada é destacada em vermelho. O códon de parada, TAA, encontra-se na cor roxa. Os primers, P5FIXKHP e P3FIXXINBAM, utilizados para a amplificação do cDNA estão indicados entre chaves verdes, e os primers,P5FIX3seq e P3FIX5seq, utilizados para a amplificação do RNAm na reação de RT-PCR estão indicados entre chaves marrom.
Figura 18 – Primers utilizados neste estudo. Acima os primers sense e abaixo os primers anti-sense. Os primers com a denominação P5FIXKHP e P3FIXXINBAM foram utilizados para a amplificação do fator IX, os P5FIX3seq e P3FIX5seq foram utilizados para a amplificação do cDNA na reação de RT-PCR e os demais para o sequenciamento do cDNA relativo ao fator IX

32
Tabela 1 – Primers utilizados em reações de amplificação por PCR e
sequenciamento do cDNA relativo ao Fator IX. Os nucleotídeos sublinhados foram adicionados para auxiliar em reações com enzimas de restrição
Primer Posição no
gene do Fator IX
Sequência dos nucleotídeos
5´ 3´
Temp. de anelamento
P5FIXKHP 30-51 5’AGCTTTGTTTAAACGTTAACACCATG
CAGCGCGTGAACATGATC3’ 64°C
P5FIXK 30-51 5´ACCATGCAGCGCGTGAACATGATC3´
55°C
P5FIXKX 30-51 5’CCGCTCGAGACCATGCAGCGCGTGA
ACATGATC3’ 66°C
P5FIXKHS 30-51 5’CCTACGTAGTTAACACCATGCAGCGC
GTGAACATGATC3’ 55°C
P3FIXXINBAM 1415-1393 5’CGGGATCCTTAAGTGAGCTTTGTTTT
TTTCCT3’ 60°C
P5FIX1seq 30-46 5´ATGCAGCGCGTGAACA3´ 50oC
P5FIX2seq 434-451 5’CATTAAGAATGGCAGATG3’ 50oC
P3FIX3seq 871-856 5’TCACCTGCGACAACTG3’ 50oC
P5FIX3seq 856-871 5’CAGTTGTCGCAGGTGA3’ 50oC
P3FIX4seq 1224-1218 5’CTTCATGGAAGCCAGC-3’ 50oC
P5FIX4seq 1218-1224 5’-GCTGGCTTCCATGAAG-3’ 50oC
P3FIX5seq 1418-1400 5’-TCATTAAGTGAGCTTTGTT-3’ 50oC
1.3 – Ligação do gene isolado no vetor de expressão
oi realizada a reação de ligação incubando 50 ng/L do vetor linearizado, 150
ng/L do produto de PCR digerido relativo ao cDNA do fator IX, 1U da T4 DNA
ligase (Invitrogen) e 3L do tampão específico da enzima (250mM Tris-HCl, pH 7.6, 500mM MgCl2, 5mM ATP, 5mM DTT, 25% polietilenoglicol 8000), para um volume
de reação final de 15L. A reação foi incubada por 16 horas a 16°C no termociclador GeneAmp® PCR System 9700 (Amplied Biosystems).
1.4 – Preparação de bactérias competentes
ma alíquota da bactéria E. coli DH10 estocada a -80°C foi estricada em placas
de petri contendo meio de cultura LB-ágar (1,5% ágar) e incubada a 37C, overnight. A seguir uma colônia foi colocada em 5mL meio de cultura LB (10g de Triptona, 10g de NaCL, 5g de extrato de levedura, diluir em H2O, pH7.0) e
incubada sob agitação a 37C, overnight. A seguir 250μL dessa cultura foi inoculada
em 25mL de meio LB e incubada a 37C sob agitação por 2 horas (assim a cultura atingiu a fase de crescimento logarítmica). Parte dessa suspensão bacteriana foi
F
U

33
centrifugada a 4.000 rpm por 15 min a 4°C, e ressuspendida em tampão Tris-HCl Cálcio (Tris-HCl 10mM pH 8,0; CaCl2 70mM). Essas bactérias competentes foram
estocadas utilizando glicerol 70% (200L de bactéria e 100L de glicerol) e
armazenadas em freezer -80C.
1.5 – Transformação bacteriana
oram adicionados 2L da reação de ligação no tubo Eppendorf contendo bactérias competentes. Por meio de incubação a 30 min no gelo, choque
térmico 42C por 50 s e 2 min no gelo, procedeu-se à transformação. A seguir foi
adicionado 250L de meio SOC (20mM glicose e meio SOB contendo 1mM MgCl2, 1mM MgSO4) e incubado por 1 h à 37°C sob agitação. Posteriormente, essa mistura foi estricada em placas de petri com meio de cultura LB-ágar contendo o antibiótico ampicilina (MERCK) a uma concentração final de 0,1 mg/mL, com a finalidade de selecionar as colônias contendo plasmídeos recombinantes. Uma colônia de bactéria transformada foi colocada em 5mL de meio LB com o antibiótico ampicilina
a 0,1 mg/mL (MERCK) e incubada sob agitação a 37C, overnight. Essas bactérias transformadas foram estocadas utilizando glicerol 70% e armazenadas em freezer -80°C.
1.6 – Extração de DNA plasmidial retroviral
ma alíquota dessa cultura (E. coli DH10), carregando o DNA plasmidial retroviral de interesse foi plaqueada em meio LB/ágar contendo ampicilina, e
incubadas por 16 h, a 37C. A seguir, foi inoculada uma colônia de bactéria em
minicultura contendo 5mL de LB/antibiótico e incubada sob agitação a 37C, por 16 h. Para isolar o DNA plasmidial das bactérias transformadas foi utilizado o kit QIAprep® Spin Miniprep Kit (QIAGEN) seguindo as recomendações do fabricante. A quantificação e a pureza da amostra do DNA plasmidial foi realizada por espectrofotometria utilizando os comprimentos de onda de 260nm e 280nm (UV).
1.7 – Análise do DNA plasmidial retroviral
DNA plasmidial das colônias transformadas foram analisados com o uso após a digestão com enzimas de restrição específicas (BamHI e HpaI). Os produtos da digestão do DNA plasmidial recombinante foram analisados por eletroforese
em gel de agarose 1% como descrito no item 1.1.
2 – Sequenciamento do DNA
ealizou-se o sequenciamento do DNA da construção recombinante pLXIN-rFIX pelo ABI Prism® Big Dye™ Terminator Cycle Sequencing Ready Reaction Kit
(Applied Biosystems). Utilizou-se para a reação de sequenciamento de DNA
2L do reagente Big Dye™ Terminator (Applied Biosystems), 500 ng/L de DNA plasmidial e 5 pmoles de primer. Essa reação foi submetida a uma termociclagem de
96C por 10 s, 50C por 5 s e 60C por 4 min, perfazendo 35 ciclos. A seguir a reação foi precipitada seguindo o protocolo ABI/Isopropanol (MERCK) e submetida à eletroforese no aparelho ABI Prism 377 DNA Sequencer (Applied Biosystems), usando gel de poliacrilamida 4%, contendo 6M de ureia, a 1500 V, durante 6 a 8 horas, a 51°C.
F
U
O
R

34
Na forma de eletroferograma as sequências de DNA geradas foram diretamente enviadas, para um computador PowerMac (Macintosh), conectado ao aparelho sequenciador. Estes eletroferogramas foram interpretados pelo software DNA Sequencing Analysis 3.3 e convertidos em sequências de DNA, as quais foram analisadas empregando o programa Sequencher 3.1.
3 – Transfecção do DNA plasmidial retroviral recombinante na linhagem celular EcoPack2TM-293
oi utilizado o protocolo de eletroporação para a transfecção do pLXIN-rFIX em células produtoras de retrovírus EcoPack2TM-293.
Para a eletroporação, plaqueou-se 6 x 106 células em 8 placas de crescimento celular (150 x 100mm de diâmetro – Cellstar), contendo meio de cultura DMEM (Dulbecco’s Modified Eagle’s Medium, GIBCO) acrescido de 3,7 g/L de bicarbonato de sódio (MERCK) e 2,4 g/L de tampão Hepes (Sigma), e suplementado com 10% (v/v) de soro fetal bovino inativado (Hyclone), 2mM L-glutamina (GIBCO), 100 U/mL de penicilina
(GIBCO) e 100 g/mL de estreptomicina (GIBCO). O cálculo do número de células/mL foi realizado utilizando a Câmara de Neubawer. As placas de cultura com uma confluência de 80% foram lavadas com tampão PBS [Phosphate-buffered saline (1X), NaCl 80,0 g/L, KCl 2,0 g/L, Na2HPO4 12,0 g/L e KH2PO4 2,0 g/L pH 7,4] e submetidas à Tripsina-EDTA (1X, GIBCO). O pellet celular formado foi lavado duas vezes com o tampão Hepes (0,5M)-PBS (10X) pH 7.5. Para a eletroporação, 1-2 x 107 células foram transferidas para as cubetas de 0,4cm (BIO-RAD) e as mesmas foram incubadas com 20μg de DNA plasmidial circular. O aparelho utilizado foi o Gene-Pulser II Electroporation System (BIO-RAD) e as condições da eletroporação foram: 1.0kv,
200ohms e 10F. Após a eletroporação as células são incubadas a 4ºC por 5 minutos, plaqueadas em garrafas de cultura celular (75mm) e mantidas em incubadoras Steri-
cult 200 (Forma Scientific - Thermoforma) a 37C, 5% de CO2 e 85% de umidade relativa do ar. Foram realizadas duas reações:
1) Co-transfecção com o DNA retroviral portador do fator IX e com o DNA plasmidial portador do gene gfp;
2) Controle negativo: eletroporação na ausência de DNA plasmidial. Para a análise da eficiência da transfecção após 72 h, as células transfectadas foram submetidas à tripsina (1X) e ressuspendidas em meio DMEM. A seguir foi transferida uma quantidade de 1 x 106 para tubo de ensaio. Por último, as células foram analisadas detectando a fluorescência do GFP, por software Cell Quest no aparelho FAC Sort (Becton Dickinson). Sendo a percentagem de células expressando GFP superior a 15%, deu-se início ao tratamento com o antibiótico geneticina, G418 sulfato
(Sigma), (300 g/mL), para a seleção da população celular transgênica.
4 – Transdução retroviral em linhagens celulares RetroPack2TM-PT67, CHO, Hek-293 e Hep-G2
pós a confirmação da integração do fator IX recombinante no genoma da linhagem celular ecotrópica (EcoPack2TM-293) realizou-se a transdução retroviral na linhagem dualtrópica RetroPack2TM-PT6, com o intuito de aumentar
o número de partículas virais recombinantes. Após a seleção da linhagem celular RetroPack2TM-PT6 com o antibiótico geneticina, o sobrenadante retroviral produzido
F
A

35
por essa linhagem com expressão estável do fator IX foi utilizada para infecção nas linhagens celulares de mamífero CHO, Hek-293 e Hep-G2. A metodologia utilizada para a transdução retroviral compreendeu-se em plaquear 3 x 106 células empacotadoras de retrovírus expressando o gene fator IX em três placas de 100mm de diâmetro, contendo 4mL de meio DMEM suplementado. Os sobrenadantes contendo as partículas retrovirais de interesse foram coletados durante intervalos de 24, 48 e 72 horas e filtrados em membranas de acetato de celulose de
0,45m (Millex - Millipore) com o intuito de evitar a contaminação da linhagem celular a ser infectada com células produtoras de retrovírus. A seguir foi adicionado ao filtrado
polybrene 5,5 g/mL (1,5-Dimethyl-1,5-diazaundecamethylene polymethobromide - Sigma). Tanto as células quanto as partículas retrovirais possuem carga negativa em suas superfícies, e estes polímeros têm a função de minimizar a repulsão eletrostática presente, auxiliando assim a entrada do RNA na célula a ser infectada (DAVIS; MORGAN; YARMUSH, 2002; DAVIS et al., 2004). A incubação da célula alvo com o sobrenadante retroviral é realizada por 24 h resultando no primeiro ciclo de transdução. Para garantir uma transdução eficiente são repetidos dois ciclos adicionais, sob as mesmas condições acima mencionadas. A linhagem celular CHO é conhecida por secretar fatores que inibem a infecção por partículas retrovirais. Essa limitação pode ser contornada com a adição do reagente tunicamicina que apresenta o papel de inibidor a glicosilação e consequentemente impedindo a ação deste agente inibidor da infecção retroviral na linhagem celular CHO. Assim para minimizar a resistência a infecção pelo retrovírus pLXIN-rFIX, as células CHO foram previamente tratadas com a droga inibidora de glicosilação,
Tunicamycin 0,5 g/mL (Sigma), conferindo portanto uma susceptibilidade a transdução retroviral (MILLER A.D.; MILLER D.G, 1992, 1993; MILLER, 1996). O tratamento de seleção da linhagem celular transgênica com o antibiótico, geneticina foi adicionado 24 h após o terceiro ciclo de transdução retroviral. Como controle do tratamento é utilizado a linhagem celular virgem que permite a caracterização da mesma quanto à sensibilidade ao antibiótico.
5 – Análise da extração do RNA mensageiro
análise da expressão do RNA mensageiro relativo ao fator IX recombinante nas linhagens transgênicas foi realizada por meio da reação de Transcriptase Reversa (RT-PCR).
A partir de 5 x 106 células, foi efetuada a extração do RNA total utilizando o RNAsy Mini Kit (QIAGEN), conforme as instruções do fabricante. A quantificação e a pureza do RNA total foram avaliadas como descrito no item 1.6. Para a produção do cDNA, foi utilizado o kit SuperScript™ II First-Strand Synthesis System for RT-PCR (Invitrogen). Foi realizada uma reação com volume final de 10μL,
adicionou-se 1-3g de RNA total, 1μL do primer P3FIXXINBAM a 50 pmoles e 10mM de dNTPs, que foi incubada em um termociclador GeneAmp® PCR System 9700 (Amplied Biosystems) a 65°C por 5 min, 4°C por 2 min, 25°C por 2min. Neste momento foi adicionado 9μL do tampão da reação [2μL do tampão da enzima RT (10X), 4μL de MgCl2 (25mM), 2μL de DTT (0,1M) e 1μL de RNaseOUT™]. Após os 2
minutos, foi adicionado à reação 1L da enzima SuperScript™ II (Invitrogen). A reação foi então incubada a 25°C por 10min; 42°C por 50 min; 70°C por 15 min. Para cada amostra testada foi realizada um controle negativo, ou seja, reações incubadas na ausência da enzima transcriptase reversa.
A

36
A reação de amplificação do cDNA foi realizada em um volume final de 25l na
presença de 2,0L do cDNA; 10mM de dNTPs; 1μL da enzima Taq DNA polimerase
(Amersham Bioscience), 2,5L do tampão 10x da respectiva enzima (Amersham Bioscience) e 1μL de cada oligonucleotídeo P3FIX5seq e P5FIX3seq a 10 pmoles.
Essa reação foi realizada em termociclador com o programa: 95C por 2 min; 35 ciclos
de 95C por 40 s, 55C por 40 s e 72C por 1 min; 72C por 10 min. O diagnóstico da integridade e concentração do RNA presente em cada amostra é realizado utilizando um gene constitutivo, em particular o gene que codifica a proteína
estrutural -actina. O gene da -actina possui 3.436 pb e codifica um RNAm de 1.793 pb com uma região codificadora de 1.127 pb. Para a construção dos primers e amplificação do fragmento foi utilizada a sequência contida no GenBank (NCBI) sob o número de acesso NM_001101, denominada Homo sapiens actin, beta (ACTB), RNAm. A sequência dos oligonucleotídeos utilizados para
amplificar um fragmento de 612 bp relativo ao cDNA da -actina encontra-se na tabela 2. Após a amplificação do cDNA de interesse, o produto da reação é analisado por eletroforese em gel de agarose 1% como descrito no item 1.1.
Tabela 2 – Primers referentes ao gene -actina
Primer
Posição no gene da
-actina
Sequência dos nucleotídeos
5´ 3´ Temp. de
anelamento
P5 -actina 521 - 539 5’ GGCATCGTGATGGACTCCG 3’ 62°C
P3 -actina 1115 - 1133 5’ GCTGGAAGGTGGACAGCGA 3’ 62°C
6 – Imunodetecção da proteína recombinante fator IX por citometria de fluxo
s linhagens celulares transgênicas portadoras do FIX recombinante RetroPack2TM-PT67, CHO, Hek-293 e Hep-G2 foram submetidas à análise por citometria de fluxo para avaliação da percentagem de células portadoras de
rFIX. As células após terem atingido uma confluência de 80% nas placas de 150 x 100mm foram submetidas à tripsina (1X) e lavadas duas vezes com PBS (1X). Amostras celulares na concentração de 1-2 x 106 células foram utilizadas em cada reação de marcação com o anticorpo de interesse. O procedimento de marcação envolveu os seguintes passos: fixação das células com 1% de paraformaldeído (MERCK) por 30 min a 4°C. Em seguida, as células foram permeabilizadas com 0,5% de Tween (USB) por 15 min a 37°C, procederam-se com a lavagem em PBS (1X)-BSA 2%. Após a permeabilização da membrana celular foi realizado o bloqueio com 1mL de um pool de soro de cabra 10% por 1 hora a 37°C. A seguir as células foram incubadas com o anticorpo primário purificado Anti-fator IX humano desenvolvido em coelho (Anti-
A

37
Human factor IX developed in rabbit, IgG fraction of antiserum - Sigma) diluído em
solução PBS (1X)-BSA 2% e incubadas por 12-16 horas a 4C. A concentração do anticorpo primário variou de acordo com a linhagem em estudo: para a linhagem RetroPack2TM-PT67 utilizou-se a concentração de 280 µg/mL (1:50), para Hek-293 35 µg/mL (1:400) e Hep-G2 14 µg/mL (1:100). O excesso de anticorpo primário não ligado foi eliminado após a lavagem das células em PBS (1X)-BSA 2%, e em seguida as células foram incubadas com anticorpo secundário Anti-coelho produzido em porco e conjugado com isotiocianato de fluoresceína (FITC-Conjugated swine anti-rabbit immunoglobulins - DAKO). Também nesse caso, a diluição do anticorpo secundário variou de acordo com a linhagem celular em estudo: para a linhagem RetroPack2TM-PT67 utilizou-se a concentração de 20 µg/mL (1:40) e para as linhagens Hek-293 e Hep-G2 16 µg/mL (1:50). A incubação com o anticorpo secundário foi realizada em câmera escura durante 30 min a temperatura ambiente. O excesso de anticorpo secundário não ligado foi eliminado após a lavagem das células em PBS (1X). Finalmente, as células foram ressuspendidas em 100μL do mesmo tampão e a fluorescência emitida pelas células positivas para o FIX marcadas com FITC foi avaliada através do citômetro de fluxo (Becton Dickinson) utilizando o software Cell Quest. Para cada reação foram realizados controles negativos, ou seja, amostras incubadas somente com o anticorpo secundário. O anticorpo primário utilizado para a linhagem CHO foi o anticorpo monoclonal derivado do hibridoma HIX-1 produzido pela fusão de células de mieloma murinas (Sp2/0-Ag14) e esplenócitos de camundongo Balb-C imunizados com o fator IX humano purificado a partir do plama (Sigma) diluído em solução PBS (1X)-BSA 2% (1:201) na concentração de 20 µg/mL e o anticorpo secundário foi o anticorpo Anti-camundongo produzido em cabra e conjugado com isotiocianato de fluoresceína (Goat Anti-Mouse Ig FITC - BD Bioscience) também diluído em solução PBS (1X)-BSA 2% (1:20) na concentração de 10 µg/mL.
7 – Análise da atividade biológica do fator IX recombinante
ara a análise da atividade biológica do rFIX presente no sobrenadante das linhagens celulares recombinantes foi empregado o teste da coagulação TTPA (teste da tromboplastina parcial ativada). A dosagem da atividade biológica
iniciou-se com a obtenção de uma curva de calibração padrão construída utilizando como referência o FIX humano derivado do plasma conhecido como Verify Reference Plasma (Organon Teknika, Durham). Este plasma referência foi reconstituído em 1mL de água destilada, concentração final de 1 IU/mL de FIX, e uma série de diluições seriadas na razão de dois (1:5; 1:10; 1:20; 1:40; 1:80) foram realizadas utilizando a solução tampão fisiológica recomendada (Owren´s Veronal - Biomeriéux). A partir do tempo de coagulação médio de cada diluição foi traçada uma curva de calibração, em que o eixo da ordenada indica o tempo de coagulação sanguínea e o eixo da abscissa as respectivas diluições do plasma referência. Ao final a atividade biológica do FIX foi obtida com a média da inclinação da curva, e convertida automaticamente em percentagem, considerando que 100% atividade representa 1 IU/mL (KURACHI S.; PANTAZATOS; KURACHI K., 1997; CHNG; SUM; KUPERAN, 2005). Para a avaliação da atividade biológica do rFIX presente no sobrenadante das linhagens celulares CHO, Hek-293 e HepG2, as mesmas foram tratadas durante 10 dias com 5 μg/mL de Vitamina K (Kanakion® MM – Roche) (BUSBY et al., 1985). Em 2003, os pesquisadores XU et al., mostraram que a secreção de proteínas sintetizadas pela linhagem celular Hek-293 para o meio extracelular podiam ser induzida pelo tratamento com a droga Phorbol 12-myristate 13-acetate (PMA), um agente estimulador da proteína C quinase (PKC), e potencializado quando administrado em conjunto com o Ionóforo de Cálcio (A-23187), uma vez que o
P

38
aumento da concentração de Ca2+ livre no meio intracelular pode estimular a PKC, a qual é Cálcio-dependente (POCOTTE et al., 1985; JOHNSON et al., 2002). O PMA atua ainda na fosforilação protéica, um tipo de modificação pós-traducional. Assim para estimular à secreção da proteína endógena rFIX, as células HEK-293 foram tratadas com 1 μg/mL de PMA (Sigma) e 0,5 μg/mL de A-23187 (Sigma) 24 horas antes da realização do TTPA. Após o tratamento com vitamina K, culturas celulares apresentando uma confluência de 80% em placas de cultivo de 150 x 150mm foram lavadas três vezes com PBS (1X) e adicionado 6mL de meio de cultivo DMEM não suplementado com soro fetal bovino. Para a linhagem celular HEK-293 foi acrescido PMA e A-23187. Após 24 horas, as amostras foram diluídas 1:10 em tampão (Owren`s Veronal -
Biomérieux), 100l dessa diluição foi misturada com 100l de plasma deficiente em fator IX humano (Biomeriéux) e a reação incubada por 20 seg a 37°C. Em seguida
adicionou-se 100L do ativador de contato (Platelin LS - Biomérieux) e a reação incubada novamente por 240 seg a 37°C. Ao término dessa reação adicionou-se
100L do cloreto de cálcio (CaCl2 0,025M) e imediatamente iniciou-se a contagem do tempo de coagulação sanguínea utilizando o coagulômetro automático (COAG-A-
MATE XM - Organon Teknika) conforme as instruções do fabricante.
8 – Caracterização do rFIX presente no sobrenadante das linhagens celulares Hek-293/rFIX e Hep-G2/rFIX
ara caracterização do rFIX presente no sobrenadante das linhagens celulares Hek-293/rFIX e Hep-G2/rFIX após a confirmação da presença do FIX biologicamente ativo nesses sobrenadantes foi realizado a concentração por
centrifugação a 7.500 rpm a 8°C utilizando os filtros Amicon® Centricon® Centrifugal Filter Devices - YM-3 (Millipore). O tempo mínimo de centrifugação foi de 2 horas, variando de acordo com o volume inicial de amostra processada. Com o intuito de retirar a glicerina presente na membrana do filtro, estes foram previamente lavados com 2mL água milli-Q a 4.300 rpm a 8°C por 2 horas. Ao término da concentração os filtros foram novamente lavados com água milli-Q
autoclavada. Após essa lavagem as amostras foram eluídas em 100L de H2O MilliQ autoclavada. A quantificação das proteínas de cada amostra foi realizada, pelo método de Bradford (BRADFORD et al., 1976). A seguir 10μL de cada amostra concentrada (15μg de proteínas totais) foram misturadas separadamente em tampão de amostra [Tris-HCL 1M pH 8.0, SDS 10%, EDTA 1mM pH 8.0, azul de bromofenol 0,01% e DTT 0,1%] e 1,5μL de β-mercaptoetanol (Sigma), fervidas a 100°C por 3 minutos e aplicadas em dois géis de
poliacrilamida pré-confeccionado (PhastGel Homogeneous 12.5 – Amersham
Biosciences) utilizando o tampão em tira (PhastGel SDS Buffer Strips – Amersham Biosciences). Para a realização da eletroforese em gel de poliacrilamida foi utilizado o aparelho PhastSystem (Pharmacia Biotech), a 100 V por aproximadamente 30 minutos, conforme as instruções do fabricante. Após a corrida, um dos géis foi fixado em uma Solução Fixadora (etanol 40% e ácido acético 10%) durante 1 hora, corado com a solução de azul de Coomassie [Solução
P

39
Coomassie B-Blue G250 (ácido fosfórico 1,3%, sulfato de amônio 0,75M e Coomassie B-Blue G250 0,1%) e metanol 20%] por 4 horas. O excesso de corante foi eliminado por meio de lavagem e o gel passou para o processo de secagem a temperatura ambiente. O segundo gel de poliacrilamida contendo as proteínas foi transferido para uma
membrana de PVDF (Polyvinylidene Fluoride - Hybond-P Amersham Biosciences) pelo método de eletro-transferência semi-seca, por meio do aparelho PhastSystem, a 90 V por aproximadamente 2,5 horas, conforme as instruções do fabricante. A eletroforese foi realizada em tampão de transferência (Tris Base 0,25M, glicina 0,96M, SDS 0,5% e água milli-Q autoclavada). Após a transferência, a membrana de PVDF foi lavada com tampão de TBS-T (Tris-HCL 1M pH 7,5, NaCL 3M pH 7,5, Tween-20 0,1%, água milli-Q autoclavada) com BSA 2% por 5 min a temperatura ambiente sob constante agitação. Posteriormente a membrana foi submetida ao bloqueio (leite Molico 5% e TBS-T com BSA 2% 100mL) dos sítios inespecíficos por incubação overnight. A seguir a membrana passou por etapas de lavagem em tampão TBS-T, e foi incubada com o anticorpo primário Anti-fator IX humano desenvolvido em coelho (Anti-Human factor IX developed in rabbit, IgG fraction of antiserum - Sigma), utilizou-se a diluição de 1:3000 (concentração final de 0,0047 μg/μL) em tampão TBS-T, por 1 hora, a temperatura ambiente sob agitação constante. Após as etapas de lavagem em tampão TBS-T, a membrana foi incubada com o anticorpo secundário conjungado com peroxidase (Peroxidase labelled anti-rabbit antibody, developed in goat) diluído 1:3.000 em tampão TBS-T com BSA 2%. A incubação com o anticorpo secundário foi realizada por 1 hora sob agitação. O excesso de anticorpo secundário é removido após a lavagem em tampão TBS-T com BSA 2%. Ao término da lavagem foi realizada a revelação da membrana utilizando o
kit de quimioluminescência (ECL Western Blotting Analysis System – Amersham Biosciences), conforme as instruções do fabricante. A autoradiografia foi efetuada na câmera escura da Radiologia, situada no balcão 10 do Hospital das Clínicas da FMRP. Como controle positivo para a técnica de western blot foi utilizado o Fator IX derivado do plasma (Octanyne®).

40
V. RESULTADOS
1 – Clonagem do cDNA relativo ao FIX no vetor plasmodial retroviral pLXIN
ara a clonagem do cDNA relativo ao fator IX no vetor plasmidial retroviral foi utilizado o DNA molde purificado de uma biblioteca de cDNA de fígado humano construída em fago lambda. O clone recombinante portador do cDNA relativo ao
FIX foi previamente isolado em nosso laboratório após quatro ensaios de hibridação com um fragmento de DNA relativo ao FIX gentilmente cedido pelo Dr. Marcelo Brígido da UnB. O fragmento de DNA relativo ao fator IX foi isolado do fago lambda pela reação em cadeia da polimerase utilizando oligonucleotídeos específicos que incluem a molécula de FIX inteira (TABELA I e FIGURA 18). Após a purificação do produto de PCR o mesmo foi digerido com endonucleases específicas (HpaI + BamHI) e submetido a ligação ao DNA plasmidial retroviral pLXIN linearizado com as mesmas enzimas de restrição. O produto de ligação foi transformado em bactéria, o que resultou na formação de 04 colônias transformantes. A análise do DNA plasmidial dessas 04 colônias mostrou que apenas uma colônia era recombinante, isto é, portadora do cDNA inteiro do FIX de coagulação sanguínea humana. Conforme mostrado na figura 19, o DNA plasmidial desse clone bacteriano é portador de um fragmento de 1.4 kb relativo ao cDNA do FIX.
Figura 19 - Clonagem do cDNA relativo ao fator IX no vetor retroviral pLXIN. Gel de agarose 1% contendo brometo de etídio. Raia M1: marcador de peso molecular 1 kb (fragmentos: 10.0; 8.0; 6.0; 5.0; 4.0; 3.0; 2.0; 1.5; 1.0; 0.5), Raia 1: clone recombinante antes da digestão, Raia 2: DNA pLXIN-rFIX após a digestão com as
enzimas de restrição HpaI + BamHI resultando em dois fragmentos, e Raia M2: X-174 (fragmentos 1.3; 1.0; 0.8; 0.6; 0.2 kb)
P
6.1 kb pLXIN
1.4 kb fator IX
M1 1 2 M2

41
2 – Sequenciamento do cDNA relativo ao FIX clonado no vetor pLXIN
om o intuito de confirmar a sequência do cDNA relativo ao fator IX clonado no vetor pLXIN foi realizado o sequenciamento do DNA em sequenciador automático ABI Prism 377 DNA Sequencer (Applied Biosystems). Após o
término das reações de sequenciamento foram geradas oito sequências de boa qualidade formando um único contig (FIGURA 20). Esse contig foi avaliado quanto à integridade da sequência utilizando o programa BLAST do NCBI (KARLIN; ALTSCHUL, 1990). Os dados do alinhamento mostraram que de fato a região codificadora do cDNA gerado nesse trabalho apresenta elevada similaridade com o cDNA relativo ao fator IX depositado no banco de dados (GenBank - NCBI) sob número de acesso NM_000133.2.
Figura 20 - Alinhamento gerado após o sequenciamento do clone recombinante pLXIN-rFIX portador do cDNA relativo ao fator IX. A sequência de referência utilizada para o alinhamento está depositada no NCBI (NM_000133.2) Entretanto, uma análise mais detalhada do sequenciamento do cDNA recombinante relativo ao FIX mostrou a presença de 04 mutações:
a) duas mutações que resultam na substituição de aminoácidos (T148A e Q173R) no peptídeo de ativação, o qual é liberado durante a ativação do FIX. Além disso, a mutação T148A consiste no polimorfismo conhecido como Malmö polymorphism, o qual foi identificado na população americana (MCGRAW et al., 1985). Convêm ressaltar que essa mesma mutação esta presente no rFIX comercial (Summary of Basis for Approval – Coagulation Factor IX
(recombinant), Genetics Institute, BeneFIXTM
). b) duas mutações no domínio catalítico, sendo uma única resultante na troca de
aminoácido (D359V). A quarta mutação (S384) é silenciosa. Apesar da identificação dessa mutação, D359V, no domínio catalítico da proteína recombinante, optou-se por continuar o desenvolvimento do projeto, uma vez que foi obtido o conhecimento sobre a existência de patentes relativas ao Fator IX que
C

42
apresentam mutação nesse domínio e permitem o aumento da atividade biológica do mesmo cerca e 2-3 vezes quando comparada com a molécula selvagem (Patente
número US Patent 6.531.298) (http://www.freepatentsonline.com/).
3 – Geração de uma linhagem celular ecotrópica portadora em seu genoma do cDNA relativo ao rFIX
onfirmada a clonagem do rFIX no vetor de expressão, nosso próximo passo consistiu em transfectar esse vetor retroviral recombinante na linhagem celular produtora de retrovírus denominada EcoPack2TM-293, utilizando a estratégia de
eletroporação. Para a análise da eficiência da transfecção foi realizada a co-transfecção com um DNA plasmidial convencional portador do gene que codifica a proteína fluorescente GFP. Conforme mostra a tabela 3 e figura 21, a eficiência da transfecção 72 h após a eletroporação variou entre 16% e 21% de acordo com a quantidade de DNA plasmidial pLXIN-rFIX (11μg e 15μg, respectivamente).
Tabela 3 – Eficiência de transfecção 72 h após a eletroporação (choque 1.0kv,
200ohms e 10F)
Transfecção Nº Placa
DNA (g) Nº Células
0h 72h % GFP
72h
1 - 2 x 107 4 x 105 -
2 11g FIX + 3g GFP 2 x 107 1,1 x 107 16,2%
2B 15g FIX + 3g GFP 2 x 107 1,2 x 107 21,7%
Figura 21 – Expressão de GFP nas linhagens celulares EcoPack2TM-293, 72 h após a transferência gênica. (A) gráfico dot plot SSC X FSC mostrando o tamanho e complexidade celular de células EcoPack2TM-293 virgens; (B) gráfico dot plot %GFP X SSC mostrando a ausência de expressão de GFP nas células EcoPack2TM-293 eletroporadas na ausência de DNA; (C e D) gráficos dot plot %GFP X SSC mostrando
C

43
a co-transfecção com o vetor retroviral pLXIN-rFIX e o vetor plasmidial pEGFP-C1. Verifica-se uma maior expressão em D a qual e referente à população EcoPack-2B Em seguida, as populações celulares transitórias foram submetidas ao tratamento com
geneticina (300 g/ml). Entre o 11° e o 21 dia de tratamento, avaliou-se a expressão permanente de GFP. Conforme mostra a tabela 4, o aumento do nível de expressão de GFP foi proporcional à quantidade de células portadoras de GFP 72 h após a eletroporação. Em ambos os casos, o aumento da expressão de GFP foi da ordem de 3X. Portanto, mesmo após o tratamento a população 2B manteve-se em um maior nível de expressão de GFP (65%) superior quando comparado com a população 2 (53%). Desta maneira, prosseguimos nossos estudos com a população ecotrópica 2B. Uma análise detalhada, por citometria de fluxo, da análise da percentagem das células ecotrópicas 2B portadoras de GFP é mostrado na figura 22.
Tabela 4 – Análise da % de células expressando GFP no 21 dia após o tratamento com antibiótico.
Transfecção Nº Placa
DNA (g) % GFP
21dia
1 - -
2 11g FIX + 3g GFP 53,2%
2B 15g FIX + 3g GFP 65,5%
Figura 22 – Expressão de GFP na linhagem celular EcoPack2TM-293 co-
transfectada com pLXIN-rFIX e pEGFP-C1, após o tratamento com geneticina. (A) gráfico dot plot SSC X FSC mostrando o tamanho e complexidade celular de células EcoPack2TM-293 virgens; (B) gráfico dot blot %GFP X SSC mostrando a ausência de
expressão de GFP nas células EcoPack2TM-293 virgens e (C) gráfico dot blot %GFP X SSC mostrando níveis de expressão de GFP 3X mais elevado quando comparado a
expressão transitória, na população transgênicas EcoPack-2B
4 – Expressão permanente do RNA mensageiro relativo ao FIX na linhagem celular ecotrópica EcoPack2™-293/rFIX/GFP+
pós a seleção da população celular ecotrópica transgênica que apresentou maior expressão da proteína GFP, o próximo passo foi constatar a expressão do RNAm relativo ao fator IX recombinante, por RT-PCR. A figura 23 mostra
uma banda de 559 pb referente ao cDNA do fator IX na linhagem EcoPack2TM-293/rFIX/GFP+ (raia 3) e a ausência da mesma na linhagem EcoPack2TM-293 virgem (raia 1).
A

44
Figura 23 – Expressão do RNAm do fator IX na linhagem celular EcoPack2TM-293 co-transfectada com FIX e GFP. Gel de agarose 1% contendo brometo de etídio. Foi
utilizado 1g de RNA total para gerar o cDNA utilizando um oligonucleotídeo 3´ específico do FIX (TABELA1). Em seguida, 1/10 vol cDNA foi empregado para amplificar uma sequência específica do RNAm do FIX de 559 pb (raia 3). Raia 1: EcoPack2TM-293 virgem, Raia 2 e 4: controle negativo da reação de RT, não foi adicionado a enzima transcriptase reversa, Raia M1: marcador de peso molecular fago
X-174 (fragmentos 1.3; 1.0; 0.8; 0.6; 0.2 kb)
5 – Geração de uma linhagem celular dualtrópica portadora em seu genoma do cDNA relativo ao rFIX
pós a obtenção de uma população ecotrópica produtora de retrovírus recombinante portador do cDNA relativo ao fator IX partimos para a geração de uma segunda linhagem celular produtora do mesmo retrovírus recombinante
objetivando um possível aumento do título retroviral. Para tanto, o sobrenadante produzido pela população celular EcoPack2TM-293/rFIX/GFP foi utilizado para transduzir a linhagem celular dualtrópica produtora de retrovírus denominada RetroPack2TM-PT67. Cerca de 72 h após a transdução foi realizado o tratamento com
geneticina na concentração de 400 g/mL. Após a seleção da população dualtrópica RetroPack2TM-PT67, conforme demonstrado na figura 24, a análise por RT-PCR do RNAm relativo ao fator IX nas linhagens celulares dualtrópica RetroPack2TM-PT67 virgem e RetroPack2TM-PT67 recombinante confirma a presença de um fragmento de 559 bp relativo ao RNAm do rFIX na célula recombinante e a ausência do mesmo na linhagem celular virgem.
A

45
Figura 24 – Expressão do transcrito primário fator IX na linhagem celular RetroPack2TM-PT67/rFIX. Gel de agarose 1% contendo brometo de etídio. Raia M1:
DNA do fago X-174 (fragmentos 1.3; 1.0; 0.8; 0.6; 0.2 kb); Raias 1 e 2 foi utilizado o RNA da célula RetroPack2TM-PT67 virgem com os primers específicos para o fator IX. A raia 2 representa o controle negativo dessa reação processada na ausência da enzima transcriptase reversa. As amostram das raias 3 e 4 representam o RNA isolado da linhagem recombinante RetroPack2TM-PT67/rFIX utilizando os primers específicos para o rFIX. Nas raias de 5 a 8 representam as mesmas amostras das
raias 1 a 4 utilizando os primers específicos para -actina para avaliação da integridade e concentração de RNA tanto na célula virgem como na célula recombinante. Raia M2: marcador de peso molecular 1 kb (fragmentos: 10.0; 8.0; 6.0; 5.0; 4.0; 3.0; 2.0; 1.5; 1.0; 0.5). Raia C-: controle negativo para reação de PCR Nosso próximo passo consistiu em diagnosticar a presença da proteína rFIX no citoplasma das células RetroPack2TM-PT67/rFIX+. Conforme demonstrado na figura 25, a análise por citometria de fluxo após a marcação com anti-hFIX mostrou que a população transgênica RetroPack2TM-PT67/rFIX+ consiste em uma população com expressão estável de rFIX, da ordem de 96%.
M1 1 2 3 4 5 6 7 8 M2 C-
559 pb 612 pb

46
Figura 25 – Proteína rFIX está presente no citoplasma da linhagem celular RetroPack2TM-PT67/rFIX+ submetida à seleção com geneticina. Análise por citometria de fluxo da percentagem de células expressando a proteína rFIX. (A) gráfico dot plot SSC X FSC mostrando o tamanho e complexidade das células RetroPack2TM-PT67 virgens; (B) gráfico dot plot %GFP X SSC mostrando a ausência de rFIX na célula virgem; (C) gráfico dot plot contendo as células RetroPack2TM-PT67/rFIX marcadas com o isotipo IgG-FITC e (D) gráfico dot plot das células RetroPack2TM-PT67/rFIX marcadas com anti-FIX-FITC mostrando que após a seleção com o antibiótico obteve-se uma população celular transgênica em que 96% das células expressam a proteína rFIX
6 – Geração de três linhagens celulares de mamífero portadoras em seu genoma do cDNA relativo ao rFIX: CHO, Hek-293 e Hep-G2
pós a obtenção da segunda população celular produtora de retrovírus denominada RetroPack2TM-PT67/rFIX o sobrenadante retroviral produzido pela mesma foi utilizado para a geração de uma linhagem celular de hamster
derivado do epitélio ovariano (CHO) e duas linhagens celulares humanas derivadas do epitélio renal e hepático, denominadas Hek-293 e Hep-G2, respectivamente. Primeiramente, quanto a geração da linhagem celular de hamster CHO portadora do cDNA relativo ao FIX: após a transdução com o sobrenadante retroviral produzido por RetroPack2TM-PT67/rFIX a linhagem celular CHO/rFIX foi submetida a seleção com
geneticina (600 g/mL) e confirmações da presença do RNAm e da proteína do rFIX foram feitos por RT-PCR (FIGURA 26) e citometria de fluxo (FIGURA 27). A figura 26 mostra a expressão estável do RNAm relativo ao rFIX na população celular CHO/rFIX e a ausência do mesmo na população celular virgem.
A

47
Figura 26 – Expressão do RNAm relativo ao fator IX na linhagem celular CHO/rFIX. Géis de agarose 1% contendo brometo de etídio, após a eletroforese. Em A foi utilizado os primers do FIX e em B foi utilizado os primers da β-actina. Em A: Raia M1: DNA do fago ФX-174 (fragmentos 1.3; 1.0; 0.8; 0.6; 0.2 kb), Raias 1 e 3 representam as linhagens celulares CHO virgem e CHO/rFIX, respectivamente, mostrando a ausência do RNAm do rFIX na célula virgem e a presença do mesmo na célula recombinante. As raias 2 e 4 representam os controles negativos das reações 1 e 3 realizadas na ausência da enzima transcriptase reversa. Em B foram utilizadas as
mesmas amostras demonstradas em A com os primers da -actina. Observa-se nas raias 1 e 3 a presença desse RNAm endógeno em ambas as amostras. De modo
similar, o RNAm da -actina não foi visualizado nas raias 2 e 4 que correspondem ao controle negativo da reação de RT-PCR realizada na ausência da enzima transcriptase reversa. A Raia M2: marcador 1kb (fragmentos: 10.0; 8.0; 6.0; 5.0; 4.0; 3.0; 2.0; 1.5; 1.0; 0.5) Para o diagnóstico da presença da proteína rFIX no citoplasma das células CHO/rFIX+, as mesmas foram marcadas com anti-hFIX e analisadas por citometria de fluxo. Conforme mostra a figura 27, a população transgênica CHO/rFIX+ apresenta expressão estável do rFIX da ordem de 14%, enquanto na célula CHO virgem o mesmo está ausente.

48
Figura 27 - Expressão de rFIX na linhagem celular CHO/rFIX+ após a seleção com geneticina. Análise por citometria de fluxo da percentagem de células expressando a proteína rFIX. (A) gráfico dot plot SSC X FSC mostrando o tamanho e complexidade das células CHO virgens; (B) gráfico dot plot %GFP X SSC mostrando a ausência de rFIX na célula virgem; (C) gráfico dot plot contendo as células CHO/rFIX marcadas com o isotipo IgG-FITC e (D) gráfico dot plot das células CHO/rFIX marcadas com anti-FIX-FITC mostrando que após a seleção com o antibiótico obteve-se uma população celular transgênica em que 14% das células expressam a proteína rFIX No que diz respeito à geração da linhagem celular de rim embrionário humano denominado Hek-293 portadora em seu genoma do cDNA relativo ao rFIX foi utilizada a mesma metodologia descrita para a geração da linhagem celular CHO/rFIX.
Conforme demonstrado na figura 28, após a seleção por geneticina (800 g/mL) foi diagnosticada a presença do RNAm relativo ao rFIX na linhagem celular Hek-293/rFIX+ e a ausência do mesmo nas células Hek-293 virgens. O mesmo foi observado em relação à proteína citoplasmática rFIX. Conforme avaliado por citometria de fluxo, o nível de expressão de rFIX na população Hek-293/rFIX+ foi da ordem de 21%, enquanto que na célula virgem o mesmo não é diagnosticado (FIGURA 29).

49
Figura 28 – Expressão do RNAm relativo ao fator IX na linhagem celular Hek-293/rFIX. Gel de agarose 1% contendo brometo de etídio. Nas raias 1 a 4 foram utilizados os primers do FIX, e as raias 5 a 8 representam as mesmas amostras de 1 a 4 utilizando os primers da β-actina. As Raias 1 e 3 representam as linhagens celulares Hek-293 virgem e Hek-293/rFIX, respectivamente, mostrando a ausência do RNAm do rFIX na célula virgem e a presença do mesmo na célula recombinante. As raias 2 e 4 representam os controles negativos das reações 1 e 3 (ausência da enzima
transcriptase reversa). As raias 5 e 8 mostram a presença do RNAm endógeno da -actina tanto na linhagem celular virgem como recombinante. Os controles negativos das respectivas reações estão nas raias 6 e 8 (ausência da enzima transcriptase reversa). A raia C- representa o controle negativo da reação de PCR
Figura 29 - Expressão de rFIX na linhagem celular Hek-293/rFIX+ após a seleção com geneticina. Análise por citometria de fluxo da percentagem de células expressando a proteína rFIX. (A) gráfico dot plot SSC X FSC mostrando o tamanho e complexidade das células Hek-293 virgens; (B) gráfico dot plot %GFP X SSC
559 pb
M1 1 2 3 4 5 6 7 8 C-
612 pb

50
mostrando a ausência de rFIX na célula virgem; (C) gráfico dot plot contendo as células Hek-293/rFIX marcadas com o isotipo IgG-FITC e (D) gráfico dot plot das células Hek-293/rFIX marcadas com anti-FIX-FITC mostrando que após a seleção com o antibiótico obteve-se uma população celular transgênica em que 21% das células expressam a proteína rFIX Finalmente, o sobrenadante retroviral produzido pela linhagem celular RetroPack2TM-PT67/rFIX foi utilizado para transduzir a linhagem celular humana hepática Hep-G2. Como realizado nas demais linhagens de mamífero, ao término dos três ciclos de infecção retroviral, a população celular Hep-G2/rFIX+ foi submetida a seleção com
geneticina (800 g/mL) e, em seguida submetida à análise por RT-PCR (FIGURA 30) e citometria de fluxo (FIGURA 31) para investigações sobre a expressão do RNAm relativo ao rFX e a proteína citoplasmática. De fato, após a análise por RT-PCR foi observado a presença do RNAm do rFIX na linhagem celular Hep-G2/rFIX e a ausência do mesmo na linhagem celular Hep-G2 virgem. O mesmo foi observado no que diz respeito à presença da proteína do rFIX após a marcação das células Hep-G2/rFIX e células Hep-G2 virgens com anti-hFIX. A análise por citometria de fluxo mostrou a expressão estável de rFIX na linhagem celular Hep-G2/rFIX, da ordem de 46% (FIGURA 31) e a ausência da mesma na linhagem celular Hep-G2 virgem.
Figura 30 - Expressão do RNAm relativo ao fator IX na linhagem celular Hep-G2/rFIX. Raia M1: DNA do fago ФX-174 (fragmentos 1.3; 1.0; 0.8; 0.6; 0.2 kb). Raia C+: controle positivo da reação de PCR. Nas raias 1 a 4 foram utilizados os primers do FIX, e as raias 5 a 8 representam as mesmas amostras de 1 a 4 utilizando os primers da β-actina. As Raias 1 e 3 representam as linhagens celulares Hep-G2 virgem e Hep-G2/rFIX, respectivamente, mostrando a ausência do RNAm do rFIX na célula virgem e a presença do mesmo na célula recombinante. As raias 2 e 4 representam os controles negativos das reações 1 e 3 (ausência da enzima transcriptase reversa). As
raias 5 e 8 mostram a presença do RNAm endógeno da -actina tanto na linhagem celular virgem como recombinante. Os controles negativos das respectivas reações estão nas raias 6 e 8 (ausência da enzima transcriptase reversa). Raia 9: controle negativo da reação de PCR; Raia M2: marcador de peso molecular 1 kb (fragmentos: 10.0; 8.0; 6.0; 5.0; 4.0; 3.0; 2.0; 1.5; 1.0; 0.5)

51
Figura 31 - Expressão de rFIX na linhagem celular HepG2/rFIX+ após a seleção com geneticina. Análise por citometria de fluxo da percentagem de células expressando a proteína rFIX. (A) gráfico dot plot SSC X FSC mostrando o tamanho e complexidade das células Hek-293 virgens; (B) gráfico dot plot %GFP X SSC mostrando a ausência de rFIX na célula virgem; (C) gráfico dot plot contendo as células Hek-293/rFIX marcadas com o isotipo IgG-FITC e (D) gráfico dot plot das células Hek-293/rFIX marcadas com anti-FIX-FITC mostrando que após a seleção com o antibiótico obteve-se uma população celular transgênica em que 46% das células expressam a proteína rFIX
7 – Análise da atividade biológica do rFIX presente no sobrenadante das linhagens celulares CHO/rFIX, Hek-293/rFIX e Hep-G2/rFIX
pós a confirmação da expressão do RNAm relativo ao fator IX e da proteína FIX no citoplasma das populações transgênicas CHO/rFIX, Hek-239/rFIX e Hep-G2/rFIX prosseguirmos com os ensaios de análise da atividade biológica do
rFIX, presente no sobrenadante destas linhagens, por meio do teste da tromboplastina parcial ativada (TTPA). Considerando que o fator IX é uma proteína dependente de vitamina K, as células foram tratadas com vitamina K por um período de 10 dias antes da análise. Conforme mostra a tabela 5, as células Hep-G2/rFIX mostraram a produção de rFIX biologicamente ativo da ordem de 274% ou 2,7 IU/mL, o que representa 2,7 vezes maior que o nível do FIX presente no plasma sanguíneo humano. Entretanto, o mesmo não foi observado para a linhagens celular CHO/rFIX, em que os níveis observados de rFIX foram similares aos níveis obtidos para o sobrenadante da respectiva linhagem celular virgem. No que diz respeito à linhagem celular Hek-239/rFIX o nível obtido de Fator IX biologicamente ativo foi da ordem de 11,8 IU/mL. Esse aumento de 4 vezes na quantidade de FIX produzido na Hek-239/rFIX quando comparado com a quantidade de FIX produzido na Hep-G2/rFIX pode ser explicado pelo fato da primeira ter sido submetida ao tratamento com os indutores da secreção protéica, PMA e o
A

52
Ionóforo de Cálcio, ao passo que a Hep-G2/rFIX não recebeu esse tratamento (TABELA 5). Tabela 5 – Análise da atividade biológica nas linhagens celulares CHO, Hek-293
e Hep-G2
AMOSTRA
TEMPO
(SEGUNDOS)
FATOR IX – ATIVIDADE %
(1:10)
FATOR IX –
UI/mL/106/24 hs
Controle negativo (meio de
cultura DMEM)
90,0
1,9 %
---
CHO virgem
87,3 2,2% 0,022
CHO/FIXr
80,0 3,5 % 0,035
Hep-G2 virgem
63,9 23,4%
0,234
Hep-G2/rFIX
42,3 274,9%
2,749
Hek virgem c/ PMA e
A-23187
83,0
3,0 %
0,03
Hek/rFIX c/ PMA e
A-23187
42,1
1177,6 %
11,8
8 – Análise da proteína rFIX presente no sobrenadante de Hek-293/rFIX e Hep-G2/rFIX por western blot
ando continuidade à caracterização da proteína recombinante do FIX presente no sobrenadante das linhagens celulares Hek-293/rFIX e Hep-G2/rFIX produtoras de FIX biologicamente ativo partimos para a análise por western
blot. Para tanto, 24 hs antes da coleta do sobrenadante, foi adicionado a cultura de Hep-G2/rFIX o meio DMEM isento de soro fetal bovino. Em seguida, as proteínas presentes no sobrenadante da Hep-G2/rFIX foram submetidas à eletroforese em gel SDS/PAGE.
Como controle foi preparado o fator IX purificado do plasma FIX (Octanyne). Conforme mostra a figura 32 A, a análise do perfil eletroforético das proteínas presentes no sobrenadante de Hep-G2/rFIX+ mostra um perfil protéico complexo mostrando a presença de proteínas de distintos pesos moleculares, com algum
enriquecimento da faixa entre 60-70 kDa. Na amostra controle (Octanyne) foi observado uma banda mais intensa do tamanho esperado (57 kDa) representando o FIX.
D

53
Em seguida, foi realizado o western blot utilizando o anticorpo monoclonal específico para o FIX e observou-se uma banda imuno-reativa, do tamanho esperado, no sobredante da linhagem celular Hep-G2/rFIX+ confirmando a secreção do rFIX pela linhagem transgênica e a ausência na linhagem não transduzida (FIGURA 32 B). Finalmente a cultura de células trangênicas da Hek-293/rFIX+ e Hek-293 não transduzida, foram tratadas previamente com substâncias indutoras de secreção proteíca, PMA e ionóforo de cálcio, e cultivadas em meio DMEM isento de soro fetal bovino. Após 24 horas o sobrenadante foi coletado e as proteínas foram submetidas à análise por western blot. Conforme mostra a figura 33 A, após a coloração com Coomassie B-Blue o perfil protéico das linhagens celulares Hek-293 virgem e Hek-293/rFIX foram similares, após o tratamento com os indutores da secreção protéica. Após o western blot foi detectada na linhagem Hek-293/rFIX uma banda imuno-reativa, do tamanho de 57 kDa representando o FIX e a ausência do mesmo na linhagem não transduzida (FIGURA 33 B).
Figura 32 - Análise da proteína rFIX no sobrenadante da linhagem celular Hep-G2. A) Eletrofore em gel de poliacrilamida SDS/PAGE 12,5% corado com Coomassie
B-Blue. Raia 1: Controle positivo - FIX derivado do plasma (1,5 g/L - Octanyne).
Raia 2: Hep-G2 virgem (15 g/L) e Raia 3: Hep-G2/rFIX+ (15 g/L). B) Autoradiografia do western blot após a imunodetecção da proteína transferida para membrana de PVDF. Observa-se uma banda imunoreativa do tamanho esperado de 57 kDa na célula produtora de rFIX e no controle positivo, e a ausência da mesma na célula virgem. O marcador peso molecular LMW (fragmentos 97, 66, 45, 30 e 20 kDa)
Figura 33 - Análise da proteína rFIX no sobrenadante da linhagem celular Hek-293. . A) Eletrofore em gel de poliacrilamida SDS/PAGE 12,5% corado com
5 6 7
B
5 6 7
A

54
Coomassie B-Blue. Raia 1: Controle positivo - FIX derivado do plasma (3,5 g/L -
Octanyne), Raia 2: HeK virgem (15 g/L) e Raia 3: HeK/rFIX+ (15 g/L). B) Autoradiografia do western blot após a imunodetecção da proteína transferida para membrana de PVDF. Observa-se uma banda imunoreativa do tamanho esperado de 57 kDa na célula produtora de rFIX e no controle positivo, e a ausência da mesma na célula virgem. O marcador de peso molecular LMW (fragmentos 97, 66, 45, 30 e 20 kDa)

55
VI. DISCUSSÃO
trabalho descrito teve como objetivo principal clonar e expressar o FIX de coagulação sanguínea humana recombinante em linhagens celulares de mamífero utilizando o sistema retroviral.
A molécula recombinante FIX gerada nesse trabalho contém a região codificante completa do cDNA relativo ao fator IX e foi isolada previamente em nosso laboratório a partir da seleção de 108 fagos derivados de uma biblioteca de fígado humano comercial (CLONTECH). O cDNA do FIX foi sub-clonado no vetor bicistrônico denominado pLXIN, por PCR. Após a confirmação da integridade do clone recombinante obtido pelo sequênciamento do DNA o mesmo foi utilizado para a geração de cinco linhagens celulares portadoras em seu genoma do cDNA relativo ao FIX de coagulação sanguínea humana. Dentre as cinco linhagens geradas, duas linhagens celulares EcoPack2TM-293/rhFIX/GFP e RetroPack2TM-PT67/rhFIX são linhagens celulares produtoras do retrovírus recombinante portador do cDNA relativo ao FIX de coagulação sanguínea humana. A geração de duas linhagens celulares produtoras do retrovírus recombinante, uma ecotrópica seguida de uma dualtrópica é uma estratégia comumente utilizada durante a modificação gênica de linhagens celulares utilizando o sistema retroviral e tem por objetivo obter uma linhagem celular produtora de elevados níveis de partículas retrovirais (GUAN et al., 2001; FONTES et al., 2006). Outros fatores importantes que influenciam a obtenção de uma população celular com elevados títulos retrovirais incluem, pH, composição do meio de cultura, densidade celular, entre outros (LEE et al., 1996; WU; ATAAI, 2000). Neste trabalho, nós combinamos essas estratégias, o que resultou na obtenção de uma linhagem celular dualtrópica RetroPack2TM-PT67/rFIX em que 96% das células expressam o fator IX recombinante em seu citoplasma. Em seguida, o retrovírus recombinante produzido pela linhagem RetroPack2TM-PT67/rFIX foi utilizado para transduzir três linhagens celulares: CHO, Hek-293 e Hep-G2. A análise do fator IX recombinante presente no citoplasma destas culturas celulares mostrou, em todos os casos, a expressão estável da proteína com níveis que variavam de 14 a 46% de toda população analisada. Níveis mais altos foram obtidos para a linhagem celular Hep-G2/rFIX+, enquanto os níveis mais baixos foram obtidos para a linhagem CHO/rFIX+. A população celular Hek-293/rFIX+ mostrou expressar níveis intermediários de fator IX em seu citoplasma da ordem de 21%. A variedade do nível de expressão de rFIX pode ser explicada por diferentes razões: 1) a maior ou menor susceptibilidade a infecção viral; 2) diferentes locais de inserção no DNA genômico; 3) número de cópias presentes no genoma; 4) diferenças na maquinaria de transcrição; 5) maior ou menor estabilidade do mRNA relativo ao rFIX; 6) diferenças na maquinaria traducional e pós-traducional, entre outras. Com relação à maior ou menor susceptibilidade a infecção viral, alguns relatos da literatura sugerem que a linhagem celular CHO é bastante resistente à infecção retroviral, o que pode ser explicado pela expressão endógena de uma proteína receptora que bloqueia a entrada do vírus (MILLER D. G.; MILLER, A. D., 1992) ou
O

56
pela secreção de um fator inibidor da infecção retroviral, produzido por hamsters chineses e sirianenses (MILLER, D. G.; MILLER, A. D., 1993). Para contornar esse problema, o tratamento da linhagem celular com tunicamicina, um agente inibidor da glicosilação, tem mostrado aumentar a susceptibilidade dessa linhagem celular à infecção viral. Também nesse estudo, a infecção da linhagem celular CHO com o retrovírus recombinante portador do fator IX não foi possível na ausência do tratamento da mesma com tunicamicina (dados não mostrados). A análise do fator IX recombinante presente no sobrenadante destas culturas celulares Hep-G2/rFIX, Hek-293/rFIX e CHO/rFIX mostrou que duas delas (Hek-293/rFIX e Hep-G2/rFIX) são capazes de produzir o rFIX biologicamente ativo no meio de cultura. Os níveis de atividade biológica do rFIX produzido por essas linhagens celulares foram 2,7 IU/mL/106 células para linhagem Hep-G2/rFIX, na ausência de indutor de secreção protéica e 11 IU/mL/106 células para a linhagem Hek-293/rFIX, na presença do indutor de secreção protéica. Observamos ainda que no caso da linhagem Hek-293/rFIX a produção do fator IX biologicamente ativo foi possível somente após a indução protéica. Esses dados sugerem que a linhagem hepática secreta o rFIX de maneira mais eficiente, quando comparado com a linhagem renal. De fato, estudos prévios em nosso laboratório sobre a produção do rFVIII nessas mesmas linhagens celulares corroboram com esses resultados (RODRIGUES, 2006; PICANÇO, 2006). Também dados da literatura mostram o aumento da expressão de proteínas recombinantes na linhagem celular renal após o tratamento com esses agentes indutores (POCOTTE et al., 1985; JOHNSON et al., 2002). Variações na quantidade produzida de rFIX de acordo com a linhagem celular utilizando vetores virais foi também demonstrado previamente, como por exemplo, em estudos envolvendo as linhagens celulares Hep-G2 e mioblastos de camundongos. Nesse caso, a variação do nível de rFIX observada foi da ordem de 2,5 vezes, sendo 22 pg/célula/24 h para a linhagem Hep-G2/rFIX versus 8 pg/célula/24 h para a linhagem de mioblasto/rFIX (NATHWANI et al., 2001). Também, estudos realizados com a linhagem celular CHO mostraram que embora
elevados níveis do antígeno do fator IX (100 g/mL/24 h) puderam ser detectados em
culturas submetidas à alta estringência de metotrexato, somente 4 g do fator IX secretado era biologicamente ativo sugerindo a heterogeneidade das moléculas recombinantes produzidas por essa linhagem celular (KAUFMAN et al., 1986). Isso foi comprovado mais tarde pelo mesmo grupo de pesquisa, onde após a transfecção dessa linhagem CHO/rFIX com o gene PACE resultou no aumento de 2-3 X na produção do fator IX biologicamente ativo (WASLEY et al., 1993). A análise de outras proteínas recombinantes da coagulação estruturalmente homólogas ao fator IX e que apresentam conservação nas modificações pós-traducionais, como por exemplo, o fator X da coagulação sanguínea mostrou a dificuldade de se obter elevados níveis da proteína biologicamente ativa nas linhagens celulares CHO e Hek-293 (HIMMELSPACH et al., 2000; CAMIRE et al., 2000). Nesses estudos foi demonstrado a geração de uma linhagem celular CHO recombinante
(CHO/rFX) com elevados níveis do antígeno do fator X (120 g/mL/24 h) embora somente 25% do fator X secretado era biologicamente ativo (HIMMELSPACH et al., 2000). Ou ainda, em estudos envolvendo a linhagem celular Hek-293/rFX foi demonstrado o aumento de 2,6 vezes na quantidade de fator X secretado com todos os resíduos de ácido glutâmico carboxilados após a geração de uma molécula quimera, em que, a sequência pró-peptídica foi substituída pela sequência homóloga da protrombina (CAMIRE et al., 2000).

57
Em geral, nesses estudos um consenso existe, a célula hepática Hep-G2 secreta naturalmente diversas proteínas da coagulação, como por exemplo, FX e FVII que apresentam modificações pós-traducionais similares ao fator IX, mas não secreta o fator IX (DE LA SALLE et al., 1985; BERKNER, 1993). Em conjunto, esses dados esclarecem a obtenção de fator IX biologicamente ativo na linhagem celular Hep-G2/rFIX mesmo na ausência de indutores da secreção protéica. No momento, estão sendo conduzidos estudos em nosso laboratório de indução da secreção do FIX na linhagem celular Hep-G2/rFIX para avaliar se o efeito desses indutores é similar ao obtido para a linhagem Hek-293. Uma vez que a linhagem celular Hep-G2 não requer a co-transfecção com genes que auxiliam o processo de modificações pós-traducionais, a estratégia para a seleção de uma população celular com elevados níveis de rFIX consistiu no tratamento com
doses crescentes do antibiótico geneticina (de 800 a 2000 g/mL). De fato, observamos que populações celulares submetidas ao tratamento com baixas doses desse antibiótico não produziram níveis de FIX similares à quantidade de FIX presente no plasma sanguíneo (dados não mostrados). Além da avaliação da atividade biológica do FIX presente no sobrenadante dessas culturas celulares foi realizado a caracterização do mesmo por western blot. Como esperado, foi possível visualizar uma banda imunoreativa de 57 kDa, confirmando a integridade dessa proteína. Em conclusão, o desenvolvimento desse trabalho mostrou a eficácia do sistema retroviral em manter a expressão estável e duradoura da proteína recombinante do fator IX de coagulação sanguínea humana. Além disso, permitiu estabelecer, em nosso laboratório, toda a tecnologia para geração de linhagens celulares transgênicas produtoras de FIX recombinante, como diagnosticá-lo, caracterizá-lo em nossas culturas de células de mamíferos e abre novos caminhos para futuros projetos que visam o desenvolvimento de novos vetores e moléculas recombinantes do FIX com potencial terapêutico.

58
VII. CONCLUSÃO
este trabalho foi realizada a construção de uma molécula de DNA recombinante do FIX contendo a região codificante completa do cDNA relativo ao fator IX de coagulação sanguínea humana;
O fragmento de DNA recombinante rFIX foi sub-clonado no vetor plasmidial retroviral pLXIN e confirmada a autenticidade da sequência por meio do sequenciamento do DNA, seguido do alinhamento com a sequência do cDNA do FIX depositado no NCBI sob número de acesso NM_000133.2; Essa construção recombinante foi utilizada para a geração de cinco linhagens celulares: 1) a linhagem celular EcoPack2™-293/rFIX+ - a qual é uma linhagem produtora de retrovírus recombinante ecotrópica; 2) a linhagem celular RetroPack2TM-PT67/rFIX+ - a qual é uma linhagem produtora de retrovírus recombinante dualtrópica; 3) a linhagem celular CHO/rFIX+; 4) Hek/rFIX+ e 5) Hep-G2/rFIX+, as quais apresentam em seu genoma o cDNA recombinante relativo ao rFIX de coagulação sanguínea humana; As cinco linhagens celulares foram caracterizadas com relação à expressão do mRNA relativo ao rFIX por meio de RT-PCR. Em todos os casos foi demonstrado a presença do mRNA rFIX na linhagem transgênica e a ausência do mesmo na linhagem virgem; A análise da atividade biológica do rFIX produzido pelas linhagens celulares CHO/rFIX+, Hek/rFIX+ e Hep-G2/rFIX+ mostrou a secreção de altos níveis de FIX biologicamente ativo, em duas linhagens Hep-G2/rFIX+ (2,4 IU/mL/24 h) e Hek-293/rFIX (11 IU/mL/24 h) o que corresponde a 2,4 a 11 X superior ao nível de FIX presente no plasma sanguíneo. A linhagem celular CHO/rFIX+ não mostrou secretar FIX biologicamente ativo. A presença da proteína rFIX no sobrenadante das linhagens celulares Hek/rFIX e Hep-G2/rFIX foi confirmada por meio de western blot. Desta forma, como sugestão para futuras pesquisas as linhagens recombinantes Hek239/rFIX e Hep-G2/rFIX aqui geradas poderão:
Ser adaptadas ao crescimento em suspensão para aumentar a quantidade da proteína do rFIX;
Ser submetidas a estudos adicionais em modelos animais hemofílicos com o objetivo de testar a eficácia desta molécula recombinante “in vivo”, bem como, caracterizar a imunogenicidade da mesma.
N

59
VIII. REFERÊNCIAS ANSON, D. S.; CHOO, K. H.; REES, D. J.; GIANNELLI, F.; GOULD, K.; HUDDLESTON, J. A.; BROWNLEE, G. G. The gene structure of human anti-haemophilic factor IX. EMBO J, v.3, n.5, p. 1053-60, May 1984. ANSON, D. S.; AUSTEN, D. E.; BROWNLEE, G. G. Expression of active human clotting factor IX from recombinant DNA clones in mammalian cells. Nature, v.315, n.6021, p.683-5, Jun 20-26. 1985. BERKNER, K. L. Expression of recombinant vitamin K-dependent proteins in mammalian cells: factors IX and VII. Methods Enzymol, v.222, p.450-77. 1993. BITHELL, T.C.Coagulação Sanguínea. In: LEE, G.R.; BITHELL, T.C.; FOERSTER, J.; ATHENS, J.W.; LUKENS, J.N. Hematologia Clínica Wintrobe’s Volume II. 1º ed. brasileira. São Paulo: Editora Manole LTDA, 1998. p. 615 – 668. BIGGS, R.; DOUGLAS, A. S.; MACFARLANE, R. G.; DACIE, J. V.; PITNEY, W. R.; MERSKEY. Christmas disease: a condition previously mistaken for haemophilia. Br Med J, v.2, n.4799, p.1378-82, Dec. 1952. BOLTON-MAGGS, P. H. Optimal haemophilia care versus the reality. Br J Haematol, v.132, v.6, p.671-682, Mar. 2006. BOWEN, D. J. Haemophilia A and haemophilia B: molecular insights. Mol Pathol, v.55, n.1, p.1-18, Feb. 2002. BJÖRKMAN S. Pharmacokinetics of plasma-derived and recombinant factor IX - implications for prophylaxis and on-demand therapy. Haemophilia. 2013 Nov;19(6):808-13. doi: 10.1111/hae.12216. BRADFORD, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem, v.72, p.248-54, May. 1976. BRENNAN, S. O.; PEACH, R. J. The processing of human proinsulin and chicken proalbumin by rat hepatic vesicles suggests a convertase specific for X-Y-Arg-Arg or Arg-X-Y-Arg sequences. J Biol Chem. v.266, n. 32, p. 21504-8, Nov 15. 1991. BURNIER, J. P.; BOROWSKI, M.; FURIE, B. C.; FURIE, B. Gamma-carboxyglutamic acid. Mol Cell Biochem, v.39, p.191-207, Sep 25. 1981. BURNOUF, T. Modern plasma fractionation. Transfus Med Rev, v.21, n.2, p. 101-17, Apr. 2007. BUSBY, S.; KUMAR, A.; JOSEPH, M.; HALFPAP, L.; INSLEY, M.; BERKNER, K.; KURACHI, K.; WOODBURY, R. Expression of active human factor IX in transfected cells. Nature, v.316, n.6025, p.271-3, Jul 18-24. 1985. BUTENAS, S.; MANN, K. G. Blood coagulation. Biochemistry (Mosc), v.67, n.1, p.3-12, Jan. 2002.

60
BUTENAS, S.; ORFEO, T.; GISSEL, M. T.; BRUMMEL, K. E. ; MANN, K. G. The significance of circulating factor IXa in blood. J Biol Chem, v.279, n.22, p. 22875-82, May. 2004. CAMERINO, G.; GRZESCHIK, K.H.; JAYE, M.; DE LA SALLE, H.; TOLSTOSHEV, P.; LECOCQ, J.P.; HEILIG, R.; MANDEL, J.L. Regional localization on the human X chromosome and polymorphism of the coagulation factor IX gene (hemophilia B locus). Proc Natl Acad Sci U S A. v.81, p. 498-502, Jan 2. 1984. CAMIRE, R. M.; LARSON, P. J.; STAFFORD, D. W.; HIGH, K. A. Enhanced gamma-carboxylation of recombinant factor X using a chimeric construct containing the prothrombin propeptide. Biochemistry, v.39, n.46, p. 14322-9, Nov 21. 2000. CHNG, W. J.; SUM, C.; KUPERAN, P. Causes of isolated prolonged activated partial thromboplastin time in an acute care general hospital. Singapore Med J, v.46, n.9, p.450-6, Sep. 2005. CHOO, K. H.; GOULD, K. G.; REES, D. J.; BROWNLEE, G. G. Molecular cloning of the gene for human anti-haemophilic factor IX. Nature, v.299, n.5879, p.178-80, Sep 9. 1982. DAVIE, E. W.; RATNOFF, O. D. Waterfall Sequence for Intrinsic Blood Clotting. Science, v.145, p.1310-2, Sep 18. 1964. DAVIS, H. E.; MORGAN, J. R.; YARMUSH, M. L. Polybrene increases retrovirus gene transfer efficiency by enhancing receptor-independent virus adsorption on target cell membranes. Biophys Chem, v.97, n.2-3, p.159-72, Jun 19. 2002. DAVIS, H. E.; ROSINSKI, M.; MORGAN, J. R.; YARMUSH, M. L. Charged polymers modulate retrovirus transduction via membrane charge neutralization and virus aggregation. Biophys J, v.86, n.2, p.1234-42, Feb. 2004. DE LA SALLE, H.; ALTENBURGER, W.; ELKAIM, R.; DOTT, K.; DIETERLE, A.; DRILLIEN, R.; CAZENAVE, J. P.; TOLSTOSHEV, P.; LECOCQ, J. P. Active gamma-carboxylated human factor IX expressed using recombinant DNA techniques. Nature, v.316, n.6025, p.268-70, Jul 18-24. 1985. DI SCIPIO, R. G.; KURACHI, K.; DAVIE, E. W. Activation of human factor IX (Christmas factor). J Clin Invest, v.61, n.6, p.1528-38, Jun. 1978. FRANCO, R.F. Defeitos Moleculares das Hemofilias A e B. In: ZAGO, M.A.; FALCÃO, R. P.; PASQUINI, R. Hematologia: Fundamentos e Prática. São Paulo: Editora Atheneu, 2001. p.798-802. FONTES, A. M.; DAVIS, B. M.; ENCELL, L. P.; LINGAS, K.; COVAS, D. T.; ZAGO, M. A.; LOEB, L. A.; PEGG, A. E.; GERSON, S. L. Differential competitive resistance to methylating versus chloroethylating agents among five O6-alkylguanine DNA alkyltransferases in human hematopoietic cells. Mol Cancer Ther, v.5, n.1, p. 121-8, Jan. 2006. FURIE, B. C.; FURIE, B. Biosynthesis of factor IX: implications for gene therapy. Thromb Haemost, v.74, n.1, p.274-7, Jul. 1995. GAILANI, D. Activation of factor IX by factor XIa. Trends Cardiovasc Med, v.10, n.5, p.198-204, Jul. 2000.

61
GIANGRANDE, P. Haemophilia B: Christmas disease. Expert Opin Pharmacother, v.6, n.9, p.1517-24, Aug. 2005. GORDON, E. M.; TANG, H.; SALAZAR, R. L.; KOHN, D. B. Expression of coagulation factor IX (Christmas factor) in human hepatoma (HepG2) cell cultures after retroviral vector-mediated transfer. Am J Pediatr Hematol Oncol, v.15, n.2, p.196-203, May. 1993. GUAN, J.; MA, L.; WEI, L. Characteristics of ovarian cancer cells transduced by the bicistronic retroviral vector containing GM-CSF and HSV-TK genes. Chinese Medical Journal, V.114, N.2, p.147-151, Feb. 2001. HARRISON, S.; ADAMSON, S.; BONAM, D.; BRODEUR, S.; CHARLEBOIS, T.; CLANCY, B.; COSTIGAN, R.; DRAPEAU, D.; HAMILTON, M.; HANLEY, K.; KELLEY, B.; KNIGHT, A.; LEONARD, M.; MCCARTHY, M.; OAKES, P.; STERL, K.; SWITZER, M.; WALSH, R.; FOSTER, W. The manufacturing process for recombinant factor IX. Semin Hematol, v.35, n.2 Suppl 2, p.4-10, Apr. 1998. HIGH, K. A. Gene transfer as an approach to treating hemophilia. Circ Res, v.88, n.2, p.137-44, Feb 2. 2001. HIMMELSPACH, M.; PFLEIDERER, M.; FISCHER, B. E.; PLAIMAUER, B.; ANTOINE, G.; FALKNER, F. G.; DORNER, F.; SCHLOKAT, U. Recombinant human factor X: high yield expression and the role of furin in proteolytic maturation in vivo and in vitro. Thromb Res, v.97, v.2, p. 51-67, Jan 15. 2000. HOFFMAN, M. Remodeling the blood coagulation cascade. J Thromb Thrombolysis, v.16, n.1-2, p. 17-20, Aug-Oct. 2003. JOHNSON, K. R.; BECKER, K. P.; FACCHINETTI, M. M.; HANNUN, Y. A.; OBEID, L. M. PKC-dependent activation of sphingosine kinase 1 and translocation to the plasma membrane. Extracellular release of sphingosine-1-phosphate induced by phorbol 12-myristate 13-acetate (PMA). J Biol Chem, v.277, n.38, p.35257-62, Sep 20. 2002. KARLIN, S.; ALTSCHUL, S. F. Methods for assessing the statistical significance of molecular sequence features by using general scoring schemes. Proc Natl Acad Sci U S A, v.87, n.6, p.2264-8, Mar. 1990. KAUFMAN, R. J.; WASLEY, L. C.; FURIE, B. C.; FURIE, B.; SHOEMAKER, C. B. Expression, purification, and characterization of recombinant gamma-carboxylated factor IX synthesized in Chinese hamster ovary cells. J Biol Chem, v.261, n.21, p.9622-8, Jul 25. 1986. KAUFMAN, R. J. Post-translational modifications required for coagulation factor secretion and function. Thromb Haemost, v.79, n.6, p.1068-79, Jun. 1998. KOZAK, S. L.; KABAT, D. Ping-pong amplification of a retroviral vector achieves high-level gene expression: human growth hormone production. J Virol, v.64, n.7, p.3500-8, Jul. 1990. KURACHI K.; DAVIE E.W. Isolation and characterization of a cDNA coding for human factor IX. Proc Natl Acad Sci USA , v.79, p. 6461-64. 1982. KURACHI, S.; PANTAZATOS, D. P.; KURACHI, K. The carboxyl-terminal region of factor IX is essential for its secretion. Biochemistry, v.36, n.14, p.4337-44, Apr 8. 1997.

62
LAMBERT, T.; RECHT, M.; VALENTINO, L. A.; POWELL, J. S.; UDATA, C.; SULLIVAN, S. T.; ROTH, D.A. Reformulated BeneFix((R)): efficacy and safety in previously treated patients with moderately severe to severe haemophilia B. Haemophilia, v.3, n. 13, p.233-43. May. 2007. LEE, S. G.; KIM, S.; ROBBINS, P. D.; KIM, B. G. Optimization of environmental factors for the production and handling of recombinant retrovirus. Appl Microbiol Biotechnol, v.45, n.4, p. 477-83, May. 1996. LE DOUX, J. M.; MORGAN, J. R.; SNOW, R. G.; YARMUSH, M. L. Proteoglycans secreted by packaging cell lines inhibit retrovirus infection. J Virol, v.70, n.9, p.6468-73, Sep. 1996. LILLICRAP, D. The molecular basis of haemophilia B. Haemophilia, v.4, n.4, p.350-7, Jul. 1998. LIND, P.; LARSSON, K.; SPIRA, J.; SYDOW-BACKMAN, M.; ALMSTEDT, A.; GRAY, E.; SANDBERG, H. Novel forms of B-domain-deleted recombinant factor VIII molecules. Construction and biochemical characterization. Eur J Biochem, v.232, n.1, p. 19-27, Aug. 1995. LIU J, JONEBRING A, HAGSTRÖM J, NYSTRÖM AC, LÖVGREN A. Improved Expression of Recombinant Human Factor IX by Co-expression of GGCX, VKOR and Furin. Protein J. 2014 Feb 25. MACFARLANE, R. G. An Enzyme Cascade in the Blood Clotting Mechanism, and Its Function as a Biochemical Amplifier. Nature, v.202, p.498-9, May 2. 1964. MCGRAW, R. A.; DAVIS, L. M.; NOYES, C. M.; LUNDBLAD, R. L.; ROBERTS, H. R.; GRAHAM, J. B.; STAFFORD, D. W. Evidence for a prevalent dimorphism in the activation peptide of human coagulation factor IX. Proc Natl Acad Sci U S A, v.82, n.9, p.2847-51, May. 1985. MIAO C.H.; OHASHI, K.; PATIJN, G.A.; MEUSE ,L. Y.E. X.; THOMPSON, A.R.; KAY, M.A. Inclusion of the hepatic locus control region, an intron, and untranslated region increases and stabilizes hepatic factor IX gene expression in vivo but not in vitro. Mol Ther., v.1, n.21, p. 522-32, Jun 6. 2000. MILLER, A. D. Cell-surface receptors for retroviruses and implications for gene transfer. Proc Natl Acad Sci U S A, v.93, n.21, p.11407-13, Oct 15. 1996. MILLER, D. G.; MILLER, A. D. Tunicamycin treatment of CHO cells abrogates multiple blocks to retrovirus infection, one of which is due to a secreted inhibitor. J Virol, v.66, n.1, p.78-84, Jan. 1992. MILLER, D. G.; MILLER, A. D. Inhibitors of retrovirus infection are secreted by several hamster cell lines and are also present in hamster sera. J Virol, v.67, n.9, p.5346-52, Sep. 1993. MORFINI, M. Pharmacokinetics of factor VIII and factor IX. Haemophilia, v.9 Suppl 1, p.94-9; discussion 100, May. 2003. NATHWANI, A.C.; DAVIDOFF, A.; HANAWA, H.; ZHOU, J.F.; VANIN, E.F.; NIENHUIS, A.W. Factors influencing in vivo transduction by recombinant adeno-

63
associated viral vectors expressing the human factor IX cDNA. Blood, v.97, p. 1258-65, Mar 2001. PEYVANDI, F.; ASSELTA, R.; MANNUCCI, P.M. Autosomal recessive deficiencies of coagulation factors. Rev Clin Exp Hematol, v.5, p. 369-88. 2001. PICANÇO, V. P. Clonagem e expressão do Fator VIII de coagulação humano. Tese de doutorado. FMRP-USP, 2006 POCOTTE, S. L.; FRYE, R. A.; SENTER, R. A.; TERBUSH, D. R.; LEE, S. A.; HOLZ, R. W. Effects of phorbol ester on catecholamine secretion and protein phosphorylation in adrenal medullary cell cultures. Proc Natl Acad Sci U S A, v.82, n.3, p.930-4, Feb. 1985. REZENDE, S. M.; PIMENTEL, B. D.; ARAÚJO, J. P. Knocking down the price of factor concentrates in Brazil. Haemophilia, v.11, n.3, p. 290-1. 2005. ROBERTS, H. R.; LILES D. K. The molecular biology of hemophilia B. In: FORBES, C. D.; ALEDORT, L. M.; MADHOK, R. Hemophilia. 1ª Edition, CHAPMAN; HALL MEDICAL, p. 35-50. 1997. ROBERTS, H. R.; ESCOBAR, D. M.; MONROE, D. More information on patients with factor XI deficiency. Anesthesiology, v.101, n. 5, p. 1253-4, Nov. 2004. RODRIGUES, E. S. Clonagem e expressão do fator VIII recombinante em células de mamífero utilizando o sistema retroviral. Dissertação de mestrado. FMRP-USP, 2006. ROTH, D. A.; KESSLER, C. M.; PASI, K. J.; RUP, B.; COURTER, S. G.; TUBRIDY, K. L. Human recombinant factor IX: safety and efficacy studies in hemophilia B patients previously treated with plasma-derived factor IX concentrates. Blood, v.98, n.13, p.3600-6, Dec 15. 2001. SAMBROOK, J.; FRITSCH, E. F., MANIATIS, T. Molecular Cloning – A Laboratory Manual. 2ª Edition. United States of America: Cold Spring Harbor Laboratory Press.1989. SCHMIDT, A. E.; BAJAJ, S. P. Structure-function relationships in factor IX and factor IXa. Trends Cardiovasc Med, v.13, n.1, p.39-45, Jan. 2003. SMITH, T. A.; MEHAFFEY, M. G.; KAYDA, D. B.; SAUNDERS, J. M.; YEI, S.; TRAPNELL, B. C.; MCCLELLAND, A.; KALEKO, M. Adenovirus mediated expression of therapeutic plasma levels of human factor IX in mice. Nat Genet, v.5, n. 4, p. 397-402, Dec. 1993. SCHULTE S. Challenges for new haemophilia products from a manufacturer's perspective. Thromb Res. 2013 Dec 19. pii: S0049-3848(13)00491-X. SERBAN M, SKOTNICKI AB, COLOVIC M, JINCA C, KLUKOWSKA A, LAGUNA P, WOLF DM. Clinical efficacy, safety and pharmacokinetic properties of the plasma-derived factor IX concentrate Haemonine in previously treated patients with severe haemophilia B. Haemophilia. 2012 Mar;18(2):175-81. doi: 10.1111/j.1365-2516.2011.02624.x. TARAN, L. D. Factor IX of the blood coagulation system: a review. Biochemistry (Mosc), v.62, n.7, p.685-93, Jul. 1997.

64
TEITEL, J. M.; BARNARD, D.; ISRAELS, S.; LILLICRAP, D.; POON, M. C.; SEK, J. Home management of haemophilia. Haemophilia, v.10, n.2, p.118-33, Mar. 2004. THOMPSON, A. Recombinant factor IX for the treatment of hemophilia B. Introduction. Semin Hematol, v.35, n.2 Suppl 2, p.1-3, Apr. 1998. UNITED KINGDOM HAEMOPHILIA CENTRE DOCTORS' ORGANISATION (UKHCDO). Guidelines on the selection and use of therapeutic products to treat haemophilia and other hereditary bleeding disorders. Haemophilia, v.9, n.1, p. 1-23, Jan. 2003. VERMA, I. M.; SOMIA, N. Gene therapy -- promises, problems and prospects. Nature, v.389, n.6648, p.239-42, Sep 18. 1997. WAJIH, N.; HUTSON, S.M.; OWEN, J.; WALLIN, R. Increased production of functional recombinant human clotting factor IX by baby hamster kidney cells engineered to overexpress VKORC1, the vitamin K 2,3-epoxide-reducing enzyme of the vitamin K cycle. J Biol Chem., v. 280, n. 36, p. 31603-7. Sep 9. 2005. WASLEY, L. C.; REHEMTULLA, A.; BRISTOL, J. A.; KAUFMAN, R. J. PACE/furin can process the vitamin K-dependent pro-factor IX precursor within the secretory pathway. J Biol Chem, v.268, n.12, p.8458-65, Apr 25. 1993. WHITE, G. C., 2ND; BEEBE, A.; NIELSEN, B. Recombinant factor IX. Thromb Haemost, v.78, n.1, p.261-5, Jul. 1997. WHITE, G. C., 2ND; PICKENS, E. M.; LILES, D. K.; ROBERTS, H. R. Mammalian recombinant coagulation proteins: structure and function. Transfus Sci, v.19, n.2, p.177-89, Jun. 1998. WISE, R. J.; BARR, P. J.; WONG, P. A.; KIEFER, M. C.; BRAKE, A. J.; KAUFMAN, R. J. Expression of a human proprotein processing enzyme: correct cleavage of the von Willebrand factor precursor at a paired basic amino acid site. Proc Natl Acad Sci U S A, v.87, n.23, p.9378-82 Dec. 1990. WOLBERG, A. S.; MORRIS, D. P.; STAFFORD, D. W. Factor IX activation by factor XIa proceeds without release of a free intermediate. Biochemistry, v.36, n.14, p.4074-9, Apr 8. 1997. WU, N.; ATAAI, M. M. Production of viral vectors for gene therapy applications. Curr Opin Biotechnol, v.11, n.2, p. 205-8. Apr. 2000. WURM, F. M. Production of recombinant protein therapeutics in cultivated mammalian cells. Nat Biotechnol, v.22, n.11, p.1393-8, Nov. 2004. XU, F.; SATOH, E.; IIJIMA, T. Protein kinase C-mediated Ca2+ entry in HEK 293 cells transiently expressing human TRPV4. Br J Pharmacol, v.140, n.2, p.413-21, set., 2003. YOSHITAKE, S.; SCHACH, B. G.; FOSTER, D. C.; DAVIE, E. W.; KURACHI, K. Nucleotide sequence of the gene for human factor IX (antihemophilic factor B). Biochemistry, v.24, n.14, p.3736-50, Jul 2. 1985.

65
YU, Y.; MILLAR, C.M. Measurement of factor IX activity in plasma-derived and recombinant concentrates: insights from thrombin generation and activation-based assays. J Thromb Haemost., v. 12, n. 01, p. 62-70, jan., 2014. doi: 10.1111/jth.12452. FOOD AND DRUG ADMINISTRATION (FDA). Apresenta a empresa licenciada para a produção do Fator IX da coagulação sangüínea humana recombinante. Disponível em:
<http://www.fda.gov/cber/efoi/approve.htm Acesso em: 9 mar. de.2014. COORDENAÇÃO DA POLÍTICA NACIONAL DE SANGUE E HEMODERIVADOS (CPNSH) DO MINISTÉRIO DA SAÚDE. Disponível em: <http://portal.saude.gov.br/saude> Acesso em: 01 jan. 2014.

66
CASTILHO-FERNANDES, A. et al. Produção da proteína recombinante Fator IX da coagulação sanguínea humana em células de mamífero. 1ª edição: Duque de Caxias: Espaço Científico Livre Projetos Editoriais, 2014.

ESPAÇO CIENTÍFICO LIVREprojetos editoriais

ESPAÇO CIENTÍFICO LIVREprojetos editoriais

ESPAÇO CIENTÍFICO LIVREprojetos editoriais

Produção da proteína recombinanteFator IX da coagulação sanguíneahumana em células de mamífero
ANDRIELLE CASTILHO-FERNANDES, APARECIDA MARIA FONTES, LUCINEI ROBERTO DE OLIVEIRA, MARTA REGINA HESPANHOL & DIMAS TADEU COVAS
A hemofilia B é uma doença ligada ao cromossomo X e consiste na deficiência do fator IX da coagulação sanguínea. O cDNA relativo ao fator IX apresenta 1.4 kb e codifica uma proteína de 281 aminoácidos e peso molecular de 57 kDa. Atualmente, existe no Brasil cerca de 1300 pacientes hemofílicos B e a forma de tratamento envolve o uso do fator IX derivado do plasma (pdFIX). O custo deste produto é muito elevado e está sujeito a contaminação viral que não é eliminada por completo durante o processo de purificação do pdFIX. Isso gera incentivo para a produção do mesmo em sistemas celulares in vitro de origem brasileira, livre de agentes infecciosos. O objetivo principal desse trabalho consistiu em clonar e expressar o cDNA relativo ao FIX da coagulação sanguínea humana em células de mamífero utilizando o sistema retroviral. A estratégia experimental consistiu em isolar e clonar o cDNA a partir de um clone de cDNA previamente isolado de uma biblioteca de fígado humano. O cDNA relativo ao fator IX foi isolado deste clone por meio de PCR e subsequentemente foi submetido a digestão com enzimas de restrição específicas para a clonagem no vetor retroviral pLXIN. Em seguida foi confirmada a autenticidade do clone recombinante por meio do sequenciamento de DNA. O vetor de expressão recombinante, pLXIN-rFIX, foi transfectado na linhagem produtora de retrovírus Eco-Pack2™-293. Pela técnica de “ping-pong” os vírus produzidos por essa linhagem EcoPack2™-293/rFIX+ foram utilizados para infectar a linhagem empacotadora de retrovírus Retro-Pack2™-PT67. A análise por citometria de fluxo mostrou que a população RetroPack2TM-PT67/rFIX+ apresenta elevados níveis de rFIX, da ordem de 96%. Finalmente, os vírus produzidos pela RetroPack2TM-PT67/rFIX+ foram utilizados para transduzir três linhagens celulares de mamífero: CHO, Hek-293 e Hep-G2. A presença do mRNA relativo ao FIX foi mostrado nas três linhagens recombinantes por RT-PCR. Também a presença da proteína citoplasmática rFIX foi demonstrada por citometria de fluxo nas três linhagens celulares em diferentes níveis (CHO/rFIX+ - 14,5%; Hek-293/ rFIX+ - 21% e Hep-G2/rFIX+ - 46%). Em seguida, a análise da atividade biológica do rFIX produzido por essas linhagens celulares mostrou a secreção de altos níveis de FIX biologicamente ativo, em duas linhagens Hep-G2/rFIX+ (2,4 IU/mL/24 h) e Hek-293/rFIX+ (11 IU/mL/24 h) e a ausência do mesmo na linhagem CHO/rFIX+. Finalmente, os sobrenadantes das culturas que mostraram apresentar o FIX biologicamente ativo foi caracterizado por western blot confirmando a presença de uma banda imunorreativa esperada de 57 kDa. Em conjunto, esse trabalho mostrou a potencialidade do sistema retroviral para a expressão do FIX humano em linhagens celulares de mamífero e a existência de peculiaridades em cada linhagem as quais podem proporcionar diferentes níveis de expressão e produção do FIX biologicamente ativo. Esse trabalho permitiu estabelecer toda a tecnologia para geração de linhagens celulares transgênicas produtoras de rFIX e futuros estudos em modelos animais poderão ser conduzidos para a elucidação minuciosa da molécula recombinante rFIX aqui gerada.
ESPAÇO CIENTÍFICO LIVREprojetos editoriais