RECONSTITUIÇÃO TENDÍNEA EM EQUINOS - …arquivo.fmu.br/prodisc/medvet/amas.pdf · mecânico,...
Transcript of RECONSTITUIÇÃO TENDÍNEA EM EQUINOS - …arquivo.fmu.br/prodisc/medvet/amas.pdf · mecânico,...
AMANDA MAZZO DE AQUINO E SANTOS
RECONSTITUIÇÃO TENDÍNEA EM EQUINOS
SÃO PAULO
2010
Trabalho apresentado ao Curso de Medicina Veterinária – FMU, como exigência de avaliação para a obtenção do título de Bacharel, sob a orientação da Professora Giovana D Andrea Pavão
AMANDA MAZZO DE AQUINO E SANTOS
RECONSTITUIÇÃO TENDÍNEA EM EQUINOS
______________________________________________________________
Prof. Giovana D Andrea Pavão
FMU – Orientador
______________________________________________________________
Prof. Antonio Carlos Bolino
FMU
_____________________________________________________________
Anandra Alves Rodrigues
Médica Veterinária
Trabalho apresentado à disciplina do curso de Medicina Veterinária da FMU, sob a orientação da Professora Giovana D Andrea Pavão. Defendido em14/06/2010. Pela banca examinadora constituída pelos professores:
“ Dedico à Deus, por ter me dado a oportunidade de conhecer e vivenciar ao lado
de um grande amigo, meu cavalo, Vitorioso, onde pude encontrar respostas para as
mais diversas dúvidas e compartilhar muita alegria, cumplicidade, angústias e
aprendizado.”
Amanda Mazzo de Aquino e Santos
“Agradeço primeiramente a Deus, por me dar a vida, pra que eu consiga caminhar
com a minha própria autonomia. Agradeço aos meus pais que me deram todo o
apoio quando eu mais precisei. Agradeço ao meu marido Caio sempre ao meu lado
me incentivando nos momentos mais difíceis. Agradeço minhas irmãs, por estarem
ao meu lado nessa trajetória e também a uma amiga em especial, Anandra
Rodrigues com sua experiência na área da Medicina Veterinária na qual me ajudou
muito. Agradeço a minha orientadora Giovana Pavão, por me apoiar e me instruir
com palavras de sabedoria sempre.”
Amanda Mazzo de Aquino e Santos
Sumário
Resumo..................................................................................................... 6
Abstract.................................................................................................... 7
Revisão de Literatura.............................................................................. 8
1 Introdução................................................................................................ 8
2 Estrutura dos Tendões........................................................................... 9
3 TENDINITE................................................................................................ 13
3.1 Etiologia das Tendinites.......................................................................... 13
3.2 Classificação das Tendinites................................................................. 13
3.3 Patogenia das Tendinites........................................................................ 13
4 FISIOPATOLOGIA DA LESÃO E REPARO............................................. 16
5 SINAIS CLÍNICOS DA LESÃO................................................................. 18
6 DIAGNÓSTICO.......................................................................................... 19
7 TRATAMENTO.......................................................................................... 20
7.1 Fármacos.................................................................................................. 21
7.2 Fisioterapia............................................................................................... 23
7.3 Plasma Rico em Plaquetas..................................................................... 25
7.4 Célula Tronco........................................................................................... 27
8 Conclusão................................................................................................. 29
9 Bibliografia............................................................................................... 30
RESUMO
Hoje em dia com o avanço da equideocultura e o aumento dos eventos
esportivos nas diversas modalidades, há maior predisposição a lesões
musculoesqueléticas entre elas a tendinite nesta espécie. As tendinites
constituem um dos problemas mais graves e limitantes dos eqüinos
submetidos a exercícios, pois, embora tratados, a composição, estrutura e
função tendínea podem não ser recuperados. Os proprietários desses
animais desejam que eles voltem ao trabalho o mais rápido possível e isso
estimula a necessidade de ter novos tratamentos como, o PRP (plasma rico
em plaquetas), células tronco e a fisioterapia sendo esta utilizada como
terapia adjuvante.
Palavras-chave: Eqüinos, tendinites, célula tronco, plasma rico em
plaquetas.
6
ABSTRACT
Nowadays, with the growing of horse breeding and equestrian sports, horses
have become much more predisposed to muscle-skeleton injuries including
tendinitis. The tendinitis is one of the most serious problems that limit horses
submitted to exercise and sports because, although treated, the composition,
structure and function of tendon could not be fully recovered. Today’s
demand of horse owners that the animals return to work as quickly as
possible is stimulating new treatments, such as PRP (Platelet-Rich Plasma),
Stem Cell and Physiotherapy.
Key words: horses, tendinitis, stem cell, platelet-rich plasma.
7
INTRODUÇÃO
A exaustão e o esforço repetitivo realizado pelos eqüinos sobre os tendões,
durante o trabalho e as atividades atléticas predispõe ao aparecimento de
micro lesões associadas ou não à ruptura de fibras colágenas. Quando
essas lesões se desenvolvem no interior do tendão, ocorre a tendinite que
representa grande perda financeira no meio eqüestre, pois, além da
reparação tendínea e a reabilitação do animal serem processos
prolongados, o alto índice de recidivas, inclusive nos tendões aparentemente
bem reparados, pode significar o fim da carreira esportiva do animal
(ALVES, 1998).
Fatores extrínsecos como a conformação, idade do animal, nível de
treinamento e tipo de ferradura, também estão implicados na etiopatogenia
das lesões. No entanto, os mecanismos geradores específicos e suas inter-
relações na gênese das lesões não são bem conhecidos. Entretanto
qualquer das estruturas tendíneas palmares ou plantares dos dígitos dos
eqüinos podem sofrer lesões, sendo o tendão flexor digital superficial (TFDS)
as mais afetadas, seguido pelo tendão flexor digital profundo (TFDP)
(STASHAK, 1994).
A principal função dos tendões é transmitir a ação do músculo
correspondente ao osso no qual ele se insere. Sabe-se que os tendões
possuem propriedades bioquímicas únicas, assim quando o tendão recebe
exigências que ultrapassam sua capacidade funcional, fica exposto à
traumas e, algumas vezes irreversíveis para a vida atlética do animal
(CAMARGO e MORAES 2003)
Até certo nível de esforço físico (sem fadiga muscular), o músculo possui
características como elasticidade e flexibilidade. Após certo ponto de tensão
as fibras tendinosas começam a deslizarem-se umas com as outras,
8
iniciando, nesse momento, um fenômeno destrutivo entre elas
(JONES,1992).
Grande variedade de tratamentos tem sido utilizada nas tendinites. A maioria
dos métodos, (como a utilização de medicamentos por exemplo) porém, tem
embasamento empírico e não proporciona a recuperação ideal do tecido.
Além disso, na maior parte dos trabalhos, a avaliação dos tratamentos
empregados é subjetiva, baseada na opinião de proprietários, treinadores e
veterinários, ou ainda em relatórios sobre o desempenho atlético após o
tratamento (MARXEN, 2001).
ESTRUTURA DOS TENDÕES:
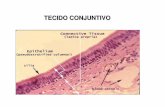
O tendão é constituído de tecido conjuntivo fibroso e age na inserção do
músculo ao osso. Eles são compostos de tecido conjuntivo denso e regular e
possuem um arranjo específico que reflete as exigências mecânicas desse
tecido. Os principais constituintes são feixes paralelos espessos e bem
compactos de colágeno orientados longitudinalmente. Os fibroblastos
(tendoblastos) estão dispostos em longas fileiras paralelas nos espaços
entre os feixes de colágeno (STASHAK 1994).
Os fascículos podem estender-se independentemente em tendões normais.
Conseqüentemente, quando o tendão é estirado além do seu limite
mecânico, algumas fibrilas irão romper-se antes de outras, resultando em
ruptura parcial, observada freqüentemente nas tendinites ( GOODSHIP,
1993).
O colágeno é uma proteína que possui várias funções como, por exemplo,
unir e fortalecer os tecidos. Ele proporciona força tênsil ao tendão e é
predominantemente do tipo I em tendões normais adultos (95%), com uma
pequena proporção de tipo III, IV e V. É estimado que o colágeno do tendão
seja regenerado a cada 6 meses (WATKINS, 1992). A degradação do
colágeno, para renovação, é iniciada por enzimas específicas, as
colagenases. Essas enzimas quebram as moléculas que se tornam
9
susceptíveis ao ataque de proteases não específicas (JUNQUEIRA &
CARNEIRO, 1999)
No animal neonato e nos estágios iniciais da reparação tendínea, as fibrilas
tendíneas são predominantemente de pequeno diâmetro e mecanicamente
mais frágeis. Nesses casos, o tecido aumenta sua resistência com o passar
do tempo devido ao aumento tanto do diâmetro fibrilar como de interligações
quimicamente estáveis (GOODSHIP, 1993). As fibrilas de maior diâmetro
proporcionam força tênsil, enquanto as de menor diâmetro proporcionam
elasticidade (POOL, 1992).
Os tendões possuem grande resistência as tensões e baixa extensibilidade.
Em termos mecânicos, esses servem principalmente como transmissores de
forças. No entanto, outras funções mecânicas atribuídas mais recentemente
a eles incluem a de amplificação dinâmica durante as contrações
musculares rápidas, de reserva de energia elástica e de atenuador de forças
durante movimentos rápidos e inesperados (STASHAK, 1994).
Entre os feixes de fibras colágenas, existe pequena quantidade de
substância fundamental amorfa e de células tendíneas. A célula mais ativa
do tecido tendíneo é o fibroblasto e a quiescente é conhecida como fibrócito.
O fibroblasto tem prolongamentos citoplasmáticos irregulares, seu núcleo é
ovóide, claro e grande, com cromatina fina e nucléolo evidente. O fibrócito é
uma célula menor, fusiforme e com menor número de prolongamentos
citoplasmático. Tem núcleo menor, alongado e mais escuro, disperso
paralelamente entre as fibras colágenas. O citoplasma é acidófilo,
dificilmente visível ao microscópio óptico. Os fibroblastos sintetizam as fibras
colágenas e as glicoproteínas e proteoglicanas da matriz extracelular.
Havendo estímulo adequado, como na cicatrização, o fibrócito pode voltar a
sintetizar fibras, reassumindo a estrutura de fibroblasto (BANKS,1992;
JUNQUEIRA e CARNEIRO, 1999).
A matriz extracelular é um gel incolor, muito hidratado e transparente que
preenche o espaço entre as células e as fibras do conectivo. Essa matriz é
formada por proteoglicanas e glicoproteínas. As proteoglicanas são
compostos macromoleculares constituídos por glicosaminoglicanas
sulfatadas ligadas por covalência às proteínas. Glicosaminoglicanas são
10
polímeros lineares não ramificados de peso molecular elevado, formados por
unidades dissacarídicas constituídas por ácido urônico e hexosamina. Por
sua hidratação, as moléculas de proteoglicanas ocupam enorme espaço,
tornando-se muito eficientes para resistir à força de compressão, enquanto
as fibras colágenas são muito resistentes à força de distensão (BANKS,
1992; JUNQUEIRA e CARNEIRO, 1999).
As fibras colágenas do tendão formam fascículos envoltos por tecido
conectivo frouxo, o endotendíneo. O epitendíneo envolve toda a unidade
tendínea. Finalmente, o tendão, na região metacarpiana, é envolvido por
bainha de tecido conectivo denso, o paratendão ( BANKS, 1992).
O suprimento sanguíneo dos tendões é de origem segmentar. Nas áreas
extra-sinoviais, este suprimento origina-se do paratendão e das junções mio
e osteotendinosas. Nas áreas sinoviais, como no túnel carpiano e no canal
digital, o suprimento sanguíneo difunde-se pelo mesotendão e pelos vínculos
que alcançam o tendão em sua face dorsal (MARXEN, 2001). Dentro dos
tendões, os vasos do epitendíneo formam canais longitudinais no
endotendíneo, que se anastomosam, criando um complexo sistema vascular
intrínseco (WATKINS, 1992). Em estudo realizado por KRAUS-HANSEN et
al. (1992), concluiu-se que o suprimento sanguíneo do tendão flexor digital
superficial (TFDS) normal de eqüinos é primariamente intratendíneo. Estes
autores produziram condições similares à tendinite aguda de ocorrência
natural ao interromperem o suprimento sanguíneo intratendíneo, concluindo
que o dano vascular poderia ser importante fator etiopatogênico. A
diminuição do suprimento sanguíneo afeta a nutrição necessária para a
manutenção do tecido e a formação de novas fibrilas de colágeno, assim
como a remoção de grande número de produtos resultantes da atividade
metabólica do tendão submetido a esforço contínuo (WATKINS, 1992).
Foi demonstrado que o músculo e o osso fornecem sangue para os 25%
proximais e distais do tendão, e pode-se supor que o paratendão tem um
papel importante. Observações realizadas no membro dianteiro dos eqüinos
concluíram que tanto na região proximal quanto na distal, os tendões
flexores digitais profundos e superficiais recebem vasos das suas inserções
musculares e periosteais, respectivamente. No interior da bainha cárpica, os
11
ramos primários da artéria mediana irrigam as superfícies desses tendões
via mesotendão e outros ramos correm paralelos aos tendões flexores até o
metacarpo. Entre as bainhas cárpicas e digitais os tendões, estão envolvidos
pelo paratendão, a partir do qual os vasos penetram no tendão (STASHAK,
1994).
Na bainha digital, o tendão flexor digital superficial recebe sangue,
caudalmente, de vasos que passam através do ligamento anular do boleto e,
dorsalmente, de vasos que se originam da artéria digital comum, que passa
sobre a superfície do tendão e da bainha digital. Do mesmo modo, vasos da
artéria digital irrigam o tendão flexor superficial distalmente ao boleto, mas
não há anostomoses entre esses dois grupos de vasos. O tendão flexor
profundo é irrigado na região próxima, no interior da bainha digital, por
ramos da artéria palmar medial ( artéria palmar digital comum III) e,
distalmente, por um vínculo. Foram identificadas regiões de menor
vascularização nos tendões flexores e relacionadas a uma predisposição a
alterações degenerativas (STASHAK, 1994).
A perfusão vascular também exerce papel importante no processo de
reparação. Em estudo realizado por HATAKA (1998), os resultados das
análises macroscópicas, morfométrica de neovasos e histopatológica da
cicatrização do tendão flexor digital profundo de cães, demonstraram intensa
e gradativa neovascularização durante o processo de reparo tendíneo,
atingindo o grau máximo aos 60 dias após a cirurgia.
O suporte sanguíneo intrínseco ao tecido lesado é evidenciado pelo
crescimento das células do epitendíneo (STASHAK, 1994).
A reparação extrínseca predomina na maioria dos casos, e é resultado da
estimulação do tecido peritendíneo para proliferar e suprir células e capilares
necessários para a cicatrização. Por outro lado, este processo também é
responsável pela formação de aderência do tendão aos tecidos adjacentes,
limitando sua função de deslizamento após o processo de reparação
(WATKINS,1992).
12
TENDINITES:
Etiologia Das Tendinites:
A etiologia das tendinites foi alvo de numerosas investigações nos últimos
anos. Além dos danos vasculares, as causas mais comumente citadas são
fadiga, microtraumas, forças biomecânicas incompatíveis e nutrição
inadequada. Possivelmente, há mais de uma patogênese envolvida
(KRAUS-HANSEN et al., 1992).
Classificação Das Tendinites:
Segundo Stashak (1994) a tendinite ou a tendossinovite foram também
classificadas quanto à posição:
Alta- imediatamente distal ao carpo ou tarso.
Média- no terço médio do metacarpo ou metatarso
Baixa- no terço distal do metacarpo ou metatarso e na região do
ligamento anular palmar ou plantar. O tendão flexor digital profundo
pode também estar afetado distalmente à articulação do boleto. Isto
foi chamado de tendinite muito baixa.
Patogenia Das Tendinites:
Tendinite é o processo inflamatório que pode acometer principalmente os
tendões flexores e suas bainhas sinoviais dos membros anteriores dos
cavalos de corrida, ou do membros posteriores dos cavalos de sela e tração,
podendo também acometer animais de outras modalidades esportivas
(THOMASSIAN,2005).
Alterações tendíneas degenerativas causadas por fadiga representam as
tendinites de origem intrínseca e geralmente ocorrem durante atividades
esportivas. Tensões geradas durante movimentos de excessiva intensidade
ou realizados em condições não fisiológicas, como na exaustão, e o
estiramento repetitivo do tendão na fase de apoio do passo, podem resultar
13
na formação de microlesões nas fibras colágenas e nos vasos sanguíneos e
linfáticos (FORNAGE & RIFKIN, 1988).
A causa determinante mais comum da tendinite é o esforço exagerado de
extenção sobre os tendões, causando distensão de suas fibras, que por não
suportarem a tração mecânica, podem apresentar rupturas parciais
desenvolvendo severa e dolorosa reação inflamatória local (THOMASSIAN,
2005).
Estas tendinites de origem intrínseca, secundárias às forças excessivas
exercidas pelo tendão, envolvem caracteristicamente a região metacarpiana
central do TFDS dos membros torácicos de cavalos de corrida e de caça.
Evidências histológicas justificam esta ocorrência como sendo esta a porção
do tendão com o menor diâmetro de secção transversal e onde o suprimento
sanguíneo intratendíneo é considerado relativamente deficiente (POOL,
1992; WATKINS, 1992).
As tendinites de origem intrínseca ocorridas naturalmente (sem esforço
físico) iniciam-se por rupturas fibrilares seguidas de hemorragia, exsudação
e formação de hematoma intratendíneo, com conseqüente aumento de
volume e inflamação. Este exsudato e a hemorragia separam e
inevitavelmente enfraquecem as fibras tendíneas normais restantes,
ampliando os danos ao tendão juntamente com a ação de proteases e
colagenases liberadas continuamente pelos macrófagos do exsudato
inflamatório. Dentro de algumas horas após a lesão, numerosos fibroblastos
de reparação do tecido conectivo interfascicular e do peritendão encontram-
se distribuídos em fileiras longitudinais entre as fibras tendíneas (MARXEN,
2001).
Os neutrófilos são estimulados a remover debris necróticos em conjunto com
os monócitos que tornam-se macrófagos teciduais e estimulam a migração
de fibroblastos do tecido perivascular para o interior do coágulo de fibrina,
iniciando a deposição de colágeno. Além disso, os macrófagos, juntamente
com plaquetas ativadas, induzem à neovascularização, transformando o
coágulo de fibrina em um tecido de granulação fibrovascular, como parte do
processo de reparação (WATKINS, 1992).
14
O controle desta cascata de eventos parece ser mediada por fatores de
crescimento peptídicos. MURPHY & NIXON (1997) demonstraram que o
fator de crescimento IGF-I aumenta o metabolismo do tenócito intrínseco em
tendões normais de equinos.
Após a remoção do tecido lesado, forma-se a cicatriz. Neste tecido cicatricial
novo, o colágeno é inicialmente imaturo, predominantemente do tipo III, com
fibrilas de pequeno diâmetro dispostas de maneira desorganizada. O
processo de maturação e organização ocorre com o tempo e o diâmetro das
fibrilas aumenta, juntamente com a proporção de colágeno do tipo I. Este
processo leva semanas a meses, ainda assim, sem a recuperação
morfofuncional original do tendão. Nas lesões crônicas, o tecido cicatricial
imaturo, embora hipertrófico, é frágil e o local de maior fragilidade é a
transição entre o tecido patológico e o tecido hígido, onde as recidivas
geralmente ocorrem (MARXEN, 2001).
Como foi mencionado anteriormente, o tendão flexor digital superficial do
membro dianteiro é o afetado com maior freqüência nos cavalos da raça
puro-sangue. Isso foi relacionado à sua menor área de secção transversal e
ao maior estresse que suporta durante a hiperextensão do boleto, quando
comparado ao tendão digital profundo (STASHAK, 1994).
Permanece incerto se uma degeneração primária predispõe a uma lesão
tendínea. Um estudo sugere que a degeneração isquêmica precede a lesão
aguda . Outro trabalho demonstrou que não há aumento do suprimento
sanguíneo em resposta ao exercício no tendão normal, o que levanta a
questão de quanta vascularização é necessária para que o tendão resista ao
estresse (MARXEN, 2001).
Nos tendões flexores há três regiões naturalmente isquêmicas: a medula
central do ligamento acessório do carpo (inferior), a região no meio do
metacarpo do tendão flexor digital superficial e o tendão flexor digital
profundo ao nível da articulação do boleto. Essas regiões tem sido
associadas a um maior número de problemas clínicos. No tendão flexor
digital superficial, pelo menos, a informação quanto aos locais de incidência
de lesões naturais apóia essa teoria, segundo a qual a maioria dos
problemas ocorreria na região do meio do metacarpo. Notou-se também que
15
as lesões em nível da articulação do boleto geralmente envolvem o tendão
flexor digital profundo. Todavia, foi também questionado como um sistema
vascular normal sobreviveria às rápidas variações de pressão no interior do
tendão flexor digital profundo, quando passa em torno da articulação do
boleto de um cavalo ao galope, sugerindo-se que, se o tendão flexor digital
profundo fosse seriamente prejudicado por esta falta de suprimento
sanguíneo, a freqüência de lesões deveria ser maior neste tendão e nesta
região (MARXEN, 2001).
4 FISIOPATOLOGIA DA LESÃO E REPARO:
Os tendões dos eqüinos são frequentemente agredidos por processos de
etiologias distintas, que se expressam no nível tecidual por fenômenos
degenerativos e alterações inflamatórias em diferentes graus de intensidade
(MIKAIL, 2006).
A lesão e degeneração dos tendões ocorrem em todos os graus de
intensidade, variando tanto de lesões subclínicas leves que podem ser
detectadas apenas pela termografia ( mapeamento térmico da temperatura
superficial do cavalo, e como o calor é um dos sinais da inflamação, o
aparelho é capaz de demonstrar esse calor) até as com ruptura total do
tendão que são avaliadas por ultrassonografia. A lesão aguda no tendão é
tipicamente acompanhada por hemorragia, edema, acúmulo de fibrina e
inchaço local. O dano e degeneração das fibrilas são reconhecidos
histologicamente e a necrose pode associada a uma lesão grave das fibrilas.
(STASHAK, 1994).
Uma força acima do limite de resistência da estrutura pode produzir
deslocamento e ruptura das fibras. Essa ruptura resulta em hemorragia de
arteríolas e capilares locais e formação de hematoma no interior do tendão,
que pode estender-se para o paratendão. O resultado imediato é a
deposição de fibrina, que atrai neutrófilos para a região. Congestão e
acúmulo de fluídos ocorrem no local da agressão, podendo haver também
isquemia e necrose de tenócitos. A extensão da necrose na região está
relacionada ao grau de comprometimento vascular (MIKAIL, 2006).
16
A cura após uma lesão grave ao tendão envolve a formação do tecido de
granulação, que é seguido pela sua organização em tecido fibroso. A análise
do colágeno realizada com a biopsia em cicatrizes de tendões de eqüinos
revela a presença de quantidades substanciais de colágeno tipo III e não do
tipo I, que é típico de tendões normais. Estas observações fornecem maior
confirmação da grande contribuição dos tecidos peritendíneos para a cura.
Os fibroblastos do paratendão migram para a região rompida e inflamada. O
alinhamento destes fibroblastos e, subsequentemente, das fibrilas
colagenosas sintetizadas por eles depende da orientação da fibrina já
depositada na região. Nesta fase, uma movimentação passiva controlada
com pequena tensão no tendão ferido pode influenciar favoravelmente o
reparo intrínseco e a orientação dos feixes de fibrilas, diminuir
potencialmente a formação de adesões e, espera-se promover uma
separação estrutural do tendão reparado a partir do paratendão ou bainha
tendínea que o envolvem. Durante o curso do reparo, as regiões residuais
de hemorragia podem persistir por um longo tempo. O processo de cura
resulta na formação de um tecido cicatricial colagenoso que pode também
conter regiões cartilaginosas ou calcificadas. Ocorre também a formação de
adesões e de fibras peritendíneas, a menos que a lesão seja pequena e
restrita ao centro do tendão. O grau de fibrose é geralmente proporcional à
intensidade da lesão do tendão, exceto na região digital, onde a lesão
sempre leva a uma fibrose subcutânea extensiva. Pode também ocorrer a
constrição do ligamento anular palmar ou plantar associada a uma tendinite
baixa (STASHAK, 1994).
A reparação tendínea evolui com a deposição contínua das fibras colágenas
junto ao local lesado, em progressiva orientação longitudinal, facilmente
visualizada pelo microscópio de luz polarizada. As camadas de fibras
colágenas orientadas longitudinalmente são agregadas em grandes feixes,
circundadas por grandes vasos sanguíneos, no septo endotendíneo. O
tecido de reparação permanece em remodelamento por alguns meses após
o início da lesão, e a possibilidade de modular-se essa reparação e restaurar
a micro anatomia do tecido é, atualmente, um desafio científico (MIKAIL,
2006).
17
5 SINAIS CLÍNICOS DA LESÃO:
Os sinais clínicos das tendinites variam consideravelmente, dependendo da
localização da lesão primária, do tipo, da gravidade e da evolução da lesão
(MIKAIL, 2006).
O animal acometido de tendinite apresenta claudicação cujo grau e
intensidade do processo dependem do tipo de trauma desencadeante, do
peso do cavalo, do tipo de trabalho que este executa e da fase de evolução
etiopatogênica (aguda ou crônica). A claudicação evidencia-se mais na fase
de apoio do membro ao solo, em razão da intensa tração que é exercida
sobre os tendões do grupo muscular flexor, superficial e profundo, que são
os mais acometidos. Na fase aguda, quando em repouso, o animal procura
manter o membro em flexão passiva, apoiando a pinça do casco no solo,
aliviando, dessa forma, a pressão sobre os tendões e a sensação de dor
(THOMASSIAN, 2005).
As lesões agudas, que frequentemente são severas e caracterizadas por
sinais clássicos de aumento de volume e temperatura local, bem como
claudicação moderada. As tendinites ocorrem principalmente nos membros
anteriores e, consequentemente, a inflamação está presente na face palmar
do metacarpo (MIKAIL,2006).
O estágio crônico se manifesta por fibrose e aumento de volume na face
palmar ou plantar. Algumas alterações inflamatórias agudas podem ainda
estar presentes, dependendo do estágio de cura ou da ocorrência de uma
nova lesão. Ou seja, o cavalo pode estar são ao passo e trote, porém
apresenta claudicação no trabalho que requer maior esforço. A constrição do
ligamento anular pode estar presente em associação a uma tendinite crônica
ao nível do boleto (STASHAK, 1994).
18
6 DIAGNÓSTICO:
No exame estático, a palpação deve ser realizada inicialmente com o
membro em apoio e posteriormente com o membro semi flexionado e
elevado, quando os tendões e ligamentos se apresentam sem tensão e são
mais facilmente palpáveis. É importante identificar, com movimentos de
flexão do membro, o deslizamento entre os tendões flexores superficial e
profundo ou uma eventual presença de aderência ou fibrose. No exame
dinâmico a claudicação de um animal com tendinite é melhor verificado ao
trote, tanto em linha reta como em círculo. Qualquer assimetria dos
membros pode ser notada, principalmente nos primeiros passos antes de o
animal compensar a instabilidade ou o alongamento do membro. A
claudicação nem sempre está presente e, nesses casos, se a condição
persistir, a tendinite pode progredir para uma lesão mais grave. Como
complementação do exame dinâmico, pode-se realizar testes de flexão e
bloqueios anestésicos dos membros para confirmação do local sede da dor
(MIKAIL, 2006).
Dois métodos diagnósticos auxiliares podem ser úteis: a termografia e a
tendinografia. A termografia pode ser útil no diagnóstico precoce da
inflamação nos tendões quando os outros sintomas clínicos não estão
evidentes (STASHAK,1994).
A ultrassonografia (US) tem contribuído significativamente para o diagnóstico
das lesões dos tecidos moles dos membros dos eqüinos. Essa técnica
diagnóstica permite ao veterinário determinar a localização exata da lesão,
quantificar sua extensão e a gravidade das lesões; e também monitorizar o
processo de reparação. Ela pode ainda, proporcionar a visualização de
pequenas lesões agudas, que, muitas vezes, ainda não apresentam
expressão clínica para serem diagnosticadas nos exames de rotina. Essa
técnica auxiliar, assim como as outras, deve ser uma complementação dos
exames clínicos tradicionais, como inspeção e palpação, e não uma
substituição destes, pois a interpretação conjunta aumenta a qualidade do
diagnóstico (MIKAIL, 2006).
19
7 TRATAMENTO:
O tratamento das tendinites agudas visa diminuir o processo inflamatório,
minimizar a formação de tecido cicatricial e promover a restauração da
estrutura e função tendíneas. O conhecimento da somatória de eventos que
ocorre na reparação tendínea é importante para que se realizem
intervenções farmacológicas, cirúrgicas e fisioterapêutica efetivas. O
tratamento e o prognóstico das tendinites devem ser baseados no exame
clínico e principalmente no ultrassonográfico, pois a gravidade da inflamação
e da dor nem sempre se correlacionam à extensão da lesão nas estruturas
intratendíneas. Um exemplo para esse fato é a avaliação de uma lesão
subaguda, na qual a inflamação inicial pode ter sido resolvida, porém a lesão
tendínea continua presente (MIKAIL,2006).
O tratamento deve levar em consideração se o processo encontra-se na fase
aguda ou crônica. Na fase aguda, institua imediatamente o repouso
associado a duchas frias três (3) vezes ao dia, com duração mínima de 20
minutos cada aplicação, ou bolsa de gelo aplicadas por 10 minutos com 15
minutos de intervalo entre as aplicações, durante pelo menos 6 a 12 horas.
Pode-se instituir também massagens com substâncias heparinóides
associadas ao DMSO 20%, e ligas de descanso (THOMASSIAN, 2005).
Outros tratamentos utilizados são a desmotomia dos ligamentos anular e
carpiano proximal, o sargeamento do tendão e a utilização de revulsivos
(HENNINGER, 1994).
Nos casos agudos, o tratamento refere-se à minimização da inflamação e
dos seus efeitos deletérios, ajudando o tendão (STASHAK, 1994). O objetivo
do tratamento inicial é deter o rápido acúmulo de sangue e exudato
inflamatório. A melhor maneira é a utilização de bandagens compressivas
desde a articulação do carpo até a coroa do casco. O ideal é colocar a
bandagem antes que inicie o edema, de tal forma que sua aplicação se torne
uma emergência clínica (JONES, 1992).
20
7.1 Fármacos
Ainda na fase aguda, pode-se lançar mão de antiinflamatórios esteroidais e
não esteroidais como: a dexametasona que é um corticoesteróide,
fenilbutazona ou flunixin meglumine por via sistêmica, ou triancinolona
associado ao DMSO a 20% em massagem local, ambos durante pelo menos
5 a 7 dias (THOMASSIAN, 2005).
Na clínica de eqüinos, a corticoterapia é rotineiramente realizada com os
medicamentos injetáveis e as principais vias de administração são
intramuscular e a intravenosa. A penetração nos tecidos e a duração do seu
efeito são principalmente influenciadas pela sua apresentação química, pois
quanto menor a solubilidade do éster, maior a duração dos seus efeitos.
Assim, ésteres de insolubilidade moderada, como o acetato, ou de
insolubilidade exagerada, como o acetonida, permitem a permanência do
medicamento no organismo por dia a meses (SPINOSA, 1999).
A fenilbutazona tem sido utilizada em equinos desde a década de 50,
principalmente nas inflamações ósseas e articulares, assim como nas
claudicações, devido ao seu baixo custo e eficácia, entretanto, oferece baixa
margem de segurança nesta espécie animal. Durante a biotransformação a
fenilbutazona origina dois metabólitos: a oxifenbutazona e
hidroxifenilbutazona, sendo a primeira um metabólito farmacologicamente
ativo. Juntos esses metabólitos correspondem a 25% do total de
medicamento administrado no organismo. A oxifenilbutazona também tem a
propiedade de inibir a taxa de metabolização da fenilbutazona, o que
ocasiona o aumento da meia vida desta substância no plasma. A meia vida
deste composto em eqüinos é de 3 a 8 horas e seu efeito farmacológico é de
cerca de 8-12 horas (SPINOSA, 1999).
O flunixin meglumine é uma substância aprovada para uso veterinário pela
Food and Drugs Administration (FDA), podendo ser administrada por via oral
ou injetável; possui grande ação analgésica e antiinflamatória em cavalos,
sendo um antiinflamatório não esteroidal usado em casos de síndrome cólica
e distúrbios músculo esqueléticos; nestas situações, o flunixin meglumine se
revela, muitas vezes tão eficaz que poderá dar a falsa sensação de
21
recuperação do animal. Em relação a ação antiinflamatória, o flunixin é
quatro vezes mais potente que a fenilbutazona, com meia vida de duas
horas em eqüinos. A duração da ação farmacológica é maior do que a
esperada partindo-se da sua meia vida e provavelmente se deve ao acúmulo
da substância no foco antiinflamatório (SPINOSA, 1999).
O dimetil sulfóxido é um subproduto do processamento da madeira e da
destilação do petróleo. Após a aplicação tópica ou em mucosas, o dimetil
sulfóxido é bem absorvido em cerca de cinco minutos e distribuído para
outros tecidos em cerca de vinte minutos, possuindo a propiedade de carrear
substâncias de pequeno peso molecular. A ação antiinflamatória deste e do
seu metabólito, o dimetil sulfeto, reside na propriedade de romover radicais
livres principalmente as hidroxilas. O demetil sulfóxido também possui
propriedades analgésicas (devido a depressão da condução dos impulsos
aferentes nervosos, a partir das áreas inflamadas), reduz a agregação
plaquetária, protege o endotélio vascular, diminui a formação de trombos,
aumenta a perfusão tecidual, melhora a ação estabilizadora de membranas
realizadas pelos corticosteróides, além de também inibir a quimiotaxia de
células inflamatórias (SPINOSA, 1999).
Quando aplicado por via tópica, é rapidamente absorvido, sendo também
capaz de penetrar a barreira hematoencefálica. É ainda eficaz quando
aplicado por diferentes vias de administração. Em cães, o dimetil sufóxido é
utilizado para alívio de afecções inflamatórias de ouvido, e em eqüinos nos
processos inflamatórios de membros, sendo também indicado nos casos
cerebrais e da coluna (SPINOSA, 1999).
Os principais efeitos colaterais descritos para o dimetil sulfóxido são: edema,
eritema, desidratração cutânea e prurido. Quando associado com
anestésico, tem sua toxicidade aumentada. Eqüinos tratados com dimetil
sulfóxido poderão apresentar áreas de alopecias, o que poderá predispô-los
a infecções cutâneas (SPINOSA, 1999).
22
7.2 Fisioterapia
Outro aspecto importante no tratamento da tendinite é o repouso. Nas duas
primeiras semanas o repouso deve ser completo e, após, pode-se realizar
manipulação passiva. Essa recomendação se baseia na descoberta de que
uma leve tensão no tendão afetado na fase inicial da cura pode auxiliar no
alinhamento dos feixes de fibrina do coágulo inflamatório inicial e promover
um alinhamento adequado do colágeno, assim como inibir a formação de
adesões. No entanto, não foi realizado nenhum trabalho em cavalos nessa
área e o equilíbrio entre a tensão adequada e a tensão excessiva não foi
definido (MARXEN, 2001).
A abordagem fisioterapêutica vai depender da fase e do grau da lesão
tendínea ou ligamentar. Na fase aguda, a aplicação de gelo vai reduzir o
metabolismo na região (reduzindo a atividade das enzimas inflamatórias) e
evitar que as células vizinhas à lesão sejam destruídas pela hipóxia
secundária (MIKAIL,2006).
No caso de uma lesão com ruptura de fibras, o laser pode acelerar o
preenchimento dessa lesão por atrair mais fibroblastos para a região e
aumentar a produção de colágeno. Além de aumentar o número de
fibroblastos, o laser também pode levar a um aumento do número e do
tamanho das mitocôndrias e do retículo endoplasmático rugoso nas células
irradiadas, o que sugere um aumento do metabolismo e da síntese de
proteínas por parte dessas células (BAXTER, 1994). O laser também ajuda a
reduzir o edema, por favorecer a circulação linfática, em alguns casos
dobrando o diâmetro dos vasos linfáticos (MIKAIL, 2006).
O aparelho deve estar sempre em contato com a pele e perpendicular à
área-alvo. Dessa forma, evita-se a reflexão de raios na superfície da pele, o
que reduziria a quantidade de energia enviada aos tecidos e a eficácia do
tratamento (MIKAIL, 2006).
Para haver recuperação da lesão, institui-se exercício controlado (ao passo),
dos exercícios passivos e da aplicação de modalidades como o laser e o
campo magnético pulsátil para conseguir alto grau de paralelismo dessas
23
fibras, pois quanto mais paralelas elas estão, maior a elasticidade e a
capacidade de suportar carga de tração (MIKAIL, 2006).
O campo magnético pulsátil, apesar de não ter seu mecanismo de ação bem
esclarecido, conta com diversos experimentos que demonstraram seus
efeitos como a melhora do consumo de oxigênio pelas células e o aumento
na atividade dos osteoblastos. A maior parte desses experimentos é voltada
para o tratamento do tecido ósseo, sendo que há poucos experimentos com
tendões. Nesse caso, é melhor esperar pela fase subaguda e iniciar o
tratamento no modo pulsátil, no qual a produção de calor é menor. Na fase
final, quando o objetivo é utilizar o calor como preparação para o
alongamento, o ultra-som pode ser utilizado no modo contínuo, pois, com o
aquecimento, o colágeno torna-se mais elástico, o que vai facilitar o
exercício. A propriedade de fonoforese do ultra-som facilita a penetração de
drogas conforme as ondas vão atravessando a pele, assim, a administração
de medicamentos tópicos pode ser potencializada (MIKAIL & ALVES, 2006).
O alongamento também favorece a orientação paralela das fibras de
colágeno e pode ser realizado de forma passiva ou com rampa. A
massagem tem um papel bastante importante na tendinite. Ela pode ser feita
no sentido da circulação linfática, para ajudar a remover o edema, e no
sentido transverso, para prevenir a formação de aderências. A massagem
transversa pode ser aplicada segurando-se o tendão flexor superficial e
provocando um deslizamento transversal sobre o tendão flexor profundo.
Esse procedimento evita a formação de aderências entre os tendões quando
há uma inflamação no local (MIKAIL, 2006).
A aplicação de bandagem é benéfica na fase inicial, pois favorece a
diminuição do edema por exercer uma leve pressão sobre os tecidos
(MIKAIL & ALVES, 2006).
24
7.3 Plasma rico em plaquetas
O plasma rico em plaquetas (PRP) são fontes de diversos fatores de
crescimento, importantes na reparação tecidual devido às ações mitogênica,
quimiotáxica e neovascular. Após a ativação por agentes farmacológicos ou
fisiológicos, as plaquetas presentes nesses componentes liberam diversos
fatores de crescimento presentes nos grânulos alfa, que apresentam grande
potencial terapêutico.(MAIA & SOUZA, 2009).
As plaquetas são fragmentos citoplasmáticos anucleados, discóides,
derivados dos megacariócitos. São pequenas, possuindo cerca de 5 a 7µm
de diâmetro e, normalmente, largura inferior a 3µm. Ocasionalmente nos
eqüinos e cobaios, as plaquetas são lentiformes, podendo alcançar 20µm de
diâmetro. Esses fragmentos apresentam importante função no processo de
coagulação do sangue e no processo inflamatório, na reparação tecidual
através da interação célula-célula e liberação de mediadores solúveis
provenientes da ativação destes. Nos ruminantes, a sobrevida das plaquetas
é de aproximadamente 10 dias (FELDMAN et al., 2000).
Normalmente as plaquetas estão no estado inativo. A ativação das plaquetas
pode ser realizada por agentes fisiológicos (ex: trombina, tromboxano,
colágeno, ADP, fator ativador de plaquetas, serotonina e epinefrina) e
farmacológicos (ex: o ionóforo de cálcio, o cloreto de cálcio e os análogos de
endoperóxido cíclico). Uma vez ativadas, as plaquetas se modificam
morfologicamente e desenvolvem pseudópodos, os quais promovem a
agregação plaquetária e, posteriormente, a degranulação dos grânulos
palquetários (MAIA & SOUZA, 2009).
Em particular, os α-grânulos das plaquetas são ricos em fatores de
crescimentos com diversas ações biológicas. Entretanto, é importante
ressaltar que a ativação das plaquetas deve ser realizada próximo ao
momento da aplicação terapêutica, de forma a assegurar uma adequada
concentração dos fatores de crescimento presentes nessas plaquetas
(MAIA, 2008).
Os fatores de crescimento são peptídeos sinalizadores que regulam o
metabolismo celular por meio da interação com um complexo de receptores
25
de superfície celular, das vias de sinalização intracelular e, finalmente, pelo
aumento da transcrição de fatores e produção de proteínas que resultam na
proliferação e diferenciação celular, bem como no aumento da produção da
matriz extracelular. Esses peptídeos liberados na matriz extracelular se
ligam ao receptor tirosina-quinase, presente nas células teciduais. A ativação
desse receptor resulta na sinalização de informações para genes
responsáveis pelo controle da divisão celular, ocorrendo assim a transcrição
do RNA mensageiro. Esse evento resulta em uma resposta biológica que,
por sua vez, ocasiona a reparação e a regeneração tecidual (MAIA &
SOUZA, 2008).
O plasma rico em plaquetas é derivado do sangue periférico, contendo cinco
vezes mais plaquetas (aproximadamente 1.000.000µL-1 ) que os níveis
fisiológicos . Esse pode ser obtido mediante uma ou duas centrifugações
entre 200 e 2000g, durante três a cinco minutos. Na medicina veterinária, a
técnica para a obtenção do PRP vem sendo baseada na técnica utilizada
para a espécie humana. O PRP pode ser obtido por meio da coleta do
sangue periférico em tubos ou bolsas de sangue contendo o anticoagulante
citrato de sódio após a centrifugação e ativação das plaquetas. O
procedimento para a obtenção desses componentes ricos em plaquetas
pode ser realizado utilizando-se centrífugas convencionais ou equipamentos
que permitem a separação (aférese) dos constituintes do sangue total
separando o plasma das plaquetas (MAIA & SOUZA, 2009).
Segundo Arguelles et al. (2008) sete eqüinos acometidos de
tendinite ou desmite, após receberem tratamento com aplicação intralesional
de PRP, demonstraram redução na severidade da claudicação e melhora na
imagem ultrassonográfica das estruturas envolvidas. Alguns animais
retornaram as suas atividades físicas após dois meses de tratamento. Em
estudo recente realizado em cinco eqüinos, sendo dois acometidos com
tendinite aguda do tendão flexor digital superficial e três com desmite
proximal do ligamento suspensório, constataram melhora clínica em ambas
as afecções após tratamento intralesional com concentrado de plaquetas,
porém a avaliação ultrassonográfica demonstrou que apenas os animais
com tendinite apresentaram evolução positiva. Por outro lado, todos os
eqüinos avaliados retornaram ao treinamento habitual seis meses após o
26
tratamento, não sendo observada recidiva até 20 meses após o mesmo,
quando os animais ainda se encontravam sob observação.
7.4 Célula tronco
A tarapia com células-tronco é outra opção para o tratamento de lesões
tendíneas em eqüinos. Células-tronco são células também conhecidas como
células progenitoras ou células-mãe. Elas são capazes de gerar células
idênticas as progenitoras ou possuem capacidade de se diferenciar em
células de diferentes funções dando origem aos tecidos e órgãos do corpo,
como cérebro, coração, ossos, músculos e pele. As células mais conhecidas
são as adultas e as embrionárias. As adultas são as células-tronco
multipotente que são encontradas em tecidos e podem se renovar com certa
limitação e se diferenciar para produzir o tipo de célula especializada do
tecido do qual se originam. As embrionárias são as células pluripotente que
são encontradas nos embriões. Elas são mais abundantes e possuem maior
capacidade para se diferenciar (ZANELLA, 2008).
Em equinos a coleta do tecido adiposo é feita proximal e abaxial à cauda,
sendo um procedimento simples. O material coletado, aproximadamente 20
gramas, é enviado ao laboratório para o isolamento das células, que são
ressuspensas e armazenadas em material salino (PBS). Grandes
quantidades de células-tronco autógenas podem ser obtidas em 48 horas. O
volume implantado e o número de pontos de aplicação são calculados de
acordo com o tamanho da lesão e o tratamento descrito pelo médico
veterinário (DALGREN, 2005).
A aplicação das células-tronco obtidas devem ser realizadas somente após a
delimitação da lesão por exame ultrassonográfico. Para as aplicações
percutâneas, deve ser feita uma sedação no animal utilizando detomidina e
butorfanol, e um bloqueio anestésico local só deve ser feito se o animal
apresentar sensibilidade local à aplicação, mesmo após a sedação. O
transdutor do aparelho de ultra-som deve ser envolvido por uma embalagem
estéril e deve ser utilizado um gel estéril. As agulhas devem ser introduzidas
e devem então ser guiada pelas imagens ultrassonográficas. O material
27
deve ser aplicado em vários pontos, com um centímetro proximal e distal à
lesão. O procedimento deve ser guiado por ultra-som a fim de verificar o
ponto exato da aplicação (RICHARD; MITCHELL, 2005; ACELL VET TM,
2006).
O animal é mantido com bandagem estéril no membro por 2 a 4 horas
depois do tratamento e aplica-se gelo por 30 minutos ao redor do local
afetado. Esse procedimento deve ser realizado duas vezes ao dia, durante 3
dias. Os animais devem receber 500mg de flunixin meglumine, duas vezes
ao dia, via oral, por 5 dias após o tratamento, e devem caminhar puxados,
duas vezes ao dia, por 10 a 15 minutos, a partir do dia seguinte ao
tratamento. Realiza-se exame ultrassonográfico após 5 dias da aplicação
para verificar a resposta ao tratamento e após 30 dias, começa com
caminhadas ao passo, realizando posteriormente novo exame
ultrassonográfico até que se completem 120 dias após o tratamento ou até
que se verifique completa recuperação do animal. Caso o animal se mantiver
sem dor, aumente-se 5 a 10 minutos de exercício, a cada semana, até
retornar ao exercício normal (RICHARD; MITCHELL, 2005).
28
8 CONCLUSÃO
Conclui-se que todos os tratamentos para lesão de tendão tem sido satisfatório,
desde que seja realizado por um profissional capacitado.
A fisioterapia ajudará a reduzir a inflamação e o edema, enquanto que o plasma rico
em plaquetas ajudará a realinhar as fibras tendíneas e a célula tronco reconstruirá o
local da lesão com o crescimento de fibras tendíneas.
Através dos estudos realizados, concluí-se, que se o animal ficar em repouso
durante no mínimo seis meses, o próprio organismo se incumbirá de reconstituir o
tendão, mas lembrando que isso varia de animal para animal, e se o animal fizer
algum tratamento como, por exemplo, a célula tronco, ele voltará as atividades mais
rápido do que sem o tratamento.
29
9. REFERÊNCIAS BIBLIOGRÁFICAS
ALVES, A. G. Influência da beta-aminopropionitrila associada à atividade física na
reparação tendínea de eqüinos após agressão pela colagenase. Análise ultra-
sonográfica e morfológica. 1998. 92 f. Tese (Doutorado em Patologia) – Faculdade
de Medicina de Botucatu, Universidade Estadual Paulista, Botucatu, 1998.
ARGUELLES D., CARMONA J.U., CLIMENT F., MUNÕZ E. & PRADES M. 2008.
Autologous platelet concentrates as a treatment for musculoskeletal lesions in Five
horses. Vet. Rec. 162(7):208-211.
BANKS, W. J. Histologia veterinária aplicada. São Paulo: Manole, 1992. 629 p.
BAXTER, G. D. Therapeutic lasers: theory and practice. New York, Churchill
Livingstone, 1994.
DAHLGREN, L.A. Review of treatment option for equine tendon and ligaments
injuries: What’s new and how do they work? In: American Association of Equine
Practitioners. Lexintong. p.2668. 2005.
FELDMAN B.F. et al. Schalm’s veterinary hematology. 5. Ed. Philadelphia: Lippincott
Williams & Wilkins, 2000. 1344p.
Ferraro, Gisele; MORAES, Julieta; PEREIRA, Gener; CAMARGO, Mauro; MORAIS,
Flavio et al. Estudo morfológico de tendão flexor de eqüinos. Brazilian Journal of
Veterinary Research and animal Science. Vol. 40 n 2. São Paulo, 2003.
FORNAGE, B, D.; RIFKIN, M. D. Ultrasound examination of tendons. Radiol. Clin.
North Am., v. 26, p. 87-107, 1988.
30
GOODSHIP, A. E. The pathophysiology of flexor tendon injury in the horses. Equine
Vet. Educ., v. 5, n. 1, p. 23-29, 1993.
HATAKA, A. Cinética vascular e celular na cicatrização tendínea experimental em
cães (Canis familiaris). 1998. 63 f. Dissertação (Mestrado em Patologia Animal) –
Faculdade de Ciência Agrárias e Veterinárias, Universidade Estadual Paulista,
Jaboticabal, 1998.
HENNINGER, R. Treatment of superficial digital flexor tendinitis. Vet. Clin. North Am.:
Equine Pract., v. 10, n. 2, p. 409-424, 1994.
JONES, Geraint. Enfermidades Ortopedicas de Los Equinos. Editora Hemisfério Sur
S.A. 1992.
JUNQUEIRA, L. C.; CARNEIRO, J. Histologia básica. Rio de Janeiro: Guanabara
Koogan, 1999. 427 p.
KRAUS-HANSEN, ANN E.; FACKELMAN, G. E.; BECKER, C. et al. Preliminary
studies on the vascular anatomy of the equine superficial digital flexor tendon.
Equine Vet. J., v. 24, n.1, p. 46-51, 1992.
MAIA, L.; SOUZA M. Componentes ricos em plaquetas na reparação de afecções
tendo-ligamentosas e osteo-articulares em animais, Santa Maria, 2009.
MAIA, L. et al. Plasma rico em plaquetas no tratamento de tendinite induzida em
eqüinos: avaliação ultra-sonográfica, Rio de Janeiro, 2009.
MARXEN, S. Análise da Eficácia do Polissulfato de Glicosaminoglicanas no
Tratamento Intratendíneo de Tendinites Induzida Enzimáticamente pela Colagenáse
em Eqüinos. 2001. 77f. Tese (Mestrado em Área de Concentração em Cirurgia
Veterinária) – Faculdade de Ciências Agrárias e Veterinárias de Jabuticabal,
Universidade Estadual Paulista, Jaboticabal, 2001.
31
MIKAIL, S.; PEDRO, R., C., Fisioterapia Veterinária. São Paulo/SP. Editora Manole,
2006. 202-206 p.
MURPHY, D. J.; NIXON, A., J. Biochemical and site-specific effects of insuline-like
growth factor I on intrinsic tenocyte activity in equine flexor tendons. Am. J. Vet. Res.,
v. 58, n. 1, p. 103-109, 1997.
POOL, R. R. Pathology of tendons and ligaments. J. Equine Vet. Sc., v. 12, n. 3, p.
145-148, 1992.
RICHARD, D.; MITCHELL, D. V. M. Treatment of Tendon and Ligament Injuries with
UBM Powder, 2005.
SPINOSA, Helenice; GÓRNIAK, Silvana; BERNARDI, Maria. Farmacologia Aplicada
à Medicina Veterinária. 2ª edição. Rio de Janeiro/RJ. Editora Guanabara, 1999.
STASHAK, Ted. Claudicação em Eqüinos Segundo Adams. 4ª edição. Rio de
Janeiro/RJ. Editora Roca, 1994.
THOMASSIAN, Armen. Enfermidades dos cavalos. 4ª edição. São Paulo/SP. Editora
Varela, 2005.
WATKINS, J. P. Tendon and ligament biology. In: AUER, J. A. Equine surgery.
Philadelphia: Saunders, 1992. p. 910-924.
ZANELLA, J. Jornal UNESP. Março/2008.
Plasma Rico em Plaquetas no Tratamento de Tendinite Induzida em Eqüinos:
Avaliação Ultrassonográfica. www.scielo.br. Disponível em:
HTTP://www.scielo.br/scielo.php?pid=S0100-
736X2009000300009&sxcript=sci_arttext /Acesso em: 02/2010.
32
Componentes ricos em plaquetas na reparação de afecções tendo-ligamentosas e
osteo-articulares em animais. www.scielo.br. Disponível em
http://www.scielo.br/scielo.php?pid=S0103-
84782009000400050&script=sci_arttext&tlng.../ Acesso em: 02/2010.
Célula Tronco. www.unesp.br Disponível em
http://www.unesp.br/aci/jornal/231/celulas.php /Acesso em: 04/2010.
Treatment of Tendon and Ligament Injuries with UBM Powder (ACELL – Vet®).
Disponível em: http://www.acell.com/vetdownload / Acesso em: 02/2009.
33