Relatório Proteínas
-
Upload
isabella-nino -
Category
Documents
-
view
231 -
download
0
description
Transcript of Relatório Proteínas

UNIVERSIDADE FEDERAL DE PERNAMBUCO – Campus Recife
CURSO DE MEDICINA
BIOQUÍMICA
1º PERÍODO - TURMA 139
ISABELLA BENIGNO NINO SILVA
RELATÓRIO DE AULA PRÁTICA DE PROTEÍNAS
RECIFE
2015

1. INTRODUÇÃO
PROTEÍNAS
As proteínas são macromoléculas muito abundantes na natureza, ocorrem em todas as
células e em grande variedade de tipos, desde peptídeos pequenos até grandes polímeros, com
elevado peso molecular e diferentes funções biológicas. São polímeros formados por
aminoácidos, unidades monoméricas relativamente simples que se ligam umas as outras por
meio de ligações peptídicas. Uma ligação peptídica é a união do grupo amino (-NH 2 ) de um
aminoácido com o grupo carboxila (-COOH) de outro aminoácido, através da formação de uma
amida.
Os diferentes grupamentos "R" encontrados nos aminoácidos influenciam na estrutura, na
funcionalidade e nas propriedades das proteínas individuais, dessa forma, podemos classificar
os aminoácidos quanto ao seu grupo funcional como não polares (alifáticos), polares não
carregados, polares positivamente carregados, polares negativamente carregados e aromáticos.
As proteínas, mesmo tendo variadas funções e propriedades, são constituídas por um grupo de
20 aminoácidos, chamados aminoácidos padrão, que se arranjam em variadas sequências a fim
de conferir conformação e função de uma determinada proteína. Os aminoácidos possuem
propriedades ópticas, apresentando estereoisômeros D e L, uma vez que todos os aminoácidos,
exceto a glicina, possuem quatro ligantes diferentes ligados ao carbono α. A maioria das
proteínas encontradas nos seres vivos são formadas por L-aminoácidos. Os D-aminoácidos
aparecem somente em certos antibióticos peptídicos e em peptídeos componentes da parede de
algumas bactérias.
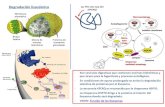
As proteínas podem se apresentar em conformação primária (linear), secundária (formando
α-hélices e folhas β), terciária (enovelamento por interação entre sequências polipeptídicas de
uma proteína com estrutura secundária) e quaternária (arranjo de mais de uma subunidade
protéica), como pode ser visto na Figura 1. As proteínas que apresentam uma ou mais cadeias
polipeptídicas formando estruturas compactas, mais ou menos esféricas e que geralmente são
solúveis denominam-se proteínas globulares. As proteínas fibrosas possuem forma alongada,
geralmente insolúveis, que em meio aquoso e desempenham um papel basicamente estrutural
nos sistemas biológicos. Ao contrário das globulares, as fibrosas são formadas pela repetição de
módulos, o que possibilita a construção de grandes estruturas, com organização que origina
fibras.

Figura 1 – Formação estrutural das proteínas. Esquema mostra o enovelamento da sequência
de aminoácidos para a formação de proteínas nas conformações primária, secundária, terciária e
quaternária.
Uma perda da estrutura tridimensional suficiente para causar perda de função é denominada
desnaturação. O estado desnaturado não necessariamente corresponde a um desenovelamento
completo da proteína, mas sob a maioria das condições, as proteínas desnaturadas consistem
num estado parcialmente enovelado. As proteínas podem ser desnaturadas pelo calor, que afeta
principalmente as ligações de hidrogênio; por extremos de pH, que alteram a carga líquida da
proteína; por solventes orgânicos miscíveis com água, que promovem rompimento de interações
hidrofóbicas; etc.
PRECIPITAÇÃO DE PROTEÍNAS COM DESNATURAÇÃO
Uma perda da estrutura tridimensional suficiente para causar perda de função é denominada
desnaturação. O estado desnaturado não necessariamente corresponde a um desenovelamento
completo da proteína, mas sob a maioria das condições, as proteínas desnaturadas consistem
num estado parcialmente enovelado. A desnaturação envolve alterações nas estruturas
quaternária, terciária e secundária de proteínas, mas não da primária.
As proteínas podem ser desnaturadas pelo calor, que afeta principalmente as ligações de
hidrogênio; por extremos de pH com adição de ácidos ou álcalis, que alteram a carga líquida da
proteína; por solventes orgânicos miscíveis com água, que promovem rompimento de interações
hidrofóbicas; soluções concentradas de uréia e guanidina; detergentes; sais de metais pesados,
etc. Entre as alterações que se observam em decorrência da desnaturação protéica, pode-se
citar: diminuição da solubilidade, perda de atividade biológica (por exemplo, da ação
enzimática, da ação hormonal), aumento da reatividade de radicais da cadeia polipeptídica,
alterações na viscosidade e coeficiente de sedimentação, etc.

A desnaturação, usualmente decresce a solubilidade das proteínas. A diminuição da
solubilidade pode ser explicada pela exposição de radicais hidrofóbicos e outros que
prejudiquem a interação da proteína com a água e favoreçam a interação entre proteínas. A
desnaturação é o evento primário e importante. A floculação e a coagulação, que muitas vezes
são confundidos com desnaturação de proteínas, são simplesmente manifestações visíveis das
alterações estruturais causadas pelos agentes desnaturantes.
As reações de precipitação com desnaturação, além de serem utilizadas para caracterizar a
presença de proteínas em solução, também são úteis para proceder a desprotenização de líquidos
biológicos para análise de componentes não protéicos.
PRINCÍPIOS TEÓRICOS
- Precipitação pelo Ácido Tricloroacético: A solubilidade de uma molécula depende da
interação entre os grupos polares dos radicais –R e as moléculas de água através de pontes de
hidrogênio. Grandes variações de pH modificam a ionização destes grupos e, portanto, a
interação da proteína com o meio. Nos seres vivos, as proteínas estão em contínua modificação
de sua conformação, uma vez que as concentrações locais de íons, o pH e o poder redutor
sofrem pequenas variações, alterando a interação dos vários grupos reativos das proteínas entre
si e com o meio. Valores extremos de pH afetam bruscamente estas interações, causando uma
desnaturação. Ânions de ácidos complexos, como o tricloroacético, o túngsnico e o pícrino,
formam sais insolúveis onde a proteína funciona como cátion.
- Precipitação com sais de metais pesados: A adição de sais de metais pesados, tais como
mercúrio, chumbo, cobre e zinco, levam à formação de sais chamados "quelatos", são
denominados de acordo com o elemento formador entre os aminoácidos ácidos e estes metais,
como por exemplo, o proteinato de mercúrio e o proteinato de chumbo A proteína precipita
porque estes sais são insolúveis em água e também porque, com a quebra das ligações iônicas,
os aminoácidos hidrofóbicos ficam mais expostos ao meio aquoso. Essa precipitação é mais
intensa quando o pH está acima do ponto isoelétrico (pI). Isso porque, acima do pI, a carga
líquida sobre a proteína é negativa, favorecendo a interação com os cátions provenientes do sal.
- Precipitação por saturação salina e com solvente orgânico: A solubilidade de uma proteína
pode variar de acordo com a concentração de sal a que ela é submetida. Em baixa concentração
de sal, observamos um aumento na solubilidade das proteínas com a presença de íons. Este
fenômeno é chamado de salting in, onde ocorre uma interação entre os íons salinos e os
grupamentos carregados das proteínas diminuindo as interações eletrostáticas intermoleculares
proteína-proteína (responsáveis pela diminuição da solubilidade protéica). Por outro lado, em
elevada concentração salina, observamos uma redução na solubilidade das proteínas. Este

processo é chamado de salting out, aonde alguns sais, ao interagir com a água, removem a
camada de solvatação das proteínas, o que facilita a formação de agregados e leva à sua
precipitação. A solubilidade das proteínas em solventes orgânicos é menor do que em água. Isso
acontece porque a capacidade de interação com as partículas de soluto é diferente para cada
solvente. Numa solução contendo, exclusivamente, água e moléculas protéicas temos: interação
água - proteína e interação proteína-proteína. Nesse caso, podemos afirmar com certeza que o
primeiro tipo de interação prevalecerá sobre o segundo porque a água possui grande capacidade
de separação das partículas do soluto (constante dielétrica elevada). O solvente orgânico
apresenta valor de constante dielétrica bem inferior à da água, o que leva a interação proteína-
proteína a ser superior, em competição com o poder de solvatação da água (interação água-
proteína). A proteína precipita. Essa precipitação é reversível pela adição de mais água. A
precipitação por solventes orgânicos depende muito da temperatura. Os solventes orgânicos,
quando utilizados a temperaturas baixas, são bastante úteis na separação de misturas de
proteínas. A temperaturas mais elevadas esses solventes podem levar à desnaturação por
rompimento das pontes de hidrogênio e estabelecimento de interações apolares, importantes na
manutenção da conformação protéica.
- Precipitação isoelétrica: As proteínas são muito sensíveis à variação de pH, podendo adquirir
uma forma aniônica, catiônica ou zwitteriônica, o que altera propriedades como sua solubililade
e atividade catalítica. Quanto maior o grau de ionização de uma proteína, maior será sua
tendência à solvatação. No ponto isoelétrico (pI), a proteína tem carga líquida igual a zero, o
que diminui a repulsão entre as moléculas protéicas e o grau de solvatação provocando a
agregação e floculação das moléculas. Esse fenômeno é chamado de precipitação isoelétrica.
As cadeias laterais de alguns aminoácidos possuem a capacidade de se ionizar em condição
ácida ou básica. Desta forma, proteínas com composição de aminoácidos diferentes poderão ter
cargas distintas de acordo com a condição a que forem submetidas. Os aminoácidos apresentam
propriedades características quando isolados, mas formando um polipeptídeo eles podem
interferir uns nos outros e consequentemente no comportamento total da proteína. As proteínas,
assim como os peptídeos e aminoácidos, possuem pontos isoelétricos característicos, nos quais
elas possuem carga líquida (soma das cargas positivas e negativas) igual à zero. O ponto
isoelétrico de cada proteína é específico e pode servir como método de separação de proteínas
em solução, por exemplo, ao submeter uma solução com várias proteínas a um pH tal que seja
equivalente ao ponto isoelétrico de uma delas, só esta precipitará, podendo ser separada das
demais.

2. MÉTODOS EXPERIMENTAIS
PRECIPITAÇÃO PELO ÁCIDO ACÉTICO
Foram utilizados três tubos de ensaio devidamente identificados e em cada um deles
foram colocados 2 mL de ovoalbumina com a utilização de uma pipeta graduada e um
auxiliador de pipetagem (pêra). Posteriormente foi adicionado 1 mL de solução de ácido acético
20% no primeiro tubo, 1 mL de solução de ácido clorídrico 20% no segundo tubo e 1 mL de
solução de ácido tricloroacético no terceiro; os três tubos foram agitados para misturar bem os
reagentes.
PRECIPITAÇÃO COM SAIS DE METAIS PESADOS
Foram utilizados três tubos de ensaio devidamente identificados e em cada um deles
foram colocados 2 gotas de NaOH com a utilização de uma pipeta graduada de 5 mL.
Posteriormente foi adicionado 1 mL de ovoalbumina no primeiro tubo, 1 mL de ovoalbumina e
5 gotas de solução de acetato de chumbo 10% no segundo tubo e 1 mL de água e 5 gotas de
solução de acetato de chumbo 10% no terceiro; os três tubos foram agitados levemente para
misturar bem os reagentes e após 10 minutos foram observados os resultados.
PRECIPITAÇÃO POR SATURAÇÃO SALINA E COM SOLVENTE ORGÂNICO
Foram utilizados dois tubos de ensaio devidamente identificados e em cada um deles foi
colocado 1 mL de ovoalbumina com a utilização de uma pipeta graduada e um auxiliador de
pipetagem (pêra). Posteriormente foram adicionados 3 mL de solução saturada de sulfato de
amônio no primeiro tubo e 3 mL álcool no segundo tubo; os dois tubos foram agitados para
misturar bem os reagentes e deixados em repouso para que os resultados fossem anotados.
Depois de 5 minutos, adicionou-se 5 mL a cada um dos tubos, que foram agitados e
posteriormente deixados em repouso afim de perceber os resultados.
PRECIPITAÇÃO ISOELÉTRICA
Foram utilizados três tubos de ensaio devidamente identificados e em cada um deles foram
colocados 2 mL de soluções tampão; no primeiro, tubo foi colocada uma solução tampão de pH
6; no segundo, uma de pH 4,7 e , no terceiro, uma de pH 3. Posteriormente foi adicionado 1 mL
de ovoalbumina e 4 mL de álcool em todos os tubos, os três tubos foram agitados para misturar
bem os reagentes.

3. RESULTADOS E DISCUSSÕES
PRECIPITAÇÃO PELO ÁCIDO TRICLOROACÉTICO
TUBO RESULTADO
1 -
2 + +
3 + + + +
QUESTÕES:
Explique a eficiência dos diferentes ácidos para precipitar a proteína.
Existe relação entre a molaridade do ácido e o seu efeito sobre a ovoalbumina?
RESPOSTAS:
Observa-se, portanto, que quanto mais forte é um ácido, mais eficiente é a precipitação
da proteína quando reage com ele. A força de um ácido é medida a partir do seu grau de
ionização, dessa forma, é possível explicar por que o ácido acético não foi capaz de provocar
precipitação da proteína, isso porque seu grau de ionização é baixo e ele é classificado como um
ácido fraco, enquanto o acido acético é considerado forte e tem alto grau de ionização, sendo
capaz de provocar precipitação. O ácido tricloroacético é capaz de promover maior precipitação
porque, além de ter alto grau de ionização, é capaz de atacar os centros hidrofóbicos das
proteínas, sendo um agente de precipitação mais eficiente.
A molaridade dos ácidos utilizados na aula prática em questão não tem relação direta
com o efeito deles sobre a ovoalbumina, visto que os ácidos com maior molaridade não são os
que provocam maior precipitação da proteína. Calculando a molaridade dos ácidos usados a
partir da seguinte fórmula:
Molaridade=% x10Massa Molar do ácido
Obteremos as molaridades:
Molaridade do Ác . Acético 20 %=3,33 molar
Molaridade do Ác . clorídrico 20 %=5,48molar
Molaridade do Ác .Tricloroacético 20 %=1,22 molar

PRECIPITAÇÃO COM SAIS DE METAIS PESADOS
TUBO RESULTADO
1 -
2 + + + +
3 + +
QUESTÕES:
Explique a natureza do precipitado no tubo nº 2.
Qual a influência do pH do meio (alcalino ou ácido) neste processo de precipitação de
proteínas?
RESPOSTAS:
O primeiro tubo não apresentou precipitado porque a base forte adicionada não é capaz
de formar um precipitado sozinha. No segundo tubo, observa-se intensa formação de
precipitado, o proteinato de chumbo. O grupo hidroxila da água reage com o sal de metal
pesado formando um hidróxido de chumbo, sal insolúvel constituinte do precipitado observado
no terceiro tubo.
O pH é importante para esse tipo de reação porque essa precipitação é mais intensa
quando o pH está acima do ponto isoelétrico. Isso porque, acima do pI, a carga líquida sobre a
proteína é negativa favorecendo a interação com os cátions provenientes do sal. Em pH abaixo
do ponto isoelétrico, não é possível provocar precipitação com sais, mas com ácidos fortes.
PRECIPITAÇÃO POR SATURAÇÃO SALINA E COM SOLVENTE ORGÂNICO
TUBO 1ª PRECIPITAÇÃO 2ª PRECIPITAÇÃO
1 + + + + -
2 + + + + + +
QUESTÕES:
Explique a reversibilidade das precipitações nos tubos 1 e 2?
Como se dá a relação das moléculas de água com o sal e com o solvente orgânico?
RESPOSTAS:

A camada de solvatação é retirada pela solução saturada de (NH4)2SO4 e pelo álcool,
fazendo a proteína se associar e precipitar.
As moléculas de água presente na solução de ovoalbumina apresentam maior tendência
de solvatação de partículas menores (nesse caso, os íons do sulfato de amônio). As moléculas de
água, ocupadas em sua interação com os íons, "abandonam" a estrutura protéica. Dessa forma,
há maior interação proteína-proteína, diminuição da solubilidade em meio aquoso e,
consequentemente, precipitação da proteína. A esse fenômeno de precipitação da proteína em
decorrência de um considerável aumento da força iônica do meio dá-se o nome de salting out. A
adição de mais água à solução possibilita a reversibilidade da precipitação porque, como há
mais moléculas de água para interagir com as proteínas, a “competição” entre a solvatação dos
íons e da proteína diminui, uma vez que existem moléculas de água suficientes para solvatar
esses dois elementos e relação água-proteína é favorecida.
Os solventes orgânicos que têm uma porção hidrofóbica e uma porção polar são capazes
de precipitar proteínas porque os grupos polares interagem com os grupos polares da proteína,
competindo com as moléculas de água, e os grupos hidrofóbicos alteram as interações
hidrofóbicas dentro da estrutura proteica. O volume de solvente orgânico reduz a concentração
efetiva da água, havendo menos moléculas para a relação água-proteína, favorecendo a relação
proteína-proteína, fazendo com que haja precipitação. A proteína não volta a se solubilizar
completamente com adição de mais água porque as interações apolares da molécula da proteína
são atingidas pelo solvente orgânico, novas interações são estabelecidas e algumas partes da
proteína não são capazes de voltar à conformação inicial. Consequentemente, a precipitação é
apenas reduzida com a adição de água, uma vez que a competição entre solvente e proteína é
eliminada pelo aumento da concentração efetiva de água, mas ainda resta precipitado por causa
da desnaturação protéica causada pelo solvente orgânico.
PRECIPITAÇÃO ISOELÉTRICA
TUBO RESULTADO
1 -
2 + + +
3 -
QUESTÕES:
Qual o ponto isoelétrico (aproximação) da ovoalbumina?
Quais aminoácidos ionizáveis são mais abundantes nesta proteína?

Faça uma curva de ionização (aproximada) para a lisina:
RESPOSTAS:
Quando uma proteína se encontra em meio com pH igual a seu ponto isoelétrico, ou
seja, quando apresenta carga líquida nula, a repulsão eletrostática entre partículas diminui,
possibilitando interações proteína-proteína, gerando uma condição favorável para que as
moléculas de proteína se aproximem, agreguem e precipitem. O ponto isoelétrico aproximado
da ovoalbumina é no pH 4,7, pois é nesse pH em que há precipitação da proteína.
A ovolbumina de galinha é composta por 385 aminoácidos, possui os 20 aminoácidos
padrão, e sua massa molecular relativa é 45 kDa. A ovoalbumina também tem várias
modificações, como a acetilação N-terminal (G1), fosforilação (S68, S344), e glicosilação
(N292). É rica em aminoácidos com enxofre como a cisteína e metionina, apresenta 4 sulfidrilas
e forma duas pontes dissulfeto; estas pontes aumentam quando se armazena a proteína. Como
contém fósforo e glicídios unidos é uma fosfoglicoproteína, que é composta por três fracções
(A1, A2 e A3 na proporção 85: 12: 3) com diferente teor de fósforo. Os aminoácidos ionizáveis
mais abundantes são cisteína, metionina, histidina, ácido glutâmico, arginina e lisina.
A curva de ionização da lisina pode ser observada na Figura 2.

Figura 2 – Curva de ionização para a lisina.
4. CONCLUSÕES
Diante do observado com a realização da prática, é possível perceber experimentalmente as
propriedades das proteínas através de suas reações de precipitação. As reações de precipitação
podem ser provocadas por diversos tipos de agentes precipitantes, são úteis para a separação
das proteínas e podem ser também agentes desnaturantes, alterando a função original de uma
determinada proteína.

REFERÊNCIAS BIBLIOGRÁFICAS
CARREIRA, R. L. et al. EFEITO DA PRECIPITAÇÃO PELO ÁCIDO
TRICLOROACÉTICO (TCA) E DA ULTRAFILTRAÇÃO SOBRE O PERFIL
PEPTÍDICO DE HIDROLISADOS DE CASEÍNA. Ciênc. agrotec., Lavras, V.27, n.2,
p.414-421, mar./abr., 2003. Disponível em: <
http://www.scielo.br/pdf/cagro/v27n2/a23v27n2.pdf>. Data da consulta: 16 de outubro de 2015.
Experimentos de química. Disponível em
<http://www.fcfar.unesp.br/alimentos/bioquimica/praticas_proteinas/precipitacao_proteinas.htm
>. Data da consulta: 10 de outubro de 2015.
MORAES, C.S. et al. SÉRIE EM BIOLOGIA CELULAR E MOLECULAR - MÉTODOS
EXPERIMENTAIS NO ESTUDO DE PROTEÍNAS. IOC - Instituto Oswaldo Cruz, Rio de
Janeiro, 1ª edição, 2013. Disponível em: <
http://www.fiocruz.br/ioc/media/apostila_volume_1.pdf>. Data da consulta: 17 de outubro de
2015.
MOTTA, V,T. BIOQUÍMICA BÁSICA – AMINOÁCIDOS E PROTEÍNAS. Disponível
em: < http://www.gilvan.pro.br/aminoeproteinas.pdf>. Data da consulta: 16 de outubro de 2015.
NELSON, D.L.; COX, M.M. Lehninguer – Princípios da Bioquímica. Editora Sarvier, São
Paulo, 4º edição, 2006.
Ovoalbumina. Disponível em: <https://gl.wikipedia.org/wiki/Ovoalbumina>. Data da consulta:
18 de outubro de 2015.
Proteínas. Disponível em
<http://www.fcfar.unesp.br/alimentos/bioquimica/introducao_proteinas/
introducao_proteinas.htm>. Data da consulta: 10 de outubro de 2015.