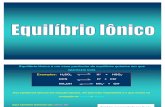
Ac e bases em equilibrio
39
Química Prof. Prof. Ródnei Ródnei Ácidos e Ácidos e bases em bases em equilíbrio equilíbrio químico químico
-
Upload
rodnei-souza -
Category
Documents
-
view
218 -
download
1
description
Apresentação sobre Aciods, bases e pH - nov/2013
Transcript of Ac e bases em equilibrio
Apresentação do PowerPointQuímica
Função química corresponde a um conjunto de substâncias que apresentam propriedades químicas semelhantes.
As substâncias inorgânicas podem ser classificadas em quatro funções:
Ácidos
Bases
Sais
Óxidos
Assim, numa reação química, todos os ácidos, por exemplo, terão comportamento semelhante.
Funções químicas
Química
Ácidos
Ácidos de Arrhenius: são substâncias compostas que em solução Aquosa liberam como único e exclusivo cátion o Hidroxônio (H3O+ ou H+).
Ionização de um Ácido
HCl + H2O H3O+ + Cl-
H2SO4 + 2H2O 2H3O+ + SO42-
H3PO4 + 3H2O 3H3O+ + PO43-
Hidrogênios ionizáveis
Os hidrogênios que fornecem H3O+ são chamados de hidrogênios ionizáveis. São aqueles que se ligam ao elemento mais eletronegativo na molécula do ácido. Geralmente a quantidade de hidrogênios do ácido é a mesma que pode ionizar, mas existem exceções:
H3PO3 + 2H2O ® 2H3O+ + HPO32- apenas 2H+
H3PO2 + H2O ® H3O+ + H2PO21- apenas 1H+
Química
Ácidos fracos: 0< a < 5%
Ácidos moderados: 5% £ a £ 50%
Ácidos fortes : 50% < a < 100%
Nº de Mol Ionizados
CONCEITOS DE LOWRY-BRÖNSTED
Os conceitos de Arrhenius para ácidos e bases são aplicados somente
para soluções aquosas.
Em 1923, 2 cientistas, o dinamarquês J.N. Brönsted e o inglês T.M.
Lowry propuseram independentemente um novo e mais amplo
conceito para ácidos e bases.
Química
Ácido é qualquer espécie química (molécula ou íon) capaz de
CEDER PRÓTONS (H+).
Base é qualquer espécie química (molécula ou íon) capaz de
RECEBER PRÓTONS (H+).
Química
Química
A atração menor entre o Hidrogênio e o Oxigênio facilita a ionização
HClO4 = ácido forte
CONCEITO DE LEWIS
Sem entrar em choque com os conceitos de Arrhenius e Lowry- Brönsted, o cientista americano Gilbert N. Lewis ampliou o conceito para ácidos e bases.
O conceito de Lowry-Brönsted engloba todos os ácidos e bases de Arrhenius e ainda inclui diversas substâncias novas.
O conceito de Lewis: engloba ainda uma série de substâncias que até então não estavam incluídas.
Química
CONCEITO DE LEWIS
Base é toda espécie química (íon ou molécula), que possui um ou mais pares de elétrons periféricos, não compartilhados, capazes de efetuar ligações coordenadas.
Ácido é toda espécie química (íon ou molécula) que é capaz de efetuar ligação coordenada, com um par de elétrons, ainda não compartilhado, que se encontra numa base.
Química
Química
H+(aq) + NaHCO3(s)
PCl5 PCl3 + Cl2 Kc = [PCl3].[Cl2] / [PCl5]
SO3 + 1/2 O2 SO3 Kc = [SO3] / [SO2].[O2]1/2
2H2 + S2 2H2S Kc = [H2S]2 / [H2]2.[S2]
Generalizando:
Química
Equilíbrio iônico da água
Na água líquida, devido às colisões intermoleculares, algumas moléculas de água são quebradas para o equilíbrio:
HOH (l) H+ (aq)+ OH- (aq)
água pura → [H+] = [OH-]
[H+] = [OH-] = 1,0.10-7 mol/L
Produto iônico da água (Kw)
Considerando o equilíbrio da água:
O valor de Kw pode ser calculado, a 25ºC, pois já conhecemos os valores de [H+] e [OH-] a essa temperatura:
Kw = 1,0 . 10-7 . 1,0 . 10-7
A 25ºC: Kw = 1,0 .10-14
Química
pH
Escala de pH – Escala de pOH
O termo pH foi introduzido, em 1909, pelo bioquímico Sorensen, para facilitar seus no trabalho no controle de qualidade de cervejas.
pH = -log [H+] = [OH-]
- Quanto mais ácida for a solução, menor será o pH.
- Quanto mais básica for a solução, maior será o pH.
Química
b) para solução ácida: [H+] = 10-3 [OH-] = 10-11
pH = - log10 (10-3) = - (-3) log 10 = 3 pOH = 11
c) para solução básica: [OH-] = 10-1 [H+] = 10-13
pOH = - log10 (10-1) = - (-1) log 10 = 1 pH = 13
Química
[H+] > [OH-]
[H+] = 10-3 ; [OH-] = 10-11
[H+] < [OH-]
[OH-] = 100 ; [H+] = 10-14
Química
INDICADORES
Pela teoria de Ostwald o indicador na forma ácida não dissociada (HIn) ou básica (InOH) teria uma cor diversa daquela que teriam seus íons
No equilíbrio HIn H+ + In- (Indicador ácido)
InOH OH- + In- (Indicador básico)
cor da forma cor da forma
não ionizada ionizada
Num meio ácido...
... o equilíbrio desloca-se para a esquerda e a solução apresenta a cor 1 (da espécie Hind).
Hind Ind- + H+
Num meio alcalino...
... o equilíbrio desloca-se para a direita e a solução apresenta a cor 2.
Hind Ind- + H+
alaranjado de metila
Química
Potenciômetros
As soluções indicadoras podem ser substituídas por potenciômetros e a medida do pH pode ser feita utilizando-se eletrodos.
Química
Química
Química
H+ (aq) + HCO3- (aq)
O que ocorre se o pH do meio (sistema) aumentar ou diminuir?
Equilíbrio do gás carbônico
Hg2Cl2(aq) 2Hg+(aq) + 2Cl- (aq) Kps = 1,3 x 10-18
Generalizando:
Química
O que é calagem?
Incorporação ao solo de certos materiais com o objetivo de corrigir sua acidez!
Solos Ácidos pH < 5,5
adiciona OH
Materiais usados na calagem: BASES em água!
Ca2+CO32(s) + H+HO() Ca2+(aq) + HCO3(aq) + OH(aq)
BASE ÁCIDO
Ca2+O2(s) + H+HO(l) Ca2+(aq) + 2 OH(aq)
Química
Química
O CASO CELOBAR:
Em meados de 2003, a população brasileira acompanhou, alarmada, o noticiário sobre a morte de mais de 20 pessoas após terem ingerido o produto Celobar®, usado para fins de contraste em exames radiológicos.
Química
O CASO CELOBAR
O CELOBAR: sulfato de bário que é pouquíssimo solúvel (Kps 1 ×10-10 à 25 oC) em água e (fato importante) não se dissolve mesmo na presença de ácidos, passa pelo aparelho digestivo e é eliminado juntamente com as fezes, sem que quantidade importante de íons bário seja absorvida pelo corpo.
BaSO4 (aq) Ba 2+ (aq) + SO4 2- (aq)
Kps = [Ba 2+]x [SO4 2-] / [BaSO4 ]
Química
O CASO CELOBAR
O carbonato de bário é igualmente pouquíssimo solúvel (Kps 5 × 10-9 à 25 oC) em água e (fato importante), porém, se dissolve na presença de ácidos e libera íons bário que é absorvido pelo corpo.
BaCO3 (aq) Ba 2+ (aq) + CO3 2- (aq)
CO3 2- (aq) + H+ (aq) HCO3- (aq) + H+ (aq) H2CO3 (aq) CO2 (g) + H2O
Kps = [Ba 2+]x [CO3 2-] / [BaCO3 ]
Função química corresponde a um conjunto de substâncias que apresentam propriedades químicas semelhantes.
As substâncias inorgânicas podem ser classificadas em quatro funções:
Ácidos
Bases
Sais
Óxidos
Assim, numa reação química, todos os ácidos, por exemplo, terão comportamento semelhante.
Funções químicas
Química
Ácidos
Ácidos de Arrhenius: são substâncias compostas que em solução Aquosa liberam como único e exclusivo cátion o Hidroxônio (H3O+ ou H+).
Ionização de um Ácido
HCl + H2O H3O+ + Cl-
H2SO4 + 2H2O 2H3O+ + SO42-
H3PO4 + 3H2O 3H3O+ + PO43-
Hidrogênios ionizáveis
Os hidrogênios que fornecem H3O+ são chamados de hidrogênios ionizáveis. São aqueles que se ligam ao elemento mais eletronegativo na molécula do ácido. Geralmente a quantidade de hidrogênios do ácido é a mesma que pode ionizar, mas existem exceções:
H3PO3 + 2H2O ® 2H3O+ + HPO32- apenas 2H+
H3PO2 + H2O ® H3O+ + H2PO21- apenas 1H+
Química
Ácidos fracos: 0< a < 5%
Ácidos moderados: 5% £ a £ 50%
Ácidos fortes : 50% < a < 100%
Nº de Mol Ionizados
CONCEITOS DE LOWRY-BRÖNSTED
Os conceitos de Arrhenius para ácidos e bases são aplicados somente
para soluções aquosas.
Em 1923, 2 cientistas, o dinamarquês J.N. Brönsted e o inglês T.M.
Lowry propuseram independentemente um novo e mais amplo
conceito para ácidos e bases.
Química
Ácido é qualquer espécie química (molécula ou íon) capaz de
CEDER PRÓTONS (H+).
Base é qualquer espécie química (molécula ou íon) capaz de
RECEBER PRÓTONS (H+).
Química
Química
A atração menor entre o Hidrogênio e o Oxigênio facilita a ionização
HClO4 = ácido forte
CONCEITO DE LEWIS
Sem entrar em choque com os conceitos de Arrhenius e Lowry- Brönsted, o cientista americano Gilbert N. Lewis ampliou o conceito para ácidos e bases.
O conceito de Lowry-Brönsted engloba todos os ácidos e bases de Arrhenius e ainda inclui diversas substâncias novas.
O conceito de Lewis: engloba ainda uma série de substâncias que até então não estavam incluídas.
Química
CONCEITO DE LEWIS
Base é toda espécie química (íon ou molécula), que possui um ou mais pares de elétrons periféricos, não compartilhados, capazes de efetuar ligações coordenadas.
Ácido é toda espécie química (íon ou molécula) que é capaz de efetuar ligação coordenada, com um par de elétrons, ainda não compartilhado, que se encontra numa base.
Química
Química
H+(aq) + NaHCO3(s)
PCl5 PCl3 + Cl2 Kc = [PCl3].[Cl2] / [PCl5]
SO3 + 1/2 O2 SO3 Kc = [SO3] / [SO2].[O2]1/2
2H2 + S2 2H2S Kc = [H2S]2 / [H2]2.[S2]
Generalizando:
Química
Equilíbrio iônico da água
Na água líquida, devido às colisões intermoleculares, algumas moléculas de água são quebradas para o equilíbrio:
HOH (l) H+ (aq)+ OH- (aq)
água pura → [H+] = [OH-]
[H+] = [OH-] = 1,0.10-7 mol/L
Produto iônico da água (Kw)
Considerando o equilíbrio da água:
O valor de Kw pode ser calculado, a 25ºC, pois já conhecemos os valores de [H+] e [OH-] a essa temperatura:
Kw = 1,0 . 10-7 . 1,0 . 10-7
A 25ºC: Kw = 1,0 .10-14
Química
pH
Escala de pH – Escala de pOH
O termo pH foi introduzido, em 1909, pelo bioquímico Sorensen, para facilitar seus no trabalho no controle de qualidade de cervejas.
pH = -log [H+] = [OH-]
- Quanto mais ácida for a solução, menor será o pH.
- Quanto mais básica for a solução, maior será o pH.
Química
b) para solução ácida: [H+] = 10-3 [OH-] = 10-11
pH = - log10 (10-3) = - (-3) log 10 = 3 pOH = 11
c) para solução básica: [OH-] = 10-1 [H+] = 10-13
pOH = - log10 (10-1) = - (-1) log 10 = 1 pH = 13
Química
[H+] > [OH-]
[H+] = 10-3 ; [OH-] = 10-11
[H+] < [OH-]
[OH-] = 100 ; [H+] = 10-14
Química
INDICADORES
Pela teoria de Ostwald o indicador na forma ácida não dissociada (HIn) ou básica (InOH) teria uma cor diversa daquela que teriam seus íons
No equilíbrio HIn H+ + In- (Indicador ácido)
InOH OH- + In- (Indicador básico)
cor da forma cor da forma
não ionizada ionizada
Num meio ácido...
... o equilíbrio desloca-se para a esquerda e a solução apresenta a cor 1 (da espécie Hind).
Hind Ind- + H+
Num meio alcalino...
... o equilíbrio desloca-se para a direita e a solução apresenta a cor 2.
Hind Ind- + H+
alaranjado de metila
Química
Potenciômetros
As soluções indicadoras podem ser substituídas por potenciômetros e a medida do pH pode ser feita utilizando-se eletrodos.
Química
Química
Química
H+ (aq) + HCO3- (aq)
O que ocorre se o pH do meio (sistema) aumentar ou diminuir?
Equilíbrio do gás carbônico
Hg2Cl2(aq) 2Hg+(aq) + 2Cl- (aq) Kps = 1,3 x 10-18
Generalizando:
Química
O que é calagem?
Incorporação ao solo de certos materiais com o objetivo de corrigir sua acidez!
Solos Ácidos pH < 5,5
adiciona OH
Materiais usados na calagem: BASES em água!
Ca2+CO32(s) + H+HO() Ca2+(aq) + HCO3(aq) + OH(aq)
BASE ÁCIDO
Ca2+O2(s) + H+HO(l) Ca2+(aq) + 2 OH(aq)
Química
Química
O CASO CELOBAR:
Em meados de 2003, a população brasileira acompanhou, alarmada, o noticiário sobre a morte de mais de 20 pessoas após terem ingerido o produto Celobar®, usado para fins de contraste em exames radiológicos.
Química
O CASO CELOBAR
O CELOBAR: sulfato de bário que é pouquíssimo solúvel (Kps 1 ×10-10 à 25 oC) em água e (fato importante) não se dissolve mesmo na presença de ácidos, passa pelo aparelho digestivo e é eliminado juntamente com as fezes, sem que quantidade importante de íons bário seja absorvida pelo corpo.
BaSO4 (aq) Ba 2+ (aq) + SO4 2- (aq)
Kps = [Ba 2+]x [SO4 2-] / [BaSO4 ]
Química
O CASO CELOBAR
O carbonato de bário é igualmente pouquíssimo solúvel (Kps 5 × 10-9 à 25 oC) em água e (fato importante), porém, se dissolve na presença de ácidos e libera íons bário que é absorvido pelo corpo.
BaCO3 (aq) Ba 2+ (aq) + CO3 2- (aq)
CO3 2- (aq) + H+ (aq) HCO3- (aq) + H+ (aq) H2CO3 (aq) CO2 (g) + H2O
Kps = [Ba 2+]x [CO3 2-] / [BaCO3 ]