Leucemia-linfoma de células T do adulto no Brasil ... · PDF filelinfomas de um modo...
Transcript of Leucemia-linfoma de células T do adulto no Brasil ... · PDF filelinfomas de um modo...

585
Leucemia-linfoma de células T do adulto no Brasil:epidemiologia, tratamento e aspectos controversosAdult T cell leukemia-lymphoma in Brasil: epidemiology, treatment and
controverstial aspects
1Médica. Mestranda em Hematologia, Universidade Federal do Rio de Janeiro, Laboratório de Marcadores Celulares -Serviço de Hematologia.2Serviço de Hematologia, Hospital do Câncer I, Instituto Nacional de Câncer.3Laboratório de Marcadores Celulares, Serviço de Hematologia, Hospital do Câncer I,Instituto Nacional de Câncer. Enviarcorrespondência para M.S.P.O. HC I, Praça Cruz Vermelha 23, 7º andar; 20230-130 Rio de Janeiro, RJ - Brasil. E-mail:[email protected]
Recebido em setembro de 2002.
ResumoResumoResumoResumoResumoA leucemia-linfoma de células T do adulto (LLcTA) é uma neoplasia de linfócitos T maduros,associada à infecção pelo vírus linfotrópico de células T humanas do tipo I (HTLV-I). LLcTAocorre mais freqüentemente em regiões onde a infecção pelo HTLV-I é endêmica, como noJapão e ilhas caribenhas, porém casos esporádicos já foram descritos em regiões não-endêmicaspara infecção por HTLV-I. No Brasil, as formas clínicas mais reconhecidas são as formasagudas e linfomatosas. Um fato interessante da coorte brasileira é a ocorrência desta doençaem crianças e jovens (2-21 anos). Rio de Janeiro e Salvador são as cidades com maior ocorrênciade casos diagnosticados, seguidos de Recife e São Paulo. LLcTA nas formas mais agressivasnão responde aos tratamentos quimioterápicos convencionais com insucesso em termos desobrevida > 5 anos. No entanto, nos casos que receberam a consolidação do tratamento coma-interferon (aIFN) associado a zidovudine (AZT) como esquema de manutenção de remissão,demonstraram melhor sobrevida. Recentemente o tratamento com anti-CD25, apesar deestar em fase experimental, vem apresentado resultados promissores. Com o crescentereconhecimento da LLcTA dentre as doenças linfoproliferativas no Brasil, tornam-se necessáriosestudos terapêuticos diferenciados desta doença. Procuramos neste artigo descrever ascaracterísticas clínico-epidemiológicas dos casos brasileiros, e com a revisão da literaturasobre os resultados terapêuticos no tratamento do LLcTA, pretendemos propor um estudocom fins terapêuticos utilizando drogas moderadoras biológicas e anti-retrovirais.Palavras-chave: leucemia-linfoma aguda de células T associada a HTLV-I; quimioterapia;epidemiologia; HTLV-I; Brasil.
REVISÃO DE LITERAREVISÃO DE LITERAREVISÃO DE LITERAREVISÃO DE LITERAREVISÃO DE LITERATURA TURA TURA TURA TURA / LITERATURE REVIEW
Fernanda Azevedo Silva,1 Ernesto Meis,2 Jane de Almeida Dobbin2 e
Maria do Socorro Pombo de Oliveira 3
Revista Brasileira de Cancerologia, 2002, 48(4): 585-595

586
AbstractAbstractAbstractAbstractAbstractAdult T-cell leukemia/lymphoma (ATLL) is a malignant disease of T-cell mature lymphocyte associ-ated to human T-cell lymphotropic virus type I (HTLV-I). Although ATLL frequently occurs inregions where HTLV-I infection are endemic, such as Japan and Caribbean islands, howeversporadic cases have been described in HTLV-I non endemic areas. In Brazil, the most recognizedclinical form of ATLL are acute and lymphoma subtypes. The occurrence of ATLL in children andyoung patients was an interesting and distinct demographic features observed in the Braziliancohort. Rio de Janeiro and Salvador cities where locations with the majority of cases registered,followed by Recife and São Paulo cities. The most aggressive clinical forms of ATLL are unrespon-sive to conventional chemotherapy protocols with poor rate of 5 years survival. However in caseswho interferon-a and ziovudine were used as consolidation treatment the overall results demon-strated a better survival rate. Recently the alternative treatment using anti-CD25 showed promis-ing results, even though in experimental protocols. With the increasing recognition of ATLL inBrazil, it has been necessary to apply different therapeutic protocols for this disease. In this manu-script we described the clinical and epidemiological characteristics of the Brazilian cases and areview of literature regarding therapeutic approaches of ATLL seeking new insights and manage-ment of biological modifiers and retroviral drugs.Key words: HTLV-I associated acute T-cell leukemia-lymphoma; chemotherapy; epidemiology; HTLV-I; Brazil.
INTRODUÇÃO
Características clínicas e laboratoriaisA leucemia-linfoma de células T do adulto
(LLcTA) é uma neoplasia de linfócitos Tmaduros, relacionada à infecção pelo víruslinfotrópico de células T humanas do tipo I(HTLV-I). Além do LLcTA, outras doençascomo paraparesia espástica tropical emielopatia associada a HTLV-I (TSP/HAM),uveíte e dermatite infecciosa na infância fazemparte do espectro clínico da infecção porHTLV-I. Ocorrem mais freqüentemente noJapão, onde LLcTA foi descrita pela primeiravez em 1977.1,2 No Brasil a infecção peloHTLV-I é considerada endêmica, porém combaixo índice de prevalência (0,4% - 1,8%) napopulação geral, quando comparado com osíndices do Japão (3% - 16%).3,4 As regiõescom maior número de casos diagnosticadossão Rio de Janeiro, Salvador, Recife e SãoPaulo, dados demonstrados após análise deuma série de 238 casos coletados ao longo deoito anos do registro de casos de LLcTA noBrasil.5
As formas clínicas do LLcTA
Silva FA, et al
caracterizam-se em quatro subtipos:leucêmico agudo, linfoma, crônico e smoldering(forma oligo-sintomática). Além destessubtipos bem definidos por critérios clínico-laboratoriais, existe um estado limítrofe en-tre indivíduos assintomáticos e LLcTA, queé denominado como fase pré- LLcTA. Nestafase assintomática existe a presença delinfócitos atípicos circulantes que podemdesaparecer espontaneamente e a doença édefinida pela monoclonalidade da inserçãoproviral do HTLV-I no linfócito T CD4+.6, 7
Nas formas clínicas mais agressivas doLLcTA (agudo e linfoma), o pacienteapresenta-se com performance status (PS)comprometido, apresenta a síndrome tumoralcaracterizada por linfoadenomegalias, lesõesviscerais múltiplas (hepatoesplenomegalia einfiltração pulmonar), lesões de pele e lesõesósseas. Hipercalcemia causada pelo aumentoda reabsorção óssea pelos osteoclastos podeocorrer em 50% dos casos. Os pacientes comLLcTA são geralmente imunodeficientes, têmpredisposição constante às infecçõesoportunísticas, sejam elas bacterianas,fúngicas, parasitárias ou virais.2,8,9 A sobrevida
Revista Brasileira de Cancerologia, 2002, 48(4): 585-595

587
Leucemia-linfoma de celulas T
na grande maioria dos casos não ultrapassa12 meses mesmo quando submetido atratamento quimioterápico agressivo. A formalinfomatosa é a mais difícil de se caracterizarcomo LLcTA, devido à semelhança com oslinfomas de um modo geral e principalmentepela ausência de um padrão histológicoarquitetural patognomônico. Só quando opaciente cursa com lesões extranodais ouevolui com hipercalcemia é que a formalinfomatosa é diagnosticada [após sorologiareativa para HTLV-I]. Quando o pacientecursa com formas smoldering ou crônica (nãoexiste massa tumoral), os sintomas são maisinconsistentes com o tipo da doença maligna.Na grande maioria dos casos o diagnósticode LLcTA só é feito durante a agudização doquadro.
Na série de casos brasileiros, 36% dospacientes apresentaram alterações clínicasdecorrentes de hipercalcemia como primeirossinais de LLcTA, ou seja, taquicardia ouarritmia cardíaca, sonolência com confusãomental, letargia, diminuição do fluxo urinárioe insuficiência renal. Por outro lado, após aconfirmação diagnóstica do LLcTA, foicomum encontrar a referência de lesões depele persistentes, de longa duração e quasesempre refratárias aos tratamentosdermatológicos. Na maioria destes casos oenvolvimento cutâneo predominantecaracterizava-se por lesões eritrodérmicas,pápulas, macroplacas, ou leões tumoraiscutâneas de longa evolução.
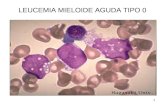
O exame morfológico das células linfóidesmuitas vezes é o primeiro sinal a despertarpara o diagnóstico do LLcTA. Os linfócitossão caracterizados por um acentuadopleomorfismo celular, irregularidadesnucleares e condensação de cromatina nuclearvariável (Figura 1). As células mais típicas daLLcTA são linfócitos de médio tamanho comnúcleos polilobulados (flower cell). Ocitoplasma é freqüentemente escasso e onúcleo irregular pode apresentar esboços denucléolos. As células grandes são semelhantesa imunoblasto com citoplasma basofílico ecromatina nuclear delicada, com nucléolos
proeminentes e aberrantes. É importanteressaltar que na forma smoldering a proporçãode células anormais é inferior a 3% e, nestescasos, as irregularidades nucleares são muitasvezes semelhantes às células cerebriformeshipercromáticas encontradas na micosefungóide. Por ser uma doença de origemperiférica, os aspirados de medula óssea nasua grande maioria apresentam pequenainfiltração de linfócitos convolutos anormais.As dosagens de cálcio sérico e de-hidrogenaselática (DHL) são indispensáveis na avaliaçãodos pacientes, pois hipercalcemia pode seruma complicação fatal nestes pacientes comLLcTA aguda. DHL apresenta-se alterada emcerca de 80% dos casos na apresentação dadoença sendo importante na caracterizaçãoentre os subtipos crônicos e smolderingconforme Tabela 1. Apesar de ainda serutilizado para fins de pesquisa clínica, adosagem sérica da interleucina IL-2 vemdemonstrando ser um excelente indicador dostatus clínico e apresenta-se elevada nospacientes com LLcTA nas formas aguda elinfomatosa.10
Figura 1.Figura 1.Figura 1.Figura 1.Figura 1. Aspectos morfológicos dos linfócitos
naLLcTA, individualizando as diversas formas dos
núcleos celulares que caracterizam a LLcTA. Letra A e C
figuras á esquerda representam as formas típicas de
flower cell.
Em relação ao perfil imunofenotípico, ascélulas da LLcTA expressam marcadores decélulas T como CD2, CD7, mCD3, CD5,CD4+/CD8- além de antígenos de ativação
Revista Brasileira de Cancerologia, 2002, 48(4): 585-595

588
celular CD38, CD30+/-, HLADr e CD25+.Existe uma correlação importante entre os al-tos níveis de células em atividade proliferativamedidas pela quantidade de Ki-67intracitoplasmática, com a rápida progressãoda doença nas fases crônicas para faseaguda.11,12
TTTTTabela 1.abela 1.abela 1.abela 1.abela 1. Características clínicas e laboratoriais que definem os critérios para
classificação dos subtipos clínicos de LlcTA.
Na classificação histológica dos tecidosanalisados, a LLcTA normalmente apresenta-se como um linfoma difuso composto porcélulas com polimorfismo e pleomorfismonuclear. O padrão caracterizado por grandescélulas ou imunoblastos podem ser apopulação predominante, enquanto, em outroscasos, há uma mistura de células pequenas,médias e grandes. Portanto, não há um padrãohistológico arquitetural patognomônico para odiagnóstico de LLcTA; ao contrário, existesuperposição entre os achados histopatológicosdos linfomas de células T, dos linfomas CD30+e dos linfomas cutâneos com LLcTA.13
A escolha dos testes moleculares para ospacientes com LLcTA difere um pouco dostestes moleculares para indivíduos infectadosassintomáticos devido à importância dopadrão monoclonal da inserção proviral. Noscasos de LLcTA, a escolha para caracterizaçãomolecular deverá ser o Southern blot ou areação da cadeia de polimerase invertido
Abreviações:*não é essencial; **não é essencial se outros itens forem preenchidos, masa prova histológica de lesão maligna é requerida; (I) acompanhada por linfocitoseT(3.5x109/l ou mais).
(PCRI). Isto porque o padrão demonoclonalidade é estabelecido através dadigestão do DNA humano com endonucleasesespecíficas e pela visualização de bandas querepresentam os fragmentos do HTLV-Iinserido no genoma humano.14-16 A endonu-clease ECO-RI divide o padrão de integraçãodo HTLV-I em 3 tipos: completo, múltiplo edefectivo. Estes padrões são utilizados comoindicadores de resposta terapêutica e comofatores prognósticos.15,16
LEUCEMIA-LINFOMA DECÉLULAS T NO BRASIL
A partir de um projeto sobre incidência epatogênese de LLcTA no Brasil, foi criadoum registro de casos de LLcTA com base não-populacional, no Laboratório de MarcadoresCelulares - Instituto Nacional de Câncer(INCA), Rio de Janeiro (1992-1999). Esteestudo teve como objetivo identificar aspossíveis diferenças regionais de LLcTA noBrasil, bem como comparar o perfil celular emolecular dos casos incidentes com aquelesdescritos no Japão. Os casos avaliados du-rante a elaboração deste estudo foramresultantes da notificação e colaboração devários pesquisadores. Os pacientes foramidentificados em diversos Centros Médicose registrados de acordo com os dados clínicosenquanto amostras de sangue eram enviadaspara confirmação diagnóstica no INCA.Neste estudo, 110 pacientes foramdiagnosticados no Rio de Janeiro, dos quais80 foram registrados de forma consecutiva, e30 casos retrospectivos foram resgatados, apóssorologia para HTLV-I; 49 pacientes foramdiagnosticados no Departamento de Patologiae Medicina Interna da Universidade Federalda Bahia em Salvador; 30 pacientes foramconsecutivamente diagnosticados e tratadosno Departamento de Hematologia doHEMOPE, Recife-Pernambuco; 18 pacientesforam consecutivamente diagnosticados etratados no Departamento de Hematologiada Escola Paulista de Medicina e 12 noDepartamento de Hematologia da Santa Casa
Silva FA, et al
Revista Brasileira de Cancerologia, 2002, 48(4): 585-595

589
da Misericórdia de São Paulo, em São Paulo.Cinqüenta e nove casos foram obtidosretrospectivamente através de revisão clínicalaboratorial nos quais o diagnóstico préviode linfoma T ocorreu antes dodesenvolvimento do registro. Estes pacientesforam descritos em publicações anteriores.17,18
Embora casos isolados da Venezuela, Itália,Japão e Grécia tenham sido incluídos naanálise (residentes no Brasil há mais de 20anos), todos os casos foram analisados porlocal de nascimento para definirmos asdiferenças regionais da LLcTA comparadas àprevalência do HTLV-I em cada região.5 Umestudo de transmissão de HTLV-I foi realizadoapós o diagnóstico da doença e a altaprevalência da infecção (38%) entre osfamiliares demonstrou a eficiência datransmissão viral intrafamiliar.19
Análise global dos casos demonstrou queas características clínicas de LLcTA no Brasilsão semelhantes aos casos descritos no Japãoe Caribe, com distribuição igual quanto aosexo (homem/mulher 1:1), bem como, quantoà freqüência dos subtipos da doença aodiagnóstico.20,21 Predominaram as formasagudas da doença (60%), seguidas de linfoma(22%), crônico (10%) e smoldering (8%) naanálise dos casos registrados. Os aspectosclínicos laboratoriais mais importantes estãodescritos na Tabela 2 e se caracterizaram porlinfadenopatia (83%), hepatomegalia (60%),lesões de pele (55%) e hipercalcemia (56%).Alguns casos apresentaram formas atípicas dadoença com lesões tumorais isoladas ou perfilimunofenotípico caracterizado por CD4-/CD8- ou CD4-/CD8+. Porém as diferençasmarcantes na série de casos brasileiros são afreqüência de LLcTA em crianças e adultojovens, a idade média dos pacientes de 40anos (2-94 anos), demonstrando um curtoperíodo de latência da infecção viral paratransformação em doença maligna.22 Outroachado importante da coorte brasileira foi apresença de 17 pacientes com TSP/HAM aodiagnóstico ou ocorrendo durante o cursoclínico da LLcTA.5
TTTTTabela 2. abela 2. abela 2. abela 2. abela 2. Aspectos clínicos e laboratoriais de LLcTA
no Brasil.
Devido à diversidade genética dapopulação brasileira, esperávamos encontrardiferenças regionais, como por exemplo, opredomínio do subtipo linfoma versus leuce-mia. Estudo comparativo entre LLcTA noJapão e Jamaica (região caribenha)demonstrou que a forma mais comum dadoença na Jamaica é a linfomatosa (65%),enquanto no Japão predominam as formasleucêmicas (aguda e crônica).23 Nossa coortenão demonstrou diferenças apesar dasinfluências raciais regionais, comodescendentes africanos na Bahia e imigraçãojaponesa em São Paulo.5 Ainda no contextode análise regional, um fato interessante foi amaior incidência de estrongiloidíase nospacientes da Bahia e Pernambuco versus Riode Janeiro e São Paulo (p.001).Estrongiloidíase é freqüentemente encontradaem portadores do HTLV-I devido ao estadode imunodeficiência. Na Martinica,indivíduos HTLV-I+ e com infestação porStrongyloides stercoralis apresentam um padrãode integração monoclonal do HTLV-I provi-ral nas células linfóides, compatível com aexistência de clone de células malignas antes
Abreviações: casos que evoluíram com hipercalcemia apósdiagnóstico; incluindo os 17 pacientes com TSP/HAMconcomitante a LLcTA; MF = micose fungóide; LgcA =linfoma de grandes células anaplásico Ki-1 positive; LNH= linfoma não-Hodgkin; LcT = linfoma T; SNC = sistemanervoso central; As percentagens nas colunas dos subtiposde LLcTa referem-se ao total de pacientes em cada grupo,portanto o somatório dos vários grupos não é 100% e nãohá correlação com a coluna do total de pacientes.
Leucemia-linfoma de celulas T
Revista Brasileira de Cancerologia, 2002, 48(4): 585-595

590
mesmo do quadro clinico de LLcTA.24
Os diversos aspectos biológicosrelacionados à patogênese da infecção porHTLV-I em pacientes brasileiros já foramabordados, tanto no âmbito do hospedeiroquanto do conhecimento da filogenia vi-ral.4,5,19,22,25
Apesar do grande potencial numérico decasos de LLcTA para elaboração de condutasterapêuticas diferenciadas dos demaislinfomas e leucemias, até o presente, nenhumprotocolo inovador foi proposto para serrealizado no Brasil. Por exemplo, as drogasmediadoras do ciclo celular como ácidoretinóico, induzem as células de LLcTA àapoptose (ensaios in vitro) e podem reduzir aresistência e estimular o sistema imune norestabelecimento da atividade anti-tumoral doindivíduo contra as células malignas.Alternativamente, a ação de anti-receptoresde interleucina 2 (anti-CD25) pode ser umaestratégia bem sucedida e merece serinvestigada. Os resultados encorajadores comagentes anti-retrovirais e novas drogasbiológicas nos estimulam ao debate sobre otema.
REVISÃO DE TRATAMENTO
Enquanto as diversas modalidades detratamento conferem grande sucesso nasabordagens de leucemias agudas e linfomasde Hodgkin, o tratamento da LLcTA estáaquém do ideal. Os fatores associados àfalência do tratamento são resistência àquimioterapia convencional, aumento deproteínas responsáveis pela resistência amúltiplas drogas (MDR), mutação ouinativação da P53, aumento da expressão dobcl-2/ bcl-1, mutação da TAX do HTLV-I,aumento do nível de tioredoxina e estado deimunodeficiência levando a infecçõesbacterianas, parasitárias e fúngicas nodecorrer do tratamento quimioterápico.26
Pacientes com as formas crônica e smolderingda LLcTA têm um curso clínico arrastado,com sintomatologia indolente até ocorrer aprogressão da doença para forma aguda.Infelizmente não existem evidências de que otratamento quimioterápico precoce vai evitar
a transformação aguda. Ao contrário, devidoà imunodeficiência, o tratamento poderáaumentar a morbidade com episódios deinfecções oportunísticas e resistência aosdiversos quimioterápicos na fase aguda dadoença.
LLcTA dos tipos agudo e linfoma sãoreconhecidamente as formas mais agressivasda doença com prognóstico sombrio esobrevida média de 5-13 meses. Os principaisfatores prognósticos para a LLcTA são o PSinicial do paciente, idade, o número total delesões envolvidas, os níveis de cálcio e de DHLséricos.8 As principais complicaçõessecundárias ao tratamento caracterizam-sepelo estado de imunodeficiência dos pacientescom: infecção de pele por vários fungos, pneu-monia por P. carinii, herpes zoster, pneumo-nia intersticial, meningite criptocócica eexacerbação de estrongiloidíase. Baseado emsintomas associados à imunodeficiência ospacientes devem ser estratificados em baixorisco, alto risco e alto risco extremo antes doinício do tratamento.8,13 Ações corretivasquanto à hipercalcemia se fazem necessárias,com hiper-hidratação, uso de bifosfanatos ecalcitonina, bem como tratamento preventivopara fungos, parasitas e infecções virais.Baixas doses de cotrimoxazol, aciclovir oral eantifúngico oral são recomendadas emconjunto com os quimioterápicos.
Uma revisão sobre as diversas formas detratamentos descritos na literatura estãoapresentados na Tabela 3. Devido à altaincidência de LLcTA entre as doençaslinfoproliferativas no Japão, os protocolosjaponeses apresentam o maior número decasos analisados e portanto resultados maisconvincentes.27,28 Na Universidade deKawasaki, a estratégia utilizada foi o uso deCHOP (ciclofosfamida, doxorrubicina,vincristina e prednisona) seguido deetoposídeo, vindesina, ranimustina emitoxantrone com fator estimulador decrescimento de colônias de granulócitos (G-CSF). Os pacientes receberam 2-4 cursos dequimioterapia com intervalos de 3 semanas.Aqueles que apresentaram remissão completa
Silva FA, et al
Revista Brasileira de Cancerologia, 2002, 48(4): 585-595

591
(RC) ou parcial (RP) recebiam etoposídeo
(50mg/m2) como tratamento de manutenção.
O resultado deste protocolo foi superior ao
uso anterior de metotrexate, doxorrubicina,
ciclofosfamida, vincristina, prednisona e
bleomicina (CHOP, MACOP-B) ou
vincristina, ciclofosfamida, prednisona e
doxorrubicina (VEPA), com 35,8% de RC e
38,3% RP na série de 83 pacientes elegíveis
para o estudo. As principais toxicidades deste
esquema foram pancitopenia, neurite
periférica e alopecia.27 Etoposídeo em baixas
doses (50mg/dia) foi relatado em uma paciente
cujo estado clínico não permitia o uso de
quimioterapia convencional. Houve remissão
completa do quadro sem reações adversas
graves, com sobrevida de aproximadamente
dois anos.29 No entanto, apesar da introdução
de etoposídeo, a taxa de sobrevida mediana
não ultrapassou nove meses para grande
maioria dos casos e de 3 anos para 13% dos
casos.
TTTTTabela 3.abela 3.abela 3.abela 3.abela 3. Resultados de estudos de tratamento da ATL.
Embora novas estratégias terapêuticasutilizando drogas moduladoras biológicas eanti-retrovirais, o Grupo Japonês para Estudode Linfomas insiste na poliquimioterapiaintensa com uso de fatores estimuladores decolônias de crescimento de granulócitos emacrófagos (GM-CSF) para evitar perdasdevido aos efeitos colaterais como infecçõese falência medular no tratamento da LLcTA.28
Os resultados do protocolo LSG15 utilizandoo esquema vincristina, ciclofosfamida,doxorrubicina e prednisona (VCAP) seguidode doxorrubicina, ranimustina e prednisona(AMP) e vindesina, etoposídeo, carboplatinae prednisona (VECP) são semelhantes aos doprotocolo de Kawasaki quanto às taxas de RCe RP, com discreto aumento na sobrevida em31% dos casos. Casos isolados de tratamentocom transplante de medula óssea (TMO)alogênico, foram relatados, porém a casuísticaé pequena e o tempo de acompanhamentoainda é insuficiente para conclusão definitivaquanto a eficácia deste procedimento. Borget al30 e Tajima et al31 relataram casos isoladosdo LLcTA submetidos a TMO com remissãocompleta mantida de 23 e 24 mesesrespectivamente. Talvez a maior experiênciano tratamento do LLcTA com TMO seja deUtsunomiya et al,32 que descreveram osresultados não muito promissores de 10pacientes submetidos a TMO. A mortalidadede 40% dos casos e 20% de recaída comsobrevida livre de linfoma (SLL) de 17 meses,demonstra a necessidade de aprimorar essaopção terapêutica.
O tratamento mais atrativo no momento,devido a sua baixa toxicidade e aos bonsefeitos em causar remissão e prolongar asobrevida para LLcTA é o uso de zidovudina(AZT) combinado ao interferon (αINF-2b).33,34
Embora o verdadeiro mecanismo de ação sejadesconhecido, especula-se que haja um efeitoimunológico do αINF associado ao efeitocitostático do AZT nas células linfóides. Noentanto, Bazarbachi e Hermine35 nãodemonstraram efeito citotóxico direto destacombinação nos linfócitos T infectados invitro, ao contrário do que é descrito na
Abreviações: n = numero de casos; SLE = sobrevida livrede eventos; SG = sobrevida global; SM= sobrevida mediana;SLD = sobrevida livre de doença; TMO = transplante demedula óssea; ICT = irradiação corporal total; VCR =vincristina; CPA = ciclofosfamida; ADM = doxorrubicina;PDN = prednisona; MCNU = ranimustina; VDS =vindesina; ETP = etoposídeo; Mitox = mitoxantrone; AZT= zidovudina; aINF = interferon alfa 2b; ATRA = ácidotransretinóico; VECP = vindesina, etoposideo, carboplatinae prednisona; AMP = doxorrubicina, ranimustina eprednisona; VCAP = vincristina, ciclofosfamida,doxorrubicina e prednisona; G-CSF = fator de crescimentogranulocítico.
Leucemia-linfoma de celulas T
Revista Brasileira de Cancerologia, 2002, 48(4): 585-595

592
infecção por vírus da imunodeficiênciahumana. Apesar destas diferenças entreensaios in vitro e ex vivo, os resultadosencorajadores com agentes anti-retrovirais emLLcTA são motivo de pesquisa para o ajustede esquema com novas drogas biológicas. Adose preconizada para o uso do AZT é de1g/dia, via oral, em doses fracionadas. O in-terferon (αINF-2b) é utilizado em dosesvariadas de 3 a 6 milhões U/dia, viasubcutânea de acordo com a tolerância decada individuo. Os efeitos colaterais sãoprincipalmente sintomas gripais, depressão,alopecia e neutropenia. Na série de casosdescritos por Matutes et al,36 a estratégiautilizada foi diminuir o volume da doença compoliquimioterapia (3 ciclos) e em seguidautilizar AZT e αINF como continuação dotratamento. A sobrevida mediana foi de 18meses, com ressalva que os pacientesresponsivos à quimioterapia inicial tiveramsobrevida significativamente superior aos nãorespondedores (6 meses). Este esquemamostrou-se superior aos estudos anterioresque não associaram quimioterapia prévia aoAZT e αINF e àqueles com poliquimioterapiasem dose de manutenção.37
A necessidade de quimioterapiaconvencional antes do uso do AZT/IFN parareduzir a carga tumoral ainda precisa serestabelecida, pois nenhum estudo apresentauma casuística homogênea. Em todos osestudos mencionados, houve a inclusão decasos de LLcTA crônica e smoldering quenaturalmente tem curso clínico arrastadoindependente de qualquer tratamento,juntamente com subtipos agudos que são asformas agressivas da doença.
Quando analisamos os resultados de todasas modalidades terapêuticas até hojeempregadas no tratamento de LlcTA, nenhumprotocolo é satisfatório (Figura 2). Não hátratamento curativo e a sobrevida é prolongadaem apenas alguns meses. Conforme abordadoanteriormente, os fatores associados à falênciados tratamentos são resistência àquimioterapia convencional e o aumento deproteínas responsáveis pela MDR,
demonstrado pelas expressões da glicoproteínaP (MDR-1), pela expressão de RNA-m daproteína de resistência a múltiplas drogas(MRP) e pela proteína de resistênciapulmonar (LRP).26,38 Para tentar reverter estequadro, novas drogas têm sido utilizadas comopossibilidade terapêutica para a LLcTA. Oácido transretinóico (ATRA) que inibe ocrescimento das células da LLcTA in vitro einduz apoptose suprimindo a atividade detranscrição da proteína NF-kB no ciclocelular,39 foi utilizado por Miyatake paratratamento de um paciente com LLcTArefratária, na dose de 60mg/dia VO comremissão completa do quadro.38-43 Outromodificador biológico é o trióxido dearsênico, que inibe o crescimento e induzapoptose das células infectadas pelo HTLV-Iatravés da ativação da via das carspases e pelainativação da via NF-kB. Esta droga deve serutilizada em associação com αINF ou ATRA,pois estudos sugerem que seu usoisoladamente poderia aumentar a produçãoviral e o número de células infectadas.43,44
Figura 2.Figura 2.Figura 2.Figura 2.Figura 2. Respostas parcial (RP) e completa (RC) dos
pacientes aos principais esquemas terapêuticos
presentes na Tabela 3.
A imunoterapia com anticorpo monoclonalanti-CD25 (HAT, Zenapax) também despontacomo uma opção promissora no tratamentode LLcTA. Na série de 19 pacientes tratadoscom HAT, 4 permaneceram em RP ealcançaram 2 RC, com sobrevida de 12meses.44 Ressaltamos que estes resultados sãoprovenientes de ensaio clínico fase II, ondeos pacientes incluídos foram refratários aosesquemas quimioterápicos convencionais ecom PS alto.44,45 HAT foi testado em altas
Silva FA, et al
Revista Brasileira de Cancerologia, 2002, 48(4): 585-595

593
doses (> 1mg/kg) sendo demonstrado, saturação> 95% do CD25 com dose de 6mg/kg.45
Até o momento não foi estabelecido qualo melhor tratamento para a LLcTA comdrogas que interferem na dinâmica dapatogênese da doença. Os estudos realizadosforam baseados em casuísticas pequenas, queimpedem a randomização por subtipos deLLcTA e não apresentam grupo controle paracomparação entre fase crônica e aguda. Istose deve à baixa prevalência da infecção porHTLV-I e LLcTA nos países que lideram aspesquisas clínicas. No Brasil novos estudosse fazem necessários para melhorar asobrevida destes pacientes. A incidência decasos LLcTA demonstrada através de estudoepidemiológico recente, irá nos permitirelaborar propostas terapêuticas semelhantesàquelas realizadas no Japão com mais de 80pacientes. Através de um estudo cooperativonacional seremos capazes de melhorar asobrevida dos pacientes e dar continuidadeàs pesquisas sobre patogênese de LLcTA.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Blattner WA, Pombo de Oliveira MS. HTLV-Iand HTLV-II. In: Morigan TC, Bartlett JC,Bolognesi D, editors. Textbook of AIDS Medi-cine. 2nd ed. Baltimore: Williams & Wilkins;1999. p. 1003-29.
2. Manns A, Hisada M, Da Grenade L. HumanT- lymphotropic virus type I infection. Lancet1999;353:1951-8.
3. Galvão-Castro B, Loures L, Rodriques LG, SerenoA, Ferreira Júnior OC, Franco LG, et al. Distribu-tion of human T-lymphotropic virus type I amongblood donors: a nationwide brazilian study. Trans-fusion 1997;37(2):242-3.
4. Farias de Carvalho SMF, Pombo de OliveiraMS, Thuler LC, Rios M, Coelho RC, RubimLC. HTLV-I and HTLV-II infections in hema-tological disorder patients, cancer patients, andhealthy individuals from Rio de Janeiro, Brazil.J Acquir Immune Defic Syndr Hum Retrovirol1997;15(3):238-2.
5. Pombo de Oliveira MS, Loureiro P, BittencourtA, Chiattone C, Borducchi D, De CarvalhoSM, et al. Geographic diversity of adult T-cellleukemia/lymphoma in Brazil. Int J Cancer1999;83(3):291-8.
6. Shimoyama M. Diagnostic criteria and classifi-cation of clinical subtypes of adult T-cell leuke-mia-lymphoma. A report from the LymphomaStudy Group. Br J Haematol 1991;79:428-7.
7. Tachibana N, Okayama A, Ishihara S, SchioiriS, Murai K, Tsuda K, et al. High HTLV-I provi-ral DNA level associated with abnormal lym-phocytes in peripheral blood from asymptom-atic carriers. Int J Cancer 1992;51:593-5.
8. Levine PH, Cleghorn F, Manns A, Jaffe ES,Navarro-Roman L, Blattner WA, et al. Adult T-cell leukemia/lymphoma: a working point-scoreclassification for epidemiological studies. Int JCancer 1994;59:491-3.
9. Lymphoma Study Group. Major prognosticfactors of patients with adult T cell leukemia/lymphoma: a cooperative study. Leuk Res1991;15:81-90.
10. Yamada Y, Ohmoto Y, Hata T, Yamamura M,Murata K, Tsukasaki K, et al. Features of thecytokines secreted by adult T cell leukemia(ATL) cells. Leuk Lymphoma 1996;21(5/6):443-7.
11. Kamihira S, Sohda H, Atogami S, Toriya K,Yamada Y, Tsukazaki K, et al. Phenotypical di-versity and prognosis of adult T-cell leukemia.Leuk Res 1992;16(5):435-9.
12. Shirono K, Hattori T, Takatsuki K. A new clas-sification of clinical stages of adult T-cell leuke-mia based on prognosis of the disease. Leuke-mia 1994;8(11):1834-7.
13. Ohshima K, Suzumiya J, Sato K, Kanda M,Sugihara M, Haraoka S, et al. Nodal T-cell lym-phoma in an HTLV-I-endemic area: proviralHTLV-I DNA, histological classification andclinical evaluation. Br J Haematol1998;101(4):703-11.
14. Yoshida M, Seiki M, Yamaguchi K, TakatsukiK. Monoclonal integration of human T-cell leu-kemia provirus in all primary tumors of adultT-cell leukemia suggests causative role of hu-man T-cell leukemia virus in the disease. ProcNatl Acad Sci USA 1984;81(8):2534-7.
15. Shimamoto Y, Kobayashi M, Miyamoto Y.Clinical implication of the integration patternsof human T-cell lymphotropic virus type Iproviral DNA in adult T-cell leukemia/lym-phoma. Leuk Lymphoma 1996;20:207-15.
16. Tamiya S, Matsuoka M, Etoh K, Watanabe T,Kamihira S, Yamaguchi K, et al. Two types ofdefective human T-lymphotropic virus type Iprovirus in adult T-cell leukemia. Blood1996;88:3065-73.
17. Pombo de Oliveira MS, Matutes E, Schulz T,
Leucemia-linfoma de celulas T
Revista Brasileira de Cancerologia, 2002, 48(4): 585-595

594
Carvalho SMF, Noronha H, Reaves JD, et al. T-cell malignancies in Brazil. Clinicopathologicaland molecular studies of HTLV-I positive andnegative cases. Int J Cancer 1995;60(6):823-7.
18. Bittencourt A, Barbosa HS, Brites C, Ferraz N,Pereira Filho CS, Harrington W.Clinocopathological aspects of HTLV-I posi-tive and negative cutaneous T-cell lymphoma.Eur J Dermatol 1997;7:283-9.
19. Pombo de Oliveira MS, Carvalho SMC,Borducchi D, Dobbin J, Salvador J, Correa RB,et al. Adult T-cell leukemia/lymphoma and clus-ter of HTLV-I associated diseases in brazilian set-tings. Leuk Lymphoma 2001;42(1/2):135-44.
20. Takatsuki K, Matsuoka M, Yamaguchi K. AdultT-cell leukemia/lymphoma in Japan. J AcquirImmune Defic Syndr Hum Retrovirol 1996;13Suppl 1:s15-9.
21. Gerard Y, Lepere JF, Fradinaud R, Joly F,Lepelletier L, Joubert M, et al. Clustering andclinical diversity of adult T-cell leukemia/lym-phoma associated with HTLV-I in a remoteblack population of French Guiana. Int J Can-cer 1995;60:773-6.
22. Pombo de Oliveira MS, Dobbin J, Loureiro P,Borducchi D, Maia RC, Fernandes MA, et al.Genetic mutation and early onset of T-cell leu-kemia in pediatric patients infected at birth withHTLV-I. Leuk Res 2002;26:155-61.
23. Cleghorn F, Manns A, Falk R, Hartge P,Hanchard B, Jack N, et al. Effect of Human T-Lymphotropic Virus type-infection on non-Hodgkin's lymphoma incidence. J Natl Can-cer Inst 1995;87(13):1009-14.
24. Watel E, Vartanian JP, Pannetier C, Wain-Holeson S. Clonal expression of HTLV-I in-fected cells in asymptomatic and symptomaticcarrier without malignancy. J Virol1999;69:2863-8.
25. Sambor AM, Pombo de Oliveira MS, Farhadi A,Carr JK, Carvalho SM, Blattner WA, et al. Hu-man t-lymphotropic virus type I tax polymor-phisms in a transmission cohort: no associationbetween sequence variation and disease mani-festations. J Hum Virol 1999;2(5):308-14.
26. Bazarbachi A, Hermine O. Treatment of adult T-cell leukaemia/lymphoma: current strategy andfuture perspective. Virus Res 2002;78:79-92.
27. Taguchi H, Kinoshita K, Takatsuki K,Tomonaga M, Araki K, Ikeda S, et al. An inten-sive chemoterapy of adult T-cell leukemia/lym-phoma: CHOP followed by etoposide,vindesine, ranimustine, and mitoxantrone withgranulocyte colony-stimulating factor support.
J Acquir Immune Defic Syndr Hum Retrovirol1996:12:182-6.
28. Yamada Y, Tomanaga M, Fukuda H, Hanada S,Utsunomiya A, Tara M, et al. A new G-CSF-supported combination chemotherapy,LSG15, for adult T-cell leukemia/lymphoma:Japan clinical oncology group study 9303. Br JHaematol 2001;113:375-82.
29. Xinjia F, Matano S, Amitani S, Terahata S,Furusyo H, Yamamoto M, et al. Low-doseetoposide in a patient with adult T-cell leuke-mia/lymphoma who had severe complications.Gan To Kagaku Ryoho 2001;28:1269-72.
30. Borg A, Yin L, Johnson PRE, Tosswili J,Saunders M, Morris D. Successful treatment ofHTLV-I associated acute adult T-cell leukemialymphoma by allogeneic bone marrow trans-plantation. Br J Haematol 1996;94:713-5.
31. Tajima K, Amakawa R, Uehira K, MatsumotoN, Shimizu T, Miyazaki Y, et al. Adult T-cellleukemia successfully treated with allogeneicbone marrow transplantation. Int J Haematol2000;71(3):290-3.
32. Utsunomiya A, Miyazaki Y, Takatsuka Y,Hanada S, Uozumi K, Yashiki S, et al. Improvedoutcome of adult T cell leukemia/lymphomawith allogeneic hematopoietic stem cell trans-plantation. Bone Marow Transplant2001;27(1):15-20.
33. Bazarbachi A, Hermine O. Treatment with acombination of zidovudine and alfa-interferonin naive and pretreated adult T-cell leukemia/lymphoma patients. J Acquir Immune DeficSyndr Hum Retrovirol 1996;13(Suppl1):S186-90.
34. Gill PS, Harrington W, Kaplan MH, Ribeiro R,Bennett JM, et al. Treatment of adult T-cellleukemia/lymphoma with a combination ofinterferon alpha and zidovudine. New Engl JMed 1995; 332:1744-8.
35. Bazarbachi A, Nasr R, El-Sabban ME, Mahe A,Mahieux R, Gessain A, et al. Evidence against adirect cytotoxic effect of alpha interferon andzidovudine in HTLV-I associated adult T cell leu-kemia/lymphoma. Leukemia 2000;14:716-21.
36. Matutes E, Taylor GP, Cavenagh J, Pagliuca A,Bareford D, Domingo A, et al. Interferon alphaand zidovudine therapy in adult T-cell leuke-mia/lymphoma: response and outcome in 15patients. Br J Haematol 2001;113:779-84.
37. White JD, Wharfe G, Stewart DM, Maher VE,Eicher D, Herring B, et al. The combination ofzidovudine and interferon alpha-2B in the treat-ment of adult T-cell leukemia/lymphoma. Leuk
Silva FA, et al
Revista Brasileira de Cancerologia, 2002, 48(4): 585-595

595
Lymphoma 2001;40(3/4):287-94.
38. Wang BJ, Kobayashi M, Sakurada K, InamuraM, Muriochi T, Hosokawa M. Possible roles ofan adult T-cell leukemia (ATL)-derived factor/thioredoxin in the drug resistance of ATL toadriamycin. Blood 1997;7:2480-7.
39. Nawata H, Maeda Y, Sumimoto Y, Miyatake J,Kanamaru A. A mechanism of apoptosis in-duced by of all-trans retinoic acid on adult T-cell leukemia cells: a possible involvement ofthe Tax/NF-kB signaling pathway. Leuk Res2001;25:323-31.
40. Maeda Y, Naiki Y, Sono H, Miyatake J,Sumimoto Y, Sakaguchi M, et al. Clinical ap-plication of all-trans retinoic acid (tretinoin) foradult T-cell leukemia. Br J Haematol2000;109:677.
41. Miyatake JI, Maeda Y. Inhibition of prolifera-tion and CD25 down-regulation by retinoicacid in human adult T cell leukemia cells. Leu-kemia 1997;11:401-7.
42. El-Sabban ME, Nasr R, Dbaibo G, Hermine
O, Abboushi N, Quignon F, et al. Arsenic-in-terferon-alpha-triggers apoptosis in HTLV-Itransformed cells is associated with Tax down-regulation and reversal of NF-kB activation.Blood 2000;96:2849-55.
43. Mahieux R, Pise-Masison C, Brady J, GessainA, Yamaoka S, Franchini G. Arsenic trioxideinduces apoptosis in human T-cell leukemiavirus type I and type II infected cells by a caspase-3-dependent mechanism involving Bcl-2 cleav-age. Blood 2001;98(13):3762-9.
44. Waldmann TA. T-cell receptors for cytokines: tar-gets for immunotherapy of leukemia/lymphoma.Ann Oncol 2000;11(Suppl 1):S101-6.
45. Morris JC, Janick JE, Turner M, Lee C, Top L, JaffeES. A phase I/II study of the efficacy and toxicity ofhumanized anti-tac (HAT, Zenapaz) for the treat-ment of tac, expressing human lymphotropic virustype-I (HTLV-I)-associated adult T-cell leukemia/lymphoma (ATL): interim results. AIDS Res HumRetrovirol 2001;17(Suppl1):S29.''
Leucemia-linfoma de celulas T
Revista Brasileira de Cancerologia, 2002, 48(4): 585-595