AVANÇOS NO TRATAMENTO DO CANCER: O PARADIGMA DA IMUNOTERAPIA · Imunidade e Câncer Imunoedição...
Transcript of AVANÇOS NO TRATAMENTO DO CANCER: O PARADIGMA DA IMUNOTERAPIA · Imunidade e Câncer Imunoedição...
AVANÇOS NO
TRATAMENTO DO CANCER: O PARADIGMA DA IMUNOTERAPIA
Luiz Flávio Coutinho
Porto Alegre
25/09/2015
Eternal Sunshine of the Spotless Mind
7
• Esqueça:
• Padrões de quimioterapia (pré-infusão)
• Padrões de resposta
• Desfechos padrões
• Toxicidade relacionada a QT
Chemotherapy
Surgery Immunotherapy
Radiotherapy
What’s immuno-oncology (I-O) Improved survival remains a challenge in some advanced cancers. 5-year survival remains poor for many patients with metastatic solid tumors.
1
There is an ongoing need for new treatments and therapeutic modalities for patients with advanced cancers.
2
8
1. Surveillance, Epidemiology and End Results (SEER) Program. Retrieved May 6, 2014, from http://seer.cancer.gov | 2. Rosenberg SA. Sci Transl Med. 2012;4(127ps8):1-5 | 3. DeVita BT, Rosenberg SA. N Engl J Med. 2012;366:2207-2214 | 4. Kirkwood JM, et al. CA Cancer J Clin. 2012;62:309-335 | 5. Murphy JF. Oncology. 2010;4:67-80
3,9
12,5 12,3
16
Lung Colorectal Kidney and renal pelvis
Melanoma
5-year survival (%)1
Pillars of Cancer Therapies
I-O therapies are being investigated in an attempt to utilize the body’s own immune system to fight diseases.3-5
Material destinado a profissionais de saúde
Imunidade e Câncer
Imunoedição
Dunn GP, Old LJ, Schreiber RD. The three Es of cancer immunoediting. Annu Rev Immunol. 2004
Ma
terial d
estina
do
à cla
sse méd
ica
CD4 = célula T auxiliar; IDO = indoleamina 2,3-dioxigenase; MICA/B = cadeia classe I relacionada a proteínas A e B do complexo principal de
histocompatibilidade; M = macrófago; NK = clélula exterminadora (killer ) natural; NKT = célula T killer; sMICA/B = MICA/B solúvel; TRAIL = ligante indutor de
apoptose relacionado a TNF; Treg = célula T reguladora; ULBP = proteínas ligantes de UL16; y = célula T y
Imunidade e câncer Fases da Imunoedição
Ma
terial d
estina
do
à cla
sse méd
ica
1. Eliminação
▫ Tumor expressa antígenos tumorais em estágios iniciais
▫ Formação de resposta imune
▫ Eliminação de células tumorais.
2. Equilíbrio
▫ Células tumorais remanescentes entram em equilíbrio com sistema imune e o tumor fica estabilizado
3. Escape
▫ Variantes resistentes a destruição imune se multiplicam
▫ Perda controle sobre tumor
▫ Progressão (clinicamente detectável)
Dunn GP, Old LJ, Schreiber RD. The three Es of cancer immunoediting. Annu Rev Immunol. 2004
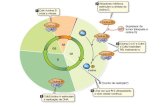
Antigen-presenting cells
(APC)1
• Take up antigens from infected or malignant cells and process them into shorter peptide segments
• Present antigens to T cells to mobilize an immune response
Players in the immune response
against cancer
11
1. Janeway CA, et al. Immunobiology: The Immune System in Health and Disease. 6th ed. New York, NY: Garland Science; 2004
Tumor-associated antigens1
• Are abnormal cell substances/proteins (tumor antigens) which can be recognized and responded to by the immune system
T cells1
• Have T-cell receptors, which can recognize tumor-associated antigens
• Play a major role in killing infected or malignant cells when activated
• Help perpetuate ongoing immune responses
Material destinado a profissionais de saúde
Players in the immune response
against cancer
12
Antibodies1
• Are secreted by activated B cells, called plasma cells
• Tag antigen-containing cells for attack by other parts of the immune system, or neutralize their targets directly by blocking important mechanisms
B cells1
• Display B-cell receptors, which can bind free floating antigens in the blood or lymph
• Once activated, B cells differentiate to become plasma cells which can secrete large quantities of antibodies against a specific antigen
1
1. Janeway CA, et al. Immunobiology: The Immune System in Health and Disease. 6th ed. New York, NY: Garland Science; 2004
NK cells1
• Can recognize infected or malignant cells innately without contact with an antigen-presenting cell or antibody (this allows NK cells to launch rapid responses against stressed cells)
• Can also attack based on recognition of antibodies on a cell surface Material destinado a profissionais de saúde
Tumor-associated antigens can cause an immune response1
13
Tumor-associate
d antigens
APC displays antigen to T
cell1
Antibodies produced
against antigen
1
Antibodies tag tumor cells for
destruction1
B cell binds to antigen
1
1. Janeway CA, et al. Immunobiology: The Immune System in Health and Disease. 6th ed. New York, NY: Garland Science; 2004
Activated T cells
migrate to and attack tumor cells
Material destinado a profissionais de saúde
Ma
terial d
estina
do
à cla
sse méd
ica
Relevância da Imuno-Oncologia
• Potencializar o sistema imune a superar a imunoedição induzida pelo tumor ▫ transformando a imunidade de pro-tumor para anti-tumor
▫ erradicar e idealmente curar o câncer
• Imunoterapias mais antigas: interferon e IL-2 ▫ uso limitado a alguns tipos de tumores
▫ significativa toxicidade
• Atualmente: ▫ Vacinas
▫ “Checkpoint Inibitors” (anti CTLA-4 e anti PD-1 e PD-L1)
▫ TIL 1. Lotze MT, in De Vita, 2001, 2054 2. Friedmann MC,Proc Natl Acad Sci U S A 1996;93:2077 3. Lotze MT, Cancer Res 1981;41:4420 4. Grimm EA, J Exp Med 1982;155:1823
Sinapse imunológica Moléculas regulatórias (Checkpoints) da resposta imune
Controle da ativação imune e tolerância
Driessens G et al. Immunol Rev. 2009 APC = célula apresentadora de antígeno; CTLA-4 = antígeno associado ao linfócito T citotóxico
TNFR = receptor do fator de necrose tumoral; PD = morte programada;
GITR = proteína relacionada ao TNRF induzida por glicocorticoide
MHC = complexo principal de histocompatibilidade;
PD-L = ligante do receptor de PD; TCR = receptor da célula T.
Os Receptores CTLA4 estão “Up-
Regulated” após ativação do linfócito T
Linfócito T
CD28
Célula dendrítica
MHC
B7
TCR
CTLA4
Antígeno
Ma
terial d
estina
do
à cla
sse m
édica
Hodi FS, et al. N Engl J Med. 2010;363:711-723.
CTLA4: inibe a ativação da célula T
CTLA4 liga ao B7 com maior afinidade que o CD28 e
envia um sinal inibitório para a célula T
MHC
B7
TCR
CD28
CTLA4
Célula dendrítica
Linfócito T
Antígeno
Ma
terial d
estina
do
à cla
sse m
édica
Hodi FS, et al. N Engl J Med. 2010;363:711-723.
O bloqueio do CTLA4 remove o freio da
ativação da célula T
Ma
terial d
estina
do
à cla
sse m
édica
MHC
B7
TCR
CD28
Antigen
CTLA4
Hodi FS, et al. N Engl J Med. 2010;363:711-723.
Célula dendrítica
Linfócito T
TCR
CD28
CTLA4
B7
Célula dendrítica Linfócito T
Antígeno MHC
O bloqueio do CTLA4 remove o freio da ativação da célula T
Ma
terial d
estina
do
à cla
sse m
édica
Hodi FS, et al. N Engl J Med. 2010;363:711-723.
Por que Imunoterapia em Melanoma?
Antígenos Tumorais são expressos pelas células
do melanoma
Regressão espontânea do melanoma primário
Regressão tumoral associada a
despigmentação autoimune e vitiligo
Evidência de atividade imunológica sugere
potencial benefício com o uso de imunoterapia
Ma
terial d
estina
do
à cla
sse m
édica
Por que Imunoterapia em Melanoma?
Antígenos Tumorais são expressos pelas
células do melanoma
Regressão espontânea do melanoma primário
Regressão tumoral associada a
despigmentação autoimune e vitiligo
Evidência de atividade imunológica sugere
potencial benefício com o uso de imunoterapia
Regressão Tumoral Espontânea
• Evidência em 14%–50% dos melanomas primários1
▫ Regressão espontânea completa em ~4–15%
• Lesões em regressão apresentam infiltrado inflamatório
▫ Evidência indireta de resposta imunológica2
1. Kalialis LV, et al. Melanoma Res 2009;19:275–282
2. Wenzel J, et al. Am J Clin Pathol 2005;124:37–48
Linfócitos CD8+ Regressão tumoral
Por que Imunoterapia em Melanoma?
Antígenos Tumorais são expressos pelas células
do melanoma
Regressão espontânea do melanoma primário
Regressão tumoral associada a
despigmentação autoimune e vitiligo
Evidência de atividade imunológica sugere
potencial benefício com o uso de imunoterapia
Associação de Vitiligo e Melanoma
• Pode refletir
▫ Resposta imune a antígenos expressos por melanócitos e células de melanoma1,2
▫ Autoimunidade envolvida na resposta ao melanoma, levando à regressão2
Linfócitos CD8+ em biópsia de vitiligo1
1. Le Gal FA, et al. J Invest Dermatol 2001;117:1464–1470 2. Boasberg PD, et al. J Invest Dermatol 2006;126:2658–
2663
Associação de vitiligo em paciente com
melanoma metastático
Cortesia do Dr. Antônio Carlos Buzaid (Hospital São José)
Antes do tratamento com ipilimumabe
Estudo MDX10-020 Padrões de Resposta
• Respostas tumorais que ocorreram após a semana 241,2
• Ipilimumabe mais gp100
▫ 3 pacientes com PD evoluiram para DE
▫ 3 pacientes com DE evoluiram para RP
▫ 1 paciente com RP evoluiu para RC
• Ipilimumabe mais placebo
▫ 2 pacientes com DE evoluiram para RP
▫ 3 pacientes com RP evoluiram para RC
1. Hodi FS et al. N Engl J Med. 2010;363:711-723. 2. Ottensmeier CH et al. Presented at: 35th ESMO Congress; October 8-12, 2010; Milan, Italy.
RC = resposta completa; RP = resposta parcial; DE = doença estável; PD = progressão de doença.
Estudo MDX10-020 Novos padrões de resposta
• Evolução de PD para DE
▫ Resposta ocorreu após aumento no volume tumoral total
e/ou
▫ Resposta ocorreu após surgimento de lesões novas2
• Evolução de DE para RP
▫ Característico do padrão de doença estável duradoura
▫ Diminuição lenta e contínua do volume tumoral total2
1. Hodi FS et al. N Engl J Med. 2010;363:711-723. 2. Ottensmeier CH et al. Presented at: 35th ESMO Congress; October 8-12, 2010; Milan, Italy.
RP = resposta parcial; DE = doença estável; PD = progressão de doença.
Quatro Padrões de Resposta Observados com
Ipilimumabe em Estudo de Fase II
Carga Tumoral Total
Doses de Ipilimumabe
Limite para resposta ou progressão de doença
SPD = soma dos produtos dos diâmetros perpendiculares
Wolchok JD et al. Clin Cancer Res. 2009;15:7412-7420.
1. Resposta nas lesões basais
SP
D (m
m2)
Semana 12
Alt
era
ções
no
ba
sal
da
s S
PD
(%
)
Dias desde a randomização
Quatro Padrões de Resposta Observados com
Ipilimumabe em Estudo de Fase II
Carga Tumoral Total
Doses de Ipilimumabe
Limite para resposta ou progressão de doença
SPD = soma dos produtos dos diâmetros perpendiculares
Wolchok JD et al. Clin Cancer Res. 2009;15:7412-7420.
2. “Doença Estável”: Declínio lento e contínuo no volume tumoral
SP
D (m
m2)
Semana 12
Alt
era
ções
no
ba
sal
da
s S
PD
(%
)
Dias desde a primeira dose
Quatro Padrões de Resposta Observados com
Ipilimumabe em Estudo de Fase II Carga Tumoral Total
Doses de Ipilimumabe
Limite para resposta ou progressão de doença
SPD = soma dos produtos dos diâmetros perpendiculares
Carga Tumoral de lesões novas
Wolchok JD et al. Clin Cancer Res. 2009;15:7412-7420.
SP
D (m
m2)
3. Resposta após aumento no volume tumoral
Semana 12
Alt
era
ções
no
ba
sal
da
s S
PD
(%
)
Dias desde a primeira dose
Quatro Padrões de Resposta Observados com
Ipilimumabe em Estudo de Fase II Carga Tumoral Total
Doses de Ipilimumabe
Limite para resposta ou progressão de doença
SPD = soma dos produtos dos diâmetros perpendiculares
Carga Tumoral de lesões novas
Carga Tumoral na linha de base
Wolchok JD et al. Clin Cancer Res. 2009;15:7412-7420.
SP
D (m
m2)
4. Redução na carga tumoral após aparecimento de lesões novas
Semana 12
Alt
era
ções
no
ba
sal
da
s S
PD
(%
)
Dias desde a primeira dose
Caso clínico de aumento inicial da carga tumoral (lesões alvo e lesões novas) seguido de resposta1
Sem 14: melhora
Dec. 2010: remissão completa
Sem 12: progressão + lesões
novas
Nov. 2007: antes
tratamento
Sem 72: remissão completa Sem 16: continua melhorando
Cortesia do Dr. Kaan Harmankaya e Dr. Hubert Pehamberger, Dept. of Dermatologia, Med. Univ. de Viena.
1. Hoos, et al. J Natl Cancer Inst 2010;102:1388-97.
Pseudo-progression and I-O therapy Apparent progression upon radiographic imaging after initial I-O therapy can actually be a sign of pseudo-progression. Pseudo-progression may occur when T cells infiltrate the tumor site and cause tumors to flare or new lesions to appear upon imaging.
1,2,3
36
1. Wolchok JD, et al. Clin Cancer Res. 2009;15:7412-7420 | 2. Topalian SL, et al. N Engl J Med. 2012;366:2443-2354| 3. Chow LQ. Am Soc Clin Oncol Educ Book. 2013:280-285
T cells infiltrate the
tumor site Appearance of tumor flare or new lesions upon imaging
I-O therapy tumor
Material destinado a profissionais de saúde
Aumento da carga tumoral (lesões novas) seguido
de resposta completa (RC) • Resposta após surgimento seguido de desaparecimento de lesões novas
Ipi 3 mg/kg
Antes do tratamento
Sem 36: Ainda Regredindo
Sem 12: Progressão
Sem 20: Regressão
Novas lesões
Julho 2006
Wolchok JD, et al. ASCO 2008. Abstract 3020.
Resposta mWHO*
Resposta
Completa Desaparecimento de todas as
lesões
Resposta
Parcial
SPD das lesões-alvo diminuem em
>50% lesões novas NÃO
permitidas
Doença
Estável
SPD das lesões-alvo não atingem RC, RP ou PD , lesões novas NÃO
permitidas
Progressão
de Doença
SPD de lesões alvo aumentam em >25% OU novas lesões OU
progressão inequívoca das lesões não-alvo
Todas lesões-alvo + novas desaparecem
SPD de lesões-alvo + novas diminuem >50% (novas lesões são mensuradas)
SPD das lesões-alvo + novas não atingem irRC, irRP, ou irPD (novas lesões são mensuradas)
irRC†
SPD de lesões-alvo + novas aumentam >25%‡ (NÃO se baseia somente no surgimento de novas lesões)
Comparação dos critérios
WHO modificado vs irRC1,2
SPD = soma dos produtos dos diâmetros perpendiculares; *inclui lesões-alvo e não-alvo; †inclui alvo somente (lesões mensuráveis); ‡Progressão a ser confirmada ao menos 4 semanas depois. 1. Wolchok J, et al. Clin Cancer Res. 2009;15:7412-20.
2. Lynch T, et al. Presented at: ESMO Congress, Milan, Italy; October 8-12, 2010; Poster 375PD.
Ma
terial d
estina
do
à cla
sse m
édica
Importância da doença estável
Resposta comum com Ipilimumabe Estudo Tratamento Doença Estável
MDX010-201
(fase III) Ipilimumabe 3 mg/kg + gp100 1 mg cada 3 semanas X 4 (n=403) ou
ipilimumabe + placebo (n=137) ou gp100 + placebo (n=136)
58 (14%) pacientes na combinação e
24 (17.5%) pacientes no ipilimumabea
MDX010-082
(faseII) Ipilimumabe 3 mg/kg cada 4 semanas X 4 com (n=35) ou sem (n=37)
dacarbazina 250 mg/m2 cada 3 semanas (dias 1 a 5)
8 (23%) pacientes na combinação e 6
(16%) pacientes na monoterapia;
duração de 1 mês a >15 mesesb
CA184-0073
(fase II)
Ipilimumabe 10 mg/kg cada 3 semanas X 4 com budesonida (n=58)
ou placebo (n=57) até semana 16, manutenção cada 12 semanas a
partir da semana 24
11 (19%) pacientes em cada grupo
CA184-0084
(fase II) Ipilimumabe 10 mg/kg cada 3 semanasX 4, manutenção cada 12
semanas a partir semana 24 (N=155) 33 (21%) pacientes
CA184-0225
(fase II)
Ipilimumabe 0.3 mg/kg (n=73), 3 mg/kg (n=72), ou 10 mg/kg (n=72)
cada 3 semanas X 4, manutenção cada 12 semanas a partir da
semana 24
10 (14%), 16 (22%), e 13 (18%)
pacientes recebendo 0.3 mg/kg, 3
mg/kg, and 10 mg/kg
MDX010-156
(fase I/II) Ipilimumabe dose única 20 mg/kg (n=30), ipilimumabe até 5 mg/kg X
3 (n=34), ou ipilimumabe 10 mg/kg cada 4 semanas X 4 (n=24)
14 (16%) pacientes; duração variou de
99 a >945 dias em pacientes
recebendo 10 mg/kg
aAntes da reindução. bSeguimento longo prazo mostrou sobrevida de 4.9 anos em 1 paciente e >5.5 anos em 2 pacientes com DE no braço combinação.
1. Hodi FS et al. N Engl J Med. 2010;363:711-723. 2. Hersh EM et al. Invest New Drugs. 2011;29:489-498. 3. Weber J et al. Clin Cancer Res. 2009;15:5591-5598. 4. O’Day SJ et al. Ann Oncol. 2010;21:1712-1717. 5. Wolchok JD et al. Lancet Oncol. 2010;11:155-164. 6. Weber J et al. J Clin Oncol. 2008;26:5950-5956.
MDX010-20: Desenho do estudo
Ipi + gp100
Ipi + placebo
gp100 + placebo
> 1 Reindução pacientes elegíveis Indução
Melanoma avançado pré-tratados, HLA-A*0201
N = 676
Ipilimumabe* + gp100 (N=403)
Ipilimumabe* + placebo
(N=137)
gp100 + placebo ( N=136)
R
A
N
D
O
M
I
Z
A
Ç
Ã
O
R
E
I
N
D
U
Ç
Ã
O
Screening
Follow up
Ipilimumabe: 3 mg/kg2 IV a cada 3 semanas (4 doses)
SG
Hodi FS, et al. N Engl J Med 2010;363:711-23.
Sobrevida Global Mediana
IPI IPI + gp100
Hodi FS, et al. N Engl J Med. 2010;363:711-723.
gp100
Mes
es
24%
Sobrevida em 1 e 2 anos
Anos
46%
25% 14%
IPI
IPI
IPI + gp100
IPI
gp100
YERVOY + gp100 vs gp100
0.68 0.0004
Risco Relativo
P
YERVOY vs gp100
0.66 0.0026
Hodi FS, et al. N Engl J Med. 2010;363:711-723.
Pro
po
rção
de
Viv
os
TODOS OS
PACIENTES
Sexo Masculino
Feminino
Idade < 65 anos
≥ 65 anos
Feminino < 50 anos
Feminino ≥ 50 anos
Estadio na inclusão M0, M1A, M1B
M1C
DHL basal ≤ LSN
> LSN
≤ 2x LSN
> 2x LSN
Uso prévio de IL-2 Sim
Não
0.2 0.5 1 2 5 0.2 0.5 1 2 5
RR 95% CI 1. Hodi FS, et al. N Engl J Med 2010;363:711-23.
Benefício de sobrevida consistente em subpopulações1 Subgrupos pré-especificados no estudo MDX010-20
Favorável: Ipi + gp100 gp100 Ipi gp100
Pooled Analysis of Long-term Survival Data from
Phase II and Phase III Trials of Ipilimumab in
Metastatic Melanoma
ESMO 2013
Schadendorf D,1 Hodi FS,2 Robert C,3 Weber JS,4 Margolin K,5 Hamid O,6 Chen TT,7 Berman DM,8 Wolchok JD9
1University Hospital Essen, Essen, Germany; 2Dana-Farber Cancer Institute, Boston, MA, USA; 3Institute Gustave Roussy, Villejuif, France; 4Moffitt Cancer Center, Tampa, FL, USA; 5University of Washington, Seattle, WA, USA; 6The Angeles Clinic and Research Institute,
Los Angeles, CA, USA; 7Bristol-Myers Squibb, Wallingford, CT, USA; 8Bristol-Myers Squibb, Lawrenceville, NJ, USA; 9Memorial Sloan-Kettering Cancer Center, New York, NY, USA.
Abstract Number 24LBA (ESMO 2013)
Schadendorf D, et al. Eur J Cancer 2013;49(suppl 2): abstract 24LBA *Material destinado à classe médica
Pacientes em Risco Ipilimumabe 1861 839 370 254 192 170 120 26 15 5 0
Pro
po
rçã
o d
e V
ivo
s
0.0
0.1
0.2
0.3
0.4
0.5
0.6
0.7
0.8
0.9
1.0
Meses
0 12 24 36 48 60 72 84 96 108 120
Ipilimumab
CENSORED
Análise Primária de Dados de SG:
1861 Pacientes
SG Mediana (95% CI): 11.4 meses (10.7–12.1)
Taxa de SG de 3 anos (95% CI): 22%
(20–24%)
47 Schadendorf D, et al. Eur J Cancer 2013;49(suppl 2): abstract 24LBA *Material destinado à classe médica
Pacientes em Risco Ipilimumabe 4846 1786 612 392 200 170 120 26 15 5 0
0.0
0.1
0.2
0.3
0.4
0.5
0.6
0.7
0.8
0.9
1.0
0 12 24 36 48 60 72 84 96 108 120
Ipilimumabe
CENSURADO
Análise de SG incluindo dados do EAP:
4846 Pacientes
SG Mediana (95% CI): 9.5 (9.0–10.0)
Taxa SG em 3 anos (95% CI): 21% (20–22%)
Pro
po
rçã
o d
e V
ivo
s
Meses
48 Schadendorf D, et al. Eur J Cancer 2013;49(suppl 2): abstract 24LBA
*Material destinado à classe médica
SG Relativa a Dados Históricos
● Controles históricos
Fase II: 1278 pacientes em 42 grupos cooperativos de 1975 a 2005
Fase III: 3739 pacientes em 10 estudos de 1999 a 2011
49 Schadendorf D, et al. Eur J Cancer 2013;49(suppl 2): abstract 24LBA
Conclusões
● Esta é a maior análise de SG até hj de pacientes tratados com Ipilimumabe em melanoma avançado
● A análise mostra um platô na SG começando no 3o ano estendendo-se até mais que os 10 anos em alguns pacientes
Platô similar para pacientes previamente tratados e não tratados
Dose ou regime de tratamento não parece impactar no platô
Platô também similar quando os dados de EAP são incluídos
● A curva de SG observada mostrou melhor sobrevida e mais durável em relação aos dados históricos
● Esta análise adicionou corpo a evidências que suportam o efeito do tratamento com Ipilimumabe a uma sobrevida de longo prazo mais duradoura, nos pacientes com melanoma avançado
50 Schadendorf D, et al. Eur J Cancer 2013;49(suppl 2): abstract 24LBA
Ma
terial d
estina
do
à cla
sse méd
ica
Eventos adversos imunorrelacionados (irEAs)1,2
Eventos adversos mais comumente relacionados ao tratamento
Definição: etiologia desconhecida, consistente com fenômeno imune, i.e., de natureza inflamatória
Baseado nos termos MedDRA pré-especificados em estudos clínicos
Protocolo para identificação de irEAs orienta investigadores a:
– Avaliar e excluir causas neoplásicas, infecciosas, metabólicas, tóxicas ou outras
– Utilizar sorologia, imunologia e histologia (biópsia) para suportar o diagnóstico
Primeiro os cutâneos, seguido por colite, hipofisite e finalmente hepatite
Weber JS, et al. J Clin Oncol 2012;30:2691–2697
Gr
au
da
to
xic
ida
de
Tempo (semanas)
Erupção, prurido Hepatotoxicidade Diarreia, colite Hipofisite
0 2 4 6 8 10 12 14
Cinética dos irEAS:
Surgimento e Resolução
Ma
terial d
estina
do
à cla
sse méd
ica
IrEA
Mediana de tempo para surgimento,
semanas (variação)
Mediana de tempo para resolução,
semanas (variação)
GI; grau 3–5 8 (5–13) 4 (0.6–22)
Hepatotoxicidade; grau 2–5 3–9 0.7–2
Cutâneo; grau 2–5 3 (0.9–16) 5 (0.6–29)
Endócrino; grau 2–4 (7–20) Não disponível
irEA = evento adverso imuno-relacionado; GI = gastrointestinal
Cinética dos irEAS:
Surgimento e Resolução
Ma
terial d
estina
do
à cla
sse méd
ica
Características dos irEAs no estudo
de fase III MDX010-20 1
IrEA por sistema
N(%) Pacientes
Ipi+ gp100 N=380
Ipi N=131
Gp100 N=132
Qualquer irEA 221 (58.2) 80 (61.1) 42 (31.8)
Dermatológico 152 (40.0) 57 (43.5) 22 (16.7)
Prurido 67 (17.6) 32 (24.4) 14 (10.6)
Rash (erupção) 67 (17.6) 25 (19.1) 6 (4.5)
Vitiligo 14 (3.7) 3 (2.3) 1 (0.8)
Gastrointestinal 122 (32.1) 38 (29.0) 19 (14.4)
Diarreia 115 (30.3) 36 (27.5) 18 (13.6)
Colite 20 (5.3) 10 (7.6) 1 (0.8)
Endócrino 15 (3.9) 10 (7.6) 2 (1.5)
Hepático 8 (2.1) 5 (3.8) 6 (4.5)
Outro 12 (3.2) 6 (4.6) 3 (2.3)
1. Hodi FS, et al. N Engl J Med 2010;363:711-23.
Ma
terial d
estina
do
à cla
sse méd
ica
Características dos irEAs no estudo
de fase III MDX010-20 1
IrEA por sistema
N(%) Pacientes
Ipi+ gp100 N=380
Ipi N=131
Gp100 N=132
Qualquer irEA 221 (58.2) 80 (61.1) 42 (31.8)
Dermatológico 152 (40.0) 57 (43.5) 22 (16.7)
Prurido 67 (17.6) 32 (24.4) 14 (10.6)
Rash (erupção) 67 (17.6) 25 (19.1) 6 (4.5)
Vitiligo 14 (3.7) 3 (2.3) 1 (0.8)
Gastrointestinal 122 (32.1) 38 (29.0) 19 (14.4)
Diarreia 115 (30.3) 36 (27.5) 18 (13.6)
Colite 20 (5.3) 10 (7.6) 1 (0.8)
Endócrino 15 (3.9) 10 (7.6) 2 (1.5)
Hepático 8 (2.1) 5 (3.8) 6 (4.5)
Outro 12 (3.2) 6 (4.6) 3 (2.3) 1. Hodi FS, et al. N Engl J Med 2010;363:711-23.
Pacientes (%)
irEA Ipilimumabe +
gp100 n=380
Ipilimumabe+ placebo n=131
gp100 + placebo n=132
Todos os graus
Qualquer 58 61 32
Dermatológico 40 44 17
GI 32 29 14
Endócrino 4 8 2
Hepático 2 4 5
Hodi FS, et al. N Engl J Med 2010;363:711–723
aNo período de duração do estudo
irEAsa (todos os graus) mais comuns
no estudo MDX010-20
Pacientes (%)
irEA
Ipilimumabe + gp100 n=380
Ipilimumabe + placebo n=131
gp100 + placebo n=132
Grau 3 Grau 4 Grau 3 Grau 4 Grau 3 Grau 4
Qualquer 9.7 0.5 12.2 2.3 3.0 0
Dermatológico 2.1 0.3 1.5 0 0 0
GI 5.3 0.5 7.6 0 0.8 0
Endócrino 1.1 0 2.3 1.5 0 0
Hepático 1.1 0 0 0 2.3 0
Óbito por irEA 1.3 1.5 0
irEAsa graus ≥3 mais comuns
no estudo MDX010-20
Hodi FS, et al. N Engl J Med 2010;363:711–723
aNo período de duração do estudo
MDX010-20: resumo de segurança
Toxicidade relacionada ao Ipilimumabe:
▫ Baseada no mecanismo de ação, toxicidade imunorrelacionada
irEAs (eventos adversos imunorrelacionados) foram mais comumente relacionados à droga, ocorrendo em ~60% dos pacientes tratados com Ipilimumabe
Perfil dos EA consistente com os observados nos estudos fase II
Manuseio com acompanhamento vigilante e necessidade de intervenção precoce com esteroides
▫ Taxa de toxicidade graus 3/4:
Relacionado ao tratamento: 17% (combinação), 23% (monoterapia)
Imunorrelacionado: 10% (combinação), 15% (monoterapia)
▫ óbitos
Relacionado ao tratamento : 2.1% (combinação), 3.1% (monoterapia)
Imunorrelacionado: 1.3% (combinação), 1.5% (monoterapia)
Hodi FS, et al. N Engl J Med 2010;363:711–723
Perfil de Segurança – EAP
Pacientes Idosos versus Pacientes Jovens • 2017 pacientes - CA184-045 (EAP)
▫ 767 (38%) ≥65
▫ 1250 (62%) <65
60
Lawrence D, et al. Presented at: 37th ESMO Congress; September 28 - October 2, 2012; Vienna, Austria.
Grupo por Idade
≥65 anos <65 anos Total
(n=767) (n=1250) (n=2017)
Qualquer irAE 82 (11%) 88 (7%) 170 (8%)
Gastrointestinal 56 (7%) 53 (4%) 108 (5%)
Diarreia 36 (5%) 31 (3%) 67 (3%)
Colite 25 (3%) 28 (2%) 53 (3%)
Gl perfuração 5 (<1%) 2 (<1%) 7 (<1%)
Cutâneo 10 (1%) 11 (1%) 21 (1%)
Pruritus 8 (1%) 3 (<1%) 11 (1%)
Laboratorial 10 (1%) 10 (1%) 20 (1%)
TGO (aumento) 4 (1%) 4 (<1%) 8 (<1%)
Lipase 2 (<1%) 1 (<1%) 3 (<1%)
Amilase 2 (<1%) 0 2 (<1%)
Endócrino 6 (1%) 9 (1%) 15(1%)
Hipofisite 2 (<1%) 5 (<1%) 7 (<1%)
Experiência Italiana
Tratamento de Reindução - Segurança • 845 pacientes – EAP – Italiano (CA184-089) 51 (6%) ipilimumabe 3 mg/kg
▫ 1 tratamento reindução - 37 (72.5%) receberam 4 doses
▫ 2 tratamentos ou mais – 2 pacientes
61
Pigozzo J, et al. Presented at: 37th ESMO Congress; September 28 - October 2, 2012; Vienna, Austria.
EA relacionado ao tratamento n (%) Todos os Graus Graus 3/4
Total 11 (21.6) 3 (5.9)
Diarreia 2 (3.9) 1 (2.0)
Prurido 4 (7.8) 0
Toxicidade Hepática 1 (2.0) 0
Fadiga 2 (3.9) 0
Hipotireoidismo 1 (2.0) 0
Hipocalemia 1 (2.0) 1 (2.0)
Aplasia de médula óssea 1 (2.0) 1 (2.0)
Manuseio apropriado dos irEAs: aprendizado
Boa comunicação com o paciente é fator crucial
Todos os efeitos colaterais dos anti-CTLA-4 são imunorrelacionados e refletem seu mecanismo de ação
Avaliar função tireoidiana e hepática no basal e antes de cada dose de Ipilimumabe
Tratar efeitos colaterais precoce e agressivamente
Doses omitidas de Ipilimumabe em razão de eventos adversos não devem ser substituidas
Utilizar esteróides para EAs grau 3
▫ Utilizar inicialmente metilprednisona IV por 1 – 2 dias para toxicidade severa
Reduzir lentamente a dose de esteroide (desmame) em não menos que 30 – 45 dias.
Monitorização dos Pacientes GASTROINTESTINAL Sinais e sintomas como: • Diarreia • Dor Abdomnal • Presença de sangue ou muco nas fezes • Perfuração intestinal • Sinais de perfuração • Ileu • Febre
Em pacientes sintomáticos, exclua outras etiologias
Em casos de persitência ou piora dos sintomas, considerar
exame endoscópico.
FÍGADO Sinais como:
•Valores anormais de Função Hepática (TGO, TGP) e bilirrubina total.
Exclua outras etiologias ou malignidades
Monitore com maior frequencia paramêtros de Função Hepática
até resolução.
PELE Sintomas como: • Erupção cutânea • Prurido
A menos que outra etiologia tenha sido identificada, sinais e
sintomas de dermatite devem ser considerados
imunorrelacionados.
NEUROLÓGICO Sintomas como: • Fraqueza uni/bilateral • Alterações sensoriais • Parestesia
28
ENDOCRINO Sinais e sintomas como: • Fadiga • Cefaleia • Alteração do status mental
• Dor abdominal • Alteração do hábito intestinal • Hipotensão
• Alteração de parametros laboratoriais função endócrina e bioquímica
• Hipofisite • Insuficiência Adrenal (incluindo crise adrenal)
• Hiper ou hipotireoidismo Sintomas não específicos - relação com outras causas (ex-
meta cerebral)
OUTRAS REAÇÕES ADVERSAS incluindo manifestações oculares
YERVOY package insert. Princeton, NJ: Bristol-Myers Squibb; 2011.
*em número limitado de pacientes a hipofisite foi identificada através de exames de imagem com aumento da glandula pituitária.
GASTROINTESTINAL Sinais e sintomas como: • Diarreia • Dor Abdomnal • Presença de sangue ou muco nas fezes • Perfuração intestinal • Sinais de perfuração • Ileu • Febre
Em pacientes sintomáticos, exclua outras etiologias
Em casos de persitência ou piora dos sintomas, considerar
exame endoscópico.
Fígado Sinais como:
•Valores anormais de Função Hepática (TGO, TGP) e bilirrubina total.
Exclua outras etiologias ou malignidades
Monitore com maior frequencia paramêtros de Função Hepática
até resolução.
PELE Sintomas como: • Erupção cutânea • Prurido
A menos que outra etiologia tenha sido identificada, sinais e
sintomas de dermatite devem ser considerados
imunorrelacionados.
NEUROLÓGICO Sintomas como: • Fraqueza uni/bilateral • Alterações sensoriais • Parestesia
ENDOCRINO Sinais e sintomas como: • Fadiga • Cefaleia • Alteração do status mental
• Dor abdominal • Alteração do hábito intestinal • Hipotensão
• Alteração de parametros laboratoriais função endócrina e bioquímica
• Hipofisite • Insuficiência Adrenal (incluindo crise adrenal)
• Hiper ou hipotireoidismo Sintomas não específicos - relação com outras causas (ex-
meta cerebral)
OUTRAS REAÇÕES ADVERSAS incluindo manifestações oculares
IMUNOTERAPIA– Controvérsias
• Uso de corticoisteróides
• Biomarcadores (para imunoterapia? Foundation one?)
• Sobrevida a longo prazo (memória imunológica)
• Futuro (imunoterapia combinada)
• Metastasectomia
Take Home Message1
• Atividade demonstrada em melanoma, câncer de próstata, rim, pulmão e ovário
• Ganho de sobrevida em melanoma metastático e cancer de pulmão
• Evidência de respostas duradouras
Take Home Message1,2
• Mudança de paradigmas na avaliação tumoral
▫ Novos padrões de respostas (diferente das terapias citotóxicas)
• Estudos em combinação com outros agentes e RT
• Busca de marcadores preditivos de resposta